бензоилпиперидина-1-бензоилалкилпипе ридины при росте на среде с глюкозой и кукурузным экстрактом (2), например гид- роксилирование 1-бензоил-4-метилпипери- дина (1) приводит к смеси двух продуктов:
-
IIШ 157.
COPhCOPh
Они были идентифицированы как 1-бензо- ил-4-гидроксиметилпиперидин (II) и 1-бен- зоил-4-гидрокси-4- метилпиперидин (III).
При использвании в качестве субстрата (±)-1-бензоил-3-метилпиперидина (IV) в продуктах реакции наблюдалось два компонента: 1-бензоил-3-метил-4- гидроксипипе- ридин (V) в оптически активной форме и 1-бензоил-З-гидрокси-З-метилпиперидин (VI), оптически неактивный:
(iH,
ГС QCOH
DQf п-1
I COPh
ОН.
сУ
V . И ОШ7У.
COPh
17)67. COPh
Культура гриба Beauverla basslana ATCC 7159 способна также окислять аналоги цитральбензамида-ациклические амиды (3). При росте на указанной выше среде культура гидроксилируют 1-(3-метилбу- тил)бензамид (VII) в положение Залкильного заместителя с выходом продукта (VIII) 13%:
«Hi-CH-CHj-C -HH jj-PeH5. О (И)
м,
-riij-c-гн, ен,-ми-д-С|Н|
0(ИП)ИХ
он
Гидроксилирование в тех же условиях 1-(1-пентил-3-)-бензамида (IX) культурой Beauverla basslana ATCC 7159 приводит к образованию оптически активного спирта (X) с выходом 10%:
ЛНСОС,Н5
CHj-CHi-CH С11,-СН)1П)
MHCClCjHs
--(-) CHj-CH-CH CH, CHj ОН (X) 10/.
Культура бактерии Pscudononas aeruginosa способна окислять аналог цит- ральбензамидз - цитраль (XI) с образованием четырех продуктов (XII) выход 62%, (XIII) выход 0,8%, (XIV) выход 0 5% и (XV) выход 1%(4):
сн
Д,
СН5
0
5
0
п - с
Ч сно k
1 vrttt. rr л s
COOK Hj(T CHj Hjf
,
(П) РШ7. CH3 1 COOH
CHs
V,
, CH,OH -flHj
(Ш 0,87.
1
-СИ, CHjWj
Ш)ОЛ СП) .
Наиболее близким прототипом предполагаемого изобретения является культура гриба Beauverla basslana ATCC 7159, которая была выделена как лабораторный загрязнитель 1. Данный микроорганизм осуществляет трансформацию 1-бензоил- пиперидина (XVI) в растущей культуре на среде следующего состава, г/л: глюкоза- 10,0; кукурузный экстракт - 20,0; вода водопроводная; рН 5,0; t 28 С/5,10. Продуктом реакции является 1-бензоил-4-гидроксипи- перидин (XVII) с выходом 18%:
«Л)
0
5
0
5
0
5
В литературе не встречается примеров трансформации цитральбензамида ни культурой Beauverla basslana ATCC 7159, ни какими-либо другими культурами, поэтому можно ограничиться указанными выше аналогами.
К недостаткам культуры Beauverla basslana ATCC 7159 относятся:
1.Выход продукта трансформации 1-бен- зоилпиперидина-1-бензоил-4-гидроксипипе ридина невысокий и составляет 18%. При трансформации не происходит введения гид- роксила в прохиральный центр с образованием оптически активного 3-гидроксиизомера.
2.Культура не гидроксилирует цитраль- бензамид, а при гидроксилировании его аналогов 1-(3-метилбутил)бензамида и 1-(1- пентил-34)бензамида выходы продуктов реакции также малы и составляют 13 и 10% соответственно.
Целью изобретения является выделение нового, более продуктивного штамма рода Bearverla, эффективно осуществляющего трансформацию 1-бензоилпипериди- на и цитральбензамида. Продукты гидроксилирования этих соединений могут быть использованы: 1-бензоил-гидроксипи- перидины в синтезе противовоспалительных и косметических преларатов (6,7), а гидроксипроиэводные цитральбензамида как ферромоны насекомых (8),
, Цель достигается выделением нового штамма Beauverla bassiana Bals BKM F- 3111D с личинки колорадско о жука.
Штамм Beauverla basslana BKM F- 3111D является энтомопатогенной культурой и природным паразитом колорадского жука, вредной черепашки, тутового шелкопряда, картофельной коровки и т.д. и был выделен авторами с пораженной грибом личинки колорадского жука, найденной на картофельном поле вблизи г. Ивантеевка Московской области.
Культура высевалась с поверхности личинки на среду следующего состава: 4°Б сусло-агар, рН 5,0, вода водопроводная. После нескольких последовательных пересевов на указанной среде была выделена чистая культура гриба и идентифицирована как Beauveria bassiana Bals (9). Данный штамм депонирован во Всесоюзной коллекции микроорганизмов ИБФМ АН СССР под номером F-3111D, непатогенен для человека.
Морфологические и культурные признаки.
Микроорганизм культивировали на ага- ризованной среде Чапека. Колонии растут сравнительно быстро, на 8-е сутки достигают 6 см в диаметре при 28°С. Колонии бугристые, белые, форма круглая, край ровный. Цвет спороносящего воздушного мицелия белый, цвет обратной стороны колонии - белый. Растворимый пигмент отсутствует. Эксудата не образует. Центральная часть колонии с хохолком. Воздушный мицелий септированный, диаметр гиф 1,0-2,0 мкм. Небольшие скопления конидиогенных клеток образуются на цилиндрических боковых клетках размером 6x15 мкм или располагаются непосредственно на гифе. Бластоспо- ры развиваются как вздутие конца конидиогненной клетки, обычно цилиндрические с гладкой поверхностью, образуются за счет симподиального роста конидиоген- ной клетки. Конидии формируются из бла- стоспор. Конидин бесцветные, одиночные, отшнуровываются поодиночке с образованием коленчатой зубчатой оси конидиоген- ной клетки. Конидии сферические, поверхность бородавчатая, размер 3,0 ±0,2 мкм, в массе белые
На среде состава, г/л: кукурузный экстракт 20, глюкоза 10,0, агар-агар 15,0, вода водопроводная, рН 5,0, колонии растут относительно быстро и на восьмые сутки достигают 5-6 мм в диаметре. Колонии белые, круглые, край ровный, в центре колонии небольшой бугорок. Поверхность колонии равная, без бугорков. Цвет спороносящего мицелия белый, обратная сторона колонии белая. Растворимого пигмента не образует. Экссудата не образует. Воздушный мицелий септированный, диаметр гиф 1,0-2.0 мкм. Скопления конидиогенных клеток образуются на цилиндрических боковых клетках размером 6x15 мкм или р.че.1 с непосредственно нэ гифе Блчст виваются как вздутие конца -i i M клетки за счет ее посл до-гач;
диального ветвления. Блас осг . рические с гладкой пэрир н образуются из благлосп, ются поодиночке с обгг той зубчатой оси v
0 Конидии сферические - бородавчатая, разм,-; Ч ( ..
На среде соеi,-гч г : пептон 10,0, вода г колонии растут довольно
5 день достигают 5-7 мм в/jf,ле- . v L белые, круглые, край ровный С стороны колонии слегка складипт спороносящего воздушного мице/. Растворимый пигмент отсчет в
0 та не образуется, диаметр гиф , (, ... На цилиндрических боковых кг.ет . , ром 6x15 мкм или непосредствеии образуются скопления ко гис т . ток. Бластоспоры развивал1 ;ч ч,а
5 конца конидиогенной гп(-т,линдрические с гладкой пес-с , , разуются за счет , конидиогенной клетки. Ко:-н л- ются из бластоспор, отшнуровываю- Р и
0 диночке с образованием гс зубчатой оси конициог зниоС . дни сферические, белые, давчатая, размер 3,0± 0, vt t
ФиЗИОЛОГО-биОХИМ и F;CKv1, J4
5Рост культуры в г(5
отсутствует. Возможен р:1 pax 25-35°С, темпйр-т -р, , -- 30°С. Оптимум рН Лг -
отсутствует, имеются г ,
0 щие прогревание пои ВО1
Способна использовать - , - венных источников утерод-э iM. . фон среды Чапека): глюкозу Д . арабинозу, Л-рамнозу, Д i м/ь
5 зу, Д-маннит, инозит сахаро; v
Для субкультисигоиа шч . - среду состава, г/л. кукуруз - 20,0; глюкоза 10,0 v,ari a допроводная. рН 5,0
0 Для длительногг Beauveria bassiana I . ют в течение 10 сут : глюкоза 20,0; nemr.jr U, :, i „. ,: . вода водопроводная- рН Ь,г : )
5 ри приготавливают а, гроаы: л i . ром 4 мм и подвергаю . - жидком азоте, используя п кг. .. -.; ротектора20%-ный раствор глииег .- стиллированной воде.
i Ч
Поставленная цель достигается выращиванием культуры Beauverla basslana BKVF-3IIID на модифицированной среде Чапека, указанной ниже, в течение 96 ч при температуре 20-35°С, рН среды 5,0-7,0. Предпочтительной температурой процесса является 28-30°С и рН 5.0. В табл.1 приведены существенные отличия предполагаемого изобретения от прототипа.
П р и м е р 1. Культуру Beauverla Basslana BKMF-3IIID выращивают на качалке (200-220 об/мин) при 28-30°С в конических колбах на 750 мл, содержащих 100 мл модифицированной среды Чапека состава, г/л: сахароза 20,0; пептон 5,0; NaNOa 2.0; КНгРСм 1,0; MgSCM -7Н20 0,5; KCI 0,5; FeSCM 0,01, вода дистиллированная, рН 5.0. Среду стерилизуют при 0,5 атм в течение 30 мин. Указанную среду используют как для выращивания посевного материала, так и как ферментационную среду для проведения трансформации. Посевной материал выращивают 48 ч и инокулум вносят в количестве 5 мл на 100 мл среды. Через 24 ч культивирования вносят субстрат для трансформации 1-бензоилпиперидина в количестве 100 мг/л и культивируют на качалке еще 24-96 ч. Биомассу отделяют фильтрованием через бумажный фильтр на воронке „Бюхнера. Фильтрат упаривают на роторном вакуумном испарителе при 50°С до 0,1 объема. Упаренную культу рал ьную жидкость доводят до рН 7,0, добавляя 40%-ный раствор МаОН и экстрагируют горячим хлороформом в экстракторе для тяжелых жидкостей в течение 30 ч (экстрагировать можно и неупаренную культуралальную жидкость). Хло- роформенный экстракт упаривают в вакууме досуха и остаток растворяют в небольшом (0,3-0,5 мл) количестве этанола.
Выделение продуктов трансформации осуществляли с помощью флэшхроматогра- фии на колонке силикагелем (Slllcagel 40/100, Chemapo ЧССР), используя систему растворителей гексан:этилацет&т:метанол 10:10:2. Полученные соединения идентифицировали на основании физико-механических и спектральных свойств: хроматографической подвижности, ВЭЖХ и масс-спектрального распада.
Масс-спектры регистрировали на приборе Varlan MAT-112S при энергии ионизации 80 эВ с прямым вводом вещества в ионный источник. Оценку чистоты веществ и количественное определение осуществляли методом ВЭЖХ на хроматографе Милихром с использованием ультрафиолетового детектора (Д- 220 нм), скорость подачи элюэнта 100 //1 /мин; объем пробы 7ц ; чувствительность
0,4; время измерения 0,6 с; скорость движения ленты самописца 720 мм/ч.
Углы вращения измеряли на приборе ЕПО-1, ВНИИпродмаш.
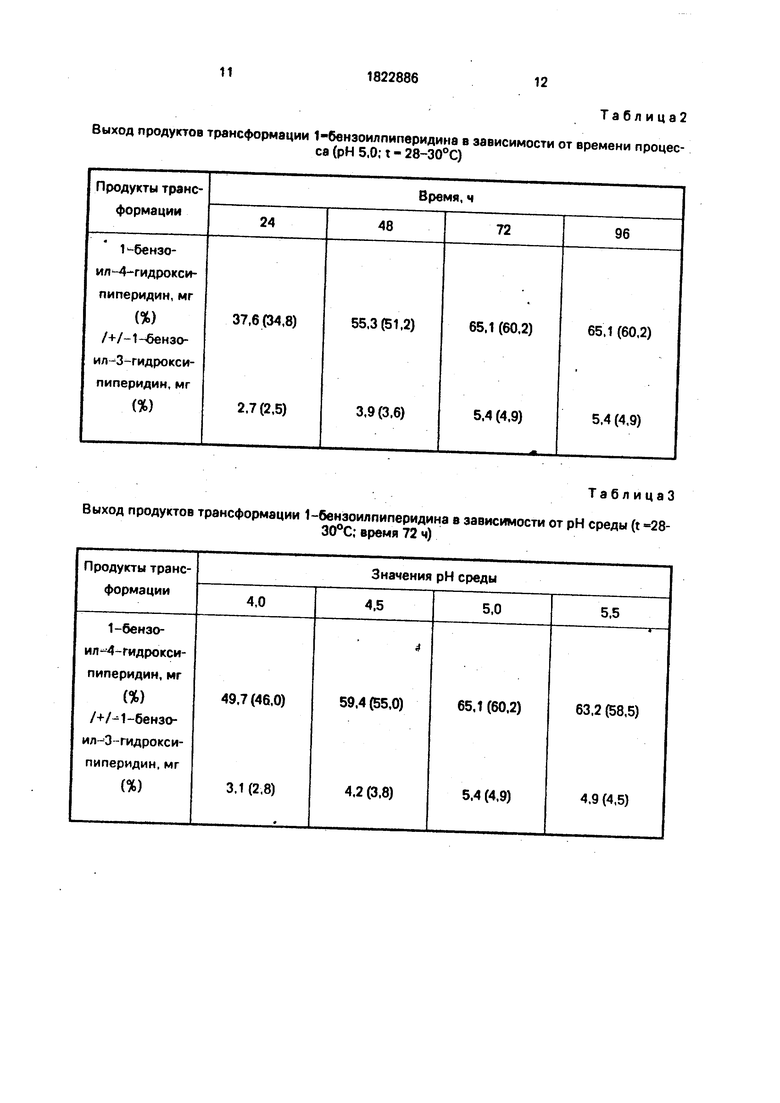
Из 100 мг 1-бенэоилпиперидина получают 65,1 мг (60,2%) бензоил-4-гидрокси- пиперидина и 5,4 мг (4,9%) 1-бенэоил-З-гидроксипиперидина (табл.2), 1-бензоил-4-гидрокси пи перидии: хроматографическая подвижность на силикагеле Merk Kleselgel 60 F254. Art 5554 - Rf - 0,37; время удерживания ВЭЖХ - 225 с. Масс- спектр: М 205/30/. 204/50/. 183/3/. 187/5/. 186/8/, 160/4/. 149/4/, 105/100/,
100/8/. 78/4/, 77/55/. Здесь и далее даны m/z (интенсивность от максимального). /+/-1-бензоил-3-гидроксипиперидин: Rf - 0,12, время удержания ВЭЖХ 87,5 с. Масс- спектр: М+ 205/16/. 204/28/. 188/6/,
187/8/, 186/5/. 177/3/. 176/6/. 160/2/. 149/4/.148/8/.134/6/, 105/100/,100/20/, 78/4/. 77/64/. Угол вращения при 300 нм 1 «1зоо20 + 124,48° (с. 0,45, метанол).
Из табл.2 видно, что реакция полностью
проходит за 72 ч и увеличение времени трансформации до 96 ч не приводит к увеличению выхода продуктов трансформации.
П р и м е р 2. Трансформацию 1-бензоилпиперидина проводят аналогично примеру 1, при t 28-30°С в течение 72 ч, но при разных значениях рН (см. табл.3).
Из данных табл.3 видно, что увеличение или уменьшение рН среды не приводит к увеличению выхода продуктов трансформации. Наилучший выход продуктов наблюдается при рН среды 5,0.
ПримерЗ. Трансформацию 1-бензоилпиперидина проводят аналогично примеру 1 при рН среды 5,0 в течение 72 ч, но при
разных температурах (см. табл.4).
Из данных табл.4 видно, что процесс микробиологического окисления протекает при температуре от 20 до 35°С, но оптимальным является интервал 28-30°С, наиболее
благоприятный для роста гриба и работы ферментных систем.
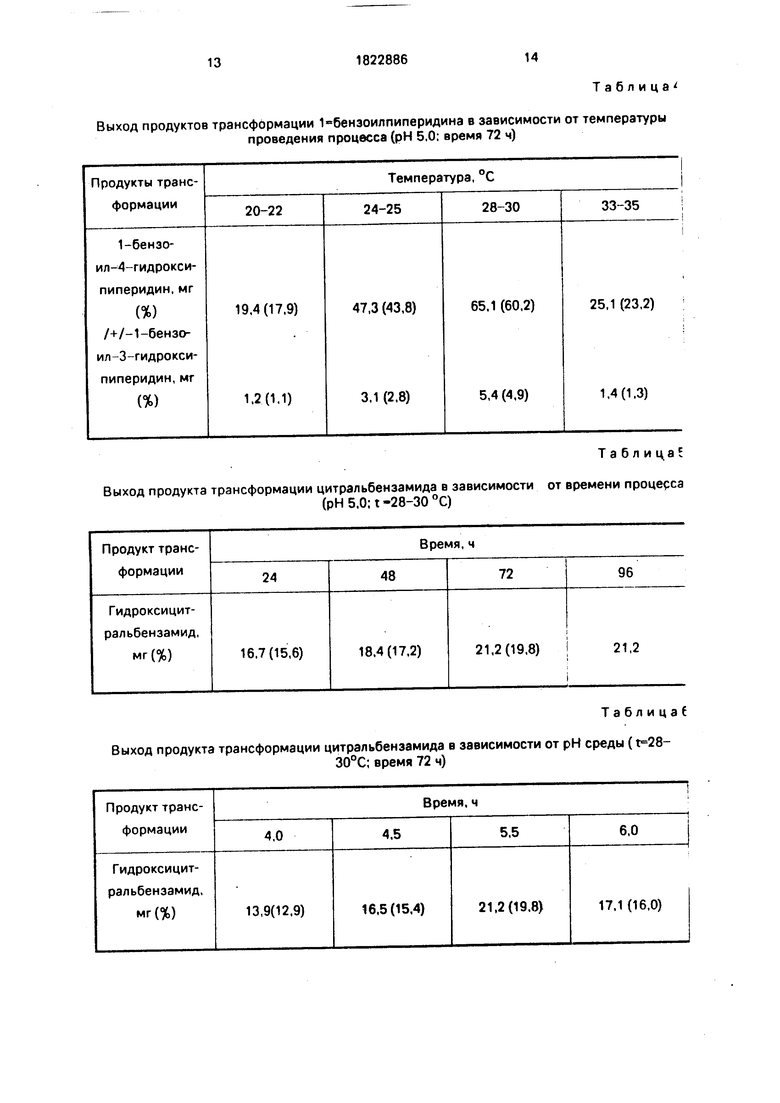
П р и м е р 4. Трансформацию цитраль- бензамида проводят аналогично примеру 1 при рН 5,0, температуре 28-30°С, но при различной длительности процесса (см. табл.5).
Из данных табл.5 видно, что реакция полностью проходит за 72 ч и увеличение времени трансформации до 96 ч не приводит к увеличению выхода гидроксицитральбензамида. Хроматографическая подвижность гид- роксицитральбензамида на силикагеле Merk Kleselgel 60 Рам, Art 5554 - Rf - 0,40. Масс-спектр: М 273/25/. 232/40/, 214/15/. 187/100/, 152/55/, 134/9/, 77/50/.
П р и м е р 5. Трансформацию цитраль- бензамида проводят аналогично примеру 1 при t 28-30°С в течение 72 ч, но при разных значениях рН (см. табл.6).
Из данных табл.6 видно, что увеличение или уменьшение значения рН не приводит к увеличению выхода продукта: наибольший выход продукта наблюдается при рН 5,0.
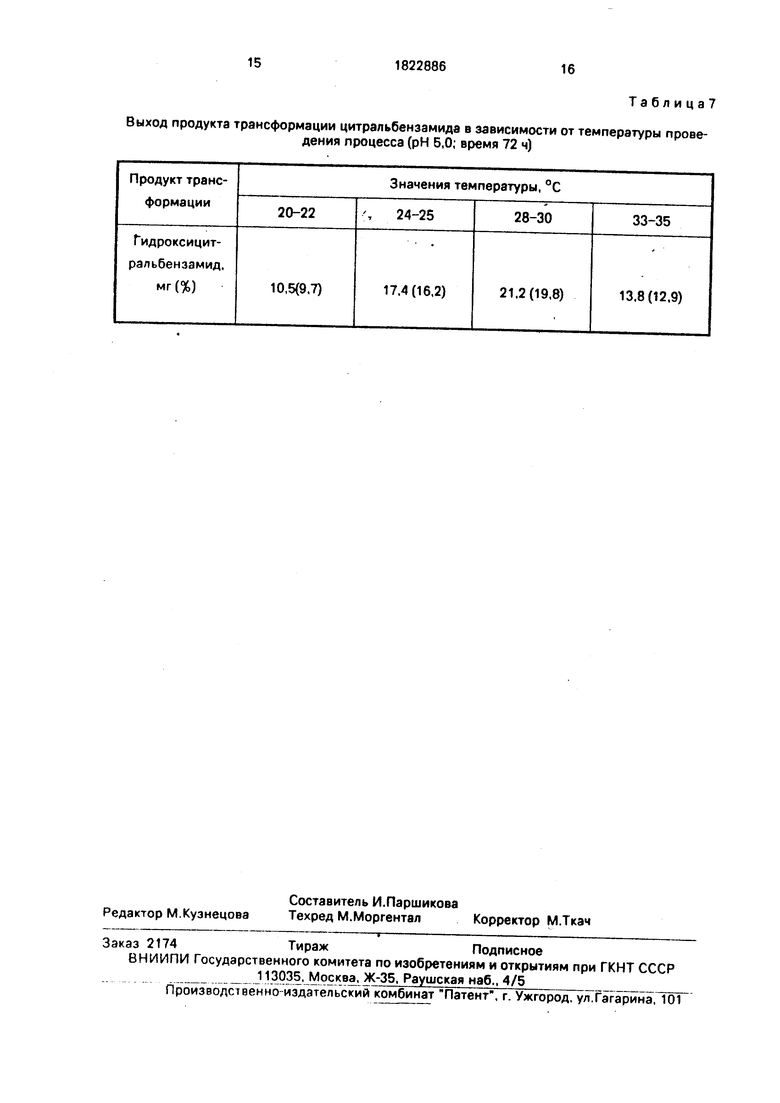
П р и м е р 6. Трансформацию цитра л ь- бензамида проводят аналогично примеру 1 при рН среды 5.0 в течение 72 ч, но при разных температурах (см. табл.7).
Из данных табл.7 видно, что процесс микробиологического окисления протекает при температуре от 20 до 35°С, но оптимальной является температура 28-30°С, наиболее благоприятная для роста и работы ферментных систем.
Выделен новый штамм Beauverln basslana (BKMF-3IID). В отличие от известного хорошо изученного штамма B.basslana АТСС 7159 он более эффективно гидроксилирует 1-бензоилпиперидин (выход 1-бен- .зоил-4-гидроксипиперидина составляет 60%, для Beauverla basslana ATCC 7159-18%), кроме того образуется еще и оптический активный 3-гидроксиизомер. Штамм позволяв
также расширить спектр применения субстратов для трансформации. Впервые показано, что грибы этого рода гидроксилируюг терпены - цитральбензамид.
Формула изобретения
Штамм гриба Beauverla basslana Bals BKMF-31111D в качестве трансформатора длп гидроксилирования 1-бензоилпиперидина и 1-бензоиламино-3,7-диметилоктадиена-2,6.




| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм гриба СUNNIGнамеLLа VеRтIсILLата - трансформатор для гидроксилирования 1-бензоилпирролидина 1-бензоиламино-3,7-диметилоктадиена-2,6 | 1990 |
|
SU1789557A1 |
| ШТАММ ГРИБА BEAUVERIA BASSIANA (BALS) VUILL BKM F-3732D, ИСПОЛЬЗУЕМЫЙ ДЛЯ ПОЛУЧЕНИЯ ЭНТОМОПАТОГЕННЫХ ПРЕПАРАТОВ | 2000 |
|
RU2172588C1 |
| Способ получения (-)-(1-оксиэтил) пиридинов | 1986 |
|
SU1364621A1 |
| Штамм гриба BeaUVeRIa ваSSIаNа (BaLS) VUILL для производства инсектицидного препарата боверина | 1989 |
|
SU1688820A1 |
| ШТАММ МИКРОМИЦЕТА BEAUVERIA BASSIANA ДЛЯ ПРОИЗВОДСТВА ЭНТОМОПАТОГЕННОГО ПРЕПАРАТА | 1993 |
|
RU2034469C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭНТОМОПАТОГЕННОГО ПРЕПЛРАГ.ЛБОВЕРИНА | 1973 |
|
SU394424A1 |
| ШТАММ ГРИБА HYPOMYCES ROSELLUS - ПРОДУЦЕНТ ЛИПИДОВ С ОДНОВРЕМЕННЫМ ПРИСУТСТВИЕМ ОРГАНИЧЕСКОГО ПИГМЕНТА | 1992 |
|
RU2020155C1 |
| Штамм гриба Beauveria bassiana, используемый для производства биопрепарата против колорадского жука, грибных патогенов и стимуляции роста картофеля в вегитационный период, биопрепарат на его основе и способ стимуляции роста картофеля в вегитационный период, защиты его от колорадского жука и ризоктониоза | 2019 |
|
RU2704859C1 |
| Штамм гриба ЕRемотнесIUт аSнвYI - продуцент эфирного масла | 1987 |
|
SU1454845A1 |
| Штамм микроскопического гриба BeaUVeRIa ваSSIаNа для получения энтомопатогенного препарата | 1990 |
|
SU1795980A3 |
Использование: биотехнология - ность изобретения выделен новый uvii грибов рода Beauveria, эффективно тр,. формирующий 1-бензоилпиперидин и v - ральбензамид. Штамм идентифицирован как Beauveria basslana Bal- P-KMF3P-0 Выделенный штамм эффе,ивно гидро 1 - лирует 1-бензоилпиперидин с образован, - ем 1-бензоил-4-гидроксипиперидина (выход 60%, в литературе 18%), кроме того образ ется оптически активный З-гидроксии- г В отличие от известных штаммов это с гр - ба новый штамм трансформирует бензамид. 7 табл. диен-2,6(гидроксицитральбензэмид) v,- мои насекомых Ближайшим аналогом предлагаем л изобретения является ку-tavc микрсн,ки пических грибов Beauve- з harslnna Агг 7159 (до 1970 года называлась SporotncU i sulfurescens (1)), которую иногда назыв к i Beauveria sulfurescens ATCC 7159. Культура гриба Beauveria basslana ATCC 715е сне. собна трансформировать производные ОС с к: а ос 1ч 
Существенные отличия предлагаемого изобретения от прототипа
20
Табл и ца1
Та бл и ца2
Выход продуктов трансформации 1-бензоилпиперидина в зависимости от времени процесса (рН 5,0; t - 28-30°С)
ТаблицаЗ
Выход продуктов трансформации 1-бензоилпиперидина в зависимости от рН среды (t 2830°С; время 72 ч)
Таблица
Выход продуктов трансформации 1 бензоилпиперидина в зависимости от температуры
проведения процесса (рН 5,0: время 72 ч)
Таблица
Выход продукта трансформации цитральбензамида в зависимости от времени процесса
(рН 5.0; t -28-30 °С)
Таблицаб
Выход продукта трансформации цитральбензамида в зависимости от рН среды (г 2830°С; время 72 ч)
Таблица
Выход продукта трансформации цитральбензамида в зависимости от температуры проведения процесса (рН 5,0; время 72 ч)
| Johnson R.A | |||
| Чугунный экономайзер с вертикально-расположенными трубами с поперечными ребрами | 1911 |
|
SU1978A1 |
| p | |||
| Способ получения продукта конденсации бетанафтола с формальдегидом | 1923 |
|
SU131A1 |
| Johnson R.A, Murray H.C., Relnekc L.M., Fonken G.S, Stechlometry of microbiolohlcal hydroxylation | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Chem, 1969, v | |||
| Нивелир для отсчетов без перемещения наблюдателя при нивелировании из средины | 1921 |
|
SU34A1 |
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| p | |||
| Пароперегреватель для паровозов | 1925 |
|
SU2279A1 |
| Johnson R.A | |||
| Murray H.C., Relneke LM | |||
| The mecroblollglcal oxygenation of acyclic N- alkylbenzamldes-J | |||
| Am, Chem | |||
| Soc., 1q971, v | |||
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
| Klesllch K | |||
| Mlcroblol transformations of non - Steroid compounds | |||
| Stuttgart: Georg Thieme Publishers, 1976, 1123 p | |||
| Johuson R.A., Herr M.E., Murray H.C., Fonken G.S | |||
| The microbiological oxygenations of aracycloalcanes | |||
| Structural determinations and some chemical modifications leading to transannular reactions | |||
| J | |||
| Org | |||
| Chem | |||
| Приспособление для контроля движения | 1921 |
|
SU1968A1 |
| Способ сопряжения брусьев в срубах | 1921 |
|
SU33A1 |
| Автоматический вагонный сцепной прибор | 1925 |
|
SU3187A1 |
| УСТРОЙСТВО ДЛЯ ЭЛЕКТРИЧЕСКОЙ АСИНХРОННОЙ ПЕРЕДАЧИ ПОВОРОТОВ ВАЛА НА РАССТОЯНИЕ | 1924 |
|
SU3111A1 |
Авторы
Даты
1993-06-23—Публикация
1990-11-15—Подача