сл
с



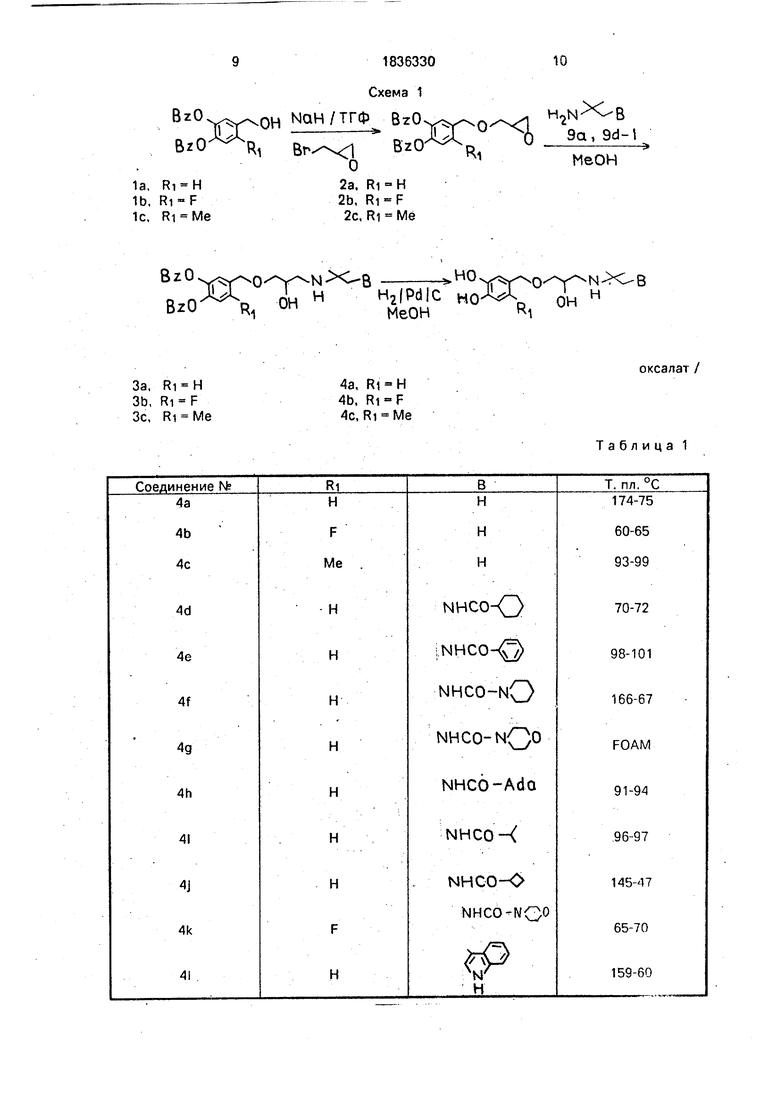
Использование: Лечение сердечных заболеваний и глаукомы. Сущность изобретения: получают соединения ф-лы (OHXRWXR1), Ph-CH2OCH2-CH(OHKH2- NH-W-B, где R-H. низший алкил, галоид; R2, R3-H или ОН, причем по крайней мере один из них - ОН; W - низший алкилен; В-водо- род, или индол ил, или группа NHCOR4, где R низший алкил, циклоалкил C/j - Се, фенил или группа NHCONR5R6, где R5 и R6 вместе с атомом азота обозначают пирроли- диновый или морфолиновый цикл, или их фармацевтически приемлемые соли. Соответствующий Оензиловый спирт подвергают взаимодействию С гидридом натрия и эпибромгидрином, полученный продукт обрабатывают производным амина общей ф- лы HaN-W-B и гидрируйт водородом в спиртовой среде. 3 табл.
Соединения настоящего изобретения полезны благодаря их ценным фармацевтическим свойствам. Они демонстрируют 0- адренергическую блокирующую активность и пригодны также для лечения глаукомы.
Настоящее изобретение относится также к лечению и профилактике сердечных заболеваний. Более конкретно, изобретение относится к новым способам лечения или профилактики сердечных заболеваний, которое включает введение / -адренергиче- ских блокирующих агентов, и к соединениям, подходящим для этих способов.
Терапевтические и профилактические применения соединений, которые блокируют симпатические нервные стимуляции ft- адренергических рецепторов в сердце, легких, сосудистой системе и других органах, хорошо документированы. Обычно taкие соединения вводят терапевтически пациентам, страдающим от ишемической болезни сердца или с инфарктом миокарда, для ослабления работы сердца, то есть скорости и интенсивности сердечных сокращений. Ослабление работы сердца снижает потребность в кислороде и может реально повысить доступ кислорода. Так, ослабление работы сердца может также служить предотвращению дальнейшего повреждения тканей и может облегчить приступы стенокардии.
jS-Адренергические стимуляторы могут . также усугубить или вызвать аритмию из-за повышения уровней катехоламинов. Так блокирующие агенты можно использовать для снижения риска возникновения аритмии. ; . . :
Способ получения соединения по настоящему изобретению общей формулой
00
Сл)
о
СлЗ СА) О
GJ
О
он
N-W-B
И
где Ri-H, низший алкил, галоид;
R2.R3 Н или ОН, причем по крайней мере один из них - ОН;
W - низший алкилен; В - водород, или индолил, или группа NHCOR4, где R4 - низший алкил, цилкоалкил Cs-Ce, фенил или группа NHCONRsRe, где RS и Re вместе с атомом азота обозначают пирролидиновый или морфолиновый цикл,
или их фармацевтически приемлемых солей, отличается тем, что бензиловые спирты общей формулы (II) или (III)
(u.)
BzO R-,
X1
OBz
OH
R1 (III)
где Ri и R2 имеют указанные значения,
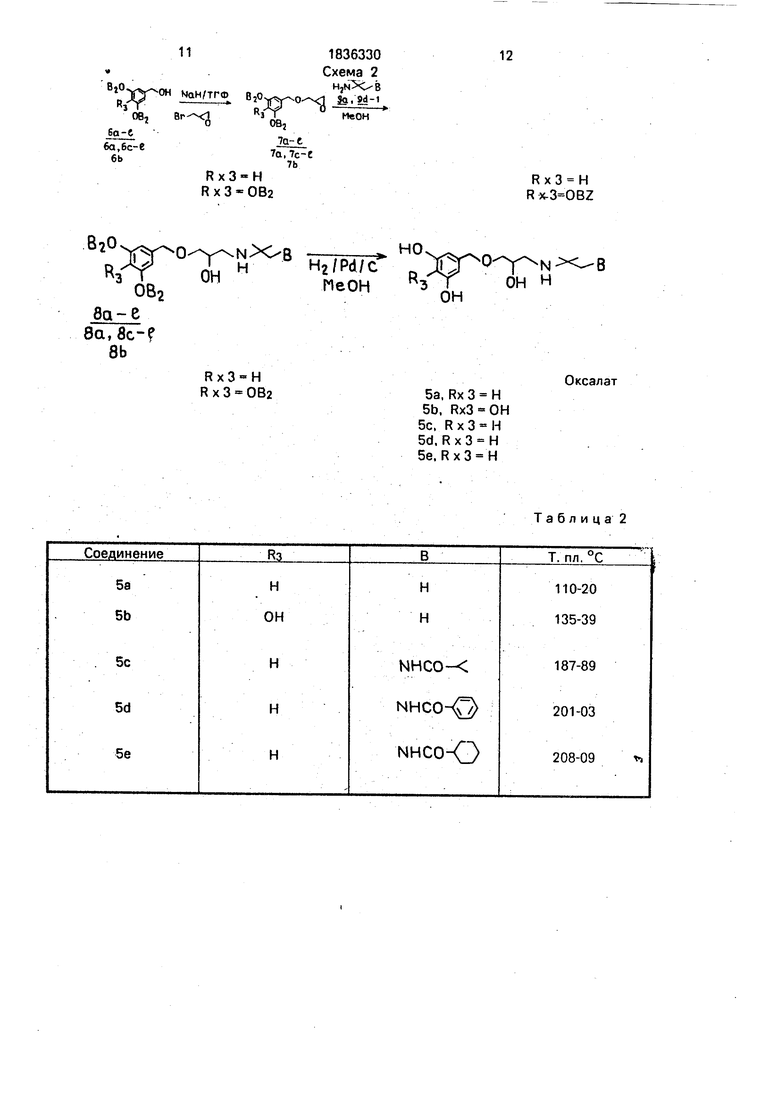
подвергают взаимодействию сначала с гидридом натрия и эпибромгидрином, затем полученный продукт обрабатывают производным амина общей формулы H2N-W-B, где W и В имеют указанные значения, и гидрируют водородом в среде метанола с катализатором Pd на угле. Эти соединения пригодны для лечения и профилактики сердечных заболеваний или для лечения глаукомы.
Некоторые соединения настоящего изобретения селективно блокируют/9-адренер- гические рецепторы в различных органах. /3-Рецепторы сердца обычно называют - рецепторами, а рецепторы, связанные с кращением сосудов и бронхов, называют / 2-рецептррами. Селективные /3-блокеры предпочтительны для лечения сердечных заболеваний, так как они потенциально менее способны вызвать гипертензию или бронхоспазм. селективных адренер- гических блокирующих агентов был раскрыт Smith Z.N. J.Appl. Chem Dlotechnol v28,201- 202 (2978). Большинство этих соединений являются структурными вариациями 1- амино-З-арилокси-2-пропанола.
Соединения настоящего изобретения пригодны также для лечения глаукомы или для снижения внутриглазного давления за счет наружного введения соединений в глазах.
Соединения настоящего изобретения можно вводить теплокровным животным орально или парэнтерально. Обычно их
0 5
0
5
0 5
0 5 0
5
можно вводить с фармацевтический носителем. Термин фармацевтический носитель для целей настоящего изобретения относится к любой среде, которая подходит для лучения дозированных единичных форм, и обозначает наполнитель для таблеток, или фармацевтически приемлемый носитель или растворитель, которые обычно используют для приготовления растворов для внутривенных или внутримышечных инъекций.
фармацевтические композиции, содержащие эти соединения, можно вводить теплокровным животным в дозах для парэнтерального или орального введения. Для парэнтерального введения подходят количества 0,001-10 мг/кг веса пациента в час, причем общая доза составляет до 0,2-2 г в день, что является подходящим интервалом для крупных животных и человека. Предпочтительным интервалом доз является интервал 0,01-10 мг/кг живого веса в час. Подходящие внутривенные дозированные формы являются стерильными растворами соединений настоящего изобретения или их фармацевтически приемлемых солей, содержащими 0,05-2 % вес/объем активного соединения. Если соединения настоящего изобретения предназначены для лечения сердечных заболеваний, например стенокардии или сердечной аритмии, или для лечения гипертонии, предполагается, что их можно вводить в полной оральной дозе 25- 1200 мг ежедневно. Подходящие дозированные формы для орального приема являются таблетками или капсулами, содержащими 25-200 мг активного соединения.
Для всех дозовых форм указанные ранее соединения можно помещать в капсулы, приготавливать в виде пилюль, облаток или таблеток обычным образом вместе с фармацевтическими носителями, хорошо известными специалистам. Таблетки можно приготовить для немедленного высвобождения активного соединения, или они могут быть предназначены для высвобождения в желудке, то есть активный ингридиент высвобождается медленно на протяжении нескольких часов внутри желудочно-кишечного тракта.
Для иллюстрации способа, которым можно получить вышеуказанные соединения, и для их характеристики приводятся следующие примеры, которые, однако, не ограничивают и не сужают объем настоящего изобретения.
В нижеследующих примерах температуры плавления получены на приборе Томаса-Гувера и даны без поправок.
Пример получения 2а (Ri - Н).
К смеси гидрида натрия (21 г 0,84 моль, 50% суспензии в масле) в сухом тетрагидро- фуране (1 л) добавляют 3,4-дибензилокси- бензиловый спирт (1а) (135 г, 0,42 моль) при интенсивном перемешивании. Наблюдается медленное выделение водорода. Спустя 30 мин добавляют эпибромгидрин (70 г, 0,5 моль) и перемешивание продолжают еще 16 ч. Реакционную смесь выпаривают и к полученной суспензии добавляют 1 л эфира, а затем воду (очень медленно) для разрушения избытка гидрида натрия. Неочищенную смесь промывают рассолом и выпаривают при пониженном давлении до получения бледно-желтого масла (150 г). Его используют в дальнейших экспериментах.
Небольшую часть вышеуказанного эпоксида (2а) отгоняют в аппарате Kugelroher при 80°С до получения прозрачного бесцветного масла.
Элементарный анализ для С24Н2404:
Рассчитано: С 76,57; Н 6,43.
Найдено: С 76,56; Н 6,35.
П р и м е р ы 2Ь, 2с и 2d. Вышеописанная процедура использована для получения 2Ь, 2с и 2d, где 1а заменяют на 1Ь, 1с и 1d соответственно.
Общая процедура для синтеза За-1. Раствор смеси 2а (), (20 г, 0,054 моль) и соответствующего амина 9а или 9d-1 (0,027 моль) в метаноле (50 мл) нагревают при кипячении с обратным холодильником в течение 6 ч и выпаривают при пониженном давлении. Остаток экстрагируют эфиром и промывают рассолом, сушат над сульфатом магния, а затем концентрируют в вакууме. Полученный остаток растворяют в этилаце- тате и подкисляют раствором щавелевой кислоты в этилацетате. В большинстве случаев полученный продукт кристаллизуется немедленно, а в других случаях для того, чтобы вызвать кристаллизацию, приходится добавлять эфир. В тех случаях, когда не получают кристаллического продукта,-его используют в виде масла на дальнейших стадиях без очистки.
Общая процедура для синтеза 4а-1, К прозрачному раствору За-1 (0,02 моль) в Ме- ОН (в некоторых случаях необходим дополнительный нагрев для растворения, а если и это не помогает, можно добавить немного ТГФ) добавляют 10% Pd/C (10 мг/г соединения За-1) и эту смесь гидрируют в аппарате Парра при давлении от 50 до 55 пси в течение 30-120 мин. Фильтруют на целите, выпаривают, повторно растворяют в метаноле (20 мл) и разбавляют в изопропаноле (20 мл до 100 мл); спустя несколько часов выделяют твердый кристаллический про0
дукт. Он кристаллизуется из изопропанбла. Температура плавления приведена в табл.1.
Пример получения 5з-е (см. табл.2),
Синтез соединений 5а из ба-е осуществлен по методике, описанной выше для получения 4а-1 (схема 1).
Пример получения 9d- i.
Соединение 9а получено от фирмы Олдрич Кемикал Компани, а соединение 91 синтезировано методом, описанным в Med. Chemv.23, 285 (1980).
Общая процедура получения соединений 9d-91 ,н
HlsNNHvR6
2О
9d-1
К охлаждаемому льдом раствору 1,2-ди- амино-2-метилпропана (7,9 г, 89 моль) в 50 мл толуола добавляют соответствующий хлорангидрид (89 ммоль) и полученную
смесь перемешивают при комнатной температуре в течение 16ч. Полученный раствор фильтруют,-а полученный фильтрат выпаривают при пониженном давлении. К этому остатку добавляют толуол (50 мл) и ацетонитрил (50 мл) и концентрируют в вакууме до получения масла. Это масло повторно растворяют в толуоле (50 мл) и промывают насыщенным раствором бикарбоната натрия, а затем рассолом, сушат над сульфатом магния, фильтруют, выпаривают при пониженном давлении и сушат в высоком вакууме до получения соответствующего масла или твердого продукта соответствующего аминоамида (9-91).
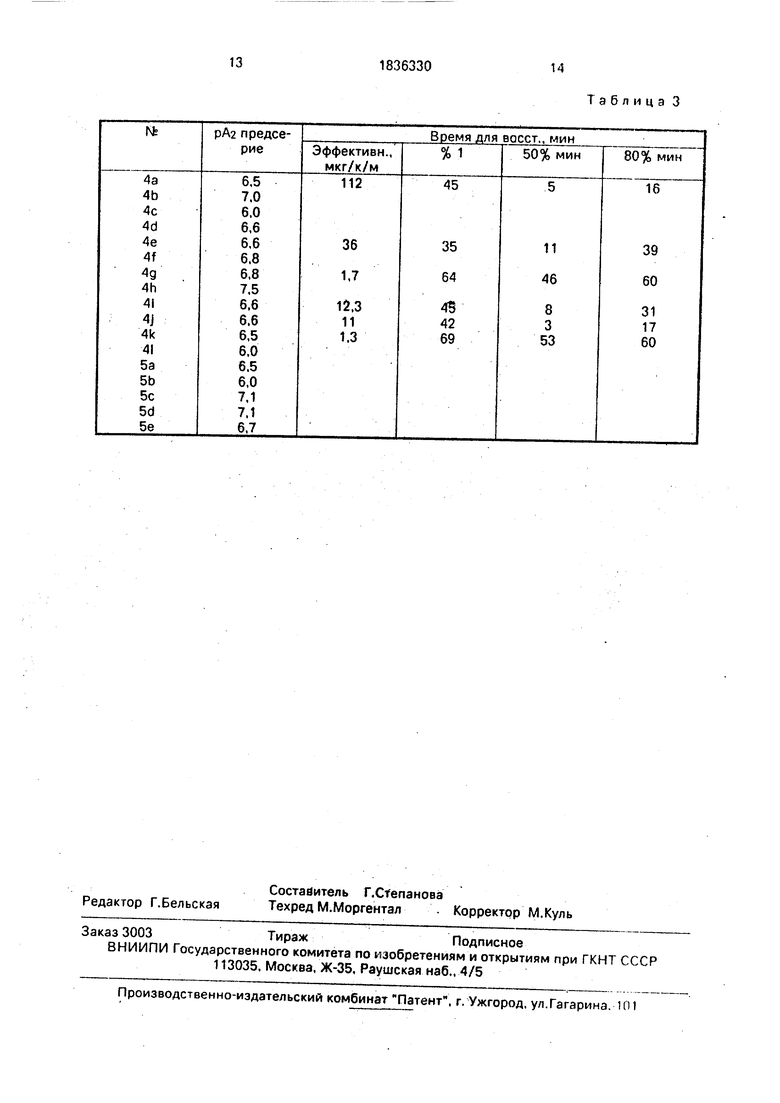
Бета-блокирующая активность in vitro. Некоторые соединения настоящего изобретения тестированы на -блокирующую активность In vitro, с использованием правого предсердия и полосок трахей морской
свинки, помещенных в ванну для тканей, содержащую обогащенный кислородом (95% 02-5% С02) физиологический раствор Кребса при температуре 37°С. Каждую ткань подвешивают между закрепленной
стеклянной палочкой и универсальным преобразователем Статхама, соединенным с самописцем Бекмана. Предсердию дают возможность спонтанно сокращаться под нагрузкой приблизительно 0,5 г. Характеристическую депрессорную и стимулирующую активность определяют для каждого соединения для прогрессивно возрастающих концентраций в ваннах ткани с 60-минутными интервалами. Между инкрементами ткани не промывают. Для экспериментов сю блокаде выбраны максимальные концентрации, которые демонстрируют слабую активность или полное отсутствие активности как кардиодепрессантов. Изменение в скорости реакции к изопротеренолу.стандартному /9 -рецепторному агонисту, измерено в присутствии тестового соединения и без него. Спиральные полоски трахеи морской свинки подвешивают при натяжении 5 гм и инкубируют с фентоламином, трополоном и кокаином. Активное натяжение создают, добавляя карбахол (3,0 х М), и оценивают снижение натяжения в реакции на и эопро- теренол. Кривые кумулятивная концентрация-реакция получены с изопротеренолом как до, так и после 60-минутного инкубирования тестовых соединений с предсердием и трахеей. Соединения с / -блокирующей активностью сдвигают кривые концентра- циятреакция вправо. Блокирующая потенциальная эффективность тестовых соединений оценена расчетом рАа значений (-log Ka) по методу Furchgott Ann. N. J. Acad. Sci, 1967, v 139, p. 553-570. Сравнение блокады реакции правого предсердия и трахеи с изопротеренолом позволяет оценить кар- диоселективность тестовых соединений: кардиоселективные соединения относительно более эффективны при блокировании скорости сокращения предсердия, нежели реакции трахеи к изопротеренолу. Степень кардиоселективности оценивали из отношения к / трахеи/К/3 (10/рА2 пред- сердия-РА2 трахеи). Отношения более единицы указывают на кардиоселективность. Тестовые препараты растворяют в дистиллированной воде и добавляют в ванну (30 мл) в объеме 10 или 100 мкл. Полученные результаты тестов In vitro представлены в табл.3. Все тестовые соединения являютоя активными /3-блокаторами.
Длительность и эффективность бета- блокирующих агентов in vivo.
Длительность ft -блокады определена In vivo, с использованием анестезированных пентобарбиталом собак, снабженных устройством для измерения сердечных сокращений (кардиотахомер Бекмана) с электронным оборудованием, считывающим фазовый сигнал давления крови в аорте. Оба вагусных нерва в цервикальном участке были разрезаны, и дыхание животных поддерживали механически. Экспериментальная конструкция использовала 3-часовую инфузию тестового соединения. Болусные
дозы изопротеренола (0,5 мкг/кг) использовали для оценки степени ft -блокирования и восстановления после /3-блокирования после определения инфузии. Дозы вводили с
10-минутными интервалами и вводили их до, во время и после инфузии тестовых соединений. Скорость инфузии устанавливали таким образом, чтобы к концу 3-го часа периода инфузии степень изопротеренольного ингибирования составляла в среднем около 50% от контроля. После окончания блокирующей инфузии процент восстановления от /3-блокады рассчитывали и, определяли время, связанное с 80%
восстановлением. Полученные результаты приведены в табл.3.
Формула изобретения Способ получения полигидроксибензи- локсипропаноламинов общей формулы
Н
ОН
где Ri - водород, низший алкил, галоид;
R2, R3 - водород или ОН, причем по крайней мере один из них обозначает ОН;
W - низший алкилен ,
В - водород, или индолил, или группа NHCOR4,
где R4 - низший алкил, С4-Се-циклоалкил, фенил или группа NHCONRsRe. где RS и Re
вместе с атомом азота обозначают пирроли- диновый или морфолиновый цикл, или их фармацевтически приемлемых солей, от л и ч а ч а ю щ и и с я тем, что бензиловые спирты общей формулы
или Bz0
ОН
VT4,
OBz
где Ri и РЗ имеют указанные значения, подвергают взаимодействию сначала с гидридом натрия и эпибромгидрином, затем.
полученный продукт обрабатывают производным амина формулы
H2N-W-B,
где W и В имеют указанные значения и гидрируют водородом в среде метанола с катализатором Pd на угле.
Схема 1
,QH NQH/ТГФ.- BzO , frs BzO - -Ri
BzO
Ri-H Ri F RI Me
0
2a. Ri H 2b, Ri F
2c, Ri Me
BzO BzO
Nr r O Y -NX-B
ОН ИH2(PdIC
R OH
MeOH
Ri H Ri F Ri Me
4a, Rl-H 4b, Ri F Ac, Ri Me
10
i
H,
0 9a, MeOH
2(PdIC
HOfV XKV 4v N В
он H
MeOHRI u
оксалат /
Таблица 1
111836330
Схема 2
-OH МОНГТГФ 6,0,0 1Й|и
МеОН
5Ј9г°
OB,
7а-с
7а,7с-С
Rx3-H Rx3-OB2
7Ь
OH
H2/Pd/C ПеОН
8a,8c-f 8b
Rx3 H R x 3 OB2
12
Rx3 H
HO
O p-N-X- B 3 IOH H
OH
Оксалат
5a, Rx 3 H
5b, Rx3 OH
5c, Rx3 H
5d. R x 3 H
5e. Rx3 H
Таблица 2
Таблица 3
| J.AppI Chem Biotechnol, 1978, v | |||
| Прибор с двумя призмами | 1917 |
|
SU27A1 |
| Питательное приспособление к трепальным машинам для лубовых растений | 1922 |
|
SU201A1 |
Авторы
Даты
1993-08-23—Публикация
1989-12-14—Подача