о
л.
Hnl
rvxc Rs, I), iniciOT 1гя всдо11иыс лпачеиия, a Hai обо;-;11ачас- атом галогена, lipo/nic.rnricjb110 атом хлора и.ти бро.ма, гюлГСргают jjcaKiuin взапмодс| |ствия с соединением ooni.eii формулы III
/- I Л N,N-A--XH
где Z, Y, /V п X имеют приведенные значения, или с производным н1,елочных мечаллсл сосдниения формулы III, еслн X -- атом кнслорода, с последующи., выделением целев.ло нродук-та извеегными приемами в С 5ободном ,е иди в виде eio соли. В случае, когда п соедниеиии ouineii формулы 111 X - атом серы, иоследиее иредиочтител1)Ио примеияют в виде производного щелочиого металла.
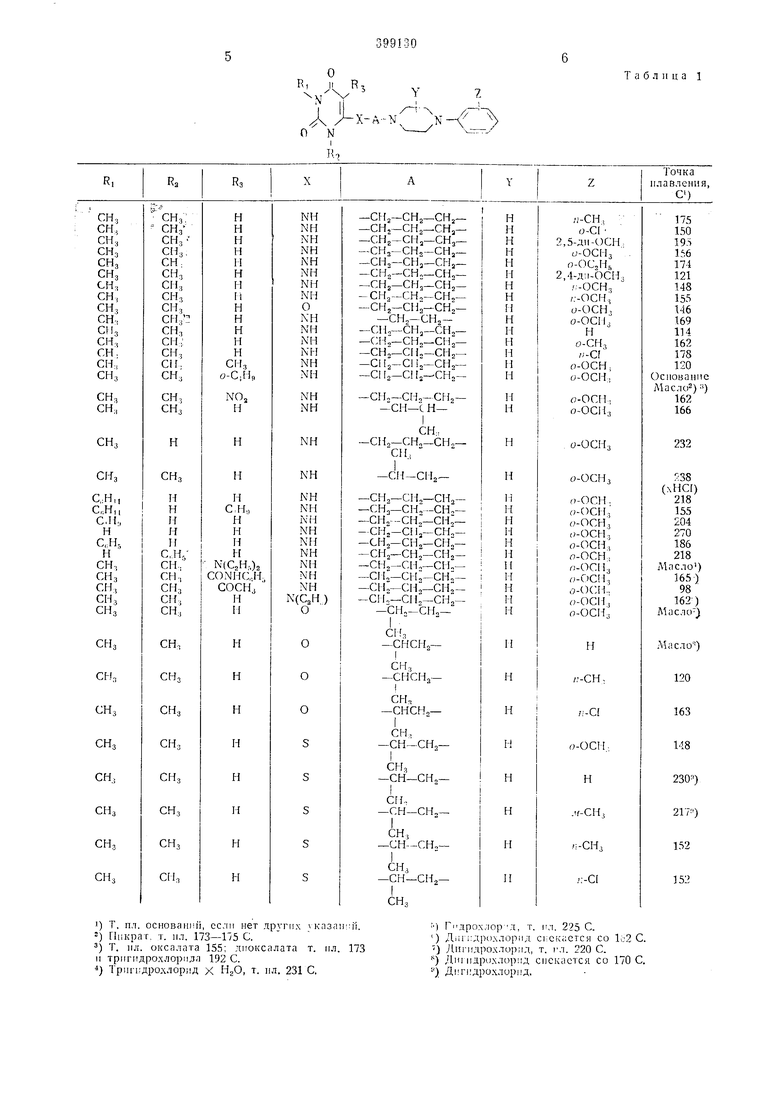
Г1редпоч1ительи1)1ми являются арилзамеHieiiru ie пиперазниилалкиламиио - урацилы, -урациловые эфиры и -ураци.човыс т-иоэ(1я1ры обще форму.ты 1 I их соли с фармако тогически примеи мым11 иеоргаиическими или оргаиичсскими кислотами оби1. формулы 1
О
R
-к-
л
N Rl
где RJ и RiJ обозиачают атом водо)ода, прямую иасьице1П1ую алкильиую груииу, содержащую до 4 аю.мов углерода, или циклоалкил1Л1ую или феиольиую груииу, причем, особеипо предпочтгггелыю яиляется .метильная г)уипа,
Rg - атом водцорода, прямая насьпценная алкильпая грунпа с сол,ержаиием до 4 атомов углерода, нитрогруппа, алк11ламн|1ог1)унна, содержащая до 3 атомов углерода, плн диальиламиногруииа с содержанием до G атомов углерода, причем oco6eiHio предиочтите. ми являются атом водорода, ирямая иасыщеиная алкильиая группа, имеклцая до 4 атомов углерода, пли диэтиламииогруина,
X обозпачает -Nll-групиу, --МС2Ы.-,-груипу, атом кислорода или атом серы,
обозначает прямую или ра.зветвлеииую, пасьпцеипую или иенасыщенную а.ткнленоную группу,
// обозначает атом водорода, метильную группу, одну пли две метоксигруппы, этоксигруппу или атом хлора, причем особенно
предпочтительно ;|вляе ся одна MeTOKcnr jyiTиа, в особе иости в ортодтоложепи.
/Келате.тыю при повы)iiei iioii теыиерату|)е, и осоПеипост .меЯСду 50 и 1Г)0С, li 1рисутс В 1и инерттюго )(, как ллоро|{)орл1, 6eii3(xT, олуол ли ксиЛОЛ. ilpi iiO.M Moi-Kei бып 1,елссообразн1.м Диба зление экв 11 ален ного количестпа всноMOraiX lli O 4J ОСНОВа 1 Я, как Ч ),) ИЛИ
н:,быт-ок соед,1Н1е1 ия общеГ (t)opMy, 111. При olcyiCTHiiH 1И1е1))ГО рас ворителя ра6(1 атт, изГл.пке ()МО ат-ел1-,1ого основания. С 1еко1 .х случаях )сак)1ня возможна 11сиол) li 1;ачестве растворителя
BG;UJ.
Соедт 1 С 1ие (1)ормул ; Ill нереводят в его ||р(,ное ще.точшлх меч а.члои изг.естным образом, ianpH.iep . обмена с nie,io4иым металлом, .о.м .е. ме|алл(Л
амидол . ме1 a;,, i , ii Koioi)i,x X обоз ачает ато. , , io4iiiiел1.() оГ) с г 1дроок 1сы(3 , металлов.
П)едпочтт телен способ нолуче я соед. O6.eil формул 1 ЛИ .
;;а {Л очается к ю/л, что обш.ей и
О
Б:,
ЛХ
N
Hal
lij
где Up R, RI и Hal имеют указаииые значения, подвергают реакции взаимодействия с соедииеиием опгиеи ll)opмyл ll 111
6
-N
где Z, 1 X -имеют указа1 И1)1е з 1ачеиия,
1 ОЛуЧе П е СОеДИ е 1 1Я ()ОрМуЛ)1 I
iipi жела1 и переводя1- в их соли.
Соли копеч лх родук ов получаю- обыч. способом, расиизряя ос 1оианпя п добавляя необ.- одимое количество кислоты. П) руд 1ораствор. вместо осиова ия .можно взят также растворимую сол, в.меето -.:11сло Ы - раство) соль
.
в качестве opraii i4CCK ix ил1 1еоргаиических могут , 1 апр11.мер, 1 азвапы уксус ая, И1,а| елевая, , фумаровая, , , 1амоак сл(, салицпло :ая, (Лзая, ОЛИВИ 1ИЛКарбО ОB je КИСЛОТ), соля1 ая, , фосфорная, а.м досу;1,1|) и мета сул фоновая; пред 0ч ител11И 1 и серная кислоты.
В таб.т. 1 дай обш.и11 обзор соединений, иплучеппыл предлагаемым способом.
1) Т, пл. основаи1 п, если нет дрзтпх казашчЧ.
) Ппкрат, т. ил. 173-1/5 С.
) Т. ил. оксалата 155; лиоксалата т. пл. 173
и тригидрохлорпда 192 С.
) Тригидроллорлд X HgO, т. пл. 231 С.
) Г-дрохлор-Л, т. пл. 225 С.
) Д|и-1:д юхлор11л спекается со 1с2 С.
) Д11п1дрохлор 1д, т. гл. 220 С.
) Ди1 пдрчхлорид спекается со 170 С.
) Д П;дрохлор11Д.
7
Пример 1. 1,3-Диметил - 4-{7- 4-(о-метоксифепил) - пнперазииил - (1)-11ропилами1ю}урацил.
20,6 г (0,083 моль) N-(o-MeTOKCHcl-)eni-m)-N(3 - амипопропил) - пнперазина и 15,7 г (0,09 моль) 1,3-деметил-4-хлорура1Шла кипятят с обратным холодильником в 100 мл триэтиламина в течение 15 час. После отделения в вакууме избытка трнэтиламнна остаток растворяют в 300 мл 1 н. соляной кнслочы и фильтруют. Фильтрат, размешивая и охлаждая на льду, разбавляют 2 н. раствором аммиака. При начинающемся осаждении затравляют несколькими кристаллами и)одукта. Аммиачную суснензию размешивают донолнительно в течение 1 час, осадок отсасывают на нутче н нромывают 200 мл воды. Продукт может быть очишен носредством нерекристаллизании или вынарнвания с ацетоном. Получают 24,2 г (75% теории) 1,3-диметнл-4{Y- 4 - (о - метоксифенил) - ииперазииил - (1)ироннламино}-урацила с т. ил. 156°С.
3,5 г 33%-iioH днснерсин натрня в толуоле (содержит около 0,05 моль натрия), разбавляют 35 мл абсолютного толуола. Размешивая, добав.чяют 9,5 г (0,037 моль) N-(о-ме-гокснфеинл)-К-(7-оксинрон 1л) -нинеразина. После того, как бурная экзотермическая реакния закончена, ири комнатной температуре добавляют порциями 8,8 г (0,05 моль) 1,3-Д1 метил-4хлоруранила. Образуется густая , которую в течеине 1,5 час нагревают с обратным холодильником. После охлаждения разбавляют 80 мл 2 н. соляиой кислоты и экстрагируют беизолом (три раза но 25 мл) для удалення еще неп юреагировавн1его хлорурацила. Затем с I и. натровым н|елоком устанаклнва от на зиачеиие рН 8 и экстрагируют хлороформом (три раза но 00 мл). После высуптиваиия соедииеииых органических фаз уиаривают и остаток иерекристаллизовывают из этаиола. Получают 8,3 г (58% теории) ,3-диметил - 4-((о - метокснфенил) - нинеразинил-П)-пронилокси}-урацила с т. нл. 145- 148°С.
Пример 2. 1,3-Диметил-4-{7- 4-фенилпинеразинил- (1)-пропиламино}-урацил.
25 г (0,14 моль) ,3-диметил-4-хлорурацила, 31,4 г (0,14 моль) М-фенил-Ы-(3-ами 10пронил)-иииеразниа и 50 мл триэтиламина кииятят с обратным холодильником в 150 мл хлороформа в течение 16 час. Для удаления ненрореагировавишго хлоруранила удаляют в вакууме хлороформ и триэтиламин, остаток растворяют в 200 мл хлороформа и экстрагируют 2 н. соляной кислотой (два раза ио 100 мл). Соединенные экстракты после добавления 100 мл 6 и. натрового щелока дважды извлекают хлороформо.м и органическую фазу освобождают от растворителя. Остаток, затирая эфиром, доводят до кристаллизации и перекристаллпзовывают из 150 мл уксусного эфира.
Получают 32 г (63% теории) 1,3-днметнл4-{v- 4 - фенилниперазниил - (1) - иронилами11о}-урацнла с т. нл. 114°С.
П р н м е р 3. ) ,3-Диметил - 4- (о-толуол)-нииеразинил-(1) - нрониламино}-урацил Смесь 5,3 г (0.03 моль) 1,3-диметнл-4-хлорураннла и 7,0 г (0.03 .моль) М-(о-толуол)(3-амннонропил)-нииеразнна кпнятят с обратным холодильником в 10 м-л триэтиламииа в
течение 10 тмин. После удаления избыточного трнэтиламнна в вакуу: 1е остаток растворяют в 70 м,т хлороформа и экстрагируют 2 н. соляной К.ПСЛ01Ы (тр раза ио 40 мл). Соединенные БО.анокислые фазы иодн1,елачнвают 40 мл
О н. натрового Н1елока и экстрагируют хлороформом. После высушивания и удаления хлороформа остается 11 г масла, которое вскоре кристаллизуется. Перекристаллизовьшая из бензола, иолучают 8,1 г (72% теории) 1,3-диметил - 4-{у- 4-(о - толил) - нннеразинил - (1)нроннламино}-уранила с т. нл. 162°С.
П р н м е р 4. 1,3-Д.иметил-4-{7- 4- (/г-хлорфенил) - ниперазннил- (1)-нроииламино}-уран.ил.
3.1 г (0,017 моль) 1.3-диметил-4-хлорурацила, 4,3 г (0.017 моль) N-(«-хлорфеиил)-Н у-амнноиропил1-иииеразина и 10 .мл трнэтнламииа нагревают в течение 1,5 час с обратным
холоднльником. После удаления избыточного триэтиламина в вакууме остаток растворяют п 50 мл хлороформа и три раза экстрагируют 50 мл 2 и. со.тянон кислоты. Объединенные кислые фазы HpoMi iBaiOT хлороформом при
ноАЮЩИ 6 н. натрового н елока, устанавливают Н1елочпую среду и три раза экстрагируют 50 .м.ч хлороформа. Остаток из высушенных хлороформовых Лаз (5,9 г) выкристаллизовывают из снирта. Получают 3,3 г (46% теории)
1,3-днмотнл-4-{ - 4-(п-хлорфеиил) - пиперазинил-(I )-ирониламино}-урацила с т. ил. 178- 179°С.
Пример 5. 1,3,5-Триметил-4-{7-4-(о- 1етоксифепил) - нинеразинил-(1) - пропиладшно}урапил.
5,6 г (0,03 моль) 1,3,5-триметил 4-хлорурацнла и 17,5 г (0,07 моль) К1-(о-метоксифенил) -N- (7-аминоиронил) -пииеразина кинятят с обратным хололи.льииком в течеиие 30 час
в 70 мл ксилола Выкристал,чнзов;1вт; пйсч HJ Hохлаждении N- (о-метоксифенол) -N- (-аминопронил)-иннеразин-гндрохлорид отделяют и промывают горячим бензолом. Фильтрат освобождают в вакууме от растворителя и очнщают хроматографически на колонне. В качестве стлнионарной фазы прпмепяют 350 г силикагеля нейтрального с величиной зерен 0,05- 0,2 мм, а растворителя - смесь хлороформа и этанола в соотношении 10:1. Получают 8 г
(66% теории) 1,3,5 - триметил-4-{7- 4-(о-метокснфеннл) - п11иеразиинл-(1) - нроииламиио}ураннла с т. нл. 120-121°С.
При м е р 6. 1,3 - Диметнл - 4-{7- 4- (о-метокснфенил) - пинеразн1 пл-(1) - ирониламиио}5-//-бутилуращ л,
7 г (0,03 моль) 1,3-дпметил-4-хлор-5-н-бутилурацнла п 17,5 г (0,07 моль) N-(о-метоксифеиил) -N- (у-амннопроппл) -пиперазпиа кипятят с обратным холодильником в чечеипе 5 диен в 70 мл ксилола. Выкристаллизовпвшийся при охлаждении гидрохлорид N-(o-i ieтоксифеиил)-Ы-(Y - аминопропил) - пиперазина отсасывают и фильтруют, упаривают. Остаток очищают хроматографией на колонне. В качестве стационарной фазы служит нейтральный силикагель с величиной зерен 0,02- 0,5 мм, в качестве растворителя - смесь хлороформа и этанола в соотношении 10:1. Получают 11,4 г коричневого масла, которое поглощают 250 бензола. Добавляют насыщенный раствор пикриновой кислоты в бензоле и после оседания осадка сливают бензол. При помощи насадки Тилепапе остаток перекристаллизовывают из этанола. Получают 11 г (54% теории) никрата 1,3-диметил-4-{у 4(о-метоксифенил) - пиперазииил-(1) - нропиламиио}-5-н-бутилуранила с т. пл. 173-175°С.
Пример 7. 1,3-Диметил - 4-{у- 4-(о - метоксифенил) - нннеразинил-(1) - проннламино}5-нитроурацил.
К раствору 11 г (0,05 моль) 1,3-диметил-4хлор-5-нитроурацила в 150 мл бензола, размещивая при комнатной темнературе, прикапывают раствор 32 г (0,1 моль) N-(о-метоксифеннл) -N- (у-амииопропил) -ииперазина.
Вначале образуется трудно размешнваемая паста, которая растворяется после окончания прикапывания. После этого вынадает крнсталлическнй гидрохлорид взятого нннеразнна. Смесь кипятят в течение приблизительно 15 мин н после охлаждения фи.чьтруют. Фильтрат унарнвают и остаток перекристаллизовывагот из спирта. Получают 17,7 г (82% теории) 1,3-диметил-4-{7- 4- (о--метокспфенил)пиперазинил-(1)-пропиламино}-5 - нитроурацила с т. пл. 160 -162°С.
Пример 8. 1,3 - Диметил-4-{((о - метоксифенил) - пиперазинил-(1) - пропиламино}уранил.
Смесь 4 г (0,023 моль} 1,3-диметил-4-хлорурацила и 12 г (0,046 моль) 1-амино-2- 4(о-метоксифеиил)-нинеразинил - (1)- нропанл кипятят с обратным холодильником, в течение 5 час в 300 мл ксилола. После охлаждения осадок отфильтровывают и промывают горячим бензолом. Объединенные фильтраты упаривают в вакууме и очищают хроматографией па колоине с нейтральным силикагелем величина зерен 0,05-0,2 мм, растворитель - смесь уксусного эфира, метанола и концентрированного аммиака в соотношении 20:4:1. Полученный таким образом коричневый продукт (5,5 г) нерекристаллизовывают при номощи активного угля из 70 мл уксусного эфира.
Получают 4,5 г (51% теории) 1,3-диметил4- (о - метоксифеннл) - нинеразинил- (1) нропиламино}-урацила с т. пл. 165-166°С.
П р и м е р 9. 1 -Метнл-4- (о-метоксифенил) - Г1инсразщ)1л - (1) - нроннламцио}-урацил.
4,8 г (0,03 МОЛ1)) 1-мстил-4-.лорурацила иагревают с 15 г (0,06 моль) (о-метоксифеиил)-нннераз пп1л-(1)-нропнламина в течение
24 час до температуры 90-100°С. Застывший
после охлаждепни стекловн.чньп нрозрачны
раствор кннятят с 150 мл снирта, нричем сначала наступает растворение, нозже к эисталлизацця. OicncbinaiOT п горячем состояннн н
промывают сцирто:м.
Получают 4,6 г i41% теорнн) 1-метнл-4{у- 4-(о - мстоксифенил) - ниперазипнл - (1)проннламнно}-ураа 1ла с т. пл. 230-233 С.
П р н Аг с р 10. 1,3-Дцметнл-4-{((о-метокснфенил пинсразши) - (1)-а-метилэтиламино}-урацнл.
Смесь 6 г (0,02t моль) Х-(о-метоксцфенцл)X - (2 - ампномропи.т) - пинеразнна, 4,4 г (0,025 мо.ть l,3-дн eтнл-4-.xлopypaцилa и 30 мл т рнэтн.тамина кинятят с обратным холодильником, не принимая во вниманне иераствореиное пещестно, п течеине 5 час. После этого т шэгнлампп удаляют в caicyyMC, остаток разбавляют 60 мл 2 н. соляно11 кислоты и экстрагируют хлороформом. Солянокислую (|)азу поднюлачнг.ают 2 н. натрог.ым н1елоко-М
и снова экстрагируют хлорофо кчом. Остаток хлороформовон (jia ;ы для нзо.пнровання нро;;укта очин1ают хроматографическн на колонне (нейт11а. снликаге.И), растворптель - смесь уксусного э( и метанола 5:1). Такнм образом получают 2,6 г (34% теории) стеклообразно зпстыпитего мас.та, гндрохлорнд которого перекрнсталлпзовапный с ацетоном в парогом экстракторе нмеет т. пл. 238- 240°С.
Прнмер 11. 1-11нклогекспл-4-((о- тетокснфенил) - ппперазпнил - (1) - нронплампно}-урацил.
3,4 г (0,015 лоль) 1-циклогекснл-4-.хлорурацила нагревают с 10 г (0,04 :моль) -(о-метокснфеннл)-Х-(Y-аминопропил) - пинеразина в течение 8 час нриб.чнлпельно до температуры 120°С. После охлаждення взбалтывают с 100 2 н. соляной кислоты и 100 мл хлороформа, хлороформовую фазу выбрасывают.
Водный кислый раствор нодщелачнвают 2 н. натровым нделокол при ледяном охлаждении и экстрагируют х.тороформом. Очищенне происходит посредством хроматографин на колонне над нейтральным снликагелсм, растворитель - смесь хлоро(1юрма и этано.та 6:1.
Получают 2.5 г (38% теории) 1-цнклогекснл-4-{у- 4-(о - метчжсифени.ч) - ниперазпнил(1 )-проп11лал;1Н1о}- рацила, который гможет бырь перекрт1ста,тлнз( из смеси 30 м.т хлороформа п 100 мл :- та11ола носредством вынаривания до 50 мл. Г1род ч т- имеет т . н.ч. 217- 219°С.
Прнмер 12. 1-/i-ByTiL4-4-{у- 4-(о-мечокенфеннл)-пинеразннил-(1) - нро11нламнно}-ураНИЛ.
8,2 г (0.04 моль) 1-бутил-4-хлорурац тла и 20 г (0,08 мп.чь) Ы-(о-метоксифеш1л)-М-(7али1 011 Ю1111л)- 1исраз1иа нагрсвают в течение 3 час до темиератзры i-iOC. Пос. охлаж. ociaioK растворяют х.лорофо1).мо-м 1 воюй. Х.юроформовую фазу отделяют, упарпсают и осчаюк лерекр стал.т поп1ДЕа 01 в najHiBOM oKCipaKinpe ил )юла. Получают 8,3 г (50% -юорин) 1-/(-бу1мл-4-{у- 4-(о - метоксифгштч) - нинеразпиил-(1) - пропи-ламино}ура1|ила с т. ил. .
Гак Jive, Kai; оппсаио D иримере 12, примен1i соответспгующие исходпьте лгагериалы, иолучаот с.тел.уюии1е соединения:
1-циклогекс;1л 4- - (о - мсюксифенил) 1П1иеразииил - (Г) - ироииламино}-5-/г - бутилyiniHT. с выходов; 06% теори.ч, с т. ил, 155°С;
4-{7- 4- (о-ме1оксифоинл) -ииперазинил- { niiipoiiHTaMHHoj-yiiaH.n.i с П1лхол,ол1 30% тео|Я111 и с т. разл. около 2/0°С.
И р и м с р 13. 1 -Фенил-4-{7ф4- (о - метокснфспил)-иииераз ПП л - (1)-ироии.ламиио -урапи.д.
(i,7 г (0,03 уол1..) 1-феиил-4-.хлор}ради.|1а иа грс1 ают в течение 0,5 час с 18 г (0,072 моль) М- |о-г.1етокси(1)) - N- (у-а.мнионроии-л) -ипперазина д,о темиерату 1ы 150°С. После ох,а/ ;дсни/ разменпизают в теченне 1 час с 00 мл поды и 100 мл хлороформа и затем (1)аз.г разд.е.тя1от. Остаток 1 ысушеиио1 1 х.(j)opMOBoit (Ьазы очинлают хромотогра(1)нчески на ко.лоние над 360 г неСггралвного си.гнкагеля (ве.лнчииа зерен 0,05-0.2 мм, растворнте.ть - ;м(чь х.лороформа н этанола 0:1).
Получают 10,4 в (80% теорнн) 1-феиил-4(v - (о - мет (1кснф еинл) - иииеразинил - (1)Н11оннламнн(:}-урацила.
Продукт, нерекристаллнзоиаииын пз :зтаиола. имеет т. нл. 18G°C.
Пример 14. 3-Фенил-4-((о - метокс () - нннсразинил-(1)j-ироиилампно}-ураИЛ1Л.
11,2 г (0,05 моль) З-феинл-4-хлорурацила нагревают в течение 1 час с 27,5 г (0,11 моль) М- (о-метоксифеннл) - N- (у-а,1 П1онроиил)-ии 1еразина до т емиературтл 60°С и ипсле охлаждеппя растворяют ириблнзнтел1Л1о п 200 мл хто :10{50)ма и 200 :.1л воды. (ргаиическую фазу отделяют и уиариваюг. Оетатогс обрабатывают посредством лромат-ографпи на колонне (нейтральны силикагель, 1;елнП1;;а зереи 0,05-0,2 мм, растворитель--сиа-ала смесь хло))0|1ма н этанола 6:1, зятем смесь уг:с сногп эфира, метаиола и ко1 цеитрир(мзанногп N(-LOH 20:4:1), Получают 3-феиил-4-{у- 4(-; - метокс ире И л-лтннерази Ил - (1)-ироннламино}-урацпл с выходом 4 г (с% теории): он гтожет быть иерекристаллизован из этано а и имеет тогда т . ил. 218С.
Пример 15. 1,3-.Циметил-4-{Ы-этил-М- 7 4-(о- метоксифеии.п) - пннеразинил-()-иpo тн,ч -aмн lo}лpa ил.
3,5 г (0,02 .моль) 1,3-диметИЛ-4-хлорурацнла с9г (0,032 мг.м,) N-((-мeтoкcliфe HIл)(cc;тп1;1амил;и |юннл) - ипнеразииа Б тсчеине
0,5 час иагревают до 120С. Путем хромато ра(1И ескиго разделе ия иа ко,тонне иолучают 5 г мас.ла 75% теорни), icoiopoe с Х.;()рВОД( КИСЛОТЫ
1ереводят в днгидро.хло1:1ид основания. Его исрекрнсталлизовывают нз изонроиаиола и он разлагаетсл, нач 111ая от 162С.
П р и мер 16. 1,3-Днметил-4-{1-метил-2 4-(о-метокснфеинл) - пинераз 11ил - (1)-этилокст } -ура1,нл.тнгидро.х.лорнд.
2,5 г (0,1 моль) N-(о-метоксифеиил)-N-(2окси рои 1л)л ииег:1ази 1а в течение 0,5-1 час кииятят с обрат Пз1.м холодильником в 150 мл абсо-., толуола с 5,3 г (0,12 моль) 55%Л10 суспеи.зин гидрата натрия Б масле. После охлажтения добавл-пот 19,2 г ,0,11 гтоль) 1,3-ди.:етнл-4-хлорурацнла и снова ки 1нтят с обратт1ым холодильником в теч.сние 0,5 - 1 час Па холоду иром1)1вают БОДОЙ 1 в 1арива от раство) толуола. Остаток растт,оряют в 300 мл аиетоиа н осажда от дигид юхлорид 1 асыи1е 1Ь м .хлорводородом. Получают 36 г (78% теорИ) 1,3-Д 1метил-4-{ -метил-2- 4-(-метоксифеиил) - иииеразинил-(1 )эти..м(и сн}-ура и-1л-днгидрохлорнд с т. пл. .
П р н мер 17.1,3-Диметил-4- {1 метил ((пиил ииеразн 1 1л-(1) - этокси}-урацил - диГ 1ДрОХЛОрИД.
Соответстве1 ио примеру 16 получают из N (1)е1 ил-М-(2 - оксинронил) - ииперазипа 1,3Д| мстт л-4-{1 -моти. - фе11 1лн11неразииилf I ) 1-э1 окс1 }-ура1.нл в ,е масла с выходом 49%, которое с хлорводородом дает дигидрохлорид, кото)ьп снекается, начиная от 170°С.
П ) н м е р 18. 1,3-Днметпл 4-{1-метнл-2- 4(«-метнлфенил) - иииеразинил- (1 j -атокси} раит1.л.
Соответственно ирнл;еру 16 нз (я-метилфенил)-N-(2-оксинронил)-пииеразина нолуча от 1,3-диметил-4-{1 - метил-2- 4-(/г - метилфе1 1л) - и 1иеразпннл-(Г) - этнлоксн} - ураиил, с в:лходом 70% н т. пл. 120С.
П р 1 м ер 19. 1,3-Диметил 4-(1-метнл-2- 4(/г-хлор(|1ент1л) - нннеразиии.д-(1) - этилоиси}уранил.
Соответстве но иримеру 16 из N-(/г-хлорфеиил)-N-(2-окенпроннл) - иинеразииа получают 1,3 диметил 4- {1 -метил-2- 4- (л-хлорфенил) г;ииераз1 нил- (1) 1-этилокси) лрацил с выходом 80% и т. пл. ример 20, 1,3 Диметил-4-{1-метил-2- 4(о - eтoкcl фe н.l) - нннеразинпл - (1)-этплi io} .т.
Смесь 33,5 г (150 моль) о метоксифенилпи 1еразн 1карбоната н 22 г (300 моль) пропи..ль(|1ида в течение 1 чае кипятят с обратным холо.а,ильником в 100 мл метанола. Избыточный проппленсульфид удаляют затем в вакууме. Остаток растворяют в растворе 5,6 г (100 моль) гндроокиси калия и 100 мл метаио,та и 5 вакуу.ме высушивают. Из остатка путем обработки ацетоном при компатпой темие|)атуре 1 зол 1ру1от- гигроскопическую соль калп;; ,гркаптосоед1). 9,5 г (31 моль)
этой соли в течение 2 час нагревают в паровой бане с 5 г (28 моль) 1,3-димстпл-4 хлорурацила в 100 мл воды. Водный раствор декантируют и остаток перекрнспаллнзовывают 2 раза из метанола. Таким образом, получают 9,8 г (78% теории в отиошешш 1,3-диметил4-хлорурацила) 1,3-днметнл - 4-{1 - .метил-2 4(о - метоксифенил) - пиперазинил - (1) - эшлтио}-урацила с т. пл. .
Пример 21. 1,3-Диметил - 4-{1-мет11л-2- 4фенилпинеразинил-(1) I - э1ил-1ло)-урацил.
Соответственно иримеру 20 из феиилнннеразинкарбоната изготовляют 1,3 диметил-4- (1метил-2- 4-феиилпииеразинил - (1)-этилтио}урацил, дигидро.лорид которого получают с выходом 59% и с т. ил. 2МС.
Пример 22. 1,3-Диметил-4-{1-мет11л-2 4(л - толил) - иииеразииил - (1 )-этилтио}-урацпл-днгидрохлорид.
Соответственно нримеру 20 из лг-толилпиперазннкарбоната изготовляют 1,3-диметил-4{1-ме1Нл - (.и-толил) - пииеразинил - ( э илтио}-урацил, из которого иолу|1а10т дигидрохлорид с выходом 48% и т. пл. .
Пример 23. 1,3-Д1 метил-4-{1-метил-2- 4(/г-толил) - ииперазипил - (1)-э1ИЛ1Но}-урацил.
Соответствеиио иримеру 20 из /г-толилнинеразиикарбоната изготовляют 1,3-днметнл-4{1 -метил-2- 4- (п - толилиииеразнннл - (I j -этилтио}-урацил с выходом 45% и с т. ил. 152°С.
Пример 24. 1,3-Диметил-4-{1-метнл-2- 4(я-хлорфенил) - иииеразинил - (1)-этилтио}урацнл.
Соответственно примеру 20 из /г-хлорфеинлпнперазннкарбоната изготовляют 1,3-днметил4-{1-метнл - (/г-хлорфеиил)-иииеразнннл(1)-этилтио}-ураиил с выходом 28% и с т. ил. 152- С.
Примененный в примере 5 как исходное соединение 1,3,5тр 1метнл-4-хлорурацпл .может быть получен с;1едующим образом.
В 92 .мл фосфороксихлорида прикапывают, разме1пивая (J,l мл 89%-пой фосфорной кислочы; после окончаппя выделения газа добавляют 34 г (0,2 моль) 1,3,5-триметплбарбитуроBoii кислоты н в течение 2 час кинятят с об1)атным холодильником. Затем отделяют в вакууме избыточный фосфороксихлорид и остаток в11 Л1И1ают на лед, ириче.м иаступает нагревание до температур, приблизительно 90- 100С. Выиав11(1;е ири охлажде1И1и кристаллы (/1сасывают н посредством экстрагирования с хлорофо)мом 1 ыделяк: т из фильтрата остаток продукта. После перекристаллизации из воды получа.ют 23 г (61% теорпп) 1,3,5-триметпл-4хлорураипла с т. n;i. 135°С.
Аналогичным образо.м, применяя 1,3-диметил-5-«-бутнлбарбнтуровой кислоты, получают 1,3-диметил-4-хлор-5-н - бутнлурацил с 45%-ным выходом с т. пл. 59-60°С, который применяют в примере 6 как исходное соединение,
14
Примепоиньь в примере 12 как исходное соединен.. i н-бутил-4-хлорурацил может быть получен слс71,уюидим образо.
В раствор 23 г (1 моль) патрия в 500 мл абсолютного этанола добавляют при комнатной температуре 35 г (0,3 моль) бутплмочевипы п 48 г (0,3 ми.ть) дпэтгк ювого эфпра малииовой кислоты.
В горячей масляной бппе, с т(.-мпе11ату 1ой
, отде.тяют спирт и остагок гк.;;де : кивают ириблнз)илыи) и течение Ki чис при этой темиерату1)е. С)хлп:-кденны11 остаток растворяют ириблнгппельно в 300 мл воды, размеишпают с акишныд углем и фильтруют.
Пз прозрачного 1|)нльтрата, под1{ 1сляя конпептрироьапнои со.тяно ьлслгп,i, получают 38 г (68% leopuii) -бутн. lyjtOBOH кислоты, которая после пер рпста.тлпзацпн из бензола л.-леет т. ил. 107---108 С.
10 г (0,50 .моль) 1-бутнлбарбнтуровой кислоты кипятит с обратны.м хо.тоднльником с ПО мл (|)ос1|)0|)окспхлорида, остаток разбав.;:i;OT Л1:;1:М|1-П liOJ.OH Н ХЛОрО(|)ОрМОМ НОСЛС ОТ,.1 и.)бытка ф,исфо|)окс11хло1)пда. Хлороформовую фазу отделяют, высушивают и упарпвают.
Получают остаток 8,2 г (73% тео)ии) 1-бутт1Л-4-хлорурацнла, Kinopiiiii пос.те )сталлизацин из бензола имеет т . пл. 187-
189°С. Прнм(.ч1снны11 в н|)11ме|)е 11 как псходние соедниенпе I -нпклспчччснл- l-xjiopyjiaiu a ,.;ei быть получен следуюп.пм образом.
16 г (0,0/5 )ль) I-ппклогекснлбарб1ггуровой кислоты размешнпают в течеипе 16 час
при те.мперат уре с 150 .мл фос1|)ор()КС11:;лорида н 10,5 мл 89%-noi (1)ос(1юрпой iviic.ioты. Затем при температуре 70 С нзбыточньи |)осфорокснхлорн;1, отделяют в вакуу.ме. Ох.таждениы| 1 остаток, )азме1пнвая, разбав.тяют
.тедяпо| 1 водо11 п .хло)01|ч)р-ли.м; х,то }офо|)мовую фазу ynapiHiajOT и остаток очннииот х)оматографней на колонне. (iaH.iiona)noii (j)a3oii служпт нейтральны с1 лпкагель, ве. зе)ен 0,02-0,5 .., |iacTiiO|)HTe. 1ел:-c: iecb х.чороформа этанола 6:1. Получают 12 г (70% теории) 1- и1клогекснл-4-хлорура1и1ла, KOTXJры| иосле nepei piiCTa.T.4H3ai Tii пз этанола, ,еет т. пл. 222-224 С.
Пр1 ме ен11ый п p)i :eiTax 13 i 1-1 и неходное соедн 1еппе 1- 3-феп 1л-4-хло|1ураннл может б.1ть К)лучеп с.тед..м образо.м.
41,0 г (0,2 .oль) 1 (|)еннлба||бН1уровоГ| ivnc..iOTIil (ИПЯ)1ГГ с об|1атН з1М ХОЛОДН. в
течение 3 час с 40U .мл фос1)орокснхло|)нда и 28 л (j)oc(j)oiiiioii . После
уДаЛе П1Я H.( (|)ОС(1)ОрОКС 1ХЛОр 1Да в
;акууме обрабатывают 1 л ледяной под, кр 1Сталлнческ1п | осадок oTcaciiUunor i ром вают водой. Остаток )астворяют в 1 л иасыш,еииого раствора б 1карбо ата 1атрпя I л хлорофор.ма и «азделяюг па . Пз хлороформовой ()азы золп 1у1от 11,8 г (26% теори 1) 3-феп л-4-хлорурацнла, KOTop iiii после иерекристаллизации из этанола, н.меет т. пл.
256С. Водную фазу после добавле П1я 1,5 л
15
.хлороформа и 10%-iioro метанола подкисляют 2 и. соляно кислотой. Количостпо экстрагированного такнм образом 1-фснил-4-хлорурацила составляет 13,8 г (31% TeopiHi). Он может быть нерекристаллнзопаи нз этанола н имеет т. ил. .
IIc.xoAiiije соед1П ения нрнмероп 16 и 19 могут быть иолучени нзвестиым образом, иутем кинячения соответствеиио заменьенпы.ч фенилнинеразниов окнсыо И1юиилеиа в метаноле, удаления летучего реактива н растворителя в вакууме и перекристаллизации.
В табл. 2 ириведеиы некоторые данные нсходны.ч еоединеиий иримеров 1G-19.
Т а б л и ц а 2
Ш
или -СОМ -Щ4-групиу, причем R.j обозначает алкильнын радикал с содержание.м до 4 атомов углерода или, в случае надобности, замеИ1е11иыи фенильиый радикал.
X обозиачает NRs-rpyHHy, нричем Rs обозначает атом жедорода или прямую или разветвленную алкильную грунну с содержанием до 4 атомов углерода или атом и слорода или серы,
Л обозиачает ирямую или разветвлеиную, иасьпденную или ие11асыи1епиую алкилеиовую груииу,
Y - атом водорода или алкильный радикал, содержащий до 6 атомов углерода,
Z - атом водорода или одиа или несколько алкильных, алкокси- или меркаитоалкильиых груип, в (аждой из которых до 6 атомов углерода, или трифторметильиые группы или атомы галогеиа, отличающийся тем, что соедииеиия общей формулы II
П р е д м е т и з о б р е т е н и я
Снособ получения ироизводных пииеразина o6m,eii формулы I
О
о N
I
ib
где Ri, R2 и Ra имеют указаиные значения, Mai - атом галогеиа, предпочтительно атом хлора или брома, подвергают реакции взаимодействия с соединением обш,ей формулы 1И
N-A-Xll
где RI и R2 обозначают атом водорода, нрямуго или разветвленную, насы1цеп11ую или иенасыгаенную алкильную группу с содержанием до 6 атомов углерода или гипчлоалкильиую или фенильную грунпу,
Rs обозначает атом водорода, прямую или разветвленную, иас лщеи11ую или иеиасыщеииую алкильную груииу, аралкильную, арильпую или циклоалкильиую группу, нитро-, алкиламино-, диалкпламиио-, ацильную группу
где Z, Y, А и X имеют приведеиные значения, или с ироизводпым н1,елочных металлов соединения формулы III, а в случае, когда X - атом кислорода, е последующим выделением нелевого иродукта известными приемами в свободиом виде или в виде его соли.
2. Способ по и. 1, отличающийся тем, что в случае, когда в соединении общей формулы III X - атом серы, последнее применяют в виде производиого щелочного металла.





| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПИПЕРАЗИНА | 1973 |
|
SU363248A1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕТЕРОЦИКЛИЧЕСКИХ ЭФИРОВ | 1973 |
|
SU404251A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ5,П-ДИГИДРО-6Н-ПИРИДО-[2,3-Ь]-[1,4]-БЕНЗО-ДИАЗЕПИН-6-ОНА | 1972 |
|
SU331554A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-АМИНО- 5-НИТРОТИАЗОЛА | 1972 |
|
SU354658A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ КУМАРИНА | 1973 |
|
SU404237A1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИАМИНОСОЕДИНЕНИЙ | 1973 |
|
SU399109A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПИПЕРАЗИНА | 1970 |
|
SU271412A1 |
| СПОСОБ ПОЛУЧЕНИЯ | 1973 |
|
SU399127A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ БЕНЗОДИАЗЕПИНА | 1973 |
|
SU400100A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ИЗОХИНОЛИНА | 1970 |
|
SU417942A3 |


Авторы
Даты
1973-01-01—Публикация