заключающийся в том, что в соединении формулы
где Ri свободная или кетализированная оксогруппа,
R2 - свободная или этерифицированная в сложный эфир оксигруппа,
Rs - углеводородный остаток или остаток карбоновой кИСлоты,
альдегидную группу восстанавливают до метильной преимущественно палладием на угле в присутствии циклогексена с выделением целевого продукта в свободном виде или с расщеплением имеющихся енольных или кетальных групп до соответствующих кетогрупп или в полученных соединениях свободные гидроксильные группы, находящиеся в положении 17,. капроил-ируют известными приемами.
Пример 1. 2,0 г палладия на угле (10%) растирают с 4 мл ледяной уксусной кислоты, по истечении приблизительно 5 мин смесь отфильтровывают, осадок промывают метиловым спиртом до нейтральной реакции, а затем переносят в реакционный сосуд совместно с приблизительно 10 мл метилового спирта. После этого в сосуд прибавляют 10,0 г 3-метокси-6-формил-17а-капроилокси-20 - оксо-Дз.5-19-норпрегнадиена и 20 мл свежеперегнанного циклогексена и реакционную смесь перемещивают в течение 18 час при одновременном кипячении с обратным холодильником. Затем реакционную смесь охлаждают до комнатной температуры, отфильтровывают от катализатора, перемещивают с 7,4 г силиката магния, 15 мин кипятят с обратным холодильником, снова производят охлаждение, разбавляют эфиром, отфильтровывают и упаривают в вакууме водоструйного насоса. Выделившийся в осадок неочищенный продукт (9,1 г) растворяют в 100 мл толуола и затем производят хроматографирование на 50-кратном по весу количестве силикагеля. При элюировании смесью толуола и ледяной уксусной кислоты (90: 10) в первой фракции получают более чистый 6а-метил-17а-капроилокси-19норпрогестерон. Соединение, многократно перекристаллизованное из смеси хлористого метилена и эфира, имеет т. пл. 113-155°С.
Использованное в качестве исходного вещества формильное соединение получают, например, но следующей методике. 13,0 г 17сскапроилокси-19-норнрогестерона растворяют в 160 мл бензола. Затем производят отгонку приблизительно 25 мл растворителя, к остатку прибавляют 6,5 мл свежеперегнанного метилового эфира о-муравьиной кислоты, 0,65 мл метилового спирта и 130 мг п-толуолсульфокислоты и реакционную смесь в течение 2,5 час кипятят при перемешивании с обратным холодильником. В течение 30 мин отгоняют другую часть (10 мл) растворителя, смесь охлаждают. После прибавления 1,3 мл пиридина реакционную смесь разбавляют эфиром, после чего ее промывают последовательно насыщенным раствором кислого углекислого натрия и водой, сушат, упаривают в вакууме водоструйного насоса. Кристаллизация полученного остатка из метилового спирта (в присутствии небольщого количества пиридина) дает возможность получить 3-метокси-17а-капроилокси - 20 - оксо-А -19-норнрегнадиен.
10,0 г этого соединения растворяют в 25 мл хлористого метилена и полученный раствор
при 6°С прибавляют но каплям к реактиву Вильсмайера, полученному из 5,8 г диметилформамида и 3 мл фосфороксихлорида в 20 мл хлористого метилена при 0°С. Окрашенный в красный цвет раствор перемешивают в
течение 2 час при 0°С. Затем раствор нагревается в течение 1 час до 18°С. После этого реакционную смесь снова охлаждают до температуры приблизительно 5°С, добавляют суспензию, приготовленную из 22 г безводного
ацетата натрия и 70 мл 90%-ного метилового спирта, и перемешивают в течение 30 мин при комнатной температуре. Затем реакционную смесь разбавляют водой и хлористым метиленом, органический слой последовательно промывают два раза водой, один раз 4%ным раствором углекислого калия и снова один раз водой, экстрагируют промывные воды хлористым метиленом, объединенные органические фракции сушат, а затем упаривают
растворитель в вакууме водоструйного насоса.
Полученный неочищенный З-метокси-6-формил-17а-ка1Нроилокси-20-окСо - Д -19-норпрегнадиен (УФ-спектр; .„акс(е220/10000 и
320/14500) без последующей очистки подвергают восстановлению.
Пример 2. 2,0 г 20-диоксо-6а-метил-17аокси-Д -19-норпрегнена при пропускании азота суспендируют в 5 мл капроновой кислоты и в течение 30 мин при перемешивании смешивают по каплям с 2,5 мл ангидрида трифторуксусной кислоты. Непосредственно после этого реакционный раствор перемешивают
еше 4 час при комнатной температуре, затем смесь выливают приблизительно в 10 г льда и для отделения избыточного количества капроновой кислоты производят отгонку с водяным паром. Нелетучий твердый остаток растворяют в эфире, эфирный раствор тщательно промывают охлажденным льдом, разбавленным раствором едкого натра и затем водой. Промывные воды экстрагируют эфиром, органические растворы сушат и упаривают их в
вакууме водоструйного насоса.
Полученный неочищенный продукт очищают с помощью хроматографии на силикагеле и с помощью последующей многократной пере
кристаллизации из смеси хлористого металла, диэтилового эфира и петролейного эфира. В результате получаюг плавящийся при 112- 115°С 3,20-диоксо-6а-метил-17а-капроилоксиД -19-норпрегнен, идентичный с препаратом,
полученным в примере 1.
5
Предмет изобретения Способ получения ба-метил-19-норпрогестерона формулы
--OCOlCH l.CH
(1)

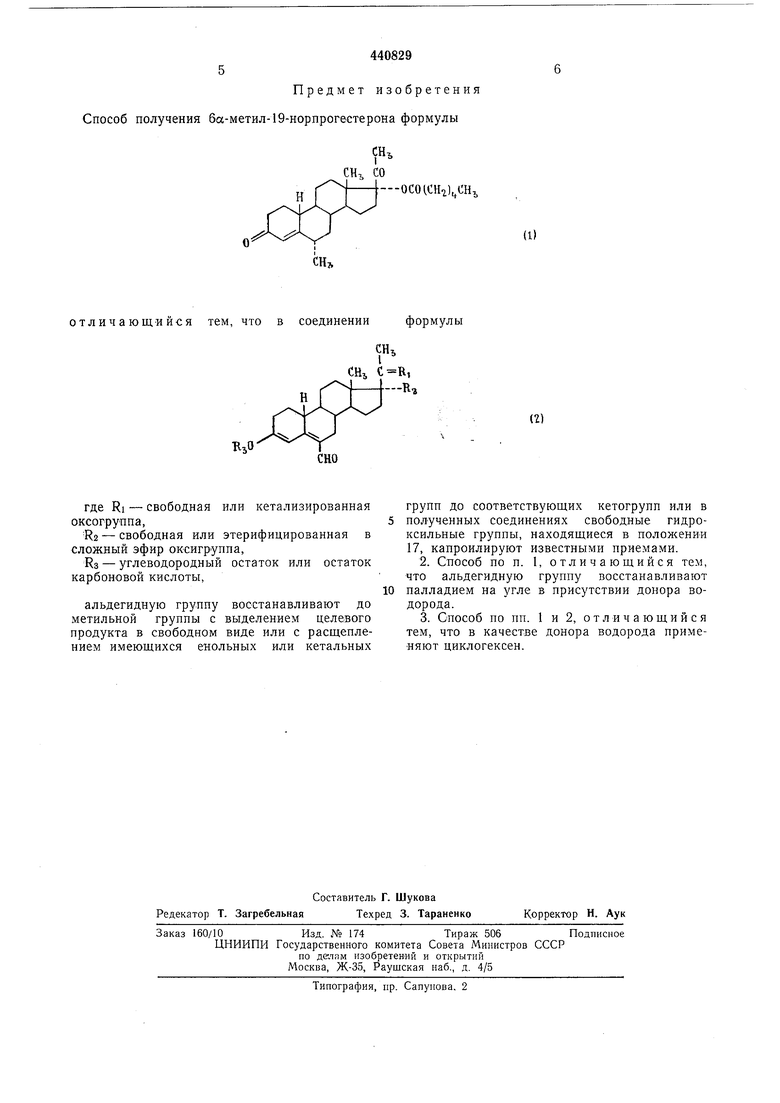

отличающийся тем, что в соединении формулы
к.о
сно
где RI - свободная или кетализированная оксогруппа,
Rj - свободная или этерифицированная в сложный эфир оксигруппа,
Нз - углеводородный остаток или остаток карбоновой кислоты,
альдегидную группу восстанавливают до метильной группы с выделением целевого продукта в свободном виде или с расщеплением имеющихся енольных или кетальных
(2)
групп до соответствующих кетогрупп или в полученных соединениях свободные гидроксильные группы, находящиеся в положении 17, капроилируют известными приемами.

Авторы
Даты
1974-08-25—Публикация