Изобретение относится к способу получения новых замещенных эфиров акриловой кислоты - а-карбонилоксиакрилатов общей формулысн.2 с-соов 0-С-Бз где К СНз-; CsHs-; Н-С4Н9; О - С - COOR; - СН : СН - С - OR iII СН,О которые могут найти применение в качестве мономеров в синтезе полимеров, а также как сшивающие агенты. Известен способ получения сс-ацилоксиакрилатов общей формулы сн, с-сиов 0-с;. о где К СНз-; СгНа-; Н-С4Н9-; СНз-; Н-С4Н9-; CsHs- взаимодействием соответствующих эфиров р-хлормолочной кислоты с ангидридами и хлорангидридами карбоновых кислот в сред органического растворителя в присутствии ор ганического основания с последующим дегидрохлорированием при 70°С в среде органического растворителя в присутствий органического основания, например пиридина. Выход целевых продуктов 40-60%. Однако синтез новых соединений с лучшими свойствами не теряет своего значения в настоящее время. Способ заключается во взаимодействии алкиловых эфиров р-хлормолочной кислоты с хлорангидридами общей формулы (/ - L. - Kj R, R, OR; Ra - О - СН - COOR; R, R, -Cn CH-C-OR; R CHj-; CjHs-; ,- в среде органического растворителя при О- 10°С в присутствии органического основания, например пиридина, с последующим дегидрохлорированием в среде органического растворителя в присутствии органического основания, например триэтиламина, и ингибитора радикальной полимеризации при 20-100°С. Выход целевых продуктов 60-70%. Эти соединения обладают лучшими свойствал-п-, чел известные. Пример 1. Синтез метил-(а-метоксикарбонилокси)акрилата СНг С-СООСН5 - ОС10)ОСНз К охлажденному до 0°С раствору 47,25 г (0,5 моль) метилхлорформиата в 400 мл серного эфира (толуола) в течение 2 ч постепенно При перемешивании прибавляют 69,25 г (0,5 моль) метилового эфира р-хлормолочной кислоты и 39,95 г (0,5 моль) пиридина в 100 мл серного эфира (толуола). Реакционную смесь выдерживают при комнатной температуре в течение 10 ч. Выпавшую хлористоводородную соль пиридина отфильтровывают, промывают растворителем. Фильтрат промывают 5%-ным раствором соляной кислоты, 5%-ным раствором бикарбоната натрия, водой до нейтральной среды. Промывные растворы готовят на 8%-ном растворе поваренной соли. Сушат сернокислым натрием или магнием. Удаляют растворитель, остаток разгоняют в вакууме, выделяют 59 г (60%) метилового эфира а-метоксикарбонилокси-р-хлориропионатааСНгШСООСНз ОС(р)ОШз Продукт представляет собой бесцветную , жидкость, растворимую во многих органических растворителях, перегоняющуюся в вакууме без заметного разложения; т. кип. 92°С . (1 мм рт. ст.); 1,4410. К 55,5 г (0,55 моль) триэтиламина в 200 мл сухого бензола при 60°С при перемешивании добавляют по каплям 59 г (0,3 моль) 1а. Температуру поднимают до 80°С и выдерживают с перемешиванием 5 ч. Охлаждают до комнатной температуры, отфильтровывают выиавший хлористоводородный триэтиламин. Фильтрат промывают аналогично указанному выше. Сушат сернокислым натрием, удаляют бензол в атмосфере аргона и разгоняют остаток в вакууме в присутствии ингибитора радикальной полимеризации. Получают 33,4 г (70%) метил-(а-метоксикарбонилокси) акрилата 1, т. кип. 82°С (2 мм рт. ст.). Это сиропообразная жидкость, хорошо перегоняющаяся в вакууме. Пример 2. Синтез этил- (а-метоксикарбонилокси) акрилата CHrCCOOCaKs 9С(0)ОСНз Синтез проводят аналогично примеру 1, Из 76,25 г (0,5 моль) этилового эфира рхлормолочной кислоты и 47,25 г (0,5 моль) метилхлорформиата и 39,95 г (0,5 моль) пиридина получают 68,5 г (65%) этилового эфира а-метоксикарбонилокси-р-хлорпропионатаClCH2aiCOOL H.;j Ъео)осн, Это бесцветная жидкость, хорошо перегоняющаяся в вакууме. Из 68,5 г (0,31 моль) Па и 55,5 г (0,55 моль) триэтиламина получено 38,3 г (72:%) п. Соединение П представляет собой сиропообразную жидкость, которая перегоняется в вакууме без заметного разложения. Пример 3. Синтез бис-(1-метилкарбоксивинилиден) карбоната (СООСНз)О 2СОП1 Необходимый для синтеза указанных симметричных карбонатов хлорангидрид C1C(0)OCHCOOR СНА получают взаимодействием алкиловых эфиров р-хлормолочной кислоты с фосгеном. Он крайне неустойчив, и уже при температуре выше +5°С разлагается. Однако в момент образования хлорангидрид приведенного строения гладко реагирует с алкиловыми эфирами р-хлормолочной кислоты при О-5°С в среде органического растворителя в присутствии органического основания в качестве акцептора хлористого водорода, давая хлорсодержащие симметричные карбонаты. В 110,4 г (0,8 моль) метилового эфира рхлормолочной кислоты и 69,5 г (0,8 моль) пиридииа в 400 мл сухого бензола при 5°С пропускают 39,6 г (0,4 моль) фосгена через барбатер в течение 2 ч. Образовавшуюся хлористоводородную соль пиридина отфильтровывают, промывают бензолом. Фильтрат обрабатывают, аналогично указанному в примере 1. В вакууме выделяют 68,9 г (46%) бис-(1-метилкарбокси-2-хлорэтил)карбоната ГаСНгСНО- JOO СООСН; Названное соединение представляет собой бесцветную маслообразную жидкость со слабым запахом, растворимую во многих органических растворителях, перегоняющуюся в вакууме без заметного разложения; т. кип. 154°С (1 мм рт. ст.). К 45,5 г (0,45 моль) триэтиламина в 150 мл сухого бензола при 60°С при перемешивании добавляют по каплям 68,9 г (0,226 моль) П1а. проводят в условиях, аналогичных приведенны.м в примере 1. После отгонки растворителя остаток перекристаллизовывают из смеси серного и петролейного эфиров в соотношении 1 : 1 из расчета 1 мл серного эфира на 1 г мономера. Выделено 42,3 г III (69%); т. пл. 35°С.
Вещество хорошо растворимо в бензоле, серном эфире и других органических растворителях.
Пример 4. Синтез бис-(1-этилкарбокснвинилидеи)карбоната
СО.
Г CHf СО
Из 122 г (0,8 моль) этилового эфира 5-хлормолочиой кислоты, 69,5 г (0,8 моль) ииридина и 39,6 г (0,4 моль) фосгена в условиях, аналогичных примеру 3, получено 63,4 г (48%) бис-(1-этилкарбокси-2-хлорэтил)карбоната
ГСЮНгСНО- 1 СО COOCaHJa
Полученное соединение - бесцветная маслообразная жидкость со слабым запахом, хорошо перегоняющаяся в вакууме. 63,4 г (0,195 моль) IVa Дегидрохлорируют 40,4 г (0,4 моль) триэтиламина аналогично указанному в примере 3. Выделяют 35,4 г (70%) IV. Соединение IV является твердым веществом, хорошо растворимым в бензоле, серном эфире и других органических растворителях.
Пример 5. Синтез бис-(н-бутилкарбоксивинилиден) -карбоната
1СО
.
Из 144,5 г (0,8 моль) н-бутилового эфира р-хлормолочной кислоты, 69,5 г (0,8 моль) пиридина, 39,6 г (0,4 моль) фосгена в условиях, аналогичных примеру 3, получено 77,5 г (50%) бис-(н-бутилкарбокси-2-хлорэтил)карбоната
rClCH CHO1 СО
L- COOC4H9-Ja
Полученное соединение - это бесцветная сиропообразная жидкость, перегоняющаяся в
вакууме без заметного разложения. 77,5 г (0,198 моль) Va Дегидрохлорируют 40,4 г (0,4 моль) триэтиламина. Реакцию проводят аналогично указанному в примере 3. Выделяют 39,6 г (65%) V. Полученное соединение V-это жидкость, которую не удалось очистить ни кристаллизацией ни перегонкой.
Пример 6. Синтез метил-(а-метилмалеиноксикарбонилокси) акрилата
СН ССООСНз
ОС(0)СН СНСООСНз
К охлажденному до 5°С раствору 74,25 г (0,5 моль) хлорангидрида монометилового эфира малеиновой кислоты в 300 мл толуола добавляют при перемешивании 68,75 г (0,5 моль) метилового эфира |3-хлормолочной кислоты и 39,9 г (0,5 моль) ииридина в 100 мл толуола. Реакционную смесь выдерживают в течение 10 ч при комнатной температуре.
Отфильтровывают выпавшую хлористоводородную соль пиридина, промывают растворителем. Фильтрат обрабатывают по схеме, ириведенной в примере 1. Удаляют растворитель, остаток разгоняют в токе аргона и в присутствии ингибитора радикальной полимеризации. Выделяют 65,0 г (52%) метил-(а-метилмалеино,ксикарбонилокси)-р-хлорпропионата.
CICH CHCOOCH,
0-С10)СН СНСООСН,
Это вязкая жидкость, хорошо растворимая в органических растворителях и перегоняющаяся в вакууме без разложения; т. кип. 190°С (3-4 мм рт. ст.).
К 39,3 г (0,45 моль) Триэтиламина в 150 мл сухого бензола при 60°С прибавляют 65,5 г (0,26 моль) Via в 30 мл бензола. Синтез и
обработку проводят по методу, указанному в примере 1. Выделяют VI 30,0 г (55%) т. кип. 128-130°С (3 мм рт. ст.). Это сиропообразная жидкость, хорошо перегоняющаяся в вакууме.
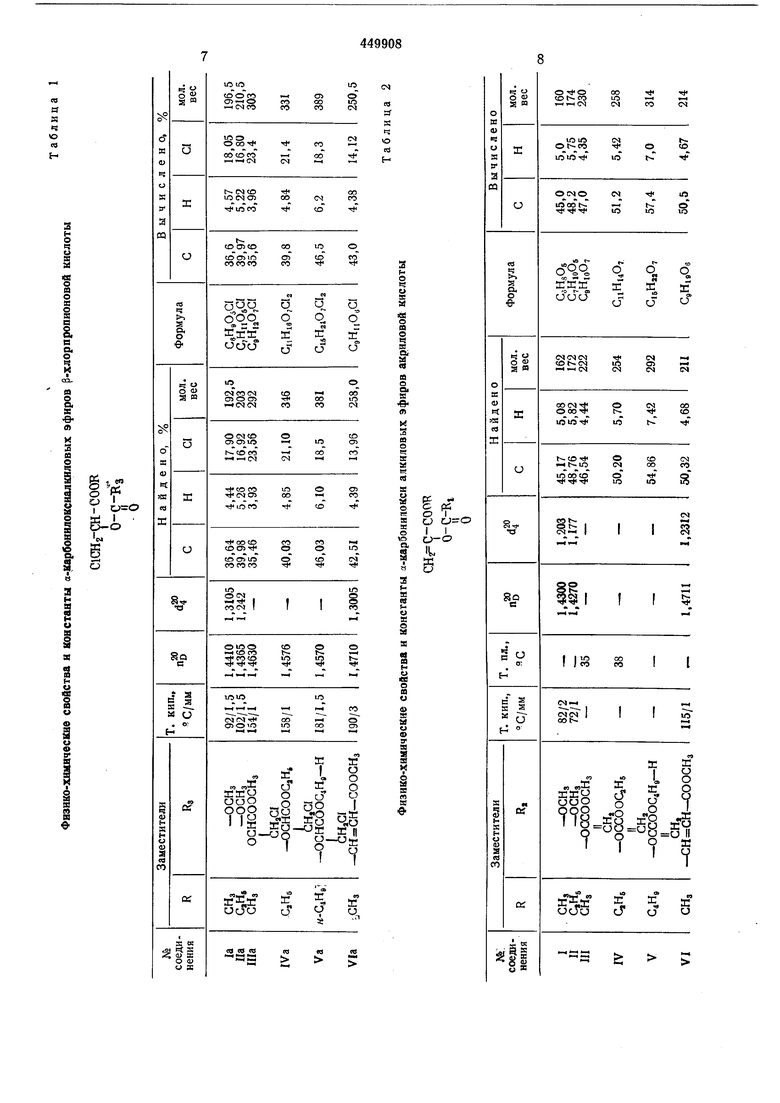
В табл. 1, 2 приведены физико-химические свойства и константы соединений 1а-Via и I-VI.
n я
Si
1
(О
to
н
Ef S Ч «Э се Е



| название | год | авторы | номер документа |
|---|---|---|---|
| Эфиры @ -оксиакриловой и фосфоновой кислот | 1974 |
|
SU493116A1 |
| СПОСОБ ПОЛУЧЕНИЯ а-АЦИЛОКСИ-, а-(АЛКОКСИКАРБОНИЛОКСИ)АРИЛАКРИЛАТОВ | 1972 |
|
SU432127A1 |
| Аллиловые эфиры замещенной -оксиакриловой кислоты для получения химически стойких, малохрупких, прозрачных высокомолекулярных соединений | 1975 |
|
SU570596A1 |
| Способ получения ацилоксиалкиловых эфиров кислот фосфора | 1974 |
|
SU506594A1 |
| Способ получения тригалогенгермилвинилалкиловых эфиров | 1981 |
|
SU1065417A1 |
| СПОСОБ ПОЛУЧЕНИЯ СИЛАЛАКТАМОВ | 1968 |
|
SU212261A1 |
| Способ получения ди-( -алкоксивиниловых) эфиров кислот пятивалентного фосфора | 1976 |
|
SU586176A1 |
| СПОСОБ ПОЛУЧЕНИЯ МЕТАКРИЛОИЛОКСИАЛКИЛДИАЛКИЛ (ДИАРИЛ)ФОСФИНОКСИДОВ | 1973 |
|
SU367113A1 |
| СПОСОБ ПОЛУЧЕНИЯ (р-/ФЕНТИАЗИНИЛ-10/-ИЗОПРОПИЛ) ДИАЛКИЛ(АРИЛ)ФОСФАТОВ | 1973 |
|
SU366199A1 |
| Способ получения замещенных 5-метилен-1,3-диоксолан-4-онов | 1970 |
|
SU606313A1 |

2 I и
9
Предмет изобретения
Способ получения а-карбонилоксиалкиловых производных эфиров акриловой кислоты общей формулы
CH C-COOR
.
О где ,-; С. Н-С,Н,; R,OR;
- О - С - COOR; - СН СН - С - OR
IIII
сн,о
отличающийся тем, что алкиловый эфир р-хлормолочной кислоты подвергают взаимодействию с хлор ангидридом общей формулы C1-C-R,
О
10 где R.,.,OR,
R, - О - СН - COOR; I СН,С1
R, R, - СН СН - с - OR
II О
,-; С,Н,; Н-С,Н,-,
в среде органического растворителя при О- 10°С в присутствии органического основания, например пиридина, с последующим дегидрохлорированием в среде органического растворителя в присутствии органического основания, например тризтиламина и ингибитора радикальной полимеризации при 20-100°С с последующим выделением целевого продукта известными приемами.
Авторы
Даты
1974-11-15—Публикация
1972-03-31—Подача