(54) СПОСОБ ПОЛУЧЕНИЯ АМИДОВ ЛИЗЕРШНОВОЙ КИСЛОТЫ
ИЛИ ИХ СОЛЕЙ


| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ДИГИДРОЛИЗЕРГИНОВОЙили дигидроизолизЕРгиновой кислоты | 1973 |
|
SU400091A1 |
| Способ получения амидов лизергиновой кислоты или их солей | 1976 |
|
SU604493A3 |
| Способ получения гетероциклических соединений | 1972 |
|
SU461500A3 |
| Способ получения алкалоидов спорыньи | 1970 |
|
SU542475A3 |
| Способ получения д-2-замещенных-6-метил-8-цианометил8-цианометилэрголинов или их солей | 1974 |
|
SU584780A3 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ АМИДОВа- | 1972 |
|
SU356843A1 |
| Способ получения 5-замещенных 10,11,-дигидро-5н-дибензо( @ , @ ) циклогептен-5,10-иминов | 1978 |
|
SU895288A3 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ D-ЛИЗЕРГИНОВОЙКИСЛОТЫ | 1969 |
|
SU252220A1 |
| Способ получения замещенных бензо ( ) хинолизин-2карбоновых кислот или их производных | 1972 |
|
SU521842A3 |
| Способ получения 8-бензофурилметил1,3,8-триазаспиро-/4,5/-деканов | 1972 |
|
SU442597A1 |

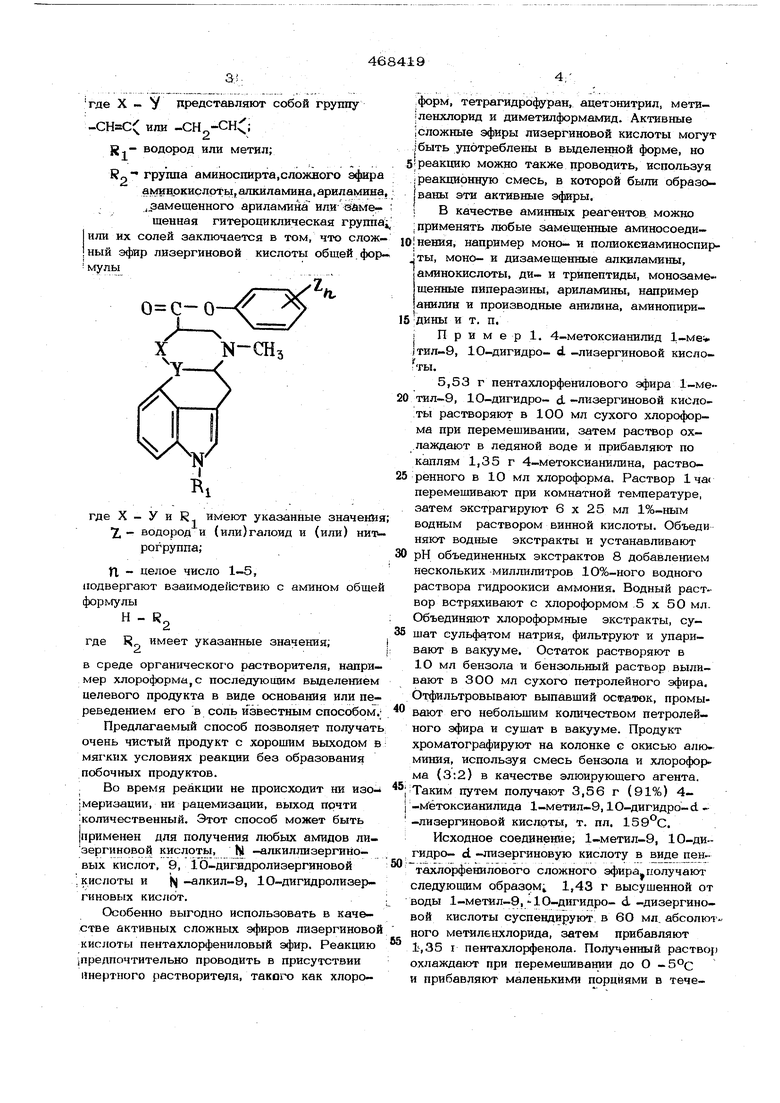
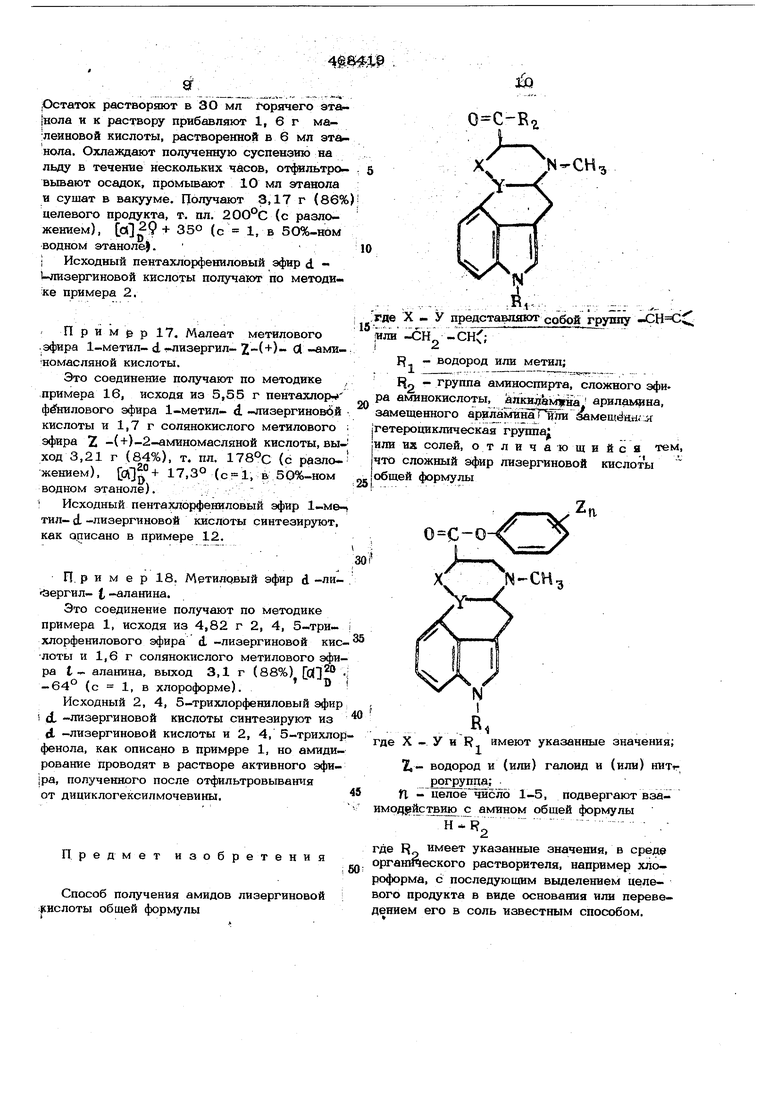
где X - V др)едставляют собой группу
iX;
( или -СН водород или метил;
группа аминоспирта.сложного эфира аминокислоты, алкилаклина, ариламина,: .замещенного ариламина или эаме- ; щенная гитероциклическая rpyrmai или их солей заключается в том, что сложный эфир лизергиновой кислоты общей фор-, мулы
где X - У и R имеют указанные значения; Т.- водород и (или)галоид и (или) нитрогруппа;
Л, - целое число 1-5,
подвергают взаимодействию с амином общей формулы
Н - R
где R имеет указанные значения;
i
в среде органического растворителя, например хлороформа, с последующим выделением целевого продукта в виде основания или переведением его в соль известным способом;
Предлагаемый способ позволяет получать очень чистый продукт с хорошим выходом в i мягких условиях реакции без образования побочных продуктов.
Во время реакции не происходит ни изо- ;меризации, ни рацемизации, выход почти
количественный. Этот способ может быть
1
|арименен для получения любых амидов лизергиновой. кислоты, N -алкиллизергино- вых кислот, 9, 1 б-дигидролизергиновой .кислоты и -алкил-9, 10-дигидролизергиновых кислот..
Особенно выгодно использовать в качестве активных сложных эфиров лизергиновой кислоты пентахлорфениловый эфир. Реакцию |предпочтительно проводить в присутствии Инертного растворителя, такого как хлоро:форм, тетрагидрофуран, ацетонитрил, мети|ленхлорид и диметилформамнд. Активные i с ложные эфиры лизергиновой кислоты могут I быть употреблены в выделенной форме, но 5; реакцию можно также проводить, используя i реакционную смесь, в которой были образованы эти активные эфиры, i В качестве аминных реагентов можно : применять любые замещенные аминосоеди-
10нения, например моно- и полиокеиаминоспир ты, моно- и дизамещенные алкиламины, аминокислоты, ди- и трйпептиды, монозаме щенные пиперазины, ариламины, например анилин и производные анилина, аминопири15 дины и т. п.
Пример. 4-метоксианилид 1-ме |тил-9, 10-дигидро- d. -лизергиновой кисло5,53 г пентахлорфенилового эфира I-Me20 тил-9, 10-дигидро- d-лизергиновой кислоты растворяют в 100 мл сухого хлороформа при перемешивании, затем раствор охлаждают в ледяной воде и прибавляют по каплям 1,35 г 4-метоксианилина, раство-
25 ранного в 10 мл хлороформа. Раствор 1 ча перемешивают при комнатной температуре, затем экстрагируют 6 х 25 мл 1%-ным водным раствором винной кислоты. Объеди няют водные экстракты и устанавливают
30 рН объединенных экстрактов 8 добавлением нескольких миллилитров 10%-ного водного раствора гидроокиси аммония. Водный раствор встряхивают с хлороформом 5x50 мл. Объединяют хлороформные экстракты, сушат сульфатом натрия, фильтруют и упаривают в вакууме. Остаток растворяют в 1О мл бензола и бензольный раствор выливают в ЗОО мл сухого петролейного эфира. Отфильтровывают выпавший осшафок, промывают его небольшим количеством петролейного эфира и сушат в вакууме. Продукт хроматографируют на колонке с окисью алю. миния, используя смесь бензола и хлорофор ма (3:2) в качестве элюирующего агента.
рТаким путем получают 3,56 г (91%) 4I -мётоксианилида 1-метил-9,1О-дигидро-с1 -лизергиновой кислрты, т. пл, 159 С.
Исходное соединение; 1-метил-9, 10-дигидро- d -лизергановую кислоту в виде пентахлорфенилового сложного эфира,получают следующим образом; 1,43 г высушенной от воды 1-метил-9,-1О-дигидро-d-дизергиновой кислоты суспендируют в 6О мл. абсолюного металенхлорида, затем прибавляют 1,35 I пентахлорфенола. Полученный раство охлаждают при перемешивании до О -50с и прибавляют маленькими порциями в тече5- ; , .; 6 ние 2 час 1,25 г дидаклогексалкарбодтшми- нилового эфира 9, 1О-дигидро d лизергида. Раствор постепенно нагревают до 20°С новой кислоты и 2,0 г 2-амино-5-бромпичи перемешивают еще 2 час. Отфильтровы-ридина, 3,4 г (80%), т. пл. 132°С. вают кристаллы дициклогексилмочевины и ,Исходный 2, 4, 5-трихлорфениловый промывают 10 мл тетрагидрофурана. Объеди- 9, 10-дигидро-d -лизергнновой кисняют фильтрат и промьтную жидкость и вы- лоты синтезируют из 9, 1О-дигидро- Ы паривают досуха при пониженном давлении. ; -лизергиновой кислоты и трихлорфено а по Сухой остаток растворяют в горячем состою: методике примера 1. ЯНИН в 5 мл бензола и полученный растворП р и м е р 6. 1 етил-9, Ю-дигидвыливают при перемешивании в 50 глппет- юро- d--лизергилгяицилтирозинол, ролейного эфира. Получетшую суспензию Это соединение получают по методике обрабатывают на льду в течение 24 час;,примера 1, исходя из 5,53 г пентахлорфепосле чего продукт фильтруют, промьшаютнилового эфира ,;1-к:егал-9, Ю-дигидро2О мл холодного петролвйногр эфира и сут-; d -лизергиновой KHcnoTW и 2,8 г глицилшат в вакууме, выход 2,О г (75%),.t 15.тирозннола, выход 4,Э г (89%), т. пл. 152°С. 2О° (с 0,5, этанол). :Исходнь1й пентахлорфениловый эфир 1 „ X .. 4-метил. 9, 10-дигидро-cL -лизергиновой П р и м е р 2. 4-Метоксианилид d. -. « «к и. , кис лоты синтезируют по методике примера, -лизергиновой кислоты..,„ , h- Пример 7, 3-Трифторметиланилид Это соединение получают по методике , -г t- « , .i 20 9, lO-дигидро- А -лизергиновой кислоты, примера 1, исходя из 5,37 г пентахлорфе-. м «j- и-t, ., „Это соединение получают по Методике нилового эфира d -лизергиновой кислоты.1 1 0 0/примера 1, исходя из 5,39 г пентахлорфеи 1,5 г р -метокснанилина, выход 84%- „ -, л Го 1x1 т,„ 10-70,-нилового эфира 9, 10-дигидро- d-лизерги 3jX T Г/ Т пл J. / ч,огч ,,„,о V Iновой кислоты и 2, о г 3-трифторметиланиИсходный пентахлорфениловыи эфир d -.. /-TOO/ -I«/ O / ; , 25 лина, выход 3,1 г (72%), т. пл. 13О°С. -лизергиновой кчслоты синтезируют из4-,.„.-j. , „1Исходный пентахлорфениловыи эфир 9. -лизергиновой кислрты и пентахлорфенола , i по методике, опиской в примере 1, вькод Ю-дигидро- d -лизергиновой кислоты син62%.Га} + 31 . (с 0.5. этанол).. - зируют, как описано в примере 1. П р е р 3. 4-Метоксианилид 9,Ю- i „ 3-Трифторметиланилид -дигидро-а. -лизергиновой кислоты. . 10-дигидро- d -лизергиновой KWf JTfTPF Эго соединение получают по методике . ,с or,J. Это соединение получают, как описано примера 1. исходя из 5,39 г пентахлорфе- Аг, „ .,В примере 1. исходя из 4.О5 г 4-нитронилового эфира 9. 10-дигидро- d -лизерги- ,.,./ -.г-фенилового эфира 1-метил-9, 10-дигндроновой кислоты и 1,5 г л-метоксианилина, j м мн 0-1 00 со/ ioxiO 35 - Л лизергиновой кислоты и 2,0 г 3-трив количестве 3.1 г (82,5%), т. пл. 164 С. ., о /c. ..„,. л. п 1 п фторметиланилина, выход 2,9 г (68%). Исходный пентахлорфениловыи эфир 9,1О-;д -дигидро- d -лизергиновой кислоты получа- , „ . , v . „Исходный 4-нитрофениловыи эфир 1-меют из 9, 10-дигидро- d-лизергиновой кис-гч i , 5 ,тил-9,10-дигидро-d -лизергиновой кислолоты и пентахлорфенола по методике, опи-. . v, ... , ,. n/ L оО40 ты получают из 1-метил-9,10-дигидро-d санной в примере 1. выход 69,5%.LC(J +3 „ . / г- .тизергиновои кислоты и 4-нитрофенола по (с О,5. этанол).„ , т-г . о / и V c методике, описанной в примере 1. но амиП р и м е р 4. 6-(4-Хлор-5-нитропи-« , t- , , „дирование проводят в растворе активного римидино) амид а -лизергиновой кислоты.-. эфира, полученного после отфильтровывания Это соединение синтезируют, как описано. 45 дициклогексилмочевины. в примере 1, исходя из 5,37 г пентахлор- , фенилового эфира d -лизергиновой кислотыП р и м е р 9. Алпиламидмалеат-d и 2,0 г 4-хлор-5-нитро-6-аминошфИмидина ..-яизергино вой. кислоты.... „. .„ гГ/4.п, Свободное основание получают по методив количестве 3,2 г (74%), т. пл 240Ос.: г пента. Исходный пентахлорфениловыи эфир-d- во;хЛорфенилового эфира d -лизергиновой кис. -лизергиновой кислоты получают, как | и 1. О г { -аллиламина. Свободное описано в примере 2.i- - - ,,с .-. / - основание, синтезированное после хромато11 р и м е р о, 2-I Ь-Бромпиридино)-,щ; - „ Р J Р м пи/графин, растворяют в 20 мл горячего этаамид 9, 1О-дигидро-d -лизергиновой кис-, г- -г г-г . нола и к раствору прибавляют раствор 1,2г . СЕ„г. ..,00 малеиновой кислоты в 5 мл этанола. От- Соеаине,ше получают по методике приме- . ф„„ьтровывают выпавшую в осадок кристалра 1, иг:ходя из 4,7 г 2, 4, 5.трихлорфе-|„„ ескую соль и промывают небольшим ко. 4684IS
7личеством холодного этанола, потом сушат. Получают 3,6 г (84%) целевого продукта, т. пп. 179°С. Исходный пентахлорфениловый эфир d ,.лизергиновой кислоты получают по методи- ке примера «Пример 1О. Аллиламид 1-метил-9, 10-дигидро- 4- -лизергиновой кислоты. Это соединение синтезируют по методике примера 1, исходя из 5,53 г пентахлор фенилового эфира 1-метил-9, 10 дигидро- - d -лнзергиновой кислоты и 1,О г t -аллиламина. Получают 3, 1 г (96%) пелевого продукта, т, пл. 189 С. Исходное соединение пентахлорфенило- вый эфир 1-метил-9,1О-дигидро d-лизергиновой кислоты получают по методике примера 1. П р и м е р 11. 2-(1-Оксибутил) амид малеат d -лизергиновой кислоты. Это соединение получают по методике примера 9, исходя из 5,37 г пентахлорфенилового эфира d -лизергиновой кислоты и 1, 1 г (+)- -окси-Яминобутана, выход 3,85 г (84,5%), т. пл. 2ОО°С, + 47,0° (с 1,0, вода).° Исходный пентахлорфениловый эфир А -лизергиновой кислоты синтезируют по методике примера 2. При мер 12. 2-( 1-Оксибутил) амид малеат 1-метил- d -лизергиновой кислоты. Это соединение получают по методике 9, исходя из 5,51 г пентахлорфенилоБого эфира 1-метил- d -лизергиновой кислоты и 1,1 г (+)-1-окси-2-аминобутана, выход 4,12 г (83%), т. пл. 183°С, ;№)+ 42,0°(с 0,4. вода). Исходный пентахлорфениловый эфир 1-ме тил- it -лизергиновой кислоты, синтезируют из 1-метил- d -лизергиновой кислоты и пентахлорфенола по методике примера 1. Пример 13. 4-( j3 -Оксипропил)пиперазидмалеат 9, 1О-дигидро- 4- -пизер;гиновой кислоты. Это соединение получают по методике примера 9, исходя из 5,;39 г пентахлорфенилового эфира 9, 1О-дигндро- d -лизергиновой кислоты и 1,75 г ( J8 -оксипропил пиперазина, выход 4,9 г (93%), т. пл. 207 M|° -4 9°(с 0,5, водный этанол). Исходный пентахлорфениловый эфир 9, 1О
Q -дйгидро- d -лизергиновой кислоты синтезируют, как описано в примере 3. . П р и. 14..Метиловый эфир 1-метил-.б,: 1р-диг«дар ; зергт1л- СО -нитро--2-арРИНИНй|.- ,:;. . Растворяют;5,53 г пентахлорфенилового эфира 1-метил-9, 1О-дигидро- d -лизергиновой кислоты в смеси 5 О мл хлороформа и 50 мл тетрагидрофурана при перемешивании и к холодному раствору прибавляют 3,5 г солянокислого метилового эфира- Z - со -нитро- 2. -аргинина, растворенного в смеси .-хлороф9рма 9 мл триэтиламина. Реакционную смесь пе|)емешивают при комнатной температуре 2 час, затем экстрагируют (5 X 30 мл) 1%-ным водным раствором винной кислоты, далее поступают, как в примере 1. Получают 4,2 г (86,5%) целевого продукта, т. пл. 220 С. Исходный пентахлорфениловый эфир 1-метил-9, 10-дигидрсЦлизергиновой кислоты получают по методТ ке примера 1. При мер 15, Диметиламид d -лизергиновой кислоты. Это соединение получают по методике примера 1, исходя из 2,7 г пентахлорфенилового эфира 4 -лизергиновой кислоты и 0,5 г диметиламина, выход 1,3 г (88%), о Lcajjj + ЗО (в пиридине). Исходный пентахлорфениловый эфирй -лизергиновой кислоты синтезируют по методике примера 2. П р и м е р 16. Малеат метилового эфира d -лизергил- Х-(+)-С1- миномасляной кислоты. 1,7 г солянокислого метилового эфира (+)-2-аминомасляной кислоты (т. пл. |94-960с, 21°, с 5, в 20%-ной соляной кислоте) суспендируют в 15О мл хлороформа и охлаждают суспензию до 1О С. К перемешиваемой суспензии прикапывают ,4 мл триэтиламина, после чего к полученному раствору прибавляют 5,37 г пентахлорфенилового эфира d -лизергиновой кислоты, реакционную смесь перемешивают еше 30 мин. Реакционную массу разбавляют ЗОО мл хлороформа и экстрагируют (2 х 50 мл) 1% нь1М водным раствором винной кислоты. Устанавливают рН объединенных водных экстрактов, равным 7-7,5, используя 10%ную водную гидроокись аммония, и этот водный раствор экстрагируют хлороформом (4 X 50 мл). Объединяют органические фазы, сушат безводным сульфатом магнмя, фильтруют и упаривают досуха в вакууме.
Авторы
Даты
1975-04-25—Публикация
1973-02-02—Подача