(54) СПОСОБ ПОЛУЧЕНИЯ 4- ИЛИ 5-НИТРОИМИДАЗОЛОВ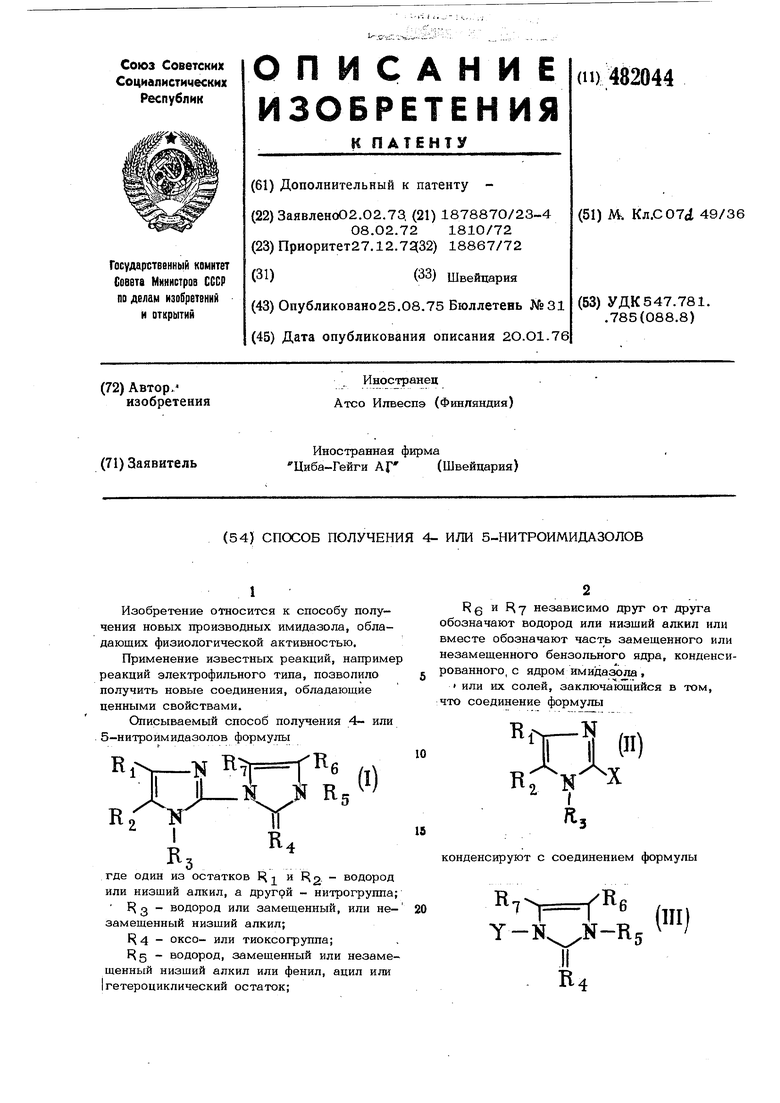



Изобретение относится к способу получения новых производных имидазола, обладающих физиологической активностью. Применение известных реакций, наприм реакций электрофильного типа, позволило получить новые соединения, обладающие ценными свойствами. Описываемый способ получения 4- или 5-нитроимидааолов формулы 1 Кб .iii Rg Нб 7 независимо друг от друга обозначают водород или низший алкил или вместе обозначают часть замещенного или незамещенного бензольного ядра, конденсированного, с ядром имидазола, или их солей, заключающийся в том, что соединение формулы в; л. конденсируют с соединением формулы
или таутомерным соединением формулы
/R
п. )
К
где R-j - Ну имеют указанные значения;
-атом кислорода или атом серы; . X и У - отщепляемые остатки,
с выделением целевого продукта в свободном виде, Б форме соли или оснований, разделением смеси рацематов на индивидуальные рацематы и/или с расщеплением полученных рацематов на оптические антиподы известным способрм.
Один из остатков X и У, прежде всего У, может быть атомом металла (щелочного или щелочноземельного) или водорода;
X - этерифицированная в простой эфир оксигруппа, свободная или этерифицированная в простой эфир меркаптогруппа, группа аммония или реакционноспособная этерифицированная в сложный эфир окси- или сульфонилгруппа.
Реакционноспособной этерифицированной в простой эфир оксигруппой является, например, этерифицированная в простой эфир с помощью ароматического или алифатического, прежде всего низщего алифатического спирта, оксигруппа, например замещенная в соответствующем случае фе- нокси- или алкоксигруппа, прежде всего низщая алкоксигруппа, в частности метокси или этокси.
Этерифицированной в простой эфир меркаптогруппой является, например, замещенная в соответствующем случае фенилмеркапто- или бензилмеркаптогруппа, или, в частности, низщая алкилмеркаптогруппа, например этил- или метилмеркаптогруппа.
Аммониевая группа, в частности четвертичная аммониевая группа, прежде всего три-низщий алкиламмониевая группа, например триметил- или триэтиламмоние- вая группа или катион ароматического основания азота, например пиридиниевая или хинолиниевая группа.
Реакционноспособную этерифицированную в сложный эфир оксигруппу, например этерифицированную в сложный эфир оксигрупПу получают; в частности, применяя сильную .органическую или неорганическую кислоту, прежде всего галогенводородную кислоту, например хлористоводородную, . бромистоводородную или йодистоводородную кислоту, или органическую сульфоновую кислоту, в частности, ароматическую сульфоновую кислоту, например бензол- сульфоновую кислоту, fif -бромбензолили П -толуолсульфоновую кислоту, или алкан-, прежде всего низщий алкансульфоновую кислоту, например метансульфоновую, этансульфоновую или опефинную сульфоновую кислоту, например этенсульфоновую кислоту.
Сульфонилгруппа является, в частности, производной органической сульфоновой кислоты, в частности ароматической сульфоновой кислоты, например бензолсульфоновой, tl -бромбензолсульфоновой или ft-толуолсульфоновой кислоты, алкан-, прежде всего низщий алкан-сульфоновой кислоты, например метанеульфоновой или этансульфоновой или олефинной сульфоновой кислоты, например этенсульфоновой кислоты.
Взаимодействие может осуществлятьсяизвестным образом. Например, при взаимодействии соединения формулы И , где
Х - заменяемый остаток, например один из указанных заменяемых остат5.ов, с соединением формулы III или lUa, где У - водород, предпочтительно работают в присутствии щелочного конденсирующего средства или соединение формулы III или
подвергают взаимодействию в виде соли, например соли металла, например соли щелочного или щелочноземельного металла, получаемой, например, из соединения i формулы ill или Ш а и сильного основания, например амида, соединения углеводорода,
лкоголята, гидроокиси или, в частности, гидрида металла, например щелочного металла, например лития, калия или прежде всего натрия, или щелочноземельного металла, например магния или кальция, и применяемой без выделения.
Основными конденсирующими средствами являются, например, щелочные или щелочноземельные гидроокиси, например гидроокись натрия, калия и кальция или органические третичные основания азота, например триалкиламины такие, как триэтилмли триметиламин, или ароматические основания азота, например пиридин или хинолин. Можнр принять и избыток соединения формулы 111 или lija, вчастности, если 5 не водород. Предпочтительно работают при повыщенной температуре и/или в присутствии инертного растворителя, в частности
нертного полярного растворителя, например ацетонитрила, диметилсульфоксида, тетраметилмочевины, высоко кипящего эфира, например диоксана, дифенилового эфира, ди60 ,z:
изопропилового эфира, эфира этипенгликоля или тетрагидрофурана, воды, высшего спирта, одного из названных оснований азота или,; в частности, диметилформамида
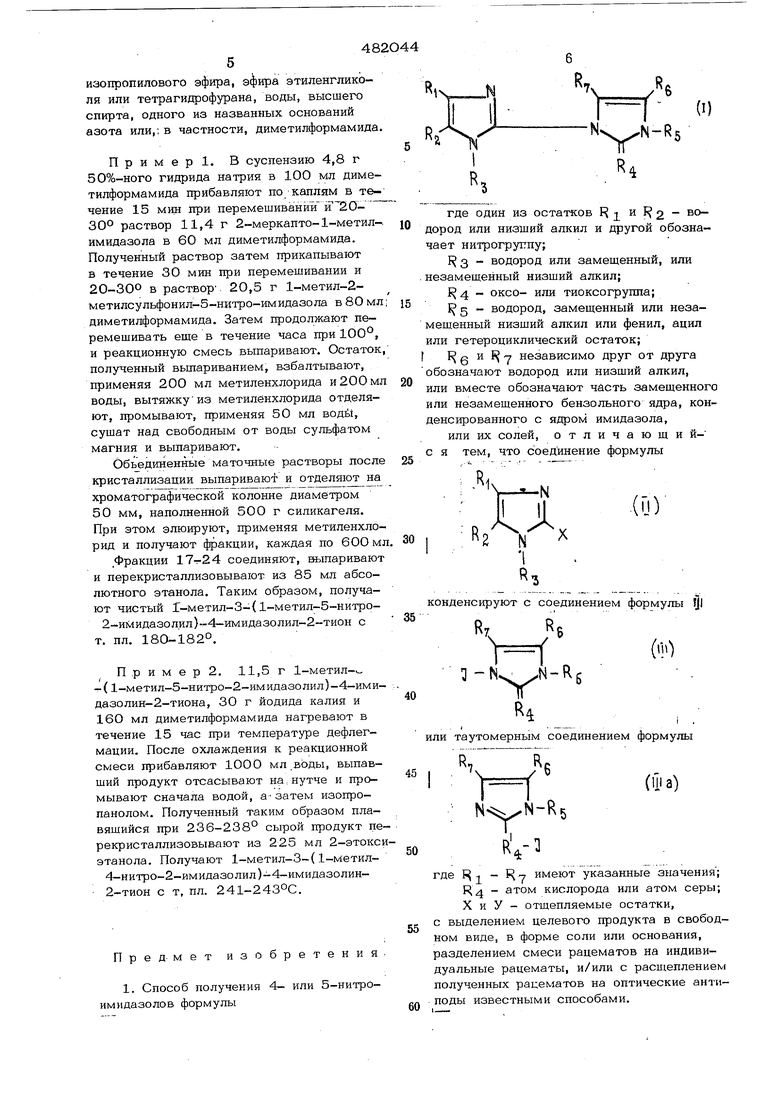
Пример. В суспензию 4,8 г 50%-ного гидрида натрия в 100 мл диметилформамида прибавляют по каплям в течение 15 мин при перемешивании й 2030° раствор 11,4 г 2-меркапто-1-метилимидазола в 60 мл диметилформамида. Полученный раствор затем прикапывают в течение 30 мин при перемешивании и 20-300 в раствор 20,5 г 1-метил-2метилсульфонил-5-нитро-имидазола в 80 мл диметилформамида. Затем продолжают перемешивать еще в течение часа при 100°, и реакционную смесь выпаривают. Остаток полученный вьшариванием, взбалтывают, применяя 200 мл метиленхлорида и 200 мл воды, вытяжкуиз метилбнхлорида отделяют, промывают, применяя 50 мл води, сушат над свободным от воды сульфатом магния и выпаривают.
Объединенные маточные растворы после кристаллизации выпаривают и отделяют на хроматографической колонне диаметром 50 мм, наполненной 500 г силикагеля. При этом элюируют, применяя метиленхлорид и получают фракции, каждая по бООм
.Фракции 17-г24 соединяют, выпаривают и перекристаллизовывают из 85 мл абсолютного этанола. Таким образом, получают чистый Г-метил-3-{ 1-метил-5-нитро2-имидазолил)-4-имидазолил-2-тион с т. пл. 180-182°.
П р и м е р 2. 11,5 г 1-метил-.-( 1-метил-5-нитро-2-имидазолил)-4-имидазолин-2-тиона, 30 г йодида калия и 160 мл диметилформамида нагревают в течение 15 час при температуре дефлегмации. После охлаждения к реакционной смеси прибавляют 1000 мл воды, выпавший продукт отсасывают на.нутче и промывают сначала водой, а-затем изопропанолом. Полученный таким образом плавяшийся при 236-238° сырой продукт церекристаллизовывают из 225 мл 2-этоксиэтанола. Получают 1-метил-3-( 1-метил4-нитро-2-имидазолил)-4-имидазолин-
2-тион с т, пл. 241-243°С.
Предмет изобретения
4- или 5-нитро1. Способ получения имидазолов формулы
(I)
где один из остатков Я 2 ° дород или низший алкил и другой обозначает нитрогруипу;
1 3 водород или замещенный, или . незамещенный низший алкил;
{ 4 оксо- или тиоксогрушта;
5 водород, замещенный или незамещенный низший алкил или фенил, ацил или гетероциклический остаток; f 1 g и F - независимо друг от друга обозначают водород или низший алкил, или вместе обозначают часть замещенного или незамещенного бензольного ядра, конденсированного с ядром имидазола,
или их солей, отличающийс я тем, что соединение формулы
(П)
конденсируют с соединением формулы fjl
35 RTRC
Y
OiO
3-Ns..N-Rs
40 , -ИЛИ таутомерным соединением формулы
R.
R
6
V/
(IN a)
RV
50
Ц, - Цу имеют указанные значения;
где
К4 атом кислорода или атом серы;
X и У - отщепляемые остатки, с выделением целевого продукта в свободном виде, в форме соли или основания, разделением смеси рацематов на индивидуальные рацематы, и/или с расщеплением полученных рацематов на оптические антиподы известными способами.
Приоритет по признакам
от 08.02.72
один из остатков Ц и R 2 водород или низший алкил, а другой - нитрогруппа;
Яз - водород или замешенный, или незамещенный низший алкил;
R и - оксо- или тиоксогруппа;
J 5 - водород, замещенный или незамещенный низший алкил или фенил, ацил или гетероарил;
1 g и Ff 7 независимо друг от друга обозначают водород или низший алкил или вместе обозначают часть замещенного или незамещенного бензольного ядра, конденсированного с ядром имидазола;
Ц 4 атом кислорода или атом серы;
X и У - отщепляемые остатки;
от 27. 12. 72
- гетероциклические остатки, кроме гетероарила.
Авторы
Даты
1975-08-25—Публикация
1973-02-02—Подача