(54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ЦЕФАЛОСПОРИНА
ИЛИ ИХ СОЛЕЙ -ОлЛв,. , : в,, . и о где R - заместитель, выбранный из групп, включающих атом водорода, алкил с содержанием 1-2 атомов углерода, грифгорметил, группу амина, меркаптогруппу, группу гидроксила, метилтиогруп пу, группу формулы - (СН )fi- Р 9 где 11 равно 1 или 2; Р - группа гидроксила, карбоксил карбамоила, морфолино-, морфолинокарбон м.егилтио-, метилсульфонила, диметиламино-, аиметиламинокарбонила, или метоксикарбонила, группа формулы -5-(СИ2)„-Р равно 1 или 2; группа гидроксила, карбоксила сулйо- карбамоила, морфолинокарбонила ацетила, ацетоксила, бензоилоксила, диметиламинокарбонила, .или эгоксикарбонил либо группа формулы NH-P , где Р мегил, метоксикарбонил, ди мегиламиноацетил, оксиэтил, димегиламйноэгил или сульфоэгил; агом водорода или метила, или их соли, способом, заключающим ся в том, что с.оединение общей форму-, .I -- СНаСОШТ где каждый из символов имеет те же значения, или его соли подвергают взаимодейс вию с саедипением общей формулы Ш где R нмеег те же значения, или с солью этого соединения, в сре де растворителя, такого как вода, фосфатный буфер с рН 6,0-7,5, или смеси растворителей с органическим раствори елем, смешивающимся с водой, в присутствии слабого основания при темпера туре С с выделением целевого продукта в свободном виде или в виде соли. Соединения, имеющие формулу П, могут быть использованы в свободном виде или в виде солн основания, примерам чего могуг быть соян с такими щелочными металлами, как натрий, калий и другие, или такими органическими аминами, ак тримегиламин, триэтиламин и другие. Используемое при этом азотсодержащее гетеропиклическое тиоловое соединение формулы Ш подвергают реакции в его свободном виде или в виде соли при взаимодействии тиола этого соединения с такими щелочными металлами, как литий, натрий, калий или сходные с ними металлы. Реакцию обычно осуществляют путем нагрева до 50-65 С почти при полной нейтрализации. Реакцию проводят в растворителе, предпочтительно в воде или в таких водных растворах, как смеси воды с высокополярными растворителями, ко- торью не будут препятствовать реакции, например с ацетоном, тетрагидрофураном, диметилформамидом, метанолом, этанолом, димегилсульфоксидом и прочими аналогичными соединениями. При использовании соединений формулы 1 в его свободном виде желательно применять в реакционной системе такие основания, как двууглекислый натрий, двууглекислый калий, карбонат натрия, карбонаг калия или аналогичные им соединения для нейтрализации показателя рН. При необходимости может быть также использован буферный раствор. Время протекания и Другие условия реакции должны быть определены со ссылками на такие факторы, как типы исходных материалов и типы растворителя, температуры и пр. Полученные таким образом производные цефалоспорина, имеющие формулу I, могут быть выделены и очищены при помощи известных способов, -экстракции растворителем, регулированием рН, перегонкой, кристаллизацией, перекристаллизацией, хроматографией, дезотерификацией, фазовым переходом. В случаях, когда К обозначает водород, соединения формулы I могут принимать два таутомерных видоизменения CHjSFj в которых все испольэоваинь)е символы имеют укааапное выи)е значение. Фактические физические данные этих соединений покааь вают, ч го в тех случаях, когда X обозначает кислород, соединения формулы I существуют исключительно в виде тиазолиногруппы, а в случаях, когда X обозначает иминогрупп они существуют в равновесном состоянии ,между этими двумя формами в том случае, если это равновесное состояние более характерно для формулы А при добав лении показанной ниже межмолекулярной связи: % (j-3w Г-Н- сн, т Номенклатура соединений формулы I по изобретению расщиряется в тех случаях, когда Т обозначает водород или метильную или этильную группу. Х - кислород эа счет тиазолиновой формы (формула А) и когда Н -водород и X - ими« иогруппа за счет тиазоловой формы (фор мула в). Все таутомерные изомеры входят в объем изобретения. Изобрегемие иллюстрируется следующими примерами. Смолы с фирмеь:ным наименованием Эмберлит представляют собой продукты, изготовленные фирмой Ром энд Хэн (CUJA), Все приведенные температуры не откорректированы. Структура полученных соединений подтверждена спектрами Т1МР Спектры сняты на спектрометре модели Вариан НА-100 (iOO мга) или модел Вариан (60 мгц). В качестве Бнутренпего или наружного эталона используют тетраметнлсилан. Пример (контрольный). Получение 7 -J2-(2- оксотиазол-4-.ацетамидоЯ-3-ацетоксиметил-3 цефем-4-карбоновойкислоты. I . Приготовление 7-(4-хлоро-3--оксо бутнриламидо)-3-ацетокс1гметйл-3-цефем 4--карбоновой кислоты. Раствор из 4з4 дикетена и Ю мл хлористого метилена предварительно охлаждают до -35°С и добавляют в него 3,92 г хлора. Полученный раствор перемешивают 15 мин. Одновременно в 10 мл хлористохЧ) метилена растворяют 10,9 г 7-аминоцефал оспореновой кислоты и 8Д г триэтиламина и охлаждают раствор до -30 С, К этому раствору добавляют первь й раст вор, nepGNiei.uHBaii я охлаждая его таким обрязо., чтобы температура новой смеси не превышала . Затем в течение 1 ч температуру смеси посгепйнно повышают до , после чего дистиллируют при пониже HiiOM давлении. К остатку добавляют 100 мл этилового эфира уксус пэй кислоты я полученную смесь перемешивают взбалтыванием с 100 мл 10 %-ного водного раствора фосфорной кислоты. Затем берут водный слой, пасыщенный хлористым натрием, и производят его трехкратную экстракцию этиловым эфиром уксусной кислоты. Слой этилового эдзира уксусной кислоты отстаивают/промывают и осы1яепным водным раствором хлористого натрия, обезвоживают и упаривают прк пониженном давлении до объема 20 ктл. Получеп 1Ый концентрат выдерживают на холоде я выделяют кристаллы С I } фильтрааией. Выход 6.3 г Температура плавления 135-140 С (разложение). ИК-спектр: КВг 1790, -1750 , 1655 см . Вычислено, %; С 43,O3j Н 3,87j N 7Д7, С,Н,5 CEN/J-5 Найдено, %: С 43,01; Н 3,89; N7,18. П. В 10 мл оцо тонн три ла растворяют (1 моль) Oj39 г 7-(4-хгюр-3-оксобутир ламндо)-3-ацегоксимет1 л-3-цефем 4-карбоноБой кислоты и 0,145 г (155моль) тцоцианата кал15я. Полученный при этом раствор перемешивают при конпштнойтемпературе в гечеияе 16 ч. Затем производят дистилляцию полученной смеси при пониженном давлении и к остатку добавляют 50 ;у;л насыщенного водного раствора хлористого натрий, рН полученной при этом CMGCH доводят до 3 прк немощи Б0%-ного раствора фосфорной кислоты, после чего производят экстракцию смеси эфиром (2x100 мл). Комбинированный экстракт промывают насыщенным, водным pacTBOposvf хлористого натрия и высушивают, повышают его концентрацию до полного высушивания. Полученный остаток перемешивают с эфиром и смесь-выдерживают. Полученный при этом осадок 7-С4тиоциано-3-оксобутириламидо)-3- азотсодержащий гетероциклический гиомегил)-3-цефем-4 карбоновой кислоты огфильтровывают. ИК-спекгр| КВг 23SO (CV) 1785, 1730 Вычислено , х O.S (CgH О, %: С 43,a.i| Н 3/75; N6,13. Найдено. %: С 42,98j Н 3,74;М 9,44,, , IJ, В 5 мл фосфатногр буферного раство ра с показателем рН 6,4 растворяют , Oj413 г 7-(4 гйациано-3-Оксобуг«рил амидо)-3-ацетоксимегил--3-цефем-4-кар боковой киспоты и 0,084 г AByyrneKvtcлого натрия. Полученный раствор выдep : ; ваюг при комнатной температуре в течение 48 4s 50%-ным водным раствором доводят рН до 3,0, затем насыщают это раствор хлористым натрием и производят экстракцию этиловым эфиром уксусной кислоты (3x10 мл). Этиловый эфир уксусной кислоты смывают водным раствором хлористого натрия, затем первый см шанный раствор обезвоживают и повышают его концентрацию. После добавления эфира концентрат выдерживают, послв этого из него выделяются кристаллы, Кристаллы восстанавливают при помощи фильтрации всасыванием. Выход 0,18 г| т. пл, 180°С, И1 спекгр: КВг 1775, 1715, 1665 см , ( 2 в 1%-иом водУФ-спекгр А НаНСО ) 248 ном растворе 1Д4 X . Вычислено для С }1 Z С 43,58| Н 3,66; N 1ОД6. . Найдено, %: С 43,37, Н 3,48; N9/77 П р и м е р 2 (контрольный). Получение 7 ( 2-амш10тиа8Ол 4- Илацетамидо) 3 ацетоксиметил-3-цефем-4-кар боновой кислоты. I , Получение 7-(4-бром 3™оксобутириламидо)3-ацетоксимвтил-3-цефем-4-карбоновой кислоты, Раствор 3,4 г цикегона-в 10 мл хлористого метилена предварительно охлаждают до 30 С и к нему по капле добав ляют раствор 6,4 г брома в 10 мл хлористого метилена. Одновременно вдор м хлористого мегилена растворяют 10,9 г Т-аминоцефалоспореновой кислоты и 6,1 триэтйламина. Полученный раствор охлаждают до 30 С. К этому раствору добавляют раствор первой ск№си, перемешивая и охлаждая его таким образом, чтобы температура новой смеси не превышала -ЗО Затем в течение 1 ч температура ностепенно повышается до комнатной, после чего производят дистилляцию полученного раствора при пониженном давлении; К ос татку добавляют i.OO мл этилового эфира уксусной кислоты и 100 мл 63 ВОДНОГО раствора фосфорной кислоты, полу- ченную смесь энергично взбалтывают. берут насыщенный хлористым натрием водный слой и производят его двойную экстракцию этиловым э4)иром уксусной кислоты. Слои этилового эфира уксусной кислоты отстаивают, промывают нас1лаенным водным раствором хлористого натрия, обезвоживают, обрабатывают активированным углем и повышают их концентрацию стойкой при пониженном давлении. К остатку добавляют эфир и полученную смесь некоторое время выдерживают. Образуемые при этом кристаллы отфильтровывают. В состав полученного соединения входит 1/4 моль этилового эфира уксусной кислоты, являющегося растворителем кристаллизации. Выход 8 г. ИК-спектр: КВи 1780, 1735, 1650 см Вычислено для С, Н. Bh NgO S « 1/4 N бД8, %1С, Н, 3,75; С4Н О, Найдено % С 39,20; П 3,63j N 6,00. Я . Получение натриевой соли (2 аминотиозол-4-ацетамндо) -З ацет- ок.скметнл™3 Цефем 4 карбоновой кислоты В смеси из 58 мл воды и 26,4 мл тетрагидрофурапа растворяют г тиомо- чевины и Of889 г двууглезскслого натрия К полученному раствору затем постепенно добавляют и растворяют в нем 2s3 г 7-.С4 бром-3- оксобутириламидо)- 3 ацетоксимегил 3 Цефем-4--карбоновой кислоты/ Полученную смесь перемешивают при комнатной температуре в течение ЗО мин, после чего повышают ее концепграцию при пониженном давлении, удаляя из нее гетрагидрофуран и еще больше повышают ее концентрацию до получения окончательного объема 20 мл. Полученный сх;гаток хроматографируют на колонне полистирольной смолы (Эмберлит XAD -2) Н проявляют водой. Частицы, содержащие требуемый продукт с хорошим погло-щенйем ультрафиолетового света на 245 мкм, огстаивают и -подвергают сушке сублимацией. Выход 1,305 г {52,6 вес. %). ИК-спектр; КВ|- 1767 см УФ спекгр:Л ..„.,, 256 км (Хв воде А ЛЛМ л11,35х 10). OgSgNa 2Н20, Вычислено для Cj С 38,29; Н 4,07| N 11,91, Найдено, %: С 38,41; Н 3,9О; N 11,72. Примерз. Получение (2-оКС отиа 30л-4 €1 цета мвдо) J -3-{ J. -мет илтетразол-5-ил}-тиометил-3-цефем-4-карбоновой кислоты. В 27 мл фосфатного буферного раств ра с показагелем рН 6,4 растворяют 0,67 г 17-(4-гиоциано-3-оксобутирил амидо)-3-ацетоксиметил-3-цефем-4-кар боновой кислоты и 0,116 г двууглекислого натрия. Полученный раствор выдерживают в течение примерно 12 ч (одной ночи). К смешанному раствору добавляю 0,168 г 1-мегилгетравол-5-тиола и по лученную смесь перемешивают при температуре 56-59°С в течение 8 ч. После охлаждения показатель рН полученной реайгиоиной смеси доводят до 3 путем добавления в нее 50%-ного водного раст вора фосфорной кислоты и экстрагируют этиловым эфиром уксусной кислоты (3-2о мл). Этиловый эфир уксусной кис лоты смывают водой, смесь обезвоживают, повышают ее концентрацию и выде живают в течение некоторого времени. Образующиеся кристаллы отфильтровывают. В состав полученного соединения входит 1 моль этилового эфира уксусной кис лоты в качестве растворителя кристаллизации. Выход 0,25 г. Температура плавления 1О7°С (разложение). ИК-спектр; KBh :1785, 1730, 166О см . УФ-спектр: 244 нм ( 2 в этаноле 1,22x10). Вычислено для . %: С 4O,92j Н 4,16; N 17,57. Найдено, %: С 4O,51j Н 4,ОО; N 16,6 П р и м е р 4. Получение (2оксотиазол-4-ацегамиао)}-3-( 1,3,4-тиадиазол-2)-тиометил-3-цефем-4-карбоновой кислоты. В смеси из 2О мл фосфатного буферного раствора с показателем рН 6,4 и 2,5 мл тетрагидрофурана растворяют 0,487 г 7-(4-тиоциамино-3-оксобутирил амидо)-3-цефем-4-карбоновой кислоты и 0,О84 г двууглекислого натрия. Полученныйраствор выдерживают в течение одной ночи. В этой смеси растворяют 0,13 г 1,3,4-тиадиаэол-2-тиола и 0,084 г двууглекислого натрия. Получен ный раствор перемешивают при нагревании при 58 С в течение 16 ч. После охлаждения полученный раствор окисляют 50% водным раствором фосфорной кислоты, обрабатывают активированным углем и производят его экстракцию этиловым эфиром уксусной кислоты (2х2Омл) Полученный экстракт этилового эфира уксусной кислоты тро5.ываюг водой, обезвоживают, повышают его концентрацию при пониженном давлении и выдерживают в течение некоторого времени, отфильтровывают. Полученное соединение имеет в своем составе по 1 моль этилового эфира уксусной кислоты и воды, которые являются растворителями кристаллизации. Выхоя 0,1 г. Температура плавления 122 140 С (рааложеш е). ИК-спекгр: KBh : 1780, 1650, 1535 см 64 Вычислено для С Н 5 -ЧЭ , о, %: С 39,50{ . Н Н 4,О1; N 12,12. Найдено, %: С 39,25; Н 3,15; N11,74. П р и м е р 5. Получение 7-f2-(2-оксотиазап-4-ацетамидо) -3-(5-мегил-1,3,4-оксадиазол-2) -тиоме гил-3-цефем 4-карбоновой кислоты. В смеси из 20 мл фосфатного буферного раствора с показателем рН 6,4 и 2,5 мл тетрагидрофурана растворяют О,487 г 7-(4-гиоциано-3-оксобутириламидо)-3-ацетоксиметил-3-цефем-4-карбоиовой кислоты и 0,О84 г двууглекислого натрия. Полученному раствору дают отстояться одну ночь, В смешанном pactfioре растворяют ОДЗ г 5-метил-1,3,4,-оксадиааол-2-тиола и 0,О84 г двууглекислого натрия и полученный при этом раствор перемешивают при нагреве до 58 С в течение 7 ч. После охлаждения полученную реакционную смесь окисляют 5О%-ным водным раствором фосфорной кислоты и производят его экстракцию этиловым эфиром уксусной кислоты (2x20 мл). Этиловый эфир уксусной кислоты смывают водой, далее смесь обезвоживают и повышают ее концентрацию при пониженном давлении. Полученному концентрату дают отстояться и фильтруют. В состав полученного продукта входит по 1моль этилового эфира уксусной кисоты и воды, являющихся растворителями ристгшлизацан. Выход 0,1 г. Темпераура плавления 122-140 С (разложеие) i ИК-спектр: KB 1784 сн,соос,н Вычислено для C gHjgHjOg fНгО, %: С 41,72; Н -i,38; N 12,17. Найдено, %: С 41,4О; Н 3,71; Niij,04. П р и м е р 6. Получение (2оксотнвзол-4-ацетамвдо) -3-(5-мегил1163-1,3,4-гиодиааол-2)-тиометил-3 це4)ем-4 карбоиовой кислоты. В 20 мл фосфатного буферного раствора с показателем рН 6s4 растворяют 0,417 г (4 тио1шамо-3-оксобутирил амидо)-3-ацетокснметил-3 Цефем-4 кар боновой кислоты SJ 0(084 г двууглекислого нагркя. Полученный раствор выдерживают в течение одной ночи. В Этом смешанном растворе растворяют 0,145 г 5-метил™1,3,4-тиадназол 2--тиола и 0,084 г двууглекислого натрия. Полученный раствор перемешивают под нагревом при 60 С в течение 6f5 ч, После охлаждения, полученную реакционну смесь окисляют 50%-пым водным раство ром фосфорной кислоты насьт1ают хчористым натрием и производят его экстракцию смесью этилового йра уксусной кислоты и тетрагидра| урана, взятых в соотношении 2:1 (3x20 мл). Полученный экстракт промывают насыщенным воднь м раствором хлористого iiarptm, обезвоживают и повышают его концентрацию. Кон центрат некоторое время выдерживают и получаемые при этом кристаллы отфнльт- ровьшают. Выход соединения г (49%)о ИК-спектр : KBh 1786, 1655, 1535 CMt П р и м е р 7. Получение натриевой соли (2-аминотиааол 4 ацетамидо) 3( i,3,4 тиадиаэол-2)-тиомет ил-З-цефем 4-карболовой кислоты В 2О МП фосфатного буферного раство ра с показателем рН 6,4 растворяют г 7-(2(2 -аминогиазол 4)--ацетам дД ™3-ацетоксимеТ1Ш--3 Цефем--4-КарбоксИ лата натрия н 0,14.г 1,3,4- надиазол 2- -т.иола Полученный при этом раствор пе ремешиваюг под нагревом до в течение 15 ч. После охлаж/. в полученную реакционную смесь добавляют 0,084 г двууглекислого натрия. Затем производят хроматографию полученной см си на колонне полистирольной смолы .(Амберлит ) и проявл5: ют ее водой. Частицы, содержащие необходимый продукт, отстаивают и подвергают сушке сублимацией. Этот способ позволяет получить соединение с выходом О,096 г. ИК-спектр: КВГ: 1763 см ч. УФ Спектр1А.262 нм iZ в воде 1,57x10) Вычислено для i,,.Nа s «3,5-Hj,O, %: С 32,43; Н .3,63; К 15,13 Найдено, %; С 32,32; Н 3,О5; N 14,86. П р и м е р 8 Получение натриевой оли (2 -аминотиазол-4)-ацетамидо 3-{ 1-метилтетразол- гиометил-3-неем-4-карбоновой кислоты. В фосфатном буферном растворе с показателем ,4 растворяют 0,47 г j- 2( 2--аминотиазол-4)-адетамидо1-3-ацетокскметил-3-1тефем-4-карбоновоикислоты, 0,138 г 1-метилтетразол-5-тиола и 0,084 г двууглекислого натрия. Полученный раствор перемешивают при нагревании при 50-55 С в течение 16ч. После охлаждения производят хроматограс|цдо этой смеси на колонне полисти|рольной смолы (Амберлит ХАД-2) и проявляют водой. Частицы, содержащие требуемый продукт, отстаивают и подвергают сушке сублимацией. Выход 0,173 г. ИК-спектр: КВг : 1768 смЧ УФ спектр: Лдлакс 260 нм ( S в воде 1,48х.. Вычислено для Cffi iff S 4 3 2,5 Н20,%: С 33.64; Н 3,76; N20,92. Найдено, % : С 33,80; Н 3,33; N 19,86. П р и м е р 9. По;5 чение натриевой соли (2-аминотИазол-4}-ацетамидо}-3-(5-метил 1,3,4-тиадиазол-2)-тиомегил-3 цефем-4-карбрновой кислоты. В 20 мл фосфатного буферного раствора с показателем рН 6,4 растворяют 0,47 г натриевой соли 7- 2-(2-аминотиазол -4) -ацетамидо1-3-аце токсиметил-З-аефем-4-карбоновой кислоты, 0,157 г 5 метил--153,4-тиадиазол-2-тиола и 0,О84 г двууглекислого натрия. Полученный раствор перемешивают при нагревании около 55 С в течение 15 ч. После охлаждения производят хроматографию ЭТОЙ смеси на колонне полистирольной СМОЛЫ { Эмбердит ХАД-2) и проявляют водой. Частицы, содержащие требуемый продукт, отстаивают и подвергают сушке сублимацией. Выход 0,118 г. ИК спектр: КВк : 1768 см . Вычислено для С|бw 6 4 2,5Н2О,% : С 34,84; Н 3,65; N:15,23. Найдено, %: С 34,87| Н 3,47; N 14,82. т од 1. Раствор из О,824 г (2 ммоль) (аминотиазол-4)-ацетамидо -3 ац8токснметил-3-дефем-4-карбоновой кислоты, 2,2 ммоль азотсодержащего гетероциклического тиола и 0,336 г () двууглекислого натрия, растворенного в 8 мл воды (если раствор ке получается однородным, в него добавляют 4 мл тетрагидрофурана), перемешивают 1363 b течение 6-8 ч при иагреваяни и температуре . После охлаждения производят дистилляцию тетрагидрофурана в смеси всасыванием, а остаток хроматографнруют на колонне полистирольной смолы (Амберлит ХАД-2)5 после чего проявляют его при градиенте алюирования начиная от воды, до 40%-ного метанола Частицы, содержащие требуемый продукт, отстаивают и подвергают сушке сублимацией, получена при этом натриевая соль (2-аминотиазол-4)-ацетамидо -3-(азотсодержащий гетероциклический тиометил)-З-цефем-4-карбоновой кислоты. д 2. В 40 мл фосфатного буферного раствора с показателем рН 6,4 растворяют Oj824 г (2 ммоль) (2-аминотиазол-4)-ацетамвдо}-3-ацеток симетил-З-цефем-4-карбоновой кислоты, i 2,2 ммоль азотсодержащего гетероцик- Лйческого тиола и 0,336 г (4 ммоль) двууглекислого натрия. Полученный рас ,аор перемешивают в течение 7-8 ч при нагреванго при 60-65°С, Затем производят концентрацию полученной смеси до 20 мл при пониженном давлении, полученый- при этом концентрат хроматогра|зируют на колонне полистирольной смолы (Амберлит ХАД-2 ), после чего проявляют его водой, 5О%-ным этанолом и 10%-ным этанопом (строго в указанной последовательности). Частицы, содержащие требуемый продукт, отстаивают и подвергают сушке сублимацией, получая ,г-акиы образом (2-аминотиазол-4,)-ацетамидо -3-{азотсодержащий гегерониклический тиометил)-3-цефем-4-карбоксилагный натрий, М е т о д 3. Смешанный раствор из 0,824 г (2 ммоль) (2-аминотигазол-4) -аце тамидо - 3-аце токсиме тил-3-цефем-4-карбонавой кислоты О,586 г {2 ммоль) 2-(2 бензоилоксиэ тилшф-1,3,4-тиациазол-5-тиола, 0,336 г 1 (4 ммоль) Д1зу тлекислого нагрия, 5 мл геграгидрофурана и 10 мл воды нагревают при температуре 65 С в течение 5 ч. Затем повышают концентрацию раствора до его высыхания, а остаток растворяют в 4 мл ацетоиитрила. Полученный раствор хроматографируют на колонне силикагеля и проявляют 5%-ным водным раствором ацетонитрила и затем 15%-ным .водным раствором ацетонитрила. Частицы, содержащие требуемый продукт, отстаивают и повышают их концентрацию для осаншения кристаллов, которые собирают путем фильтрации и получают таким об«разом 2-аминотиазол-4)-ацетамидоЗ-3 2-(2-бензоилоксиэтилтио)-1,3,4-тиадиаэол-5-тиометил J -З-цефем-4-карбоновую кислоту. Me г о д 4, В смеси из 8 мл воды .и 4 мл, теграгидрофурана растворяют 0,974 г (2 моль) (2-оксотиазолин-4)-ацетамидо 3-ацетоксимегил-3 цефем-4-карбоновой кислоты, 1,1 ммоль азотсодержаще го гетероциклического тиола и 0,336 г (4 ммоль) двууглекислого натрия. Полученный при этом раствор перемешивают в течение 6-8 ч при нагреве при температуре бО-бЗ С. После охлаждения показатель рН полученной смеси доводят до 3,О путем добавления в нее фосфорной кислоты и производят экстракцию этиловым эфиром уксусной кислоты, после чего смесь промывают водой и сушат. Затем повышают концентрацию полученной смесн, полностью высушивая ее при пониженном давлении, перемешивают полученный остаток с эфиром и в течение некоторого времени выдерживают. Полученный осадок фильтруют и получают при этом порошок 7-f2-(2-oKcoтиазолин-4) -ацетамндо} -3-{ азотсодержащий гетероциклический тиомегил)-3-цефем-4-карбоновой кислоты. В таблице приведены соединения к методика получения, описанная в примере 9.
27 N (Cig
Na26O
1765
4,
(1,70x10 )
1
II TJ--M
у-Ш«СОШ1-J-Y , II н.
IJ CH CH NCCHg)
28
-CHACON Hg
29
-CH CH OH
30
H
im.j.
IW- i-СПАСШИ 6
31 -CHaCOONa
-y- ш.сош-11 Ш 11tii
.J--Bx,
СООМ V
RJ
Mq2611765
(1,71x10 )
1765
Na259
4,
(1,48x10
1760
.i--- cii. s -Л..
- fiOOT-f
2S91763
(1,66x10)
s.
r....
J; i«
«: л:|- - ™™il I- --i -
L,. X
R
-1I.A ч
eooM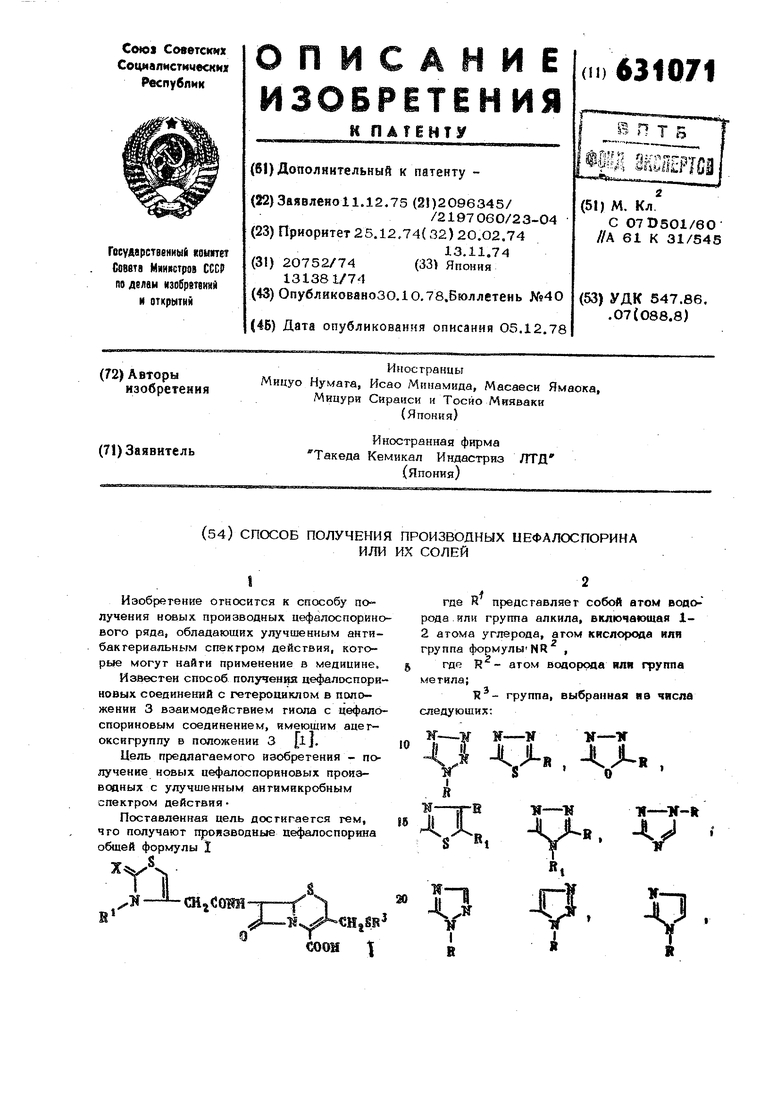








| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производныхцЕфАлОСпОРиНА или иХ СОлЕй | 1974 |
|
SU795481A3 |
| Способ получения производных цефалоспорина или их солей | 1975 |
|
SU667139A3 |
| Способ получения цефалоспориновых соединений | 1978 |
|
SU919596A3 |
| Способ получения производных 7 -ацетамидо-3-цефем-4-карбоновой кислоты | 1976 |
|
SU660594A3 |
| Способ получения производных 7-ацетамидо-3-цефем-карбоновой кислоты | 1974 |
|
SU668607A3 |
| ПРОИЗВОДНЫЕ ЦЕФАЛОСПОРИНА И ИХ ФАРМАКОЛОГИЧЕСКИ ПРИЕМЛЕМЫЕ НЕТОКСИЧНЫЕ СОЛИ, ФИЗИОЛОГИЧЕСКИ ГИДРОЛИЗУЕМЫЕ СЛОЖНЫЕ ЭФИРЫ, СИН-ИЗОМЕРЫ И ОПТИЧЕСКИЕ ИЗОМЕРЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1994 |
|
RU2091384C1 |
| Производные 7 @ -метоксицефалоспорина или их натриевые соли,обладающие противомикробной активностью | 1981 |
|
SU1130569A1 |
| Способ получения производных7-/2-(2-АМиНОТиАзОлил-4)-2-АлКОКСи-иМиНОАцЕТАМидО/-3-ТиОМЕТил-3-цЕфЕМ- 4-КАРбОНОВОй КиСлОТы B ВидЕ СиН- изОМЕРОВ | 1978 |
|
SU795482A3 |
| Способ получения производных цефалоспорина | 1978 |
|
SU953983A3 |
| Способ получения производных цефалоспорина или их фармацевтически приемлемых солей | 1981 |
|
SU1095879A3 |

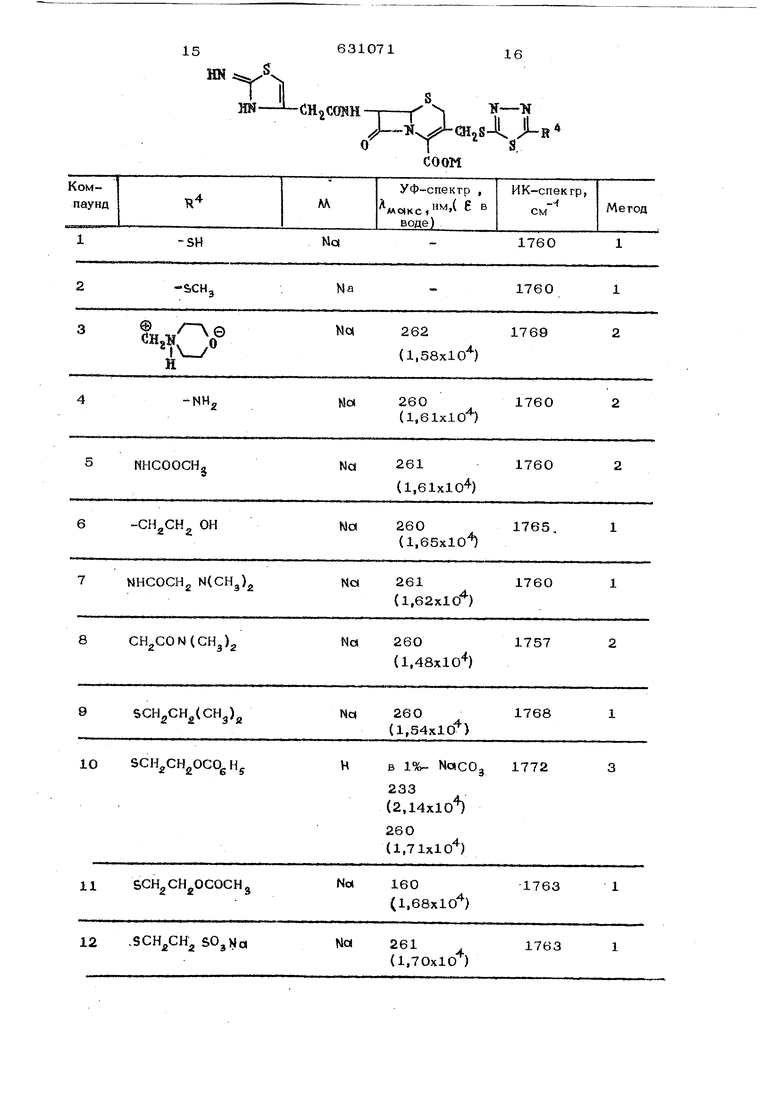
32 -HH
OTYX
R8
33
4-.WH , S-CH,
3
34
4-ЫИ, e-OH
b
354-аН,
1758
Na237
(1,48x10 )
.й5
™Т IV
.-.М ..Д- m J J
..S .Л.
уГ II
.
1758
1758
2 2 1760
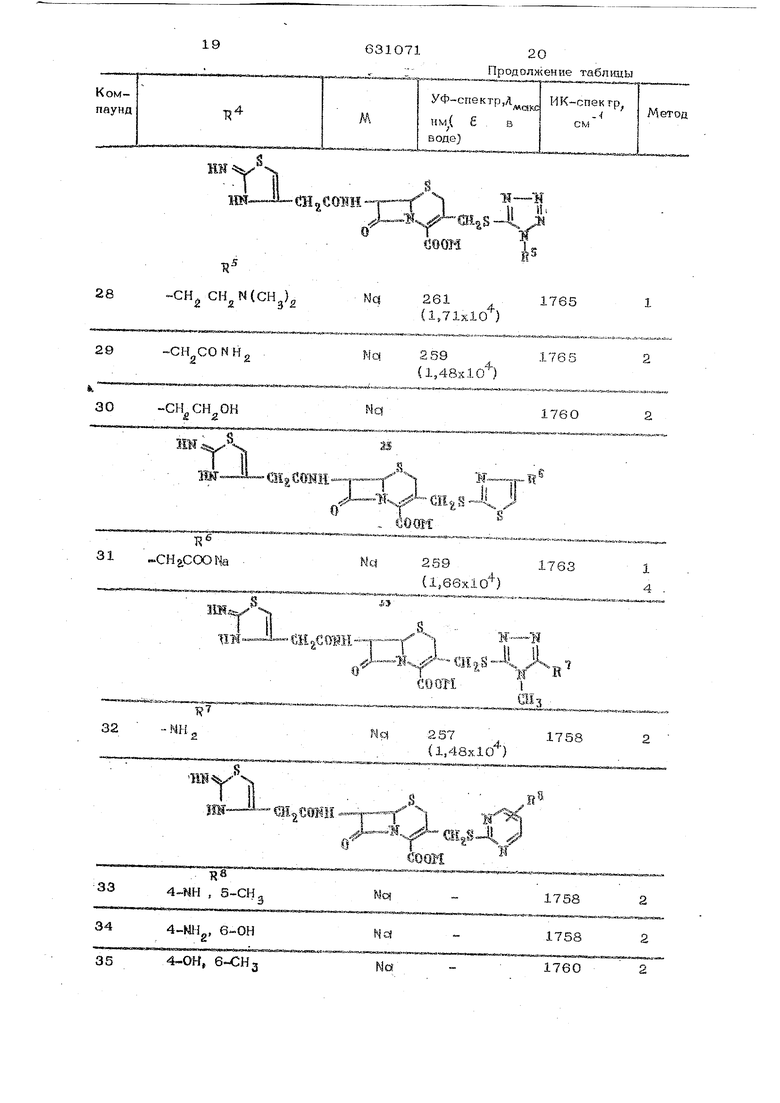
OvS
JJ
HNu-
-NHCH.
36
Tl
и Ij
B«- -CHjWWH
392-Метил-.1,3,4-оксадиазол- No 258
(1.56x10) 40 1-Мегип-1,3,4-гриазол-5-ил No
41З-Метил-2-N - окисьпиридазин-6-ил431-Метил-1,3,4-гриазол-5-ил Na
441-Мегилимидазол-2-ил
45 2-ТрифгормегиЛ-1, -тнадиазол-5-ил
464,5-Димегилгиазол-2-нл
K-IT
73р-с„,ЯА
COOM
1780
Hв 5%- NdHCO
(1,28x10)
s
JH.
1768
1750
Nq 250
1758
(1,57x10)
1763
Nd 261.
(i,59xlO
1757
No 258
(1,61x10) 2611765 (1,49x10 25O176O (1,60x10)
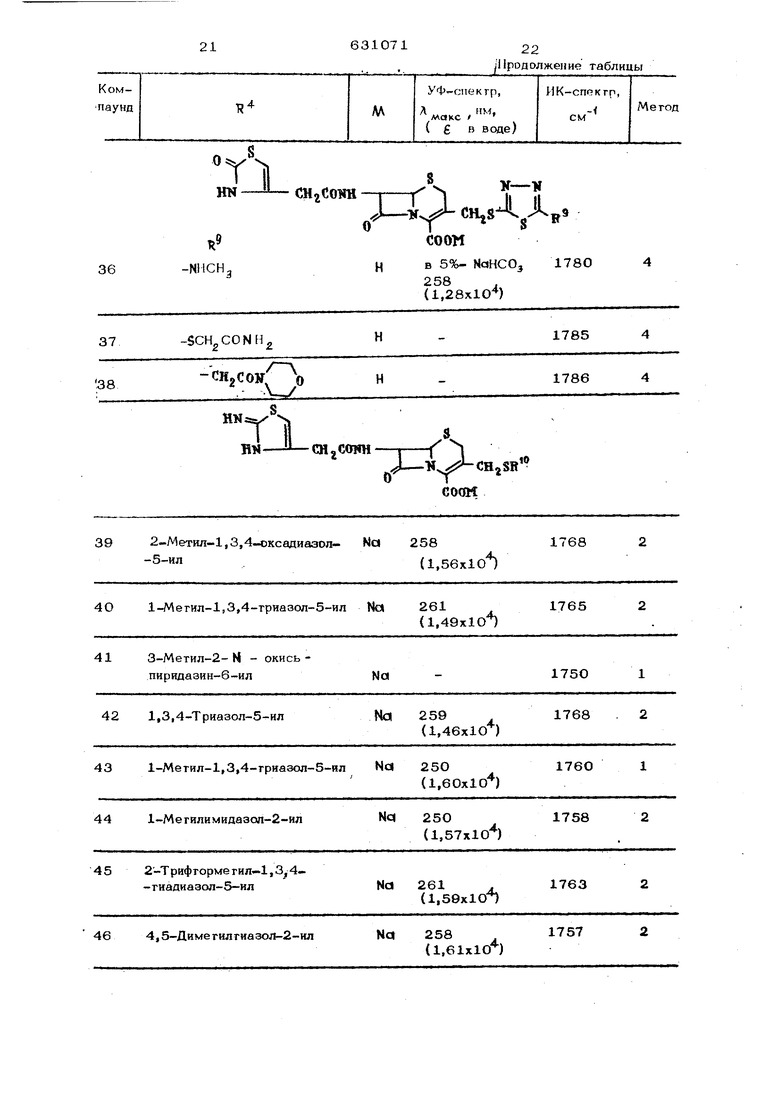
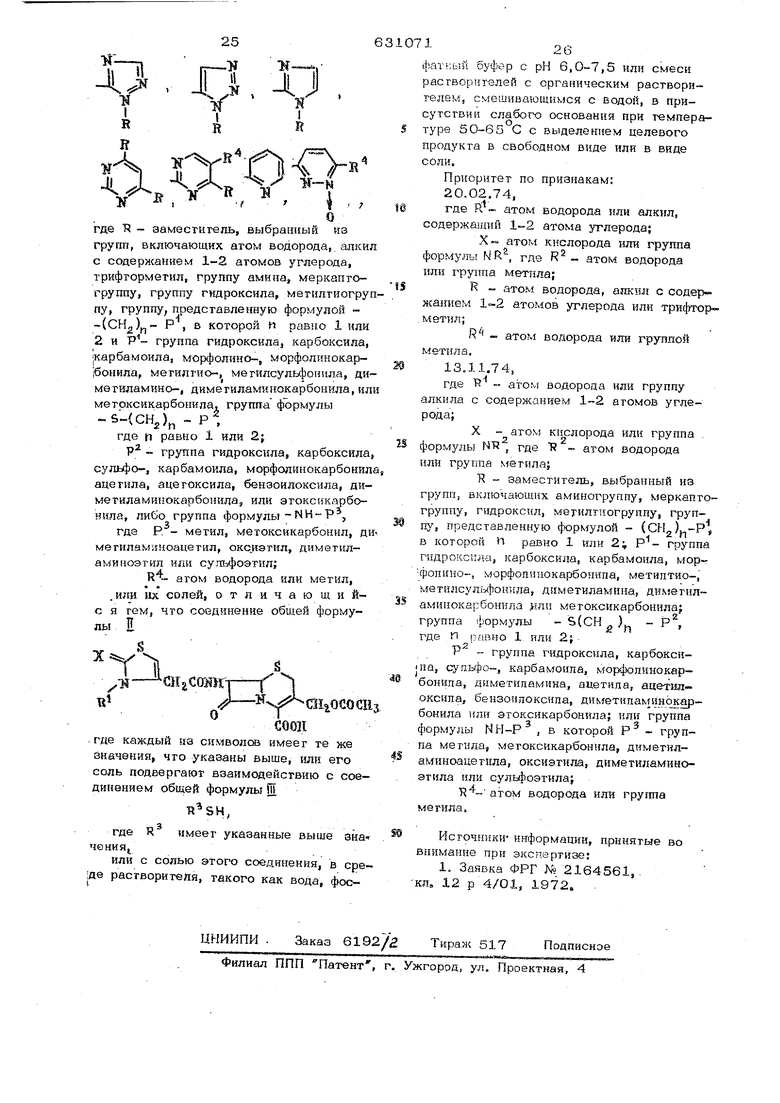
Формула ввобрегвкия Способ получение проиэвооаых це фалоспорнна обшей формупыХ
-(Я1|ССПШ
соон
гее в - «том вооороаа нли группа адкйлв| включающая 1-2 агома углерода;
X - атом кмслоро1 1а или группа формулы MR, гцеП- атом вооороаа или мегкла}
R - группа, выбранная из числа следующих:
М-М
, ЛД-в-ЦЬр.
V-яг
и-и-й
..V
Авторы
Даты
1978-10-30—Публикация
1975-12-11—Подача