Изобретение с; тносится к способу получения новьох соединений - производных аминоалкоксибензофуранов фор мулы «°«3.Я, -Wl-CO-lfs 0-CHi-(CHiU- C (О представляет мо где группа нометиламино-, моноэтиламино- или диметиламиногруппу; группа представляет, мо ноалкиламино- или диалкиламиногрупп где алкил содержит от 1 до 3 атомов углерода, или гетероциклический радикал, а именно пир-ролидиновое, пиперидиновое, метил-4-пиперидиновое, 1летил-1-пиперазиновое или тетрагидро-1,2,5,6-пиридиновое кольцо; m - целое число. 1 или 2. Эти соединения обладают ценными биологически активными свойствами. Способ основан на известной в ор ганической химии реакции взаимодействия галогенпроизводного соединения, например хлорметильного производного фурана, с амином 1. Целью предлагаемого изобретения является получение новых производных аминоалкоксибензофуранов, обладающих биологически активными Свойствами. Предлагаемый способ заключается в том, что соединение формулы ОСНз KH-CO--N (CHj),n-Ci и га имеют выгде группа -тг шеуказанные значения, подвергают взаимодействию с амином с формулой где группа -ТГ имеет вышеукаанные значения, в среде толуола при 100-110°С. р 1, 4,7- ЛI i м е -Г о к с и - 6 (из опропиламино-2-э ток си) -метилкар бамоиламино -бензофураи„ ПерЕЫИ этап. 4 ,7.Дп.метокси-5-(М-метилкарбамоилгмино)-6-оксибензофу ран.К раствору 20,9г (0,1 моль) 5-а .,.7 диметокси-6-6ксибеизофуранг) 200 мл хлороформа медленно добавляют 5,7 г (0,1 моль) изоцт1аг ата мети ла. Перемешивают при компсхтной темп ратуре в течение 2 ч, затем испаряю растворитель, кристаллизуя остаток в эфире и фил.ьтруют. Получают 23 г искомого продукта. Выход 89% т,гш, 110с. Вычислено, С 54,13 Н 5,30; N 10,52, . Найдено, %: С 54,03; П 5,36; N 10,48, Второй этап, 6 (Хлор-2-этокси}-4, 7-диметокси-5- (N-метилкарбамоила но)-бензофураи„ При кипении реакцио ной среды в течение 4,5 ч нагревают смесь 150 г (0,56 моль) соединения, полученного на предыдущем этапе, 100 мл (1,2 моль) 2 хлор-1 б ромэ т а на и 207 г (If 5 моль) карСЗоната калия в 1,4 л ацетонитрила. Горячую смесь фильтруют., охлажда ют и фильтруют образовавшийся осадок. Получают 115 г искомого продук та. Выход ТоПЛ„ 148°С: ВычислоЕЮ, %: С 57,53 Н 5,52; 9,50, Ci4 Hj-jCtN O, Найденоf sTc 57,46; И 3,49 9,48, Третий этап. 4, 7 Д1;меток-сн-13- (и пропиламино 2-.этокси) --5- (N-метилка бамоилаг-дано) -бензофур ан,, В автоклЕ ,ве нагревают с оЗратнь й1 холо1Э,нльни ком в течение 15 ч раствор 11, 5 г ,(0,035 моль) б (хлор--2- Этокси) -4 , 7 -д име ток с и-5-(N-ме т илк арб а моил ами но -бензофурана, полученного на пред1ыДущем этапе, 8,2 г (0,14 моль) изо пропР1ламина, 7,5 г (0,05 моль) гхзди того натрия и 4,8 г (0,035 моль) карбоната калия в 200 мл толуола,, Фильтруют, испаряют филтэтрат и рекристаллизуют в ацетате этила« Так об,разом получают 2,2 г искомого пр дукта. Выход 18%; т, пл, 140-С. .-Вычислено, %: С 58,10: Н 7,17: 11,96. CnHjsNsOs. Найдено, .%: С 57,79; Н 7fli; 11,86. Пример 2, б (Дииэопропила НО-2-ЭТОКСН-4,7-ди.метокс,и-5- (М-ме тилкарба,,моила лино) -бензофуран,, Нагревают с обратным холодильни ком в течение 4 ч с -спензию 12 г (0,045 моль) 4,7-диметокси-5-(Ы-ме тилкарбамоиламйио)-б оксибекзофура на, получак1.1ого на первом этапе примера 1, 12 г (ОД)б моль) хлорги 2I ата 2-лиизопропиламино-1-хлорэтана 21 г (0,15 моль) карбоната калия 100 мл ацетонитрила, фильтруют, исаряют фильтрат и рекристаллизуют остаток в смеси 50/50 ацетата этила и изопропилового эфира. Таким образом пoлsчaют 13,5 г искомого прр142°С. укта, Выходт: 77%. т. пл, Н 7,94; С 60,05; Выч;-Еслено, 10,68, CsoHsiNgOg, С 61,22; Н 7,94-; Найдено, N 10,62. П р и мер 3, 4,7-Д,иметокси-5 -(метил-4-пиперазинокарбамоиламино) 6- (пиперидино-2-этокси)-бсэнзофуран. Первый этап, Дихлоргидрат 5-амино4 ,. 7--диметокси-6-Г1иперидиноэтоксибензофурана. В течение 10 ч нагревают с обратным холодильником раствор 25,1 г (0,1 моль) 5-адетамидо-4,7-димeтoкcи б пипepидинoэтoкcибeнзoфypaнa в 200 соляной кислоты 2 и. Затем 1-1ейтра.лизуют концентрированной содой извлекают ацетатом этила, испаряют растворитель, вновь псмеш,а,ют остаток в ацетон ,и добавляют 30 мл хлористо,БОДОродного этанола 7н. Фи,льтруют и peкpиcтaлJП зyют в этаноле. Выход 43%; т. пл. 203°С. Вычисленоf %: С 51,48; Н 6,74; N 6,91. С 17 И 26 N204. С 51,72; Н 6,68; Найдено, % N 6,81. ,Второй этап, 4 , 7 Диметскси 5-(N,метилкарбамоиламино) -6-- (пиперидино2-этокси)-бензофуран, Вндерж,итзают1 в 71ечение 3 ч при 8090С в ав7;оклаБе смесь 16 г (О..05моль) 5-амино--4,7-диметоксИ 6-пиперндиноэтоксибензофурана f приготовленного jia пре,дь-1,дущем этапе, и 3,2 мл (0,055 мол ь) и 3 оци ан ат а мет ил а в 500 рдл толуола. Затем испаряют растворитель, кристаллизуют полученное масло в петроле,йном эфире и рекристаллиз5ют в изопропиловом эфире; т. шт. . Выход 37%. G 60,46; Н 7,21; Вычислено, 11,23. Cjo С 60,42; И 7,29; Нггйдено, % 11,30. Третий этап, 4,7 Диметокси-5-(4-метйлпиперазинокарбамоилагдано) -6 (пиперщ:;ино-2-этоксн) -бензофуран. В течение 20 ч нагревают с обратным холодильником раствор 8,5 г (0,023 rvsoль) 4 ,7 днметокси 5 (К метилкарба мои:лам.ино) -5- (г -иперидиио™2-этокои) -бензофурана,получен„ного на предыдущем этапе и 9,1 г (О,09моль) метилпиперазина в 100 мл толуола. Испаряют растворитель, вновь помещают остаток в этилацетат, прог алвают водой, кристаллизуют остаток ,в эфире и рекристаллизуют в этилацетате. Выход 25%. 1. пл. .
Вычислено, %: С 61,86; Н 7,68; N 12,55.
4 5Е айдено, %: С 61,63; Н 7,70; N 12,33.
Пример 4. Гидратированный дихлоргидрат 5-ацетамидо-4,7-диметоси-6-(4-метилпиперазиноэтокси)бензофурана.
В течение 8 ч нагревают с обратным холодильником раствор 15,5 г (0,05 моль) 5-ацетамидо-б-(хлор-2-этокси)-4,7-диметоксибензофурана, и 15 г (0,15 моль) N-метилпиперазина
в 100 мл толуола. Фильтруют, испаряют фильтрат в вакууме, вновь помещают остаток в спир и добавляют хлористоводородный спирт. Фильтруют и рекристаллизуют в абсолютном спирте. Выход 55%; т. пл. . Вычислено, %: С 46,48; Н 6,88; N 8,36.
CjgH2,CZ-,N304 + 9/4 .
Найдено,%: С 46,76; Н 6,73; N 8,34.
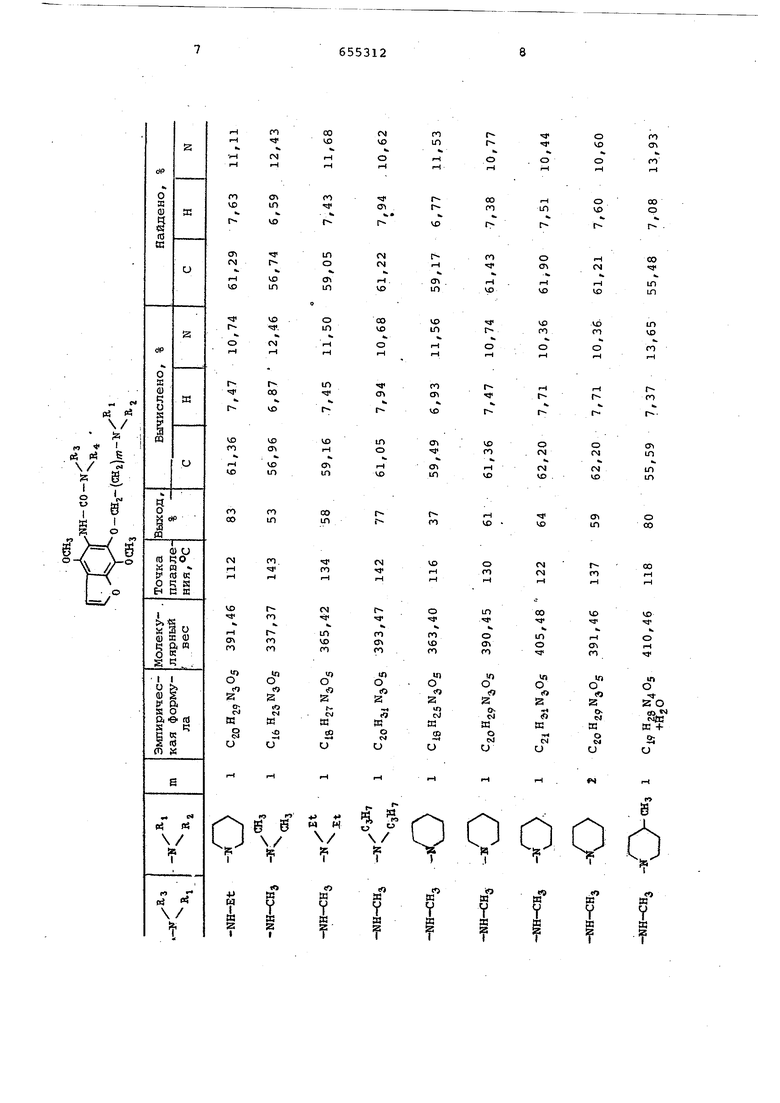
С помощью методики, описанной на третьем этапе примера 1, но исходя из соответствующих реактивов, получают соединения, представленные в таблице.
го т
о
Г
5Г





оо
О VO
оо п
iH
о
1Л
со
го
о
см
cjЧ
СП
1Л
I-)
г-(
LO VO ю
1Л VD
г«3
ЛО
м
п
Г ГО
1
Г-г
S
1-
УЭ
о
о м
in
го
in in
м ю
гч
J3
о со
а
VO ш
VO
г
00
(N Гч1
о го
п
1-1
VO
00 rj
VO
ш ччгГ
ч
о
in
о а
О
1-1
а п го Ч
чW
ш
w О «
т
о
о
о
л 2
lO
г
а
оо
и
«
csjfC
CJ
« « О
и +
аз о
ЕС
;Г4
а N
со
Csl
и О
о
О
000
W
«о
«
X
I
Y
V I
и
f
f
о
ел
00
СГ1
ОО
Г1
гм
ю
(N
00
ш ю
ч
о un
о
VO
(У1
rгм г
г-
«с
00
VO
ч
1
о
о л
VO
ОО
рm
г
со
о
(N
CN
го
1-1 ч«Я
1Л Г-г г
го
п
ш
о л
о
л
iZ in
iZ
fe
Сч
ж
X
о
и
00
л
rt
Щ
к
V
и
СП
f
f 11 Формула изобретения Способ получения производ амимоалкоксибепзофураыов формул ОСИз Ш1-СО-ЪТ о-сн,-(сня)-кс; , ОСНз г где группа -Н представляе монометиламино-, моноэтиламинодиметиламиногруппу;группа -V представляе ноалкиламино- или диалкиламиног пу,. где алкил содержит от 1 до 3 мов углерода, циклоалкиламиногр содержащую 5-6 атомов углерода, гетероциклический радикал, а им пирролидиновое, пиперидиновое, саметилениминовое , гептаметилен новое, метил-4-пиперидинрвое, м тил- 1 -пиперазиновое или тетраги 1, 2,5,6--пиридиновое кольцо; m - целое число 1 или 2, о т л и ч а ю щ и и с я тем что соединение формулы II ОСИ,о иjf .T H-CO-lTCf R 0-СН,-(СН,),„-С1 ОСНз где m и группа -N имеют указанные значения, подвергают модействию с амином формулы III где группа имеет указанные выше значения, в среде толуола при 100-110°С. Приоритет по признакам /к-з 12 ,07, 76-группа v предили моноставляет ионометиламииоЭуиламииогруппу;группа -Л представляет моноалкиламлногруппуj где алкил содержит от 1 до 3 атомов углерода, диалкиламиногруппу, где алкил содержит от 1 до 3 атомов углерода, или гетероциклический радикал, а именно пирролидиновое, пиперидиновое, метил-1пиперазиновое кольцо; т целое число 1 или 2. 27.06.77- группа -К представляет моноалкиламино- или диалкиламииогруппу, где алкил содержит от 1 до. 3 атомов углерода, циклоалкиламиногруппу, содержащую 5-6 атомов углерода или гетероциклический радикал, а именно пирролидиновое, пиперидиновое гексаметилениминовое, гептаметилениминовое, метил-4-пиперидиновое, метил- 1-пиперазин6вое или тетрагидро1,2,5,6 пиридиновое кольцо; iri целое число 1 или 2; группа - N - представляет мономе гиламино-, моноэтиламино- или диметиламиногруппу, Источники информации, принятые во внимание при экспертизе 1. Заявка № 1962620/04, по которой принято решение о выдаче патента СССР, кл. С 07 D 407/06, 12.09.73.
Авторы
Даты
1979-03-30—Публикация
1977-07-12—Подача