Предпочтительной, так «ак .,бо,лее н1изкие темпёр-атуръ замедляют процесс завершения .{Ааки;ии. В «ачестве спирта используют метанол, Этанол, про.па;нол, изопропанол, н-бутаяол, изобутанол. Целевой продукт может быть выделен из реакционной смери экстракцией с примейгейгйем соответствующег 5 растворителя, например хлористого метилена, который является предпочтительным, хлороформа, атиладетата. Желательный лрбдукт выделяют ,из экстракта хроматогр1афией иа силикагеле с применением соответствующих систем растворителей, например хлороформ- метанол (95 : 5) и СНСЬ-СНзО.Н-НгО (78:20:2). 7-О-Алкилногарол можно ацилировать в стандартных ацилирующих условиях с применением соответствующего галогенан1гидрид1а.ил:и ангидрида кислоты, получая ащилирю-ва-нное соединение . Реакцию аадлирования ведут в присутствии связывающего кислоту агента. К пригодным .агентам такого рода относятся амины, как пиридин, хЯНолин, ИЗОХИНОЛИ.Н, и буферные соли, как адетат «атрия. Предпочтительным основаниеьг является пиридин. . Проценты в примерах даны по весу, все соотношения хмесей растворителей приведены по объему.. Пример 1. ... :. : ,...;,-. ч.,л-- 1 А. Раствор 12,3 гногаламициновой кислоты в смеси 20 мл диметилформамида и 50 мл СПзОН получают при нагревании. После выдерживания раствора при комнатной температуре в течение ночи его выливают |На 500 г силикагеля, элюИруя смесью хлороформ-метаиол, начиная с соотнощения 99: 1 и постепенно увеличивая Концентрацию СНзОН до соотнощения 4:1. После элюирования обрабатывают тонкослойной хроматографией (СНС1з : СНзОН : ПаО 78 : 20 : 2) и собирают фракции, содержащие только ногамицин (R/ 0,5). Получают всего 3,9г. 1,5 г перекристаллизовывают из смеси ацетона и СНзОН (85 : 16), получая 259 мг; т. пл. 210-215°С;|аЬ + 273° (с 0,923, хло|роформ); УФ-спектр (этанол); Л„акс « 236 .(,700), 259 (е 25,850), 290 (е 10,050) и 478 (е 16,,100). . ИК-спектр (в Nujol): 3500, 1670, 1575, 1Й95, 1230, 11,10, 105:5, 1005, 920, 890, 838,778, 762 и 724 еж-1; Масс-спектр: rnJe. 729. . Вычислено, %: С Н N 1,92. i Сз7Н47ЫО,4 Найдено, %: С 58,55; Н 6,42; N 1,94. Б. Получение 7-О-метилногарола.. . Раствор 5 г (6,8 моль) ногамицина в 200 мл 0,26 л. метанола в хлористом водороде нагревают с обратнь1М холодильником 2ч. рхлажденный раствор выпаривают при поняже1нном давления npHMiepHO до 75 мл. Затем раствор разбавляют ВОДой (250 мл) и экстрагируют тремя порщиям-и по 50 мл хлороформа. Водный слой затем обрабатывают до рН 7,2 60%-ным -pfacTBOpOM гидроокиси натрйя и экстрагируют тр-амя порциями по 100 ;ил хлороформа. Соединенные хлороформные экстракты выпаривают досуха при п.о.Н11 ке;нчом давлении. Остатак (примерной г) хроматопрафируют на 125 г «иликагеля, элюируя с применением смеса хлороформ - метанол в соотношении 95 : 5. и собирая 266 фракций по 10 мл. Фракци:и 87-185 соединяют яа основе цветного пика и тонкослойной хроматографии в системе хлороформ - метанол - вода (78 : 20 : 2). Выпаркой при пониженном давлении получают 1,97 г (53%); т. пл. 248-253°С; Rf (по указанной системе) 0,64; MD +958° (с 0,163 в хлороформе); УФ-спектр (этанол): акс 235 нм (е 41,200), 251 нм (е 25,500), 257 нм (е24,150), 290 нм (е 10,500), 479 нм (б 15,530). Вычислено, %: С ,62,|Ш; Н 5,78; N 2,59. . C28H3IiNOio Найдено, %: С 62,Й1; Н 5,94; N 2,66. Пример 2. Получение 7-О-этилногарола.- . ;. . Раствор 2 г нагам|Ицина в 150 мл абсолютного этанола .в хлористом водороде (0,093 Н.) 8 ч нагревают с обратным холодильником. Затем в течение ночи перемешивают при комнатной температуре. Приблизительно половину количества этанола удаляют выпаркой при пониженном давлении, разбавляя остаток водой в количестве 100 мл. После экстрагирования водного раствора порция|ми хлороформа по 100 мл, соединения и вьшарки при пониженном давлении получают 1,98 г остатка. Этот продукт затем х,роматографируют ж;идкостной хроматографией под высоким давлением на 60 г сил;икагеля, элюируя смесью хлороформ - метанол в соотношении 95 : 5 и собирая 150 фракций по 5 мл. На оановании тонкослойной хроматографии в с истеме хлороформ - метанол - вода (78 : 20 : 2) фракции собирают в качестве перв|ой порции. Выпаркой этой порции при П01ниженном давлении получают 0,30 г 7-О-этилногарола, однородного согласно тех в указан ной системе ( 0,70); т. пл. 190-200° С (с разложением) 822° (с 0,114, ,хлороформ)г. Масс-спектр: М+ 555. Вычислено, %: С 62,70; Н 5,95; N 2,52. С29НззЫО10 , Найдено, %: С 61,66; Н 6,40; N 3,01. Вторую порцию выпаривают при пониженном давлении, получая 0,32 г 7-Оэтилэпиногарола; т. пл. С (с разложением) 487° (с 0,218, СНС1з);
УФ, (этанол) Я,„акс HJd 236 (е 43,700), 260 (е 22,300), 288 sh (е 8,550), 476
(8:13,950).
ИК (Nujol): 3400, 3250 sh, Зб80, 1655, 1620, 1605, 1575, 1280, 1220, 1120, il055, 1005 и 775 см-.
Масс-спектр: М+ 555. Вычислено, %: С 62,70; Н 5,95; N 2,52. CagHasNOio
Найдено, %: С. 60,36; Н 5,93; N 2,75.
Формула « 3 о б р е т е ,н и я
Способ получения 7-0-алкилногарола формулы
где R - алкил с I--4 атойаиИ, углерода, отличающийся тем, что яогамицин
формулы
сн: ои
но
он о он OR
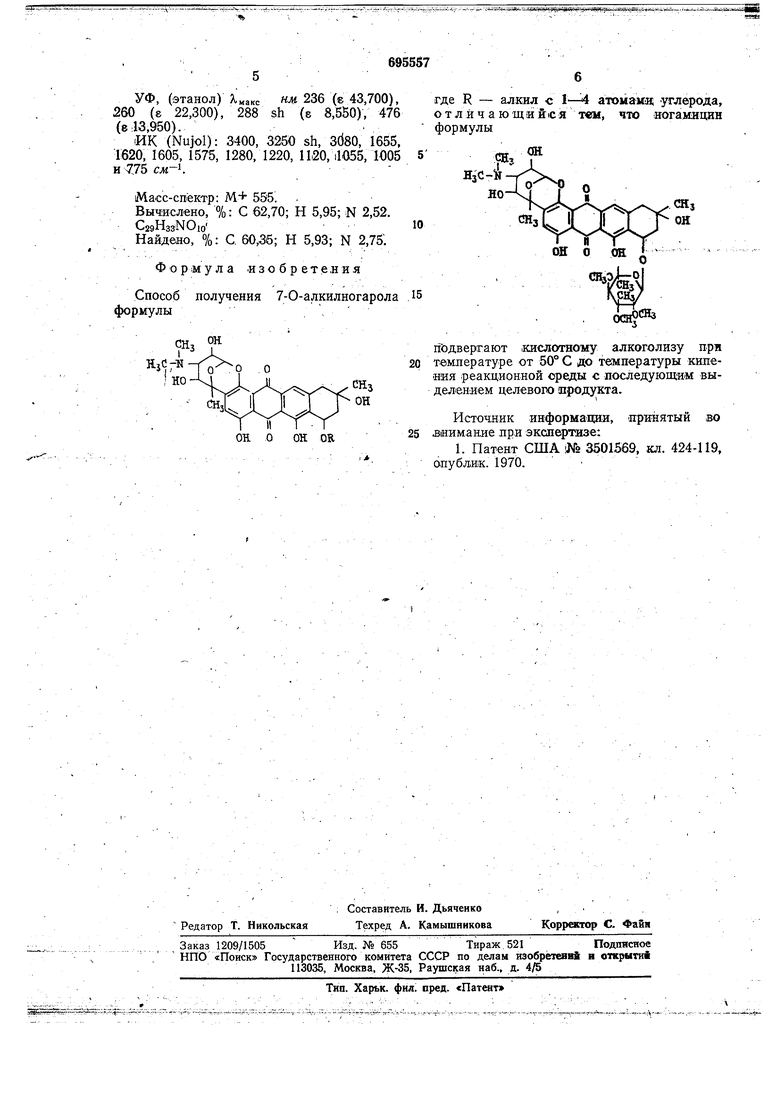
гГодвергают .кислотному алкоголизу при темлературе от 50° С до температуры кипеиия реакционной среды с последующим выделением целевого иродукта.
Исгоч:ник информа ции, -принятый во внимание лри экспертизе:
1. Патент США № 3501569, кл. 424-119, опубл,И;К. 1970.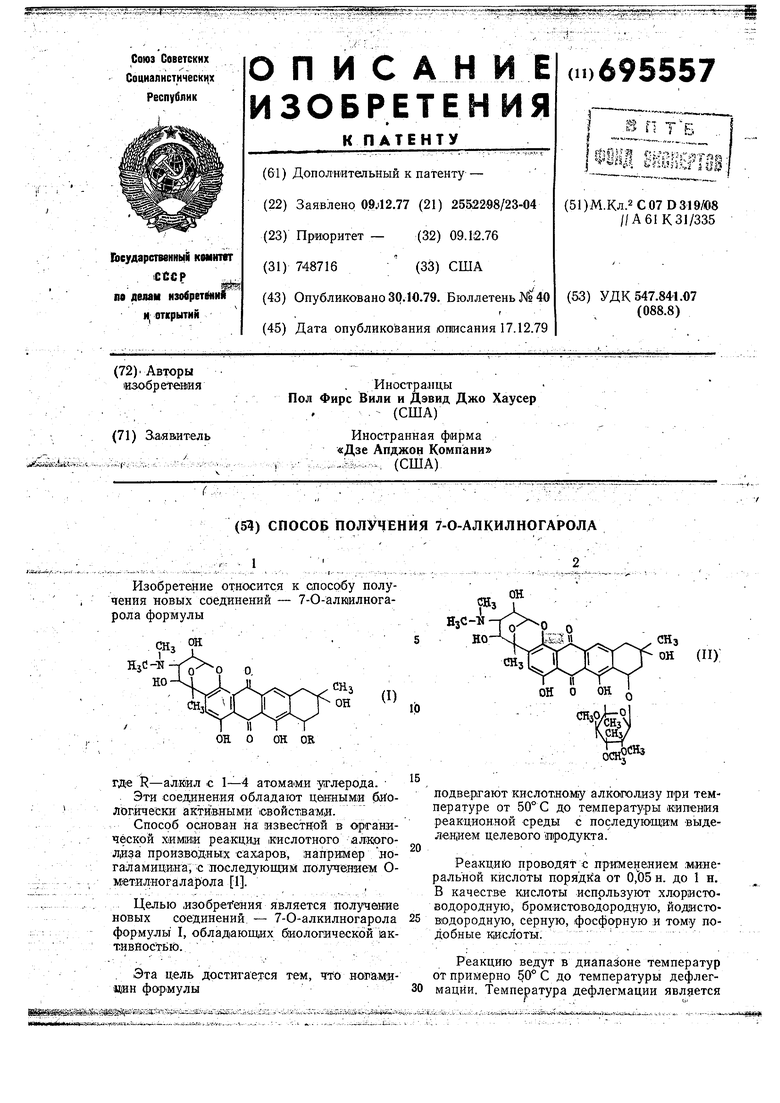



Авторы
Даты
1979-10-30—Публикация
1977-12-09—Подача