i
Изобретение относится к области высокомолекулярных соединений, а именно к синтезу огне-,терме- и теплостойких полимеров, которые мо- с гут быть использованы в различных областях техники.
Известен способ получения полибенз.имидазолохиназоливов, основанный йа реакции взаимодействия аромати- 10 ческих диаминов, содержащих в о-положениях к аминогруппам бензимидазо.пьные циклы, с дигалоидангидридами ароматических дикарбоновых кислот в условиях низкотемпературной поликрн- 5 денсации в среде амидных растворителей с последующей твердофазной по.пициклодегидратацией образовавшихся промежуточных полимерных продуктов при 350 370°С 1 .20
Недостатком данного способа является то, что используемые в качестве мономеров ароматические диамины обладают низкой нуклеофильной реакционной способностью вследствие на- 25 личия бензимидазольных о-замегзтителей у аминогрупп,что ограничивает возможность получения полибензимидазолохиназо.пинов с высоким молекулярным весом. Кроме того, осуществле-зо
ние процесса полициклодегидратацич промежуточных полимерных продуктов при очень высоких температурах () вызывает протекание побочных
деструкции
сшивки
процессов
и т.д., что приводит к образованию полибензимидазолохиназолинов,раство. только в сильных кислотных растворителях.
Известен также способ получения полибенэимидазолохиназолинов,основанный на высокотемпературной поликлоконденсации бис-(о-фенилендиаминов) с бис-бензоксазинонами при 350- 2 .
Недостатки известного способа получения полкбензимидазолохиназолинов следуюгцие:
необходимость использования в ка.честве мономеров относительно труднодоступных и легко окисляющихся бис-(о-фенилендиаминов);
низкая электрофильная реакционная способность бисбензоксазинонов, используемых в качестве мономеров, затрудняющая получение полимеров с высоким молекулярным весом;
необходимость проведения процесса полициклоконденсации при , что Первую стадию процесса - синтез поли-(о-нитро)амидов - можно осуществить различными методами полиамидирования - на границе раздела фаз, эмульсионной низкотемпературной в растворе и акцепторнокаталитической поликонденсацией. Наиболее высокомолекулярные поли-(о-нитро)амиды образуются при взаимодействии- строго эквимолярных количеств дигалоидан гидридов о,о -ди нитродикарбоновых кислот с бис-о -нитроанилинами в среде апротонкых амидных растворителей, типа диметилацетамида, N-метилпирролидона, гекса метилфорфорамида и др., являющихся одновременно акцепторами галоидводородов - побочных продуктов реакции полиамидирования при температурах не вьше 0°С или в среде высокомолекулярных инертных органических растворителей в присутствии третичных аминов в качестве акцепторов галоидводородов при 20-25°С, При этом образуются высокомолекулярные поли-(нитро)амиды, полностью растворимые в диметилформамиде, а также муравьиной, трифторуксусной и серной кислотах и обладающие приведенной вязкостью О,5%-ных.растворов в органических растворителях, равной по мень шей мере, 0,4 дл/г. По данным динамического термогравиметрического анализа полностью ароматические поли-(о-нитро) а «5иды не леструктируются на воздухе до . Восстановление поли-(о-нитро)амидов в поли-(о-амино)амиды и циклизацию последних с образованием поли-(о -амино)бензимидазолов предпочтительн проводить в виде совмещенных процессов с использованием металлов или их солей (например, Fe или SnCC2) с хло ристым водородом, являющимся одновре менно катализатором образования бенз имидазольного цикла,в среде амидных растворителей при 150-180 С, При этом образуются высокомолекулярные поли-(о-амино)бензимидазолы, полностью растворимые в м-крезоле, смеси тетрахлорэтана с фенолом (3:1) , .в вышеперечисленных биполярных апротон ных и сильных кислотных растворителя и обладающие приведенной вязкостью О,5%-ных растворов в органических растворителях, равной, по меньшей мере, 0,5 дл/ г. По данным динамического термогравиметрического анализа поли-(о-амино бензимидазолы не деструктируются на воздухе до 360°С. На их основе получаются серые, прозрачные и эластичные пленки, обладающие прочностью на разрыв равной, по меньшей мере, 900 кг/см при 25°С. Для идентификации поли-(о-амидо) амидов восстановление поли(о-нитро) амидов следует осуществить методом каталитического восстановления молекулярным водородом в присутствии таких катализаторов, как Ni .Ренея, Pt/C,Pd/C,Pt или других в среде аг-шдных растворителей при температурах не вьие 30°С, чтобы избегать циклозамыкание образовавшихся в процессе восстановления о-амино-амидных фрагментов в бензимидазольные. При этом образуются высокомолекулярные поли-(о-амино)-амидьл, полностью растворимые в вышеперечисленных биполярных амидных и сильных кислотных растворителях и обладающие приведенной вязкостью О,5%-ных растворов в органических растворителях, равной, по меньшей мере, дл/г. Циклизацию поли-(о-амино)амидов в поли-(о-амино)бензимидазолы можно осуществить как. терг-шчески в твердой фазе, так и химически в растворе,однако, термическая циклизация поли-(о-амино)амидов приводит к образованию поли-(о-амино)бензимидазолов, растворимых только в сильных кислотных растворителях, в то время, как химическая циклизация приводит к получению полимеров, обладающих свойствами идентичными свойствам поли-(о-амино)бензирФ1дазолов, полученных выиеописанным совмещенным способом. Последующую стадию процесса - ацилирование поли-(о-амино)бензимидазолов с образованием поли-(о-амидо) бензимидазолов - можно осуществить любыми монокарбоновыми кислотами или их производными, наиболее предпочтительны№1 среди которых являются галоидаигидриды и ангидриды, обладающие наиболее высокой реакционной способностью. Превращение поли- (о-амино) бензимидазолов в поли-(о-амндо) бензимидазолы наиболее целесообразно осуществлять обработкой полимерных растворов поли-(о-амино)бензимидазолов в среде апротонных амидных растворителей галоидангидридами или ангидридами монокарбоновых кислот в условиях низкотемпературной конденсации При этом получаются высокомолекулярные поли-(о-амидо)бензимидазолы, полностью растворимые в вышеупомянутых биполярных апротонных и сильных кислотных растворителях и обладающие приведенной вязкостью О,5%-ных растворов в органических растворителях ранкой, по меньшей мере, 0,55 дл/г„ .По данным динамического термогравиметрического анализа полностью ароматические поли-(о-амидо)бенэимидазолы теряют 10% от первоначального веса в температурном интервале 350SVO C, а затем устойчивы до 550с. Эти результаты указываютна то,что при температуре выше 350 С протекает твердофазная поллциклодегидратация поли-(о амидо)бензимидазолов с
образованием полибеизимидазолохиназо линов, что подтверл-гдается также данными спектральных и элементного анализов. На основе полк-(о-ам- до) бензимидазолов получаются серыер прозрачные и эластичные пленки, обладающие прочностьЕО па разрьззрравной,
по меньщей мере, 800 г/см;
25°С. при
Последнюю стадию процесса - превращение поли- (о--амило) бензимидаэолов в полибеизимидазолохииазолины - можно осуществить тер.лчеслсл или каталитически, Kair в твердой фазе,так и в расплаве или в растворе (наиболе предпочтительны.м них является хи ми че с ка я поли ци тело да ги др ат ацн я поли- (о--амидо) бенэимидазолов в сре,пе апротонных a тидныx растворителей, в присутствии хлористого водорода). При этом образуются вглсокомолекулярные поли бен 3 ими дазоло хи и аз оли в ы/ полностью pacтвopи Me в диметт-глформамиде, ,циметилацета№-5де, диметилсульфо ;сиде, N-метилпирролидоне,сульфолане, м-крезоле, смеси тетрахлорэтана с фенолом (3:1), хлорированных фенолах, а также в г-гуравьино8, трифторуксусной, монохлоруксусной и серной кислотах с образованием выско концентрированных растворов. Приведенная в я экое т ь О , 5 % - н ы ; р а с т в о ров полибензимидазолохиназо.пинов в органических растворителях равняется, по меньшей мере, 0,7 дл/г,
На основе полибензимидазолошназолинов получаются серые,, прозрачные и эластичные пленки, обладаюшие прочностью на разрыв, равной, по. меньшей мере, 1000 кг/см при .
Полученные поли бен з иь-м дазоло хин азлины обладают высокиг-я- TepMK4ecKH vsi.t характеристиками - полностью ароматические полимеры не теряют в весе, согласно данным .5чаского и тер-могравиметрического
а н ал и 3 а и а. в о з духе, до 550 С, а полимеры,
включающие алифатические фрагмег5ты -- до .
Проведение процесса гюлициклодегидратации поли-(о амидо)-бензимидазлов в среде сильных кислотных растворителей типа муравьиной, монохлоруксусной, полифосфорной и других кислот при 150-200 с приводит ; образованию полибен3имидазолохиназОЛИнов, обладающих свойствами, идентич. ными свойствам полибензир.дадазолохин™ азолинов, получеЕшых в результате химической полициклодегидра:гации поли-(о-амидо)бензимидазолоз в среде апротонных растворителей в присутствии хлористого водорода.
В отличии от раздельного способа получения полибензимидазолохкиазалинов совмещенный способ синтеза указанных полимеров наиболее доступно осуществить путем проведения всех вьаиеперечиелейных стадий nposj,ecca в
среде N-метклпирролидона без выделения промежуточных полимерных продуктов, образовавшихся на первых трех стадиях процесса, т.е. в реакционный раствор поли-(o-HHTpojамида, полученный на первой стадии процесса полгимидирозания в среде N-метилпирролидона, вводят восстановленное железо при непрерывном насыщении реакционной смеси хлористым водородом и процесс проводят при }60°С до полного израсходования железа (3ч). После окончания процесса восстановления реакционный раствор полученного таки образом полк-(о-амино)бензимидазола оклажд ают до и доводят путем rjведения акцептора хлористого водоро.да (например триэтиламина) до нейтральной реакции (рН равно 7) .
Превращение поли-(о-амино)бензимиазола в поли-(о-амидо)бензимидазол осуществляется введением в реакционную смесь поли(о-амино)бензимидазола 2 молей ацилир тощего агента, (например х/гористого бензоила) в расчет на элементарное звено поли-(о-амйно) бензимидазола и процесс ацилирования продолжают еще 3 ч при 25°С. По окончании процесса ацилированияреакционную смесь полученного таким образом поли-(о-амидо)бензимидазола доводят путем введения кислоты (например HCft) до слабокислой реакции (рН 5) при 25°С. Циклодегидратацию поли-(о-амидо) бeнзи лидaзoлa до поли бе н зи ми дав о ло хин аз о ли на пpoвo Jят при в течение 5-6 ч.
Полученные таким образом полибей з и ми дазоло хин аз оли ны обладают свойствами, идентичными свойствам поли бен 3 и дазоло хин а во ли но в, полученных раздельным способом.
Синтезированные промежуточные полимерные продукты и поли бензимидазолохиназолины характеризуются по приведенной вязкости их раствором в органических растворителях, УФ- и ИК-спектрам, сравнением спектральных характеристик со спектрами модельных соединений и полимеров, полученных независи «л ли метода -с1, данным элеменного ан.ализа, результатам динамического и изотер№1ческого анализа, а также .свойствам пленок полученных на их основе.
П р я мер 1 .
loJ
в трехгорлую колбу емкостью 150 к-ш, снабженную мешалкой и вводом для инертного газа, загр ткают 2,902 г (0,01 моль) бис-(З-нитро-4-аг-гинофен} л)-оксида и 15 мл свежеперегнанного Н-метил-2-пирролидона, При перемеитвании в токе инертного
газа при -5С к реакционному раствору в течение 30 мин прибавляют 2,930 г (0,01 моль) дихлораи гидрида 4,6-динитроизофталевой кислоты, а затем снимают охлаждение и температура реакции самопроизвольно поднимается до 25с. Реакционный раствор перемешивают при 25°С в течение одного часа и выливают его в 500 мл дистиллированной воды, получая оранжевые волокна, которые отфильтровывают, промывают водой до отрицательной реакции на ион Ct, экстрагируют метанолом и сушат в вакууме при 100 С до постоянного веса. Выход полимера количественный. Приведенная вязкость 0,5%-ного раствора полимера
при 25°С в N-метилпирролидоне 0,73 дл/г.
В ИК-спектре полимера содержатся максимумы поглощения в областях 3300-3200 и 1670 см , характерные ДЛЯ NH и СО групп амидной связи и максиму№й поглощения в областях 1550 и 1350 характерные для NO группы.
Полученный поли-(о-нитро)-амид-. растворяется в таких органических растворителях, как N-матилпиррояидон,-диметилформамид, гексаметилформамид, диметилацетамид, диметилсульфоксид, сульфолан и сильных кислотных растворителях.
П р и м е р ,, 2.
в трехгорлую колбу емкостью 500 мл, снабженную мешалкой и термометром, загружают 3,823 г (0,01 моль бис-13-нитро-4-аминофенил -гидрохинона, 100 мл сухого сульфолана и при интенсивном перемешивании прибавляют 2,8 мл (0,02 моль) триэтиламина. Затем к полученному реакционному раствору добавляют за один прием 3,412 г (0,01 моль) дихлорангидрида бис-(З-нитро-4-карбоксифенила) при 25с. Перемешивание продолжают один час и реакционный раствор полученного поли-(о-нитро)амида-11 выливают в 1,0 л дистиллированной воды. Промавку и сушку полимера осуществляют аналогично методике, описанной в примере 1. Выход полимера 92% от теоретического. Приведенная вязкость 0,5%-ного раствора поли- (о-нитро-) амида-11 в N-метилпирролидоне 0,81 дл/г.
, ИК-спектр полимера аналогичен ИК-спектру поли-(о-нитро)амида-1 описанного в примере 1.
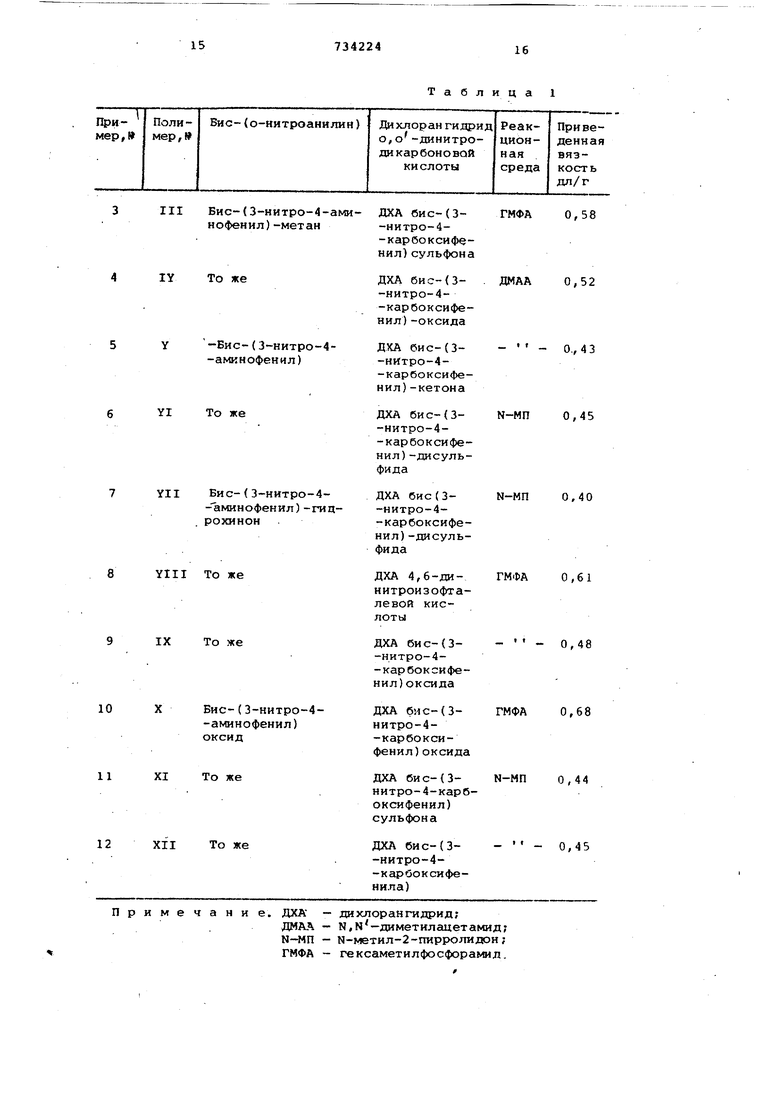
Примеры 3-12. ;По методике описанной в примере 1, ;синтезированы 10 поли-(о-нитро) амидов (11Г основе 0,01 моль бис(о-нитроанилина) и 0,01 моль ди хлорангидрида о,о -динитродикарбоновых кислот. Выходы полимеров во всех случаях количественные.- ИКспектры синтезированных полн-(онитро) амидов аналогичны ИК-спектру полимера, описанного в примере 1.
Условия синтеза полимеров и в язкостные характеристики 0,5%-ных растворов полимеров в N-метилпирролидоне приводятся в табл.1. Пример 13.
5,0 г поли-(о-нитро)амида-1, описанного в примере 1, растворяют в 30 мл N-метилпирролидона при перемешивании и прибавляют 10 г восстановленного железа, затем реакционную смесь насыщают газообразным нес с постепенным увеличением температуры реакции от 25 С до 180с. При этой температуре реакционную смесь выдерживают до полного израсходования железа (3 ч). По окончании процесса восстановления реакционную массу разбавляют 30 ил лиаметилформаьотда и охлаждают ее до 60 С. Вь деление и сушку пояидера осуществляют аналогично методике, описанной в примере 1. Выход полимера количественный. Приведенная вязкость 0,5%-ного раствора полимера в N-метилпирролидоне при 1,04 дл/г.
ИК-спектр поли-(о-амино)бензимидазола-Га содержит максимумы поглощения в областях 3300-3500 см (дублет), характерные для Н группы, и в области 1610 см, характерный для группы бензимидазольного цикла, соответственно, .исчезают максимуг .поглощения характерные д.пя - NOj
групп и амидных связей.
Полученный таким образом поли-{б-a ssHO) бензиг-.тадазол 1а растворяется в биполярных зпротоннык и сильных кислотйах растворителях, перечисленных в примере 3. .
A-.CO-HN-/
5fO г поли-(о-нитро) а 1ида-11, описанного в примере 2, 50 мл ди 5eтилацетамЗТда и каталитическое количество Ni Ренея Эс1Гружагот в автоклав и под давлением молекулярного водорода {..20 ат) проводят процесс восстаповленяя пгри в течение .10 ч По окончании процесса восстановлеиин реакционнузо смесь отфильтровывают от -катализатора выделение и сушку полимера осуществляют аналогично методике, описанной в примере 1 --,
Выход полимера количественный. Вязкость 0,5%-ного раствора поли- (o-a№i -«o) амида в М метилпирролидоне при 2 5 С 0,5 4 .ЦП / г.
КК-спектр полимера содержит максимумы ipynrrn поглощения в областях 3300-3500 см, характерные для NH
Из 20%-Hort) раствора полимера в ЛЛметилацетамиде получают прозрачные, эластичные пленки, имеющие поочность на разрыв 960 ккг/см при 25°С.
Пример i4. Шг HjN
группы; сохраняется максимум поглощения и в области 1650 см, ответственный за амидную связь, и исчезают полосьа поглощения, характерные для НО групгш.
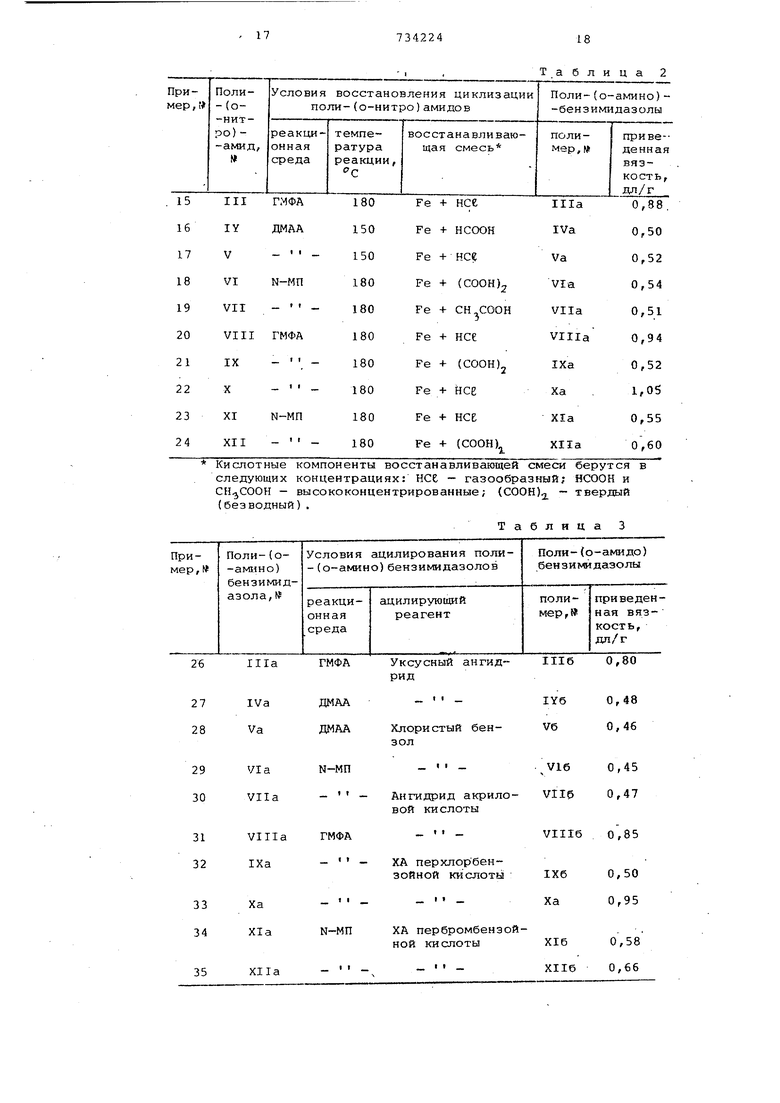
При меры 15-24, По методике описанной в примере 13, синтезированы 10 поли-(о амино)бензимидазолов
{Illa-XIIa) на основе поли-(о-нитро)-амидов (III-XII), описанных в примерах 3-12, соответственно (см. табл.1).
Выходы полимеров во всех случаях
количественные, ИК-спектры синтезированных поли-(о-амино)бензимидазолов и приведенные вязкости 0,5%-ных растворов полимеров в N-метилпирролидоие даются в табл.2.
25.
В трехт-орлую колбу, емкостью 150 мл- снабженную мезиалкой и термометром, эаго -окают 5,0 поли-(о-амино) бензим-|дазола 1а и 50 мл Н метилпирролилона, ес41щионную смесь перемеиизают до образования го «югенного раствора, а затем добавляют 2,82 мл свежеперегнанного хлористого бензоила.. Реакции) проводят при комнатной температуре ( в течение 34 ч„Выделение и сушку полимера осущес.гвляют анапогично методике описанной в.примере 1, Выход полимера количественный. Приведенная вязкость О, 5%-Е-юто раствора noj-шмера в М-метилпирролидоне 0,96 дл/г,
В ИК-спектре полимера содержатся MaKCHMyivffij поглощения в областях 3300 3200f 1670, 1550 и 710 см , характерные для аг-лидкой связи, соответственно исчезают максимумы поглощения.: характерные для первичной aivaiH о группы.
Полученный поли-(о-амидо)бензиМ11йазол 1бг растворяется во всех биполярных апротонных и сильных кислотных растворителях, перечисленных в примере 1. Из 20%-иого раствора, пг-чмера в ; иметилацетамиде получают серые, прозрачные и эластичные пленки, обладаюище прочностью на разрыв 870 кг/см .
В ИК-спектре поли-(о-амидо)бензимндазола 1б, подвергнутого термической обработке в вакууме (остаточное давление .рт.ст.) в температурном интервале 350-З70с в течение б ч, содержится макснь гум поглощения в области 1380 см характерный для третичного атома азота; соответственно, исчезают полосы поглощения,
ответственные за NH бензимидазола и а№1дную связь,
Полибензимидазолохиназолин, полученный твердофазной полициклоде- , тодратацией поли-(о-амидо)бензиьаддазола-1б, растворяется только в сильных кислотных растворителях и обладает приведенной вязкостью Ор5%-но1Х) раствораполимера в Н SO. при 25°С равной 0,96 д;1/г.
Примеры 26-35, По мэтодике,
описанной в примере 25, синтезированы 10 поли-()бекзимидазолов (III6-XII0) на основе поли-(о-амино)бензимидазолов (Ills-XTia),описанных
в примерах 15-24 (см.табл. 2) ./
Таблица 1







| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения поли-(-2-замещенных) хиназолонов | 1977 |
|
SU702036A1 |
| Способ получения полиамидобензимидазолов | 1978 |
|
SU717090A1 |
| Способ получения политриазолохиназолинов | 1977 |
|
SU734223A1 |
| Способ получения полихиназолинхиназолонов | 1978 |
|
SU749857A1 |
| Способ получения поли-(1,2-дизамещенных)-бензимидазолов | 1976 |
|
SU652193A1 |
| Способ получения полибензимидазолов | 1976 |
|
SU619493A1 |
| БИС-(3-АМИНО-5-ФЕНОКСИ)ФЕНИЛОВЫЙ ЭФИР ГИДРОХИНОНА И ПОЛИИМИДЫ НА ЕГО ОСНОВЕ ДЛЯ ТЕРМОСТОЙКИХ МАТЕРИАЛОВ | 1994 |
|
RU2072350C1 |
| Способ получения полибензоксазолов | 1977 |
|
SU663699A1 |
| Способ получения полибензимидазолимидов | 1978 |
|
SU749859A1 |
| Способ получения полиамидокислот и каталитическая композиция для получения полиамидокислот | 1979 |
|
SU920057A1 |

III Бис-(3-нитро-4-аминоФенил)-метан
1У То же
-Бис-(З-нитро-4-амкнофенил)
YI То же
YII Бис-(З-нитро-4- аминофенил) -гидрохинон
Y1II То же
IX То же
Бис-(З-нитро-410
-аминофенил)
оксид
То же
XI
11
XII То же
12
Примечание. ДХА - дихлорангидрид;
ДМАА - N,N-диметилацетамид; - N-мeтил-2-rп ppoлидoн; ГМФА - гексаметилфосфорамил.
ГМФА 0,58
. ДМАА 0,52
- - 0., 43
N-МП 0,45
N-МП 0,40
ГМФА 0,61
- - 0,48
ГМФА 0,68
N-МП 0,44
- - 0,45
Кислотные компоненты восстанавливающей смеси следующих концентрациях: НСе - газообразный; - высококонцентрированные; {СООН) - (безводный).
ГМФА
Ilia
26
I I
XII а
35
Таблица 2
Табли
0,80
III6
ангид0,48
IY6 0,46 V6
бен V160,45
VII60,47
VIII60,85
1X60,50
Ха0,95
XI60,58
XII60,66
А,В,В,Г,Д,Е
А/Н,Б/Н,Г,Д,Е
А/Н,Б/Н,Г,Д,Е,
Г,Д/Г,Е
Г,Д/Н,Е
А,Б,В,Г,Д,Е
А,Б,В,Г,Д,Е
А,Б,В,Г,Д,Е
А,Б;В,Г,Д,Е
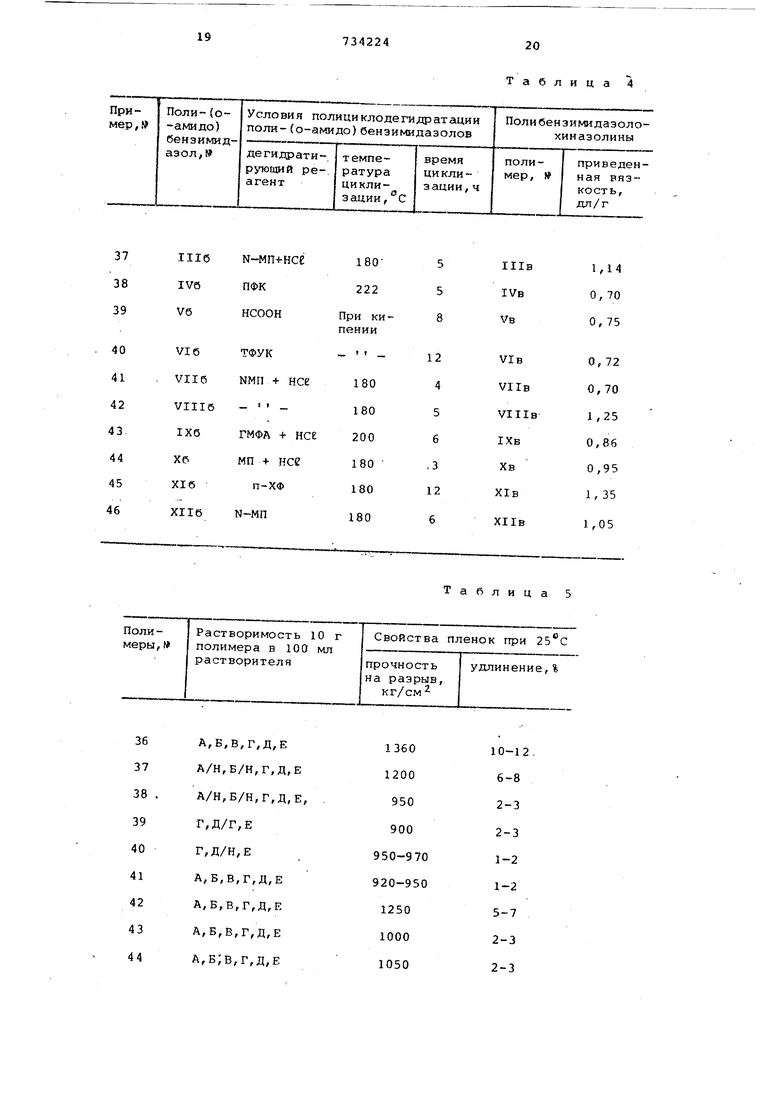
Таблица 4
Таблица 5
Авторы
Даты
1980-05-15—Публикация
1977-11-21—Подача