(54) СПОСОБ ПОЛУЧЕНИЯ ЭРГОЛИН- -ИЛ-АЛКИЛЭФИРОВ, ТИОЭФ№ОВ И АМИДОВ ПРОСТАНОВЫХ КИСЛОТ Изобретение относится к способу получения новых производных простановых кислот, в част ности к способу получения эрголин-8-ил-алкш1эфиров , тиоэфиров или амидов простановых кислот общей формулы I где D - группа формулы А - имидазол-1-ил, l, 2, 4 -триазол-1-ил, пиразол- -ил,пурнн-7-ил; пурин-9-ил или 6 -димет11лам1Шопур1Ш-9 -ил, X - СНг-СНа- или (транс)-СН СН; у CHz-CHj или (цис или трас)-СН СН, Z - СН2 -СН или (цис или транс) -crf RI - алкильная группа с 1-8 атомами утлерода или 11иклогексш1ьная группа; R2 - водород или метильная грушш; и R4- независимо друг от друга водород или алканоильная группа с 1-8 атомами углерода; - кислород, сера или группа -NH-, а R - ;алкйлэрголиновая часть, представ ляющая собой остаток формулы TI где n - 1 или 2, RS- водород или метильная группа, 10 независимо друг от друга водород бром или хлор; R7 - метильная группа; Rg и - соответственно водород, или Rj и Яд вместе образуют связь, или Rg- водород, а R9 - метоксигруппа. Соединения формулы Т обладают ценными фармакологическими свойствами. Известны сложные эфиры простановых кис лот формулы . Ri-eoOR А-еен-(енг)п-снз но/ В5 R«f где R - алкил Cj-Cj2, Rj - СН2-СН2-, один из R2, RS водород, а другой ОН или R2 RS вместе образуют оксогруппу, А- Сн С - или - (Js d-1. I R4 и RS - водород, a другой ОН, один из водород, алкил Cj-С4, R6 n 3 или 4, обладающие ценными фармакологическими свойствами. Цель изобретения -.расширение ассортиме производных простагландинов, обладающих фа макологической активностью. Цель достигается описываемым способом, заключающимся в том, что соедине1ше формулы 1П, Z имеют указанны где D, R, значения, или их реакционноспособные кислотные прои водные подвергают реакции обмена с соедине ями формулы IV H-WR .(IV), где R и W имеют указанные значения, после чего целевые продукты выделяют извес тными методами. Способ может осуществляться известным получения зфиров, тиоэфнров и амидов прос новой кислоты методом. Реакционноспособно кислотное производное простановой кислоты получают с применением карбонилдиимидазол Для активирования особенно гидроксиалкилз голина или тиоалкнлэрголияа предпочгетелыю обавляют каталитические количества раствора мидазолнатрия в тетрагидрофуран. При приме-, нении соединения формулы III, где D-D2, имеет место присоединение образовавшегося имидазола при образовании соединения формулы Г, где D - Dg и А - имидазол-1-ил. Для получения соединений формулы 1, где D-Dj и для возможнсяго получения амидов применяются преимущественно другие реактивные кислотные производные, например, -2-тиопиридила. Применяющиеся в качестве исходных соединений соединения формулы 111 а Y- 7,-do ОН ...R. OR 3 R г где A, RI, R2/ RB- X, Y и Z имеют указанные значения, можно получить реакцией замещения соединений формулы ГП б где RJ , R2, RS. X, Y и Z имеют указанные значения, с aминa ш, вводящими остаток А. Способ можно осуществлять известным образом. Реакция замещения проводится при 040°С, целесообразно при комнатной температуре, в среде инертного органического растворителя. В определенных случаях, например при замещении пурином, имеет место изомеризация амина, так что получаются два конечных продукта формулы ТПа (см. пример 4). Необходимо подчеркнуть, что упомянутые способы обьино осуществляют при применении чистых исходных соединений и реагентов, например обезвоженных. Способ желательно осуществлять в атмосфере азота. Простагланд1ип 1 очищают известным способом. Встречающиеся в виде свободных оснований соединения формулы Т и соединения формулы 1П, где D-Dft, могут переводиться в их аддитивные соли и наоборот. Из пригодных для образования солей кислот можно назвать винную и метансульфоновую кислоты. Простагла1здины; могут быть в рацемической форме или в одной из двух оптически активных форм. Оптически активные формы могут быть получены известным способом, например, из оптически активных исходных соединений. Эрголин-8-нл-алкиловые эфиры, тиоэфиры и амидь простановых кислот имеют лучшие фармакологические подобные простатандину свойства, чем соответствующие простановые кислоты. Они, в частности, способствуют понижени артериального давления крови. Кроме того, эрголин-8-ил-алкиловые эфиры тиоэфиры и амиды простановых кислот, в част ности, где D-Dg, задерживают развитие тромбоцитопении. Соединения формулы ГПа также способств ют понижению артериального давления крови и задерживают развитие тромбоцитопении в указ ных для эфиров, тиоэфиров и амидов дозах. Пример l.llalB 8-Дш-идрокси-9-кето-13-транс-дигидроизолизергиламид простано вой кислоты. Раствор 150 мг чистого гфостагланд11на EI добавляют в 4 мл абсолютного диметилфррмам да с 76 мг карбонилдиимидазола и помешиваю в атмосфере азота при комнатной температуре 3,5 ч. Затем туда добавляют 130 мг мелкопорошкового дигидроизолизергнламина. После 7 дней перемешивания при комнатной температур растворитель выпаривается при комнатной температуре и высоком вакууме -и маслянистый осадок хроматографируется на 250 г сефадекс LH 20 (Sephadex LH 20) с хлористым метиленом при добавлении 1% метанола, причем полу чают требуемое соединение. ИК: 1740, 1660, 1520 смЧ Свободное основание реакцией замещения с метансульфоновой кислотой переводится в сульфонат метана. Получение зфиров формулы I. Аналогично примеру 1 и при применении соответствующих простагландинов формулы TII и соединений формулы IV, где W - кислород, которые добавляются вместе со свежеприготовленным каталитическим количеством раствора имидазол-иатрий в тетрагидрофуран, получают следующие эфиры формулы 1: а)9а, По, 155-тригидрокси-5-ш1с, 13-транс лизергилэфирпростадиеновой кислоты, т. пл. гидротартрата 117-120°С; б)На 155-дипвдрокси-9-кето-13-транслизергилэфир простановой кислоты, т. пл. гидротартрата 158-160°С; в)дигидролизергилэфир Па 158-дигидро-9-кето-13-транс-(2 , 13 -дибромо) простановой кислоты, ИК: 1740 (широкий); г)лизергилзфир Па 153-дигидрокси-9-кето-5-цис, 13-транс--простадиеновой| кислоты, ЙК: 1740 см (широкий); д)Па 155-дигидрокси-9-кето-13-транс(1 -метил) лизергиловый эфир простановой кислоты, ИК: 1740, 1735 (ш1ечо/см ); е)На 155-дигидрокси-9-кето-13-транс-(10а -метокси)дитидррлиз€ргилэфир простанов кислоты, ИК: 1740 (широкий); ж)Нее, 153-дигидрокси-9-кето-13-транс-2-2 -хлоро-б -метилэрголин-8 -ил-этиловый эфир ( простановой кислоты, ИК: 1740, 1735 з)Па 155-дигидрокси-9-кето-15-метил-23-транс- (-) -метилен-13-транс-лизергилэфир простановой кислоты, ИК-: 1740, 1930 и) Па , 158-дигидрокси-9-кето-15-метил-5-цис, 13-транс, лизергилэфир простадиеновой кислоты, ИК: .1745, 1735 (плечо) к) По:, 153-дигидрокси-9-кето-лизергилэфир простановой кислоты, ИК: 1740 (широкий) л) Пес, 15Р1-дигидрокси-9-кето-16Н-метил-5-цис-лизергилэфир простановой кислоты, ИК: 1740, 1735 (плечо) м) На, 15П-дигвдрокси-9-кето-16Р-метил-2,3-транс- (+) -метнлен-5-цис-лизергилэфир простановой кислоты, ИК: 1740, 1735 (плечо) н) 15-щ« логексил-11а, 15В-дигидрокси-9-кето-16,17,18,19,20-пентанор-5-цис-лизергилэфир простановой кислоты, ИК: 1740 (широкий) о) Па, 15В-Д1Пидрокси-9-кето-16Р-метил-23-транс- (-) -метилен-5-цис-лизергиловый эфир простановой кислоты, ИК: 1740, 1735 (плечо) . Аналогично примеру 1 и при применении простагландинов формулы 111, где D-D2, или соответствующих простагландинов формулы 111, где D-Dg, и соответствующих соединений формулы IV, где W - кислород, вместе с каталитическим количеством раствора имидазол-нат{жй в тетрагидрофуране: аа)153-гидрокси-11а-имидазол-1 -ил-9-кето-5-цис, 13-транс-лизергилэфир простадиеновой кислоты, ИК:3450, 1740,1730 аб)15Н-гвдрокси-11а-имидазол-1- ил-9-кето-5-цис, 13-транс-лизергилэфир простадиеновой кислоты, ИК: 3550, 3450, 1745-1740 ав)155-гвдрокси-11о:-имидазол-1 -ил-9-кето- 13-транс-лизергилэфир простановой кислоты, т. пл. гидротартрата 104-106°С; аг)155-гидрокси-Па-имидазол-1 -ил-9-кето-5-ш1с-,13-транс-дигидроизолизергш1эфир простадиеновой кислоты, ИК 3450, 1740, 1720, 1500 ад)158-гидрокси-Па-имидазол-1 -ил-9-кето5-дис, 13-транс(2 , 13-дибромо)-дигидролизергилэфир простадиеновой кислоты, ИК: 3450, 1740, 1715, 1500 ае)158-гидрокси-9-кето-Па - l, 2, 4 -триазол-l -Ш1-5-ПИС, 13-транс-лизергш1эфир простадиеновой кислоты, ИК: 1740, 1720 аж)15П-гидрокси-11о;имидазол-1 -ил-9-кето16П-метил-5-цис-лизергш1эфир простановой кисоты, ИК: 1740, 1720, 1500 аз)158-гидрокси-11а -илшдазол-1 -ил-9-кето-5-Щ1С, 13-транс-(1 -метил)-лизергилэфир простаиеновой кислоты, ИК: 1740, 1725 аи) 15-циклогексил-15Я-гилрокси-11о -нмиазол-1 -ш1-9-кето-16, 17, 18, 19, 20-т1ентанор774179-5-цис, 13-транс-лизергилэфир прсктадиеновой. киспоты, ИК: 1740, 1720 ак) 15В-гидроксй-11о -имидазол-1 ил-9-кето-16В-метил-2,3-транс-()Метилен-5-цис-лизергилэфир простановой кислоты, ИК: 1740, 1720 ал) 155-гидрокси-11а-имидазол-1 ил-9-кето-13-транс-(2, 13-дибромо)-дигидролизергилэфир простановой кислоты, ИК: 1740, 1715, 1500 ам) 15В-гидрокси-11а-имидазол-l-Ш1-9-кето-5-ЦИС-, 13-транс-дигидроизолизергилэфир проста- ю диеновой кислоты, ИК: 3450, 1740, 1720, 1500 . Получение тиоэфиров формулы I. Аналогично примеру 1, но при гфименении is соответстеующих прост гландинов и пригодных тиолов формулы IV вместе с каталитическим количеством раствора имидазол-натрий в тетрагидрофуране получают следующие соединения формулы 1:20 ба)Па, 158-дшидрокси-9-кето-13-транс-лизергилтиоэфир простановой кислоты, ИК: 1740, 1695 бб)15S-гидрокси-11а-имидазол-l-ил-9-кето-5-цис-13-транс-лизерпштиоэфир простадиеновой 25 кислоты (исходя из простагландина Aj), ИК: 1740, 1700 . Получение амидов формулы Т, Аналогично примеру 1, однако, при примене- JQ НИИ пригодных простагландинов и пригодных аминов формулы IV получают следующие соединения формулы 1: ва)На, 155-дигидрокси-9-кето-13-транс-лизергиламид простановой кислоты, ИК: ,. (СН2 СВг + СНзОН): 3400 (щир.), 1740, 1660, 1520 вб)На, 153-дигидрокси-9-кето-13-трзнс-дигидролизергиламид простановой кислоты, ИК: 1740, 1665, 1520 40 вв)На, 155-дш-идрокси-9-кето-13-транс-2-(б-метилэрголин-8 |3-ил)-этиламид простановой кислоты, ИК: 3400, 1740, 1660, 1520 вд)9а,11а, 155-тригидрокси-5-щ1с, 13-транс-лизергиламид простадиеновой кислоты, ИК: 1660, 1520 ве)На, 153-дигидрокси-9-кето-лизергиламид простановой кислоты, ИК:. (СН2СЕ 2 СНзОН) : 3400 (шир.), 1740, 1660, 1520 . вж)155-гидрокси-9-кето-5-цис, 13-транс-ли- j зергиламид, простадиеновой кислоты, ИК: 1740, 1660, 1520 вз)155-падрокси-11а-имидазол-1 -ил-9-кето-5-цис, 13-транс-(-метил)-лизергиламид простадаеновой кислоты, ИК: 1725, 1660, 1520 ви) 155-гидрокси-11а-имидазол-1-ил-9-кето-5-цис, 13-транс-2-(б-метил-эрголин-8 ил) этиламид простагщеновой кислоты, ИК: 1725, 1668,1525 8 вк) 158-ацетокси-Иа-имидазол-Г-ил-9-кето-З-цис, В-транс-лизергиламид тфостадиеновой кислоты, ИК: 1730 (широкий), 1660, 1520 вл) 155-гидрокси-11а -имидазол-1-ил-9-кето-5-цис, 13-транс-лизергиламид простадиеновой кислоты, ИК:3450, 1740, 1665, 1520см ; вм) 15S-гидрокси-На-имидазол-1-ил-9-кето-13-транс-лизергиламид простановой кислоты, ИК 1725, 1665, 1525 , причем для полимеров вж) до вм) применяется пригодный простагландин формулы Т, где D-Dj. При применении описанного в примере 1 способа получают следующие эфиры, тиоэфиры и амиды формулы Г, где часть R означает лизергил, дигидролизергил, изолизергил, дигидроизолизергил, 2-бромлизергил, 13-бромдигидролизергил, 13-дибромгидролюергш1, Юа -метоксидигидролизергил, Юл-метоксидигидроизолизергил, 2,13-дибром-10а-метоксидигидролизергил, 2- или 13-бром-10о -метоксидигидролизергил, а часть простановой кислоты имеет следующие значения: 16,16-диметил ПГЕ2, 16,16-диметш1 ПГФ2, 15-метш1 ПГЕг, 15-метил ПГФ2(Л. 16R и S-метил-13,14-дигидро ПГЕз; 11-дезокси-ПГЕ2, их 15-эпи-изомер, а также их 5,6-дигидро- и 5, 6, 13, 14-тетрагидропроизводное; ПГЕ2, его 15-эпи-И9Омер, а также его 5,6-дигидро- и 5, 6, 13, 14-дигидропроизводное, ПГФцд, его 15-эпиизомер, а также его 13, 14-дигидрбпроизводное. Пример 2. 155-Гидрокси-9-кето-5-щ1с, 10-цис, 13-транс-лизергш1амид простатриеновой кислоты: а) 159 мг простагландина А2 и 167 мг 2,2-дитиодипиридина и 199 мг трифенилфосфина в 5 мл ксилола перемешивают при 20°С 24 ч. После выпаривания растворителя осадок разделяют путем хроматографии на 100 г Сефадеке LH 20 с хлористым метиленом +2% метано З причем получают 2-тиопиридилэфир простагландина А2; б) 131 мг простагландина А2 -2-тиопиридилэфира при 20°С перемешивают 24 ч с 93 мг лизергиламина в 5 мл тетрагидрофурана. Реакционную смесь разделяют путем хроматографии на 100 г Сефадекс LH 20 с хлористым метиленом +0,5% метанола, причем получают требуемое соединение, ИК: 3450, 1730, 1710 . Аналогично примеру 2 получают: а) 15 3-гидрокси-9-кето-10-цис, 13-транс-дигидролизергиламид простадиеновой кислоты, ИК: 3450, 1705, 1665, 1520 б) 15Н-гидрокси-9-кето-16Р-метил-2,3-транс-(-)-метилен-5,10-цис-лизергиламид гфостадиеновой кислоты, ИК: 3450, 1700, 1665,1520 а также соединения согласно примерам 1 и 1 ва (до вж). Пример 3. Аналогично примеру 1 получают следующие соединения:
.а) 158-гидрокси-9-кето-5-цис, 10-цис-13-тран-лизергилэфир простатриеновой кислоты, ИК; .3450, 1730, 1710 см-;
б)15Р-гидрокси-9-кето-5-цис, 10-цис-, 13-транс-лизергилэфир простатриеновой кислоты, ИК: 3560, 3350, 1720, 1695, 1600
в)155-гидрокси-9-кето-5-цис, 10-цис, 13транс-дигидролизергилэфир простатриеновой кислоты, ИК: 3555, 3350, 1730, 1705 см .
Исходные соединения формулы III.
Пример 4. 155-Гидрокси-9-кето-11а пурин-7 -ИЛ-5-ЦИС, 13-транс-простадиеновая кислота и 155-гидрокси-9-кето-11о;-пурин-9-ИЛ-5-ЦИС, 13-транс-простадиеновая кислота.
356 мг чистого простагландина А7 н 127 мг пурина растворяют в 4 мл абсолютного диметилформамида и выдерживают 6 нед при комнаной температуре, причем течение реакции контрлируется с помощью тонкослойной хроматографии на фольге кизельгеля (пропускные средств , 20% СНзОН+1% ледяной уксусной кислоты) . После полного замещения диметилформамид выпаривают при комнатной температуре и высоком вакууме, а полученный осадок разделяют путем хроматографии на 80 г Сефадекс LH 20 хлористым метиленом +1% метанола, за счет чего достигают разделения на смесь Па-пурин-7-ил- и Па-пурин-9-ил-производных (смесь а) и смесь П-а -пурин-9-ил-производного и простагландина А-2 (смесь б).
Смесь а) дважды разделяют путем хроматографии на Сефадексе, причем извлекают 15S-гидрокси-9-кето-11а -пурин-7 -ил-5Цис, 13-транс-простадиеновую кислоту как таковую с ярко выраженной полярностью, ИК: 1745, 1705, 1600, 1560 см-.
Изолирование 155-гидрокси-9-кето-11 а-пури-9-Ш1-5-ЦИС, 13-транс-простадиеновой кислоты.
148 мг указанной смеси б) смешивают с 23 мг имидазола и выдерживают 1,5 ч при-комнатной температуре. Затем продукт реакции растворяют в 100 мл хлористого метилена и взбалтывают с 20 мл 0,01 н. хлористоводородной (соляной) кислоты. Органическую фазу отделяют, высушивают, фильтруют и выпаривают, причем получают чистое заданное соединение, ИК: 1745, 1705, 1600, 1530, 1500 П р и м е р 5. 155-Гидрокси-11а-имидазол-1 -ил-9-кето-5цис, 13-транс-простадиеновая кислота.
315 Мг простагландина АЗ, а также 96 мг имидазола соединяют в 3 мл хлористого металена, так что получают прозрачный раствор, после выпарива1шя растворителя при комнатной температуре осадок выдерживают при комнатной температуре 3 дня и продукт реакции разделяют путем хроматографии на 100 г Сефадекс LH 20 хлористым метиленом +1% метанола, причем получают заданное соединение , ИК: 3350,3300, 1740, 1710, 1695 (плечо), 1600 .
УФ: 208 им (-6500), 276 им (-800). Аналогично примеру 5 получают:
а)155-гищ)окси-Па-имидазол-1 -ил-9-кето-13-транс-простановую кислоту, ИК: 3450, 1740, 1695 (плечо)
б)155-гвдрокси-9-кето-11а -l, 2, 4, триазол-l -Ш1-5-цис-13-транс-простадиеновую кислоту ИК: 1745, 1705, 1505,
в)158-гидрокси-9-кето-Па-шфазол-1 -ил-5-цис, 13-транс-простадиеновую кислоту, ИК: 1745 1705, 1505 (малый, );
г)15 В-гидрокси-9-кето-1 la- (6 -диметилами но)-пурин-9 -ИЛ-5-ЦИС, 13-транс-простадиеновую кислоту, ИК: 1745, 1705, 1600,1560
д)15Р-гидрокси-Пог -имидазол-1 -ил-9-кето-5-цис, 13-транс-простадиеновую кислоту, ИК: 1740, 1700, 1500 см-;
е)16,16-диметил-16П-гидрокси-11а -имидазол-1 -ил-9-кето-23-транс-(-)-метилен-5-цис, 13-транс-простадиеновую кислоту, ИК: 1740,
1700
ж)15 S- гидрокси- 9-кето-11 а- (6 -диметил амино-пурин-9 -ИЛ-5-ЦИС, 13-транс-простадиеновую кислоту, ИК: 1745, 1705, 1600, 1565
з) 11Н-гидрокси-11а-имидазол-1 -ил-9-кето-16Я-метил-5 цис, простановую кислот}, ИК: 1745 1705, 1500
и) 155-ацетокси-11а -имидазол- 1-ил-9-кето-5цис-13-транс-простадиеновую кислоту, ИК: 1745, 1735 (плечо), 1700
к) 15-циклогексил-Па-имидазол-1 -ил,-15Ягидрокси-9-кето-16, 17, 18, 19, 20 -пентанор-5цис, 13-транс-простадиеновую кислоту, ИК: 1740, 1700
л) 15Р-гидрокси-11а -имидазол- -ил-9-кето16Я-метил-2,3-транс(-)-метилен-5-цис-простадиеновую кислоту, ИК: 1740, 1700 .
Формула изобретения
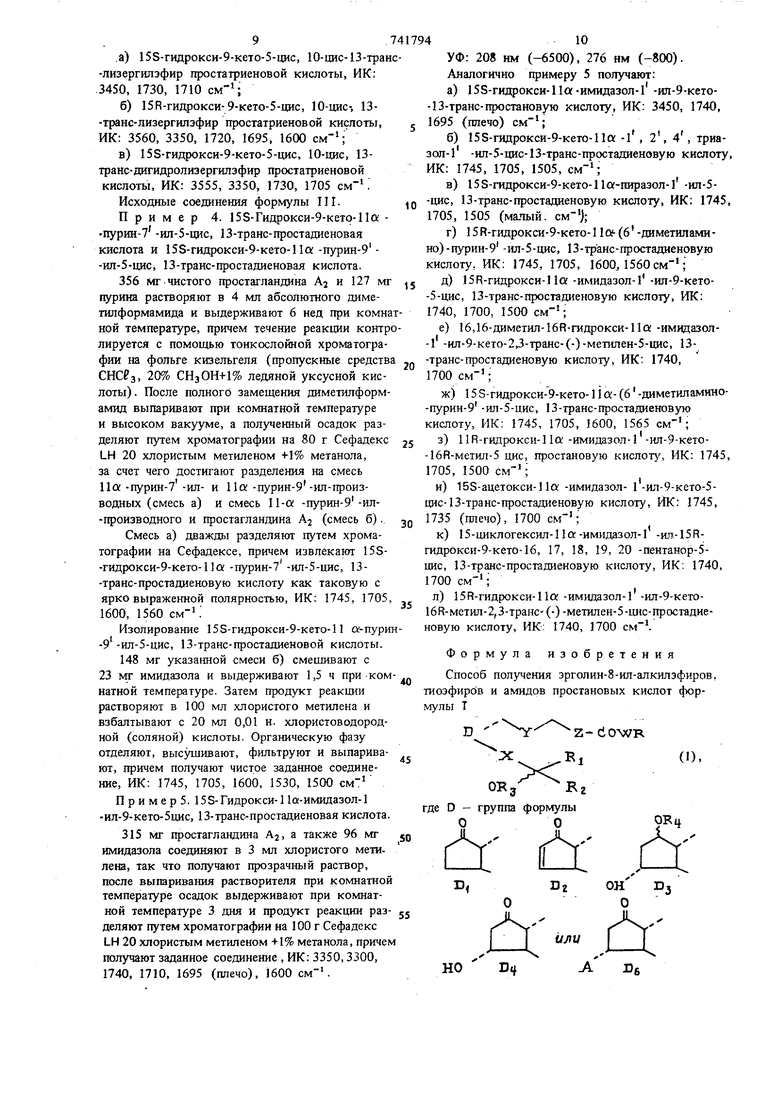
Способ получения эрголин-8-ил-алкилэфиров, шоэфиров и амидов простановых кислот формулы Т
z-cio-wR
D
OKg- Rz
где D - группа формулы ОО
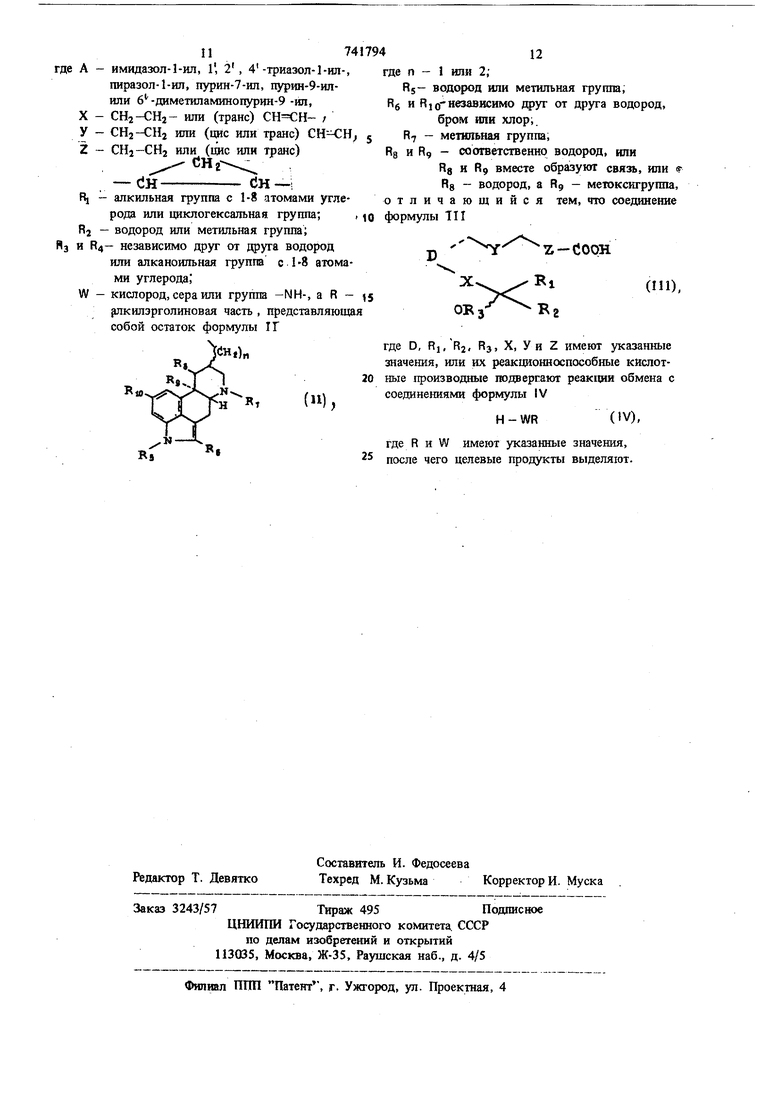
Ж.ногде А - имидазол-1-ил, 1, 2, 4-триазол-Ьил-, пиразол-1-ил, пурин-7-ил, пурин-9-илили 6 -диметиламинопурии-9 -ил, X - СНг-СНа- шга (транс) / У - СН2-СН2 или (оде или транс) 5 Z - CHj-CHj или (цис или транс) CJH СН-1 R, - алкильная групш с 1-8 атомами углерода или циклогексальная группа; Rj - водород или метильная группа; и R4- независимо друг от друга водород или алканоильная группа с 1 -8 атомами углерода; W - кислород, сера или группа -NH-, а R - 5 {шкилэрголиновая часть , представляющая собой остаток формулы 1Г где Rg Rg от 10 фо п - 1 или 2; S- водород или метильная групш, и R10-независимо друг от друга водород, бром или хлор;. 7 - метильная группа, и Rg - соответственно водород, или Rg и R9 вместе образуют связь, или Rg - водород, а R9 - метокскгруппа, личающийся тем, что соединение мулы ТП z-dooH
(),
где D, RI/RJ, Rj, X, Уи Z имеют указанные значения, или их реакционноспособные кислотные производные подвергают реак1ши обмена с соединениями формулы IV
(IV),
H-WR
где R и W имеют указанные значения, 25 после чего целевые продукты выделяют.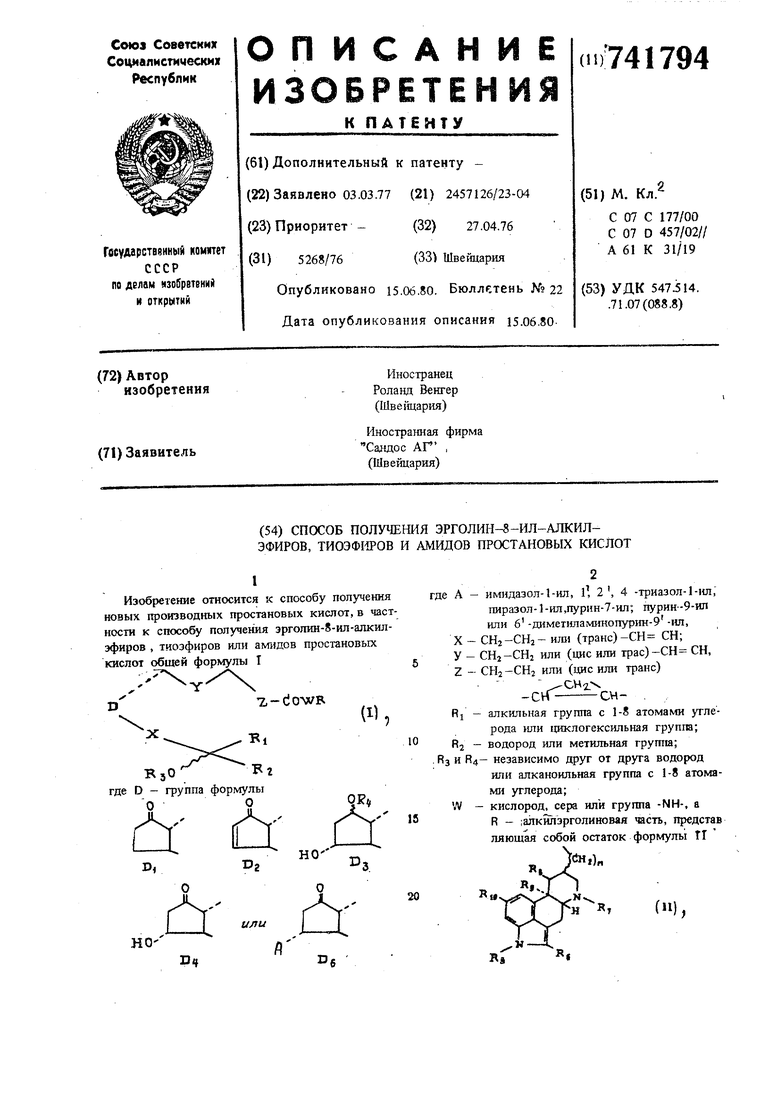





Авторы
Даты
1980-06-15—Публикация
1977-03-03—Подача