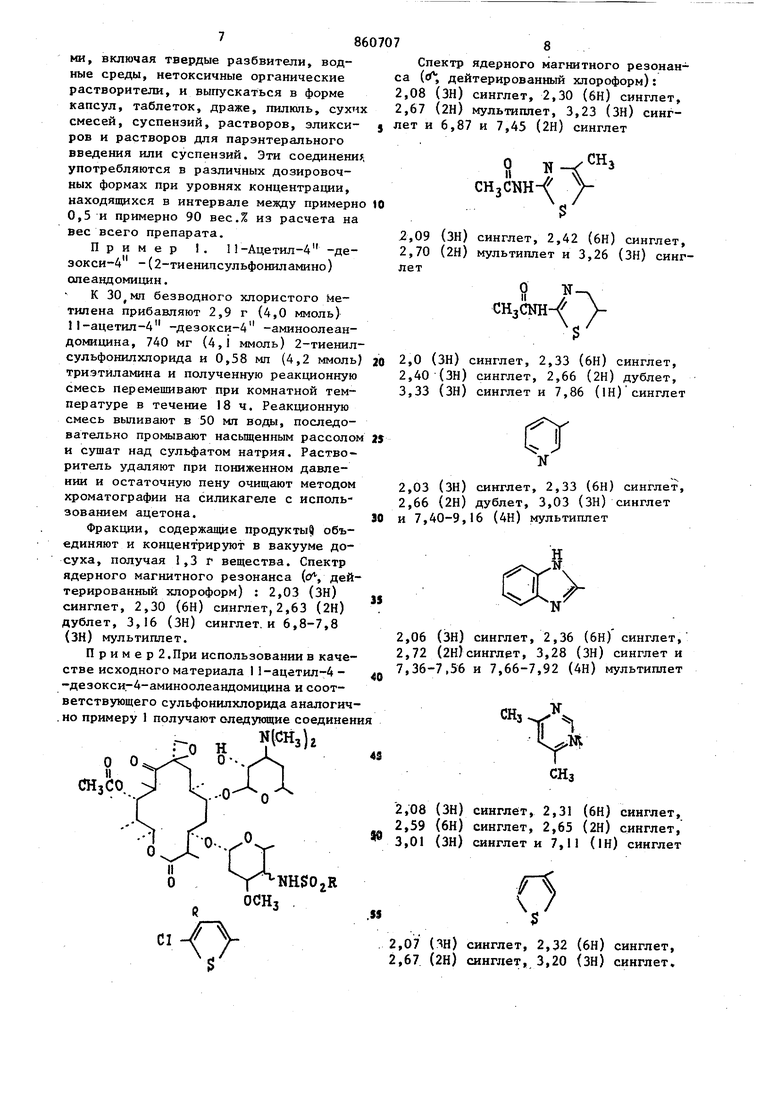
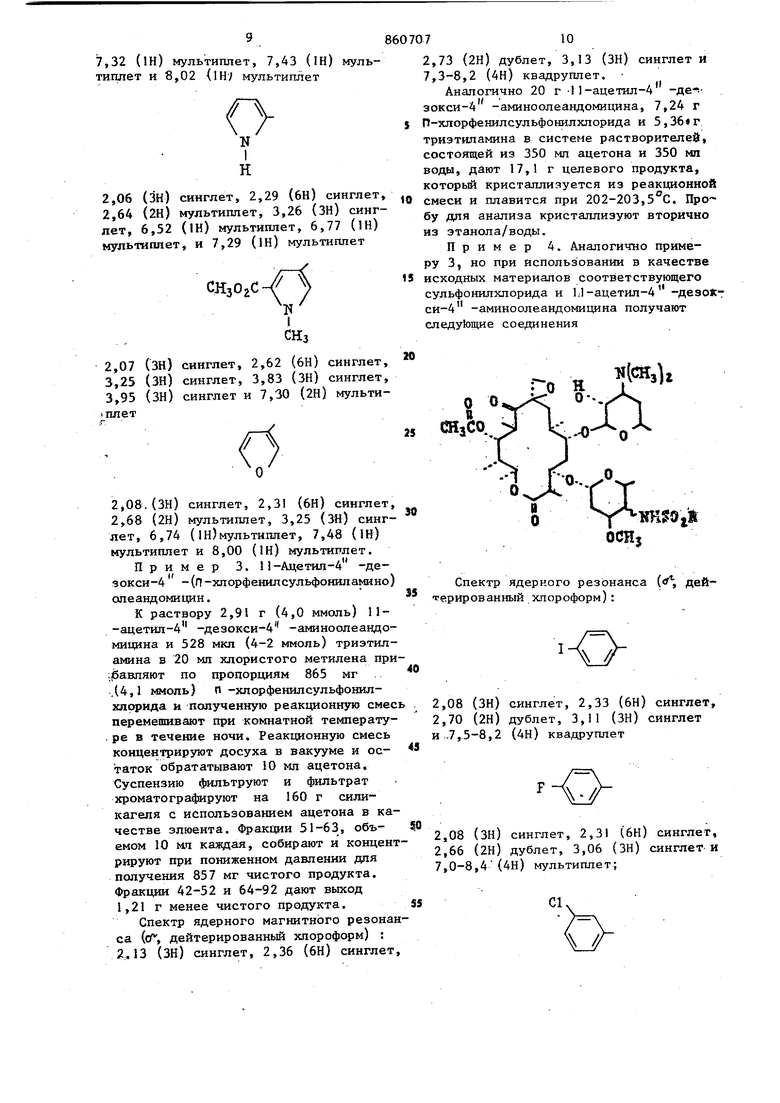
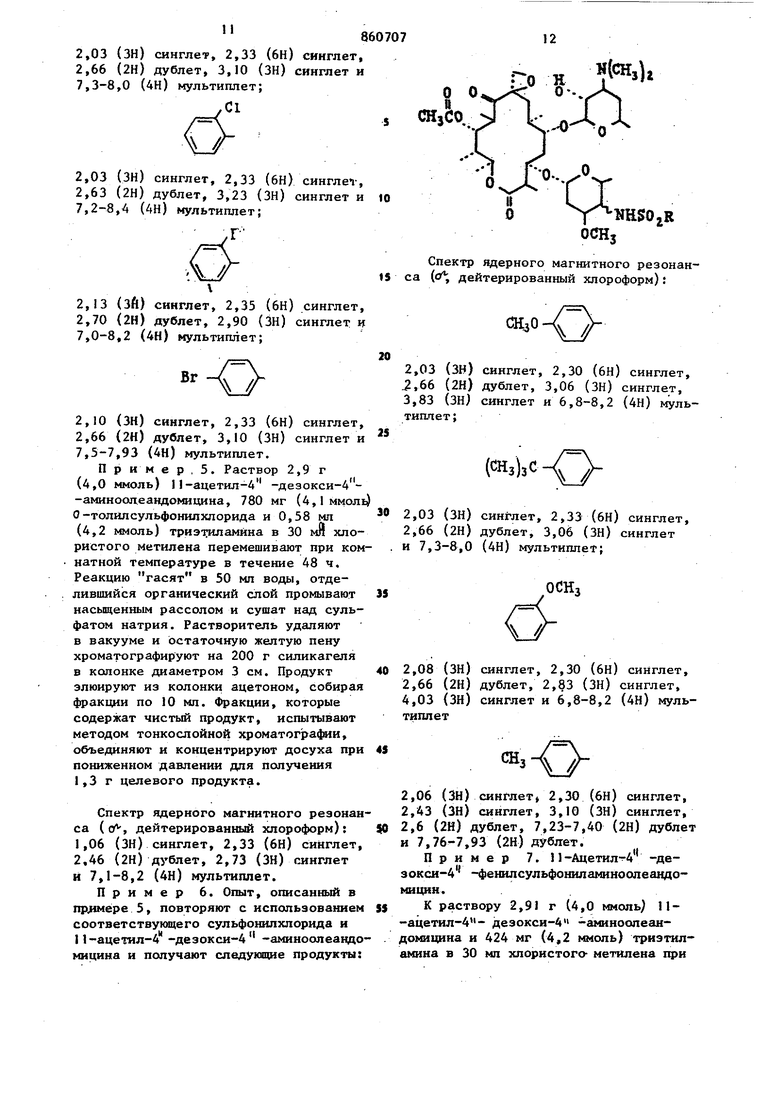
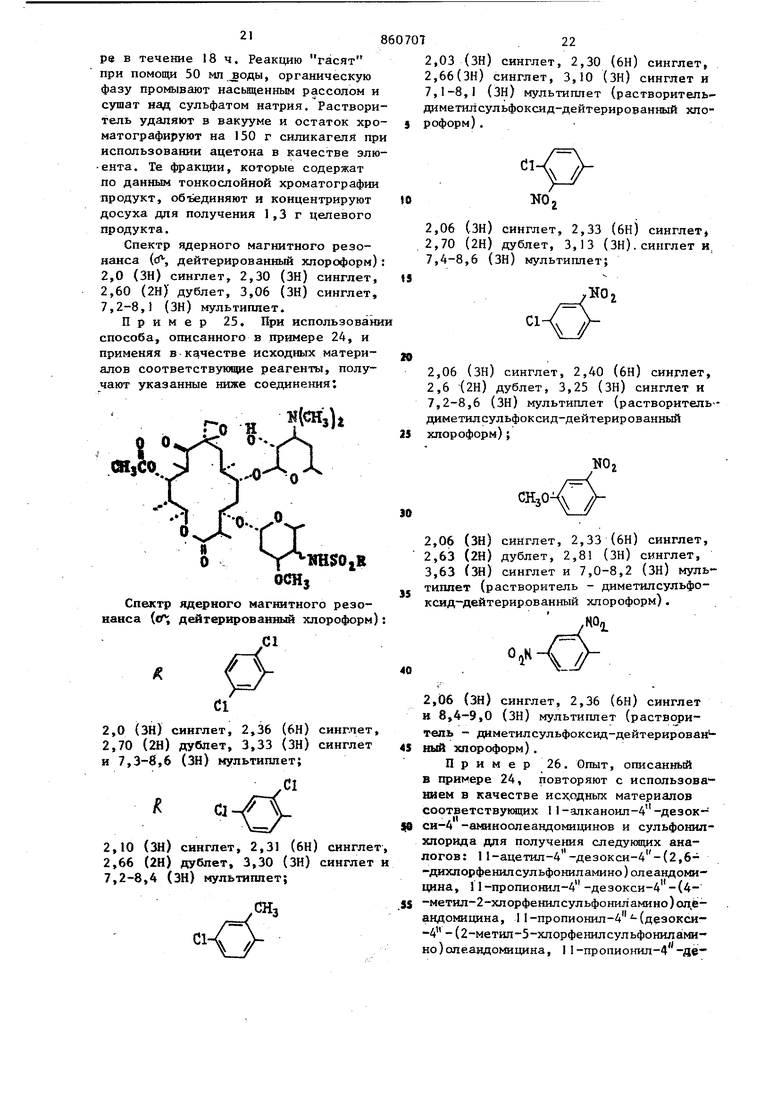
щёиный фенил, в котором указанный заместитель представляет собой атомы фтора, хлора брома, иода, окси-, метокси-, циайо-, карбоксамидо-, нитроамино-, карбометокси-, карбобензилокси-, карбокси-, трифторметил, трифторэтил, алкил или aцeтa шдoгpyппy, ;ртзамещенный фенил, в котором указанный заместитель представляет собой атомы хлора, нитро-, амино-, метокси- или метильные группы, трихлорфеНШ1, оксидихлорфенил, бензнл, нафтил, тиенил, хлортиенил, 2-ацетамидо-5-тиазолил, 2-ацетамидо-4-метил-5-тиазолил2-бензшшдазолил, диметил-2-пиримидинил, пиррил, фурил, монозамещенный тиенил, пиррил или фурил, в которых каждый заместитель представляет собой карбометокси- или алкил , 1-метил-5-карбометокси - 3-пиррил, или их сопей, совдаснение общей формулыOCHi где R имеет вьпиеуказанные значения 1юдвергак т взаимодействию с I мопь сульфонилхлорида формулы в пр сутствии или третичного органическог амина или гидроокиси, или гидрида ил карбоната щелочного металла, или кар бонате щелочногземвлького металла в среде инертного органического р аство рителя при комнатной температуре с посл укщим вьщелением целевого продукта в свободном состоянии или в ви де соли известными приемами. Исходные аминосоединения включают в связи с методом их синтеза, два 4 э имерных амина. Поэтому производные А -де5к кси-4 -сульфониламиноолеанд мицина, которые образуются из этих аминов также представляют собой зпи мерную смесь. Экспериментально установ лено, что оба эпимера присутствуют в конечном продукте в различных соотношениях в зависимости от выбора метода синтеза. Смесь эпимеров может быть разделена с применением методов, известных специалистам в данной области техники. Из практических соображений целесообразнее использовать указанную смесь в том виде, в котором она вьщеляется после реакции. Однако зачастую целесообразно очищать смесь зпимеров путем проведения по крайней мере одной перекристаллизации из подходящего растворителя, с применением метода колоночной хроматографии, с распределением при помощи растворителей или путем растирания с подходящим растворителем. Указанная очистка необязательно ведет к разделению эпимеров, но удаляет нежелательные побочные продукты реакции, исходные материалы. Оба эпимера данного соединения обладают одинаковым типом активности, т. е. являются противобактериальными агентами. Вышеуказанные реакции между 4 -дезокси-4 -аминоолеандомицином и соответствующим галогенидом сульфонила проводят в присутствии поглотителя кислоты. Поглотитель может состоять из гидратов окисей, гидридов или карбонатов щелочных или щелочно-земельных металлов, а также представлять собой третичный органический амин. Растворитель, инертный в реакционных условиях, используемый при вышеуказанном способе, должен быть таким растворителем, который солюбилизирует реагенты, но не реагирует ни с реагентами, ни с образующимися продуктами. Рекомендуется пользоваться полярными растворителями, смешивающимися или несмешивающимися с водой. Реакционная смесь после завершения может быть обработана любым из двух способов. Первый метод заключается в прибдвлеиии реакционной смеси к воде с последующим отделением несмешивающегося с водой растворителя, содержащего целевой продукт, с последующим его удалением для получения сырого продукта. Если употребляют смешивающийся с водой растворитель, то продукт экстраируют из погашенной водой реакционной смеси с использованием несмешивающегося с водой растворителя, такого как хлористый метилен. Второй метод обработки реакционной смеси заключается в концентрировании реакционной смеси досуха с последующим экстрагированием продукта из соли,обра зукицейся Из поглощающего кислоту основания и галоидводорода, являющейся побочным продуктом с использованием .ацетона, Ацетоновый экстракт может быть концентрирован для получения сырого продукта. При использовании хемо терапевтической активности производных 4 -дезокси-4 -сульфониламиноолеавдомнцина рекомендуется пользоват ся их фармацевтически приемлемыми со- лями. Примерами кислот, которые обра- зуют фармацевтически приемлемые анионы, являются соляная, бромистоводород ная, иодистоводородная, азотная, серная или сернистая, фосфорная, уксусная, молочная, лимонная, щавелевая, янтарная, налеиновая, гхпоконовая, аспарагиноваяуглутаминовая и лаурилсерная. Новые 4 -дезокси-4 -аминоолеандомициновые производные проявл5аот in vitro активность против ряда положительных микроорганизмов, таких как StaphyJococcus aureus и Streptococcus pyogenes, и против ряда граммотрицательных микроорганизмов, таких как имекщие сферическую или эллипсоид ную форму (кокки.Их активность отчет ливо демонстрируется при проведении испытаний in vitro против различных микроорганизмов в инфузионной среде мозга - сердца при обычной двухсерийной методике разбавпення. Активность in vitro делает их полезньши при мест ном применении в форме мазей, кремов и т. п., для целей стерилизации, например, палат в больницах, и в качестве промышленных противобактериальных агентов, например, при обработке воды, контроле ила, при консервировании красок и древесины. Кроме того, многие соединения, полученные предлагаемым способом являют ся активными по отношению к грамм-положительным микроорганизмам при ораль ном и/или п энтеральном введении их животным и людям. Их активность In vivo более ограничена с точки зрения чувствительности организмов и определяется обычным способом, который вклю чает инокулирование мьппей по существу однородного веса испытательным микроорганизмом с последукмцим оральным или субкутанным введением испытуемого сое динения. На практике мышей, например 10, подвергают интраперитониальной 1Нбкуляции соответствующим образом разведенными культурами, содержащими примерно от 1 до 10-кратной (наи- , низшая концентрация организма, требующаяся для того, чтобы вызвать 100%-ную смертность). Контрольные опыты проводятся одновременно на мьшах, получивншх инокулят при меньшей степени разбавления в качестве проверки возможной вариации вирулентности испытательного микроорганизма. Испытуемое соединение вводится по щрсиаествии 0,5 ч После инокуляции и дается повторно через 4, 24 и 48 ч. Выжившие мыпм вцдерживаются в течение 4 сут после послед-, него лечения, и регистрируется число выживших мышей. При использовании in vivo предаагаемые соединения могут быть введены орально илн парэнтерально, например путем субкутанной или внутримышечной инъекции, при дозировке от примерно 1до примерно 200 мг/кг веса тела в день. Наиболёе благоприятная дозировка находится в интервале мевду примерно 2и примерно JOO мг/кг веса тела в день, а наиболее рекомендуемый интервал дозировки соответствует интервалу между примерно 2 и примерно 50 мг/кг веса тела в день. Пригодными для парэнтерального введения средами являются либо водные среды, такие как вода, изотонический солевой раствор, изотонический раствор декстрозы, раствор Рингера, либо неводные, такие как масла на основе кислот или масл. растительного происхождения (семян хлопчатника, земпяных орехов, кукуруз-. ное, сезамовое), диметилсульфоксид и другие неводные среды, не мешающие терапевтической эффективности препаратов и являющиеся нетоксичными в объеме используемой доли глицерин, пропил енгликоль, сорбит. Кроме того, могут быть изготовлены препараты, пригодные для подготовки растворов непосредственно перед их введением. Та-. кие препараты могут «содержать жидкие разбавители, например пропиленгликоль, диэтилкарбонат, глицерин, сорбит и т. д., забуферивающие вещества, гаулуронидазу, местные анестезирующие вещества и неорганические соли для того, чтобы способствовать достижению желательного терапевтического эффекта. Эти соединения могуттакже комбинироваться с различными фармацевтически приемлемыми инертными носителями, включая твердые разбвители, водные среды, нетоксичные органические растворители, н выпускаться в форме капсул, таблеток, драже, шшкшь, сухих смесей, суспензий, растворов, эликсиров и растворов для парэнтерального введения или суспензий. Эти соединение употребляются в различных дозировочных формах при уровнях концентрации, находящихся в интервале между примерно 0,5 и примерно 90 вес.% из расчета на вес всего препарата. Пример 1. П-Ацетил-4 -дезокси-4 -(2-тиенипсульфониламино) опеандомицин. К безводного хлористого йетипена прибавляют 2,9 г (4,0 ммоль) II-ацетил-4 -дезокси-4 -аминоолеандомицина, 740 мг (4,1 ммоль) 2-тиенилсульфонилхлорида и 0,58 мп (4,2 ммоль) триэтиламина и полученную реакционную смесь перемешивают при комнатной температуре в течение 18 ч. Реакционную смесь выливают в 50 мл вода, последовательно промывают насыщенным рассолом и сушат над сульфатом натрия. Растворитель удаляют при пониженном давлении и остаточную пену очищают методом хроматографии на силикагеле с использованием ацетона. Фракции, содержащие продукты объединяют и концентрируют в вакууме досуха, получая 1,3 г вещества. Спектр ядерного магнитного резонанса (о, дейтерированный хлороформ) : 2,03 (ЗН) синглет, 2,30 (6Н) синглет,2,63 (2Н) дублет, 3,16 (ЗН) синглет. и 6,8-7,8 (ЗН) мультиплет. Пример 2 .При использовании в качестве исходного материала I 1-ацетш1-4 -дезокси-4-аминоолеандомицина и соответствующего сульфонилхлорида аналогич. но примеру 1 получают следующие соединен :-0 Н («И. „ Спектр ядерного магнитного резонана ( дейтерированный хлороформ): ,08 (ЗН) синглет, 2,30 (6Н) синглет, ,67 (2Н) мультиппет, 3,23 (ЗН) сингет и 6,87 и 7,45 (2Н) синглет cHjCHHсинглет, 2,42 (бн) синглет, мультиплет и 3,26 (ЗН) синглCH,CNH 2,0 (ЗН) синглет, 2,33 (6Н) синглет, 2,40 (ЗН) синглет, 2,66 (2Н) дублет, 3,33 (ЗН) синглет и 7,86 (1Н)синглет а 2,03 (ЗН) синглет, 2,33 (6Н) синглет, 2,66 (2Н) дублет, 3,03 (ЗН) синглет и 7,40-9,16 (4Н) мультиплет 2,06 (ЗН) синглет, 2,36 (6Н) синглет, 2,72 (2Н)синглет, 3,28 (ЗН) синглет и 7,36-7,56 и 7,66-7,92 (4Н) мультиплет синглет, 2,31 (6Н) синглет, синглет, 2,65 (2Н) синглет, синглет и 7,11 (1Н) синглет ,07 () сииглет, 2,32 (6Н) синглет, ,67 (2Н) синглет, 3,20 (ЗН) синглет. 2,03 (ЗН) синглет, 2,33 (6Н) синглет, 2,66 (2Н) дублет, 3,10 (ЗН) синглет и 7,3-8,0 (4Н) мультиплет; 2,03 (ЗН) синглет, 2,33 (6Н) сингл en-, 2,63 (2Н) дублет, 3,23 (ЗН) синглет и ю 7,2-8,4 (4Н) мультнплет; 860707 NHSOjR
./
2,13 (ЗЙ) синглет, 2,35 (6Н) синглет, 2,70 (2Н) дублет, 2,90 (ЗН) синглет И 7,0-8,2 (4Н) мультиплет;
Спектр ядерного магнитного резонанса (о дейтерированный хлороформ):
СИяО 2,10 (ЗН) синглет, 2,33 (6Н) синглет, 2,66 {2Н) дублет, 3,10 (ЗН) синглет и 7,5-7,93 (4Н) мультиплет. П р и м е р , 5. Раствор 2,9 г (4,0 ммоль) 11-ацетил-4 -дезокси-4 -аминоолеандомицина, 780 мг (4,1 ммоль О-толилсульфонилхлорида и 0,58 мл (4,2 ммоль) триэ1:нламйна в 30 мл хлористого метилена перемешивают при комнатной температуре в течение 48 ч. Реакцию гасят в 50 мл воды, отделившийся органический слой промывают насыщенным рассолом и сушат над сульфатом натрия. Растворитель удаляют в вакууме и остаточную желтую пену хроматографируют на 200 г силикагеля в колонке диаметром 3 см. Продукт элюируют из колонки ацетоном, собирая фракции по 10 мл. Фракции, которые содержат чистый продукт, испытывают методом тонкослойной хроматографии, объединяют и концентрируют досуха при пониженном давлении для получения 1,3 г целевого продукта. Спектр ядерного магнитного резонанса (о, дейтерированный хлороформ): 1,06 (ЗН) синглет, 2,33 (6Н) синглет, 2,46 (2Н) дублет, 2,73 (ЗН) синглет и 7,1-8,2 (4Н) мультиплет. Пример 6. Опыт, описанный в npjHMepe 5, повторяют с использованием соответствующего сульфонилхлорида и 11-ацетил-4 -дезокси-4 -аминоолеандомицина и получают следующие продукты: 2,03 (ЗН)синглет, 2,30 (бн) синглет, J,66 (2Н)дублет, 3,06 (ЗН) синглет, 3,83 (ЗН)синглет и 6,8-8,2 (4Н) мультиплет ; 2,03 (ЗН) синглет, 2,33 (6Н) синглет, 2,66 (2Н) дублет, 3,0б (ЗН) синглет и 7,3-8,0 (4Н) мультиплет; 2,08 (ЗН) синглет, 2,30 (бн) синглет, 2,66 (2Н) дублет, 2,83 (ЗН) синглет, 4,03 (ЗН) синглет и 6,8-8,2 (4Н) мультиплет2,06 (ЗН) синглет 2,30 (6Н) синглет, 2,43 (ЗН) синглет, 3,10 (ЗН) синглет, 2,6 (2Н) дублет, 7,23-7,40 (2Н) дублет и 7,76-7,93 (2Н) дублет. Пример 7. П-Ацетил-4 -дезокси-4 -фенилсульфошшаминоолеандомицин. К раствору 2,91 г (4,0 ммоль) 11-ацетил-4 - дезокси-4 -аминоолеандомицина и 424 мг (4,2 ьшоль) тризтил- амина в 30 мл хлористого- метилена 13860707 охлаждении на ледяной бане прибавляют 722 мг (4,1 ммоль) бензолсульфонилхлорида. По прошествии 10 мин баню удаляют и реакционную смесь перемешивают при комнатной температуре. Реакцию гасят 50 МП воды, органический слой промывают насыщенным рассолом и сушат над сульфатом натрия. После удаления растворителя получают сырой продукт, который подвергают очистке путем хроматографирования на 160 г силикагеля с использованием ацетона в качестве элюента. Фракции (каждая по 10 мл) 61-93, содержащие чистый продукт, по данным хроматографии на тонком слое объединяют и концентрируют досуха для получения 1,5 г целевого продукта. Спектр ядерного магнитного резонанса (о, деитерированный хлороформ): 2,06 (ЗН) синглет, 2,30 (ЗН) синглет, 2,63 (2Н) дублет, 3,06 (ЗН) синглет и 7,3-8,2 (5Н) мультиплет. При употреблении соответствующих исходных материалов аналогично получены:1 1-ацетш1-4 -дезокси-4 -(2-нафтилсульфониламино)олеандомицин, спектр ядерного магнитного резонанса (с«, дейтерированный хлороформ): 2,03 (ЗН) синглет, 2,26 (ЗН) синглет. 2,65 (2Н} дублет, 2,96 (ЗН) и 7,4-8,6 (7Н) мультиплет;11-ацетил-4 -дезокси-4 -бензилсульфониламиноолеандомицин, спектр .ядерного магнитного резонанса (а,дейтерированный хлороформ): 2,00 (3HJ синглет, 2,30 (ЗН) синглет, 2,63 (2Н) дублет, 3,46 (ЗН) синглет, 4,33 (2HJ синглет и 7.36 (5Н} синглет. Пример 8. 1 1-Ацетил-4--дезокси-4 - (П-бензилоксикарбонилфенилсульфониламино олеандомицин. Раствор 2,55 г (3,5 ммоль) 11-ацеТШ1-4 -безокси-4 -аминоолеандомицина, 1,12 г (3,6 ммоль) П -бензилоксикарбонилфенилсульфонилхлорида и 379 мг (3,75 ммоль) триэтиламина в 25 мл хлористого метилена перемешивают при комнатной температуре в течение ночи. Растворитель удаляют в вакууме и остаток растирают в 10 мл ацетона. Твердые вещества отфильтровывают и фильтрат хроматографируют на 280 г силикагеля с использованием . ацетона в качестве элюента и с отбором фракции по 10 МП. Фракции 90-203, которые по данным тонкослойной хроматографии содержат большую часть чистого продукта, объединяют и концентрируючен са 2, 2, 5, и в ве -а ми сл са ти 5, и 2,0 2,6 т при пониженном давлении дпя полуия 1,25 г целевого продукта. Спектр ядерного магнитного резонан(с дейтерированный хлороформ): 4 (ЗН) синглет, 2,30(6Н) синглет, 6 (2Н) дублет, 3,01(ЗН) синглет, 8 (2Н) синглет, 7,50 15Н) синглет ,03-8,53 (4Н) мультиплет. Пример 9. При употреблении ачестве исходных материалов сооттствующего сульфонилхлорида и 11цетил-4 -дезокси-4 -аминоолеандоцина получают аналогично,примеру 8 едуюище соединения: UHSOjR Спектр ядерного магнитного резонан(о, дейтерированный хлороформ) : синглат, 2,30 (бн) синглет, дублет, 3,03 (ЗН) синглет, синглет и 7,3-9,0 (4Н) мульлет;ОСН20 синглет, 2,30 (6Н) синглет, дублет, 3,01 (ЗН) синглет. 3 (2Н) дублет, 7,46 (5Н) синглет ,33-8,70 (4Н) мультиплет; 6 (ЗН) синглет, 2,30 (бн) синглет, 6 (2Н) дублет, 3,06 (ЗН) синглет. 4,0 (ЗН) синглет и 7,8-8,4 (4Н) мультиппет;СНзО синглет, 2,30 (6Н) синглет, дублет, 3,0 (ЗН) синглет и синглет. Пример 10. 11-Ацетил-4 -дезокси-4 - (о -нитрофенилсульфонилаыино) олеандомицин. Берут 5 г (6,8 ммоль) 11-ацеткп-4 -дезоксзи-4 -аминоолеандомицина, 1,5 г (7,0 ммоль) О-нитросульфонилхлорида и 0,98 МП триэтиламина, вводят в 50 м хлористого метилена и перемешивают пр комнатной температуре в теЧение48 ч. Реакционную смесь гасят водой в рав ном объеме и органическую фазу промывают насыщенным рассолом и сушат над сульфатом натрия. Поспе удаления раст ворителя при пониженном давлении полу чают сырой продукт в форме пены. Продукт очищают хроматографией на 140 г силикагеля в колонке диаметром 3 см с использованием ацетона в качестве элюента. Собирают фракции 20-3Q, объемом каждая по 50 мл, объединяет их и концентрируют досуха для получения 3,4 г целевого соединения. Спектр яде ного магнитного резонанса (Д дейтерированный хлороформ):-2,10 (ЗН) синг дет, 4,36 (2Н) дублет, 2,90 (ЗН) синг лет и 7,4-8,4 (4Н) мультиплет. Аналогично, при соответствующем вы боре исходных материалов и при применении описанного выше способа получают следующие соединения: 11-ацетил-4 -дезокси-4 - (м -нитрофенипсульфошшамино/ олеандомицин, спектр ядерного магнитного резонанса (с, дейтерированный хлороформ): 2,06 (ЗН) синглет, 2,30 (6Н) синглет, 2,6 (2Н) дублет, 3,06. (ЗН) синглет и 7,4-9,0 (4Н) мультиплет; П-ацетш1-4 -дезокси-4 - (П -нит рофенилсупьфониламино)олеандомицин, спектр ядерного магнитного резонанса ((Л, дейтерированный хлороформ): 2,10 (ЗН) синглет, 2,35 (6Н) синглет, 2,68 (2Н) дублет, 3,06 (ЗН) синглет и 8,08j6 (4Н) мультиплет. Пример 11. П-Ацетил-4 -дезокси-4 - (tl -оксифенилсульфонилШ4ИНО)оцеандомиции.. Раствор 2,55 г (3,5 ммопь) 11-ацетил-4 -дезокси-4 -аминоолеандомицина, 701 мг (3,65 ммоль) п -окснфешшсульфонилхлорида и 51,8 мкл триэтиламина в 25 мл хлористого метилена перемепшвают при комнатной температуре в течение 48 ч. Растворитель удаляют в вакууме и остаток обрабатывают 10 МП ацетона. Нерастворимые вещества отфильтровывают и фильтрат хроматографируют на 200 г силикагеля с использованием ацетона в качестве элюента. Фракции 116-175, которые по данным тонкослойной хроматографии содержат чистый продукт, объединяют и концентрируют досуха при пониженном давлении для получения 550 мг целевого продукта. Спектр ядерного магнитного резонанса (, дейтерированный хлороформ): 2,0 (ЗН) синглет, 2,33 (6Н) синглет, 2,68 (2rf) дублет, 3,06 (ЗН) синглет и 6,6-8,0 (4Н) мультиплет. Пример 12. При использовании в качестве исходных материалов соответствующих I1-алканоил-4 -дезокси-4 -аминоолеандомицина и сульфонилхлорида аналогично примеру 11 получают следующие соединения: 11-ацетил-4 -дезокси-4 -(м -оксифенилсульфониламино)олеандомицин, 11-пропионил-4 -дезокси-4 -(п -оксифенилсульфониламино) олеандомицин, II-пропионил-4 -дезокси-4 -(м -оксифенилсульфониламино) олеандомицин, 11-ацетил-4-дезокси-4 -(о -оксифенилсульфониламино) олеандомицин и I1-пропионш1-4 -дездкси-4 -(о-оксифенилсульфониламино) олеандомицин. Пример 13. 11-Ацетил-4 -дезркси-4 -(м -карбоксамидофенилсульфониламино) апеандомицин. К 20 мл хлористого метилена, содержашего 2,91 г (4,0 ммоль) 11-ацетил-4 -дезсжси-4 -аминоолеандомицина и 434 мг (4,2 ммоль) триэтиламина прибавляют 898 мг (4,1 ммоль) М -карбоксамидофенилсульфонилхлорида и полученную реакционную смесь перемешивают в течение 48 ч. Растворитель удаляют в вакууме и остаток обрабатывают 25 МП ацетона. Гидрохлорид триэтипамина отфильтровывают и фильтрат хроматографируют на 160 г силикагеля. фракции объемом по 50 мл собирают и исследуют методом тонкослойной хромато1т)афии для определения степени чистоты продукта. Фракции 66-93 объединяют и концентрируют при пониженном 800 мг целеводавлении для получения го продукта. Спектр ядерного магнитного резонанса ( , дейтерированный хлороформ): 2,06 (ЗН) синглет, 2,33 (6Н) синглет, 2,70 (2Н) синглет, 3,10 (ЗН) синглет и 7,4-9,0 (4Н) мультиплет. Пример 14. Опыт, описанный в примере 13, повторяют с использованием в качестве исходных материалов соответствующих 11-алканоил-4 -дезокси-4 -аминоолеандомицина и сульфонилхлорида, получают следующие соединения: 11-пропионил-4 -дезокси-4 -((М -карбоксиамидофенилсулффониламино) оле андомицин, 11-ацетил-4 -дезокси-4 -(О -карбоксиамидофенилсульфониламино олеандомицин, 11-ацетил-4 -дезокси-4 -(п-карбоксиамидофенилсульфониламино)олеандомииин, П-пропионил-4 -дезокси-4 -(о -карбоксамидофенилсульфониламино)олеандомицин и 11-проПИОНШ1-4 -дезокси-4 -(п -карбоксамидосульфониламино)олеандомицин. Пример 15. 11-Ацетил-4 -дезокси-4 -(п -ацетамидофенилсульфонил амино)олеандомицин. Раствор 2,91 г (4,0 ммоль) 11-ацетил-4 -дезокси-4 -аминоолеандомицина, 955 мг (4,6 ммоль) т -ацетамидофенилсульфонилхлорида и 424 мг (4, 2 ммол триэтиламина в 30 мл хлористого метил на перемешивают в течение 48 ч при ко натной температуре. Реакционную смесь концентрируют при пониженном давлении для получения пены, которую после это го обрабатывают 10 мл ацетона. Нераст воримый гидрохлорид триэтиламина отфильтровывают и фильтрат хроматографи руют на .160 г силикагеля при использо вании ацетона в качестве элюента. Фра ции 42-86, которые по данным тонкослойной хроматографии содержат большу часть чистого продукта, объдиняют и концентрир}тот в вагсууме для получения целевого продукта. Спектр ядерного магнитного резонанса (о, дейтерирован ный хлороформ): 2,06 (ЗН) синглет, 2,23 (ЗН) синглет, 2,35 (6Н) синглет, 2,70 (2Н) синглет, 3,13 (ЗН) синглет и 7,6-8,2 (4Н) мультиплет. Пример 16. Опыт, описанный в примере 15, повторяют с использованием в качестве исходных материалов соответствующих 11-алканоил-4 -де,11. ЗОКСИ-4 -аминоолеандомицинов и подходящего сульфонилхлорида и получают следующие соединения: 1 1-пропиошш-486-дезокси-4 -(П -ацетамидофенилсульфониламино)-1-олеандомицин; 1-про1шонил-4 -дезокси-4 -(о -ацетамидофенилсульфониламино)олеандомицин; 11-ацетил-4 -дезокси-4 -{М -ацетамидофенилсульфониламршо)олеандомицин и Ппропионил-4 -дезокси-4 -(О -ацетамидофенилсульфониламино олеандомицин., П р и М е .р 17. 11-Адетил-4 -дезокси-4 -(П -цианофенилсульфрниламино)олеандомицин. Раствор 2,55 г (3,5 ммоль) 11-ацетил-4 -дезокси-4 -аминоолеандомицина, 734 мг (3,-65 ммоль) п -цианофенилсульфонилхлорида и 518 мкл триэтиламина в 25 мл хлористого метилена пере-, мешивают при комнатной температуре в течение ночи. Растворитель удаляют в вакууме и остаток обрабатывают 10 мл ацетона. Нерастворимые вещества отфильтровывают и фильтрат хроматографируют на 120 г силикагеля с использованием ацетона в качестве злюента. Собирают фракции по 10 мл, фракции 47-83 объ.единяют и концентрируют при пониженном давлении для получения 231 мг целевого продукта. Спектр ядерного магнитного резонанса (cf, дейтерированный хлороформ): 2,10 (ЗН) синглет, 2,36 (6Н) синглет, 2,71 (2Н) дублет, 3,06 (ЗН) синглет и 7,7-8,4 (4Н) мультиплет. Пример 18. При использовании соответствующих исходных материалов - 11-алканоил-4 -дезокси-4 -аминоолеандомицина и цианобензолсульфонилхлоркда аналогично примеру I7 синтезируют следующие соединения: 11-ацетил-4 -д зокси-4 -(м -цианофенилсульфониламино олеандомицин, 11-пропионил-4 -дезокси-4 -(Q -цианофенилсульфониламино олеандомицин, 11-пропионил-4 -дезокси-4 -(П -цианофенилсульфониламино}олеандомицин, 1 1-ацетил-1-дезокси-4-(0-цианофенилсульфониламино олеандомицин 11нилсульфониламино олеаидомицин и 11-пропионил-4 -дезокси-4 -(W -цианофенилсульфониламино)олеандомицин. Пример 19. 1 1-Ацетил-4 -дезокси-4 - (п -трифторметилфенилсульфониламино)олеандомицин. К раствору 2,55 г (3,5 ммоль)11 ацетил-4 -дезокси-4 -аминоолеандомицина и 518 мкл (3,75 ммоль) триэтиламина в 25 мл хлористого метилена прибавляют 91 мг (3,65 ммоль) р -трифторметилфенилсульфонилхлорида и полученную реакционную смесь перемеишвают в
течение 18 ч. Растворитель удаляют в вакууме и остаток растирают в 15 мл ацетона. Твердые вещества отфильтровывают, а фильтрат хроматогра(}щруют на сшшкагеле для получения 287 мг целевого продукта. Спектр ядерного магнитного резонанса (о, дейтерированный хлороформ): 2,03 (ЗН) синглет, 2,3 (6Н) синглет, 2,63 (2Н) дублет, 3,40 (ЗН) синглет и 7,15-8,3 (4Н) культи.пле.
Пример 20. Опыт, описанный в примере 19, повторяют с использованием соответствунйцих исходных материалов и получают следукидие соединения: П-прог ионил-4 -дезокси-4-(М -трифторметилфенилсульфониламино)олеандомицин Ii-ацетил-4 -дезоксн-4 -(О-трифторметилсульфониламино)олеандомицин, 1 адетил-4 -дезокси-4 -(и-трифторметилфенилсульфониламино)олеандомицин, II-пропионил-4 -дезокси-4-(п-трифторме-галфенилсул ьфонкламино) олеандомицин и -про11ионил-4 -дезокси-4 -(о-трифторметилсульфониламино)алеандомицин,
Пример 21.11-Ацетш1-4 -дезокси-4 -(2,2,2-трифторэтилсульфониламино)олеандомицин.
Раствор 2,55 г (3,5 ммапь) П-ацетил-4 -дезокси-4 -аминоолеандомицина, 666 мг (3,65 ммоль) 2,2,2-триф орэтилсульфоиилхлорндаи 379 мг (3,75 ммоль} триэтиламина в 25 мл хлористого метилена перемешивают в течение 30 ч при комнатной температуре. Прибавляют еще 333 мг сульфонилхлорида и 270 мкп триэтиламина и перемешивание продолжают еще 4 ч. Растворитель после этого удаляют в вакууме и остаток обрабатывают 20 МП ацетона. Твердые веществ а -отфипьтровьшают и шьтрат хроматографируют на 110 г сипикагепя с использованием ацетона в качестве элюента. Отбирают фракции по ly мп. Фракции 50-80 объединяют и концентрируют для получения 385 мг целевого продукта. Спектр ядерного магнитного резонанса (tA, дейтерированный хпороформ): 2,06 (ЗН) .синглет, 2,26 (6Н) синглет, 2,60 (2Н) дублет и 3,36 (ЗН) синглет.
Аналогично, при употреблении в качестве исходного материала 11-пропионил-4 -дезокси--4 г-аминоолеандомицинавместо I1-ацетильнЬго эфира и с применением описанного выше способа получают 11 -пpoпиoншI-4 -дезокси-4 -(2,2,2-трифторэтипсульфониламино)олеандомицин.
Пример 22. П-Ацетил-4 -дезйкси-4 - метилсульфониламино)олеандомицин.
Раствор 2,91 г (4jO ммоль) 11-ацеТШ1-4 -дезЬкси-4 -аминоолеандомицина, 467 мг (4,1 ммоль) метилсульфонилхлорида и 424 мг (4,2 ммоль) триэтиламина в 25 мл хлористого метилена перемешивают при комнатной температуре в течение ночи. Растворитель удаляют при пониженном давлении и остаток обрабатывают 20 мл ацетона. Гидрохлорид триэтиламина отфильтровывают, а фильтрат, содержащий продукт, хроматографируют на 180 г силикагеля с использованием ацетона в качестве элюента. Отбирают фракции по 6 мл, фракции 67-133 объединяют и концентрируют в вакууме для получения j2 г целевого продукта. Спектр ядерного магнитного резонанса ((7, дейтерированный хлороформ): 2,06 (ЗН) синглет, 2,28 (6Н) синглет, 3,06 (ЗН) синглет, 2,62 (2Н) дублет, и 8,40 (ЗН) синглет.
Пример 23. При использовании в качестве исходного материала подходящего алкилсульфонилхлорида и 1I-алканоил-4 -дезокси-4-аминоолеандомицина получают следукмпие соединения:
OCHj
,co-,cHjCO-;cHi|CO-;сн сн со-; с«5СМо со-,ензС%со-;сно,,
ьс Я1-;снз-1йо 5-1 i-Ca,H7Пример 24. 11-Ацетил-4 -дезокси-4 -(3,4-дихл орфенилсульфониламино)олеандомицин.
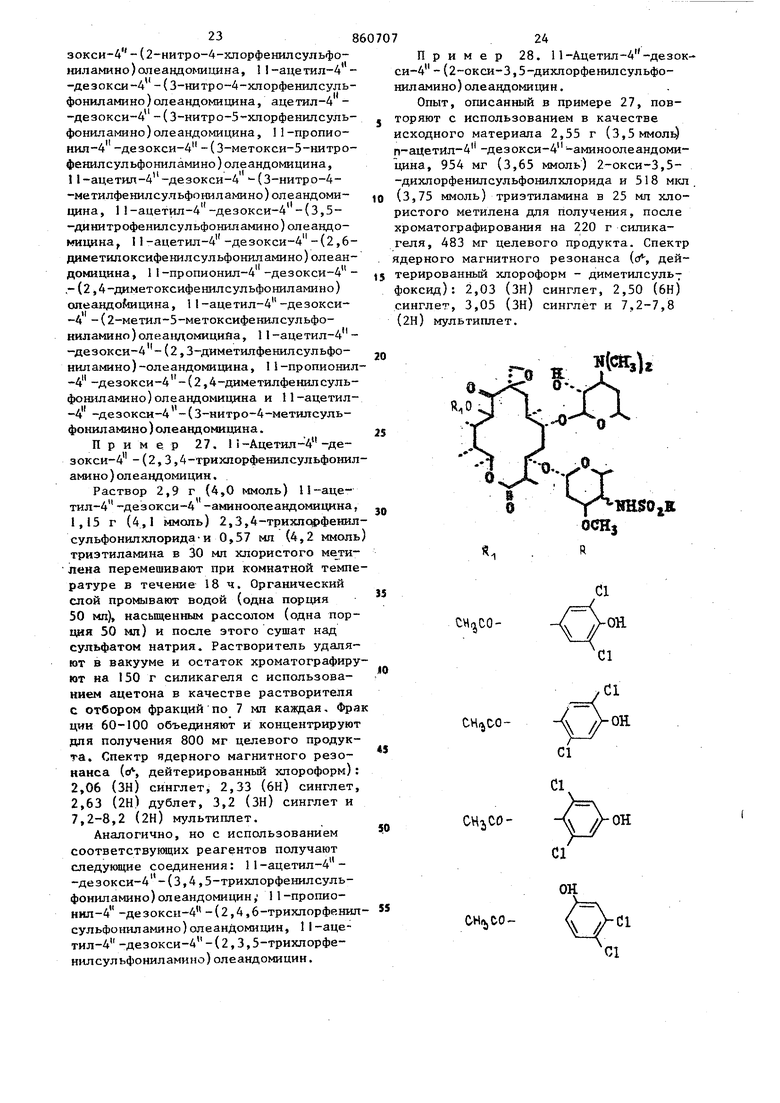
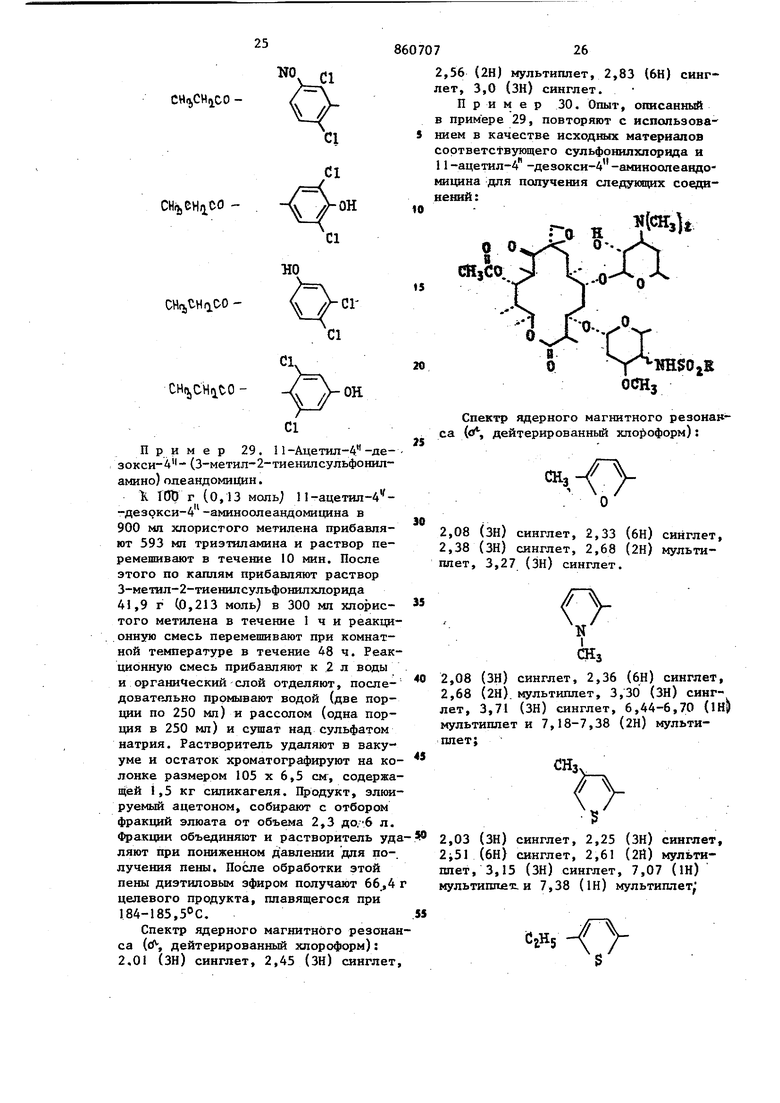
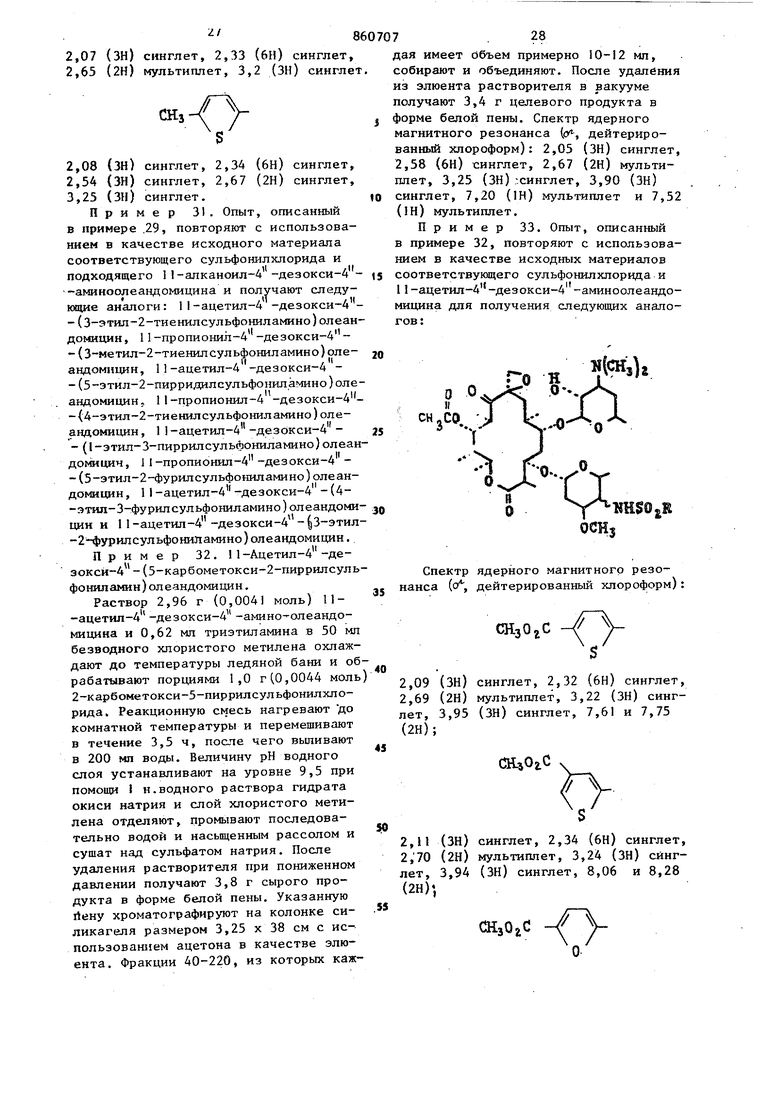
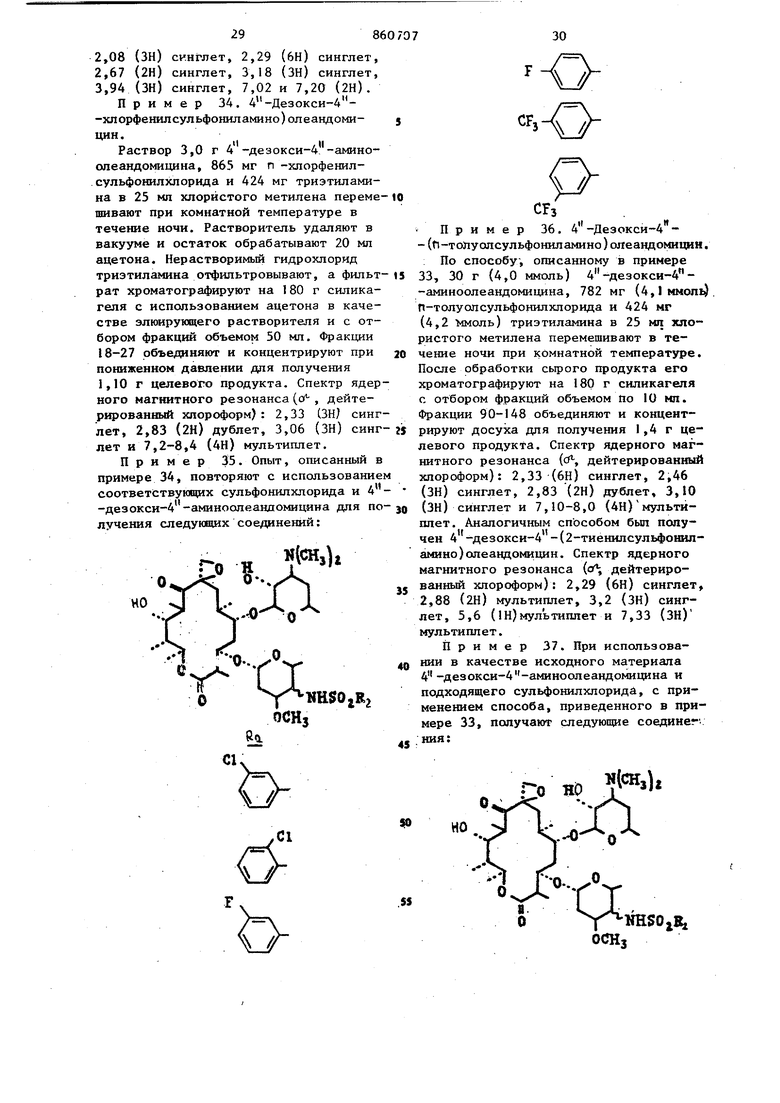
Берут 2,9 г (4,0 ммоль) П-ацетил-4 -дезокси-4 -аминоолеандомицина,. 1,0 г (4,1 ммоль) 3,4-дихлорфенилсульфонилхлорида и 0,57 мп(4,2ммоль) тризтиламина, вводят в 30 мп мтористого метилена и полученный раствор перемешивают при комнатной температуре в течение 18ч. Реакцию гасят при помощи 50 мл jBOAbi, органическую фазу промывают насыщенным рассолом и сушат над сульфатом натрия. Растворитель удаляют в вакууме и остаток хроматографируют на 150 г силикагеля при использовании ацетона в качестве элюента. Те фракции, которые содержат по данным тонкослойной хроматографии продукт, объединяют и концентрируют досуха для получения 1,3 г целевого продукта. Спектр ядерного магнитного резонанса ((Я-, дейтерированный хлороформ) 2,0 (ЗН) синглет, 2,30 (ЗН) синглет, 2,60 (2Н) дублет, 3,06 (ЗН) синглет, 7,2-8,1 (ЗН) мультиплет. Пример 25, При использовани способа, описанного в примере 24, и применяя в качестве исходных материалов соответствующие реагенты, получают указанные ниже соединения; сн,ео. 1Ш$0,В Спектр ядерного магнитного резонанса (сГ; дейтерированный хлороформ) 2,0 (ЗН) синглет, 2,36 (6Н) синглет, 2,70 (2Н) дублет, 3,33 (ЗН) синглет и 7,3-8,6 (ЗН) мультиплет; 2,10 (ЗН) синглет, 2,31 (6Н) синглет 2,66 (2Н) дублет, 3,30 (ЗН) синглет 7,2-8,4 (ЗН) мультиплет; 2,03 (ЗН) синглет, 2,30 (6Н) синглет, 2,66(ЗН) синглет, 3,10 (ЗН) сннглет и 7,1-8,1 (ЗН) мультиплет (растворительдиметнлсульфоксид-дейтерированный хлороформ) . 2,06 (ЗН) синглет, 2,33 (6Н) синглет, 2,70 (2Н) дублет, 3,13 (ЗН). сииглет и, 7,4-8,6 (ЗН) мультиплет; 2,06 (ЗН) синглет, 2,40 (бн) синглет, 2,6 (2Н) дублет, 3,25 (ЗН) сннглет и 7,2-8,6 (ЗН) мультиплет (растворительдиметилсульфоксид-дейтерированныйхлороформ); 2,06 (ЗН) синглет, 2,33 (бн) синглет, 2,63 (2Н) дублет, 2,81 (ЗН) синглет, 3,63 (ЗН) синглет и 7,0-8,2 (ЗН) мультиплет (растворитель - днметнлсульфоксид-дейтерированный хлороформ). 2,06 (ЗН) синглет, 2,36 (6Н) синглет и 8,4-9,0 (ЗН) мультиплет (растворитель - димeтилcyльфoкcид-дeйтepиpoвaн ный хлороформ). Пример 26. Опыт, описанный в примере 24, повторяют с нспользова нием в качестве исз одных материалов соответствующих 11-алканош1-4 -дезокси-4 -а№1ноолеандомицинов и сульфонилхлорида для получения следующих аналогов: 11-ацетш1-4-дeзoкcи-4 -(2,6-диxлopфeнилcyльфoнил амино ) ол еандомн-цина, П-пропионил-4 -дезокси-4 -(4-метш1-2-хлорфенилсульфониламино)олеандомицина, I I -пропионил-4 - (дезоксн-4 - (2-метил-5-хлорфенилсульфониламино)олеаидомицина, I1-пропионш1-4 -де 238 ЗОКСИ-4 -(2-НИТРО-4-ХЛорфенилсульфо1П1ламино) олеандомицина, 1 1 -ацетил-4 -дезокси-4 -(3-нитро-4-хлорфенилсульфониламино)олеандомицина, ацетил-4 -дезокси-4 -(3-нитро-5- Хлорфенилсульфониламино)олеандомицина, 11-пропионил-4 -дезокси-4 -{З-метокси-5-нитрофенилсульфониламино)олеандомицина, 1-ацетил-4 -дезокси-4 (З-нитро-4-метилфенилсульфониламино)олеандомицина, 1 -ацетил-4 -дезокси-4 -(3,5-динитрофенилсульфониламино)олеандомицина, 11-ацетил-4 -дезокси-4 -(2,6диметилоксифенилсульфониламино)олеандомицина, 11-пропионил-4 -дезокси-4 .-(2,4-диметоксифенилсульфониламино) олеандоЬицина, 11-ацетил-4 -дезокси-А -(2-метил-5-метоксифенилсульфониламино)олеалдомицияа, 11-ацетил-4 -дезокси 4 -(2,3-диметилфенилсульфониламино) -олеандомицина, I1-пропионил -4 -дезокси-4 -(2,4-диметилфе1Шлсульфошшамино)олеандомицина и 11-ацетил-4 -дезокси-4 -(З-нитро-4-метилсульфониламино)олеандомицина. Пример 27. 1i-Ацетил-4 -де зокси-4 -(2,3,4-трихпорфенилсульфонил амино)олеандомицин. Раствор 2,9 г (4,0 ммоль) 1 -ацетил-4 -дезокси-4 -аминоопеандомицина, 1,15 г (4,1 ммопь) 2,3,4-трихпсффенил сульфонилхлорида-и 0,57 мл (4,2 ммоль триэтиламина в 30 мл хлористого метилена перемешивают при комнатной темпе ратуре в течение 18ч. Органический слой промывают водой (одна порция 50 мп), насьщенным рассолом (одна порция 50 мл) и после этого сушат над сульфатом натрия. Растворитель удаляют в вакууме и остаток хроматографиру ют на 50 т силикагеля с использованием ацетона в качестве растворителя с отбором фракций по 7 мп каждая, Фра ции 60-100 объединяют и концентрируют для получения 800 мг целевого продукта. Спектр ядерного магнитного резонанса (f-f дейтерированный хлороформ): 2,06 (ЗН) синглет, 2,33 (6Н) синглет, 2,63 (2Н) дублет, 3,2 (ЗН) синглет и 7,2-8,2 (2Н) мультиплет. Аналогично, но с использованием соответствукщих реагентов получают следующие соединения: 11-ацетил-4 -дезокси-4 -(3,4,5-трихлорфенилсульфонил амино) олеандомицин, 11-пропионнл-4 -дезокси-4 -(2,4,6-трихлорфеншт сульфониламино)олеандомицин, 1I-ацетил-4 -дезокси-4 -(2,3,5-трихлорфенилсул ьфониламино) олеандомицин. Пример 28. 11-Ацетил-4 -дезокси-4 -(2 окси-3,5-дихлорфенилсульфониламино)олеандоми1щн. Опыт, описанный в примере 27, повторяют с использованием в качестве исходного материала 2,55 г (3,5 ммоль) п ацетИл-4 -дезокси-4 -аминоолеандомицина, 954 мг (3,65 ммоль) 2-окси-3,5-дихлорфенилсульфонилхлорида и 518 мкл. (3,75 ммоль) триэтиламина в 25 мл хлористого метилена для получения, после хроматографирования на 220 г силикагеля, 483 мг целевого продукта. Спектр дерного магнитного резонанса (, дейтерированный хлороформ - диметилсуль7 фоксид): 2,03 (ЗН) синглет, 2,50 (6HJ синглет, 3,05 (ЗН) синглет и 7,2-7,8 (2Н) мультиплет. WJ H$OiR CHijCOCHa,00CHjCDCHftitOCHo,CHiCO CH/,eHiiCO CHijtHaoo CHtjjCHitOПример 29. 11-Ацетил-А.-дезокси-4 - (3-метил-2-тиенилсульфониламино) олеандомии(ин. К ТШ г (о, 13 моль; П-ацетил-4-дезокси-4 -аминоолеандомицина в 900 мл хлористого метилена прибавляют 593 мл триэтиламина и раствор перемешивают в течение 10 мин. После этого по каплям прибавляют раствор 3-метил-2-тиенилсульфонш1хлорида 41,9 г Со,213 моль) в 300 мл хлористого метилена в течение 1 ч и реакци онную смесь перемешивают при комнатной температуре в течение 48 ч. Реак ционную смесь прибавляют к 2 л воды и органический слой отделяют, последовательно промывают водой (две порции по 250 мл) и рассолом (одна порция в 250 мл) и сушат над сульфатом натрия. Растворитель удаляют в вакууме и остаток хроматографируют на ко лонке размером 105 х 6,5 см, содержа щей 1,5 кг силикагеля. Продукт, элюи руемый ацетоном, собирают с отбором фракций элюата от объема 2,3 до.6 л. Фракции объединяют и растворитель уд ляют при пониженном давлении для получения пены. После обработки этой пены диэтиловым эфиром получают 66,4 целевого продукта, плавящегося при 184-185,. Спектр ядерного магнитного резона са (д, дейтерированный хлороформ): 2.01 (ЗН) синглет, 2,45 (ЗН) синглет 8 26 ,56 (2H) мультиплет, 2,83 (6Н) сингет, 3,0 (ЗН) синглет. Пример 30. Опыт, описанный примере 29, повторяют с испольэоваием в качестве исходных материалов оответствующего сульфонилхлорид и 1-ацетил-4 -дезокси-4 -аминоолеандоицина для получения следуилцих соедиений : §...Jf ..Спектр ядерного магнитного резонанса (f дейтерированный хло оформ): Ч/ 2,08 (ЗН) синглет, 2,33 (6Н) синглет, 2,38 (ЗН) синглет, 2,68 (2Н) мультиплет, 3,27 (ЗН) синглет. f 2,08 (ЗН) синглет, 2,36 (6Н) синглет, 2,68 (2Н). мультиплет, 3,30 (ЗН) синглет, 3,71 (ЗН) синглет, 6,44-6,70 (IHJ мультиплет и 7,18-7,38 (2Н) мультиплет;2,03 (ЗН) синглет, 2,25 (ЗН) синглет, 2i51 (6Н) синглет, 2,61 (2Й) мультиплет, 3,15 (ЗН) синглет, 7,07 (Ш) мультишта-с. и 7,38 (Ш) мультиплет, /Л 2,07 (ЗН) синглет, 2,33 (бН) синглет, 2,65 (2Н) мультиплет, 3,2 (ЗН) сингле Пример 31. Опыт, описанный в примере .29, повторяют с использованием в качестве исходного материала соответствующего сульфонилхлорида и подходящего 11-алканоил-4 -дезокси-4 -аминоолеандомицина и получают следукядие аналоги: 11-ацетил-4 -дезокси-4 -(3-этил-2-тиенилсульфониламино)олеан домицин, 11-пропионил-4 -дезокси-4 -(3-ме тил-2-тиенил сул ьфонил амино)олеандомицин, 11-ацетил-4 -дезокси-4 -(5-этил-2-пирридилсульфониламино)оле андомицин, 11-пропионил-4 -дезокси-4 -(4-этил-2-тиенилсульфониламино)олеандомицин, 1 -ацетил-4 -дезокси-А - (1-этил-3-пиррилсульфониламино)олеан домицин, 1I-пропионил-4 -дезокси-4 -(5-этил-2-фурилсульфониламино)олеандомицин, 11-ацетил-4 -дезокси-4 -(4-этил-3-фурилсульфониламино) олеандоми Иit / цин и 11-ацетил-4 -дезокси-4 - 3-этил -2-фурилсульфониламино)олеандомицин. Пример 32. 1-Ацетил-4 -дезоксй-4 -(5-карбометокси-2-пиррилсуль фониламин)олеандомицин. Раствор 2,96 г (0,0041 моль) 11-ацетил-4 -дезокси-4 -амино-олеандомицина и 0,62 ми триэтиламина в 50 мл безводного хлористого метилена охлаждают до температуры ледяной бани и об рабатывают порциями 1,0 г (,0,0044 моль 2-карбометокси-5-пиррилсульфонилхлорида. Реакционную смесь нагревают до комнатной температуры и перемешивают в течение 3,5 ч, после чего выливают в 200 МП воды. Величину рН водного слоя устанавливают на уровне 9,5 при помощи I н.водного раствора гидрата окиси натрия и слой хлористого метилена отделяют, промывают последовательно водой и насыщенным рассолом и сушат над сульфатом натрия. После удаления растворителя при пониженном давлении получают 3,8 г сырого продукта в форме белой пены. Указанную йену хроматографируют на колонке силикагеля размером 3,25 х 38 см с использованием ацетона в качестве элюента. Фракции 40-220, из которых каж7дая имеет объем примерно 10-12 мл, собирают и объединяют. После удаления из элюента растворителя в вакууме получают 3,4 г целевого продукта в форме белой пены. Спектр ядерного магнитного резонанса (о, дейтерированный хлороформ): 2,05 (ЗН) синглет, 2,58 (6Н) синглет, 2,67 (2Н) мультиплет, 3,25 (ЗН)-.синглет, 3,90 (ЗН) синглет, 7,20 (1Н) мультиплет и 7,52 (IH) мультиплет. Пример 33. Опыт, описанный в примере 32, повторяют с использованием в качестве исходных материалов соответствующего сульфонилхлорида и 11-ацетил-4 -дезокси-4 -аминоолеандомицина для получения следующих аналогов:Спектр ядерного магнитного резонанса (о, дейтерированный хлороформ): // S СНзОгС 2,09 (ЗН) синглет, 2,32 (6Н) синглет, 2,69 (2Н) мультиплет, 3,22 (ЗН) синг(ЗН) синглет, 7,61 и 7,75 лет, 3,95 (2Н); CftjOiC 2,П (ЗН) синглет, 2,34 (6Н) синглет, 2,70 (2Н) мультиплет, 3,24 (ЗН) синглет, 3,94 (ЗН) синглет, 8,06 и 8,28
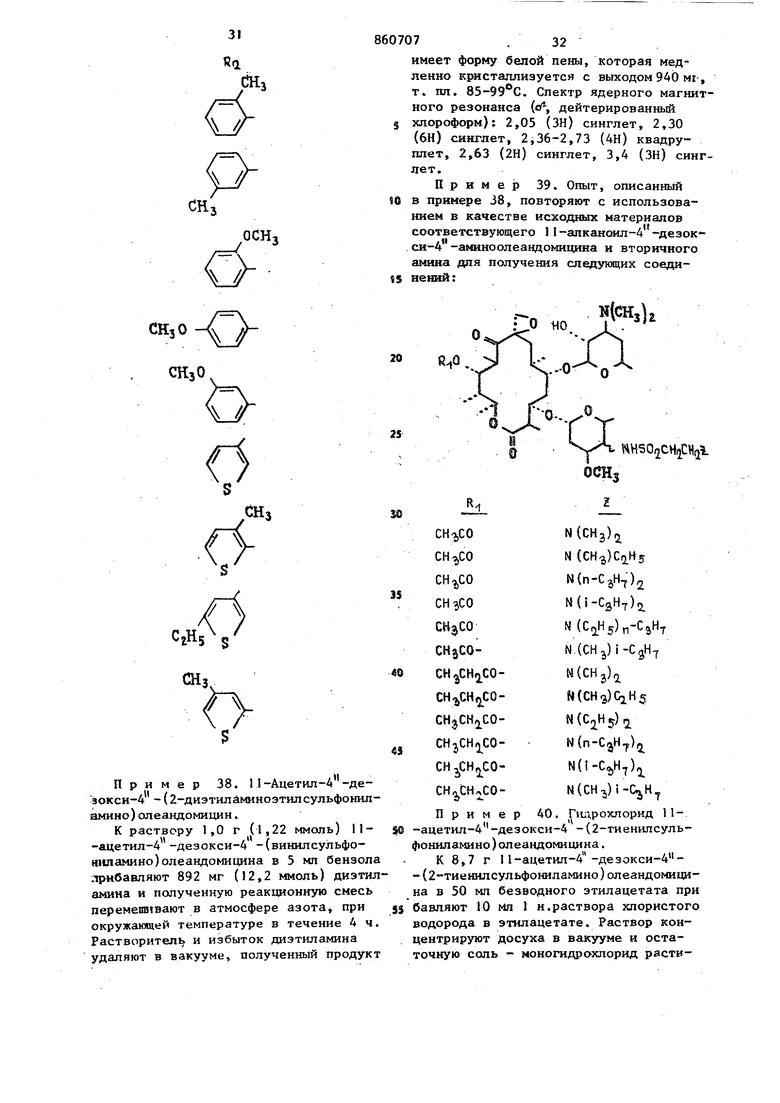
СНзО
СгН5 S Шз
О
S
Пример 38. 11-Ацетил-4 -дезокси-4 -(2-диэтиламиноэтилсульфониламино)олеандомицин.
К раствору 1,0 г (1,22 ммоль) 11-ацетил-4 -дезокси-4 -(винилсульфониламино)олеандомицина в 5 мл бензола лрибавляют 892 мг (12,2 ммоль) диэтиламина и полученную реакционную смесь перемешивают в атмосфере азота, при окружающей температуре в течение 4 ч. Растворитель и избыток диэтиламина удаляют в вакууме, полученный продукт
60707.32
имеет форму белой пены, которая медленно кристаллизуется с выходом 940 мг, т. пл. 85-99°С. Спектр ядерного магнитного резонанса (t, дейтерированный 5 хлороформ): 2,05 (ЗН) синглет, 2,30 (бН) синглет, 2,36-2,73 (4Н) квадруплет, 2,63 (2Н) синглет, 3,4 (ЗН) синглет.
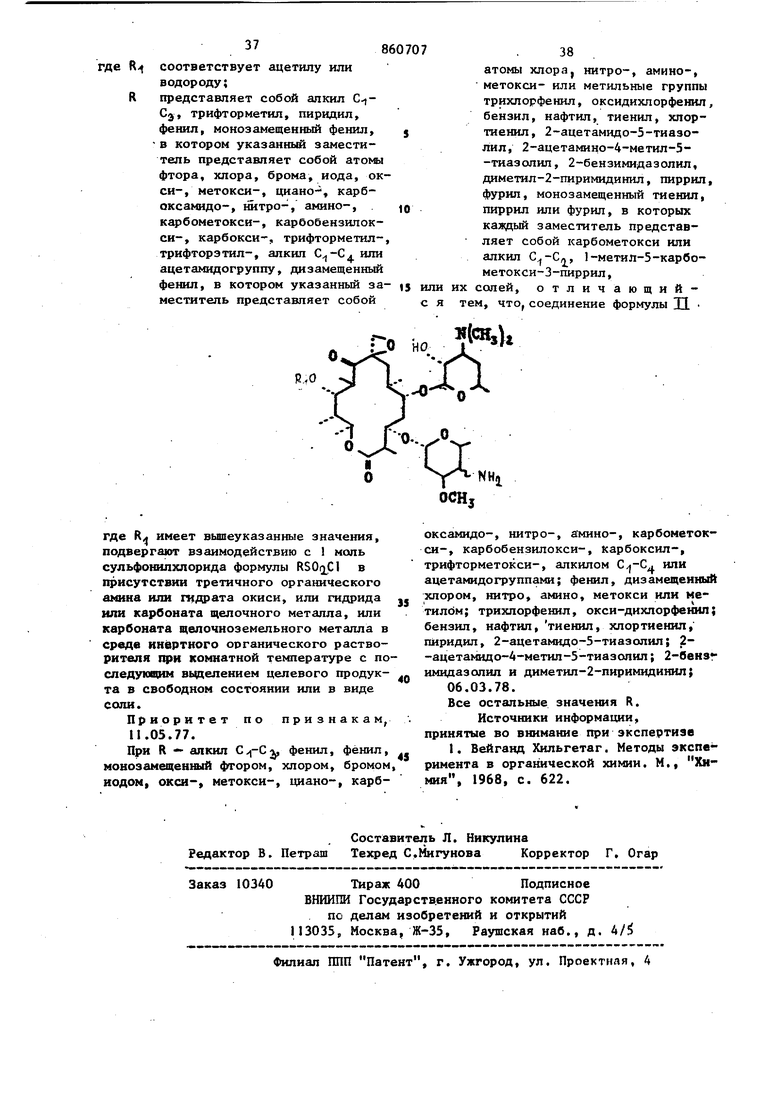
Пример 39. Опыт, описанный to в примере 38, повторяют с использова1шем в качестве исходных материалов соответствующего 1 1-алканоил-4 -дезок си-4 -амшюолеандомицина и вторичного амина для получения следукмцих соедиfS нений:
20R,Q,
HHSOrjCHijCH l
N(CH3)r, N (CH)C,
М(п-СзН )2 М(1-СзН)2
N()n-C5HT
H.(CH-)
NCCHj),
N(CHs)CiH5
N(C2H5)
М{п-СзН)2
N(-C,,H7)
N(CH)
Пример АО. Гшгрохлорид П-.
ацетил 4 -дезокси-4 -(2-тиенилсульфониламино)олеандомицина.
К 8,7 г 11-ацетил-4 -дезокси-4 -(2-тиенилсульфониламино)олеандомицина в 50 МП безводного этилацетата при
бавляют 10 мл 1 н.раствора хлористого водорода в этилацетате. Раствор концентрируют досуха в вакууме и остаточную соль - моногидрохлорид растирают с диэтиловым эфиром и отфильтровывают . Пример 41. Фосфат 1-ацетил-4 -де окси-4 -(2-тиeнилcyльфoншIaминo ) ол еандомицина. К раствору 15,0 11-ацетил-4 -дезок си-4 -(2-тиенилсульфониламино)олеандо . мицина в 100 мл этилацетата прибавляют 1,0 мл фосфорной кислоты. Полученную суспензию перемешивают в течение 4 ч при комнатной температуре. Твердые вещества отфильтровывают, промывают этилацетатом и сушат для получения 12,5 г целевой соли, 168°С (с разложением). Аналогичным образом получают фосфат 11-ацетил-4 -дезокси-4 -(З-метил-2-тиенилсульфониламино)олеандомицина с т. пл. 184-188 С и фосфат 11-ацетил-4 -дезокси-4 - (п -хлорфенилсул фониламино)олеандомицина ст. пл. 204 205°С. Препарат А. 4 -Дезокси-4 -оксоолеандомицин. 1. 11-Ацетил-4 -дезокси-4 -оксоолеандомицин. а) 11,2 -Диацетил-4 -дизокси-4 -оксоолеандомицин:К 4,5 г N-хлорсукцинимида, 50 мп бензола и 150 мл толуола в сухой колбе, оборудованной магнитной мешалкой и трубкой для ввода азота, охлаждаемой до , прибавляют 3,6 мл димети сульфида. После перемешивания при 0°С в течение 20 мин содержимое колбы охлаждают до -5°С и обрабатывают 5,0 г 11,2 -диацетил-олеандомидина и 100 мл бензола. Охлаждение и перемешивание продолжают в течение 2 ч, после чего прибавляют 4,73 МП триэтиламина. Реакционную смесь перемешивают при О С в течение 15 мин и после этого выливают в 500 МП воды. Величину рН устанавливают на уровне 9,5 при помощи 1 н.раствора гидрата окиси натрия в воде и органический слой отделяют, промывают водой и рассолом и сушат над сульфатом натрия. После удаления растворителя в вакууме получают 4,9 целевого продукта в форме пены. Спек ядерного магнитного резонанса (А, де терированный хлороформ): 3,48 (ЗИ) синглет, 2,61 (2Н) мультиплет, 2,23 (6Н) синглет и 2,03 (6Н) синглет. в) 11-Ацетип-4 -дeзoкcи-4 -oкcooлeaндoмицин. Раствор 4,0 г П ,2-дигщетил-4.-дезокси-4 -оксоолеандомицина в 75 м метанола перемешивают при комнатной 734 температуре в течение ночи. Реакционную смесь концентрируют прл пониженном давлении для получения продукта в форме пены. Раствор остатка в диэтиловом эфире после обработки гексаном дает возможность получить 2,6 г продукта в форме белого твердого вещества ст. пл. 112-117 0. Спектр ядерного магнитного резонанг са (, дейтерированный хлороформ): 3,43 (ЗН) синглет, 2,60 (2Н) мультиплет, 2,23 (6Н) синглет и 2,61 (ЗН) синглет. Аналогично при употреблении П,2-дипропионил-4 -дезокси-4 -оксоолеандомицина или 11-пропионил-2 -ацетил-4 -дезокси-4 -оксоолеандомицина получают 1 1-пропионил-4 -дезокси-4-оксоолеандомицин. IIи 11.4 -Дезокси-4 -оЛсоолеандомиции. а) 2 -Ацетш1-4 -дезокси-4 -оксоолеандомицин. Диметидсульфид (0,337 мл) прибавляют к мутному раствору 467 мг N-xnopсукцинимида в 20 мп толуола и 6 мл бензола, охлажденных до -5°С и вьщерживают в атмосфере азота. После перемешивания при в течение 20 мин смесь охлаждают до -25с и прибавляют 1,46 г 2 -ацетилолеандомицина и 15 кп Перемешивание продолжают вестолуолатечение 2 ч при , послечего ти в прибавляют 0,46 мл триэтиламина..Реакционную смесь выдерживают еще 5 мня при -20 С и после этого позволяют ей нагреться до 0°С. Смесь выливают при перемешивании в 50 мп воды и 50 мл этилацетата. Величину рН раствора устанавлившот 9,5 путем прибавления водного раствора гидрата окиси натрия.. Органический слой после этого отделяют, сушат над сульфатом натрия и кон центрируют в вакууме для получения белой пены (1,5 г). После растирания с диэтиловым эфиром получают 864 мг сырого продукта, который после перекристаллизации, проведенной два раза из хлористого метилена - диэтилового эфира, даёт 212 мг чистого продукта с т. Ш1. 183-185°С. Найдено, %: С 60,9; Н 8,4; М 1,9. Вычислено, %: С 61,1; Н 8,5; N 1,9 Спектр ядерного магнитного резонанса ((, дейтерированный хлороформ): 5,60 (Ш) мультиппет, 3,50 (ЗН) синглет, 2,73 (2Н) мультиплет, ,23 (6Н) . синглет, 2,03 (ЗН) сикглет. в) 4 -Дезокси-4 -оксоолеандомицин; Раствор 1,0 г 2 -ацетил-4 -дезокси-4 -оксо-олеандомицина в 20 мл метанола перемешивают при комнатной температуре в течение ночи. Раствор концентрируют в вакууме для получения целе вого продукта в форме белой пены, весом 937 мг. Спектр ядерного магнитного резонанса (J дейтерированный хлороформ): 5,60 (1Н) мультиплет, 3,50 (ЗН) синглет, 2,85 (2Н) мультиплет, 2,26 (бН) синглет. Препарат В. 4 -Дезокси-4 -аминоолеандомицин. 1,1-Ацетш1-4 -дезокси-4 -аминоолеандомицин. К суспензии 10 г 10%-ного палладия на угле в 100 мл метанола прибавляют 21,2 г ацетата аммония и полученную взвесь обрабатывают раствором 20 г 11-ацетил-4 дезокси-4 -оксоолеандомицина в 100 мл того же растворителя. Суспензию встряхивают при комнатной температуре в атмосфере водорода при начальном давлении 50 фунтов/кв. дюйм (3,5 кг/см). По прошествии 1,5 ч ката лизатор отфильтровывают и фильтрат прибавляют при перемешивании к смеси из 1200 мл воды и 500 мп хлороформа. Величину рН снижают с 6,4 до 4,5 и органический слой отделяют. Водный слой после экстракции хлорофорйом (500 мл) обрабатывают 500 мп этилаце тата и величину рН устанавливают 9,5 при помощи 1 н.раствора гидрата окиси натрия. Слой этилацетата отделяют и водный слой экстрагируют снова этилацетатом. Экстракты в этилацётате объединяют, сушат над сульфатом натрия и концентрируют до получения желтой пены 08,6 г), которая после перекристаллизации из диизопропилового эфира дает 6,85 г очищенного продукта т. пл. 157,,-Спектр ядерного магнитного резонанса (rf, дейтерирован ный хлороформ): 3,Л (ЗН) синглет, 2,7 (2Н) мультиплет, 2,36 {6Н) синглет и 2,10 (ЗН) синглет. Другой эпимер, который присутствует в сырой пене в количестве 20-25%, получают путем постепенного концентрИ рования и фильтрования маточного раст вора. Аналогичным образом, при употреблении в качестве исходного материала 11-ПРОПИОНИЛ-4-дезокси-4 -оксоолеандомицина при описанном вьше спо собе получают 11-щ)опионил-4 -дезокси -4 -аминоолеандомицин. I I. 4 -Дезокси-4 -аминоолеандомицин. Раствор 20 г 2 -ацетш1-4 -дезокси-4 -оксоолеандомицина в 125 мл метанола после перемешивания в течение ночи при комнатной температуре обрабатывают при помощи 21,2 г ацетата аммония . Полученный раствор охлаждают в ледяной бане и обрабатывают 1,26 г цианоборгидрида натрия. Охлажденную баню удаляют и реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Реакционную смесь выливают в 600 мл вохцз и 600 мл диэтилового эфира и величину рН снижают с 8,3 до 7,5. Эфирный слой отделяют, а водный слой экстрагируют этилацетатом. Экстракты оставляют, величину рН водного слоя повьш1ают до 9,9, Экстракты в да этш1овом эфире и этилацётате объединяют при этой величине рН, промывают последовательно водой (одна порция) и насыщенным рассолом и сушат над сульфатом натрия. Последние экстракты, отобранные при величине рН 9,9, концентрируют для получения и .; хроматографируют на 160 г силикагеля с использованием хлороформа в качестве растворителя и элюента. После одиннадцати фракций по 12 мл элюент заменяют с переходом на 5% метанола - 95% хлороформа. После фракции 370 переходят на 10% метанола - 90% хлороформа, .а посл.е фракции 440 употребляют 15% метанола - 85% хлороформа. Фракции 85-260 объединяют и концентрируют в вакууме для получения 2,44 г целевого продукта. Спектр ядерного магнитного резонанса (о , дейтерированный хлороформ) i 5,56 (Ш) мультиплет, 3,36 (ЗН) .синглет, 2,9 (2Ы) мультиллет и 2,26 (6Н) синглет. Формула изобретения Способ получения производных 4 -дезокси-4 -сульфониланинолеандомицина общей формулы I KHSOjB








| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных 3-пропенил-7- @ 2-(2-аминотиазолил-4)-2-гидроксииминоацетамидо @ -3-цефем-4-карбоновой кислоты или ее сложных эфиров в виде Z- или Е-изомеров или их смесей | 1986 |
|
SU1428204A3 |
| Способ получения гуанидинотиазольных соединений | 1980 |
|
SU876056A3 |
| Способ получения аналогов липида А | 1990 |
|
SU1836378A3 |
| Способ получения производных4-АМиНООлЕАНдОМициНА или иХСОлЕй | 1978 |
|
SU805949A3 |
| Способ получения производных гексагидробензпираноксантенонов | 1978 |
|
SU793395A3 |
| Способ получения 2-гуанидино- 4-(2-замещенный амино-4-имидазолил)-тиазолов или их бромистоводородных солей и способ получения ацетилимидазола | 1983 |
|
SU1195907A3 |
| Способ получения производных оксотиазолидина или их солей | 1987 |
|
SU1493107A3 |
| Способ получения амидов ненасыщенных кислот | 1987 |
|
SU1695825A3 |
| ПРОИЗВОДНЫЕ АЗЕТИДИНОНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1992 |
|
RU2047602C1 |
| Способ получения антрациклиновых гликозидов | 1986 |
|
SU1553015A3 |


Авторы
Даты
1981-08-30—Публикация
1978-05-10—Подача