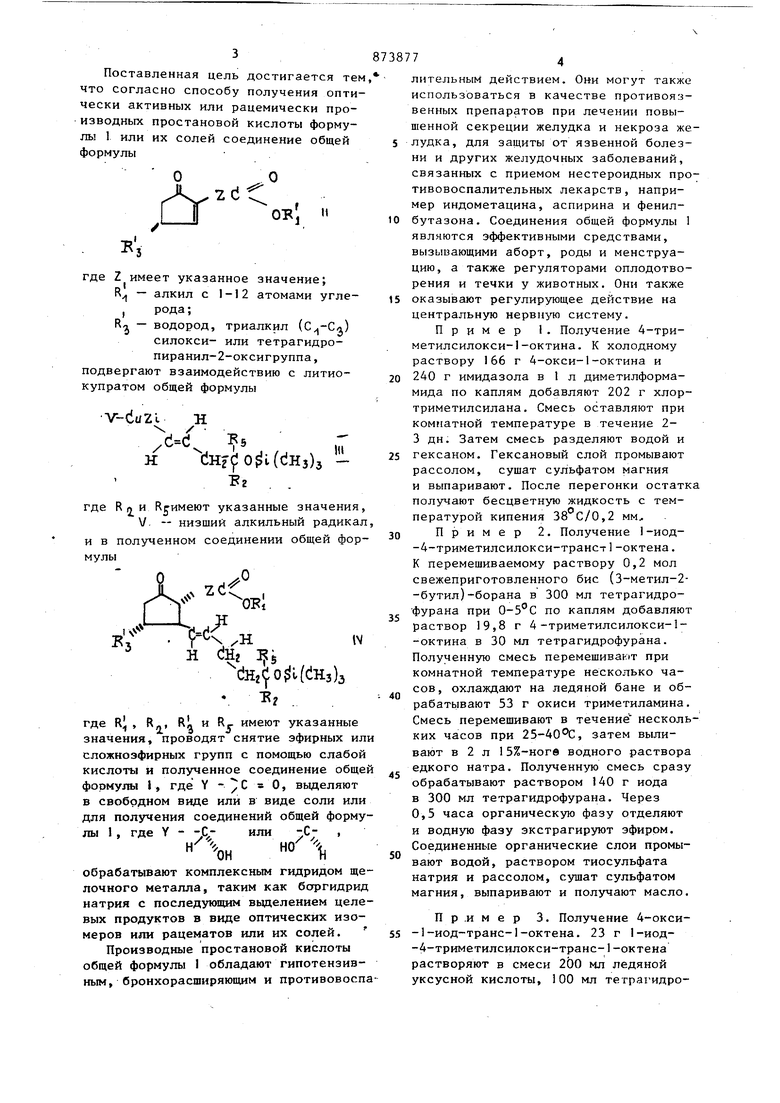
5 фурана .и 50 мл воды. После растворения добавляют толуол и смесь выпаривают. Оставшееся масло хроматографируют на силикагеле гексаном, посте пенно обогащаемом бензолом, затем ацетоном и получают 16 г масла. Пример 4. Получение 4-оксо-1-иод-транс-1-oKTeiia. К перемешиваемой суспензии 6,15 г хлорхромата пиридиния в 20 Mji метиленклооида добавляют 450 мг ацетата натрия. Через 5 мин добавляют за один раз раствор 3,65 г 4-ОКСИ-1-иод-транс-1-октена в 15 мл метиленхлорида, Темную смесь перемешивают при комнатной температу ре 75 мин, разбавляют 50 мл эфира и декантируют. Твердый шламм повторно промывают эфиром и декантируют. Соединенные растворы перколируют через флорисил. Раствор выпаривают и получают оранжевое масло. Пример 5. Получение 4-окси-4-ВИНИЛ-1-иод-транс-1-октена. К пер мешиваемому раствору 7,8 мл винилмагнийхлорида (2,3 М в тетрагидрофуране) при добавляют 15 мин раствор 3,55 г 4-оксо-1-иод-транс-1-рктена в-,20 мл тетрагиДрофурана. После добавления раствор перемешивают 30 мин (-20)-(-15)С. Водную фа зу отделяют и экстрагируют гексаном. Соединенные гексановые экстракты про мывают водой и рассолом. Раствор сушат сульфатом магния и выпаривает. Остаток хроматографируют на силикагеле на сухой колонке бензолом и получают жидкость. Пример 6. Получение 4-триме тилсилокси-4-вилин-1-иод-транс-1 -. -октена. К перемешиваемому раствору 456 мг 4-окси-4-винил-1-иод-транс-1-октена и 320 мг имидазопа в 1 мл диметилформамида добавляют 0,23 мл хлорметилсилана 3 мин. Смесь перемешивают при комнатной температуре 22 ч и разделяют смесью холодного гексана и воды. Гексановый слой дваж ды промьтают водой и рассолом сушат сульфатом магния, выпдривают и получают масло. Пример 7. Получение 9-ркср-lli, I 6-ДИОКСИ-16-ВЙНИЛ-13-транс-йрх стеновой кислоты. К перемешиваемому раствору 555 мг 4-триметилсилокси-4-винил-1-иод-транс-1-октена в 2 мл эфира добавляют раствор третбутиллйтия в п нтане (1,6 М) 10 мин при . Раствор перемешивают при - 78 1,5 ч и при 30 мин и пoлyчaюt 7 1-литио-транс-алкен. В колбе перемешивают смесь 0,2| г 1-медь (1)-1-пен-тина, 0,7 мл триамида гексаметилфосфора и 2 мл эфира до получения Прозрачного, раствора. Этот раствор добавляют IО мин к перемешиваемому раствору 1 -литио-транс-алкена при -78с. Раствор перемешивают 2 ч при - 78 С, затем его обрабатывают раствором 580 мг 4-(триметилсилЬкси)-2-(б-карботриметилсилоксигексил)-циклОпент-2-ен-1-она в 3 мл эфира 10 мин. После выдержки в течение 10 мин при - раствор перемешивают I ч при - 40 до -50С и при -35 до 1 ч. Раствор охлаждают до , выливают в 100 мл насьш1енного раствора хлористого аммония и разбавляют эфиром. Органическую фазу отделяют, промывают водой и разбавленной соляной кислотой, фильтруют через диатомную землю, фильтрат промывают водой и рассолом и сушат сульфатом магния. После вьтаривания раствора получают сырой бис-триметилсилильпый эфир в виде масла. Масло обрабатывают раствором IО мл ледяной уксусной кислоты, 5 мл тетрагидрофурана и 2,5 мл воды. Смесь перемешивают при комнатной температуре 20 мин и разбавляют 50 мл толуола. После выпаривания при ЗЗ-С в вакууме остаток хроматографируют на силикагеле с 1%-ной уксусной кислотой в этилацетате и получают масло. Пример 8. Получение н-бутилциклоцропилкетона. К сильно перемешиваемому раствору 31,0 г циклопропанкарбоновой кислоты в 330 мл эфира. 1 ч при 5-10С добавляют раствор н-бутиллития (748 ммол) в почти 750 мл смеси эфир-гексан 2:1. Полученную суспензию разбавляют 300 мл эфира и перемешивают при комнатной температуре 2 ч и при температуре кипения с обратным холодильником 2 ч. Затем смесь охлаждак1Т и выливают в несколько порций смеси льда и 4 н. соляной кислоты (1:1). Эфирные фазы соединяют вместе, промывают рассолом, раствором карбоната натрия и снова рассо(Пом. Экстракт сушат сульфатом магния и выпаривают. Остаток перегоняют и получают жидкость с температурой кипения 102-104 с/80 мм рт.ст. Пример 9. Получение 4-циклопропил-4-окси-1-октана. К перемешиваемой при кипении с обратным холодильником суспензии амальгАмы, полученной из 6,2 г магния и 50 мг хлорида ртути (2), суспендированной в 60 мл эфира, добавляют 1 ч раствор смеси 30,4 г н-бутил-циклопропилкетона и 29,8 г пропаргилбромида в 65 мл эфира. После реакции при температуре кипения с обратным холодильником смесь охлаждают . где 30 мин до и обрабатывают 35 rui насыщенного раствора хлористого аммония. Затем смесь разбавляют Эфиром и фильтруют через целит. Фильтрат промывают рассолом., сушат карбонатом калия и выпаривают. Остаток перегоняют и получают жидкость с температурой кипения 93-94°С/12 мм рт.ст.
Пример 10. Получение 4-циклопропил-4-триметилсилокси-I-октина. К перемешиваемому раствору 27,8 г 4-циклопропил-4-окси-1-октина и 33,3 г имидазола в 130 мл диметилформамида при 5°С 5 мин добавляют 24 мл хлортриметилсилана. Раствор перемешивают при комнатной температуре 17 ч, затем распределяют в 600 мл гексана и 250 мл ледяной воды. Гексановую фазу отделяют, промывают водой и рассолом. Раствор сушат сульфатом магния, выпаривают и получают жидкость.
Пример 11. Получение 4-циклопропил-4-триметилсилокси-1-(три-н-бутилстаннил)-транс-1-октена. Перемешиваемую смесь 23,8 г 4-циклопропил-4-триметилсилокси-1-октина, 28 м гидрида тои-н-бутилолова и 50 мг азобисизобутиронитрила в атмосфере азота, нагревайт до 85 С. После развившейся экзотермической реакции смесь нагревают 1 ч до 130с.
Сырой продукт вышаривают перегонкой и получают жидкость.
Примеры 12-14. По методике примеру 8 получают по реакции соотвествующего алкиллития с циклопропанкарбоновой кислотой следующие циклопропилалкилкетоны, приведенные в. табл. 1.
Примеры 15-18. По реакции виниллития с требующейся карбоновой кислотой получают следующие винилкетоны, указанные в табл. 2.
Примеры 18(a-d)-20..no метдике примера 9 по реакции пропаргилмагний-бромида с кетонами из табл. 3 получают следующие 4-замещенные-1-алкин-4-олы.
Примеры 21-25. По методике примера 10 приведенные в табл. 4 4-замещенные-1-алкин-4-олы превращают в их соответствующие триметилсилильные эфиры.
Примеры 27-32. По методике примера 11 по реакции гидрида три-н-бутилолова с предшественником 1 -алкинов из табл. 5 получают следующие 1 -(три-н-бутилстаннил)-4-замещенные-4-триметилсилокси-транс-1-алкены.
П р и м е р 33. Получение 9-оксо-1 1 oL, I 6-диокси-1 6-циклопропил-5-цис, 1З-транс-простадиеновой кислоты. К
перемешиваемому раствору 11,54 г 4-циклопропил-4-три-метилсилокси-1 -{три-н-бутилстаннил)-транс- -октена в IО мл тетрагидрофурана при -78 С добавляют 10 мин 9,1 мл 2,4 М н-бутил лития в гексане. Полученный раствор перемешивают при -1Q°C 10 мин, при -40С 1 час и при -40 до 40 мин. К перемешиваемому при раствору добавляют раствор 2,84 г
пентинилмеди, 10,8 мл три-н-бутилфосфина в 25 мл эфира. Полученный раствор перемешивают при -78 С 2 ч, затем его обрабатывают 10 мин раствором 6,03 г 2-(б-триметилсилоксикарбонил г2 )-цис-гексенил-4-триметилcилoкcициклoпeнт-2-eн- 1 -она (табл. 6, ссылка Л) в 20 мл эфира. Через 10 мин раствор перемешивают при -50 до -40®С I ч, затем при -40
до 50 мин. Раствор снова охлаждают до -50°С и выливают в пере- мешиваемую смесь 600 мл насыщенного раствора хлористого аммония и 300 мл эфира; Органическую фазу отделяют
и промывают разбавленной соляной кислотой, водой и рассолом.
Остаток, полученный после выпаривания растворителя, обрабатывают 120 мл ледяной уксусной кислоты, 60 мл тетрагидрофурана и 30 мл воды, смесь перемешивают при комнатной температуре 30 мин, разбавляют 150 мл толуола и выпаривают. Остаток очищают хроматографией на сухой колонке с силикагелем с помощью 1%-ной уксусной кислоты в этилацетате и получают масло.
Примеры. 34-49. 9-OKco-lldl, 16-диокси-простадиеновые или простеновые кислоты из табл. 6 получают
по методике примера 38. В соответствии с описанным способом исходные 1-(три-н-бутилстаннил)-4-триметилсилокси-транс-1-алкены из табл. 6 обрабатывают н-бутиллитием и получают соот ветствующие транс-1-алкенил-литиевые производные, которые после обработки комплексом пентин-меди-три-н-бутилфосфин дают соответствующие транс-1-алкенкупраты, последние обрабатывают 4-оксициклопент-2-ен-1-онами, указанными в табл. 6. Полученные триметилсилильные эфиры 9-оксо-1 loL, 16-бис (триметилсилокси)-простадиеновой или простеновой кислот гидролизуют .обработкой смесью уксусная кислотатетрагидрофуран-вода. Пример 50. Получение 9d, 1Ы 16-триокси-16-циклопропил-5-цис, 13-транс-простадиеновой кислоты. К перемешиваемому раствору 785 мг 9-оксо-1IcL, 16-диокси-16-циклопропил-5-цис, 13-транс-простадиеновой кислоты (пример 33) в.12 мл тетрагидрофурана при -70 С добавляют 12 мл 0,95 М раствора пергидро-9(Ь-борафеналилгидрида лития в тетрагидрофуране. Раствор перемешивают при 30 мин, нагревают до О 15 мин и обрабатывают 0,6 мл воды. Смесь распределяют эфиром и раствором карбоната калия. Водную фазу подкисляют соляной кислотой и экстрагируют этилацетатом. Экстракт промывают водой и рассолом, сушат сульфатом магния и выпаривают. Полученный остаток хроматографируют на колонке с силикагелем с помощью 1%-ной уксусной кислоты в этилацетате и получают вяз кое масло. Примеры 51-67. Восстановление 9-оксо-производных, перечисленных в табл. 7, пергидро-9р -борафеналил гидридом лития по методике примера 50 дает 9с1-окси-простадиеновые и простеновые к-ислоты,указанные в табл. 7. Примеры 68-75. Обработка циклопентенон-алкильных эфиров из табл. 9 купратным производным 1-(три-н-бутилстаннил-А-циклопропил-4-триметилсилокси)-транс-1-октана (пример 11) по методике примера 33 или купратным производным 4-триметилсилОКСИ-4-ВИНИЛ-I-иод-транс-1-октена(пример 6) по методике примера 7 с последующим удалением триметилсилильной группы по методике примера 33 дает алкильные эфиры 1б-замещенных-16-окси- простеновых кислот,указанных в табл. 8. Примеры 76-83. Омыление алкильных эфиров 16-замещенных-16-оксипростеновых кислот из табл. 9 с помощью 0,5 н. едкого кали в смеси метанол-вода 10:1 при комнатной температуре 24 ч с последуюпщм подкислением и экстрагированием эфиром дает 16-3амещенные-16-окси-простадиеновыеили простеновые кислоты из табл. 9. Пример 84. Получение и разделение , 11с6,1 6-триокси-1 6-циклопропил-5-цис-13 -транс-простадиеновой кислоты и 9|3, llct, 16-триокси-16-циклопропил-5-цис-13-транс-простадиеновой кислоты. к перемещиваемому охлаждаемому льдом раствору 350 мг 9-оксо-11о1,16-диокси-16-циклопропил-5-цис, I 3-транс-простадиеновой кислоты в 50 мл этанола добавляют 408 мг боргидрида натрия мелкими порциями в течение 1 мин. Смесь перемешивают при 5 мин при комнатной температуре 1 ч. Основную массу этанола отгоняют, остаток распределяют холодной разбавленной соляной кислотой и этилацетатом. Органическую фазу отделяют и промывают водой и рассолом, сушат сульфатом магния и выпаривают. Оста-. ток хроматографируют на силикагеле и получают масло, элюируют сначала 8i, 1 lei, I 6-триокси-1 6-циклопропил-5-цис-13-транс-простадиеновую кислоту, (второй элюат) масло 9cL, lldL, 16-триоксй-16-циклопропил-5-цис, 13-транс-простадиеиовая кислотач Примеры 85-103. Обработка 9-оксо-простагландинов из табл. 10 боргидридом натрия по методике примера 100 с последующим хроматографи-. рованием дает 9dr-oKCH и 9|Ь-оксй простагландины из табл. 10. Таблица 1










| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных простановой кислоты | 1973 |
|
SU648088A3 |
| Способ получения производных 8,12-диизопростановой кислоты или их солей | 1972 |
|
SU694069A3 |
| Способ получения производных -тетранорпростагландинов или их эпимеров по с -или их солей | 1973 |
|
SU584766A3 |
| Способ получения 9-бромпростановых производных | 1982 |
|
SU1225486A3 |
| Способ получения оптически активных производных простановой кислоты или их рацематов | 1973 |
|
SU656510A3 |
| Способ получения производных 9-фтор-простана или их солей с физиологически приемлемыми основаниями | 1982 |
|
SU1301308A3 |
| Способ получения оптически активных или рацемических 17-аза-производных простагландинов пгф | 1978 |
|
SU730297A3 |
| Способ получения соединений ряда простагландинов | 1973 |
|
SU526283A3 |
| Способ получения производных простановой кислоты | 1973 |
|
SU654167A3 |
| Способ получения производных 16-аминопростагландина или их солей | 1981 |
|
SU1082321A3 |

н-Пропиллитий
12 13 н-Амиллитий
н-Гексиллитий
14
Циклопропил-н-пропилкетон
н-Амилциклопропилкетон
Циклопропил-н-гексилкетон
ример Карбоновая кислота I Целевой алкилвинилкетон
15и-Масляная кислотан-Пропилвинилкетон
16н-Валериановая кислотан-Бутилвииилкетон
17и-Капроновая кислотан-Амилвинилкетои
18н-Энаитовая кислотан-Гексилвинилкетон
Исходный кетон Целевой 4-замещенныйиз примера -1-алкин-4-ол
12 13 14 15 17 18
Целевой 4-триметилсилокси-1- алкии
4-Циклопропил-4-триметилсилокси 8а-1-гептин
4-Циклопропил-4-триметилсилокси18Ь-1-нонин
4-Циклопропил-4-триметилсилокси18с-1-децин
18d
4-Триметилсилокси-4-винил-I-гептин 4-Триметилсилокси-4- винил-1-нонин
19 4-Триметилсилокси-4-винил-1.-децин
20
Таблица2
.Т а 6 л и ц а 3
4-Циклопропш1-4-окси-1-гептин 4-Циклопропил-4-окси-1-нонин 4-Циклопропил-4-окси-1-децин 4-ОКСИ-4-ВИНИЛ-1-гептин 4-ОКСИ-4-ВИНИЛ-1-нонин 4-ОКСИ-4-ВИНИЛ-I-децин
Таблица 4
27 28 29
21 22 23
30 31 32
24 25 26
27
126
34
28
126
35
29
126
36
30
126
37
31
126
38
, 32
126
39
Таблица 5
1-(Три-н-бутилстаннил)-4-циклопропил-4-циклопропил-4-триметилсилокси-транс-1-гептен
I-(Три-н-бутилстаннил)-4-циклопропил-4-триметилсилокси-транс-1-нонен
1-(Три-н-бутилстаннил)-4-цикло-, пропил-4-триметилсилокси-транс-1 децен
1-(Трн-н-бутилстаннил)-4-винил-4-триметилсилокси-транс-1-гептин
1-(Три-н-бутилстаннил)-4-ВИНИЛ-4-триметилсилокси-транс-1-нонен
1-(Три-н-бутилстаннил)-4-винил-4-триметилсилокси-транс-1-децен
Таблица 6
9-ОКСО-1 let, 16-циклопропил-20-Hop-l3-транспростеновая кислота
9-Оксс-Hi, 16-ДИОКСИ-16-циклопропил-20-метил-13-транс-простеновая кисло
9-Оксо-11 dl, 16-ДИОКСИ-16-Ц1 клопропил 20-этил-.13-транс-простеновая кислот
9-Оксо- П cL, 16-диокси-16-винил-20-нор-13-транс-простеновая кислота
9-Оксо-11 d, 16-диокси-16-винил-20-метил-13-транс-простеновая кислота
I
9-Оксо-1 Iti-, 16-диокси-16-ВИНИЛ-20-ЭТИЛ-13-транс-простеновая кислота
40 126П
41
42 А28
43 А29
44 А30
45 А31
46 А32
47А(по методике
примера 7)
48127
49 12811
49А 129
49С 129А11
49Д 129В
fд . 4-триметилсилокси-2-(6-карботриметиясш1окс)-2-циссенил)-циклопент-2-ен-1-он.
Продолжение табл. 6
9-OKCO-I lot, 16-ДИОКСИ-1 6-циклопропил-13-транс-простеновая кислота
9-Оксо-1 let, I 6-диокси-1 6-циклопропил-20-нор-5-цис-13-транс-простадиеноваякислота
9-Оксо-1 Id,16-диокси-16-циклопропил-20-метил-5-цис-13-транс-простадиеноваякислота
9-Оксо-1 Idl, 1 6-диокси-1 6-ЦИКЛОПРОПИЛ-20-ЭТИЛ-5-ЦИС-13-транс-простадиеноваякислота
9-ОКСО-1 IcL, 16-диокси-16-ВИНИЛ-20-НОР-5 -цис,13-транспростадченовая кислота
9-ОКСО-1 let, 1 6-диокси-1 6-винил-20-метил-5-цис, 13-транс-простадиеновая кислота
9-Оксо-1 l-d-, 1 6-диокси-16- -ВИНИЛ-20-ЭТИЛ-5-ДИС,13-транс-простадиеновая кислрта
9-Оксо-1 1 oL, 16-диокси-1 6-ВИНИЛ-5-ЦИС,I3-транс-простадиеновая кислота
Метиловый эфир 1-9-оксо-1 lot, 16-диокси-16-винил-13-транс-простеновой кислоты
Метиловый эфир 1-9-оксо-1 loL, 16-диокси-16-циклопропил-5-ци-13-транс-простадиеновой кисл
9-Оксо-11 d, 16-диокси-16-винил-5-цис-13-транс-2а,2в-бисгомопростадиеновая кислота
9-Оксо-1 Id,16-диокси-16-циклопропил-13-транс-З-окса-простеновая кислота
9-Оксо-1 1 el, 16-диокси-1 6-винил-13-транс-З-окса-простеноваякислота
гек34 35
36 37 38 39 40 41
42 43
44 45 46 47 7
48 49
49А
Таблица 7
9 d, 11 oL, 1 6-Триокси-16-циклопропил-20-HOp-i 3-тр.анс-простеновая кислота 9о1., 1 lot/, 1 6-Триокси-1 6-циклопропил-20-метил-13-транс-простеновая кислота
., 1 I dl, 1 6-Триокси-1 6-циклопропил-20-этил-13-транс-простеновая кислота
9с1 1 I cL, 1 6-Триокси-16-винил-20-нор-13-транс-простеновая кислота
9А, 1 Id, 16-Триокси-16-ВИНИЛ-20-метил-13-транс-простеновая кислота
9А, I Id, 16-Триокси-16-ВИНИЛ-20-ЭТИЛ -13-транс-простеновая кислота
9d., 1 Id, 16-Триокси-1.6-циклопропил-I3-транс-простеновая кислота
9d 1 Id, 16-Триокси-16-циклопрог(ил-20-нор-5-цис, 13-транс-простадиеновая кислота
9с1., 1 Id, I 6-Триокси-1 6-цикло11ропил-20-метил-5-цис,13-транс-простадиеновая кислота
.9d, 1 Id, 16-Триокси-16-циклопропил-20-ЭТИЛ-5-ЦИС, 13-транс-простадиеновая кислота
9d, 11d,6-Триокси-16-винил-20-нор-5-цис,13-транс-простадиеновая кислота
9d, 11 d, 1 6-Триокси-16-Bif нил-20-метил-5-цис, I3-транс-простадиеноная кислота
9bL, I Id, 16-Триокси-16-ВИНИЛ-20-ЭТИЛ-5-цис, 13-транс-простадиеновая кислота
9оЦ 1 Id,16-Триокси-16-ВИНИЛ-5-ЦИС, 13-транс-простадиеновая кислота
9А, 1 Id, 16-Триокси-16-ВИНИЛ-13-транспростеновая кислота
Метиловый эфир 1-9d, 11 d, 16-триокси-16-ВИНИЛ-13-транс-простеновой кислот
Метиловый эфир 1-9oU 11 d, 16-триокси-16-циклопропил-5-цис-13-транс-простадиеновой кислоты
Id, 16-Триокси-1 6-винил -5-цис-13-транс-2а,2в-бис-гомопростадиековая кислота
19
9б1, I i, 16-Триокси-1 6-циклопропил-5-цис, 13-трайс-2а,2в-бисгомопростадиеновая кислота
9oL, П i, 16-Триоксициклопропил-1 3-транс-3-окса-простеновая кислота
9о1, Id,, 16-Tpиoкcи-16-винил-13-тpaнc-3-oкca-пpocтeнoвaя кислота
Исходный 1-(триИсходный алкильный эфир -н-бутилстаннилциклопентенона-4-триметилсилокси)-транс-1-алкен из примера
2-(6-Карбометокси-2-цис-гексенил)циклопент-2-ен-1-он
(патент США №3873067)
2-(б-Карбометокси-2-цис-гексенил)цикло-пент-2-ен-1-он(патент США № 3873607)
2-(б-Карбэтоксигексил)-2-циклопентенон(патент США № 3873607)
2-(б-карбэтоксигексил)-2-циклопен генон(патент США № 3873607)
2-(б-Карбэтокси-5-тиагёксид)-2-циклрпентенон
2-(б-Карбэтокси-5-тиа-гексил)-2-циклопентенон
(патент США № 3873607)
2-(б-Карбэтокси-5-оксагексил)-2-циклопентенон (патент США 3873607)
2-(б-Карбэтокси-5-оксагексил)-2-циклопентенен (патент СЩА № 3873607)
20
Таблица 8
Целевой алкильный эфир 16-замещенной-1 -окси-простадиеновойили простеновой кислоты
етш1-9-оксо-16-оксиг
-16-циклопропил-5-цис, 13-транс-простадиеноат.
Метил-9-оксо-16-окси-16-ВИНИЛ-5-ЦИС,13-транс-простадиеноат
Этил 9-ОКСО- 6-ОКСИ-16-циклопропил-13-транс-простеноат
Этил 9-ОКСО-16-ОКСИ-16-винил-13-транс-простено
X.
Этил-9-оксо-16-окси-16-винил-3-т иа-13-транс-простеноат
Этил-9-оксо-16-окси-16-циклопропил-З-тиа-13-транс-простеноат
Этил 9-оксо-16-окси-16винил-З-окса-13-транспростеноат
Этил 9-оксо-16-окси-16-циклопропил-3-окса-13-транс-простеноат
9eL//J, I 1 dL, 16- Триокси-1 6-циклопропил-20-нор-1 3-транс-простеновая кислота
9ol//i, 1 Idl 16-Триокси-1 6-циклопропил-20-метил-13-транс-простеновая кислота
9oL/Ib, 11d, 16-Триокси-16-циклопропил-20-этил- -13-транс-простеновая кислота
9d/|i, 11(1,16-Триокси-16-винил-20-нор-13-транс-простеНовая кислота
9о1/(Ь, I lot, 1 6-Триокситвинил-20-метил-1 3-транс-простеновая Кислота
9d/(b,l1А,16-Триокси-16-винил-20-этил-13-тран-простеновая кислота
9A/tb, 114,16-Триокси-16-циклопропил-1 3-транс-простеновая кислота
9dl/fb, 11 cL, 1 6-Триокси-16-циклопропил-20-нор-5-цис, I3-транс-простадйеновая кислота
9tl/ft, 1 Id/, 16-Tpиoкcи-16-циклoпpoпил-20-мeтйл-5-циc, 13-транс-простадиеновая кислота
Таблица 9
Таблица 10
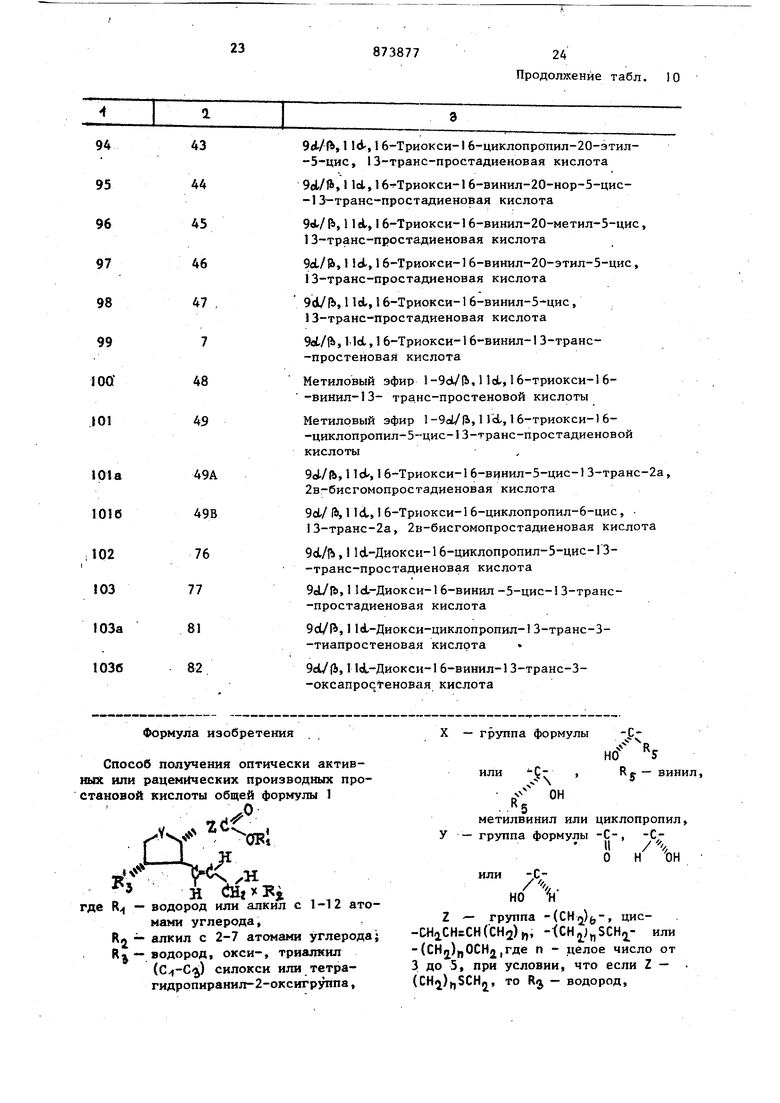
овой кислоты общей формулы 1
1 - OFl
Н (
1-12 атоводород или алкил с
R-, нами углерода,
RA алкил с 2-7 атомами углерода;
R - водород, ОКСИ-, триалкил () силокси или тетрагидропиранил-2-оксигруппа,
- ,е ОН
метилвинил или циклопропил,
группа формулы С
%н
/
Н
А.
или
НО и
Z - группа -(СНо)(,-, цис-CHaCH CH(CH2)rt, -tCHj J SCH - или -(СН2)„ОСН2,где п - целое число от 3 до 5, при условии, что если Z - (CH.i),SCHj, то Rj - водород.
Авторы
Даты
1981-10-15—Публикация
1977-07-19—Подача