Изобретение относится к медицине, а именно, к лепрологии, и может быть, в частности, использовано для моделирования лепрозной инфекции in vivo.
Известен способ стимулирования размножения микобактерий лепры в организме интраплантарно зараженной мыши, заключающийся в подавлении иммунитета мышей путем предварительной (до заражения) тимэктомии и облучения кобальтовой пушкой [1] При использовании этого способа увеличение количества микобактерий в месте инокуляции с 104 до 106 достигается через 5 месяцев после заражения, через 8 месяцев отмечается образование лепроматозных структур в месте инокуляции, а через 11-14 месяцев после заражения может развиться генерализация лепрозного процесса. К недостаткам способа относится техническая трудность выполнения манипуляций, необходимость сложной аппаратуры и специальных условий содержания атимусных животных, а также недостаточное сокращение сроков локального размножения микобактерий и позднее развитие лепроматозных структур и генерализации лепрозного процесса.
Известен способ моделирования лепры, заключающийся в воздействии на макрофагальное звено иммунитета путем многократного дренажа брюшной полости мыши с последующим интраплантарным заражением дозированным количеством микобактерий [2] При этом способе через 3 месяца достигается достоверное увеличение количества микобактерий в месте инокуляции, а через 6 месяцев в части случаев развивается генерализация лепрозной инфекции с образованием лепроматозных структур во внутренних органах. К недостаткам способа относится трудоемкость (10-12 манипуляций дренажа брюшной полости, травматичность манипуляций) и необходимость соблюдения условий стерильности.
Известен способ интраплантарного заражения мышей микобактериями лепры, заключающийся в том, что мыши в подушечку лапы вводят дозированное количество (104) микробных тел. Через 8-12 месяцев количество микобактерий в месте инокуляции возрастает до 106. При последующих пассажах из лапы в лапу увеличение количества микобактерий с 104 до 106 наступает через 6-8 месяцев после инокуляции [3] Развития лепроматозных структур в месте инокуляции и генерализации лепрозной инфекции при использовании этого способа не отмечается. Существенным недостатком способа является длительный срок до получения результатов, а также невозможность получения генерализации лепрозного процесса.
Этот способ принят в качестве прототипа для моделирования лепрозной инфекции in vivo.
Целью изобретения является ускорение размножения микобактерий лепры in vivo.
Цель достигается тем, что к интраплантарно вводимой мышам взвеси микобактерий лепры добавляют синтетический тетрапептид тафцин в дозе 0,2-20,0 мкг/мышь.
Отличительной особенностью осуществления способа является использование синтетического тетрапептида тафцина в соответствующих дозировках. Кроме того, при осуществлении способа применяется не используемый ранее метод введения тафцина экспериментальным животным в составе инфекционного материала.
Поскольку микобактерии лепры не культивируются на питательных средах, воспроизведение инфекции на лабораторных животных является актуальной проблемой современной лепрологии. Моделирование лепрозной инфекции в эксперименте позволяет изучать биологию возбудителя заболевания, отдельные стороны патогенеза лепры, а также осуществлять поиск и отбор препаратов с потенциальной противолепрозной активностью.
Применение cинтетического тетрапептида тафцина в соответствующей дозировке позволяет значительно сократить сроки размножения микобактерий лепры в месте инокуляции (в 3-4 раза по сравнению с прототипом), а также получить через 6-8 месяцев после заражения генерализацию лепрозного процесса.
Сущность предлагаемого способа моделирования лепры с целью ускорения размножения микобактерий лепры заключается в следующем: в суспензию, приготовленную из ткани подушечек лап мышей, зараженных M.leprae по методу Shepard, McRae (1968) (Shepard C.C. McRae D.H.A. A method of counting acid-fast bacteria // Int. J. Leprosy. 1968. Vol.36. P.78-82). Однако перед окончательным разведением вводили промежуточный этап, при котором количество микобактерий в суспензии доводили до 2•104. Затем суспензию разводили в 2 раза соответствующим раствором тафцина с тем, чтобы во вводимой суспензии была требуемая концентрация тафцина, а количество микобактерий составляло 1•104. Приготовление растворов тафцина производили следующим образом: 4 мг порошкообразного тафцина ("SERVA", Германия) разводили в 3 мл физиологического раствора. Полученный маточный раствор использовали для разведения суспензии микобактерий. Для получения конечной концентрации тафцина 20,0 мкг/мышь разводили следующим образом: 3,0 мл раствора, содержащие 4,0 мг тафцина, сливали с 3,0 мл суспензии, содержащей 2•104 микробных тел M.leprae. В результате в каждой вводимой мышам дозе (0,03 мл) содержалось 20,0 мкг тафцина и 1•104 микробных тел M.leprae. Для получения более низких концентраций тафцина (2,0; 0,2) маточный раствор тафцина разводили соответственно в 10 и 100 раз. В подушечку задней лапы мыши производят инокуляцию 0,03 мл суспензии, содержащей 1•104 микобактериальных тел и соответствующего количества тафцина. В качестве контроля этой же суспензией, но без тафцина заражают группу мышей. С целью выявления пригодности предлагаемого способа для скрининга соединений на противолепрозную активность части животных (как с тафциной, так и без тафцина) в течение всего срока эксперимента применяли противолепрозное лечение в виде кормолекарственной смеси по известному способу, заключающемуся во введении в корм дапсона в концентрации 0,001 г на 100 г корма и рифампицина в концентрации 0,003 г на 100 г корма (Laboratory techniques for leprosy, Geneva. 1987. P.70-70).
Мыши забиваются группами опыт-контроль в сроки от 2 до 8 месяцев. Из подушечки лапы готовится суспензия и подсчитывается количество микобактерий в лапе. Наличие лепроматозных структур определяется на основании гистологического исследования ткани органов.
Предлагаемый способ апробирован в научно-исследовательском институте по изучению лепры в течение 1990-1991 гг.
Опыты были поставлены на 760 мышах линии CBA с первоначальным весом 25,0 г. Ниже приводятся результаты апробации.
Все опыты, указанные в табл.1-4, проведены с применением одной суспензии. Для всех опытов общий контроль: заражение этой суспензией без добавления тафцина.
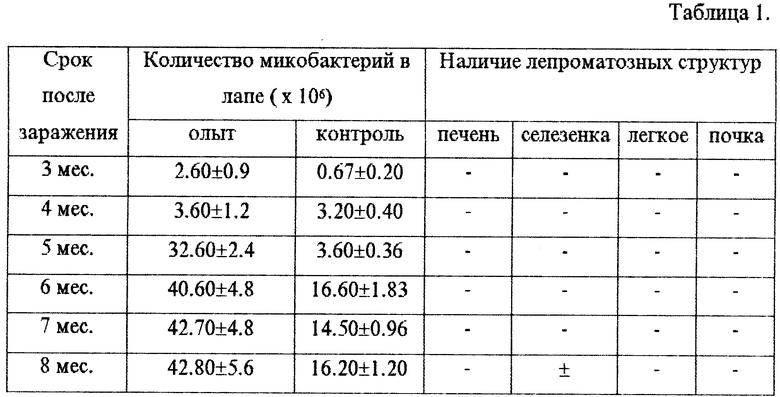
Пример 1. Интраплантарно заражено 60 мышей взвесью микобактерий лепры (104 микобактерий на мышь) с добавлением тафцина в дозировке 0,2 мкг препарата на мышь и 40 мышей этой же взвесью без тафцина (контроль). Мыши забивались группами опыт-контроль в сроки 3,4,5,6,7 и 8 месяцев. Подсчитывали количество микобактерий в лапе, проводили гистологическое исследование органов. В табл.1 приведены показатели подсчета микобактерий на лапу и результаты гистологического исследования органов. В контрольных экспериментах (без тафцина) лепроматозные структуры не обнаруживались и в табл.1 не отражены.
Заключение. Добавление к суспензии интраплантарно инокулируемой взвеси микобактерий лепры тетрапептида тафцина в дозировке 0,2 мкг препарата на мышь приводит к достоверному ускорению размножения микобактерий в подушечке лапы сравнительно с контролем (та же взвесь без тафцина). Через 8 месяцев после заражения в отдельных опытах с применением тафцина отмечается наличие лепроматозных структур в ткани селезенки.
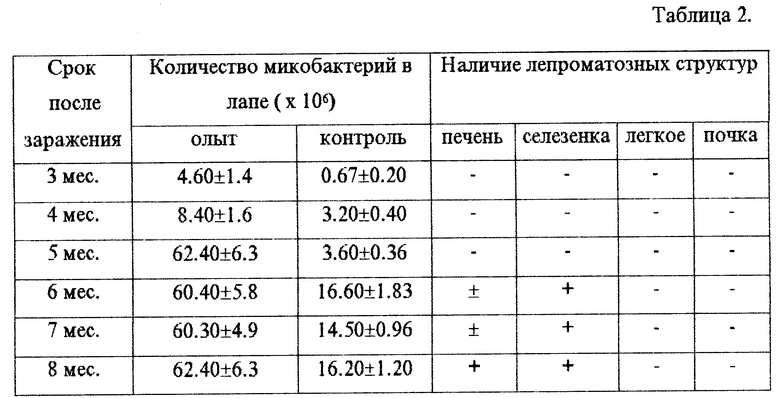
Пример 2. Условия эксперимента как в примере 1, дозировка тафцина 20,0 мкг препарата на мышь. Опыт 60 мышей, контроль (без тафцина) 40 мышей. Результаты представлены в табл.2.
Заключение. Добавление к инокулируемой интраплантарно взвеси микобактерий лепры тетрапептида тафцина в дозировке 20,0 мкг препарата на мышь приводит к достоверному ускорению размножения микобактерий в подушечке лапы сравнительно с контролем (введения той же взвеси без добавления тафцина). Через 6 месяцев и далее после заражения в большинстве опытов отмечается развитие лепроматозных структур в селезенке, в отдельных опытах в ткани печени при отсутствии лепроматозных структур в ткани легких и почек.
Пример 3. Условия эксперимента как в примере 1, дозировка тафцина 2,0 мкг на мышь. Опыт 60 мышей, контроль (без тафцина) 40 мышей. Результаты представлены в табл.3.
Заключение. Добавление к инокулируемой интраплантарно взвеси микобактерий лепры тетрапептида тафцина в дозировке 2,0 мкг на мышь приводит к достоверному ускорению размножения микобактерий в подушечке лапы сравнительно с контролем (введение той же взвеси без добавления тафцина). Через 6-8 месяцев после заражения в большинстве опытов отмечается наличие лепроматозных структур в ткани печени, селезенки, легких и почки, что свидетельствует о генерализации лепрозной инфекции.
Пример 4. Условия эксперимента как в примере 1, дозировка тафцина 0,02 и 100,0 мкг на мышь. Опыт 120 мышей, контроль (без тафцина) 40 мышей. Результаты представлены в табл.4.
Заключение. Добавление к инокулируемой интраплантарно взвеси микобактерий лепры тетрапептида тафцина в дозировке 0,02 мкг и 100,0 препарата на мышь не приводит к достоверному ускорению размножения микобактерий в подушечке лапы сравнительно с контролем (введение той же взвеси без добавления тафцина). Развития лепроматозных структур в ткани внутренних органов не наблюдается.
Анализ приведенных примеров показывает, что наиболее стабильные результаты как в отношении ускорения размножения микобактерий в подушечке лапы мыши, так и в отношении развития лепроматозных структур в ткани внутренних органов мыши достигаются при дозировке тафцина 2,0 мкг препарата на мышь.
Проверка пригодности предлагаемой модели экспериментальной лепры для проведения скрининга соединений на противолепрозную активность осуществляли при дозировке тафцина 2,0 мкг препарата на мышь. В качестве тест-препаратов использовали базовые противолепрозные препараты диафенил-дисульфон (дапсон) и рифампицин.
Лечение осуществляли в виде применения кормолекарственной смеси, которую мыши получали в течение всего эксперимента. Дозировка дапсона 0,001 г на 100 г корма, дозировка рифампицина 0,003 г на 100 г корма, что соответствует общепринятой практике выяснения лекарственной чувствительности к этим препаратам.
Пример 5. Опыт поставлен на 360 мышах. Осуществлено 6 серий экспериментов: 1) заражение взвесью микобактерий в дозе 104 микобактерий на мышь с добавлением тафцина в дозе 2,0; 2) заражение той же взвесью без добавления тафцина; 3) заражение той же взвесью с добавлением тафцина, лечение дапсоном. 4) Заражение той же взвесью без добавления тафцина, лечение дапсоном (контроль); 5) заражение той же взвесью с добавлением тафцина, лечение рифампицином; 6) заражение той же взвесью без добавления тафцина, лечение рифампицином (контроль). Мыши забивались группами опыт-контроль в сроки 3,4,5,6,7 и 8 месяцев. По известному способу подсчитывалось количество микобактерий на лапу. Результаты подсчета представлены в табл.5. При гистологическом исследовании развитие лепроматозных структур отмечено только в первой серии экспериментов, т.е. при заражении взвесью микобактерий с добавлением тафцина и без лечения.
Проведенный анализ патентной и научной литературы показал, что в известных способах моделирования лепры ни тафцин, ни другие олигопептиды не применялись. По данным научной литературы, тафцин при использовании в опытах in vivo обладает выраженным направленным влиянием на фагоцитарные системы организма, в том числе на макрофаги, которые являются клеткой-хозяином для микобактерий лепры. Сведений о применении тафцина при лепре в научной и патентной литературе не имеется. Кроме того, во всех экспериментальных исследованиях с использованием тафцина и других олигопептидов введение этих препаратов осуществлялось в виде внутрибрюшинных, внутривенных и внутримышечных инъекций. Введение таких препаратов в составе инфекционного материала не применялось и является оригинальным. Именно сочетание двух новых для экспериментальной лепрологии приемов, а именно: применение олигопептида тафцина как препарата с направленным воздействием на макрофаги; введение тафцина в соответствующей дозировке в виде однократной инъекции в составе суспензии микобактерий лепры позволило получить положительный эффект в виде значительного сокращения сроков достоверного увеличения содержания микобактерий лепры в месте инокуляции в 3-4 раза по сравнению с прототипом, а также в виде развития генерализованного лепрозного процесса. Примененное в заявляемом способе направленное воздействие на макрофаг с помощью тафцина и оригинальный способ его введения в составе инокулята (суспензии микобактерий) являются существенным отличием в подходе к моделированию лепры на иммунологически интактных мышах, и именно эти отличия позволили получить положительный эффект в виде значительного сокращения сроков достоверного увеличения содержания микобактерий в месте инокуляции и развития генерализации процесса через 6-8 месяцев после заражения. Кроме того, выяснено полное сохранение чувствительности микобактерий к действию противолепрозных препаратов, что значительно расширяет диапазон применения способа.
Применение предлагаемого способа позволяет изучать отдельные стороны патогенеза лепрозной инфекции, а также осуществлять скрининг препаратов с потенциальной противолепрозной активностью, что способствует расширению арсенала противолепрозных средств для лечения больных лепрой.
Предлагаемый способ может быть рекомендован для использования в научных и клинических лабораториях противолепрозных учреждений системы здравоохранения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ МОДЕЛИРОВАНИЯ ЛЕПРОЗНОЙ ИНФЕКЦИИ | 1995 |
|
RU2102482C1 |
| СПОСОБ ИММУНОПРОФИЛАКТИКИ ЭКСПЕРИМЕНТАЛЬНОЙ ЛЕПРОЗНОЙ ИНФЕКЦИИ | 1996 |
|
RU2135196C1 |
| СПОСОБ ЛЕЧЕНИЯ ЭКСПЕРИМЕНТАЛЬНОЙ ЛЕПРОЗНОЙ ИНФЕКЦИИ | 1999 |
|
RU2188003C2 |
| Способ моделирования лепры | 1987 |
|
SU1439665A1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ДЕФЕКТА МАКРОФАГОВ | 1994 |
|
RU2105352C1 |
| СПОСОБ ЛЕЧЕНИЯ ЭКСПЕРИМЕНТАЛЬНОЙ ЛЕПРОЗНОЙ ИНФЕКЦИИ | 2011 |
|
RU2467742C1 |
| СПОСОБ ДЛИТЕЛЬНОГО ХРАНЕНИЯ МИКОБАКТЕРИЙ ЛЕПРЫ | 2019 |
|
RU2737149C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ГРУППЫ РИСКА РЕЦИДИВА ЛЕПРЫ | 1993 |
|
RU2082979C1 |
| СПОСОБ ЛЕЧЕНИЯ ЭКСПЕРИМЕНТАЛЬНОЙ ЛЕПРОЗНОЙ ИНФЕКЦИИ | 2006 |
|
RU2322991C1 |
| ЖИДКАЯ ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКОБАКТЕРИЙ ИЗ ЛЕПРОМ БОЛЬНЫХ ЛЕПРОЙ | 2009 |
|
RU2403282C1 |
Использование: изобретение относится к медицине, а именно к лепрологии, и может быть, в частности, использовано для моделирования лепрозной инфекции in vivo. Сущность: при интраплантарном заражении экспериментальных животных микобактериями лепры в дозе 1•104 микробных тел на мышь к интраплантарно вводимой животным взвеси микобактерий лепры добавляют синтетический тетрапептид тафцин в дозировке 0,2-20,0 мкг/мышь. Технический результат: изобретение позволяет значительно сократить сроки достоверного увеличения содержания микобактерии лепры в месте инокуляции, а также сроки развития генерализованного лепрозного процесса. 5 табл.
Способ моделирования лепры, заключающийся в интраплантарном заражении экспериментальных животных микобактериями лепры в дозе 1•104 микробных тел на мышь, отличающийся тем, что к интраплантарно вводимой мышам взвеси микобактерий лепры добавляют синтетический тетрапептид тафцин в дозировке 0,2 20,0 мкг/мышь.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Rees R.J.W.Enhanced susceptibility of thymectomiced and irradiated mice to infection with Mycobacterium leprae "Nature, - 1966, v | |||
| Способ добывания бензина и иных продуктов из нефти, нефтяных остатков и пр. | 0 |
|
SU211A1 |
| Конденсатор | 1923 |
|
SU657A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| SU, авторское свидетельство, 1439665, кл | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Shepard C.C | |||
| The experimental diseace follous the injection of human feprosy bacilli into foot-pads of mice | |||
| // Jornal Experimental Medicine, 1961, v | |||
| Прялка для изготовления крученой нити | 1920 |
|
SU112A1 |
| ПРИСПОСОБЛЕНИЕ ДЛЯ АВТОМАТИЧЕСКОЙ БОКОВОЙ СТАБИЛИЗАЦИИ | 1921 |
|
SU445A1 |
Авторы
Даты
1997-12-10—Публикация
1993-04-26—Подача