Изобретение относится к микробной экологии и биотехнологии. Технический результат - создание оптимальных условий для преимущественного выделения пропанокисляющих родококков из смешанных природных и промышленных популяций.
Пропанокисляющие родококки представляют интерес для биотехнологии и защиты окружающей среды как биодеструкторы различных классов углеводородных поллютантов, потенциальные продуценты незаменимых аминокислот, витаминов и биосурфактантов (Ившина, 1992; Ившина и др., 1987, 1996; Каталог штаммов..., 1994). Благодаря экологически важной способности усваивать в качестве единственного источника углерода и энергии газообразные н-алканы (пропан, н-бутан), недоступные для большинства других прокариотных организмов, газоокисляющие родококки - доминирующий компонент естественного биоценоза "бактериального фильтра" районов нефтяных и газовых залежей (Ившина и др., 1981).
Несмотря на преобладание представителей рода Rhodococcus в природных газоассимилирующих популяциях, выделение их из естественных субстратов всегда сопряжено с большими затратами труда и времени. Трудность выделения газоиспользующих родококков связана с тем, что последние развиваются в накопительной культуре в характерном сообществе с быстрорастущими спутниковыми микроорганизмами, не усваивающими газообразные н-алканы, развивающимися за счет экзометаболитов родококков и тормозящими рост последних (Ившина и др., 1995).
Для подавления нежелательной микрофлоры при направленном выделении бактерий определенных родов и видов широко используются антибиотические вещества и их комбинации. При изучении возможности использования отдельных антибиотических веществ для подавления развития сопутствующих микроорганизмов при изоляции пропанокисляющих родококков из природных сред (Ившина и др., 1990; Куюкина, 1995) учитывалась выявленная нами закономерность повышения антибиотикорезистентности родококков в условиях индукции пропанмонооксигеназной активности (табл. 1). Как видно из табл. 1, пропанокисляющие родококки при их росте на пропане демонстрируют резкое снижение чувствительности к гентамицину, неомицину, оксацилину, эритромицину и хлорамфениколу и хорошую устойчивость к воздействию линкомицина, олеандомицина, полимиксина и налидиксовой кислоты (зоны ингибирования составляют менее 10 мм или отсутствуют).
Исследование состава пропанокисляющих культур накопления, выделенных из различных природных субстратов нефтепромысловых районов, выявило наряду с доминирующим пропанокисляющим компонентом, представленным исключительно Rhodococcus ruber, присутствие большого числа спутниковых микроорганизмов - представителей отдельных видов косурий, микрококков и псевдомонад, не способных усваивать газообразные углеводороды и тормозящих развитие газоиспользующих родококков.
Изучение чувствительности к антибиотикам естественных спутников пропанокисляющих родококков выявило высокую чувствительность грамотрицательных псевдомонад к полимиксину, налидиксовой кислоте и хлорамфениколу, грамположительных микрококков и косурий - к хлорамфениколу, линкомицину, эритромицину.
Обнаруженная разница в антибиотикочувствительности родококков в условиях их роста на пропане и бактерий-спутников позволила отобрать пять антибиотических веществ (линкомицин; полимиксин, хлорамфеникол, эритромицин и налидиксовую кислоту), различных по спектру антимикробного действия, в качестве селективных агентов для предотвращения развития нежелательных микроорганизмов при выделении пропанокисляющих родококков.
В экспериментах по выявлению оптимальных концентраций отобранных антибиотиков с использованием искусственных бактериальных ассоциаций показано, что для подавления роста грамположительных бактерий (косурий и микрококков) наиболее успешным является использование линкомицина в концентрации 90 мкг/мл и эритромицина - 2,5 мкг/мл; для ингибирования развития грамотрицательных микроорганизмов (псевдомонад) - 100 Ед/мл полимиксина и 20 мкг/мл налидиксовой кислоты. Хлорамфеникол в концентрации 20 мкг/мл проявляет комплексное воздействие, угнетая рост обеих групп микроорганизмов. Данные концентрации антибиотиков практически не оказывают отрицательного влияния на жизнедеятельность пропанокисляющих родококков.
К минеральной основе известной питательной среды К (Малашенко и др., 1973), содержащей (г/л): нитрат калия 1,0; однозамещенный фосфат калия 1,0; двузамещенный фосфат калия 1,0; хлористый натрий 1,0; сернокислый магний 0,2; хлористый кальций 0,02; хлорное железо 0,01, рекомендовано внесение пропана в качестве единственного источника углеродного питания и следующих антибиотиков (и их оптимальных сочетаний) в качестве селективных добавок: либо хлорамфеникола (20 мкг/мл); либо смеси линкомицина (90 мкг/мл) и полимиксина (100 Ед/мл); либо смеси эритромицина (2,5 мкг/мл) и налидиксовой кислоты (20 мкг/мл).
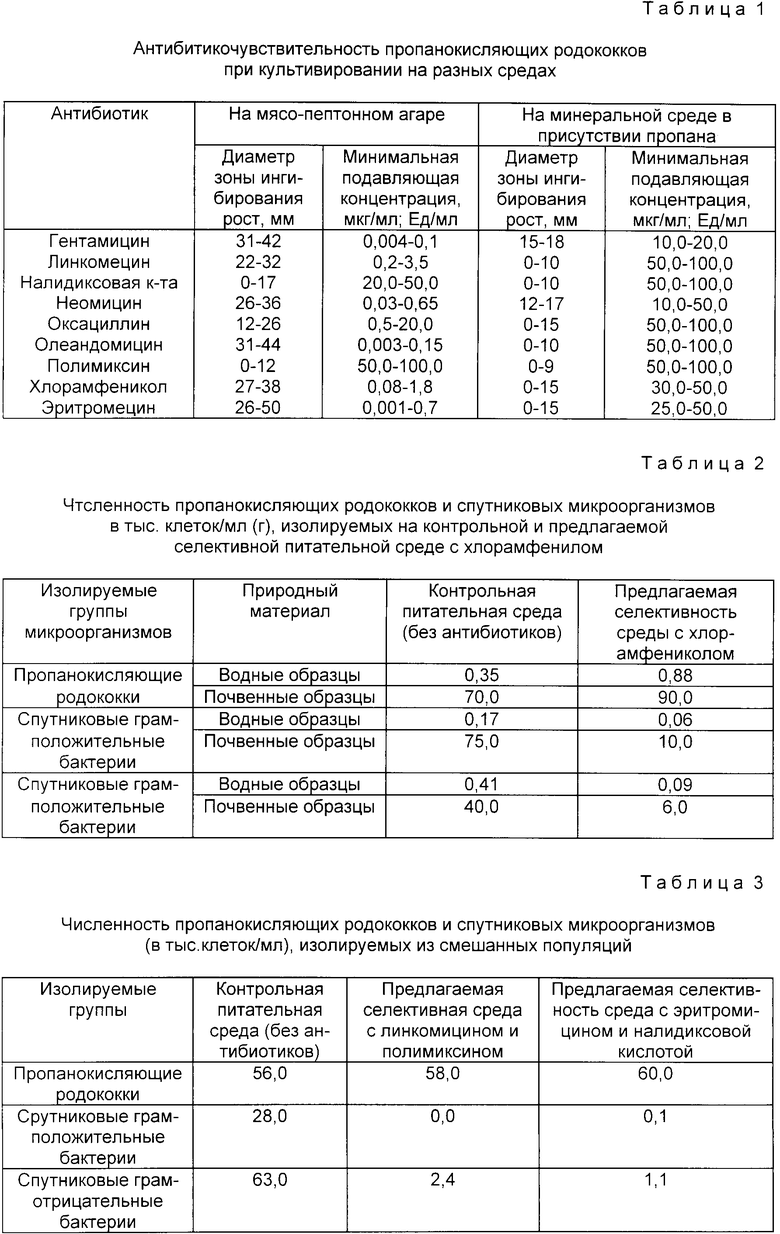
Предлагаемые варианты селективной питательной среды характеризуются высоким селективным индексом (85-98%) по сравнению с таковым (38%) контрольной среды без антибиотиков (чертеж). Они эффективны для выделения чистых культур пропанокисляющих родококков из водных и почвенных экосистем и рекомендуется для использования в экологических (популяционных) исследованиях пропанокисляющих родококков и при культивировании их смешанных культур в нестерильных производственных условиях.
Для полного выявления пропанокисляющих родококков из почвенных образцов дополнительно необходимо использование ультразвукового воздействия на образцы в следующем режиме: частота ультразвуковых колебаний 22 кГц, сила тока 0,3 А, экспозиция озвучивания 5 мин.
Сущность изобретения заключается в том, что разработанный способ селективной изоляции пропанокисляющих родококков из смешанных природных популяций включает предварительную подготовку природных образцов к анализу с последующим высевом их на питательную среду с пропаном в качестве единственного источника углеродного питания и антибиотическими добавками в качестве селективных агентов, не оказывающих ингибирующего воздействия на пропанокисляющие родококки при выделении их из природных источников на пропансодержащей среде и подавляющих рост естественных спутников родококков - представителей отдельных видов косурий, микрококков и псевдомонад.
Пример 1. Способ селективной изоляции пропанокисляющих родококков из водных и почвенных образцов.
Приготовление селективной питательной среды. Используют минеральную основу известной среды К (Малашенко Ю.Р., Романовская В.А., Богаченко В.Н., Хотян Л. В. , Волошин Н.В. Особенности углеродного питания микроорганизмов, растущих на природном газе. - Микробиология. 1973. Т. 42. Вып. 3. с. 403-408), включающую следующие ингредиенты (в г/л):
KNO3 - 1,0
K2HPO4 - 1,0
KH2PO4 - 1,0
NaCl - 1,0
MgSO4 - 0,2
CaCl2 - 0,02
FeCl3 - следы
Агар-агар - 18,0
Дистиллированная вода - остальное
pH - 6,8 - 7,0
Стерилизация при 121oC в течение 30 мин.
Дополнительно готовят основной раствор хлорамфеникола: 0,2 г в 100 мл стерильной дистиллированной воде. 10 мл основного раствора добавляют в приготовленную стерильную минеральную основу (для получения концентрации хлорамфеникола в среде 20 мкг/мл).
Приготовление почвенного образца. Почвенные образцы подвергают специальной обработке. Для этого 1 г среднего образца помещают в коническую 100-миллиметровую колбу с 9 мл стерильной водопроводной воды. Встряхивают в течение 2 мин и подвергают ультразвуковой обработке на низкочастотном диспергаторе типа УЗДН-А в режиме: рабочая частота 22 кГц, сила тока 0,3 А, время озвучивания 5 мин. Суспензии дают отстояться 30 сек и используют для приготовления разведений.
Готовят серию 10-кратных разведений полученной почвенной суспензии (или водных проб, которые не требуют предварительной обработки) в стерильной водопроводной воде. 0,1 мл суспензии из каждого разведения наносят на агаризованную среду и с помощью шпателя равномерно распределяют по ее поверхности.
Чашки Петри с засеянной питательной средой инкубируют при 28oC в течение 7 сут в пропано-воздушной атмосфере (пропан-воздух 1:5).
После подсчета и описания выросших колоний каждую из изолированных культур проверяют на способность расти на пропане в качестве единственного источника углерода.
Сравнительные результаты использования контрольной и предлагаемой селективной питательной среды с хлорамфениколом для преимущественной изоляции пропанокисляющих родококков представлены в табл. 2. Из табл. 2 видно, что максимальное количество выделенных из естественных субстратов представителей пропанокисляющих родококков обеспечивает предлагаемая селективная среда с хлорамфениколом. При этом число изолированных из водных и почвенных образцов на данной среде пропанокисляющих родококков в 2,5 и 1,3 раза, соответственно, больше, чем таковое на контрольной питательной среде без антибиотиков. Селективный индекс предлагаемой питательной среды с хлорамфениколом составляет 85% и изображен на чертеже.
Эти данные свидетельствуют о направленности и чувствительности предлагаемой селективной питательной среды, позволяющей ее использовать в широкомасштабных экологических исследованиях пропанокисляющих родококков.
Пример 2. Способ селективной изоляции пропанокисляющих родококков из смешанных культур в нестерильных условиях.
Технология приготовления селективной питательной среды аналогична примеру 1, но в качестве селективных добавок используют следующие комбинации антибиотиков: смесь линкомицина (90 мкг/мл) и полимиксина (100 Ед/мл) (для этого готовят 100 мл основного раствора антибиотиков, содержащего 0,9 г линкомицина и 1 000 000 Ед полимиксина; 10 мл стерильного основного раствора добавляют в приготовленную (стерильную минеральную основу) или смесь эритромицина (2,5 мкг/мл) и налидиксовой кислоты (20 мкг/мл) (для этого готовят 100 мл основного раствора, содержащего 0,025 г эритромицина и 0,2 г налидиксовой кислоты; 10 мл стерильного основного раствора добавляют в приготовленную стерильную минеральную основу).
Результаты использования селективной питательной среды с различными комбинациями антибиотиков для выделения пропанокисляющих родококков из смешанных культур приведены в табл. 3.
Представленные данные свидетельствуют, что питательная среда с различными сочетаниями используемых антибиотиков отличается высокой селективностью, то есть способностью избирательно подавлять развитие спутниковых грамположительных и грамотрицательных эубактерий. Селективный индекс предлагаемых вариантов селективной питательной среды составляет 96 - 98%, показан на чертеже.
Способ селективной изоляции пропанокисляющих родококков рекомендуется для использования:
в лабораторной практике при получении чистых бактериальных культур;
при промышленном культивировании пропанокисляющих родококков с целью контроля чистоты культуры;
для микробиологического обнаружения мест утечек горючего газа из поврежденных газопроводов и подземных газохранилищ.
Способ селективной изоляции чистых культур пропанокисляющих родококков основан на их резистентности к ряду антибиотических веществ в условиях индукции пропанмонооксигеназной активности. Для более полного выделения пропанокислящих родококков в минеральную среду, содержащую нитрат калия, однозамещенный фосфат калия, двузамещенный фосфат калия, хлористый натрий, сернокислый магний, хлористый кальция, хлорное железо, вносят пропан в качестве единственного источника углерода и антибиотики и их комбинации в оптимальных концентрациях в качестве селективного агента, подавляющего рост сопуствующих эубактерий. Технический результат - высокий селективный индекс (85 - 98%), позволяющий выявлять максимально полное количество культур пропанокисляющих родококков, содержащихся в исследуемом образце. Способ рекомендуется для использования в экологических исследованиях и при культивировании смешанных культур в нестерильных производственных условиях. 3 з.п. ф-лы, 3 табл.,1 ил.
Нитрат калия - 1,0
Однозамещенный фосфат калия - 1,0
Двузамещенный фосфат калия - 1,0
Хлористый натрий - 1,0
Сернокислый магний - 0,2
Хлористый кальций - 0,02
Хлорное железо - Следы
Агар-агар - 18,0
Дистиллированная вода - До 1 л,
а также селективные агенты - либо хлорамфеникол, либо смесь линкомицина и полимиксина, либо смесь эритромицина и налидиксовой кислоты, причем выращивание ведут в пропановоздушной атмосфере при 28 - 30oС в течение 5 - 7 суток.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Ившина И.Б | |||
| Создание сети взаимодействующих коллекций микробных культур и компьютеризированных банков данных как основы изучения и сохранения разнообразия микробиологических ресурсов // Экология, - 1992, N 6, с | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Ившина И.Б., Пшеничнов Р.А., Оборин А.А | |||
| Пропанокисляющие родококки | |||
| /Монография/ | |||
| - Свердловск: УНЦ АН СССР, 1987, с | |||
| Плуг с фрезерным барабаном для рыхления пласта | 1922 |
|
SU125A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Ившина И.Б., Филп Д., Куюкина М.С., Кристофи Н | |||
| Новые экологически безопасные биосурфактанты родококков //Матер | |||
| Междун | |||
| конф., посвящ | |||
| памяти акад | |||
| А.А.Баева | |||
| Прибор для промывания газов | 1922 |
|
SU20A1 |
| Вага для выталкивания костылей из шпал | 1920 |
|
SU161A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Каталог штаммов региональной профилированной коллекции алканотрофных микроорганизмов | |||
| /Под ред | |||
| И.Б.Ившиной | |||
| Ин-т экологии и генетики микроорганизмов УрО РАН | |||
| - М.: Наука, 1994, с | |||
| Деревянное стыковое устройство | 1920 |
|
SU163A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Ившина И.Б., Оборин А.А., Нестеренко О.А., Касумова С.А | |||
| Приспособление для изготовления в грунте бетонных свай с употреблением обсадных труб | 1915 |
|
SU1981A1 |
| Устройство для выпрямления многофазного тока | 1923 |
|
SU50A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| ПРИБОР ДЛЯ ИЗМЕРЕНИЯ КОНУСОВ | 1922 |
|
SU709A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Ившина И.Б., Гвоздяк О.Р., Богомягкова О.А., Шкабура В.В | |||
| Использование метода иммунодиффузионного анализа в видовой дифференциации микрококков // Микробиорлогия, 1975, т | |||
| Нефтяной конвертер | 1922 |
|
SU64A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Парный автоматический сцепной прибор для железнодорожных вагонов | 0 |
|
SU78A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Ившина И.Б., Каменских Т.Н., Козырева Г.И | |||
| Антибиотикочувствительность родококков, культивируемых на разных средах // Факторы и механизмы регуляции развития бактериальной популяций: Труды /УрО РАН | |||
| Ин-т экологии и генетики микроорганизмов | |||
| Свердловск: УНЦ АН СССР, 1990, сэ 92 - 98 | |||
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| Куюкина М.С | |||
| Своеобразие физиологических свойств бактерий рода Rhodococcus, ассимилирующих газообразные и жидкие н-алканы // Механизмы поддерживания биологического разнообразия | |||
| /Екатеринбург, 1995, с | |||
| Пюпитр для работы на пишущих машинах | 1922 |
|
SU86A1 |
Авторы
Даты
1998-03-10—Публикация
1996-12-30—Подача