Изобретение относится к новым синтетическим мезопористым (т.е. ультра-широкопористым) кристаллическим материалам и способам их приготовления. Такие материалы представляют большой интерес для использования в качестве сорбентов или катализаторов реакций превращения органических и неорганических веществ. Этот интерес обусловлен тем, что в указанных материалах, во-первых, в силу их кристаллической структуры наблюдается не широкое распределение пор по размерам (как в аморфных системах), а унифицированный размер пор; во-вторых, этот унифицированный размер пор является очень большим (18 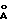 и более), а его конкретная величина зависит от конкретного метода приготовления. Однако во всех случаях прямым следствием очень большого размера пор являются очень большие величины как удельной поверхности, так и удельного суммарного объема пор в таких мезопиристых кристаллических фазах.
и более), а его конкретная величина зависит от конкретного метода приготовления. Однако во всех случаях прямым следствием очень большого размера пор являются очень большие величины как удельной поверхности, так и удельного суммарного объема пор в таких мезопиристых кристаллических фазах.
Таким образом, мезопористые кристаллические фазы могут в первом приближении рассматриваться как аналоги цеолитов и цеолитоподобных систем (которые являются микропористыми кристаллическими фазами), но с гораздо большим размером пор [C.T.Kresge, M.E.Leonowicz, W.J.Rorh, J.C.Vartuli, J.S. Beck, "Ordered mesoporous molecular sieves synthesized by а liquid-crystal temlate mechanism", Nature, v. 359, N 6397, p. 710 - 712 (22.10.1992); J.S. Beck, J.C.Vartuli, W.J.Rorh, M.E.Leonowicz, C.T.Kresge, K.D.Schmitt, C.T.-W. Chu, D. H.Olson, E.W.Sheppard, S.B.McCullen, J.B.Higgens, J.L.Schlenker, "A new family of mesoporous molecular sieves prepared with liquid crystal templates", J.Amer.Chem.Soc., v. 114, p. 10834 - 10843 (1992)].
Известно [Q.Huo, D.I.Margolese, U.Ciesla, P.Feng, T.E.Gier, P.Sieger, R. Leon, P. M.Petroff, F.Schuth, G.D.Stucky, "Generalzed synthesis of periodic surfactant/inorganic composite materials", Nature, v. 368, N 6469, p. 317 - 321 (24.03.1994)], что базовым принципом формирования структуры мезопористой фазы любого химического состава является взаимодействие в определенных условиях в водном растворе катионов или анионов органического поверхностно-активного вещества (сурфактанта) соответственно с анионами или катионами (т. е. с частицами противоположного знака заряда) неорганического материала. В результате такого взаимодействия получается исходная форма мезопиристой фазы, весь объем пор в которой заполнен органический сурфактантом. Именно по этой причине исходная форма мезопористой фазы не представляет никакого практического интереса. Для реализации же ее уникальной удельной поверхности сурфактант должен быть удален из пористой структуры исходной формы тем или иным способом, например, путем окислительной термообработки. Если в результате удаления органического сурфактанта кристаллическая структура мезопористой фазы, сформированная из частиц неорганического материала, остается неименной или сохраняется в очень большой степени, то только в этом случае в полной мере могут быть реализованы уникальные адсорбционные характеристики системы: большие величины как удельной поверхности, так и суммарного объема пор.
Таким образом, критерием того, что в результате конкретного способа приготовления достигнута поставленная цель, т.е. конкретного способа приготовления достигнута поставленная цель, т.е. получена мезопористая кристаллическая фаза данного химического состава, является наличие у полученного продукта следующих трех характеристик одновременно: (а) на рентгенограмме должен наблюдаться по меньшей мере один рефлекс, соответствующий межплоскостному расстоянию более 18 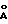 ; (б) продукт должен иметь большую величину удельной поверхности, измеренной адсорбционным методом; (в) продукт должен иметь большой суммарный объем пор, также измеренный адсорбционным методом.
; (б) продукт должен иметь большую величину удельной поверхности, измеренной адсорбционным методом; (в) продукт должен иметь большой суммарный объем пор, также измеренный адсорбционным методом.
Известна мезопористая кристаллическая фаза диоксида кремния и другие силикатные системы на ее основе и способ ее получения [C.T.Kresge, M.E.Leonowicz, W.J.Roth, J.C.Vartuli, J.S.Beck, "Ordered mesoporous molecular sieves syntjesized by а liquid-crystal template mechanism", Nature, v. 359, N 6397, pp. 710 - 712 (22.10.1992); J. S.Vartuli, W.J.Rorh, M.E.Leonowicz, C.T. Kresge, K.D.Schmitt, C.T. - W.Chu, D.H.Olson, E.W.Sheppard, S.B.McCullen, J. B. Higgens, J. L. Schlenker, "A new family of mesoporous molecular sieves prepared wirh liquid crystal templates", J.Amer.Chem.Soc., v. 114, pp. 10834 - 10843 (1992); q.Huo, D.I.Margolese, U.Ciesla, P.Feng. T.E.Gier, P.Sieger, R.Leon, P.M.Petroff, F.Schuth, G.D.Stucky, "Generalized sythesis of periodic surfactant/inorganic composite materials", Nature, v. 368, N 6469, pp. 317 - 321 (24.03.1994); патенты США N 5057296, (1991); N 5098684 (1992); N 5102643 (1992); N 5108725 (1992); N 5211934 (1993); N 5215737 (1993); N 5264203 (1993); N 5304363 (1994); N 5308602 (1994); N 5334368 (1994)]. Мезопористая кристаллическая фаза диоксида кремния имеет характеристики, приведенные в табл. 1 для катионных сурфактантов различного состава (см. в конце описания). Способ получения состоит из одного химического этапа и заключается в гидротермальной кристаллизации (при температуре 90 - 150oC в течение от 4 до 144 часов) реакционной смеси, приготовленной из источника диоксида кремния (силикагель, силикат натрия, тетраэтилортосиликат, и др.), щелочи (гидросиды натрия, тетраалкиламмония (CnH2n+1)4ONH с n = 1 - 4, и др.), воды и катионного сурфактанта NR
Из приведенных в табл. 1 характеристик видно, что мезопористая кристаллическая фаза для случая диоксида кремния во всех известных способах (разные авторы, разные условия формирования) имеет практически постоянную величину удельной поверхности. Изменение длины углеродной цепи в молекуле катионного сурфактанта сказывается только на значении межплоскостного расстояния на рентгенограмме этой фазы. Это обстоятельство позволяет заключить, что мезопористая кристаллическая фаза данного химического состава, приготовления с использованием любого катионного сурфактанта типа NR
1140 (м2/г)•60,085 (г/моль) ≅ 68500 (м2/моль),
где 60,085 г/моль - молекулярная масса диоксида кремния.
Переход к мезопористой кристаллической фазе любого другого оксида ЭОn, приготовленной с использованием катионного сурфактанта типа NR
68500(м2/моль)/M(ЭОn) (г/моль),
где M(ЭОn) - молекулярная масса оксида ЭОn. В частности, для мезопористой кристаллической фазы диоксида циркония ZrO2 величина удельной поверхности будет равна:
68500(м2/моль)/123,219(г/моль) ≅ 556 (м2/г ZrO2).
Однако такая величина удельной поверхности будет наблюдаться только в том случае, если после удаления органического сурфактанта типа NR
Sизм(м2/г)/556 (м2/г),
где Sизм - измеряемая величина удельной поверхности мезопористой кристаллической фазы диоксида циркония. Если же при удалении органического сурфактанта NR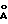 , не будет наблюдаться.
, не будет наблюдаться.
Диоксид циркония, содержащий сульфатные группы в своем составе (от 0,2 до 5 мас.% в расчете на элементарную серу), известен как суперкислотная каталитическая система, высокоактивная во многих кислотно-основных превращениях, в частности, в реакциях алкилирования [A.Corma, A.Martinez, "Chemistry, catalysts, and processes for isoparaffin-olefin alkylation: actual situation and future trends", Catal,Rev. - Sci,Eng., v. 35, N 4, p. 483 - 570 (1993); C.Guo, S.Vao, J.Cao, Z.Qian, "Alkylation of isobutane with butenes over solid superacids, SO
Известна мезопористая кристаллическая фаза диоксида циркония [J.S.Reddy, A. Sayari, "Nanoporous zirconium oxide prepared using the supramolecular templating approach", Catalysis Letters, v. 38, p. 219 - 223 (1996)], получаемая одноэтапным способом гидротермальной кристаллизации реакционной смеси, приготовленной из сульфата циркония Zr(SO4)2 и катионных сурфактантов (CnH2n+1)(CH3)3N+Br- или (CnH2n+1)(H)3N+Cl-, где n = 8, 10, 12, 14, 16, в водном или смешанном водно-этанольном растворах, при температуре 27 - 100oC в течение от 0,5 до 120 часов. Состав исходный смеси (в терминах мольных отношений на 1 моль ZrO2 в исходном соединении циркония) соответствует:
ZrO2•(2 - 3)SO3•(0,065-1,04)(NR4)2O•(30 - 375) H2O.
Исходная смесь для кристаллизации имеет pH 0,7 - 1. По окончании кристаллизации и стадий фильтрации, промывки и сушки получают исходную форму мезопористой кристаллической фазы диоксида циркония. Для удаления сурфактанта исходную форму подвергают либо окислительной термообработке (при температуре 500oC в течение 6 часов), либо экстрагируют смесью этанол-н.гептан-HCl. Во всех случаях получают продукт, который не имеет рефлексов на рентгенограмме (является аморфным) и практически не имеет пористой структуры. Таким образом (табл. 3 в конце описания), недостатком известного продукта [J.S.Reddy, A. Sayari, "Nanoporous zirconium oxide prepared using the supramolecular templating approach", Catalysis Letters, v. 38, p. 219 - 223 (1996)] и способа его приготовления является полное разрушение мезопористой кристаллической структуры фазы диоксида циркония.
Известна мезопористая кристаллическая фаза диоксида циркония [V.- Y.Huang, T.J.McCarthy, W.M.H.Sachtler, "Preparation and catalytic testing of mesoporous sulfated zirconium dioxide with partially tetragonal wall structure", Applied Catalysis A: General, v.148, p.135 - 154 (1996)], на рентгенограмме которой наблюдается рефлекс, соответствующий значению межплоскостного расстояния 36-40 Ангстрем (рис. 6 в статье), что свидетельствует о сохранности кристаллической структуры. Величина удельной поверхности этой фазы находится в пределах 91-216 м2/г (табл.1 в статье). Следовательно, степень сохранности структуры фазы-аналога составляет от 91/566 ≅ 0,16 до 216/556 ≅ 0,39, т.е. 16 - 39%, что полностью согласуется с малой величиной суммарного удельного объема пор (0,12 - 0,13 см3/г и менее, рис.10, 11 в статье). Фазу с такими характеристиками получают двухэтапным способом. На первом этапе проводят гидротермальную кристаллизацию реакционной смеси, приготовленной из пропоксида циркония Zr(n-OC3H7)4 и катионного сурфактанта (C16H33)(H)3N+Cl- в смешанном растворителе (вода-н.пропанол-этанол-ацетилацетон), при 20oC в течение 120 часов. Состав исходной смеси (в терминах мольных отношений оксидов на 1 моль ZrO2 в исходном соединении циркония) соответствует:
ZrO2 • (O )SO3 • (0,15) (NR4)2O • [39 H2O + 1,8 C3H7OH + 6,0 C2H5OH + 0,5 CH2(COCH3)2],
т.е. без сульфатных анионов. По окончании кристаллизации и стадий центрифугирования и сушки получают исходную форму мезопористой кристаллической фазы диоксида циркония. Для удаления сурфактанта исходную форму экстрагируют этанолом и после фильтрации, промывки и сушки, получают продукт первого этапа. На втором этапе проводят стабилизацию структуры путем обработки продукта первого этапа водным раствором серной кислоты в течение 10 минут при 20oC. Состав исходной смеси на втором этапе соответствует: 15 мл 0,5 М водного раствора серной кислоты на 1 г продукта первого этапа. После фильтрации и сушки продукт второго этапа подвергают окислительной термообработке при температуре 650oC в течение 2 часов.
Таким образом (табл.3), недостатком известного продукта-аналога [Y.-Y. Huang, T. J.McCarthy, W.M.H.Sachtler, "Preparation and catakytic testing of mesoporous sulfated zirconium dioxide with partially tetraganal wall structure", Applied Catalysis A: General, v.148, p.135 - 154 (1996)] и способа его приготовления является очень низкая степень сохранности кристаллической структуры мезопористой фазы диоксида циркония.
Наиболее близким к заявляемому продукту и способу его приготовления по технической сущности и достигаемому эффекту является материал на основе мезопористой кристаллической фазы диоксида циркония [U.Ciesla, S.Schacht, G.D. Strucky, K.K.Unger, F.Schuth, "Formation of a porous zirconium oxo phosphate with a high surface area by a surfactant-assisted synthesis", Angewandte Chemie, International Edition in English, v.35, N 5, p.541-543 (1996)], на рентгенограмме которого наблюдается рефлекс, соответствующий значению межплоскостного расстояния 28,1 - 38,6 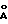 (рис. 1C, табл. 1 в статье), что свидетельствует о сохранности кристаллической структуры. Величина удельной поверхности полученной фазы находится в пределах 230-390 м2/г (табл. 1 в статье). Следовательно, степень сохранности структуры фазы-прототипа составляет от 230/556 ≅ 0,41 до 390/556 ≅ 0,70, т.е. 41 - 70%, что полностью согласуется с небольшой величиной суммарного удельного объема пор, который составляет 0,122 - 0,218 см3/г (табл. 1 в статье). Материал-прототип получают двухэтапным способом. На первом этапе получают исходную форму указанной фазы путем гидротермальной кристаллизации реакционной смеси, приготовленной из источника ZnO2 (сульфат циркония Zr(SO4)2 или смесь пропоксида циркония Zr(OC3H7)4 и сульфата аммония (NH4)2SO4) и катионного сурфактанта (CnH2n+1)(CH3)3N+Br-, где n = 16, 18, 20, в водном растворе, при температуре 100oC в течение 48 часов. Состав исходной смеси (в терминах мольных отношений оксидов на 1 моль ZrO2 в исходном соединении циркония) соответствует: ZrO2 • (2) SO3 • (0,268) (NR4)2O • (434) H2O. По окончании кристаллизации и стадий фильтрации, промывки и сушки получают исходную форму мезопористой кристаллической фазы диоксида циркония. На втором этапе проводят стабилизацию структуры путем обработки продукта первого этапа водным раствором фосфорной кислоты H3PO4 в течение 2 часов при 20oC. Состав исходной смеси на втором этапе соответствует: 68 молей H3PO4 на моль ZrO2 в продукте первого этапа. После фильтрации и сушки, продукт второго этапа подвергают окислительной термообработке при температуре 500oC в течение 6 часов для удаления сурфактанта.
(рис. 1C, табл. 1 в статье), что свидетельствует о сохранности кристаллической структуры. Величина удельной поверхности полученной фазы находится в пределах 230-390 м2/г (табл. 1 в статье). Следовательно, степень сохранности структуры фазы-прототипа составляет от 230/556 ≅ 0,41 до 390/556 ≅ 0,70, т.е. 41 - 70%, что полностью согласуется с небольшой величиной суммарного удельного объема пор, который составляет 0,122 - 0,218 см3/г (табл. 1 в статье). Материал-прототип получают двухэтапным способом. На первом этапе получают исходную форму указанной фазы путем гидротермальной кристаллизации реакционной смеси, приготовленной из источника ZnO2 (сульфат циркония Zr(SO4)2 или смесь пропоксида циркония Zr(OC3H7)4 и сульфата аммония (NH4)2SO4) и катионного сурфактанта (CnH2n+1)(CH3)3N+Br-, где n = 16, 18, 20, в водном растворе, при температуре 100oC в течение 48 часов. Состав исходной смеси (в терминах мольных отношений оксидов на 1 моль ZrO2 в исходном соединении циркония) соответствует: ZrO2 • (2) SO3 • (0,268) (NR4)2O • (434) H2O. По окончании кристаллизации и стадий фильтрации, промывки и сушки получают исходную форму мезопористой кристаллической фазы диоксида циркония. На втором этапе проводят стабилизацию структуры путем обработки продукта первого этапа водным раствором фосфорной кислоты H3PO4 в течение 2 часов при 20oC. Состав исходной смеси на втором этапе соответствует: 68 молей H3PO4 на моль ZrO2 в продукте первого этапа. После фильтрации и сушки, продукт второго этапа подвергают окислительной термообработке при температуре 500oC в течение 6 часов для удаления сурфактанта.
Таким образом (табл. 3), недостатками известного материала на мезопористой фазы диоксида циркония и способа его приготовления [U.Ciesla, S.Schacht, G.D.Strucky, K.K.Unger, F.Schuth, "Formation of a porous zirconium oxo prosphate with a high surface area by a surfactant-assisted synthesis", Angewandte Chemie, International Edition in English, v.35, N 5, p. 541 - 543 (1996)] является не полная степень сохранности кристаллической структуры продукта даже при температуре термообработки 500oC, вследствие чего продукт имеет пониженные величины и удельной поверхности, и удельного суммарного объема пор.
Предлагаемое изобретение решает задачу разработки материала на основе мезопористой кристаллической фазы диоксида циркония с увеличением значениями удельной поверхности и удельного суммарного объема пор за счет практически полного сохранения кристаллической структуры продукта после окислительной термообработки при температурах 550 - 600oC и способа его приготовления, включающего, на первом этапе, получение исходной формы мезопористой кристаллической фазы диоксида циркония путем гидротермальной кристаллизации реакционной смеси, приготовленной из смеси сульфата циркония Zr(SO4)2 и гидроксида циркония Zr(OH)4 (взятых в определенном соотношении) и катионного сурфактанта в водном растворе, и на втором этапе стабилизацию мезопористой структуры исходной формы фазы (т.е. продукта первого этапа) путем ее обработки в определенных условиях щелочным раствором оксида ЭОm, взятом в определенном соотношении к исходной форме мезопористой кристаллической фазы.
Приготовление по заявленному способу проводят следующим образом.
На первом этапе готовят исходную форму мезопористой кристаллической фазы диоксида циркония. Для этого исходную смесь, содержащую сульфат циркония, гидроксид циркония, катионный сурфактант NR
ZrO2 • (0,9 - 1,5) SO3 • (0,1 - 0,2) (NR4)2O • (80-100) H2O,
выдерживают в автоклаве при температуре 90 - 120oC в течение 30 - 40 часов. По окончании кристаллизации исходную форму мезопористой кристаллической фазы фильтруют, промывают водой и сушат.
На втором этапе проводят стабилизацию мезопористой структуры кристаллической фазы. Для этого исходную смесь, содержащую исходную форму фазы и щелочной водный раствор оксида ЭОm в соотношении (в терминах мольных отношений оксидов на 1 моль ZrO2 в продукте первого этапа):
ZrO2 • (0,75 - 1,0) M2O • xЭOm • (100 - 200) H2O,
где M - катион щелочного металла или тетраалкиламмония N(CnH2n+1)4 с n= 1-4, а величина x не более 10, выдерживают в автоклаве при температуре 60-100oC в течение 5-50 часов. По окончании стабилизации продукт фильтруют, промывают водой, сушат при 105-110oC, прокаливают в потоке воздуха при 50-600oC в течение 2-5 часов и получают материал на основе мезопористой кристаллической фазы диоксида циркония.
Заявляемый материал на основе мезопористой кристаллической фазы диоксида циркония отличается от известного тем, что имеет удельную поверхность 410-549 м2 /г, т. е. более 390 м2/г, удельный суммарный объем пор 0,218-0,274 см3/г, т. е. более 0,218 см3/г, за счет степени сохранения кристаллической структуры 74-98,7%, т. е. более 70%, и имеет химический состав в терминах мольных отношений оксидов ZrO2 • xЭОm, где Э - по крайней мере один из элементов III-VI групп, а величина x не более 10.
Заявляемый способ отличается от известного тем, что в реакционной смеси на первом этапе приготовления мольное отношение оксидов (SO3/ ZrO2) составляет не 2, а равно 0,9-1,5; мольное отношение оксидов [(NR4)2O/ZrO2] составляет не 0,268, а равно 0,1-0,2; стабилизация исходной формы мезопористой фазы проводится не в кислой среде обработкой раствором фосфорной кислоты, а в щелочной среде обработкой щелочным раствором оксида ЭОM, где Э - по крайней мере один из элементов III-VI групп, при определенном соотношении реагентов и определенных условиях.
Получаемый материал на основе мезопористой кристаллической фазы диоксида циркония применим в качестве катализатора реакций алкилирования углеводородов, высокоэффективно работающего при относительно низких температурах.
Техническое решение, обладающее указанной совокупностью отличительных признаков, из уровня техники не известно. Отличительные признаки придают объекту новые свойства, в результате чего достигается новый технический результат - получение материала на основе кристаллической мезопористой фазы диоксида циркония с увеличенными значениями удельной поверхности до 549 м2/г и удельного суммарного объема пор до 0,274 см3/г за счет практически полного сохранения кристаллической структуры продукта после окислительной термообработки при температурах 550-600oC против 230-390 м2/г и 0,122-0,218 см3/г после 500oC в прототипе, и 91-216 м2/г и менее 0,13 см3/г после 650oC в аналоге по причине лишь частичного сохранения в них кристаллической структуры этой фазы.
Сущность предлагаемого способа приготовления иллюстрируется примерами 1-21. Примеры 22-25 приведены для сравнения. В примере 26 описывается измерение каталитической активности получаемого материала. Условия приготовления материала на основе мезопористой кристаллической фазы диоксида циркония по заявленному способу сведены в табл. 2 (см. в конце описания). Физико-химические характеристики материала на основе мезопористой кристаллической фазы диоксида циркония после окислительной термообработки при температуре не ниже 550oC, приготовленного как по заявляемому способу так и по способам-аналогам, сведены в табл.3.
Измерения физико-химических характеристик целевого продукта проводили следующим образом.
Регистрация рентгенограмм проведена на дифрактометре URD-6 в монохроматизированном CuKα-излучении (длина волны λ = 1.54178 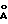 ) в области от 1.0o до 10.0o по 2 θ со скоростью 0.5 град/мин. Для контроля за положением и интенсивностью рефлексов использовался внешний стандарт - NaCl. Расчет значений межплоскостных расстояний d проведен по формуле: d = λ/(2sinθ), где θ - угол, соответствующий максимуму наблюдаемого рефлекса.
) в области от 1.0o до 10.0o по 2 θ со скоростью 0.5 град/мин. Для контроля за положением и интенсивностью рефлексов использовался внешний стандарт - NaCl. Расчет значений межплоскостных расстояний d проведен по формуле: d = λ/(2sinθ), где θ - угол, соответствующий максимуму наблюдаемого рефлекса.
Адсорбционные характеристики (величины удельной поверхности и удельного суммарного объема пор) вычислены из изотерм физической адсорбции азота при 77К, измеренных объемным методом на автоматизированном приборе ASAP-2400 (фирма Micromeritics, США). Этот прибор аттестован Госстандартом РФ как прибор высшей точности для измерения удельной поверхности адсорбентов и катализаторов методом БЭТ; суммарная погрешность измерения удельной поверхности - не более 1.6%. Вся процедура измерений и обработки результатов проводится автоматически с помощью компьютера. Величина удельной поверхности рассчитывалась по уравнению: 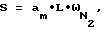 где L - число Авогадро,
где L - число Авогадро, 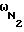 - площадка, занимаемая одной молекулой азота (использовано общепринятое значение равное 0,162 ни2), am - емкость монослоя по БЭТ, определяемая уравнением БЭТ:
- площадка, занимаемая одной молекулой азота (использовано общепринятое значение равное 0,162 ни2), am - емкость монослоя по БЭТ, определяемая уравнением БЭТ: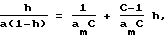
в котором h = P/Ps - относительное давление, a - равновесная величина адсорбции при относительном давлении h, C - энергетическая константа. Удельный суммарный объем пор рассчитывался из равновесной величины адсорбции (a) при h = 0,95.
Пример 1.
I этап.
Вначале готовят исходную реакционную смесь. Для этого в 24,7 г воды растворяют 7,1 г безводного сульфата циркония (0,025 моля ZrO2, 0,05 моля SO3), а затем в полученном растворе растворяют 15,0 г гидратированного гидроксида циркония (0,025 моля ZrO2). К полученному раствору при перемешивании приливают раствор 4,6 г цетилтриметиламмония бромистого (C16H33) (CH3)3NBr (ЦТМА-Br, 0,0125 моля) в 40 г воды. Полученная смесь соответствует составу (в терминах мольных отношений оксидов на 1 моль ZrO2 в исходных соединениях циркония): ZrO2 • (1,0) SO3 • (0,125) (ЦТМА)2O • (85) H2O и имеет pH ≅ 0,5-1. Эту смесь выдерживают в автоклаве при температуре 120oC в течение 39 часов. После этого, исходную форму мезапористой кристаллической фазы фильтруют, промывают водой и сушат.
II этап.
Для стабилизации структуры используют диоксид кремния.
Вначале готовят исходную реакционную смесь. Для этого к перемешиваемой взвеси 16,5 г воздушно-сухой исходной формы (продукт I этапа; 0,05 моля ZrO2) в 80 г воды прибавляют раствор 4,5 г SiO2 (0,075 моля) в 26,9 г 42%-ного гидроксида тетраэтиламмония (C2H5)4NOH (ТЭА-OH, 0,075 моля) и 48 г воды. Полученная смесь соответствует составу (в терминах мольных отношений оксидов на 1 моль ZrO2 в продукте первого этапа):
ZrO2 • 0,75) [(ТЭА)2O] • (1,5) SiO2 • (160) H2O
и имеет pH ≅ 10-11. Эту смесь выдерживают в автоклаве при температуре 100oC в течение 20 часов. По окончании стабилизации продукт фильтруют, промывают водой, сушат при 105-110oC и прокаливают в потоке воздуха при 550-600oC в течение 2-5 часов.
Полученный материал на основе мезопористой кристаллической фазы диоксида циркония имеет рефлекс на рентгенограмме, соответствующий межплоскостному расстоянию 39,1  , и величину удельной поверхности 549 м2/г, что соответствует степени сохранности кристаллической структуры этой фазы на уровне 549/556 ≅ 0,987 (т.е. 98,7%) и подтверждается большим значением величины суммарного удельного объема пор 0,247 см3/г (табл.3).
, и величину удельной поверхности 549 м2/г, что соответствует степени сохранности кристаллической структуры этой фазы на уровне 549/556 ≅ 0,987 (т.е. 98,7%) и подтверждается большим значением величины суммарного удельного объема пор 0,247 см3/г (табл.3).
Пример 2. По примеру 1.
На I этапе: мольное отношение (SO3/ZrO2)=1,17; продолжительность кристаллизации - 38 часов.
На II этапе: мольное отношение [(ТЭА)2O/ZrO2]=0,80; мольное отношение (SiO2/ZrO2)=1,60; продолжительность стабилизации - 15 часов.
Физико-химические характеристики материала приведены в табл. 3.
Пример 3. По примеру 1.
На I этапе: мольное отношение (SO3/ZrO2)=1,33; продолжительность кристаллизации - 33 часа.
На II этапе: мольное отношение [(ТЭА)2O/ZrO2]=0,85; мольное отношение (SiO2/ZrO2)=1,70; продолжительность стабилизации - 10 часов.
Физико-химические характеристики материала приведены в табл. 3.
Пример 4. По примеру 1.
На I этапе: мольное отношение (SO3/ZrO2)=1,50; продолжительность кристаллизации - 32 часа.
На II этапе: мольное отношение [(ТЭА)2O/ZrO2]=1,00; мольное отношение (SiO2/ZrO2)=2,00; продолжительность стабилизации - 5 часов
Физико-химические характеристики материала приведены в табл. 3.
Пример 5. По примеру 4.
На I этапе: мольное отношение (H2O/ZrO2)=100.
На II этапе: в качестве щелочи используют водный раствор гидроксида тетрабутиламмония (C4H9)4NOH (ТБА-OH); мольное отношение (SiO2/ZrO2)=1,50; мольное отношение (H2O/ZrO2)=140; температура стабилизации - 95oC; продолжительность стабилизации - 37 часов.
Физико-химические характеристики материала приведены в табл. 3.
Пример 6. По примеру 3.
На II этапе: в качестве щелочи используют водный раствор гидроксида натрия NaOH; температура стабилизации - 95oC; продолжительность стабилизации - 37 часов.
Физико-химические характеристики материала приведены в табл. 3.
Пример 7. По примеру 1.
На I этапе: мольное отношение (SO3/ZrO2)= 0,90; мольное отношение [(ЦТМА)2O/ZrO2] = 0,113; мольное отношение (H2O/ZrO2)=80; температура кристаллизации - 90oC; продолжительность кристаллизации- 40 часов.
На II этапе: мольное отношение [(ТЭА)2O/ZrO2]=0,90; мольное отношение (SiO2/ZrO2)= 1,80; температура стабилизации - 80oC; продолжительность стабилизации - 41 час.
Физико-химические характеристики материала приведены в табл. 3.
Пример 8. По примеру 7.
На I этапе: мольное отношение (SO3/Zr)2) = 1,00; мольное отношение [(ЦТМА)2O/ZrO2] = 0,125.
На II этапе: в качестве щелочи используют водный раствор гидроксида тетраметиламмония (CH3)4NOH (TMA-OH); мольное отношение [(TMA)2O/ZrO2] = 0,89; мольное отношение (SiO2/ZrO2) = 1,78; температура стабилизации - 95oC; продолжительность стабилизации - 39 часов.
Физико-химические характеристики материала приведены в табл. 3.
Пример 9. По примеру 8.
На I этапе: мольное отношение (SO3/ZrO2) = 1,17; мольное отношение [(ЦТМА)2O/ZrO2] = 0,147.
На II этапе: мольное отношение [(TMA)2O/ZrO2] = 0,87; мольное отношение (SiO2/ZrO2) = 1,74; продолжительность стабилизации - 38 часов.
Физико-химические характеристики материала приведены в табл. 3.
Пример 10. По примеру 7.
На I этапе: мольное отношение (SO3/ZrO2) = 1,50; мольное отношение [(ЦТМА)2O/ZrO2] = 0,188; продолжительность кристаллизации - 39 часов.
На II этапе: мольное отношение [(ТЭА)2O/ZrO2] = 1,00; мольное отношение (SiO2/ZrO2) = 1,98; температура стабилизации - 95oC; продолжительность стабилизации - 37 часов.
Физико-химические характеристики материала приведены в табл. 3.
Пример 11. По примеру 7.
На I этапе: мольное отношение (SO3/ZrO2) = 1,00; мольное отношение [(ЦТМА)2O/ZrO2] = 0,125.
На II этапе: в качестве щелочи используют водный раствор гидроксида натрия NaOH; мольное отношение (Na2O/ZrO2) = 0,90; мольное отношение (H2O/ZrO2) = 150; температура стабилизации - 60oC; продолжительность стабилизации - 50 часов.
Физико-химические характеристики материала приведены в таблице 3.
Пример 12. По примеру 2.
На II этапе: мольное отношение [(ТЭА)2O/ZrO2] = 0,75; мольное отношение (SiO2/ZrO2) = 0,75; мольное отношение (H2O/ZrO2) = 150; температура стабилизации - 95oC; продолжительность стабилизации - 37 часов.
Физико-химические характеристики материала приведены в таблице 3.
Пример 13. По примеру 12.
На II этапе: для стабилизации структуры материала используют оксид бора; мольное отношение [(ТЭА)2O/ZrO2] = 1,00; мольное отношение (BO1,5/ZrO2) = 2,00; продолжительность стабилизации - 40 часов.
Физико-химические характеристики материала приведены в таблице 3.
Пример 14. По примеру 13.
На II этапе: в качестве щелочи используют водный раствор гидркосида натрия NaOH; мольное отношение (Na2O/ZrO2) = 1,00.
Физико-химические характеристики материала приведены в табл. 3.
Пример 15. По примеру 13.
На II этапе: мольное отношение (BO1,5/ZrO2) = 4,00.
Физико-химические характеристики материала приведены в табл. 3.
Пример 16. По примеру 13.
На II этапе: мольное отношение (BO1,5/ZrO2) = 10,00.
Физико-химические характеристики материала приведены в табл. 3.
Пример 17. По примеру 12.
На II этапе: для стабилизации структуры материала используют оксид алюминия; мольное отношение (AlO1,5/ZrO2) = 1,50; продолжительность стабилизации - 40 часов.
Физико-химические характеристики материала приведены в табл. 3.
Пример 18. По примеру 17.
На II этапе: мольное отношение [(ТЭА)2O/ZrO2] = 1,00; мольное отношение (AlO1,5/ZrO2) = 2,00.
Физико-химические характеристики материала приведены в табл. 3.
Пример 19. По примеру 14.
На II этапе: для стабилизации структуры материала используют оксид фосфора; мольное отношение (PO2,5/ZrO2) = 0,67.
Физико-химические характеристики материала приведены в табл. 3.
Пример 20. По примеру 19.
На II этапе: мольное отношение (PO2,5/ZrO2) = 1,00.
Физико-химические характеристики материала приведены в табл. 3.
Пример 21. По примеру 19.
На II этапе: мольное отношение (PO2,5/ZrO2) = 2,00.
Физико-химические характеристики материала приведены в табл. 3.
Пример 22 (сравнительный).
I этап.
Вначале готовят исходную реакционную смесь. Для этого в 10,0 г воды растворяют 6,8 г безводного сульфата циркония (0,024 моля ZrO2, 0,048 моля SO3), а затем в полученном растворе растворяют 23,0 г гидратированного гидроксида циркония (0,036 моля ZrO2). К полученному раствору при перемешивании приливают раствор 4,4 г цетилтриметиламмония бромистого (C16H33)(CH3)3NBr (ЦТМА-Br, 0,012 моля) в 42,9 г воды. Полученная смесь соответствует составу (в терминах мольных отношений оксидов на 1 моль ZrO2 в исходных соединениях циркония): ZrO2 • (0,8) SO3 • (0,100) (ЦТМА)2 • (68) H2O и имеет pH ≅ 0,5 - 1. Эту смесь выдерживают в автоклаве при температуре 135oC в течение 64 часов. После этого, исходную форму мезопористой кристаллической фазы фильтруют, промывают водой и сушат.
II этап.
Для стабилизации структуры используют диоксид кремния.
Вначале готовят исходную реакционную смесь. Для этого к перемешиваемой взвеси 16,5 г воздушно-сухой исходной формы (продукт I этапа; 0,05 моля ZrO2) в 80 г воды прибавляют раствор 4,5 г (0,075 моля) SiO2 в 16,1 г 42%-ного гидроксида тетраэтиламмония (C2H5)4NOH (ТЭА-OH, 0,045 моля) и 48 г воды. Полученная смесь соответствует составу (в терминах мольных отношений оксидов на 1 моль ZrO2 в продукте первого этапа):
ZrO2 • (0,45) [(ТЭА)2O] • (1,5) SiO2 • (160) H52O
и имеет pH ≅ 7 - 8. Эту смесь выдерживают в автоклаве при температуре 100oC в течение 39 часов. По окончании стабилизации продукт фильтруют, промывают водой, сушат при 105 - 110oC и прокаливают в потоке воздуха при 550 - 600oC в течение 2 - 5 часов.
Физико-химические характеристики материала приведены в табл. 3.
Пример 23 (сравнительный).
I этап.
Вначале готовят исходную реакционную смесь. Для этого в 33,0 г воды растворяют 12,0 г безводного сульфата циркония (0,0425 моля ZrO2, 0,085 моля SO3), а затем в полученном растворе растворяют 4,5 г гидратированного гидроксида циркония (0,0075 моля ZrO2). К полученному раствору при перемешивании приливают раствор 4,6 г цетилтриметиламмония бромистого (C16H33)(CH3)3NBr (ЦТМА-Br, 0,0125 моля) в 40,0 г воды. Полученная смесь соответствует составу (в терминах мольных отношений оксидов на 1 моль ZrO2 в исходных соединениях циркония): ZrO2 • (1,70) SO3 • (0,250) (ЦТМА)2O • (85) H2O и имеет pH ≅ 0,5 - 1. Эту смесь выдерживают в автоклаве при температуре 120oC в течение 31 часа. После этого исходную форму мезопористой кристаллической фазы фильтруют, промывают водой и сушат.
II этап.
Для стабилизации структуры используют диоксид кремния.
Вначале готовят исходную реакционную смесь. Для этого к перемешиваемой взвеси 16,5 г воздушно-сухой исходной формы (продукт I этапа; 0,05 моля ZrO2) в 80 г воды прибавляют раствор 4,5 г (0,075 моля) SiO2 в 35,8 г 42%-ного гидроксида тетраэтиламмония (C2H5)4NOH (ТЭА-OH, 0,1 моля) и 48 г воды. Полученная смесь соответствует составу (в терминах мольных отношений оксидов на 1 моль ZrO2 в продукте первого этапа):
ZrO2 • (1,00) [(ТЭА)2O] • (1,5) SiO2 • (160) H2O
и имеет pH ≅ 8 - 9. Эту смесь выдерживают в автоклаве при температуре 95oC в течение 37 часов. По окончании стабилизации продукт фильтруют, промывают водой, сушат при 105 - 110oC прокаливают в потоке воздуха при 550 - 600oC в течение 2 - 5 часов.
Физико-химические характеристики материала приведены в табл. 3.
Пример 24 (сравнительный).
I этап.
Вначале готовят исходную реакционную смесь. Для этого в 80,3 г воды растворяют 46,3 г безводного сульфата циркония (0,1634 моля ZrO2, 0,3268 моля SO3), а затем в полученном растворе растворяют 35,0 г гидратированного гидроксида циркония (0,0545 моля ZrO2). К полученному раствору при перемешивании приливают раствор 29,8 г цетилтриметиламмония бромистого (C16H33) (CH3)3NBr (ЦТМА-Br, 0,0817 моля) в 225,0 г воды. Полученная смесь соответствует составу (в терминах мольных отношений оксидов на 1 моль ZrO2 в исходных соединениях циркония): ZrO2•(1,5) SO3•(0,188) (ЦТМА)2O•(85) H2O и имеет pH ≅ 0,5 - 1. Эту смесь выдерживают в автоклаве при температуре 95oC в течение 39 часов. После этого исходную форму мезопористой кристаллической фазы фильтруют, промывают водой и сушат.
II этап.
Для стабилизации структуры используют диоксид кремния.
Вначале готовят исходную реакционную смесь. Для этого к перемешиваемой взвеси 16,5 г воздушно-сухой исходной формы (продукт I этапа; 0,05 моля ZrO2) в 80 г воды прибавляют раствор 4,0 г (0,066 моля) SiO2 в 23,3 г 42%-ного гидроксида тетраэтиламмония (C2H5)4NOH (ТЭА-OH, 0,065 моля) и 48 г воды. Полученная смесь соответствует составу (в терминах мольных отношений оксидов на 1 моль ZrO2 в продукте первого этапа):
ZrO2•(0,65) [(ТЭА)2O]•(1,32) SiO2•(160) H2O
и имеет pH ≅ 9 - 10. Эту смесь выдерживают в автоклаве при температуре 95oC в течение 36 часов. По окончании стабилизации продукт фильтруют, промывают водой, сушат при 105 - 110oC и прокаливают в потоке воздуха при 550 - 600oC в течение 2 - 5 часов.
Физико-химические характеристики материала приведены в табл. 3.
Пример 25 (сравнительный).
I этап.
Вначале готовят исходную реакционную смесь. Для этого в 24,7 г воды растворяют 7,1 г безводного сульфата циркония (0,025 моля ZrO2, 0,05 моля SO3), а затем в полученном растворе растворяют 15,0 г гидратированного гидроксида циркония (0,025 моля ZrO2). К полученному раствору при перемешивании приливают раствор 4,6 г цетилтриметиламмония бромистого (C16H33) (CH3)3NBr (ЦТМА-Br, 0,0125 моля) в 40 г воды. Полученная смесь соответствует составу (в терминах мольных отношений оксидов на 1 моль ZrO2 в исходных соединениях циркония): ZrO2•(1,0) SO3•(0,125) (ЦТМА)2O•(85) H2O
и имеет pH ≅ 0,5 - 1. Эту смесь выдерживают в автоклаве при температуре 120oC в течение 39 часов. После этого, исходную форму мезопористой кристаллической фазы фильтруют, промывают водой и сушат.
II этап.
Для стабилизации структуры используют диоксид кремния.
Вначале готовят исходную реакционную смесь. Для этого к перемешиваемой взвеси 16,5 г воздушно-сухой исходной формы (продукт I этапа; 0,05 моля ZrO2) в 80 г воды прибавляют раствор 125 г тетраэтоксисилана (C2H5O)4Si (0,60 моля SiO2) в 28,9 г 42%-ного гидроксида тетраэтиламмония (C2H5)4NOH (ТЭА-OH, 0,08 моля) и 48 г воды. Полученная смесь соответствует составу (в терминах мольных отношений оксидов на 1 моль ZrO2 в продукте первого этапа):
ZrO2•(0,80) [(ТЭА)2O]•(12,00) SiO2•(150) H2O
и имеет pH ≅ 10 - 11. Эту смесь выдерживают в автоклаве при температуре 95oC в течение 37 часов. По окончании стабилизации продукт фильтруют, промывают водой, сушат при 105 - 110oC и прокаливают в потоке воздуха при 550 - 600oC в течение 2 - 5 часов.
Физико-химические характеристики материала приведены в табл. 3.
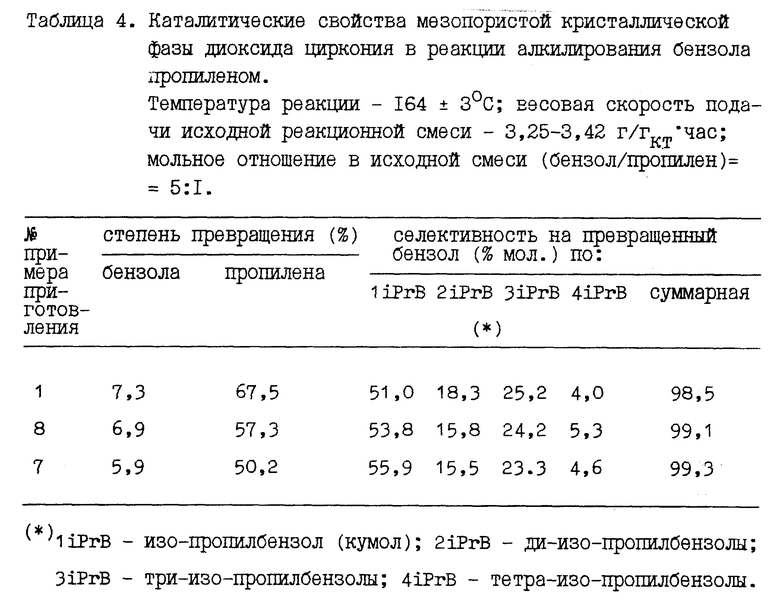
Пример 26.
Каталитические свойства мезопористой кристаллической фазы диоксида циркония, приготовленной по заявляемому способу, измерены в реакции алкилирования бензола пропиленом при атмосферном давлении. Для проведения измерений из порошка материала на основе мезопористой кристаллической фазы диоксида циркония путем сухого прессования (без связующего) и последующего дробления таблеток отбирают фракцию 2 - 4 мм. Определенную навеску фракции помещают в проточный кварцевый реактор и активируют в потоке воздуха при температуре 550 - 600oC. Затем температуру в реакторе снижают до рабочей температуры реакции алкилирования (164±3oC), и одновременно поток воздуха заменяют на поток инертного газа (гелия). После установления рабочей температуры, поток газа перекрывают, и в реактор через испаритель с температурой 200 - 220oC подают (с определенной весовой скоростью) смесь бензола с пропиленом в мольном отношении (бензол/пропилен) = 5:1. Продукты превращения на выходе из реактора охлаждают водяным холодильником и разделяют по фазам в приемнике-сепараторе. Количество получаемых жидких продуктов определяют взвешиванием, количество газообразных - по газовому счетчику. Состав и жидких, и газообразных продуктов анализируют хроматографически (метод ГЖХ).
Условия испытаний и результаты расчета степеней превращения и селективностей приведены в табл. 4 (в конце описания)
См. табл. 2 и 3. Сравнение физико-химических характеристик материала на основе мезопористой кристаллической фазы диоксида циркония после окислительной термообработки при температуре не ниже 550oC, показывает, что материал, приготовленный по заявляемому способу, во всех случаях имеет и большую удельную поверхность, и больший суммарный объем пор по сравнению с этими характеристиками для материалов, полученных по способам-аналогам и способу-прототипу. Причина заключается в большей (практически полной) степени сохранности кристаллической структуры материала на основе мезопористой фазы диоксида циркония, приготовленной по заявляемому способу. Как видно из результатов сравнительных примеров, отклонение способа приготовления от заявляемых составов либо первого, либо второго этапа приводит к ухудшению характеристик материала. Так, увеличение мольного отношения (SO3/ZrO2) от 1,50 уже до 1,70 (пример 23 ср.) приводит к исчезновению рефлекса на рентгенограмме (аморфизации фазы и, как следствие, к малому суммарному объему пор), хотя удельная поверхность остается значительной. Уменьшение отношения (SO3/ZrO2) от 0,9 до 0,8 (пример 22 ср.), а также уменьшение мольной доли щелочи на II этапе от 0,75 до 0,65 и менее (примеры 22 ср., 24 ср.) не влияют на сохранность рефлекса, однако приводят к значительному уменьшению и удельной поверхности, и суммарного объема пор. Чрезмерное увеличение концентрации элемента в щелочном растворе на этапе стабилизации до уровня мольного отношения (SiO2/ZrO2) = 12 (пример 25 ср.) приводит и к исчезновению рефлекса на рентгенограмме (аморфизации фазы и, как следствие, к малому суммарному объему пор), и к значительному уменьшению удельной поверхности.
См. табл. 4. Мезопористая кристаллическая фаза диоксида циркония, полученная в оптимальных условиях по заявляемому способу, обладает высокой активностью и селективностью действия в реакции алкилирования, даже при относительно низкой температуре реакции и относительной большой удельной нагрузке по сырью (большой скорости подачи).
| название | год | авторы | номер документа |
|---|---|---|---|
| МЕЗОПОРИСТЫЙ МАТЕРИАЛ НА ОСНОВЕ ОКСИДА ЦИРКОНИЯ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2005 |
|
RU2280504C1 |
| КАТАЛИЗАТОР ДЛЯ АЛКИЛИРОВАНИЯ БЕНЗОЛА ПРОПИЛЕНОМ И СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ | 1995 |
|
RU2097129C1 |
| КАТАЛИЗАТОР ПРЕВРАЩЕНИЯ УГЛЕВОДОРОДОВ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2005 |
|
RU2276621C1 |
| КАТАЛИЗАТОР ОКИСЛЕНИЯ ОКСИДА УГЛЕРОДА И УГЛЕВОДОРОДОВ (ВАРИАНТЫ) | 1996 |
|
RU2100067C1 |
| КАТАЛИЗАТОР ДЛЯ СИНТЕЗА ГИДРОКСИЛАМИНА | 1994 |
|
RU2065326C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВЫСОКООКТАНОВЫХ КОМПОНЕНТОВ БЕНЗИНА И КАТАЛИЗАТОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1995 |
|
RU2091360C1 |
| КАТАЛИЗАТОР И СПОСОБ ПОЛУЧЕНИЯ СИНТЕЗ-ГАЗА ПАРОВОЙ КОНВЕРСИЕЙ УГЛЕВОДОРОДОВ | 2001 |
|
RU2185239C1 |
| УГЛЕРОДМИНЕРАЛЬНЫЙ КОМПОЗИТ | 1995 |
|
RU2106196C1 |
| СПОСОБ ПОЛУЧЕНИЯ НОСИТЕЛЯ КАТАЛИЗАТОРА ПРЕВРАЩЕНИЙ УГЛЕВОДОРОДНОГО СЫРЬЯ НА ОСНОВЕ МЕЗОПОРИСТОГО МАТЕРИАЛА | 2015 |
|
RU2584951C1 |
| КАТАЛИЗАТОР СИНТЕЗА β - ПИКОЛИНА КОНДЕНСАЦИЕЙ АКРОЛЕИНА С АММИАКОМ И СПОСОБЫ ЕГО ПРИГОТОВЛЕНИЯ | 1994 |
|
RU2079360C1 |
Изобретение относится к новым синтетическим мезопористым кристаллическим материалам и способам их приготовления. Такие материалы представляют большой интерес для использования в качестве сорбентов или катализаторов реакций превращения органических и неорганических веществ. Получен новый материал на основе мезопористой кристаллической фазы диоксида циркония с увеличенными значениями удельной поверхности и удельного суммарного объема пор за счет практически полного сохранения кристаллической структуры продукта после окислительной термообработки при температурах 550 - 600oС. Способ приготовления материала включает на первом этапе, получение исходной формы мезопористой кристаллической фазы диоксида циркония путем гидротермальной кристаллизации реакционной смеси. Смесь приготовлена из смеси сульфата циркония Zr(SO4)2 и гидроксида циркония Zr(OH)4, взятых в определенном соотношении, и катионного поверхностно-активного вещества в водном растворе. На втором этапе проводят стабилизацию мезопористой структуры исходной формы фазы путем ее обработки в определенных условиях щелочным раствором оксида ЭOm, взятом в определенном соотношении к исходной форме мезопористой кристаллической фазы. 2 с. и 3 з.п. ф-лы, 4 табл.
 , отличающийся тем, что указанный материал имеет химический состав в терминах мольных отношений оксидов ZrO2 • хЭОm, где Э - по крайней мере один из элементов III - VI групп, а величина х не более 10, удельную поверхность более 390 м2/г и удельный суммарный объем пор более 0,218 см3/г.
, отличающийся тем, что указанный материал имеет химический состав в терминах мольных отношений оксидов ZrO2 • хЭОm, где Э - по крайней мере один из элементов III - VI групп, а величина х не более 10, удельную поверхность более 390 м2/г и удельный суммарный объем пор более 0,218 см3/г. , химический состав в терминах мольных отношений оксидов ZrO2 • хЭОm, где Э - по крайней мере один из элементов III - VI групп, а величина х не более 10, удельную поверхность более 390 м2/г и удельный суммарный объем пор более 0,218 см3/г, путем гидротермальной кристаллизации на первом этапе соединений циркония в присутствии сульфатных анионов и алкил (арил) аммонийных катионов состава NR
, химический состав в терминах мольных отношений оксидов ZrO2 • хЭОm, где Э - по крайней мере один из элементов III - VI групп, а величина х не более 10, удельную поверхность более 390 м2/г и удельный суммарный объем пор более 0,218 см3/г, путем гидротермальной кристаллизации на первом этапе соединений циркония в присутствии сульфатных анионов и алкил (арил) аммонийных катионов состава NR
| CIESLA U | |||
| et al "Formation of porouz zirconium oxo phosphate with a high surface area by a surfactant - assisted synthesis", ANGEWANDTE CHEMIE, INTERNATIONAL EDITION IN ENGLISH, 1996, v.35, N 35, N 5 | |||
| Способ обработки легко рассыпающихся и плохо высыхающих осочно-тростниковых торфов при помощи разбавленных щелочей | 1922 |
|
SU541A1 |
| МИКРОСФЕРИЧЕСКИЙ ЦЕОЛИТСОДЕРЖАЩИЙ КАТАЛИЗАТОР ДЛЯ ПРЕВРАЩЕНИЯ АЛИФАТИЧЕСКИХ УГЛЕВОДОРОДОВ C- C | 1992 |
|
RU2019290C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛЫХ МИКРОСФЕР ОКСИДА МЕТАЛЛА | 1990 |
|
RU2021206C1 |
| US 5004719 A, 02.04.91 | |||
| КОМПОЗИЦИЯ ЭЛЕКТРООСАЖДАЕМОГО ПОКРЫТИЯ, ХАРАКТЕРИЗУЮЩАЯСЯ УЛУЧШЕННЫМ ПРОТИВОДЕЙСТВИЕМ ОБРАЗОВАНИЮ КРАТЕРОВ | 2017 |
|
RU2709432C1 |
| EP 0327814 A1, 16.08.89 | |||
| Ключевой стабилизатор напряженияпОСТОяННОгО TOKA | 1979 |
|
SU796821A1 |
Авторы
Даты
1999-05-10—Публикация
1997-12-09—Подача