Настоящее изобретение относится к области медицины, в частности к получению применяемых в терапии сахарного диабета препаратов инсулина. Изобретение может быть использовано в медицинской промышленности для изготовления инсулина.
В настоящее время для лечения сахарного диабета используется широкая гамма препаратов инсулина, получаемых из природных источников - островков поджелудочной железы крупного рогатого скота и свиней. Бычий и свиной инсулины, которые являются наиболее близкими к инсулину человека по своему строению и аминокислотной последовательности, проявляют в организме человека активность, сравнимую с инсулином человека. Бычий инсулин отличается по аминокислотам в трех положениях, поэтому он обладает высокой иммуногенностью и в настоящее время редко используется. Молекула свиного инсулина, который получают вытяжкой из поджелудочной железы свиньи (Большая медицинская энциклопедия, статья “Инсулин”), отличается от инсулина человека всего лишь на одну аминокислоту в В-цепи (вместо треонина в 30 положении находится аланин) и благодаря современным способам очистки используется достаточно широко. Однако после длительного применения в организме человека начинают накапливаться антитела к свиному инсулину, тем самым сводя на нет его действие. Кроме того, самый быстродействующий инсулин достигает после инъекции своего максимального действия через достаточно большой промежуток времени: от 2 до 8 часов.
Но в связи с ростом заболеваемости сахарным диабетом материального субстрата (поджелудочной железы свиньи) вскоре будет не хватать. Поэтому, несмотря на несомненное качество многокомпонентных свиных инсулинов, которые успешно применяются, в перспективе нужно стремиться переходить на альтернативные источники получения инсулина.
Технический результат настоящего изобретения заключается в расширении арсенала природных источников для получения инсулина, способного в дозозависимой манере конкурировать за связь с инсулиновым рецептором, в концентрации свыше 100 нг/мл вызывать резкое увеличение рецепторного связывания, имеющего более высокую, чем у стандартных инсулинов, гидрофобность, а значит, и определенные отличия в структуре его молекулы.
Указанный технический результат достигается тем, что в способе получения инсулина путем выделения его из поджелудочной железы природного источника согласно изобретению используют поджелудочную железу северного оленя, которую гомогенизируют в растворе солянокислого этанола, проводят экстракцию с последующим осветлением раствора и получением супернатанта, который подвергают ионообменной хроматографии и изоэлектрическому осаждению с получением инсулина, очистку которого проводят путем высокоэффективной обратнофазной жидкостной хроматографией.
В дальнейшем предлагаемое изобретение поясняется конкретным примером его выполнения и прилагаемыми чертежами, на которых согласно изобретению:
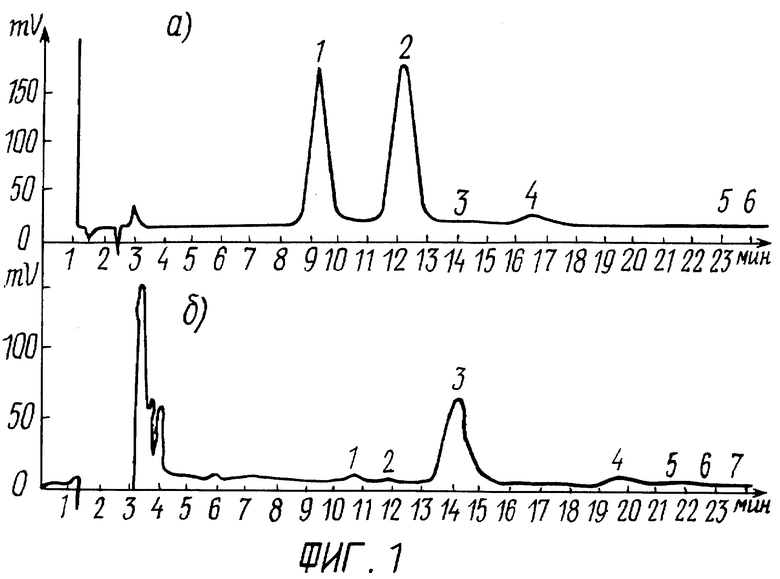
Фиг.1 - изображает обратнофазную жидкостную хроматографию смеси стандартных инсулинов быка, свиньи и панкреатического инсулина северного оленя;
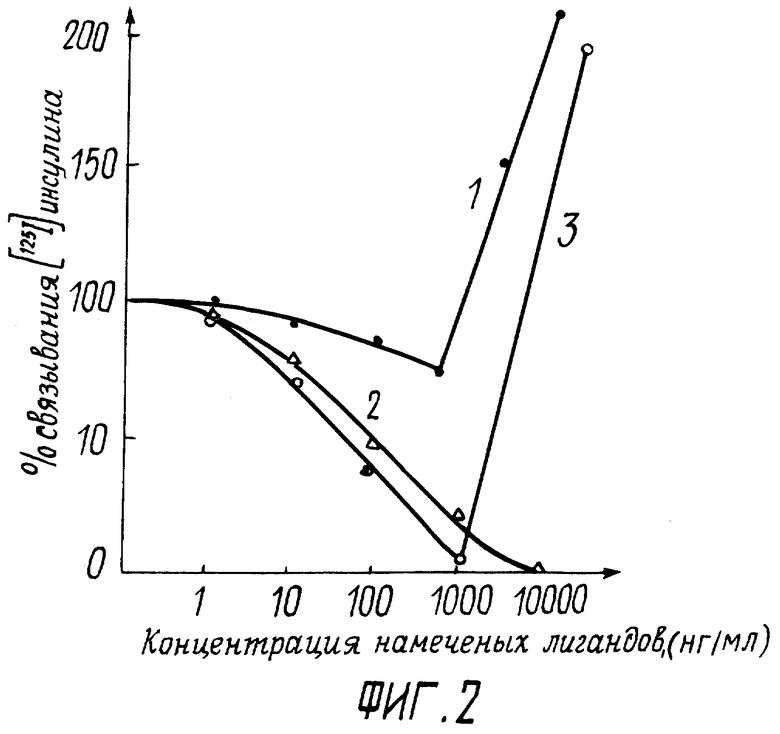
Фиг.2 - кривые конкурентного вытеснения меченного 125I инсулина поджелудочной железы северного оленя, связанного с гомологичным рецептором плазматических мембран печени крыс.
Предлагаемый способ получения инсулина осуществляют следующим образом.
Поджелудочную железу северного оленя, содержащую наряду с эндокринной тканью большое количество жировых прослоек, гомогенизировали в растворе солянокислого эталона в соотношении 1:15. Экстракцию проводят на шуттельн-аппарате в течение 2 часов при комнатной температуре, после чего раствор осветляют центрифугированием с получением супернатанта (К-70, 3000 об/мин, 60 мин, 4°С).
Ионообменная хроматография
Супернатант поджелудочной железы подвергают ионообменной хроматографии. Для этого супернатант наносят на колонку (5×50 см), заполненную микропористым сульфокатионитом КУ-23 в H+ форме. Последующие этапы очистки состоят из обезжиривания белок-катинит 70% этанолом, отмывки от балластных белков (0,5 М раствор уксусного аммония, рН 5,0), элюции инсулина (0,2 N раствор аммонийного буфера, рН 9,4). Контроль состава элюатов осуществляют на спектрофотометре при длине волны 280 нм. Белковый пик, обнаруживаемый в тех же условиях, что и стандартный инсулин, собирают и после приведения к рН 2,3 проводят его рехроматографию.
Изоэлектрическое осаждение
Сопутствующие основному веществу белки осаждают путем последовательного приведения полученного после ионообменной хроматографии элюата к рН 2,0 и после добавления ацетона (20% от объема раствора) - к рН 4,0. Смеси оставляют на 1 час при +20°С и на ночь при +4°С. Раствор центрифугируют (осадок замораживают). К супернанту добавляют 10%-ный раствор ацетата Zn (2% от объема раствора) и доводят рН до 5,95. Раствор оставляют при +20°С в течение часа, затем помещают на 72 часа в холодильник. Осадок отделяют центрифугированием (К-23, 4000 об/мин или К-70, 3000 об/мин, 60 мин, 4°С).
Высокоэффективная обратнофазная жидкостная хроматография (ВЭЖХ)
ВЭЖХ очистку полученного из поджелудочной железы северного оленя инсулина выполняют с применением системы Knauer (Германия) на колонке Диасфер С 18,5 мкм×4,0×250 мм (“ЭЛСИКО”, Россия), с использованием буферных смесей. Скорость элюции - 1 мл/мин. Оптическую плотность элюата регистрируют при 226 нм. Рехроматографию значимых пиков осуществляют в аналогичных фракционированию условиях.
Радиолигандные исследования
Способность выделенного из поджелудочной железы северного оленя инсулина связываться с рецептором инсулина проверяют в специфичной для гормона радиорецепторной системе (Rusakov et al, “Isolation and characterization of insulin in Russian sturgeon (Acipenser guldenstaedti)” J.Peptide Res. 1998. v.51. p.395-400). Она включает меченый инсулин, плазматические мембраны печени и стандартный немеченый гормон. Анализ состоит в построении кривых конкурентного вытеснения свиного 125I инсулина, связанного сплазматическими мембранами, немеченым свиным инсулином, панкреатическим инсулином северного оленя.
Получение меченого гормона
В радиорецепторной тест-системе инсулина используют плазматические мембраны печени крыс, выделенные по методу Невилла (со степенью обогащения мембран рецепторами в 15-20 раз).
Очистку панкреатического инсулина северного оленя (тестируемый препарат) проводят следующим образом. Последовательные процедуры экстракции, ионнообменной хроматографии, изоэлектрического осаждения позволяют получить грубые фракции инсулина, которые после лиофилизации фракционируют с помощью ВЭЖХ. Система буферов дает возможность провести одноэтапное фракционирование панкреатического инсулина.
В одинаковых с тестируемым препаратом условиях были получены “эталонные” хроматограммы смеси коммерческих инсулинов быка (пик №1) и свиньи (пик №2), профили элюции для которых представлены на фиг.1А.
Профиль элюции для панкреатического инсулина северного оленя представлен на фиг.1Б (пик №3).
Хроматограмма тестируемого препарата позволяет проанализировать его физико-химические свойства. Как видно из фиг.1 (Б), разрешающая способность использованной ВЭЖХ системы позволяет проводить разделение инсулина, структура которого отличается двумя аминокислотами, то есть можно говорить о высокой гомогенности полученных пептидов.
Величины “подвижности” (Rf) значимых фракций тестируемого препарата, рассчитанные относительно стандартного инсулина быка и свиньи, приведены в таблице.
Как видно из таблицы, сравнение по времени удержания на колонке подтвердило отсутствие сходства панкреатического инсулина северного оленя как со стандартным инсулином крупного рогатого скота (быка), так и с гормоном свиньи. Инсулин оленя (его мажорная фракция) имеет более высокую, чем у стандартных инсулинов, гидрофобность, а значит, и определенные отличия в структуре его молекулы.
Грубый препарат панкреатичного инсулина северного оленя оценивали в экспериментах in vivo по способности вызывать гипогликемический эффект.
Опытные группы крысят получали внутрибрюшинные инъекции в количестве 50 или 100 мкг инсулина оленя, растворенного в 1,5 мл физиологического раствора. Через 20 мин после введения при дозе 50 мкг у крысят отмечено нарушение координации движения, а при дозе 100 мкг активные судороги, которые снимались введением глюкозы. Судороги крыс в ответ на инъекцию препарата Zn-инсулина северного оленя в экспериментах in vivo и последующее снятие действия препарата внутрибрюшинным введением глюкозы однозначно свидетельствуют об его гипогликемическом эффекте. Подобный метод является стандартным экспресс-тестом, применяемым при определении биологической активности любого инсулина.
Способность отдельных фракций инсулина оленя взаимодействовать с инсулиновым рецептором плазматических мембран печени крыс проиллюстрирована на фиг.2.
Как видно из фиг.2, две фракции инсулина оленя (пик №1-2 и пик №3) способны в дозозависимой манере вытеснять связанный с рецептором меченый гормон. Причем в диапазоне концентраций пептида пика №3 от 0,1 до 100 нг/мл ход кривых вытеснения стандартного инсулина и тестируемой фракции №3 практически не отличается. При концентрации пептидов более 100 нг/мл наблюдалось резкое повышение связывания меченого гормона.
Результаты радиолигандного анализа показали, что отдельные пептиды инсулина северного оленя способны по-разному, но в дозозависимой манере конкурировать за связь с инсулиновым рецептором: в концентрации свыше 100 нг/мл вызывал резкое увеличение рецепторного связывания. Этот факт свидетельствует о наличии во всех исследованных пептидных фракциях фактора, стимулирующего связывание гормона с инсулиновым рецептором.
Ни один из известных к настоящему времени инсулинов позвоночных подобной активирующей способностью не обладает.
Ниже приводятся конкретные примеры выполнения заявленного способа получения инсулина.
Пример 1.
Полупрепаративный способ получения инсулина из поджелудочной железы северного оленя (Rangifer tarandus)
1 этап. Ионообменная хроматография солянокислых экстрактов на катионообменнике КУ-23 в Н'-форме
1.1. Поджелудочная железа. До начала процедур экстрипрированную ткань поджелудочной железы северного оленя (1300 г) сохраняют в замороженном виде
1.2. Гомогенизирование. Раствор солянокислого этанола (96%-ный этанол: дистиллированная вода: 12 N соляная кислота (соотношение 880:220:17). Поджелудочную железу измельчают и гомогенизируют с помощью ножевого гомогенизатора в растворе солянокислого этанола. Соотношение ткань : солянокислый этанол 1:15. Температура 0-4°С.
1.3. Экстракция. Полученный гомогенат встряхивают на шуттель-аппарате в течение 2 ч при температуре 20-25°С.
1.4. Центрифугирование. Полученный экстракт осветляют центрифугированием (4500g 4°C в течение 60 мин.). Центрифуга К-70.
1.5. Хроматография:
Оборудование:
Стеклянная колонка: 5×50 см. Объем смолы 900 см3.
Спектрофотометр СФ-26 (или детектор 280 нм с проточной кюветой).
Реагенты:
Ионообменная смола: Сульфокатионит КУ-23 в Н+-форме.
Буфер А: раствор солянокислого этанола (96%-ный этанол: дистиллированная вода: 12 N соляная кислота (соотношение 880:220:17).
Буфер В: 70%-ный этанол.
Буфер С: 0.5 М раствор уксуснокислого аммония. рН 5.0.
Буфер Д: 0.2 М раствор хлористого аммония. рН 9.4.
Нанесение отмывки элюирование. 19.5 л осветленного центрифугированием экстракта (рН 2.3) наносят на колонку. Скорость нанесения 100 мл/ч/см2. После обезжиривания 70%-ным этанолом (2 л) комплекса белки-катионит проводят элюирование балластных белков 0.5 М раствором уксуснокислого аммония. рН 5.0, объем 15 л. Элюцию инсулина осуществляют с помощью 0.2 М раствора хлористого аммония. рН 9.4 объем 1.0 л. Состав Элюата контролируют спектрофотометрически при 280 нм и приводят к рН к 2.3, после чего проводят его рехматографию (см. п.п.1.1.-1.5.).
2 этап. Изоэлектрическое осаждение, получение комплекса цинк-инсулина северного оленя.
Оборудование: рН-метр.
Центрифуга К-70. К-23.
Реагенты: 10%-ный раствор ацетата Zn.
6 N соляная кислота.
12% раствор аммиака.
Ацетон.
2.1. Освобождение от балластных белков.
Полученный после ионообменной хроматографии элюат, содержащий инсулин, приводят рН к 2.0 (6 N соляная кислота), при помутнении (обычно в течение 30-60 мин) раствор осветляют на сутки при 4°С. Раствор центрифугируют при 3000 g. В течение 30 мин. Центрифуга К-70. Осадок разводят 0.6% уксусной кислотой и лиофилизируют: к надосадку добавляют ацетон (205 объем/объем). Приводят к рН 4.0 раствором 12% аммиака и оставляют на 1-3 суток при 4°С. Инсулинсодержащий раствор центрифугируют при 3000 g. В течение 30 мин. Центрифуга К-70. В дальнейшей работе используют надосадок.
2.2 Получение грубого Zn-инсулина северного оленя. Надосадок быстро доводят рН до 7.0 12% раствором NH4OH затем ступенчато подкисляют 6 N НСl до рН 5.95. При этом порциями добавляют 10% раствор ацетата цинка Zn(СН3СОО)2 2% от объема надосадка. Активно перемешивая содержимое сосуда стеклянной палочкой в течение 1-1,5 ч при комнатной температуре (20-25°С). Раствор оставляют на 2-ое суток в холодильнике при 4°С, затем центрифугируют (Центрифуга К-23, 4000 g, 60 мин 4°С) и в дальнейшей работе используют осажденный Zn-инсулин.
3 этап. Получение кристаллического препарата инсулина северного оленя.
Оборудование: рН-метр.
Центрифуга К-23.
Реагенты: 0.1 N лимонная кислота
10%-ный раствор ацетата Zn.
6 N соляная кислота.
12% раствор аммиака.
Ацетон
3.1. Кристаллизация инсулина. Осадок Zn-инсулина растворяют в 25 мл 0.1 N лимонной кислоты и 5 мл ацетона 12%-ным раствором аммиака доводят рН до 7.0, затем ступенчато приводят к 5.95 раствором 6 N НСl и добавляя на каждой ступени 5%-ный хлорид цинка (ZnCl2) (общее количество=2% объем/объем). Процесс занимает 1-1.5 ч, в течение которых стеклянной палочкой проводят потирание стенок сосуда. Стимулируя тем самым начальный процесс кристаллизации. Каплю раствора наносят на предметное стекло и под микроскопом контролируют начало образования кристаллов. Затем раствор оставляют на 203 суток в холодильнике при 4°С.
3.2. Осаждение, обезвоживание и сушка препарата инсулина северного оленя.
Взвесь с осадком инсулиновых кристаллов центрифугируют при 3000 g. В течение 30 мин. Надосадок отбрасывают. К осадку приливают 1-2 мл охлажденного ацетона или этанола (-18 -25°С) и переносят в полипропиленовую пробку (энсидорф). Суспензию встряхивают, после чего центрифугируют в течение 2-3 мин при 3000 g. Надосадок удаляют и процедуру обезвоживания препарата повторяют 3-5 раз. Влажный осадок сушат в термостате (или вакуумной камере) при 25-30°С в течение нескольких часов, определяя готовность полученного препарата по мере убывания веса пробирки с кристаллическим инсулином.
4 этап. Анализ биологической активности препарата инсулина северного оленя.
4.1. Биотестирование in vitro. Панкреатический инсулин северного оленя проверяют на способность связываться с рецептором инсулина в специфической для этого гормона радиорецепторной системе, включающей меченный 125I инсулин (160-180 мкКи/мкг). Плазматические мембраны печени (0.4 мг/мл) и стандартный немеченый инсулин свиньи (0.1-10000 кг/мл).
4.2. Биотестирование in vitro. Очищенный препарат панкреатического инсулина северного оленя проверяют на способность вызывать гипогликемический эффект в условиях in vitro. Крысы (массой 60-100 г) получают внутрибрюшинные инъекции 50 или 100 мкг панкреатического инсулина северного оленя. Растворенного в 1.0 мл физиологического раствора. Крысы из контрольной группы получают тот же объем физиологического раствора без панкреатического инсулина северного оленя. Через 20 минут после введения препарата в дозе 50 мкг у крыс отмечают нарушение координации движения, а при дозе 100 мкг - активные судороги, которые снимаются внутрибрюшинным введением раствора глюкозы. Судороги у крыс в ответ на инъекцию препарата Zn-инсулина северного оленя в условиях in vitro и последующее снятие действия препарата после введения глюкозы однозначно свидетельствует о гипогликемическом эффекте панкреатического инсулина северного оленя. Подобный метод является стандартным экспресс-тестом, применяемым при определении биологической активности любого инсулина.
Пример 2.
Аналитико-препаративный способ получения инсулина из поджелудочной железы северного оленя (Rangifer tarandus)
1 этап. Ионообменная хроматография солянокислых экстрактов на катионообменнике КУ-23 в H+-форме
1.1. Поджелудочная железа. До начала процедур экстрипрированную ткань поджелудочной железы северного оленя (1300 г) сохраняют в замороженном виде
1.2. Гомогенизирование. Раствор солянокислого этанола (96%-ный этанол: дистиллированная вода: 12 N соляная кислота (соотношение 880:220:17). Поджелудочную железу измельчают и гомогенизируют с помощью ножевого гомогенизатора в растворе солянокислого этанола. Соотношение ткань:солянокислый этанол 1:15. Температура 0-4°С.
1.3. Экстракция. Полученный гомогенат встряхивают на шуттель-аппарате в течение 2 ч при температуре 20-25°С.
1.4. Центрифугирование. Полученный экстракт осветляют центрифугированием (4000g 4°C в течение 60 мин). Центрифуга К-70.
1.5. Ионнообменная хроматография:
Оборудование:
Стеклянная колонка: 5×50 см. Объем смолы 900 см3.
Спектрофотометр СФ-26.
Реагенты:
Ионообменная смола: Сульфокатионит КУ-23 в Н+-форме.
Буфер А: раствор солянокислого этанола (96%-ный этанол:дистиллированная вода:12 N соляная кислота (соотношение 880:220:17).
Буфер В: 70-%-ный этанол.
Буфер С: 0.5 М раствор уксуснокислого аммония. рН 5.0.
Буфер Д: 0.2 М раствор хлористого аммония. рН 9.4.
Нанесение отмывки элюирование. 19.5 л осветленного центрифугированием экстракта (рН 2.3) наносят на колонку. Скорость нанесения 100 мл/ч/см2. После обезжиривания 70%-ным этанолом (2 л) комплекса белки-катионит проводят элюирование балластных белков 0.5 М раствором уксуснокислого аммония. рН 5.0, объем 15 л. Элюцию инсулина осуществляют с помощью 0.2 М раствора хлористого аммония. рН 9.4 объем 1.0 л. Состав элюата контролируют спектрофотометрически при 280 нм и приводят к рН к 2.3, после чего проводят его рехматографию (см. п.п.1.1.-1.5.).
2 этап. Изоэлектрическое осаждение, получение комплекса цинк-инсулина северного оленя.
Оборудование: рН-метр.
Центрифуга К-23.
Реагенты: 10%-ный раствор ацетата Zn.
6 N соляная кислота.
12% раствор аммиака.
Ацетон.
2.1. Освобождение от балластных белков.
Сопутствующие основному веществу белки осаждают путем последовательного приведения белкового элюата к рН 2.0 (6 N соляная кислота) и после добавления ацетона (20% от объема раствора) к рН 4.0 раствором 12% аммиака. Инсулиносодержащий раствор оставляют на 1 ч при 20°С, затем в течение ночи при 4°С. В случае помутнения или возникновения осадка балластных белков раствор центрифугируют (5000 g. 4°С, в течение 60 мин). Центрифуга К-23.
2.2 Осаждение Zn-инсулина северного оленя. К супернатанту добавляют 10%-ный раствор ацетата цинка (2% от объема раствора) и доводят рН до 5.95. Раствору дают стоять 1 ч при 20°С и в течение 72 ч при 4°С. Осадок Zn-инсулина отделяют центрифугированием (Центрифуга К-23. 4000 g. 60 мин 4°С).
3 этап. Высокоэффективная обратнофазная жидкостная хроматография препарата. Zn-инсулина северного оленя.
Оборудование: Система для высокоэффективной жидкостной хроматографии (Knauer).
Хроматографическая колонка Диасфер-110-С18, 5 мкм. 4.6×250 мм (“ЭЛСИКО”, Россия).
Реагенты: Трифторуксусная кислота.
Ацетонитрил.
Бидистиллированная вода.
3.1. Очистка препарата Zn-инсулина северного оленя. Препарат, полученный из поджелудочной железы северного оленя, очищают методом высокоэффективной обратнофазной жидкостной хроматографии (ВЭЖХ) с применением системы Knauer на колонке Диасорб-110-С18, 5 мкм, 4.6×250 мм (“ЭЛСИКО”, Россия). Элюцию образца проводят со скоростью 1 мл/мин в градиенте буферов А - 0.1% трифторуксусная кислота Н2О, буфер Б - 0.05% Трифторуксусная кислота в 84% ацетонитриле (СН3СN). Оптическую плотность элюата регистрируют при 226 нм. Полученный препарат подвергают повторной очистке с помощью рехроматографии в аналогичных условиях. После проведения очисток содержание инсулина в препарате составляет не менее 97%.
4 этап. Анализ биологической активности препарата инсулина северного оленя.
4.1. Биотестирование in vitro. Панкреатический инсулин северного оленя проверяют на способность связываться с рецептором инсулина в специфической для этого гормона радиорецепторной системе, включающей меченный 125I инсулин (160-180 мкКи/мкг). Плазматические мембраны печени (0.4 мг/мл) и стандартный немеченый инсулин свиньи (0.1-10000 кг/мл).
4.2. Биотестирование in vitro. Очищенный препарат панкреатического инсулина северного оленя проверяют на способность вызывать гипогликемический эффект в условиях in vitro. Крысы (массой 60-100 г) получают внутрибрюшинные инъекции 50 или 100 мкг панкреатического инсулина северного оленя, растворенного в 1.0 мл физиологического раствора. Крысы из контрольной группы получают тот же объем физиологического раствора без панкреатического инсулина северного оленя. Через 20 минут после введения препарата в дозе 50 мкг у крыс отмечают нарушение координации движения, а при дозе 100 мкг - активные судороги, которые снимаются внутрибрюшинным введением раствора глюкозы. Судороги у крыс в ответ на инъекцию препарата Zn-инсулина северного оленя в условиях in vitro и последующее снятие действия препарата после введения глюкозы однозначно свидетельствует о гипогликемическом эффекте панкреатического инсулина северного оленя. Подобный метод является стандартным экспресс-тестом, применяемым при определении биологической активности любого инсулина.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРОТИВОДИАБЕТИЧЕСКОЕ СРЕДСТВО НА ЕЕ ОСНОВЕ | 2002 |
|
RU2213568C1 |
| ПРИМЕНЕНИЕ АНТАГОНИСТОВ ЛЕПТИНА ДЛЯ ЛЕЧЕНИЯ РЕЗИСТЕНТНОСТИ К ИНСУЛИНУ ПРИ ДИАБЕТЕ II ТИПА | 1997 |
|
RU2201249C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИНСУЛИНА | 1992 |
|
RU2027444C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВЫСОКООЧИЩЕННОГО КРИСТАЛЛИЧЕСКОГО ИНСУЛИНА ЛЮБОГО ПРОИСХОЖДЕНИЯ | 2011 |
|
RU2453331C1 |
| СТИМУЛЯТОР РЕГЕНЕРАЦИИ ПАНКРЕАТИЧЕСКИХ БЕТА-КЛЕТОК И ПРОДУЦИРОВАНИЯ ИНСУЛИНА В ПАНКРЕАТИЧЕСКИХ БЕТА-КЛЕТКАХ | 2006 |
|
RU2403058C2 |
| Способ получения рекомбинантной ДНК,кодирующей нуклеотидную последовательность инсулина | 1978 |
|
SU1308199A3 |
| СПОСОБ ПОЛУЧЕНИЯ ВЫСОКОЧИСТОГО ИНСУЛИНА | 1992 |
|
RU2087151C1 |
| Способ получения карбоксипептидазы В из поджелудочной железы свиньи | 2017 |
|
RU2658757C1 |
| СПОСОБ ОЧИСТКИ ИНСУЛИНА | 1999 |
|
RU2146944C1 |
| СПОСОБ ПОЛУЧЕНИЯ ХОЛЕСТЕРОЛЭСТЕРАЗЫ, ТРИПСИНА, ДЕЗОКСИРИБОНУКЛЕАЗЫ И РИБОНУКЛЕАЗЫ ИЗ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ КРУПНОГО РОГАТОГО СКОТА | 2005 |
|
RU2311455C2 |
Настоящее изобретение относится к области медицины, в частности к получению применяемых в терапии сахарного диабета препаратов инсулина. Изобретение может быть использовано в медицинской промышленности для изготовления инсулина. Для получения инсулина используют поджелудочную железу северного оленя, которую гомогенизируют в растворе солянокислого этанола, проводят экстракцию с последующим осветлением раствора и получением супернатанта, который подвергают ионообменной хроматографии и изоэлектрическому осуждению с получением инсулина, очистку которого проводят путем высокоэффективной обратнофазной жидкостной хроматографией. Полученный инсулин способен конкурировать за связь с инсулиновым рецептором в концентрации свыше 100 нг/мл. Технический результат - расширение арсенала природных источников для получения инсулина, способного в дозозависимой манере конкурировать за связь с инсулиновым рецептором, в концентрации свыше 100 нг/мл вызывать резкое увеличение рецепторного связывания, имеющего более высокую, чем у стандартных инсулинов, гидрофобность, а значит, и определенные отличия в структуре его молекулы. 2 с.п. ф-лы, 2 ил., 1 табл.
| Большая медицинская, энциклопедия | |||
| - М.: Советская энциклопедия, 1978, т.9, с.768-774 | |||
| СПОСОБ ВЫДЕЛЕНИЯ И ОЧИСТКИ ИНСУЛИНА ИЛИ ЕГО БИОТЕХНОЛОГИЧЕСКИХ ПРЕДШЕСТВЕННИКОВ | 1994 |
|
RU2081122C1 |
| RU 2000107344 A, 10.09.2002 | |||
| ИНСУЛИНОВЫЙ ПРЕПАРАТ, СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА, СПОСОБ ЛЕЧЕНИЯ САХАРНОГО ДИАБЕТА | 1994 |
|
RU2135205C1 |
| СПОСОБ ОЧИСТКИ ИНСУЛИНА И/ИЛИ ЕГО ПРОИЗВОДНЫХ | 1991 |
|
RU2037500C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВЫСОКООЧИЩЕННОГО МОНОКОМПОНЕНТНОГО ИНСУЛИНА | 1995 |
|
RU2120299C1 |
| Способ получения белково-пептидногоКОМплЕКСА | 1979 |
|
SU843994A1 |
| WO 8303054 A1, 15.09.1983 | |||
| СПОСОБ ПОЛУЧЕНИЯ ПАРФЮМЕРНОГО α-ТЕРПИНЕОЛА | 2015 |
|
RU2581647C1 |
Авторы
Даты
2005-05-10—Публикация
2003-09-18—Подача