Изобретение относится к соединениям, обладающим агонистической или антагонистической активностью в отношении гликопротеинового гормона, в частности к соединениям, обладающим агонистической активностью в отношении лютеинизирующего гормона (LH). Кроме того, изобретение относится к бициклическим гетероароматическим производным, содержащим их фармацевтическим композициям, а также к применению данных соединений в медицинской терапии, в частности для использования для регулирования фертильности.
Гонадотропины выполняют важные функции во множестве функций тела, включая метаболизм, температурную регуляцию и репродуктивный процесс. Гипофизарный гонадотропин FSH, например, играет основную роль в стимуляции развития и созревании фолликула, тогда как LH индуцирует овуляцию (Sharp R.M. Clin. Endocrinol. 33:787-807, 1990; Dorrington and Armstrong, Recent Prog.Horm.Res. 35:301-342, 1979). В настоящее время LH применяется клинически, в сочетании с FSH, для стимуляции яичников, например, для гиперстимуляции яичников для оплодотворения in vitro (IVF) и индуцирования овуляции у бесплодных неовулирующих женщин (Insler V., Int.J.Fertility 33:85-97, 1988, Navot and Rosenwaks, J.Vitro Fert. Embryo Transfer 5:3-13, 1988), а также при недоразвитии половой системы у мужчин и мужском бесплодии.
Гонадотропины действуют на специфические гонадные типы клеток для инициирования яичниковой и тестикулярной модификации и стероидогенеза. Действие данных слизистых и плацентарных гормонов опосредовано специфическими плазматическими мембранными рецепторами, которые принадлежат к большому семейству G-протеин-связанных рецепторов. Они состоят из единственного полипептида с семью трансмембранными доменами и способны взаимодействовать с Gs белком, приводя к активации аденилциклазы.
Гонадотропины, предназначенные для терапевтических целей, могут быть выделены из мочи человека в качестве источников и имеют низкую чистоту (Morse et al., Amer.J.Reproduct. Immunol. And Microbiology 17:143, 1988). Альтернативно, они могут быть получены в качестве рекомбинантных гонадотропинов.
Как и в случае других терапевтических белков, гонадотропины необходимо вводить либо подкожно, либо внутримышечно. Однако было бы предпочтительно активировать рецептор маленькими молекулами, которые можно было бы вводить, например, пероральным или чрескожным путями.
В настоящем изобретении описано получение таких низкомолекулярных аналогов гормонов, которые селективно активируют один из гонадотропиновых рецепторов, что является одним из основных преимуществ настоящего изобретения.
Таким образом, изобретение относится к бициклическим гетероароматическим производным общей формулы I или их фармацевтически приемлемым солям
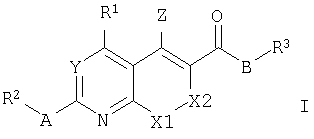
где
R1 представляет собой С3-С8циклоалкил, С2-С7гетероциклоалкил, С6-С14арил или С4-С13гетероарил; предпочтительно R1 представляет собой С6-С14арил или С4-С13гетероарил;
R2 представляет собой С1-С4алкил, С2-С4алкенил, С2-С4алкинил, С6-С14арил или С4-С13гетероарил;
R3 представляет собой С1-С8алкил, С3-С8циклоалкил, С2-С7гетероциклоалкил, С6-С14арил или С4-С13гетероарил;
Y представляет собой СН или N;
Z представляет собой NH2 или ОН;
А представляет собой S, N(H), N(R4), O или связь;
R4 может быть выбран из групп, которые описаны для R2, и В представляет собой N(H), О или связь.
Кольцевая система в R1 необязательно может быть замещена одним или несколькими заместителями, выбранными из R5,N(R4)R5, NHR5, OR5 и/или SR5, в которых R5 представляет собой С6-С14арил, С4-С13гетероарил, С6-С14арилкарбонил, С2-С7гетероциклоалкил, С3-С8циклоалкил, С6-С14арилсульфонил, С6-С14ариламинокарбонил, С6-С14арилоксикарбонил, С6-С14ариламиносульфонил, С6-С14арилоксисульфонил, С2-С8алкенил, С2-С8алкинил, С2-С7гетероциклоалкилкарбонил, С2-С8алкенилсульфонил, С2-С8алкеноксикарбонил, или С1-С8алкил, С1-С8алкилкарбонил, С1-С8алкилсульфонил, С1-С8(ди)алкиламинокарбонил, С1-С8алкоксикарбонил, С1-С8(ди)алкиламиносульфонил или С1-С8алкоксисульфонил, алкильная группа в которых необязательно может быть замещена одним или несколькими заместителями, выбранными из гидроксила, С1-С8алкокси, С2-С7гетероциклоалкил(С1-С8)алкокси, С3-С8циклоалкил(С1-С8)алкокси, С6-С14арил(С1-С8)алкокси, С4-С13гетероарилС1-С8алкокси, С2-С7гетероциклоалкила, С3-С8циклоалкила, С6-С14арила, С4-С13гетероарила, С1-С8алкоксикарбонила, С6-С14арилоксикарбонила, С1-С8алкилкарбонилокси, С6-С14арилкарбонилокси, С1-С8алкилкарбонила, С6-С14арилкарбонила, амина, С1-С8алкиламинокарбонила, С6-С14ариламинокарбонила, С1-С8алкилкарбониламино, С6-С14арилкарбониламино, С6-С14(ди)ариламино, (ди)[С1-С3алкокси(С1-С3)алкил]амино и/или С1-С8(ди)алкиламино. Предпочтительно заместители в R1 выбирают из NHR5 или OR5. R5 в любом из заместителей при R1 предпочтительно представляет собой С2-С7гетероциклоалкилкарбонил, С6-С14арилкарбонил или С1-С8алкил, С1-С8алкилкарбонил или С1-С8(ди)алкиламинокарбонил, алкильная группа в которых необязательно может быть замещена С2-С7гетероциклоалкилом, С4-С13гетероарилом, С1-С8алкоксикарбонилом, С1-С8алкиламинокарбонилом, С1-С8алкилкарбониламино, С6-С14арилкарбониламино, амином, и/или С1-С8(ди)алкиламино. Наиболее предпочтительные заместители в алкильной группе представляют собой С2-С7гетероциклоалкил, С1-С8(ди)алкиламино, амин и С1-С8(ди)алкиламинокарбонил.
Наиболее предпочтительным в R1 является фенил, необязательно замещенный одним из выше указанных заместителей, предпочтительно замещение осуществлено в мета-положении.
В соединениях изобретения Х1-Х2 представляет собой С=С, C(O)-NH, NH-C(O), C(O)-О, O-C(O), C=N или N=C. Если R5 представляет собой С1-С8алкилсульфонил, С6-С14арилсульфонил, С1-С8(ди)алкиламинокарбонил, С6-С14ариламинокарбонил, С1-C8алкоксикарбонил, С6-С14арилоксикарбонил, С1-С8(ди)алкиламиносульфонил, С6-С14ариламиносульфонил, С1-С8алкоксисульфонил, С2-С7гетероциклоалкилкарбонил, С2-С8алкенилсульфонил, С2-С8алкеноксикарбонил или С6-С14арилоксисульфонил, то Х1-Х2 дополнительно могут представлять собой S или О.
Предпочтительными соединениями согласно изобретению являются соединения общей формулы I, где В представляет собой N(H) или связь, и/или Z представляет собой NH2. Среди таких предпочтительных соединений особенно предпочтительными являются те, в которых В представляет собой N(H) или связь, и Z представляет собой NH2. Более предпочтительными являются соединения, в которых предпочтительно в дополнение к указанным отмеченным определениям В и Z, R1 определятся как С6-С14арил или С4-С13гетероарил, необязательно замещенный одним или несколькими заместителями, выбранными из N(R4)R5, NHR5, R5, OR5 и/или SR5, предпочтительно NHR5 или OR5.
Предпочтительно, во всех вышеуказанных соединениях Y представляет N, предпочтительным для В является N(H) или связь. Если В представляет собой связь, то R3 предпочтительно представляет собой C2-C7гетероциклоалкил.
Кроме того, во всех вышеуказанных соединениях Х1-Х2 предпочтительно представляет собой С=С, C=N или N=C, наиболее предпочтительно С=С.
Если R5 представляет собой С1-С8алкилсульфонил, С6-С14арилсульфонил, С1-С8(ди)алкиламинокарбонил, С6-С14ариламинокарбонил, С1-С8алкоксикарбонил, С6-С14арилоксикарбонил, С1-С8(ди)алкиламиносульфонил, С6-С14ариламиносульфонил, С1-С8алкоксисульфонил, C2-C7гетероциклоалкилкарбонил, С2-С8алкенилсульфонил, С2-С8алкеноксикарбонил или С6-С14арилоксисульфонил, тогда предпочтительным для Х1-Х2, в дополнение к вышеуказанным группам, также является S.
Наиболее предпочтительными являются соединения, выбранные из группы, включающей трет-бутил 5-амино-2-метилтио-4-(3-((N,N-диэтиламино)карбонилокси)фенил)тиено[2,3-d]пиримидин-6-карбоксамид, трет-бутил 5-амино-2-метилтио-4-(3-(метоксикарбониламино)фенил)тиено[2,3-d]пиримидин-6-карбоксамид, трет-бутил 5-амино-2-метилтио-4-(3-(аллилоксикарбонил-амино)фенил)тиено[2,3-d]пиримидин-6-карбоксамид, трет-бутил 5-амино-2-метилтио-4-(3-(этоксикарбониламино)фенил)тиено[2,3-d]пиримидин-6-карбоксамид, трет-бутил 5-амино-2-метилтио-4-(3-((морфолин-4-ил)карбониламино)фенил)тиено[2,3-d]пиримидин-6-карбоксамид, трет-бутил 5-амино-2-метилтио-4-(3-(1,2,3,6-тетрагидропиридино-карбониламино)фенил)тиено[2,3-d]пиримидин-6-карбоксамид, трет-бутил 5-амино-2-фенил-4-(3-((N,N-диметиламино)карбонилокси)фенил)тиено[2,3-d]пиримидин-6-карбоксамид.
Такие соединения как этил 5-гидрокси-2-метил-4-(пиперидин-1-ил)-пиридо[2,3-d]пиримидин-6-карбоксилат, этил 5-гидрокси-2-метил-4-(морфолин-4-ил)-пиридо[2,3-d]пиримидин-6-карбоксилат или этил 5-гидрокси-2-метил-4-(пирролидин-1-ил)пиридо[2,3-d]пиримидин-6-карбоксилат исключены из объема настоящего изобретения.
Исключение связано с раскрытием данных соединений в Chem. Pharm. Bull., 18(7), 1385-1393 (1970).
Термин С1-С8алкил, как он использован в определении формулы I, означает разветвленную или неразветвленную алкильную группу, имеющую 1-8 атомов углерода, например, метил, этил, пропил, изопропил, бутил, втор-бутил, трет-бутил, гексил и октил. C1-C6Алкильные группы являются предпочтительными, C1-C3алкильные группы являются наиболее предпочтительными.
Термин С2-С8алкенил означает разветвленную или неразветвленную алкенильную группу, имеющую 2-8 атомов углерода, такую как этенил, 2-бутенил и т.д. C1-C6Алкенильные группы являются предпочтительными, C1-C3алкенильные группы являются наиболее предпочтительными.
Термин С2-С8алкинил означает разветвленную или неразветвленную алкинильную группу, имеющую 2-8 атомов углерода, такую как этинил и пропинил. Наиболее предпочтительными являются C2-C4алкинильные группы.
Термин С6-С14арил означает ароматическую углеводородную группу, имеющую 6-14 атомов углерода, такую как фенил, нафтил, тетрагидронафтил, инденил, антрацил, которые необязательно могут быть замещены одним или несколькими заместителями, такими как, но не ограничиваясь ими, гидрокси, галоген, нитро, трифторметил, циано, С1-С8алкилкарбониламино, С1-С8алкиламинокарбонил или С1-С8(ди)алкиламино, алкильные фрагменты имеют такое же значение, как определено ранее. Более предпочтительными являются С6-С10арильные группы. Наиболее предпочтительной ароматической углеводородной группой является фенил.
Термин С3-С8циклоалкил означает циклоалкильную группу, содержащую 3-8 атомов углерода, представляющую собой циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил.
Термин C2-C7гетероциклоалкил означает гетероциклоалкильную группу, имеющую 2-7 атомов углерода, предпочтительно 2-5 атомов углерода, и по крайней мере включающую один гетероатом, выбранный из N, O или S. Предпочтительными гетероатомами являются N или О. Азот-содержащие гетероциклоалкильными группы могут быть связаны через атома углерода или азота. Наиболее предпочтительными гетероциклоалкильными группами являются пиперидин, морфолин и пирролидин.
Термин C2-C7гетероциклоалкилкарбонил означает гетероциклоалкильную группу, имеющую 2-7 атомов углерода, как определено ранее, соединенную с карбонильной группой.
Термин С1-С8алкокси означает алкоксильную группу, имеющую 1-8 атомов углерода, алкильный фрагмент имеет значения, определенные ранее. C1-C6Алкоксильные группы являются предпочтительными, C1-C3алкоксильные группы являются наиболее предпочтительными.
Термин С1-С8алкоксикарбонил означает алкоксикарбонильную группу, алкильная группа в которой содержит 1-8 атомов углерода и имеет значение, определенное ранее. C1-C6Алкоксикарбонильные группы являются предпочтительными, C1-C3алкоксикарбонильные группы являются наиболее предпочтительными.
Термин С1-С8алкеноксикарбонил означает алкеноксикарбонильную группу, алкенильная группа в которой содержит 2-8 атомов углерода и имеет значение, определенное ранее. С2-С6Алкеноксикарбонильные группы являются предпочтительными, С2-С3алкеноксикарбонильные группы являются наиболее предпочтительными.
Термин С1-С8алкоксисульфонил означает алкоксисульфонильную группу, алкильная группа в которой содержит 1-8 атомов углерода и имеет значение, определенное ранее. C1-C6Алкоксисульфонильные группы являются предпочтительными, C1-C3алкоксисульфонильные группы являются наиболее предпочтительными.
Термин С1-С8(ди)алкиламино означает (ди)алкиламиногруппу, имеющую 1-8 атомов углерода, алкильный фрагмент в которой имеет значение, определенное ранее. Более предпочтительными являются C1-C6(ди)алкиламино группы.
Термин ди[C1-C3алкоксиC1-C3алкил]амино означает (ди[алкоксиалкил]амино группу, в которой как алкильный, так и алкоксильный фрагменты имеют 1-3 атома углерода и значения, определенные ранее.
Термин С6-С14(ди)ариламино означает (ди)ариламиногруппу, имеющую 6-14 атомов углерода, арильный фрагмент имеет значение, определенное ранее. Более предпочтительными являются С6-С10(ди)ариламино группы. Наиболее предпочтительной (ди)ариламино группой является (ди)фениламино.
Термин С1-С8алкилтио означает алкилтио группу, имеющую 1-8 атомов углерода, алкильный фрагмент имеет значение, определенное ранее. Наиболее предпочтительными являются С1-С4алкилтио группы.
Термин С6-С14арилоксикарбонил означает арилоксикарбонильную группу, арильная группа в которой содержит 5-14 атомов углерода, более предпочтительно 6-10 атомов углерода и имеет значение, определенное ранее. Наиболее предпочтительными являются феноксикарбонильные группы.
Термин С6-С14арилоксисульфонил означает арилоксисульфонильную группу, арильная группа в которой содержит 6-14 атомов углерода, более предпочтительно 6-10 атомов углерода и имеет значение, определенное ранее. Наиболее предпочтительными являются феноксисульфонильные группы.
Термин С6-С14арилС1-С8алкил означает арилалкильную группу, имеющую 7-22 атома углерода, где алкильная группа представляет собой С1-С8алкильную группу, и арильная группа представляет собой С6-С14арильную группу, как определено ранее. Более предпочтительными являются С6-С10арилС1-С4алкильные группы. ФенилС1-С4алкильные группы, такие как бензил, являются наиболее предпочтительными аралкильными группами.
Термин С4-С13гетероарил означает замещенную или незамещенную ароматическую группу, имеющую 4-13 атомов углерода, предпочтительно 4-9, и включающую по крайней мере один гетероатом, выбранный из N, O и/или S, такую как имидазолил, тиенил, бензтиенил, хинолил, тетрагидрохинолил, изохинолил, тетрагидроизохинолил, индолил, акридинолил, фурил или пиридил. Заместители гетероарильной группы могут быть выбраны из группы заместителей, перечисленных для арильной группы. Предпочтительными гетероарильными группами являются тиенил, фурил, пиридил и пиримидил. Азот-содержащие гетероарильные группы могут быть связаны посредством атома углерода или азота.
Термин галоген означает фтор, хлор, бром или иод.
Термин C2-C7гетероциклоалкилС1-С8алкокси означает гетероциклоалкильную группу, содержащую 2-7 атомов углерода, как определено ранее, присоединенную к С1-С8алкоксильной группе, алкоксильный фрагмент имеет значение, определенное ранее. Более предпочтительными являются C2-C5гетероциклоалкилC1-C4алкоксильные группы.
Термин С3-С8циклоалкилС1-С8алкокси означает циклоалкильную группу, содержащую 3-8 атомов углерода, как определено ранее, присоединенную к С1-С8алкоксильной группе, алкоксильный фрагмент имеет значение, определенное ранее. Более предпочтительными являются C3-C6циклоалкилC1-C4алкоксильные группы.
Термин С6-С14арилС1-С8алкокси означает арильную группу, содержащую 6-14 атомов углерода, как определено ранее, присоединенную к С1-С8алкоксильной группе, алкоксильный фрагмент имеет значение, определенное ранее. Более предпочтительными являются C6-C10арилC1-C4алкоксильные группы, фенилC1-C4алкоксильные группы являются наиболее предпочтительными. C4-C13ГетероарилС1-С8алкоксильные группы являются аналогами С6-С14арилС1-С8алкоксильных групп, включающими по крайней мере один гетероатом, выбранный из N, O и S в гетероарильном кольце. Более предпочтительными являются С4-С9гетероарилC1-C4алкоксильные группы.
Термин С1-С8алкилкарбонил означает алкилкарбонильную группу, алкильная группа в которой содержит 1-8 атомов углерода и имеет значение, определенное ранее. Более предпочтительными являются C1-C6алкилкарбонильные группы, C1-C4алкилкарбонильные группы являются наиболее предпочтительными.
Термин С6-С14арилкарбонил означает арилкарбонильную группу, арильная группа в которой содержит 6-14 атомов углерода и имеет значение, определенное ранее. Более предпочтительными являются C6-C10арилкарбонильные группы, фенилкарбонильные группы являются наиболее предпочтительными.
Термин С1-С8алкилсульфонил означает алкилсульфонильную группу, алкильная группа в которой содержит 1-8 атомов углерода и имеет значение, определенное ранее. Более предпочтительными являются C1-C6алкилсульфонильные группы, C1-C4алкилсульфонильные группы являются наиболее предпочтительными.
Термин С2-С8алкенилсульфонил означает алкенилсульфонильную группу, алкенильная группа в которой содержит 2-8 атомов углерода и имеет значение, определенное ранее. Более предпочтительными являются C2-C6алкенилсульфонильные группы, C2-C4алкенилсульфонильные группы являются наиболее предпочтительными.
Термин С6-С14арилсульфонил означает арилсульфонильную группу, арильная группа в которой содержит 6-14 атомов углерода и имеет значение, определенное ранее. Более предпочтительными являются C6-C10арилсульфонильные группы, фенилсульфонильные группы являются наиболее предпочтительными.
Термин С1-С8алкилкарбонилокси означает алкилкарбонилокси группу, алкильная группа в которой содержит 1-8 атомов углерода и имеет значение, определенное ранее. Более предпочтительными являются C1-C6алкилкарбонилокси группы. Более предпочтительными являются C1-C4алкилкарбонилокси группы.
Термин С6-С14арилкарбонилокси означает арилкарбонилокси группу, арильная группа в которой содержит 6-14 атомов углерода и имеет значение, определенное ранее. Более предпочтительными являются C6-C10арилкарбонилокси группы, фенилкарбонилокси группы являются наиболее предпочтительными.
Термин С1-С8(ди)алкиламинокарбонил означает (ди)алкиламинокарбонильную группу, алкильная группа в которой содержит 1-8 атомов углерода и имеет значение, определенное ранее. Более предпочтительными являются C1-C6(ди)алкиламинокарбонильные группы, C1-C4(ди)алкиламинокарбонильные группы являются наиболее предпочтительными.
Термин С6-С14(ди)ариламинокарбонил означает (ди)ариламинокарбонильную группу, арильная группа в которой содержит 6-14 атомов углерода и имеет значение, определенное ранее. Более предпочтительными являются C6-C10(ди)ариламинокарбонильные группы, (ди)фениламинокарбонильные группы являются наиболее предпочтительными.
Термин С1-С8 (ди)алкиламиносульфонил означает (ди)алкиламиносульфонильную группу, алкильная группа в которой содержит 1-8 атомов углерода и имеет значение, определенное ранее. Более предпочтительными являются C1-C6(ди)алкил-аминосульфонильные группы, C1-C4(ди)алкиламиносульфонильные группы являются наиболее предпочтительными.
Термин С6-С14(ди)ариламиносульфонил означает (ди)ариламиносульфонильную группу, арильная группа в которой содержит 6-14 атомов углерода и имеет значение, определенное ранее. Более предпочтительными являются C6-C10(ди)ариламиносульфонильные группы, (ди)фениламиносульфонильные группы являются наиболее предпочтительными.
Термин С1-С8алкилкарбониламино означает алкилкарбониламино группу, алкильная группа в которой содержит 1-8 атомов углерода и имеет значение, определенное ранее. Более предпочтительными являются C1-C6алкилкарбониламино группы, C1-C4алкилкарбониламино группы являются наиболее предпочтительными.
Термин С6-С14арилкарбониламино означает арилкарбониламино группу, арильная группа в которой содержит 6-14 атомов углерода и имеет значение, определенное ранее. Более предпочтительными являются C6-C10арилкарбониламино группы, фенилкарбониламино группы являются наиболее предпочтительными.
Термин C2-C7гетероциклоалкилокси означает гетероциклоалкильную группу, содержащую 2-7 атомов углерода, как определено ранее, присоединенную к атому кислорода. Наиболее предпочтительными являются C2-C5гетероциклоалкилокси группы.
Термин С3-С8циклоалкилокси означает циклоалкильную группу, содержащую 3-8 атомов углерода, как определено ранее, присоединенную к атому кислорода.
Термин С6-С14арилокси означает арильную группу, содержащую 6-14 атомов углерода, как определено ранее, присоединенную к атому кислорода. Более предпочтительными являются C6-C10арилокси группы, феноксигруппы являются наиболее предпочтительными. С4-С13Гетероарилокси группы являются аналогами С6-С14арилокси группы, включающими по крайней мере один гетероатом, выбранный из N, O и S в гетероарильном кольце. Более предпочтительными являются С4-С9гетероарилокси группы.
Было показано, что соединения указанной выше формулы I способны связываться с LH рецептором и проявляют агонистическую активность в отношении LH.
Изобретение дополнительно относится к фармацевтической композиции, включающей бициклическое гетероароматическое производное или его соли, имеющие общую формулу I.
Таким образом, соединения согласно изобретению могут использоваться в терапии. Дополнительный аспект изобретения относится к применению бициклического гетероароматического соединения, имеющего общую формулу I для получения лекарственного средства для регулирования фертильности. Предпочтительно настоящие соединения используют для активации LH-рецептора.
Бициклические гетероароматические производные по данному изобретению могут иметь один или несколько хиральных атомов углерода. Следовательно, соединения могут быть получены в виде хирально чистых соединений или в виде смеси диастереоизомеров и/или энантиомеров. Способы получения хирально чистых соединений хорошо известны в данной области, например, кристаллизация или хроматография.
Для терапевтического применения соли соединений формулы I являются такими солями, где противоион является фармацевтически приемлемым. Однако также могут найти применение, например, при получении или очистке фармацевтически приемлемого соединения, кислотно-аддитивные соли оснований соединений формулы I. Все соли, являются они фармацевтически приемлемыми или не являются, включены в объем настоящего изобретения.
Примеры кислотно-аддитивных солей включают соли, полученные из минеральных кислот, таких как хлористоводородная кислота, фосфорная кислота, серная кислота, предпочтительно, полученные из хлористоводородной кислоты, и органических кислот, таких как лимонная кислота, винная кислота, уксусная кислота, молочная кислота, малеиновая кислота, малоновая кислота, фумаровая кислота, гликолевая кислота, янтарная кислота и подобные.
Подходящие пути введения соединений формулы I или их фармацевтически приемлемых солей, также упоминаемых в настоящем описании в качестве активного ингредиента, представляют собой внутримышечные инъекции, подкожные инъекции, внутривенные инъекции или внутрибрюшинные инъекции, пероральное или внутриназальное введение. Предпочтительно, соединения можно вводить перорально. Точная доза и режим введения активного ингредиента или его фармацевтической композиции определенным образом будут зависеть от желаемого терапевтического действия (лечение бесплодия, контрацепция) и могут изменяться в зависимости от конкретного соединения, способа введения, возраста и состояния индивидуального субъекта, которому вводится лекарственное средство.
В общем, при парентеральном введении требуются более низкие дозы, чем для других способов введения, которые в большей мере зависят от адсорбции. Однако доза для людей предпочтительно составляет 0,0001-25 мг на кг веса тела. Желаемая доза может быть представлена в виде единичной дозы или в виде множества разделенных доз, вводимых с подходящими интервалами в течение дня, или, в случае реципиентов женского пола, в виде доз для введения с подходящими дневными интервалами в течение менструального цикла. Доза, а также режим введения могут различаться для реципиента женского и мужского пола.
В случае in vitro или ex vivo применений, таких как IVF применения, соединения по изобретению должны использоваться в инкубационной среде в концентрации приблизительно 0,01-5 мкг/мл.
Таким образом, настоящее изобретение также относится к фармацевтическим композициям, включающим бициклическое гетероароматическое соединение формулы (I) в смеси с фармацевтически приемлемыми вспомогательными добавками и, необязательно, с другими терапевтическими агентами. Вспомогательные добавки должны быть «приемлемыми» в смысле совместимости с другими ингредиентами композиции и неопасными для реципиентов.
Фармацевтические композиции включают те, которые являются подходящими для перорального, ректального, назального, местного (включая чрескожное, буккальное и сублингвальное), вагинального или парентерального (включая подкожное, внутримышечное, внутривенное и внутрикожное) введения. Композиции могут быть получены любым способом, хорошо известным в области фармацевтики, например, с использованием способов, описанных в Gennaro et al., Remington's Pharmaceutical Science (18th ed., Mark Publishing company, 1990, смотри, в особенности, часть 8: Pharmaceutical Preparations and Their Manufacture (Фармацевтические препараты и их получение).
Такие способы включают стадию приведения в контакт активного ингредиента с любым вспомогательным агентом. Вспомогательный агент(ы), также именуемый добавочным ингредиентом, включает общепринятые в данной области (Gennaro, выше), такие как наполнители, связующие вещества, разбавители, разрыхляющие агенты, смазывающие вещества, красители, вкусовые агенты и смачивающие агенты.
Фармацевтические композиции, подходящие для перорально введения могут быть представлены в виде отдельных стандартных препаративных форм, таких как пилюли, таблетки или капсулы, или в виде порошков или гранул, или в виде раствора или суспензии. Активный ингредиент также может быть представлен в виде болюса или пасты. Композиции дополнительно могут быть переработаны в суппозитории или клизмы для ректального введения.
Для парентерального ведения подходящие композиции включают водные и неводные стерильные инъекции. Композиции могут быть представлены в виде контейнера с единичной дозой или многократной дозой, например, запаянные пробирки или ампулы и могут храниться в высушенном вымораживанием состоянии, требующем только добавления стерильного жидкого носителя, например воды, перед употреблением.
Композиции или составы, подходящие для введения посредством назальной ингаляции, включают тонкодисперсные дусты или туманы, которые могут генерироваться с помощью аэрозолей, распылителей и аппаратов для вдувания.
Бициклические гетероароматические производные по изобретению также могут вводиться в форму имплантируемых фармацевтических устройств, состоящих из ядра активного вещества, заключенного в мембрану, контролирующую скорость высвобождения. Такие имплантаты могут применяться подкожно или местно, и они будут высвобождать активный ингредиент с приблизительно постоянной скоростью в течение относительно большого промежутка времени, например, от недель до лет. Способы получения имплантируемых фармацевтических устройств, как таковых, известны в данной области, например, описаны в Европейском патенте 0303306 (AKZO N.V.).
Таким образом, соединения согласно настоящему изобретению могут использоваться в тех же клинических целях, что и природный LH, с тем преимуществом, что они обладают измененными свойствами стабильности и могут вводиться по-иному.
Соединения настоящего изобретения, где В=NH, представленные формулой (I-a) обычно могут быть получены в соответствии с известной в данной области конденсацией кислоты формулы (II) с амином формулы (III).
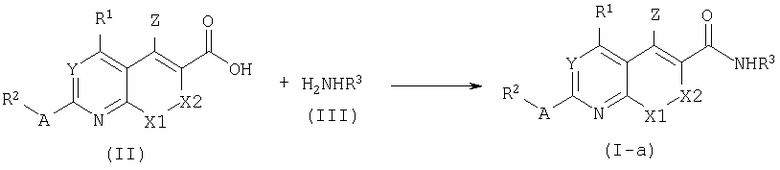
Вышеуказанную реакцию проводят при комнатной температуре в подходящем растворителе, например, в апротонном растворителе, таком как N,N-диметилформамид (ДМФ) или дихлорметан с использованием конденсирующего реагента, такого как тетрафторборат О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (TBTU) или гексафторфосфат бромтрипирродидинофосфония (PyBrOP) и основания - третичного амина, например, N,N-диизопропилэтиламина (DiPEA).
Также соединения формулы (I), где В=О, представленные формулой (I-b), могут быть получены таким же образом, как описано выше для соединений формулы (I-a), исходя из кислот общей структуры (II) и спиртов формулы (IV).
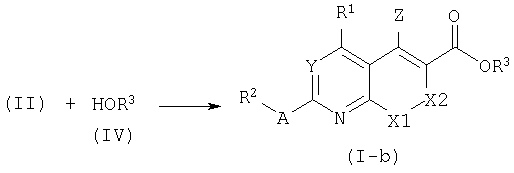
Соединения формулы (I), где В является связью, представленные формулой (I-c), могут быть получены взаимодействием подходящего металлоорганического реагента с производными формулы (V) в апротонном растворителе, таком как ТГФ. Родственные реакции замещения могут быть найдены в литературе: S.V.Frye, M.C.Johnson, N.L.Valvano, J.Org.Chem. 56:3750, 1991. Амиды Вайнреба (Weinreb) формулы (V) могут быть синтезированы из кислот формулы (II) и N-метокси-N-метиламина с использованием условий, описанных для получения амидов формулы (I-a).
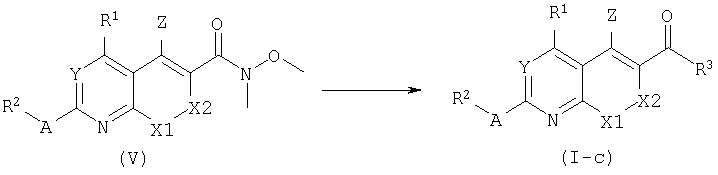
Подходящим способом для получения промежуточных кислот (II) является известное в данной области омыление в основной среде этиловых сложных эфиров общей структуры (VI). Омыление происходит в присутствии основания, такого как гидроксид лития. Гидроксид калия или гидроксид натрия в водном диоксане при повышенной температуре (от 40° до температуры кипения) с последующей обработкой кислотой.
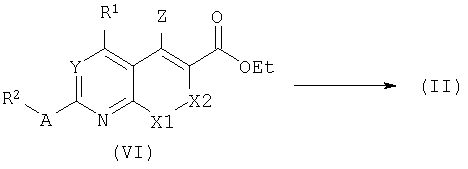
Бициклические лактамы формулы (VII) являются полезными исходными веществами для получения соответствующих иминов (VIII). В типичном эксперименте, лактам превращают в соответствующий хлоримин с использованием фосфорилхлорида при повышенной температуре (от 60° до температуры кипения) в подходящем растворителе, таком как 1,4-диоксан. При обработке восстановителем, таким как водород в присутствии подходящего катализатора в этаноле, может быть выделен целевой имин общей формулы (VIII). Родственное восстановление было описано в литературе, смотри, например: E.Bisagni, C.Landras, S.Thirot and C.Huel, Tetrahedron 52: 10427, 1996.
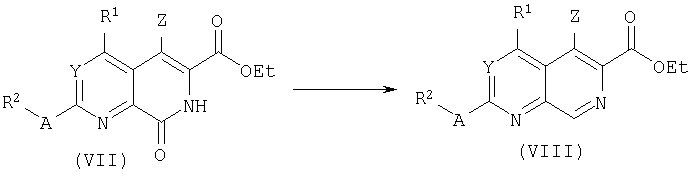
Бициклические лактамы общей структуры (VII) могут быть получены конденсацией кислот типа (IX) с диэтиламиномалонатом при действии конденсирующего агента, такого как TBTU/DiPEA и циклизацией промежуточных амидов в этаноле в основных условиях. Ароматизация с сопутствующим деэтоксикарбонилированием затем дает бициклы типа (VII). В альтернативном способе этиловый эфир глицина может быть использован вместо диэтиламиномалоната. Смотри, например, M.Blanco, M.G.Lorenzo, I.Perillo, C.B.Schapira, J.Heterocycl.Chem., 33:361, 1996. Циклизация промежуточных амидов также может быть выполнена под действием хлорида олова(IV). О применении хлорида олова(IV) для осуществления замыкания кольца цикла в родственных системах сообщалось: A.C.Veronese, R.Callegari, C.F.Morelli, Tetrahedron 51:12277, 1995.
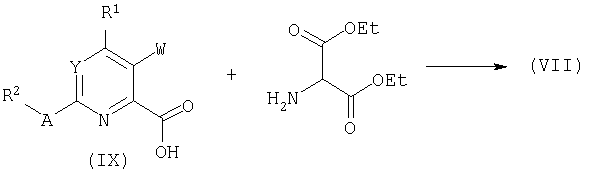
Обработка кислоты формулы (IX) этилбромацетатом в апротонном растворителе при действии не-нуклеофильного основания, такого как карбонат калия или трет-бутоксид калия может дать ароматический лактон общей структуры (Х). Родственные структуры были описаны в литературе: C.Bhakta, Indian J.Chem.Sect.B. 25:180, 1986.
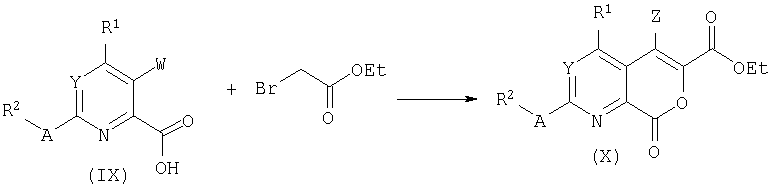
Обработка винильных производных формулы (XI) диэтилмалонатом в основных условиях дает возможность сопряженного присоединения. Промежуточный аддукт может циклизоваться в бициклы формулы (XII) посредством реакции под действием хлорида олова (IV) и последующей обработки.
Альтернативно трет-бутилэтилмалонат может быть использован в таком способе вместо диэтилмалоната.
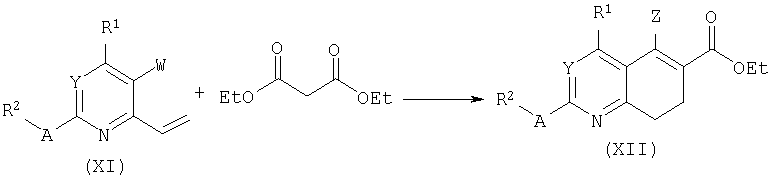
При обработке подходящим окислителем, таким как DDQ, или палладиевым катализатором при повышенной температуре в подходящем растворителе, таком как ксилол, ароматизация производных формулы (XII) приводит к хиназолинам или хинолинам общей формулы (XIII). Смотри также: K.Kobayashi, T.Uneda, K.Takada, T.Kitamura, O.Morikawa, H.Konishi, J.Org.Chem.62:664, 1997.
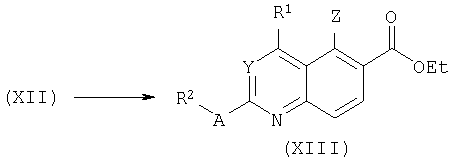
При другом подходе метилпири(ми)дины общей формулы (XIV) депротонируют по метильной группе под действием сильного основания, такого как гексаметилдисилазан лития (LiHMDS) или диизопропиламид лития (LDA), в подходящем апротонном растворителе, таком как ТГФ при низкой температуре (-78°С). Анион затем взаимодействует с этил 3-этоксиакрилатом. После сопряженного присоединения происходит циклизация в хинолины или хиназолины общей формулы (XIII), как описано K.Kobayashi, K.Takada, H.Tanaka, T.Uneda, T.Kitamura, Chem.Lett.:25, 1996; K.Kobayashi, T.Uneda, K.Takada, H.Tanaka, T.Kitamura, O.Morikawa, H.Konishi, J.Org.Chem.62:664, 1997.
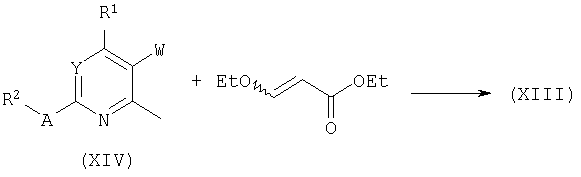
Обработка хлоридов общей формулы (XV) этиловым эфиром (N-алкил)-бета-аланина (XVI) в основных условиях дает бициклы общей формулы (XVII). Родственные превращения были описаны: P.Y.Boamah, N.Haider, G.Heinisch, Arch.Pharm. (Weinheim) 323:207, 1990.
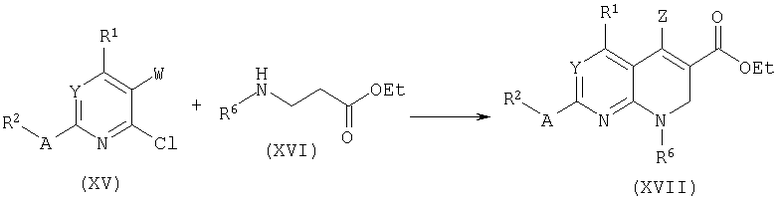
Соединения формулы (XVII), где R6=H могут быть окислены до производных формулы (XVIII) с использованием палладия на активированном угле при повышенной температуре. Смотри, например, M.Onda, K.Kawakami, Chem.Pharm.Bull. 20:1484, 1972. Соединения формулы (XVII), где R6=Н или алкил, могут быть преобразованы в имины формулы (XVIII) с использованием DDQ, как описано: H.Ishii, Chem.Pharm.Bull. 26:864, 1978; J.I.DeGraw, P.H.Christie, W.T.Colwell, F.M.Sirotnak, J.Med.Chem., 35:320, 1992.
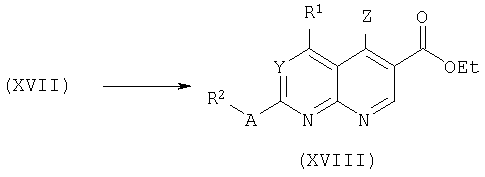
Альтернативно, имины формулы (XVIII) могут быть получены из соответствующих лактамов формулы (XIX) аналогичным образом (смотри выше) в виде их региостереоизомерных аналогов формулы (VIII), например, преобразование в хлоримин с использованием POCl3 и последующее дегалогенирование с использованием водорода и подходящего катализатора.
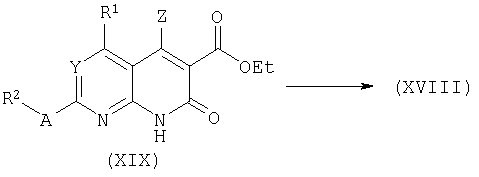
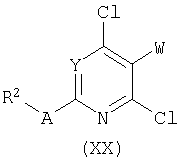
Лактам формулы (XIX) может быть получен ацилированием аминопири(ми)дина формулы (ХХ) хлорэтилмалонатом в присутствии подходящего основания. Последующее замыкание кольца в промежуточном ациклическом малонамиде под действием основания (этоксид натрия в этаноле) или хлорида олова(IV) затем приводит к бициклическому лактаму типа (XIX). Аналогичные превращения были описаны в литературе. Смотри, например, A.C.Veronese, R.Callegari, C.F.Morelli, Tetrahedron 51:12277, 1995; W.Stadlbauer, S.Prattes, W.Fiala, J.Heterocycl.Chem.35:627, 1998.
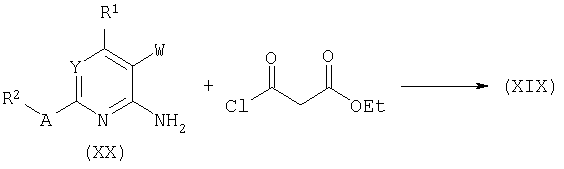
В зависимости от системы замещения аминопири(ми)динов формулы (ХХ), лактамы формулы (XIX) могут быть получены конденсацией диэтилмалоната под действием хлорида олова (IV) с последующей циклизацией при высокой температуре в подходящем растворителе (например, 240°С в дифениловом эфире).
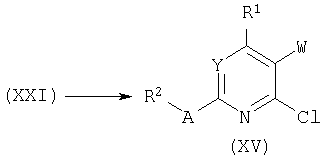
Аналогичным образом лактоны типа (XXII) могут быть получены О-ацилированием лактамов формулы (XXI) хлорэтилмалонатом и последующей циклизацией.
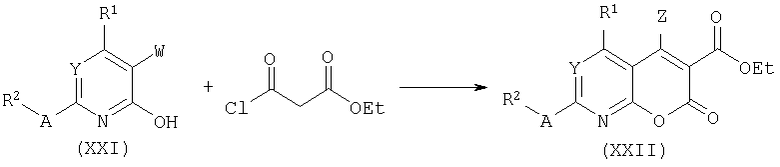
Фуропири(ми)дины общей формулы (XXIII) получают селективным О-алкилированием лактамов типа (XXI) с использованием карбоната калия в ацетоне и последующим замыканием цикла под действием этоксида натрия в этаноле.
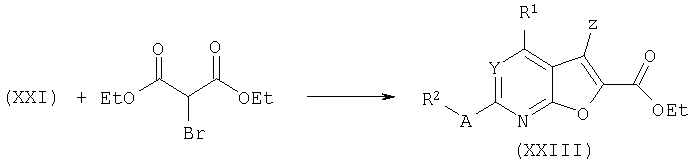
Тиенопири(ми)дины общей формулы (XXIV) получают обработкой хлоридов (XVI) этилмеркаптоацетатом под действием сильного основания. В типичном эксперименте один эквивалент хлорида (XV) подвергают взаимодействию с 1,5 эквивалентами этилмеркаптоацетата и 2 эквивалентами трет-бутоксида калия в ТГФ. При таких условиях ациклический сульфид подвергается самопроизвольной циклизации с образованием тиенопири(ми)дина общей формулы (XXIV). Если R1 представляет собой (гетеро)арил, замещенный электроотрицательной группой, такой как нитрогруппа, вышеуказанную циклизацию осуществляют в две стадии, включая выделение промежуточного тиоэфира с последующей обработкой третичным основанием, таким как DIPEA в толуоле/EtOH при температуре кипения, для осуществления образования кольца.
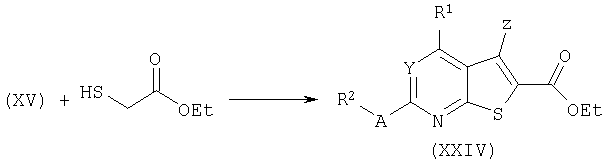
Пири(ми)динкарбоксилаты общей формулы (IX) получают омылением алкоксикарбонилпири(ми)динов формулы (XXV) с использованием сильного основания, такого как гидроксид лития или гидроксид калия в смеси воды и органического сорастворителя, такого как 1,4-диоксан или метанол при повышенной температуре (от 40°С до температуры кипения) с последующей обработкой кислотой. Если W=CO2алкил, R7 предпочтительно представляет собой бензил, чтобы дать возможность селективного гидрирования сложноэфирной бензильной функции таким образом, чтобы заместитель W оставался незатронутым.
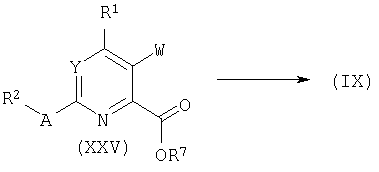
Соединения формулы (XXV) могут быть получены палладий-катализируемым алкоксикарбонилированием хлоридов (XV) в присутствии монооксида углерода и подходящего спирта (R7OH, XXVI). Подобные превращения описаны в литературе, смотри, например: Y.Bessard, R.Crettaz, Heterocycles 51:2589, 1999.
Палладий-катализируемые реакции хлоридов (XV) с винилтрибутилоловом или тетравинилоловом дают винилпири(ми)дины общей структуры (XI). Такой тип преобразований широко описан в литературе, смотри, например: L.L.Gundersen, A.K.Bakkestuen, A.J.Aasen, H.Oeveras, F.Rise, Tetrahedron 50:9743, 1994; F.Guillier, F.Nivoliers, A.Godard, F.Marsais, G.Queguiner, J.Heterocycl.Chem., 36:1157, 1999.
В зависимости от структуры замещения хлоридов общей формулы (XV) винилпири(ми)дины общей формулы (XI) также могут быть получены замещением хлорида метилентрифенилфосфином с последующим взаимодействием с (пара)формальдегидом.
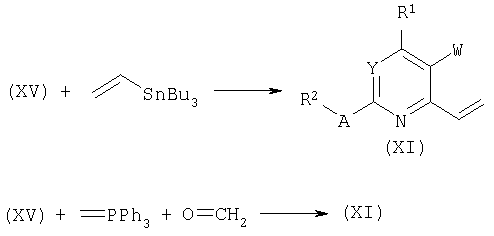
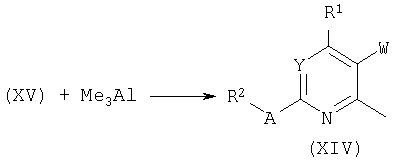
Аналогично, обработка хлоридов общей формулы (XV) триметилалюминием в присутствии палладиевого катализатора в апротонном растворителе, таком как ТГФ, дает метилпири(ми)дины общей формулы (XIV). Родственные синтезы были опубликованы в: Q.Lu, I.Mangalagiu, T.Benneche and K.Undheim, Acta Chem.Sc. 51:302, 1997.
Соединения формулы (XXI), где Y=N, представленные формулой (XXI-a), могут быть получены с помощью нескольких способов, основанных на литературных данных.
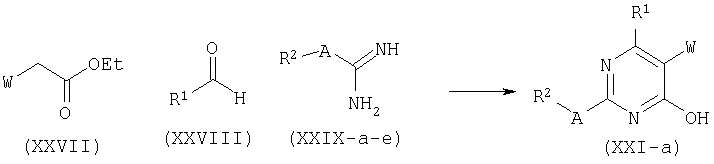
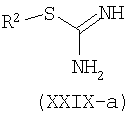
Например, производные формулы (XXI-a), где R1=С6-С14арил или С4-С13гетероарил, могут быть синтезированы конденсацией этиловых сложных эфиров (XXVII), где W является таким, как определено ранее, с альдегидами (XXVIII) и соединениями (XXIX), которые могут представлять собой изотиомочевину (XXIX-a), изомочевину (XXIX-b), монозамещенные гуанидины (XXIX-c), дизамещенные гуанидины (XXIX-d) или амидины (XXIX-e).
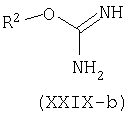
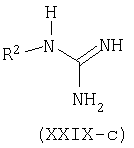
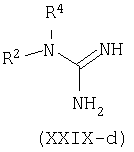
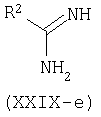
В типичном эксперименте компоненты (XXVII), (XXVIII) и (XXIXa-e) суспендируют в подходящем растворителе, например, этаноле, метаноле, N,N-диметилформамиде, N-метилпирролидиноне, тетрагидрофуране или пиридине и добавляют основание, такое как карбонат калия, ацетат натрия, метоксид натрия или этоксид натрия. Взаимодействие происходит при повышенной температуре (от 70°С до температуры кипения). Смотри, например: S.Kambe, K.Saito and H.Kishi, Synthesis: 287, 1979; A.M.Abd-Elfattah, S.M.Hussain and A.M.El-Reedy, Tetrahedron 39: 3197, 1983; S.M.Hussain, A.A.El-Barbary and S.A.Mansour, J.Heterocycl.Chem., 22:169, 1985. В случае W=C(O)OEt, ароматизация происходит при добавлении окислителя, такого как DDQ или кислород. Родственные циклизации также могут быть осуществлены на твердой подложке, такой как смола Меррифилда (Merrifield) с использованием подходящего линкера, смотри, например, A.L.Mrzinzik and E.R.Felder, J.Org.Chem. 63:723, 1998; T.Masquelin, D.Sprenger, R.Baer, F.Gerber and Y.Mercadal, Helv.Chim.Acta 81:646, 1998.
Соединения общей формулы (ХХ), где Y=N, представленные формулой (ХХ-а) могут быть получены тем же путем конденсации с использованием малонитрила.
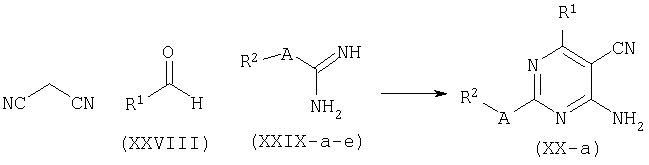
Альтернативно, соединения общей формулы (ХХ) получают аммонолизом хлоридов формулы (XV) с использованием водного аммиака и подходящего органического сорастворителя, такого как 1,4-диоксан. Такое превращение также может быть выполнено с помощью хлорида аммония и основания - третичного амина, такого как DiPEA, в апротонном растворителе, таком как ДМФ.
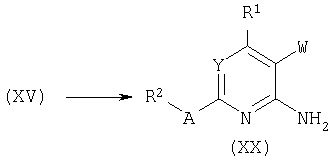
Хлориды общей формулы (XV) могут быть синтезированы известной в данной области реакцией лактамов (XXI) с POCl3 в подходящем растворителе, таком как 1,4-диоксан, при повышенной температуре (от 60°С до температуры кипения).
Производные формулы (XV), где Y=N и R1 не является С6-С14арилом или С4-С13гетероарилом, могут быть получены монозамещением Cl в производных формулы (ХХХ) различными нуклеофилами. Родственные реакции замещения можно найти в литературе, например, S.Kohra, Y.Tominaga and A.Hosomi, J.Heterocycl.Chem. 25:959, 1988; A.A.Santilli, D.H.Kim and S.V.Wanser, J.Heterocycl Chem.8:445, 1971; J.Clark, M.S.Shannet, D.Korakas and G.Varvounis, J.Heterocycl. Chem. 30:1065, 1993; S.Tumkevicius, Liebigs Ann.Org.Bioorg.Chem. 9:1703, 1995.
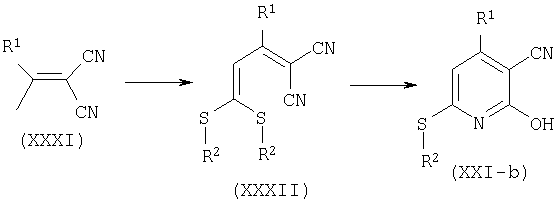
Пиридины общей формулы (XXI), где Y=CH, A=S и W=CN, представленные формулой (XXI-b), получают последовательным алкилированием α,β-ненасыщенных динитрилов общей структуры (XXXI) дисульфидом углерода и иодистым алкилом R2-I, с образованием соединения общей формулы (XXXII), как описано P.Milart, Tetrahedron 54:15643-15656, 1998. Циклизация соединений формулы (XXXII) в кислотных условиях, как описано K.Peseke, Z.Chem. 29:442-443 (1989), дает пиридины общей формулы (XXI-b).
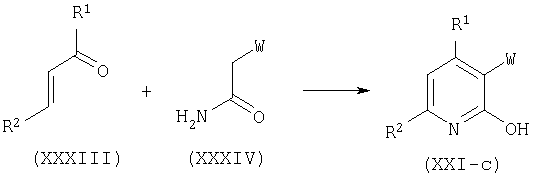
Соединения общей формулы (XXI), где А представляет связь, Y=CH и W является таким, как определено ранее, представленные формулой (XXI-c) могут быть получены взаимодействием α,β-ненасыщенных кетонов общей формулы (XXXIII) с амидами общей формулы (XXXIV), где W является таким, как определено ранее, с использованием сильного основания, такого как трет-бутоксид калия, в присутствии кислорода в подходящем растворителе, таком как диметилсульфоксид. Родственные циклизации описаны в R.Jain, F.Roschangar, M.A.Ciufolini, Tetrahedron Lett. 36:3307, 1995.
Способы определения рецепторного связывания, а также in vitro и in vivo анализы для определения биологической активности гонадотропинов хорошо известны. В общем, экспрессированный рецептор приводят в контакт с исследуемым соединением и измеряют связывание или стимуляцию или ингибирование функциональной ответной реакции.
Для измерения функциональной ответной реакции выделенную ДНК, кодирующую LH рецепторный ген, предпочтительно рецептор человека, экспрессируют в подходящие клетки-хозяева. Такой клеткой может быть клетка яичника китайского хомячка, но другие клетки также являются подходящими. Предпочтительно клетки имеют происхождение от млекопитающих (Jia et al., Mol.Endocrin., 5:759-776, 1991).
Способы создания рекомбинантных LH экспрессирующих клеточных линий хорошо известны в данной области (Sambrook et al., Molecular Cloning: a Laboratory Manual, Cold Spring Harbor laboratory Press, Cold Spring Harbor, последнее издание). Экспрессирования рецептора достигают с использованием экспрессии ДНК кодирующей желаемый белок. Методики сайт-направленного мутагенеза, лигирования дополнительных последовательностей, ПЦР и конструирования подходящих систем экспрессии все, к настоящему времени, хорошо известны в данной области. Части или все ДНК, кодирующие желаемый белок, могут быть сконструированы синтетически с использованием стандартных твердофазных способов, предпочтительно для включения сайтов рестрикции для легкости лигирования. Подходящие контрольные элементы для транскрипции и трансляции включенной кодирующей последовательности могут обеспечиваться для ДНК кодирующих последовательностей. Как хорошо известно, в настоящее время являются доступными системы экспрессии, которые совместимы с большим множеством хозяев, включая прокариотических хозяев, таких как бактерии, и эукариотических хозяев, таких как дрожжи, растительные клетки, клетки насекомых, клетки млекопитающих, клетки птиц и подобные.
Клетки, экспрессирующие рецептор, затем вводят в контакт с исследуемым соединением для наблюдения связывания, или стимуляции или ингибирования функциональной ответной реакции.
Альтернативно, для связывания соединения можно использовать выделенные клеточные мембраны, содержащие экспрессированный рецептор.
Для измерения связывания можно использовать радиоактивно или флуоресцентно меченные соединения. В качестве ссылочного соединения можно использовать рекомбинантный LH человека. В качестве альтернативы также могут быть выполнены анализы конкурентного связывания.
Другой анализ включает отбор соединений - агонистов LH рецептора путем определения стимуляции рецептора, опосредованной цАМФ аккумулированием. Таким образом, такой способ включает экспрессию рецептора на клеточной поверхности клетки-хозяина и воздействие на клетку исследуемого соединения. Затем измеряют количество цАМФ. Уровень цАМФ будет снижаться или увеличиваться, в зависимости от ингибирующего или стимулирующего действия исследуемого соединения на связывание с рецептором.
В дополнение к непосредственному измерению, например уровней цАМФ в подвергаемой воздействию клетке, также можно использовать клеточные линии, которые в дополнение к трансфекции ДНК, кодирующей рецептор, также трансфектированы второй ДНК, кодирующей репортерный ген, экспрессия которого отвечает на уровень цАМФ. Такие репортерные гены могут быть цАМФ-индуцируемыми или могут быть сконструированы таким образом, что они связаны с новыми цАМФ-отвечающими элементами. Обычно, экспрессию репортерного гена можно контролировать посредством любого отвечающего элемента, реагирующего на изменение уровней цАМФ. Подходящими репортерными генами являются, например, LacZ, щелочная фосфатаза, люцифераза светлячка и зеленый флуоресцентный белок. Принципы таких трансактивирующих анализов хорошо известны в данной области и описаны, например, в Stratowa Ch., Himmler A. And Czernilofsky A.P. (1995) Curr.Opin.Biotechnol. 6:574.
Для выбора активных соединений тестирование при 10-5М должно приводить к активности более чем в 20%, когда LH используют в качестве сравнительного соединения. Другим критерием может быть значение ЕС50, которое должно быть <10-5M, предпочтительно <10-7M.
Квалифицированному специалисту будет очевидно, что требуемые значения ЕС50 зависят от исследуемого соединения. Например, соединение с ЕС50, которое меньше 10-5М, обычно рассматривается как кандидат для получения лекарственного средства. Предпочтительно данное значение ниже, чем 10-7М, более предпочтительно 10-8М. Однако соединение, которое имеет более высокие значения ЕС50, но является селективным в отношении определенного рецептора, даже может оказаться хорошим кандидатом.
Скрининг соединений - агонистов LH рецептора также может быть осуществлен с использованием биоанализа мышиных клеток Лейдига (Van Damme M., Robertsen D. And Diczfalusy E. (1974). Acta Endocrinol. 77:655-671; Mannaerts B., Kloosterboer H and Schuurs A. (1987). Neuroendocrinology of reproduction (Нейроэндокринология воспроизведения). R. Rolland et al. Eds., Elsevier Science Publishers B.V., 49-58). В данном анализе опосредованное стимулированием LH рецептора продуцирование тестостерона может быть измерено в клетках Лейдига, выделенных из самцов мышей.
Для измерения in vivo активности соединений - агонистов LH рецептора может быть исследована индукция овуляции у молодых мышей. В данном анализе молодым самкам мышей можно ввести FSH мочи и приблизительно через 48 часов обработать LH-агонистическим соединением. Животных убивают после обработки LH агонистом и число яйцеклеток в фаллопиевой трубе может быть оценено с помощью микроскопа.
Соединения настоящего изобретения могут применяться клинически в тех режимах, как в настоящий момент используют LH или hCG. Они включают LH замещение у субъектов с гипогонадным недоразвитием половой системы либо у мужчин, либо у женщин, введение в середине цикла для индуцирования овуляции (OI) или контролируемой гиперстимуляции (СОН) или стимуляции желтого тела.
Следующие примеры являются иллюстративными в данном изобретении, и их не следует интерпретировать как ограничивающие объем изобретения.
Примеры
Пример 1
Трет-бутил 5-амино-2-метилтио-4-(3-метоксикарбонилокси)фенил)тиено[2,3-d]пиримидин-6-карбоксамид
(a). 5-Циано-4-(3-метоксифенил)-2-метилтио-6-гидроксипиримидин
Смесь сульфата S-метилизотиомочевины (139 мг), 3-метоксибензальдегида (243 мкл), этил цианоацетата (112 мкл) и карбоната калия (145 мг) в абсолютном этаноле (2 мл) перемешивали при 60°C в течение 5 часов. Реакционную смесь охлаждали до 0°C на ледяной бане, фильтровали и остаток нагревали в воде (H2O) до получения прозрачного раствора. Раствор подкисляли 2 н. водн. HCl до pH 2 и охлаждали до 0°C на ледяной бане. Полученные кристаллы собирали фильтрованием и сушили в вакууме.
Выход: 186 мг
MS-ESI: [M+H]+=274,2
ТСХ: Rf=0,50, силикагель, дихлорметан (СН2Cl2)/метанол (СН3ОН)=9/1 (об/об)
(b). 6-Хлор-5-циано-4-(3-метоксифенил)-2-метилтиопиримидин
Оксихлорид фосфора (0,75 мл) добавляли к перемешиваемому раствору 5-циано-4-(3-метоксифенил)-2-метилтио-6-гидроксипиримидина (пример 1a, 305 мг) в сухом 1,4-диоксане (1 мл). Добавляли каплю N,N-диметиланилина. Через 3 часа при 80°C, смесь охлаждали до 0°C на ледяной бане и медленно добавляли дробленый лед. После прекращения экзотермической реакции добавляли Н2O (3 мл). Твердые вещества собирали фильтрованием и сушили в вакууме.
Выход: 244 мг
MS-ESI: [M+H]+=292,2
ТСХ: Rf=0,86, силикагель, CH2Cl2
(c). Этил 5-амино-4-(3-метоксифенил)-2-метилтио-тиено[2,3-d]пиримидин-6-карбоксилат
Трет-бутоксид калия (150 мг) добавляли к перемешиваемому раствору этил 2-меркаптоацетата (92 мкл) и 6-хлор-5-циано-4-(3-метоксифенил)-2-метилтиопиримидина (пример 1b, 244 мг) в сухом тетрагидрофуране (ТГФ) (4 мл). Через 1 час смесь охлаждали до 0°C на ледяной бане, разбавляли Н2O (10 мл). Твердые вещества собирали фильтрованием и сушили в вакууме.
Выход: 260 мг
MS-ESI: [M+H]+=376,2
ТСХ: Rf=0,44, силикагель, CH2Cl2
(d). 5-Амино-4-(3-метоксифенил)-2-метилтио-тиено[2,3-d]пиримидин-6-карбоновая кислота
Этил 5-амино-4-(3-метоксифенил)-2-метилтио-тиено[2,3-d]пиримидин-6-карбоксилат (пример 1c, 9,27 г) растворяли в смеси 1,4-диоксана (270 мл) и H2O (30 мл). Добавляли гидроксид лития (10 г) и смесь перемешивали при 80°C в течение 48 часов. 1,4-Диоксан удаляли из смеси выпариванием и остаток помещали в H2O. Оставшийся раствор подкисляли до pH 2 добавлением 3 н. водн. HCl. Полученный осадок отфильтровывали и промывали H2O. Следы воды в осадке удаляли совместным выпариванием с 1,4-диоксаном и затем с диэтиловым эфиром и сушили в вакууме при 50°C в течение ночи.
Выход: 8,45 г
MS-ESI: [M+H]+=348,0
ТСХ: Rf=0,2, силикагель, CH2Cl2/CH3OH=9/1 (об/об)
(e). Трет-бутил 5-амино-2-метилтио-4-(3-метоксифенил)-тиено[2,3-d]пиримидин-6-карбоксамид
5-Амино-4-(3-метоксифенил)-2-метилтио-тиено[2,3-d]пиримидин-6-карбоновую кислоту (пример 1d, 7,0 г) растворяли в сухом CH2Cl2 (100 мл). Добавляли тетрафторборат бензотриазол-1-ил-N,N,N,N'-тетраметилурония (TBTU) (8,0 г), N,N-диизопропилэтиламин (DIPEA) (6,6 мл) и трет-бутиламин (4,0 мл) и смесь перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь промывали 5% водн. NaHCO3 (2×100 мл) и 1 M водн. HCl (2×100 мл). Органический слой сушили (MgSO4) и концентрировали в вакууме. Указанное в заголовке соединение очищали хроматографией на силикагеле с использованием смеси с гептаном (гепт)/этилацетат (EtOAc)=1/0 до 3/2 (об/об) в качестве элюента.
Выход: 6,5 г
MS-ESI: [M+H]+=403,0
ВЭЖХ: Rt=33,56 мин, колонка 3 мкм Luna C-18(2) 100×2,0 мм, поток 0,25 мл/мин, температура печи 40°C, детектирование 210 нм + 254 нм, элюент H2O/ацетонитрил (CH3CN)/CH3OH=70/28,5/1,5 до 0/95/5 (об/об) в течение 50 минут.
(f). Трет-бутил 5-амино-2-метилтио-4-(3-гидроксифенил)-тиено[2,3-d]пиримидин-6-карбоксамид
Трет-бутил 5-амино-2-метилтио-4-(3-метоксифенил)тиено[2,3-d]пиримидин-6-карбоксамид (пример 1e, 1,8 г) растворяли в сухом СН2Cl2 (30 мл) и полученный раствор охлаждали до 0°C. Добавляли по каплям раствор трибромида бора (1,28 мл) в сухом CH2Cl2 (30 мл) и смесь перемешивали в течение ночи при комнатной температуре. К реакционной смеси добавляли по каплям насыщенный водн. NaHCO3 до прекращения экзотермической реакции. После этого CH2Cl2 удаляли из смеси выпариванием и добавляли большое количество EtOAc. Органический слой промывали насыщенным водн. NaHCO3, сушили (MgSO4) и концентрировали в вакууме.
Выход: 1,3 г
MS-ESI: [M+Н]+=389,2
ВЭЖХ: Rt=17,44 мин, колонка Luna C-18 (смотри пример 1e), элюент H2O/CH3CN/CH3OH = 90/9,5/0,5 до 0/95/5 (об/об) в течение 50 минут.
(g). Трет-бутил 5-амино-2-метилтио-4-(3-(метоксикарбонилокси)фенил)тиено[2,3-d]пиримидин-6-карбоксамид
Трет-бутил 5-амино-2-метилтио-4-(3-гидроксифенил)-тиено[2,3-d]пиримидин-6-карбоксамид (пример 1f, 100 мг) растворяли в сухом СН2Cl2 (5 мл). Добавляли DBPEA (500 мкл) и метил хлорформиат (199 мкл) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь промывали Н2О. Органический слой сушили (MgSO4) и концентрировали при пониженном давлении. Указанное в заголовке соединение очищали с помощью ВЭЖХ с использованием колонки Luna C-18 с использованием следующего градиента: CH3CN/H2O=10/90 до 90/10 (об/об) в течение 30 минут. Указанное в заголовке соединение затем лиофилизовали из смеси 1,4-диоксана и Н2О.
Выход: 93 мг
MS-ESI: [M+H]+=447,4
ВЭЖХ: Rt=17,56 мин, колонка Luna C-18 (смотри пример 1e), элюент H2O/CH3CN=40/60 до 0/100 (об/об) в течение 25 минут.
Пример 2
Трет-бутил 5-амино-2-метилтио-4-(3-(аллилоксикарбонилокси)фенил)-тиено[2,3-d]пиримидин-6-карбоксамид
Взаимодействие трет-бутил 5-амино-2-метилтио-4-(3-гидроксифенил)-тиено[2,3-d]пиримидин-6-карбоксамида (пример 1f, 100 мг) с аллилхлорформиатом (274 мкл) осуществляли в соответствии с методиками, описанными в примере 1g. Указанное в заголовке соединение очищали с помощью ВЭЖХ с использованием колонки Luna C-18 и следующего градиента: CH3CN/H2O=10/90 до 90/10 (об/об) в течение 30 минут. Указанное в заголовке соединение затем лиофилизовали из смеси 1,4-диоксана и H2O.
Выход: 102 мг
MS-ESI: [M+H]+=473,4
ВЭЖХ: Rt=19,82 мин, колонка Luna C-18 (смотри пример 1e), элюент H2O/CH3CN=40/60 до 0/100 (об/об) в течение 25 минут
Пример 3
Трет-бутил 5-амино-2-метилтио-4-(3-(бензиоксикарбонилокси)фенил)тиено[2,3-d]пиримидин-6-карбоксамид
Взаимодействие трет-бутил 5-амино-2-метилтио-4-(3-гидроксифенил)-тиено[2,3-d]пиримидин-6-карбоксамида (пример 1f, 100 мг) с бензилхлорформиатом (368 мкл) осуществляли в соответствии с методиками, описанными в примере 1g. Указанное в заголовке соединение очищали с помощью ВЭЖХ использованием колонки Luna C-18 и следующего градиента: CH3CN/H2O=10/90 до 90/10 (об/об) в течение 30 минут. Указанное в заголовке соединение затем лиофилизовали из смеси 1,4-диоксана и H2O.
Выход: 112 мг
MS-ESI: [M+H]+=523,2
ВЭЖХ: Rt=22,22 мин, колонка Luna C-18 (смотри пример 1e), элюент H2O/CH3CN=40/60 до 0/100 (об/об) в течение 25 минут
Пример 4
Трет-бутил 5-амино-2-метилтио-4-(3-(п-нитро-бензилоксикарбонилокси)фенил)-тиено[2,3-d]пиримидин-6-карбоксамид
Взаимодействие трет-бутил 5-амино-2-метилтио-4-(3-гидроксифенил)-тиено[2,3-d]пиримидин-6-карбоксамида (пример 1f, 100 мг) с п-нитробензилхлорформиатом (554 мг) осуществляли в соответствии с методиками, описанными в примере 1g. Указанное в заголовке соединение очищали с помощью ВЭЖХ с использованием колонки Luna C-18 и следующего градиента: CH3CN/H2O=10/90 до 90/10 (об/об) в течение 30 минут. Указанное в заголовке соединение затем лиофилизовали из смеси 1,4-диоксана и H2O.
Выход: 47 мг
MS-ESI: [M+H]+=568,4
ВЭЖХ: Rt=21,45 мин, колонка Luna C-18 (смотри пример 1e), элюент H2O/CH3CN = 40/60 до 0/100 (об/об) в течение 25 минут.
Пример 5
Трет-бутил 5-амино-2-метилтио-4-(3-(феноксикарбонилокси)фенил)тиено[2,3-d]пиримидин-6-карбоксамид
Взаимодействие трет-бутил 5-амино-2-метилтио-4-(3-гидроксифенил)-тиено[2,3-d]пиримидин-6-карбоксамида (пример 1f, 100 мг) с фенилхлорформиатом (324 мкл) осуществляли в соответствии с методиками, описанными в примере 1g. Указанное в заголовке соединение очищали с помощью ВЭЖХ использованием колонки Luna C-18 и следующего градиента: CH3CN/H2O=10/90 до 90/10 (об/об) в течение 30 минут. Указанное в заголовке соединение затем лиофилизовали из смеси 1,4-диоксана и H2O.
Выход: 89 мг
MS-ESI: [M+H]+=509,4
ВЭЖХ: Rt=21,12 мин, колонка Luna C-18 (смотри пример 1e), элюент H2O/CH3CN=40/60 до 0/100 (об/об) в течение 25 минут.
Пример 6
Трет-бутил 5-амино-2-метилтио-4-(3-(п-нитро-феноксикарбонилокси)фенил)тиено[2,3-d]пиримидин-6-карбоксамид
Взаимодействие трет-бутил 5-амино-2-метилтио-4-(3-гидроксифенил)тиено[2,3-d]пиримидин-6-карбоксамида (пример 1f, 400 мг) с п-нитрофенилхлорформиатом (207 мг) осуществляли в соответствии с методиками, описанными в примере 1g. Выпаривание растворителя при пониженном давлении давало неочищенное указанное в заголовке соединение.
Выход: 569 мг
MS-ESI: [M+H]+=554,6
ТСХ: Rf=0,5, силикагель, гептан/EtOAc=3/2 (об/об)
Пример 7
Трет-бутил 5-амино-2-метилтио-4-(3-((N,N-диэтиламино)карбонилокси)фенил)тиено[2,3-d]пиримидин-6-карбоксамид
Трет-бутил 5-амино-2-метилтио-4-(3-гидроксифенил)тиено[2,3-d]пиримидин-6-карбоксамид (пример 1f, 100 мг) растворяли в сухом CH2Cl2 (5 мл) и добавляли несколько капель N,N-диметилформамида (ДМФ). Добавляли диэтилкарбамоилхлорид (68 мг) и DIPEA (217 мкл) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь промывали H2O. Органический слой сушили (MgSO4) и концентрировали при пониженном давлении. Указанное в заголовке соединение очищали с помощью ВЭЖХ с использованием колонки Luna C-18 и следующего градиента: СН3CN/Н2О=10/90 до 90/10 (об/об) в течение 30 минут. Указанное в заголовке соединение затем лиофилизовали из смеси 1,4-диоксана и H2O.
Выход: 75 мг
MS-ESI: [M+H]+=488,4
ТСХ: Rf=0,6, силикагель, гептан/EtOAc=1/1 (об/об)
Пример 8
Трет-бутил 5-амино-2-метилтио-4-(3-(1,2,3,6-тетрагидропиридинокарбонилокси)фенил)тиено[2,3-d]пиримидин-6-карбокамид
Трет-бутил 5-амино-2-метилтио-4-(3-(п-нитро-феноксикарбонилокси)фенил)тиено[2,3-d]пиримидин-6-карбоксамид (пример 6, 142 мг) растворяли в CH2Cl2. Добавляли 1,2,3,6-тетрагидропиридин (117 мкл) и DIPEA (224 мкл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли CH2Cl2 и промывали Н2O. Органический слой концентрировали при пониженном давлении. Указанное в заголовке соединение очищали с помощью ВЭЖХ с использованием колонки Luna C-18 и следующего градиента: CH3CN/H2O=20/80 до 100/00 (об/об) в течение 45 минут. Указанное в заголовке соединение затем лиофилизовали из смеси 1,4-диоксана и H2O.
Выход: 76 мг
MS-ESI: [M+H]+=498,2
ВЭЖХ: Rt=13,90 мин, колонка 5 мкм Luna C-18(2) 150×4,60 мм, поток 1 мл/мин, детектирование 210 нм, элюент H2O/CH3CN=40/60 до 0/100 (об/об) в течение 15 минут.
Пример 9
Трет-бутил 5-амино-2-метилтио-4-(3-(п-толуолсульфонамидо)фенил)тиено[2,3-d]пиримидин-6-карбоксамид
(a). 5-Циано-4-(3-нитрофенил)-2-метилтио-6-гидроксипиримидин
Смесь сульфата S-метилизотиомочевины (69,0 г), 3-нитробензальдегида (75,0 г), этилцианоацетата (56,0 мл) и карбоната калия (72,5 г) в абс.EtOH (1500 мл) перемешивали при 60°C в течение 16 часов. Реакционную смесь охлаждали до 0°C на ледяной бане. Полученный осадок отфильтровывали, промывали абс.EtOH и растворяли в горячей воде (100°C). Раствор охлаждали до комнатной температуры, подкисляли 2 н. HCl до pH 2 и охлаждали до 0°C на ледяной бане. Полученный осадок отфильтровывали и промывали ледяной водой. Оставшуюся воду в осадке удаляли совместным выпариванием с 1,4-диоксаном.
Выход: 54,0 мг.
MS-ESI: [M+H]+=289,0
ТСХ: Rf=0,3, силикагель, ДХМ/MeOH=9/1 (об/об).
(b). 6-Хлор-5-циано-4-(3-нитрофенил)-2-метилтиопиримидин
POCl3 (100 мл) добавляли к перемешиваемому раствору 5-циано-4-(3-нитрофенил)-2-метилтио-6-гидроксипиримидина (пример 9(a), 25,0 г) в сухом 1,4-диоксане (300 мл). Через 3 часа при 90°C, смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток растворяли в 1,4-диоксане (100 мл) и полученный раствор охлаждали до 0°C. Осторожно добавляли ледяную воду. Полученный осадок отфильтровывали и промывали водой. Оставшуюся воду в осадке удаляли совместным выпариванием с 1,4-диоксаном.
Выход: 26,0 г.
MS-ESI: [M+H]+=307,0
ТСХ: Rf=0,5, силикагель, гептан/EtOAc=3/2 (об/об).
(c). Этил 5-циано-4-(3-нитрофенил)-2-метилтио-6-(этоксикарбонилметилтио)пиримидин
DIPEA (15,7 мл) добавляли к перемешиваемому раствору этил 2-меркаптоацетата (9,3 мл) и 6-хлор-5-циано-4-(3-нитрофенил)-2-метилтиопиримидина (пример 9(b), 26,0 г) в смеси EtOH (250 мл) и ДХМ (250 мл). Через 1 час при комнатной температуре, добавляли к смеси 0,1 н. водн. HCl (500 мл), которую затем экстрагировали ДХМ (3×500 мл), сушили (MgSO4) и концентрировал при пониженном давлении.
Выход: 28,0 г
MS-ESI: [M+H]+=390,4
ТСХ: Rf=0,5, силикагель, гептан/EtOAc=3/2 (об/об).
(d). Этил 5-амино-4-(3-нитрофенил)-2-метилтио-тиено[2,3-d]пиримидин-6-карбоксилат
Смесь этил 5-циано-4-(3-нитрофенил)-2-метилтио-6-(этоксикарбонилметилтио)пиримидина (пример 9(c), 28,0 г) и DIPEA (30 мл) в смеси толуола (150 мл) и EtOH (150 мл) перемешивали при кипячении с обратным холодильником (100°C) в течение 16 часов. Смесь затем охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаточный DIPEA удаляли совместным выпариванием с толуолом.
Выход: 28,0 г
MS-ESI: [M+H]+=391,2
ТСХ: Rf=0,6, силикагель, гептан/EtOAc=3/2 (об/об).
(e). Трет-бутил 5-амино-2-метилтио-4-(3-аминофенил)-тиено[2,3-d]пиримидин-6-карбоксамид
Этил 5-амино-2-метилтио-4-(3-нитрофенил)тиено[2,3-d]пиримидин-6-карбоксилат (пример 9d, 780 мг) растворяли в 1,4-диоксане (10 мл). Добавляли этанол (10 мл) и хлорид олова (II) (1,1 г) и реакционную смесь перемешивали в течение ночи при 90°C. После концентрирования реакционной смеси в вакууме, остаток повторно растворяли в EtOAc (50 мл) и промывали 4 M водн. NaOH (10 мл), сушили (MgSO4) и концентрировали при пониженном давлении. Сложноэфирную этильную группу в полученном производном этил 5-амино-2-метилтио-4-(3-аминофенил)-тиено[2,3-d]пиримидин-6-карбоксилате (558 мг) омыляли до соответствующей кислоты (430 мг), используя способ, описанный в примере 1d и впоследствии подвергали взаимодействию с трет-бутиламином (200 мкл) для образования соответствующего трет-бутиламида (согласно примеру 1e). Указанное в заголовке соединение очищали хроматографией на силикагеле с использованием смеси гептан/EtOAc=3/1 (об/об) в качестве элюента.
Выход: 391 мг
MS-ESI: [M+H]+=388,0
ТСХ: Rf=0,43, силикагель, гептан/EtOAc=3/2 (об/об)
(f). Трет-бутил 5-амино-2-метилтио-4-(3-(п-толуолсульфонамидо)фенил)тиено[2,3-d]пиримидин-6-карбоксамид
Трет-бутил 5-амино-2-метилтио-4-(3-аминофенил)тиено[2,3-d]пиримидин-6-карбоксамид (пример 9e, 100 мг) растворяли в сухом пиридине (5 мл). Добавляли п-толуолсульфонилхлорид (70 мг) и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь разбавляли CH2Cl2 и промывали 0,1 M водн. HCl. Органический слой сушили (MgSO4) и концентрировали при пониженном давлении. Указанное в заголовке соединение очищали хроматографией на силикагеле с использованием смеси гептан/EtOAc=3/2 (об/об) в качестве элюента.
Выход: 63 мг
MS-ESI: [М+Н]+=542,4
ВЭЖХ: Rt=23,46 мин, колонка Luna C-18 (смотри пример 1e), элюент фосфатный буфер 50 мМ pH 2,1/H2О/СН3CN/СН3ОН=10/72/17/1 до 10/18/68/4 (об/об) в течение 50 минут.
Пример 10
Трет-бутил 5-амино-2-метилтио-4-(3-(винилсульфонамидо)фенил)-тиено[2,3-d]пиримидин-6-карбоксамид
Трет-бутил 5-амино-2-метилтио-4-(3-аминофенил)тиено[2,3-d]пиримидин-6-карбоксамид (пример 9e, 2,5 г) растворяли в смеси CH2Cl2 (25 мл) и пиридина (25 мл). 2-Бром-этансульфонилхлорид получали, как описано в Bull. Chem. Soc. Jpn. 39,1937-1941 (1966). Добавляли по каплям раствор 2-бром-этансульфонилхлорида (2 г) в СН2Cl2 (5 мл) и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь разбавляли СН2Cl2 и промывали насыщенным водн. NaHCO3. Органический слой сушили (MgSO4) и концентрировали при пониженном давлении. Указанное в заголовке соединение очищали хроматографией на силикагеле с использованием смеси гептан/EtOAc=3/2 (об/об) в качестве элюента.
Выход: 1,4 г
MS-ESI: [M+H]+=478,6
ТСХ: Rf=0,80, силикагель, гептан/EtOAc=3/2 (об/об)
Пример 11
Трет-бутил 5-амино-2-метилтио-4-(3-(2-пиперидиноэтансульфонамидо)фенил)тиено[2,3-d]пиримидин-6-карбоксамид
Трет-бутил 5-амино-2-метилтио-4-(3-(винилсульфонамидо)фенил)-тиено[2,3-d]пиримидин-6-карбоксамид (пример 10, 87 мг) растворяли в сухом ТГФ (5 мл). Добавляли пиперидин (181 мкл) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли CH2Cl2 и промывали насыщенным водн. NaHCO3. Органический слой сушили (MgSO4) и концентрировали при пониженном давлении. Указанное в заголовке соединение первоначально очищали хроматографией на силикагеле с использованием смеси гептан/EtOAc=3/2 (об/об) в качестве элюента и затем с помощью ВЭЖХ с использованием колонки Luna C-18 и следующего градиента: CH3CN/0,1% водн. трифторуксусная кислота (ТФУК)=10/90 до 90/10 (об/об) в течение 30 минут. Указанное в заголовке соединение затем лиофилизовали из смеси 1,4-диоксана и 0,1% водн. ТФУК.
Выход: 89 мг (ТФУК соль)
MS-ESI: [M+H]+=563,4
ВЭЖХ: Rt=18,4 мин, колонка Luna C-18 (смотри пример 1e), элюент H2O/CH3CN=60/40 до 0/100 (об/об) в течение 25 минут.
Пример 12
Трет-бутил 5-амино-2-метилтио-4-(3-(2-(тиоморфолин-4-ил)-этансульфонамидо)фенил)тиено[2,3-d]пиримидин-6-карбоксамид
Взаимодействие тиоморфолина (184 мкл) с трет-бутил 5-амино-2-метилтио-4-(3-(винилсульфонамидо)фенил)тиено[2,3-d]пиримидин-6-карбоксамидом (пример 10, 87 мг) осуществляли в соответствии с методикой, описанной в примере 11. Указанное в заголовке соединение первоначально очищали хроматографией на силикагеле с использованием смеси гептан/EtOAc=3/2 (об/об) в качестве элюента и затем с помощью ВЭЖХ с использованием колонки Luna C-18 и следующего градиента: CH3CN/0,1% водн. ТФУК=10/90 до 90/10 (об/об) в течение 30 минут. Указанное в заголовке соединение затем лиофилизовали из смеси 1,4-диоксана и 0,1% водн. ТФУК.
Выход: 120 мг (ТФУК соль)
MS-ESI: [M+H]+=581,2
ВЭЖХ: Rt=17,2 мин, колонка Luna C-18 (смотри пример 1e), элюент H2O/CH3CN=60/40 до 0/100 (об/об) в течение 25 минут.
Пример 13
Трет-бутил 5-амино-2-метилтио-4-(3-(2-(бис-(2-метоксиэтил)амино)этансульфонамидо)фенил)тиено[2,3-d]пиримидин-6-карбоксамид
Взаимодействие бис-(2-метоксиэтил)амина (244 мг) с трет-бутил 5-амино-2-метилтио-4-(3-(винилсульфонамидо)фенил)тиено[2,3-d]пиримидин-6-карбоксамидом (пример 10, 87 мг) осуществляли в соответствии со способом, описанным в примере 11. Указанное в заголовке соединение первоначально очищали хроматографией на силикагеле с использованием гептан/EtOAc=3/2 (об/об) в качестве элюента и затем с помощью ВЭЖХ с использованием колонки Luna C-18 и следующего градиента: CH3CN/0,1% водн. ТФУК=10/90 до 90/10 (об/об) в течение 30 минут. Указанное в заголовке соединение затем лиофилизовали из смеси 1,4-диоксана и 0,1% водн. ТФУК.
Выход: 60 мг (ТФУК соль)
MS-ESI: [M+H]+=611,4
ВЭЖХ: Rt=17,9 мин, колонка Luna C-18 (смотри пример 1e), элюент H2O/CH3CN=60/40 до 0/100 (об/об) в течение 25 минут
Пример 14
Трет-бутил 5-амино-2-метилтио-4-(3-(2-(N-метилпиперазино)-этансульфонамидо)фенил)тиено[2,3-d]пиримидин-6-карбоксамид
Взаимодействие N-метилпиперазина (184 мкл) с трет-бутил 5-амино-2-метилтио-4-(3-(винилсульфонамидо)фенил)тиено[2,3-d]пиримидин-6-карбоксамидом (пример 10, 87 мг) осуществляли в соответствии с методикой, описанной в примере 11. Указанное в заголовке соединение первоначально очищали хроматографией на силикагеле с использованием смеси гептан/EtOAc=3/2 (об/об) в качестве элюента и затем с помощью ВЭЖХ c использованием колонки Luna C-18 и следующего градиента: CH3CN/0,1% водн. ТФУК=10/90 до 90/10 (об/об) в течение 30 минут. Указанное в заголовке соединение затем лиофилизовали из смеси 1,4-диоксана и 0,1% водн. ТФУК.
Выход: 85 мг (ТФУК соль)
MS-ESI: [M+H]+=578,4
ВЭЖХ: Rt=16,1 мин, колонка Luna C-18 (смотри пример 1e), элюент H2O/CH3CN=60/40 до 0/100 (об/об) в течение 25 минут.
Пример 15
Трет-бутил 5-амино-2-метилтио-4-(3-(метоксикарбониламино)фенил)тиено[2,3-d]пиримидин-6-карбоксамид
Трет-бутил 5-амино-2-метилтио-4-(3-аминофенил)тиено[2,3-d]пиримидин-6-карбоксамид (пример 9e, 100 мг) растворяли в сухом СН2Cl2 (5 мл). Добавляли метилхлорформиат (199 мкл) и DIPEA (500 мкл) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь промывали Н2О. Органический слой сушили (MgSO4) и концентрировали при пониженном давлении. Указанное в заголовке соединение очищали с помощью ВЭЖХ с использованием колонки Luna C-18 и следующего градиента: CH3CN/10% водн. CH3CN=10/90 до 90/10 (об/об) в течение 30 минут. Указанное в заголовке соединение затем лиофилизовали из смеси 1,4-диоксана и Н2О.
Выход: 80 мг
MS-ESI: [M+H]+=446,2
ВЭЖХ: Rt=20,44 мин, колонка Luna C-18 (смотри пример 1e), элюент фосфатный буфер 50 мМ pH 2,1/H2O/CH3CN=10/72/18 до 10/18/72 (об/об) в течение 20 минут.
Пример 16
Трет-бутил 5-амино-2-метилтио-4-(3-(аллилоксикарбониламино)фенил)тиено[2,3-d]пиримидин-6-карбоксамид
Взаимодействие трет-бутил 5-амино-2-метилтио-4-(3-аминофенил)тиено[2,3-d]пиримидин-6-карбоксамида (пример 9e, 100 мг) с аллилхлорформиатом (274 мкл) осуществляли с использованием методик, описанных в примере 15. Указанное в заголовке соединение очищали с помощью ВЭЖХ использованием колонки Luna C-18 и следующего градиента: CH3CN/10% водн. CH3CN=10/90 до 90/10 (об/об) в течение 30 минут. Указанное в заголовке соединение затем лиофилизовали из смеси 1,4-диоксана и Н2О.
Выход: 66 мг
MS-ESI: [M+H]+=472,2
ВЭЖХ: Rt=22,37 мин, колонка Luna C-18 (смотри пример 1e), элюент фосфатный буфер 50 мМ pH 2,1/H2O/CH3CN=10/72/18 до 10/18/72 (об/об) в течение 20 минут.
Пример 17
Трет-бутил 5-амино-2-метилтио-4-(3-(бензилоксикарбониламино)фенил)тиено[2,3-d]пиримидин-6-карбоксамид
Взаимодействие трет-бутил 5-амино-2-метилтио-4-(3-аминофенил)тиено[2,3-d]пиримидин-6-карбоксамида (пример 9e, 100 мг) с бензилхлорформиатом (368 мкл) осуществляли в соответствии с методиками, описанными в примере 15. Указанное в заголовке соединение очищали с помощью ВЭЖХ с использованием колонки Luna C-18 и следующего градиента: CH3CN/10% водн. CH3CN=10/90 до 90/10 (об/об) в течение 30 минут. Указанное в заголовке соединение затем лиофолизовали из смеси 1,4-диоксан и Н2О.
Выход: 112 мг
MS-ESI: [M+H]+=522,4
ВЭЖХ: Rt=24,10 мин, колонка Luna C-18 (смотри пример 1e), элюент фосфатный буфер 50 мМ pH 2,1/H2O/CH3CN=10/72/18 до 10/18/72 (об/об) в течение 20 минут.
Пример 18
Трет-бутил 5-амино-2-метилтио-4-(3-(этоксикарбониламино)фенил)тиено[2,3-d]пиримидин-6-карбоксамид
Взаимодействие трет-бутил 5-амино-2-метилтио-4-(3-аминофенил)тиено[2,3-d]пиримидин-6-карбоксамида (пример 9e, 100 мг) с этилхлорформиатом (247 мкл) осуществляли с использованием методик, описанных в примере 15. Указанное в заголовке соединение очищали с помощью ВЭЖХ с использованием колонки Luna C-18 и следующего градиента: CH3CN/10% водн. CH3CN=10/90 до 90/10 (об/об) в течение 30 минут. Указанное в заголовке соединение затем лиофилизовали из смеси 1,4-диоксана и Н2О.
Выход: 74 мг
MS-ESI: [M+H]+=460,4
ВЭЖХ: Rt=21,77 мин, колонка Luna C-18 (смотри пример 1e), элюент фосфатный буфер 50 мМ pH 2,1/H2O/CH3CN=10/72/18 до 10/18/72 (об/об) в течение 20 минут.
Пример 19
Трет-бутил 5-амино-2-метилтио-4-(3-феноксикарбониламино)фенил)тиено[2,3-d]пиримидин-6-карбоксамид
Взаимодействие трет-бутил 5-амино-2-метилтио-4-(3-аминофенил)тиено[2,3-d]пиримидин-6-карбоксамида (пример 9e, 100 мг) с фенилхлорформиатом (324 мкл) осуществляли с использованием методик, описанных в примере 15. Указанное в заголовке соединение очищали с помощью ВЭЖХ с использованием колонки Luna C-18 и следующего градиента: CH3CN/10% водн. CH3CN=10/90 до 90/10 (об/об) в течение 30 минут. Указанное в заголовке соединение затем лиофилизовали из смеси 1,4-диоксана и H2О.
Выход: 47 мг
MS-ESI: [M+H]+=508,4
ВЭЖХ: Rt=23,25 мин, колонка Luna C-18 (смотри пример 1e), элюент фосфатный буфер 50 мМ pH 2,1/H2O/CH3CN=10/72/18 до 10/18/72 (об/об) в течение 20 минут.
Пример 20
Трет-бутил 5-амино-2-метилтио-4-(3-(п-нитро-феноксикарбониламино)фенил)тиено[2,3-d]пиримидин-6-карбоксамид
Трет-бутил 5-амино-2-метилтио-4-(3-аминофенил)тиено[2,3-d]пиримидин-6-карбоксамид (пример 9e, 1 г) растворяли в сухом CH2Cl2 (10 мл). Далее, добавляли по каплям раствор п-нитро-фенилхлорформиата (520 мг) в сухом CH2Cl2 (10 мл) и реакционную смесь перемешивали при комнатной температуре. Через 1 час реакционную смесь промывали H2O. Органический слой сушили (MgSO4) и концентрировали при пониженном давлении.
Выход: 1,42 г
MS-ESI: [M+H]+=553,6
ТСХ: Rf=0,7, силикагель, гептан/EtOAc=3/2 (об/об)
Пример 21
Трет-бутил 5-амино-2-метилтио-4-(3-((морфолин-4-ил)карбониламино)фенил)тиено[2,3-d]пиримидин-6-карбоксамид
Трет-бутил 5-амино-2-метилтио-4-(3-(п-нитро-феноксикарбониламино)фенил)тиено[2,3-d]пиримидин-6-карбоксамид (пример 20, 142 мг) растворяли в сухом CH2Cl2 (5 мл). Добавляли морфолин (112 мкл) и DIPEA (225 мкл) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли CH2Cl2 и промывали H2O. Органический слой концентрировали при пониженном давлении. Указанное в заголовке соединение очищали с помощью ВЭЖХ с использованием колонки Luna C-18 и следующего градиента: H2O/CH3CN=80/20 до 0/100 (об/об) в течение 45 минут. Указанное в заголовке соединение затем лиофилизовали из смеси 1,4-диоксана и Н2O.
Выход: 22 мг
MS-ESI: [M+H]+=501,2
ВЭЖХ: Rt=8,62 мин, колонка Luna C-18 (смотри пример 8), элюент H2O/CH3CN=40/60 до 0/100 (об/об) в течение 15 минут.
Пример 22
Трет-бутил 5-амино-2-метилтио-4-(3-(о-анизидинокарбониламино)фенил)тиено[2,3-d]пиримидин-6-карбоксамид
Связывание c помощью мочевины трет-бутил 5-амино-2-метилтио-4-(3-(п-нитро-5-феноксикарбониламино)фенил)тиено[2,3-d]пиримидин-6-карбоксамида (пример 20, 142 мг) с орто-анизидином (159 мг) осуществляли в соответствии с методиками, описанными в примере 21. Указанное в заголовке соединение очищали с помощью ВЭЖХ с использованием колонки Luna C-18 и следующего градиента: H2О/CH3CN=80/20 до 0/100 (об/об) в течение 45 минут. Указанное в заголовке соединение затем лиофилизовали из смеси 1,4-диоксана и H2O.
Выход: 18 мг
MS-ESI: [M+H]+=537,2
ВЭЖХ: Rt=12,94 мин, колонка Luna C-18 (смотри пример 8), элюент H2O/CH3CN = 40/60 до 0/100 (об/об) в течение 15 минут.
Пример 23
Трет-бутил 5-амино-2-метилтио-4-(3-(1,2,3,6-тетрагидро-пиридинокарбониламино)фенил)тиено[2,3-d]пиримидин-6-карбоксамид
Связывание с помощью мочевины трет-бутил 5-амино-2-метилтио-4-(3-(п-нитро-феноксикарбониламино)фенил)тиено[2,3-d]пиримидин-6-карбоксамида (пример 20, 142 мг) с 1,2,3,6-тетрагидропиридином (118 мкл) осуществляли в соответствии с методиками, описанными в примере 21. Указанное в заголовке соединение очищали с помощью ВЭЖХ с использованием колонки Luna C-18 и следующего градиента: H2O/CH3CN=80/20 до 0/100 (об/об) в течение 45 минут. Указанное в заголовке соединение затем лиофилизовали из смеси 1,4-диоксана и H2О.
Выход: 18 мг
MS-ESI: [M+H]+=497,2
ВЭЖХ: Rt=11,19 мин, колонка Luna C-18 (смотри пример 8), элюент H2O/CH3CN=40/60 до 0/100 (об/об) в течение 15 минут.
Пример 24
Трет-бутил 5-гидрокси-2-метилтио-4-(3-метоксифенил)хиназолин-6-карбоксамид
(a). Этил 2-метилтио-4-(3-метоксифенил)-6-метил-1,4-дигидропиримидин-5-карбоксилат
Смесь сульфата S-метилизотиомочевины (13,9 г), 3-метоксибензальдегида (7,5 г), этилацетоацетата (6,5 г) и гидрокарбоната натрия (21 г) в ДМФ (200 мл) перемешивали при 70°C в течение 18 часов. Реакционную смесь охлаждали до комнатной температуры, разбавляли диэтиловым эфиром и промывали H2O и насыщенным водн. NaCl. Указанное в заголовке соединение очищали хроматографией на силикагеле с использованием смеси гептан/EtOAc=3/2 (об/об) в качестве элюента.
Выход: 7,3 г
MS-ESI: [M+H]+=321,0
ТСХ: Rf=0,2, силикагель, гептан/EtOAc=3/1 (об/об)
(b). Этил 2-метилтио-4-(3-метоксифенил)-6-метилпиримидин-5-карбоксилат
Этил-2-метилтио-4-(3-метоксифенил)-6-метил-1,4-дигидропиримидин-5-карбоксилат (пример 24a, 7,65 г) растворяли в смеси толуола (200 мл) и CH2Cl2 (100 мл). Добавляли 2,3-дихлор-5,6-дициано-1,4-бензохинон (5,45 г) и реакционную смесь перемешивали при комнатной температуре в течение 15 минут. Добавляли 0,2 M водн. NaOH (250 мл). Органический слой отделяли, промывали H2O (2×250 мл) и насыщенным водн. NaCl (2×250 мл), сушили (MgSO4) и концентрировали при пониженном давлении. Указанное в заголовке соединение очищали хроматографией на силикагеле с использованием смеси гептан/EtOAc=4/1 (об/об) в качестве элюента.
Выход: 4,0 г
MS-ESI: [M+H]+=319,2
ТСХ: Rf=0,4, силикагель, гептан/EtOAc=3/1 (об/об)
(c) Этил 5-гидрокси-2-метилтио-4-(3-метоксифенил)хиназолин-6-карбоксилат
Раствор этил 2-метилтио-4-(3-метоксифенил)-6-метилпиримидин-5-карбоксилата (пример 24b, 318 мг) в сухом ТГФ (2 мл) добавляли к свежеполученному раствору LDA в сухом ТГФ (1 мл), охлажденному до -78°C. Смесь перемешивали при -78°C в течение 30 минут и добавляли 3-этоксиакрилат (217 мкл). Смесь затем перемешивали в течение 3 часов, поднимая температуру от -78°C до комнатной температуры. Добавляли 0,1 M водн. HCl (20 мл) к реакционной смеси, которую после этого экстрагировали EtOAc (25 мл). Органический слой промывали водой (25 мл) и насыщенным водн. NaCl (25 мл), сушили (MgSO4) и концентрировали при пониженном давлении. Указанное в заголовке соединение очищали хроматографией на силикагеле с использованием смеси гептан/EtOAc=3/1 (об/об) в качестве элюента и перекристаллизовывали из СН3ОН.
Выход: 38 мг
MS-ESI: [M+H]+=371,2
ТСХ: Rf=0,6, силикагель, гептан/EtOAc=2/3 (об/об)
(d). Трет-бутил 5-гидрокси-2-метилтио-4-(3-метоксифенил)хиназолин-6-карбоксамид
Этил-5-гидрокси-2-метилтио-4-(3-метоксифенил)хиназолин-6-карбоксилат (пример 24c, 38 мг) растворяли в смеси 1,4-диоксана (4 мл) и 1 M водн. KOH (0,5 мл). Смесь кипятили с обратным холодильником в течение 48 часов, затем охлаждали до комнатной температуры и подкисляли добавлением 0,1 M водн. HCl (15 мл). Смесь экстрагировали CH2Cl2 (15 мл). Органический слой сушили (MgSO4) и упаривали при пониженном давлении, получая 5-гидрокси-4-(3-метоксифенил)-2-метилтиохиназолин-6-карбоновую кислоту. Последнюю растворяли в ДМФ (2 мл). Добавляли трет-бутиламин (53 мкл) и TBTU (96 мг) и смесь перемешивали при комнатной температуре в течение 3 часов. Добавляли EtOAc (15 мл) и органический слой промывали насыщенным водн. NaHCO3 (15 мл) и насыщенным водным NaCl (15 мл), сушили (MgSO4) и упаривали при пониженном давлении. Указанное в заголовке соединение первоначально очищали хроматографией на силикагеле с использованием смеси гептан/EtOAc=7/3 (об/об) в качестве элюента. Затем его очищали с помощью ВЭЖХ с использованием следующего градиента: 10% водн. CH3CN/CH3CN/0,1% водн. ТФУК = 57/40/3 до 7/90/3 (об/об) в течение 30 минут. Указанное в заголовке соединение лиофилизовали из смеси воды и 1,4-диоксана.
Выход: 25 мг
MS-ESI: [M+H]+=398,2
ВЭЖХ: Rt=9,75 мин, колонка Luna C-18 (смотри пример 1e), элюент фосфатный буфер 50 мМ pH 2,1/H2O/CH3CN/CH3OH=5/35/57/3 до 5/10/81/4 (об/об) в течение 15 минут.
Пример 25
Трет-бутил 5-амино-2-метилтио-4-(3-метоксифенил)хиназолин-6-карбоксамид
(a). 5-Циано-4-(3-метоксифенил)-2-метилтио-6-винилпиримидин
6-Хлор-5-циано-4-(3-метоксифенил)-2-метилтио-пиримидин (пример 1b, 1,46 г) суспендировали в 1,4-диоксане (10 мл). Добавляли тетракис(трифенилфосфин)палладий(0) (350 мг) и смесь помещали в атмосферу азота. Добавляли тетравинилолово (1,26 мл) и смесь кипятили с обратным холодильником в течение 5 часов. Реакционную смесь затем выливали в смесь EtOAc (100 мл) и Н2O (100 мл). Органический слой промывали насыщенным водн. NaCl, сушили (MgSO4) и концентрировали при пониженном давлении. Указанное в заголовке соединение очищали хроматографией на силикагеле с использованием смеси гептан/CH2Cl2=1/0 до 1/3 (об/об).
Выход: 1,05 г
MS-ESI: [M+H]+=284,2
ТСХ: Rf=0,4, силикагель, гептан/CH2Cl2=1/2 (об/об)
(b). 5-Циано-4-(3-метоксифенил)-2-метилтио-6-(1,1-бис-(этоксикарбонил)проп-3-ил)пиримидин
5-Циано-4-(3-метоксифенил)-2-метилтио-6-винил-пиримидин (пример 25a) растворяли в смеси этанола (2 мл) и толуола (2 мл). Добавляли карбонат калия (690 мг) и диэтилмалонат (272 мкл) и смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь затем выливали в смесь 0,5M водн. HCl (25 мл) и EtOAc (50 мл). Органический слой промывали H2O (50 мл) и насыщенным водн. NaCl (50 мл), сушили (MgSO4) и концентрировали при пониженном давлении. Указанное в заголовке соединение очищали хроматографией на силикагеле с использованием смеси толуол/EtOAc=100/0 до 95/5 (об/об) в качестве элюента
Выход: 344 мг
MS-ESI: [M+H]+=444,2
ТСХ: Rf=0,3, силикагель, толуол/EtOAc=95/5 (об/об)
(c). Этил 5-амино-2-метилтио-4-(3-метоксифенил)-7,8-дигидрохиназолин-6-карбоксилат
5-Циано-4-(3-метоксифенил)-2-метилтио-6-(1,1-бис(этоксикарбонил)проп-3-ил)пиримидин (пример 25b, 81 мг) растворяли в сухом CH2Cl2 (1 мл). Добавляли по каплям 1M раствор хлорида олова(IV) в СН2Cl2 (1 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Затем к реакционной смеси добавляли Н2O (10 мл) и EtOAc (10 мл). Органический слой промывали Н2O (10 мл) и насыщенным водн. NaCl (10 мл), сушили (MgSO4) и концентрировали при пониженном давлении. Указанное в заголовке соединение очищали хроматографией на силикагеле с использованием смеси гептан/EtOAc=1/0 до 3/2 (об/об) в качестве элюента.
Выход: 24 мг
MS-ESI: [M+H]+=372,2
ТСХ: Rf=0,5, силикагель, гептан/EtOAc=3/1 (об/об)
(d). Этил 5-амино-2-метилтио-4-(3-метоксифенил)хиназолин-6-карбоксилат
Этил 5-амино-2-метилтио-4-(3-метоксифенил)-7,8-дигидрохиназолин-6-карбоксилат (пример 25c, 22 мг) растворяли в CH2Cl2 (1 мл). Добавляли 0,06M раствор 2,3-дихлор-5,6-дициано-1,4-бензохинона в СН2Cl2 (1,2 мл) и смесь перемешивали при комнатной температуре в течение 15 минут. Реакционную смесь концентрировали при пониженном давлении. Указанное в заголовке соединение очищали хроматографией на силикагеле с использованием смеси толуол/EtOAc=95/5 (об/об) в качестве элюента.
Выход: 20 мг
MS-ESI: [M+H]+=370,0
ТСХ: Rf=0,3, силикагель, гептан/EtOAc=1/3 (об/об)
(e). 5-Амино-2-метилтио-4-(3-метоксифенил)хиназолин-6-карбоновая кислота
Этил 5-амино-2-метилтио-4-(3-метоксифенил)хиназолин-6-карбоксилат (пример 25d, 490 мг) растворяли в 15 мл 1,4-диоксана и добавляли 2 M водный раствор KOH (3 мл). Смесь кипятили с обратным холодильником в течение 5 часов и при 70°C в течение 76 часов. Смесь охлаждали до комнатной температуры и добавляли 0,5 M раствор HCl в воде. Смесь экстрагировали CH2Cl2 (2×50 мл), объединенные органические слои сушили (MgSO4) и концентрировали при пониженном давлении, получая неочищенное указанное в заголовке соединение.
Выход: 406 мг (неочищенный)
MS-ESI: [M+H]+=342,2
ТСХ: Rf=0,0, силикагель, гептан/EtOAc=2/3 (об/об)
(f). Трет-бутил 5-амино-2-метилтио-4-(3-метоксифенил)-хиназолин-6-карбоксамид
К 1,8M раствору 5-амино-2-метилтио-4-(3-метоксифенил)хиназолин-6-карбоновой кислоты в ДМФ (1,8 мл) добавляли TBTU (173 мг) и трет-бутиламин (95 мкл). Реакционную смесь перемешивали в течение 2 часов и затем выливали в смесь EtOAc (25 мл) и насыщенного водного раствора NaHCO3 (50 мл). Органическую фазу отделяли и промывали 0,5 M водной HCl (50 мл) и насыщенным раствором соли (50 мл), с последующей сушкой (MgSO4) и концентрированием при пониженном давлении. Указанное в заголовке соединение очищали хроматографией на силикагеле с использованием смеси гептан/EtOAc=1/0 до 2/3 (об/об) в качестве элюента. Указанное в заголовке соединение лиофилизовали из смеси диоксана и воды, содержащей 1,5 эквивалента HCl.
Выход: 44 мг
MS-ESI: [M+H]+=397,2
ВЭЖХ:Rt=21,52 мин, колонка Luna C-18 (смотри пример 1e), элюент фосфатный буфер 50 мМ pH 2,1/H2O/CH3CN=10/70/20 до 10/10/80 (об/об) в течение 20 минут.
Пример 26
Трет-бутил 5-амино-2-метилтио-4-(3-(2-(пирролидин-1-ил)этокси)фенил)хиназолин-6-карбоксамид
(a). Трет-бутил 5-амино-2-метилтио-4-(3-гидроксифенил)-хиназолин-6-карбоксамид
Раствор трет-бутил 5-амино-2-метилтио-4-(3-метоксифенил)хиназолин-6-карбоксамида (пример 25f, 1,5 г) в сухом CH2Cl2 охлаждали до 0°C. Добавляли по каплям раствор BBr3 (1,1 мл) в СН2Cl2 (25 мл) и после завершения прибавления смесь перемешивали в течение 3 часов при комнатной температуре. Смесь разбавляли СН2Cl2 и осторожно добавляли насыщенный водный раствор NaHCO3 (200 мл). Смесь интенсивно перемешивали в течение 1,5 часов до растворения всех твердых веществ. Водный слой экстрагировали дважды СН2Cl2. Первый органический слой промывали насыщенным водн. NaHCO3 и насыщенным раствором соли. Объединенные органические слои сушили (MgSO4) и концентрировали при пониженном давлении. Указанное в заголовке соединение очищали хроматографией на силикагеле с использованием смеси гептан/EtOAc=1/0 до 1/1 (об/об) в качестве элюента.
Выход: 930 мг
MS-ESI: [M+H]+=383,4
ТСХ: Rf=0,3, силикагель, гептан/EtOAc=2/3 (об/об)
(b). Трет-бутил 5-амино-2-метилтио-4-(3-(2-(пирролидин-1-ил)этокси)фенил)хиназолин-6-карбоксамид
Смесь К2СО3 (1,0 г), гидрохлорида 1-(2-хлорэтил)пирролидина (66 мг) и трет-бутил 5-амино-2-метилтио-4-(3-гидроксифенил)хиназолин-6-карбоксамида (пример 26a, 121 мг) в ацетоне в течение ночи кипятили с обратным холодильником. Смесь охлаждали до комнатной температуры, твердые вещества удаляли фильтрованием и фильтрат концентрировали при пониженном давлении. Остаток помещали в EtOAc и промывали водой и насыщенным раствором соли. Органическую фазу сушили (MgSO4) и концентрировали в вакууме. Указанное в заголовке соединение очищали с помощью ВЭЖХ с использованием колонки Luna C-18 и следующего градиента: 10% водн. CH3CN/CH3CN/0,1% водн. ТФУК=72/25/3 до 27/70/3 (об/об/об) в течение 30 минут. Указанное в заголовке соединение лиофилизовали из смеси воды, ТФУК и CH3CN.
Выход: 42 мг (ТФУК соль)
MS-ESI: [M+H]+=480,4
ВЭЖХ: Rt=12,93 мин, колонка Luna C-18 (смотри пример 1e), элюент фосфатный буфер 50 мМ pH 2,1/H2O/CH3CN=10/70/20 до 10/10/80 (об/об) в течение 20 минут.
Пример 27
Трет-бутил 5-амино-2-метилтио-4-(3-аминофенил)хиназолин-6-карбоксамид
(a). 5-Циано-2-метилтио-4-(3-нитрофенил)-6-[(трифенилфосфанилиден)метил]пиримидин
К суспензии безводного бромида метилтрифенилфосфония (29,5 г) в диметоксиэтане (400 мл) при -78°C добавляли 1,6 M раствор н-бутиллития в гексанах. Смесь перемешивали при -78°C в течение 1 часа и добавляли раствор 6-хлор-5-циано-4-(3-нитрофенил)-2-метилтио-пиримидина (пример 9b, 10,1 г) в диметоксиэтане (100 мл) и охлаждающую баню удаляли. Через 1 час реакция завершалась и добавляли воду (15 мл). Удаление твердых веществ фильтрованием с последующим концентрированием реакционной смеси давало темный остаток, который перемешивали с этилацетатом, получая суспензию. Концентрирование в вакууме проводили после фильтрования, промывки остатка водой и насыщенным раствором соли и сушки органического слоя MgSO4. Указанное в заголовке соединение очищали хроматографией на силикагеле с использованием смеси гептан/EtOAc=4/1 до 1/1 (об/об) в качестве элюента.
Выход: 7,04 г
MS-ESI: [M+H]+=299,2
ТСХ: Rf=0,4, силикагель, гептан/EtOAc=3/2 (об/об)
(b) 5-Циано-2-метилтио-4-(3-нитрофенил)-6-винилпиримидин
Раствор 5-циано-2-метилтио-4-(3-нитрофенил)-6-[(трифенилфосфанилиден)метил]пиримидина (пример 27a, 7,04 г) в ТГФ (64 мл) обрабатывали водным формальдегидом (37 вес.%, 3,55 мл) при 60°C в течение 1 часа. После охлаждения смеси до комнатной температуры, ее разбавляли EtOAc (100 мл) и промывали водой (2×50 мл), сушили (MgSO4) и концентрировали при пониженном давлении. Указанное в заголовке соединение очищали хроматографией на силикагеле с использованием смеси гептан/EtOAc=9/1 до 3/2 (об/об) в качестве элюента.
Выход: 1,42 г
MS-ESI: [M+H]+=547,2
ТСХ: Rf=0,6, силикагель, гептан/EtOAc=3/2 (об/об)
(c). Трет-бутил этил (2-(5-циано-2-метилтио-4-(3-нитрофенил)пиримидин-6-ил)этил)малонат
Карбонат калия (1,88 г) и трет-бутилэтилмалонат суспендировали в EtOH (82 мл) и медленно добавляли (примерно 1,5 часа) раствор 5-циано-2-метилтио-4-(3-нитрофенил)-6-винилпиримидина (пример 27b, 2,71 г) в смеси толуол/CH2Cl2 (33 мл). После завершения прибавления смесь перемешивали дополнительно в течение 40 минут. Смесь разбавляли EtOAc и промывали водой (2x) и насыщенным раствором соли. Органический слой сушили (MgSO4) и концентрировали при пониженном давлении. Указанное в заголовке соединение очищали хроматографией на силикагеле с использованием смеси гептан/CH2Cl2=1/1 (об/об) в качестве элюента.
Выход: 1,42 г
MS-ESI: [M+H]+=487,2
ТСХ: Rf=0,5, силикагель, гептан/EtOAc=3/2 (об/об)
(d). Этил 5-амино-2-метилтио-4-(3-нитро-фенил)-7,8-дигидрохиназолин-6-карбоксилат
Раствор трет-бутил этил {2-[5-циано-2-метилтио-4-(3-нитро-фенил)пиримидин-6-ил]этил}малоната (пример 27c, 1,40 г) в CH2Cl2 (15 мл) охлаждали до 0°С. Добавляли по каплям раствор SnCl4 (1 M в СН2Cl2, 11,5 мл), ледяную баню удаляли и раствор перемешивали дополнительно в течение 30 минут при комнатной температуре. Добавляли воду (64 мл) и EtOAc (64 мл) и смесь интенсивно перемешивали до растворения всех твердых веществ. Органическую фазу промывали водой и насыщенным раствором соли, сушили (MgSO4) и концентрировали при пониженном давлении, получая указанное в заголовке соединение в виде неочищенного продукта.
Выход: 1,19 г (неочищенный)
MS-ESI: [M+H]+=387,2
ТСХ: Rf=0,5, силикагель, гептан/EtOAc=3/2 (об/об)
(e). Этил 5-амино-2-метилтио-4-(3-нитрофенил)хиназолин-6-карбоксилат
Раствор неочищенного этил 5-амино-2-метилтио-4-(3-нитрофенил)-7,8-дигидрохиназолин-6-карбоксилата (пример 27d, 1,19 г) в CH2Cl2 (31 мл) охлаждали до 0°C. Добавляли по каплям раствор DDQ (1,14 г) в толуоле (31 мл), ледяную баню удаляли и раствор перемешивали дополнительно в течение 30 минут при комнатной температуре. Смесь разбавляли СН2Cl2 (примерно 100 мл) и промывали насыщенным водным раствором NaHCO3 (3×100 мл) и насыщенным раствором соли (2×50 мл). Объединенные водные слои повторно экстрагировали CH2Cl2. Объединенные органические слои сушили (MgSO4) и концентрировали при пониженном давлении. Указанное в заголовке соединение очищали хроматографией на силикагеле с использованием смеси гептан/EtOAc=9/1 до 3/2 (об/об) в качестве элюента.
Выход: 735 мг
MS-ESI: [M+H]+=385,2
ТСХ: Rf=0,5, силикагель, гептан/EtOAc=3/2 (об/об)
(f). Этил 5-амино-2-метилтио-4-(3-аминофенил)хиназолин-6-карбоксилат
К смеси этил 5-амино-2-метилтио-4-(3-нитрофенил)хиназолин-6-карбоксилата (пример 27e, 1,54 г) и SnCl2-2H20 (4,52 г) в 1,4-диоксане (35 мл) добавляли EtOH (35 мл) и концентрированную водную HCl (690 мкл). Реакционную смесь перемешивали при 90°C в течение 5 часов. После охлаждения до комнатной температуры и концентрирования при пониженном давлении остаток суспендировали в EtOAc (35 мл). Смесь доводили до pH 10 добавлением 2 M NaOH и добавляли ТГФ и насыщенный раствор соли. Полученную смесь перемешивали в течение 40 минут, после чего органический слой отделяли, сушили (MgSO4) и концентрировали при пониженном давлении. Указанное в заголовке соединение очищали хроматографией на силикагеле с использованием смеси гептан/EtOAc=9/1 до 3/2 (об/об) в качестве элюента.
Выход: 818 мг
MS-ESI: [M+H]+=355,2
ТСХ: Rf=0,3, силикагель, гептан/EtOAc=3/2 (об/об)
(g). 5-амино-2-метилтио-4-(3-аминофенил)хиназолин-6-карбоновая кислота
Раствор 5-амино-2-метилтио-4-(3-аминофенил)хиназолин-6-карбоксилата (пример 27f, 658 мг) в 1,4-диоксане обрабатывали водным раствором KOH (2 M, 4,2 мл) при 70°C в течение 18 часов. После охлаждения реакционной смеси до комнатной температуры, ее подкисляли до pH 1 с использованием 4 н. HCl. Смесь экстрагировали CH2Cl2 (3x). Объединенные органические слои сушили (MgSO4) и концентрировали при пониженном давлении, получая неочищенное указанное в заголовке соединение.
Выход: 215 мг
MS-ESI: [M+H]+=327,2
ТСХ: Rf=0,3, силикагель, гептан/EtOAc=3/2 (об/об)
(h) Трет-бутил 5-амино-2-метилтио-4-(3-аминофенил)хиназолин-6-карбоксамид
Преобразование 5-амино-2-метилтио-(3-аминофенил)хиназолин-6-карбоновой кислоты (пример 27g, 192 мг) в соответствующий трет-бутиламид осуществляли в соответствии с методикой, описанной в примере 1e. Указанное в заголовке соединение очищали хроматографией на силикагеле с использованием смеси гептан/EtOAc=9/1 до 3/2 (об/об) в качестве элюента.
Выход: 243 мг
MS-ESI: [M+H]+=382,2
ВЭЖХ: Rt=6,57 мин, колонка Luna C-18 (смотри пример 1e), элюент H2O/CH3CN=45/55 до 0/100 (об/об) в течение 20 минут
Пример 28
Трет-бутил 5-амино-2-метилтио-4-(3-(2-(морфолин-4-ил)ацетамидо)фенил)хиназолин-6-карбоксамид
(a). Трет-бутил 5-амино-2-метилтио-4-(3-(2-бромацетамидо)фенил)хиназолин-6-карбоксамид
К суспензии трет-бутил 5-амино-2-метилтио-4-(3-аминофенил)хиназолин-6-карбоксамида (пример 27h, 791 мг) в CH2Cl2 (60 мл) добавляли DIPEA (1,08 мл), с последующим медленным прибавлением бромацетилхлорида (242 мкл) в CH2Cl2 (20 мл). Через 40 минут при комнатной температуре реакционную смесь промывали насыщенным водным раствором NHCO3 (3x), затем сушили (MgSO4) и концентрировали при пониженном давлении. Неочищенное указанное в заголовке соединение использовали без дополнительной очистки на следующей стадии.
Выход: 1,20 г (неочищенный)
MS-ESI: [M+H]+=504,2
ТСХ: Rf=0,4, силикагель, гептан/EtOAc=3/2 (об/об)
(b). Трет-бутил 5-амино-2-метилтио-4-(3-(2-(морфолин-4-ил)ацетамидо)фенил)хиназолин-6-карбоксамид.
К раствору трет-бутил 5-амино-2-метилтио-4-(3-(2-бромацетамидо)фенил)хиназолин-6-карбоксамида (пример 28a, 88 мг) в ацетонитриле добавляли морфолин (148 л) и смесь перемешивали в течение 18 часов. По завершении данного времени добавляли CH2Cl2 (15 мл) и смесь промывали насыщенным водным раствором NaHCO3. Органический слой сушили (MgSO4) и концентрировали в вакууме. Указанное в заголовке соединение очищали хроматографией на силикагеле с использованием смеси CH2Cl2/МеОН=1/0 до 9/1 (об/об) в качестве элюента. Указанное в заголовке соединение лиофилизовали из смеси ацетонитрила и воды, содержащей 1,5 эквивалента HCl.
Выход: 82 мг (HCl соль)
MS-ESI: [M+H]+=509,2
ВЭЖХ: Rt=13,00 мин, колонка Luna C-18 (смотри пример 1e), элюент H2O/CH3CN=75/25 до 0/100 (об/об) в течение 20 минут.
Пример 29
Трет-бутил 5-амино-2-метилтио-4-(3-((N-(трет-бутил)глицинил)амино)фенил)хиназолин-6-карбоксамид
Взаимодействие трет-бутиламина (275 мкл) с трет-бутил 5-амино-2-метилтио-4-(3-(2-бромацетамидо)фенил)хиназолин-6-карбоксамидом (пример 28a, 130 мг) осуществляли согласно способу, описанному в примере 28b. Указанное в заголовке соединение первоначально очищали хроматографией на силикагеле с использованием смеси гептан/EtOAc=3/2 (об/об) в качестве элюента и затем с помощью ВЭЖХ с использованием колонки Luna C-18 и следующего градиента: CH3CN/0,1% водн. ТФУК=10/90 до 90/10 (об/об) в течение 30 минут. Указанное в заголовке соединение затем лиофилизовали из смеси 1,4-диоксана и водн. HCl.
Выход: 28 мг (HCl соль)
MS-ESI: [M+H]+=495,4
ВЭЖХ: Rt=12,93 мин, колонка Luna C-18 (смотри пример 1e), элюент фосфатный буфер 50 мМ pH 2,1/H2O/CH3CN=10/70/20 до 10/10/80 (об/об) в течение 20 минут.
Пример 30
Этил 5-амино-2-метилтио-4-(3-нитрофенил)-7-гидрокси-пиридо[2,3-d]пиримидин-6-карбоксилат
(a). 6-Амино-5-циано-2-метилтио-4-(3-нитрофенил)пиримидин
Раствор 6-хлор-5-циано-4-(3-нитрофенил)-2-метилтиопиримидина (пример 9b, 10,0 г) обрабатывали гидроксидом аммония (28% NH3 в воде, 15 мл) и смесь перемешивали в течение ночи. Образовавшиеся кристаллы собирали фильтрованием и промывали водой. Продукт сушили при 50°C в вакууме, получая указанное в заголовке соединение.
Выход: 8,9 г
MS-ESI: [M+H]+=288,2
ТСХ: Rf=0,3, силикагель, гептан/EtOAc=3/2 (об/об)
(b). Диэтил 2-(амино-[6-амино-2-метилтио-4-(3-нитрофенил)пиримидин-5-ил]метилен)малонат
К суспензии 6-амино-5-циано-2-метилтио-4-(3-нитрофенил)пиримидина (пример 30a, 5,74 г) в 1,2-дихлорпропане (200 мл) добавляли диэтилмалонат (9,1 мл). Смесь охлаждали до 0°C и добавляли по каплям раствор SnCl4 (14 мл) в 1,2-дихлорпропане (50 мл). После завершения прибавления суспензию кипятили с обратным холодильником в течение 18 часов. Смесь охлаждали до комнатной температуры и после осаждения твердых веществ 1,2-дихлорпропан осторожно декантировали. Полученные твердые вещества перемешивали с EtOAc (300 мл) и водой (300 мл) до полного растворения. Органический слой промывали водой (500 мл) и насыщенным раствором соли (500 мл), сушили (MgSO4) и концентрировали в вакууме. Указанное в заголовке соединение очищали хроматографией на силикагеле с использованием смеси гептан/EtOAc=1/0 до 3/2 (об/об) в качестве элюента.
Выход: 3,78 г
MS-ESI: [M+H]+=448,4
ТСХ: Rf=0,2, силикагель, гептан/EtOAc=3/2 (об/об)
(c). Этил 5-амино-2-метилтио-4-(3-нитрофенил)-7-гидрокси-пиридо[2,3-d]пиримидин-6-карбоксилат
Суспензию диэтил 2-(амино-[6-амино-2-метилтио-4-(3-нитрофенил)пиримидин-5-ил]метилен)малоната (пример 30b, 1,34 г) в дифениловом эфире (30 мл) нагревали в токе азота при 240°C в течение 2 часов. После охлаждения смеси до комнатной температуры, добавляли гептан (200 мл) и твердые вещества собирали фильтрованием. Указанное в заголовке соединение очищали хроматографией на силикагеле с использованием смеси CH2Cl2/ацетон=1/0 до 4/1 (об/об) в качестве элюента.
Выход: 590 мг
MS-ESI: [M+H]+=402,4
ТСХ: Rf=0,3, силикагель, CH2Cl2/ацетон=9/1 (об/об)
Пример 31
Трет-бутил 5-амино-2-фенил-4-(3-((тиоморфолин-4-ил)карбониламино)фенил)тиено[2,3-d]пиримидин-6-карбоксамид
(a). 5-Циано-4-(3-нитрофенил)-2-фенил-6-гидроксипиримидин
Смесь гидрохлорида бензамидина (16,4 г), 3-нитробензальдегида (15,1 г), этил цианоацетата (11,2 мл) и карбоната калия (16,6 г) в абс. EtOH (250 мл) перемешивали при 60°C в течение 8 часов. Реакционную смесь охлаждали до 0°C на ледяной бане. Полученный осадок отфильтровывали, промывали абс. EtOH и нагревали в воде (100°C) до получения прозрачного раствора. Раствор охлаждали до 50°C, подкисляли до pH 2 добавлением 2 н. водн. HCl и охлаждали до 0°C на ледяной бане. Полученный осадок отфильтровывали и промывали ледяной водой. Оставшуюся воду удаляли совместным выпариванием с 1,4-диоксаном.
Выход: 15,0 г.
MS-ESI: [M+H]+=319,2
ТСХ: Rf=0,3, силикагель, ДХМ/MeOH=9/1 (об/об).
(b). 6-Хлор-5-циано-4-(3-нитрофенил)-2-фенил-пиримидин
POCl3 (50 мл) добавляли к перемешиваемому раствору 5-циано-4-(3-нитрофенил)-2-фенил-6-гидроксипиримидина (пример 31(a), 15,0 г) и диметиланилина (0,5 мл) в сухом 1,4-диоксане ч.д.a. (200 мл). Через 3 часа при 90°C теплую смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток растворяли в 1,4-диоксане и добавляли ледяную воду. Полученный осадок отфильтровывали и промывали водой. Оставшуюся воду удаляли совместным выпариванием с 1,4-диоксаном.
Выход: 15,8 г
MS-ESI: [M+H]+=337,4
ТСХ: Rf=0,8, силикагель, гептан/EtOAc=3/2 (об/об).
(c). Этил 5-циано-4-(3-нитрофенил)-2-фенил-6-(этоксикарбонилметилтио)пиримидин
DIPEA (8,71 мл) добавляли к перемешиваемому раствору этил 2-меркаптоацетата (5,15 мл) и 6-хлор-5-циано-4-(3-нитрофенил)-2-фенилпиримидина (пример 31(b), 15,8 г) в смеси EtOH (125 мл) и ДХМ (125 мл) в атмосфере азота. Через 2 часа при комнатной температуре, смесь разбавляли ДХМ до полного растворения, промывали 0,5 н. водн.HCl, сушили (MgSO4) и концентрировали при пониженном давлении.
Выход: 19,7 г
MS-ESI: [M+H]+=421,2,
ТСХ: Rf=0,7, силикагель, гептан/EtOAc=3/2 (об/об).
(d) Этил 5-амино-4-(3-нитрофенил)-2-фенил-тиено[2,3-d]пиримидин-6-карбоксилат.
DIPEA (20,0 мл) добавляли к перемешиваемому раствору этил 5-циано-4-(3-нитрофенил)-2-фенил-6-(этоксикарбонилметилтио)-пиримидина (пример 31(c), 19,7 г). в смеси абс. EtOH (100 мл) и толуола ч.д.a.(чистый для анализа) (100 мл). Через 48 часов при 100°C, смесь охлаждали до 0°C. Полученный осадок отфильтровывали, промывали охлажденным EtOH и сушили в вакууме при 40°C.
Выход: 17,0 г
MS-ESI: [M+H]=421,2
ТСХ: Rf=0,5, силикагель, гептан/EtOAc=3/2 (об/об).
(е) Этил 5-амино-4-(3-аминофенил)-2-фенил-тиено[2,3-d]пиримидин-6-карбоксилат
Раствор хлорида олова(II) (23,0 г) в абс. EtOH (250 мл) добавляли к раствору этил 5-амино-4-(3-нитрофенил)-2-фенил-тиено[2,3-d]пиримидин-6-карбоксилата (пример 31(d), 16,6 г) в 1,4-диоксане ч.д.a. (250 мл). Добавляли 37% водн. HCl (6,9 мл) и смесь кипятили с обратным холодильником (90°C) в течение 16 часов. Смесь оставляли охлаждаться до комнатной температуры и концентрировали при пониженном давлении. Остаток суспендировали в EtOAc (500 мл). Для достижения pH 10-11 добавляли 4 н. водн. NaOH. Смесь разбавляли добавлением насыщенного водн. NaCl. Органический слой отделяли, сушили (MgSO4) и концентрировали при пониженном давлении.
Выход: 17,0 г
MS-ESI: [M+H]+=421,2
ТСХ: Rf=0,5, силикагель, гептан/EtOAc=3/2 (об/об).
(f). 5-Амино-4-(3-аминофенил)-2-фенил-тиено[2,3-d]пиримидин-6-карбоновая кислота
Гидроксид калия (20,0 г) добавляли к раствору этил 5-амино-4-(3-аминофенил)-2-фенил-тиено[2,3-d]пиримидин-6-карбоксилата (пример 31(e), 17,0 г) в смеси 1,4-диоксана (210 мл) и воды (80 мл). Через 16 часов при 90°C, смесь охлаждали до 0°C. Полученный осадок отфильтровывали, суспендировали в воде (300 мл) и охлаждали до 0°C. Смесь подкисляли до pH 3 добавлением 2 н. водн. лимонной кислоты и перемешивали, поднимая температуру от 0°C до комнатной температуры в течение 2 часов. Полученный осадок отфильтровывали, промывали водой и сушили в вакууме при 40°C.
Выход: 13,3 г
MS-ESI: [M+H]+=363,0
ТСХ: Rf=0,2, силикагель, ДХМ/MeOH=95/5 (об/об).
(g). Трет-бутил 5-амино-4-(3-аминофенил)-2-фенил-тиено[2,3-d]пиримидин-6-карбоксамид
DIPEA (15,3 мл), трет-бутиламин (9,3 мл) и TBTU (14,1 г) добавляли к смеси 5-амино-4-(3-аминофенил)-2-фенил-тиено[2,3-d]пиримидин-6-карбоновой кислоты (пример 31(f), 13,3 г) в смеси ДХМ (250 мл) и ДМФ (50 мл) в атмосфере азота. Через 3 часа при комнатной температуре смесь разбавляли ДХМ и промывали насыщенным водн. NaHCO3, 0,1 н. водн. HCl и насыщенным водн. NaCl. Органический слой сушили (MgSO4) и концентрировали при пониженном давлении. Сырой продукт очищали хроматографией на силикагеле, с использованием смеси гептан/EtOAc=3/7 до 1/1 (об/об) в качестве элюента.
Выход: 14,7 г
MS-ESI: [M+H]+=418,4
ТСХ: Rf=0,4, силикагель, гептан/EtOAc=3/2 (об/об).
(h) Трет-бутил 5-амино-2-фенил-4-(3-(п-нитро-фенокси-карбониламино)фенил)тиено[2,3-d]пиримидин-6-карбоксамид
Трет-бутил 5-амино-2-фенил-4-(3-аминофенил)тиено[2,3-d]пиримидин-6-карбоксамид (пример 31(g), 2,0 г) растворяли в сухом CH2Cl2 (20 мл). Впоследствии добавляли по каплям раствор п-нитро-фенилхлорформиата (520 мг) в сухом СН2Cl2 (10 мл) и реакционную смесь перемешивали при комнатной температуре. Через 3 часа реакционную смесь промывали Н2O. Органический слой сушили (MgSO4) и концентрировали при пониженном давлении.
Выход: 2,9 г
MS-ESI: [M+H]+=583,2
ТСХ: Rf=0,6, силикагель, гептан/EtOAc=1/1 (об/об).
(i). Трет-бутил 5-амино-2-фенил-4-(3-((тиоморфолин-4-ил)карбониламино)фенил)тиено[2,3-d]пиримидин-6-карбоксамид
Тиоморфолин (300 мкл) добавляли к раствору трет-бутил 5-амино-2-фенил-4-(3-(п-нитро-феноксикарбониламино)фенил)-тиено[2,3-d]пиримидин-6-карбоксамида (пример 31(h), 150 мг) в дихлорметане (5 мл) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Впоследствии, реакционную смесь разбавляли CH2Cl2 и промывали H2O. Органический слой концентрировали при пониженном давлении. Указанное в заголовке соединение очищали с помощью ВЭЖХ с использованием колонки Luna C-18 и следующего градиента: H2O/CH3CN=80/20 до 0/100 (об/об) в течение 45 минут. Указанное в заголовке соединение затем лиофилизовали из смеси 1,4-диоксана и Н2О.
Выход: 89 мг
MS-ESI: [M+H]+ =547,2
ВЭЖХ: Rt=11,71 мин, колонка Luna C-18(2), 3 мкм, 100 x 2,0 мм, УФ детектирование=210 нм, температура печи = 40°C, поток = 0,25 мл/мин, элюент фосфатный буфер 50 мМ pH 2,1/вода/ACN=10/30/60 до 10/5/85 (об/об/об), время выполнения = 20 минут.
Пример 32
Трет-бутил 5-амино-2-фенил-(3-((N,N-диметиламино)карбониламино)фенил)тиено[2,3-d]пиримидин-6-карбоксамид
Гидрохлорид диметиламина (150 мг) добавляли к раствору N,N-диизопропилэтиламина (DIPEA, 0,50 мл) и трет-бутил 5-амино-2-фенил-4-(3-(п-нитро-феноксикарбониламино)фенил)тиено[2,3-d]пиримидин-6-карбоксамида (пример 31(h), 250 мг) в дихлорметане (5 мл) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Далее, реакционную смесь разбавляли CH2Cl2 и промывали H2O. Органический слой концентрировали при пониженном давлении. Указанное в заголовке соединение очищали с помощью ВЭЖХ с использованием колонки Luna C-18 и следующего градиента: H2O/CH3CN=80/20 до 0/100 (об/об) в течение 45 минут. Указанное в заголовке соединение затем лиофилизовали из смеси 1,4-диоксана и H2О.
Выход: 75 мг
MS-ESI: [M+H]+=489,2
ВЭЖХ: Rt=19,58 мин, колонка Luna C-18(2), 3 мкм, 100×2,0 мм, УФ детектирование = 210 нм, температура печи = 40°C, поток = 0,25 мл/мин, элюент фосфатный буфер 50 мМ pH 2,1/вода/ACN=10/60/30 до 10/5/85 (об/об/об), время выполнения = 20 минут.
Пример 33
Трет-бутил 5-амино-2-фенил-4-(3-((морфолин-4-ил)карбониламино)фенил)тиено[2,3-d]пиримидин-6-карбоксамид
Морфолин (250 мг) добавляли к раствору трет-бутил 5-амино-2-фенил-4-(3-(п-нитро-феноксикарбониламино)фенил)тиено[2,3-d]пиримидин-6-карбоксамида (пример 31(h), 150 мг) в дихлорметане (5 мл) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Далее, реакционную смесь разбавляли СН2Cl2 и промывали H2O. Органический слой концентрировали при пониженном давлении. Указанное в заголовке соединение очищали с помощью ВЭЖХ с использованием колонки Luna C-18 и следующего градиента: H2О/CH3CN=80/20 до 0/100 (об/об) в течение 45 минут. Указанное в заголовке соединение затем лиофилизовали из смеси 1,4-диоксана и H2O.
Выход: 63 мг
MS-ESI: [M+H]+=489,2
ВЭЖХ: Rt=19,39 мин, колонка Luna C-18(2), 3 мкм, 100×2,0 мм, УФ детектирование = 210 нм, температура печи = 40°C, поток = 0,25 мл/мин, элюент фосфатный буфер 50 мМ pH 2,1/вода/ACN=10/60/30 до 10/5/85 (об/об/об), время выполнения = 20 минут.
Пример 34
CHO-LH и CHO-FSH биоактивность in vitro
LH агонистическую активность соединений исследовали на клетках яичника китайского хомячка (CHO) стабильно трансфектированных человеческим LH рецептором и со-трансфектированных цАМФ отвечающим элементом (CRE)/промотором, направляющим экспрессию люциферазного репортерного гена светлячка. Связывание лиганда с Gs-связанным LH рецептором будет приводить к увеличению цАМФ, что, в свою очередь, будет индуцировать повышенную трансактивацию люциферазной репортерной конструкции. Люциферазный сигнал оценивали количественно с использованием счетчика люминесценции. Для исследуемых соединений рассчитывали значения ЕС50 (концентрация тестируемого соединения, вызывающая полу-максимальное (50%) стимулирование). С этой целью использовали программное обеспечение GraphPad PRISM, версия 3.0 (GraphPad Software Inc., San Diego). Результаты показали, что значение ЕС50 для соединений примеров 9, 11, 12, 13, 14, 25 и 27 находилось в диапазоне между 10-6 и 10-7 M. Соединения примеров 1, 2, 3, 4, 5, 17, 22, 26, 28, 29, 31 и 33 продемонстрировали значения EC50 в диапазоне между 10-7 и 10-8 M, тогда как значения EC50 для соединений примеров 7, 15, 16, 18, 21, 23 и 32 были ниже 10-8 M.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ТИЕНО[2,3-D]ПИРИМИДИНА И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ НАРУШЕНИЙ ФЕРТИЛЬНОСТИ | 2002 |
|
RU2298011C2 |
| ГЛИЦИН-ЗАМЕЩЕННЫЕ ТИЕНО[2,3-D]ПИРИМИДИНЫ С ОБЪЕДИНЕННОЙ LH И FSH АГОНИСТИЧЕСКОЙ АКТИВНОСТЬЮ | 2002 |
|
RU2294331C2 |
| БИЦИКЛИЧЕСКИЕ ГЕТЕРОАРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ LH АГОНИСТОВ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2000 |
|
RU2248979C2 |
| 2-ОКСА-5-АЗАБИЦИКЛО[2.2.1]ГЕПТАН-3-ИЛЬНЫЕ ПРОИЗВОДНЫЕ | 2015 |
|
RU2697651C2 |
| ФЕНОКСИМЕТИЛЬНЫЕ ПРОИЗВОДНЫЕ | 2016 |
|
RU2746481C1 |
| ЗАМЕЩЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СУЛЬФОНАМИДНЫЕ СОЕДИНЕНИЯ, ПОЛЕЗНЫЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ TRPA 1 | 2014 |
|
RU2675792C2 |
| ПИРИДАЗИНОНОВЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ФОСФОИНОЗИТИД-3-КИНАЗ | 2015 |
|
RU2695374C2 |
| НЕКОТОРЫЕ ИНГИБИТОРЫ ПРОТЕИНКИНАЗЫ | 2015 |
|
RU2671494C2 |
| ПРОИЗВОДНЫЕ ДИГИДРОПИРИДИНА | 2005 |
|
RU2372337C2 |
| ЗАМЕЩЕННЫЕ ПИРРОЛЫ, АКТИВНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗ | 2013 |
|
RU2666538C2 |
Изобретение относится к новым бициклическим гетероароматическим соединениям общей формулы (I) 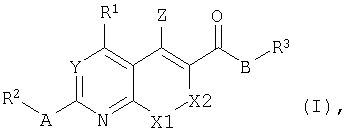 где R1 представляет фенил, необязательно замещенный NHR5 или OR5; R2 представляет С1-С4алкил или фенил; R5 представляет фенилкарбонил, С4-С6 гетероциклоалкилкарбонил, C2-C8 алкенилсульфонил и др.; Y представляет N; Z представляет NH2 или ОН; А представляет S или связь; В представляет N(H) или О; X1-Х2 представляет С=С, NH-C(O), C=N и др. Указанные соединения обладают агонистической активностью в отношении LH рецептора и могут найти применение в медицине. 4 н. и 6 з.п. ф-лы.
где R1 представляет фенил, необязательно замещенный NHR5 или OR5; R2 представляет С1-С4алкил или фенил; R5 представляет фенилкарбонил, С4-С6 гетероциклоалкилкарбонил, C2-C8 алкенилсульфонил и др.; Y представляет N; Z представляет NH2 или ОН; А представляет S или связь; В представляет N(H) или О; X1-Х2 представляет С=С, NH-C(O), C=N и др. Указанные соединения обладают агонистической активностью в отношении LH рецептора и могут найти применение в медицине. 4 н. и 6 з.п. ф-лы.
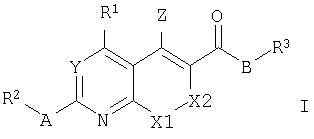
где R1 представляет собой фенил, необязательно замещенный NHR5 или OR5;
R2 представляет собой С1-С4алкил или фенил;
R3 представляет собой С1-С8алкил;
R5 представляет собой фенилкарбонил, С4-С6гетероциклоалкил-карбонил, С2-С8алкенилсульфонил, С2-С8алкеноксикарбонил, фенилсульфонил, фениламинокарбонил, фенилоксикарбонил, С1-С8алкил, С1-С8алкилкарбонил, С1-С8алкилсульфонил, C1-C8 (ди)алкиламинокарбонил, С1-С8алкоксикарбонил, алкильная группа в которых необязательно может быть замещена заместителем, выбранным из С4-С6гетероциклоалкила, фенила, С1-С8алкоксикарбонила, (ди) [С1-С3алкоксиС1-С3алкил]амино или C1-C8 (ди) алкиламино;
Y представляет собой N;
Z представляет собой NH2 или ОН;
А представляет собой S или связь;
В представляет собой N(H) или О;
X1-Х2 представляет собой С=С, NH-C(O), С=N, N=C или дополнительно S, если R5 представляет собой С1-С8алкилсульфонил, фенилсульфонил, C1-C8 (ди)алкиламинокарбонил, фениламинокарбонил, C1-С8алкоксикарбонил, фенилоксикарбонил, С4-С6гетероциклоалкил-карбонил, С2-С8алкенилсульфонил или С2-С8алкеноксикарбонил.
| ТИЕНОПИРИМИДИНОВЫЕ ПРОИЗВОДНЫЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2142275C1 |
| ПРОИЗВОДНЫЕ АНЕЛЛИРОВАННОГО ДИГИДРОПИРИДИНА ИЛИ ИХ СОЛИ С ФИЗИОЛОГИЧЕСКИ ПЕРЕНОСИМЫМИ КИСЛОТАМИ И СРЕДСТВО, БЛОКИРУЮЩЕЕ НЕСЕЛЕКТИВНЫЕ КАТИОННЫЕ КАНАЛЫ | 1993 |
|
RU2127736C1 |
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
Авторы
Даты
2006-03-10—Публикация
2001-09-17—Подача