Область техники, к которой относится изобретение
Изобретение относится к области биотехнологии и молекулярной биологии, а также может использоваться для доставки генотерапевтических средств к месту их действия.
Уровень техники
В последние годы, в связи с развитием генетической инженерии, все более актуальным становится создание генотерапевтических препаратов [1]. При этом одним из основных аспектов, сдерживающих широкое распространение таких препаратов в клинической практике, является сложность доставки генетических конструкций в клетки. Основными способами доставки рекомбинантных ДНК в клетки эукариот являются: использование вирусных и вирусоподобных систем, полимерных материалов, катионных липидов [2, 3, 4, 5]. Использование вирусных векторов и систем доставки, основанных на вирусоподобных частицах, дает хорошие результаты, однако их применение нежелательно ввиду возможности встраивания рекомбинантной ДНК в геном реципиента [1]. В связи с этим широкое распространение получила доставка рекомбинантной ДНК с помощью липофекции. Однако известные в настоящее время протоколы трансфекции с применением липосом обладают низкой специфичностью и малой эффективностью, хотя и используются в ряде современных клинических протоколов генной терапии [6]. Повышения эффективности трансфекции клеток можно добиться путем конденсации рекомбинантной ДНК при помощи каких-либо вспомогательных агентов [6]. Одним из типов таких вспомогательных соединений могут служить ДНК-связывающие белки.
Sloots и Wels ([7] - ближайший аналог) в качестве такого ДНК-связывающего и конденсирующего белка использовали рекомбинантный белок HMGB2 человека, полученный путем гетерологичной экспрессии соответствующего гена в Escherichia coli. При предварительной обработке плазмидной ДНК рекомбинантным HMGB2 перед липофекцией уровень трансфекции клеток возрастал в различных экспериментах от 15 до 55 раз.
Кроме этого подходящими кандидатами для использования в качестве вспомогательных при трансфекции белков могли бы оказаться полипептиды группы Нu. Эти белки характерны для всех бактерий, они обладают высоким сродством к ДНК и способны существенно компактизовать ее [8]. Также важным свойством Нu-белков является их слабая иммуногенность.
В связи с этим целью настоящего изобретения стало получение ДНК-связывающего Нu-белка Acholeplasma laidlawii для использования его в целях конденсации плазмидной ДНК при липофекции клеток эукариот.
Поставленная цель достигается путем конструирования плазмидного вектора, содержащего последовательности гена Нu-белка A. laidlawii (ACLH), введения этой плазмиды в культуру клеток Е. coli, экспрессии клонированного гена, наработкой рекомбинантного белка, его очистки, инкубации плазмидной ДНК с препаратом рекомбинантного белка и трансфекции обработанной ДНК клеток НЕК293.
В описываемом изобретении используется нуклеотидная последовательность гена Нu-белка Acholeplasma laidlawii [9]. Отличительной особенностью этого полипептида является его относительно небольшой размер и способность эффективно связывать и конденсировать двуцепочечную ДНК. Аминокислотная последовательность белка ACLH приведена на рисунке 1.
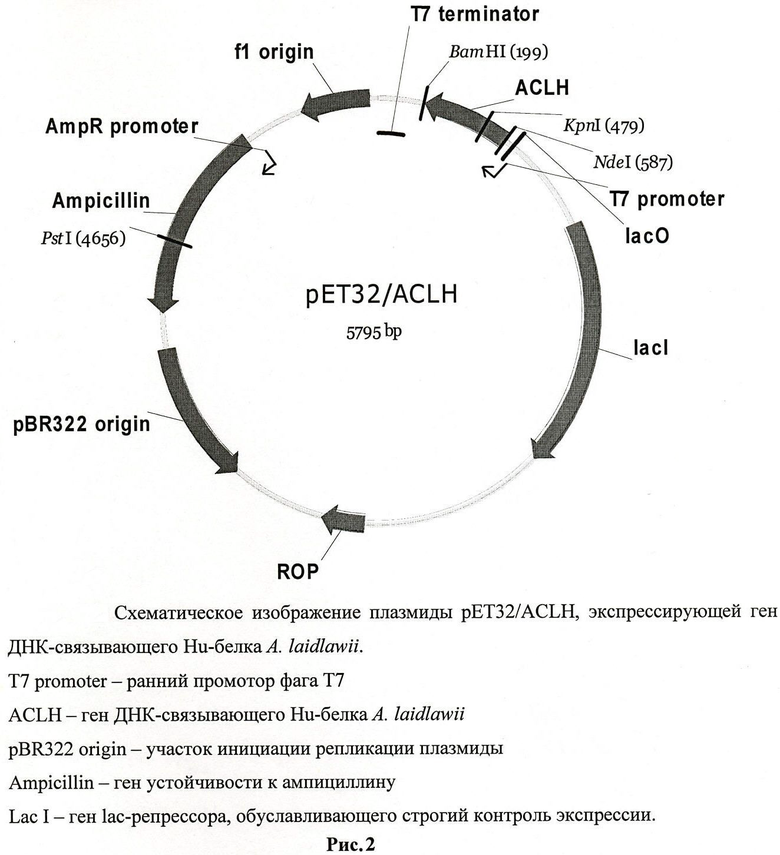
Последовательность гена синтезируется путем ПЦР-амплификации соответствующего участка геномной ДНК A. laidlawii штамма PG-8A с использованием подбираемых и синтезируемых олигонуклеотидов (синтез производится на автоматическом синтезаторе нуклеиновых кислот ASM-700 (Биоссет, Россия)). Полученный фрагмент ДНК клонируется в составе плазмидного вектора рЕТ32а (Novagen, США) по сайтам рестрикции KpnI и BamHI. Таким образом, сконструированный вектор имеет в своем составе ген Нu-белка A. laidlawii, находящийся под контролем раннего промотора фага Т7. Помимо этого в 5'-концевой части гена в одной рамке считывания с последовательностью ACLH находится участок, кодирующий синтез гексагистидинового пептида, обуславливающего последующую очистку рекомбинантного белка с помощью аффинной хроматографии. Полученный экспрессионный вектор называется pET32/ACLH (рисунок 2).
Плазмидой pET32/ACLH трансформируется штамм Е. coli B834(DE3) (Novagen, США). Выросшие на селективной агаризованной среде LB с ампициллином колонии переносятся в жидкую питательную среду 2xYT и культивируются при 37°С до оптической плотности OD600~0,8. После этого к культуре добавляют индуктор экспрессии изопропил-β,D-галактотиопиранозид до концентрации 0,1 мМ и культивируют бактерии при 30°С в течение 3 часов. После этого клетки собирают центрифугированием, ресуспендируют в лизирующем буфере (0,1М NaH2PO4 pH 7,4; 0,3M NaCl; 20 mM имидазол) и разрушают при помощи ультразвукового дезинтегратора. После этого лизат центрифугируют 45 минут при 40000g. Полученный лизат наносят на колонку с никель-сефарозой HisTrap (GE Healthcare, США) и проводят аффинную очистку рекомбинантного белка на хроматографической системе АКТА FPLC (GE Healthcare, США). Элюцию очищенного препарата белка проводят буфером того же состава, содержащим 300 мМ имидазола. Чистоту препарата определяют методом денатурирующего электрофореза в 15% полиакриламидном геле с последующим окрашиванием Coomassii G250 (GE Healthcare, США).
Раскрытие изобретения
Поскольку другими авторами было показано, что предварительная обработка используемой для трансфекции эукариотических клеток плазмиды ДНК-связывающим и конденсирующим белком способствует значительному увеличению эффективности последующей липофекции, исследуется возможность применения в качестве повышающего эффективность трансфекции реагента рекомбинантного Нu-белка Acholeplasma laidlawii, выделенного из Е. coli. Авторами реализуется следующая схема эксперимента.
1. Трансфицирующий вектор pEGFP-N1 (Clontech, США), несущий в своем составе ген репортерного зеленого флуоресцирующего белка под контролем раннего промотора цитомегаловируса, обрабатывается очищенным рекомбинантным белком ACLH в различных молярных соотношениях.
2. Подготовленным таким образом препаратом плазмидной ДНК производится трансфекция культуры клеток НЕК293 (АТСС № CRL-1573) с использованием липофектамина 2000 (Invitrogen, США).
3. Через 24 часа после трансфекции производится подсчет количества трансфицированных клеток в сравнении с контролем (трансфицированные необработанным вектором pEGFP-N1 клетки) с помощью флуоресцентной микроскопии.
Пример реализации изобретения. Увеличение эффективности трансфекции линии клеток НЕК293 плазмидой pEGFP-N1 после ее предварительной конденсации рекомбинантным белком ACLH.
1. Очищенный вектор pEGFP-N1 смешивают с раствором рекомбинантного белка ACLH в молярном соотношении 1:10 и инкубируют 10 минут при комнатной температуре. Об эффективности взаимодействия плазмидной ДНК с белком судят по задержке прохождения связанного вектора в ходе электрофореза в 1% агарозном геле по сравнению с контролем.
2. Трансфекцию проводят с использованием липофектамина 2000 (Invitrogen, США). В одной пробирке к 1 мкг обработанной плазмидной ДНК добавляют 15 мкл среды MEM без сыворотки. В другой пробирке к 15 мкл среды MEM без сыворотки добавляют 5 мкл липофектамина. Перемешивают осторожным пипетированием, содержимое пробирок объединяют и инкубируют при комнатной температуре 15 мин. Далее смесь ДНК/липофектамин добавляют к клеткам.
3. Через 24 часа клетки промывают фосфатно-солевым буфером (ФСБ; 1,7 мМ KH2PO4, 5,2 mM Na2HPO4, 150 mM NaCl, pH 7,4) и фиксируют метанолом. Подсчет эффективности трансфекции (не менее 50 полей зрения) проводят с использованием микроскопа Eclipse E800 (Nikon, Япония) при увеличении ×400. Результаты приведены на Рис.3.
Литература
1. Sinkovics JG.// Int J Oncol. 2009. V.35(3). P.441-65.
2. Felgner PL, Gadek TR, Holm M. // Proc Natl Acad Sci USA. 1987. V.84. P.7413-7417.
3. Miller AD. // Angew Chem Int Ed Engl. 1998. V.37. P.1768-1785.
4. Lollo CP, Banaszczyk MG, Mullen PM. // Methods Mol Med. 2002. V.69. P.1-13.
5. Zaric V, Weltin D, Erbacher P, Remy JS, Behr JP, Stephan D.// J Gene Med. 2004. V.6. P.176-184.
6. Жданов Р.И. // Вопр. Биол. Мед. Фарм. Химии. 1999. №4. С.3-6.
7. Sloots A. Wels WS. // FEBS Journal. 2005. V.272. P.4221-4236.
8. Kamashev D. Rouviere-Yaniv J. // EMBO J. 2000. V.19. P.6527-6535.
9. GenBank: ABX81485.1 (http://www.ncbi.nlm.nih.gov/protein/161985836).


Изобретение относится к области биотехнологии и молекулярной биологии. Способ конденсации плазмидной ДНК предусматривает смешивание плазмидной ДНК с конденсирующим агентом в молярном соотношении 1:10. В качестве конденсирующего агента используют рекомбинантный ДНК-связывающий Нu-белок Acholeplasma laidlawii. Способ позволяет повысить эффективность трансфекции эукариотических клеток плазмидной ДНК. Изобретение может быть использовано в научных исследованиях и для доставки генотерапевтических агентов в клетки эукариот. 5 ил.
Способ конденсации плазмидной ДНК для трансфекции эукариотических клеток, реализуемый путем смешивания плазмидной ДНК с конденсирующим агентом в молярном соотношении 1:10, отличающийся тем, что в качестве конденсирующего агента используется рекомбинантный ДНК-связывающий Нu-белок Acholeplasma laidlawii, полученный из Escherichia coli, контроль эффективности конденсации осуществляется по задержке прохождения плазмидной ДНК в агарозном геле.
| Sloots A | |||
| et al., "Recombinant derivatives of the human high-mobility group protein HMGB2 mediate efficient nonviral gene delivery", FEBS J | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| KAMASHEV D | |||
| et al., "The histone-like protein HU binds specifically to DNA recombination and repair intermediates", EMBO J | |||
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| СПОСОБ МНОЖЕСТВЕННОГО ПАРАЛЛЕЛЬНОГО СКРИНИНГА СПЕЦИФИЧНОСТИ СВЯЗЫВАНИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ СОЕДИНЕНИЙ С НУКЛЕИНОВЫМИ КИСЛОТАМИ С ИСПОЛЬЗОВАНИЕМ БИОЧИПА (ВАРИАНТЫ) | 2000 |
|
RU2182708C2 |
Авторы
Даты
2012-10-20—Публикация
2009-10-07—Подача