Изобретение относится к области медицины, а именно к клеточной и молекулярной технологии, и может быть использовано в медицинских исследованиях в кардиологии для изучения клеточного состава в атеросклеротических бляшках с целью выявления иммунологических механизмов их созревания и разрыва.
Сложность строения атеросклеротических бляшек известна со времен Вирхова [Вирхов Р. Целлюлярная патология, в применении к микроскопической анатомии нормальных и ненормальных: пер. с нем. Чт. 16. - М, В типографии Каткова и К., 1859. - С. 480], когда было выяснено, что в их состав входят различные клеточные компоненты, в том числе большое количество иммунных и гладкомышечных клеток. При этом общепринятая теория о том, что развитие атеросклеротической бляшки происходит при отложении в сосудистой стенке инородной субстанции - модифицированных липопротеинов, не могла объяснить клеточную гетерогенность бляшек. В связи с этим была сформулирована альтернативная гипотеза R. Ross и L. Harker [Faggiotto A, Ross R, Harker L. Studies of hypercholesterolemia in the nonhuman primate. I. Changes that lead to fatty streak formation. Arteriosclerosis. - 1984. - №4. - P. 323-340; Ross R, Harker L. Hyperlipidemia and atherosclerosis. Science. - 1976. - №193. - P. 1094-1100] о том, что пусковым фактором атеросклероза является повреждение эндотелия, сопровождающееся адгезией к его поверхности лейкоцитов и тромбоцитов. Моноциты проходят через эндотелиальную выстилку и превращаются в макрофаги. Параллельно происходит миграция гладкомышечных клеток из медии в субэндотелий и изменение их фенотипа (дедифференцировка). Предполагается, что вначале иммунная система пытается уничтожить чужеродный объект, в частности путем его фагоцитоза макрофагами [Kruth HS Sequestration of aggregated low-density lipoproteins by macrophages. Curr Opin Lipidol. - 2002. - №13. - P. 483-488]. Макрофаги поглощают липопротеиды, однако это приводит к гибели самих фагоцитов и формированию очага некроза [Geng YJ, Libby Р Progression of atheroma: A struggle between death and procreation. Arterioscler Thromb Vase Biol. - 2002. - №22. - P. 1370-1380], сопровождаемого образованием капсулы. Дальнейшее развитие атеросклеротической бляшки определяется активностью иммунного ответа, в частности воспалением.
Вклад воспаления в развитие атеросклероза обсуждается со времен Рудольфа Вирхова, однако его решающая роль в росте и разрушении бляшек стала признаваться сравнительно недавно. Воспаление - это сложное явление, включающее миграцию реактивных клеток, в частности лимфоцитов и моноцитов, и их многоступенчатую активацию с последующим выбросом различных цитокинов.
Известно, что содержание многих провоспалительных цитокинов в крови коррелирует со смертностью у больных коронарной болезнью сердца [Libby Р, Okamoto Y, Rocha VZ, Folco E. Inflammation in atherosclerosis: transition from theory to practice. Circ J. - 2010. - №74. - P. 213-220; Stefanadi E, Tousoulis D, Papageorgiou N, Briasoulis A, Stefanadis C. Inflammatory biomarkers predicting events in atherosclerosis. Curr Med Chem. - 2010. - №17. - P. 1690-1707]. Так, было показано, что повышение содержания определенной группы лимфоцитов в крови связано с увеличением частоты сердечнососудистых событий у пациентов с ИБС, ревматоидным артритом, сахарным диабетом и хронической почечной недостаточностью [Libby P. Role of inflammation in atherosclerosis associated with rheumatoid arthritis. Am J Med. - 2008. - №121. - P. S21-S31; Liuzzo G, Biasucci LM, Trotta G, Brugaletta S, Pinnelli M, Digianuario G, Rizzello V, Rebuzzi AG, Rumi C, Maseri A, Crea F. Unusual CD4_CD28null T lymphocytes and recurrence of acute coronary events. J Am Coll Cardiol. - 2007. - №50. - P. 1450-1458; Giubilato S, Liuzzo G, Brugaletta S, Pitocco D, Graziani F, Smaldone C, Montone RA, Pazzano V, Pedicino D, Biasucci LM, Ghirlanda G, Crea F. Expansion of CD4+CD28null T-lymphocytes in diabetic patients: exploring new pathogenetic mechanisms of increased cardiovascular risk in diabetes mellitus. Eur Heart J. - 2011. - №32. - P. 1214-1226]. He только системное воспаление, но и локальный удаленный воспалительный процесс влияет на состояние атеросклеротических бляшек. Например, была выявлена связь заболеваемости периодонтитом и коронарным атеросклерозом [Humphrey LL, Fu R, Buckley DI, Freeman M, Helfand M. Periodontal disease and coronary heart disease incidence: a systematic review and meta-analysis. J Gen Intern Med. - 2008. - №23. - P. 2079-2086]. Еще более важен тот факт, что воспаление в бляшке может вызывать ее рост и разрыв покрышки, приводя к таким клиническим проявлениям, как нестабильная стенокардия или острый инфаркт миокарда.
Как и воспаление любой другой локализации, воспаление в бляшке характеризуется инфильтрацией и активацией клеток иммунной системы [Naruko Т, Ueda М, Haze К, van der Wal AC, van der Loos CM, Itoh A, Komatsu R, Ikura Y, Ogami M, Shimada Y, Ehara S, Yoshiyama M, Takeuchi K, Yoshikawa J, Becker AE. Neutrophil infiltration of culprit lesions in acute coronary syndromes. Circulation. - 2002. - №106. - P. 2894-2900; Taleb S, Tedgui A, Mallat Z. Regulatory T-cell immunity and its relevance to atherosclerosis. J Intern Med. - 2008. - №263. - Р. 489-199]. Однако детальный анализ состояния отдельных клеток в бляшках до настоящего времени не был проведен за исключением традиционного иммуногистохимического анализа. Гистохимический анализ выявил, что в осложненных бляшках, полученных в ходе каротидной эндартерэктомии, содержится больше лимфоцитов [Rossmann A, Henderson В, Heidecker В, Seiler R, Fraedrich G, Singh M, Parson W, Keller M, Grubeck-Loebenstein B, Wick G. T-cells from advanced atherosclerotic lesions recognize hHSP60 and have a restricted T-cell receptor repertoire. Exp Gerontol. - 2008. - №43. - P. 229-237] и дендритных клеток [Erbel С, Sato К, Meyer FB, Kopecky SL, Frye RL, Goronzy JJ, Weyand CM. Functional profile of activated dendritic cells in unstable atherosclerotic plaque. Basic Res Cardiol. - 2007. - №102. - P. 123-132], чем в контрольных образцах артерий.
Несмотря на большое количество клинических и экспериментальных данных об образовании, созревании и разрыве атеросклеротических бляшек, механизмы этих явлений остаются во многом неизвестными. Показано, что системное воспаление играет важную роль в этом процессе [Tahara N, Imaizumi Т, Virmani R, Narula J. Clinical feasibility of molecular imaging of plaque inflammation in atherosclerosis. J Nucl Med. - 2009. - №50. - P. 331-334].
Гистохимический анализ [Gewaltig J, Kummer M, Koella C, Cathomas G, Biedermann ВС.Requirements for CD8 T-cell migration into the human arterial wall. Hum Pathol. - 2008. - №39. - P. 1756-1762] и полимеразная цепная реакция с ДНК, выделенной из атеросклеротических бляшек [De Palma R, Del Galdo F, Abbate G, Chiariello M, Calabro R, Forte L, Cimmino G, Papa MF, Russo MG, Ambrosio G, Giombolini C, Tritto I, Notaristefano S, Berrino L, Rossi F, Golino P. Patients with acute coronary syndrome show oligoclonal T-cell recruitment within unstable plaque: evidence for a local, intracoronary immunologic mechanism. Circulation. - 2006. - №113. - P. 640-646], выявили активацию Т-клеток в нестабильной бляшке, что значительно расширило наше знание факторов, связанных с нестабильностью бляшек.
Однако этих знаний недостаточно, поскольку полимеразная цепная реакция дает возможность выявить лишь общие характеристики Т-лимфоцитов, а при помощи иммуногистохимии можно определять только один-два клеточных антигена.
Для более полной характеристики лимфоцитов и их роли в иммунологических механизмах созревания и разрыва бляшки необходимо проанализировать лимфоцитарные фенотипы и их распределение в отдельных бляшках. Единственная современная технология, позволяющая выполнить эти задачи - это многоцветная проточная цитометрия. Одним из основных препятствий к использованию современной технологии многоцветной проточной цитометрии для всестороннего изучения параметров клеток, содержащихся в бляшке, является сложность выделения клеток из бляшки без повреждения поверхностных клеточных маркеров, определяющих фенотип клеток.
Известен способ выделения лимфоцитов из ткани атеросклеротических бляшек сонных артерий. В способе использовался метод разделения ткани на мелкие блоки, которые в дальнейшем помещались в культивационную среду на 4-6 часов с различными активаторами миграции лимфоцитов. Далее отдельные лимфоциты, мигрировавшие за время культивирования из ткани в среду, собирались, окрашивались на поверхностные маркеры CD4 и CD8 и подвергались исследованию с помощью проточной цитометрии [Curry MP, Norris S, Golden-Mason L, Doherty DG, Deignan T, Collins C, Traynor O, McEntee GP, Hegarty JE, O’Farrelly C. Isolation of lymphocytes from normal adult human liver suitable for phenotypic and functional characterization. J Immunol Methods. - 2000. - №242 (1-2). - Р. 21-31]. В данном способе не проводился ферментативный гидролиз тканей и фильтрация клеток, анализировались только клетки, мигрировавшие в культуральную среду. Это давало возможность не отрабатывать методику выделения живых клеток и отделения их тканевого дебриса, так как проводился анализ только клеток из жидкостной среды, а не из самой ткани образца. Кроме того в способе рассматривались поверхностные маркеры лишь двух указанных типов. Поэтому данный способ не дает возможности оценить полный клеточный состав атеросклеротических бляшек, так как исследовались только отдельные CD4 и CD8 лимфоциты, которые самостоятельно мигрировали в культивационную среду.
Кроме того, известен способ выделения лимфоцитов из ткани миндалин и цервико-вагинального тракта [Saba Е, Grivel JC, Vanpouille С, Brichacek В, Fitzgerald W, Margolis L, Lisco A. HIV-1 sexual transmission: early events of HIV-1 infection of human cervico-vaginal tissue in an optimized ex vivo model. Mucosal Immunol. - 2010. - №3 (3). - P. 280-290], где участки лимфоидной ткани, препарированные на мелкие блоки, подвергались обработке коллагеназой IV типа в концентрации 5 мг/мл в течение 30-90 мин. Далее суспензия клеток окрашивалась различными комбинациями флуоресцентно-меченых антител для определения всех типов клеток, выделенных из лимфоидной ткани, после чего проводился анализ клеточного состава с помощью проточной цитометрии. Однако в данном способе клетки выделялись из образцов тканей солидных иммунных органов, которые имели малую плотность и малую гетерогенность, в связи с чем дополнительная обработка высококонцентрированными ферментами и фильтрация образцов исследователям не требовалась. Однако подобный метод не позволит провести выделение всех типов клеток из высоко гетерогенной и плотно структурированной ткани атеросклеротических бляшек.
Описан также способ определения состава иммунных клеток, которые выделялись из ткани тонкой кишки свиней. В способе проводилась ферментативная обработка коллагеназой крупных участков тонкой кишки без ее дополнительного препарирования. В дальнейшем проводился анализ с помощью проточной цитометрии лимфоцитов, выделяющихся только из внутреннего гомогенного слоя клеток кишки [Solano-Aguilar GI, Vengroski KG, Beshah E, Lunney JK. Isolation and purification of lymphocyte subsets from gut-associated lymphoid tissue in neonatal swine. - 2000. - №241 (1-2). - P. 185-199]. Так же, как и в предыдущем способе, выделение клеток в данном исследовании проводилось из внутреннего гомогенного слоя мягкотканной структуры кишки, что позволило применять смесь ферментов в низких концентрациях и не проводить дополнительной фильтрации образцов. Однако как и предыдущий, описанный метод не позволит провести выделение всех типов клеток из высоко гетерогенной и плотно структурированной ткани атеросклеротических бляшек.
Таким образом, по данным литературы существующие на сегодняшний день методы анализа клеточного состава тканей с помощью проточной цитометрии позволяют либо анализировать небольшое количество клеток, которые были выделены не из тканей, а из культуральной среды при кратковременном культивировании ткани; либо проводить выделение с помощью малоактивных ферментов без дополнительной фильтрации и анализировать клетки из мягкотканных гомогенных структур, таких как лимфоидные органы кишки, лимфатические узлы. Однако важно отметить, что структура атеросклеротических бляшек крайне гетерогенна, бляшки содержат не только различные клеточные компоненты, но и большое число внеклеточных структур (кристаллы солей кальция, холестериновые кислоты, некротические массы). В связи с этим выделение всех клеток из данных структур требует отработки этапов фильтрации образцов для увеличения точности анализа всех клеток бляшек с помощью проточной цитометрии.
Описан способ определения клеточного состава атеросклеротических бляшек сонных артерий человека с помощью проточной цитометрии [Bonanno Е, Mauriello A, Partenzi A, Anemona L, Spagnoli LG. Flow cytometry analysis of atherosclerotic plaque cells from human carotids: a validation study. Cytometry. - 2000. - №39 (2). - Р. 158-165]. В данном способе в качестве материала для определения клеточного состава атеросклеротических бляшек использовали операционный материал, полученный при проведении операции каротидной эндартеректомии (атеросклеротические бляшки). Бляшки нарезали на кусочки и затем подвергали ферментативной обработке коллагеназой I (250 ед/мл) в течение ночи при 37°C. Суспензию клеток фильтровали через 150 мкм нейлоновый фильтр и окрашивали для проточной цитометрии моноклональными антителами к ассоциированным с цитоплазматической мембраной антигенам в течение 30 минут при 4°C, после чего проводили проточную цитометрию. Недостаток данного способа заключается в том, что после препарирования ткани атеросклеротических бляшек и ферментативной обработки проводилась фильтрация клеточной суспензии с помощью 150 мкм нейлонового фильтра, что не позволит достоверно разделять отдельные типы иммунных клеток при анализе с высокой эффективностью, а также использовать современные проточные цитометры с ограничением диаметра сортировочного сопла.
Известен способ определения иммунных клеток из атеросклеротических бляшек человека с помощью проточной цитометрии [Новый метод анализа клеточного состава атеросклеротических бляшек / Гривель Ж.-Ш. [и др.] // Креативная кардиология - 2012. - №1. - С. 26-40], заключающийся в том, что в качестве материала для определения клеточного состава атеросклеротических бляшек используют операционный материал, полученный при проведении операции каротидной эндартеректомии (атеросклеротические бляшки), который транспортируют в культуральной среде RPMI 1640 при комнатной температуре в течение не более 2 часов. От атеросклеротической бляшки отделяют фрагмент размером 2 мм, который фиксируют в 2% формалине. Остаток ткани нарезают на блоки размером 2 мм и подвергают ферментативной обработке. Кусочки бляшки лизируют коллагеназой IV (1,25 мг/мл) в присутствии 0,2 мг/мл ДНКазы I в течение 1 часа при 37°C при постоянном перемешивании. Суспензию клеток фильтруют через 100 мкм нейлоновый фильтр и отмывают в растворе PBS.
Из полученной клеточной суспензии берут 100 мкл для постановки негативного контроля. Для отделения живых клеток от мертвых остальные клетки ресуспензируют в растворе PBS и окрашивают специальным красителем в течение 15 минут в темноте при комнатной температуре, затем отмывают раствором PBS с 2% содержанием нормальной мышиной сыворотки. Затем суспензию клеток делят на необходимое количество пробирок, оставляя часть для анализа на живые/мертвые клетки, и окрашивают моноклональными для определения CD4 и CD8 Т-лимфоцитов, В-лимфоцитов, NK-клеток, а также степени дифференцировки и активации Т-лимфоцитов, в течение 15 минут в темноте при комнатной температуре. После окраски клетки отмывают раствором PBS, фиксируют в 1% растворе формальдегида в PBS, и анализируют на проточном цитометре (типа FACS Canto II, BD Biosciences, San Jose, CA). Ставятся одноцветные реакции компенсации для каждой окраски в каждом эксперименте, используя сферические микрочастицы. В качестве контроля для установки области анализа и подтверждения специфичности окраски используются те же комбинации антител, что и в эксперименте, но за вычетом одного из антител. При окончательном анализе используется перекрытие спектров различных флуорофоров с учетом аутофлуоресценции сигналов. Этот способ был выбран за прототип.
Недостаток данного способа заключается в сниженной точности отделения фракции живых клеток от мертвых, приводящей к снижению эффективности определения клеточного состава атеросклеротических бляшек. Применение при фильтрации нейлонового фильтра с размером пор 100 мкм не обеспечивает достаточно эффективного удаления фрагментов и агрегатов мертвых клеток, а также агрегатов липидных клеток и солей кальция, что приводит к очень высокой интенсивности аутофлуоресценции сигнала от большинства лазеров в образцах, которая мешает проведению анализа данных с помощью проточной цитометрии и снижает точность оценки клеточного состава атеросклеротических бляшек.
Кроме того, применение нейлонового фильтра с размером пор 100 мкм при подготовке суспензии клеток приводит к формированию крупных клеточных агрегатов, в связи с чем использование данной суспензии для анализа на проточных цитометрах современного поколения, имеющих диаметр сортировочного сопла для фокусировки потока жидкости менее 100 мкм, становится не возможным.
Задачей изобретения является повышение эффективности оценки состава иммунных клеток атеросклеротических бляшек.
Технический результат заключается в повышении эффективности выделения и точности определения популяции живых клеток, необходимых для исследования состава иммунных клеток из атеросклеротических бляшек на различных моделях проточного цитометра.
Это достигается за счет того, что при приготовлении клеточной суспензии используют нейлоновый фильтр с размером пор 40 мкм.
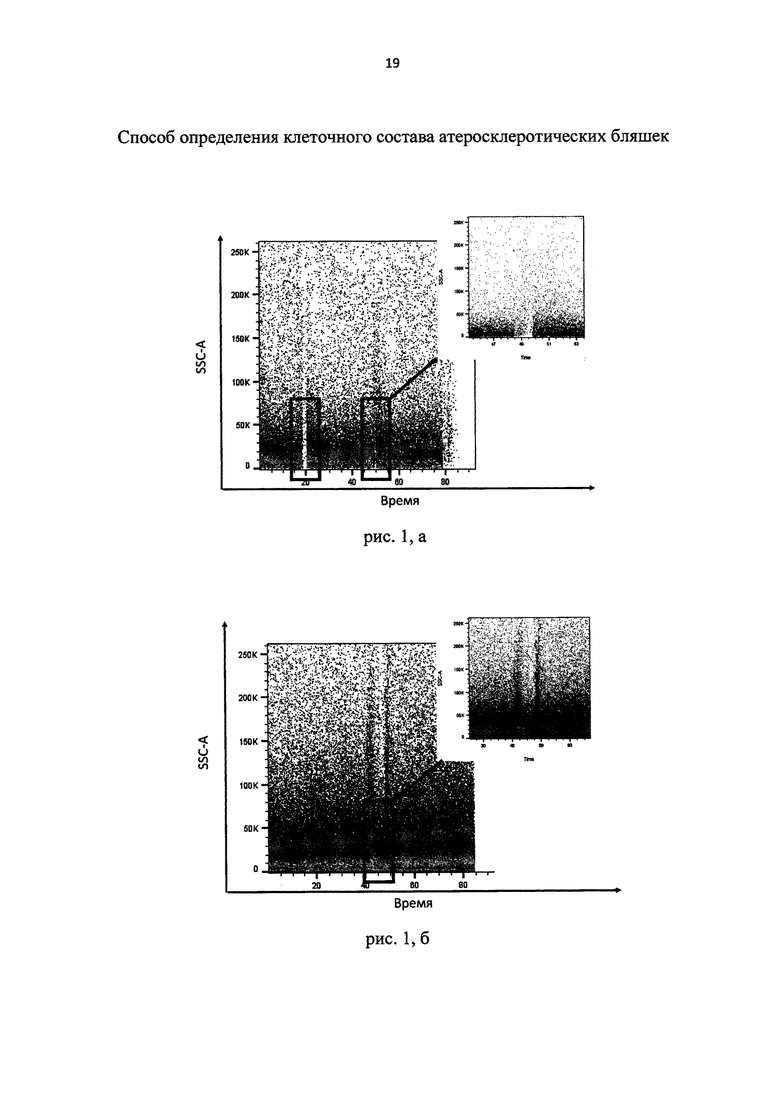
При прохождении через поры нейлонового фильтра с размером пор 40 мкм агрегаты клеток разбиваются на более мелкие структуры, чем при использовании фильтра с размерами пор 100 мкм, при этом через 40 мкм пору не проходят агрегаты фрагментов умерших клеток, а также солей кальция или жировой ткани адвентиции атеросклеротических бляшек. Уменьшение размера структур в суспензии делает возможным использование последнего поколения проточных цитометров-сортеров, обладающих сортировочным соплом с диаметром 70-100 мкм (Рис. 1, а - изображение потока жидкости проточного цитометра-сортера при анализе клеточной суспензии, фильтрованной с помощью 100 мкм нейлонового фильтра; рис. 1, б - изображение потока жидкости проточного цитометра-сортера при анализе клеточной суспензии, фильтрованной с помощью 40 мкм нейлонового фильтра). Как видно на рис. 1, а, при анализе клеточной суспензии, фильтрованной через 100 мкм фильтр, возникают моменты блокировки потока жидкости проточного цитометра клеточными агрегатами. При анализе клеточной суспензии, фильтрованной через 40 мкм фильтр, выделен фрагмент возможной остановки потока, однако при большем разрешении определено, что блокировка потока жидкости не происходит (Рис. 1, б).
Кроме того, удаление перечисленных структур из образцов клеток приводит к значительному уменьшению интенсивности аутофлуоресценции в спектре флуорохромов, сцепленных с анализируемыми антителами и их изотипами. При этом уровень флуоресценции изотипических контролей снижается до 5% от флуореценции позитивного сигнала (Табл. 1).
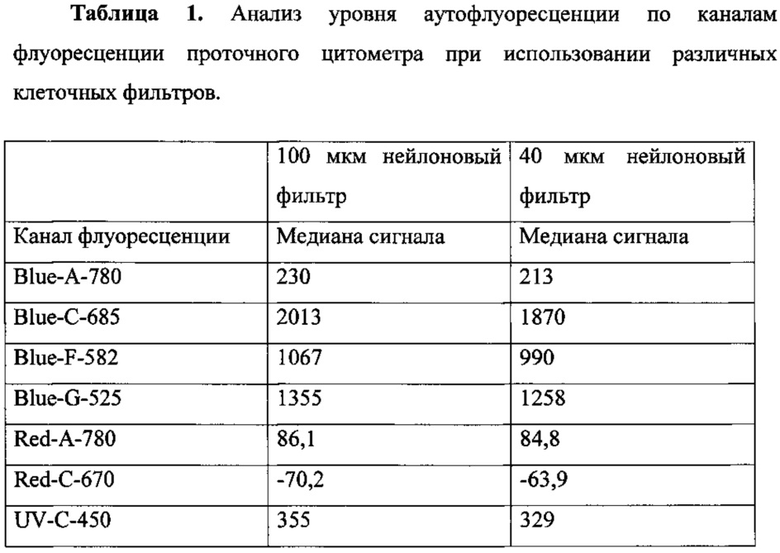

Как видно из табл. 1, уровень аутофлуоресценции снижается при использовании 40 мкм фильтра по всем каналам флуоресценции проточного цитометра. Таким образом, гораздо более высокой становится точность отделения по интенсивности флуоресцентного сигнала негативных событий от позитивных и более точная оценка количества живых клеток, несущих исследуемые поверхностные маркеры (Табл. 2).
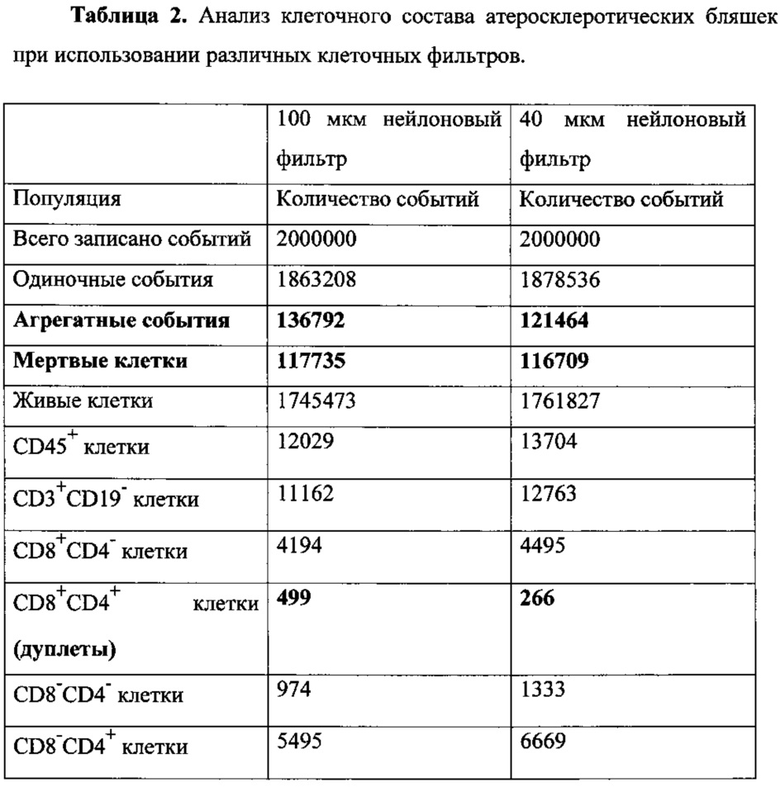
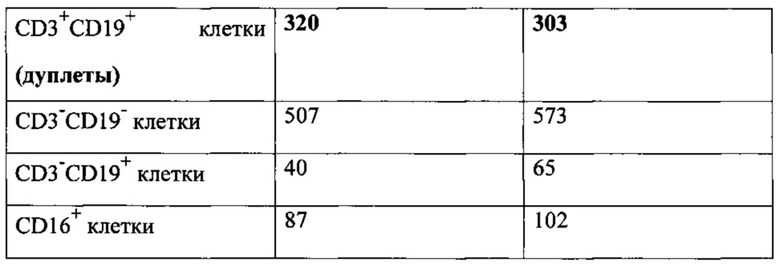
Как видно из табл. 2, количество агрегатов клеток, мертвых клеток, а также дуплетных событий становится значительно ниже при использовании 40 мкм фильтра по сравнению со 100 мкм фильтром.
Рисунки, поясняющие сущность изобретения:
рис. 1, а и б - изображение моментов остановки потока жидкости проточного цитометра-сортера при анализе клеточной суспензии.
Способ осуществляется следующим образом:
В качестве материала для выделения иммунных клеток из атеросклеротических бляшек используют операционный материал, полученный при проведении операции эндартерэктомии (атеросклеротические бляшки), которые транспортируют в среде RPMI 1640 при комнатной температуре в течение не более 2 часов. От атеросклеротической бляшки отделяют фрагмент размером 2 мм, который фиксируют в 2% формалине. Остаток ткани нарезают на блоки размером 2 мм и затем подвергают ферментативной обработке. Кусочки бляшки лизируют коллагеназой IV (1,25 мг/мл) в присутствии 0,2 мг/мл ДНКазы I в течение 1 часа при 37°C при постоянном перемешивании. Суспензию клеток фильтруют через 100 мкм нейлоновый фильтр и отмывают в растворе PBS. Из полученной клеточной суспензии берут 100 мкл для постановки негативного контроля. Для отделения живых клеток от мертвых остальные клетки ресуспензируют в растворе PBS и окрашивают специальным красителем в течение 15 минут в темноте при комнатной температуре, затем отмывают раствором PBS с 2% содержанием нормальной мышиной сыворотки. Затем суспензию клеток делят на необходимое количество пробирок, оставляя часть для анализа на живые/мертвые клетки, и окрашивают моноклональными для определения CD4 и CD8 Т-лимфоцитов, В-лимфоцитов, NK-клеток, а также степени дифференцировки и активации Т-лимфоцитов, в течение 15 минут в темноте при комнатной температуре. После окраски клетки отмывают раствором PBS, фиксируют в 1% растворе формальдегида в PBS, и анализируют на любом типе проточного цитометра (например, прибор FACS Aria II, BD Biosciences, San Jose, СА). Ставятся одноцветные реакции компенсации для каждой окраски в каждом эксперименте, используя сферические микрочастицы. В качестве контроля для установки области анализа и подтверждения специфичности окраски используются те же комбинации антител, что и в эксперименте, но за вычетом одного из антител. При окончательном анализе используется перекрытие спектров различных флуорофоров с учетом аутофлуоресценции сигналов.
Пример
В качестве источника исследуемого материала была взята атеросклеротическая бляшка из правой внутренней сонной артерии при операции эндартерэктомии у пациента мужского пола 69 лет. Бляшка была помещена в транспортную среду RPMI 1640. Образцы в течение 1,5 часов были доставлены в лабораторию. В лаборатории образец бляшки был помещен в чашку Петри, осмотрен и описан макроскопически, сфотографирован и в стерильных условиях порезан на блоки размером 2 мм. 1 кусочек был залит раствором 2% формалина для дальнейшего гистологического исследования. Остальные кусочки бляшки поместили в пробирки типа эппендорф, содержащие раствор коллагеназы IV (1,25 мг/мл) в присутствии 0,2 мг/мл ДНКазы I, инкубировали в течение 1 часа при 37°C при постоянном перемешивании. После этого клетки были профильтрованы через 40 мкм нейлоновый фильтр и отмыты в растворе PBS. Из полученной клеточной суспензии взято 100 мкл для негативного контроля. Остальные клетки ресуспензированы в растворе PBS и окрашены красителем Pacific Orange с реактивной аминогруппой (Invitrogen, Carlsbad, СА) в течение 15 минут в темноте, отмыты раствором PBS с 2% содержанием нормальной мышиной сыворотки. Клетки были поделены по 50 мкл для окраски комбинациями антител и для анализа на живые/мертвые клетки. Для окраски использовались следующие комбинации моноклональных антител, разведенных до оптимального титра: (1) CD45 Cy7-РЕ, CD3 Cy5.5-PerCp, CD4 eFluor780-APC, CD28 РЕ, CD27 FITC, CD197 АРС и CD45RA eFluor 450 для выявления популяций Т-клеток памяти и наивных Т-клеток; (2) CD45 Cy7-РЕ, CD3 Cy5.5-PerCp, CD4 eFluor780-APC, CD25 РЕ, CD146 FITC, CD38 АРС и HLA-DR Pacific blue для определения Т-клеточной активации; а также, (3) CD45 Cy7-РЕ, CD3 Cy5.5-PerCp, CD4 eFluor780-APC, CD 19 РЕ, CD16 FITC, CD56 АРС, CD8 eFluor450 для анализа Т-клеток, В-клеток и натуральных киллеров (NK). Окраска проводилась в 5 мл пробирках в течение 15 минут в темноте, затем клетки отмывались раствором PBS и фиксировались 1% раствором формалина. Также ставились одноцветные реакции компенсации для каждой окраски в каждом эксперименте, используя сферические микрочастицы CompBeads (Becton Dickinson). В качестве контроля для установки области анализа и подтверждения специфичности окраски использовались те же комбинации антител, что и в эксперименте, но за вычетом одного из антител. При окончательном анализе использовалось перекрытие спектров различных флуорофоров с учетом аутофлуоресценции сигналов.
При проведении фильтрации с 40 мкм порами общий фон аутофлуоресценции изотипических контролей составил менее 5% от флуоресценции позитивных событий.
При анализе с помощью проточной цитометрии живых клеток, выделенных их бляшки, были получены следующие результаты:
Количество лейкоцитов (CD45+ клеток): 457500 клеток на 1 мг ткани бляшки: гранулоциты - 17.10%, моноциты - 2.63%, лимфоциты - 31.50%.
Количество лимфоцитов: 144 113 клеток на 1 мг ткани бляшки:
Т-лимфоциты - 76.40% (110 102 клетки);
В-лимфоциты - 2.00% (288 клетки);
Натуральные киллеры - 17.80% (25 652 клетки): активированные - 10.10%, зрелые - 0.62%, незрелые - 0.00%);
NKT-клетки - 0.25% (358 клеток): CD4+% - 0.00%, CD8dim - 55.60%, CD8+% - 11.10%, NK-подобные Т-клетки - 33.30%).
При анализе дифференцировки Т-лимфоцитов:
наивные клетки: CD8 Naive - 0.89%, CD4 Naive - 2.15%;
клетки памяти:
центральные клетки памяти: CD8 Tcm - 25.90%, CD4 Tcm - 36.20%;
эффекторные клетки памяти:
CD8 Tem - 60.90% (Early differentiated - 33.80%, Terminally differentiated - 37.50%, Intermediate differentiated - 28.70%);
CD4 Tem - 30.30% (Early differentiated - 29.60%, Terminally differentiated - 7.99%, Intermediate differentiated - 62.41%).
При анализе активации Т-лимфоцитов:
CD8 CD25 - 16.00%, CD8 CD38 - 47.30% и CD8 HLA-DR - 66.00%;
CD4 CD25 - 30.10%, CD4 CD38 - 33.00% и CD4 HLA-DR - 52.20%.
Таким образом, нами была успешно исследована степень дифференцировки и активации всей популяции иммунных клеток, выделенных из ткани атеросклеротической бляшки.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ СОСТАВА ИНДИВИДУАЛЬНЫХ ВНЕКЛЕТОЧНЫХ ВЕЗИКУЛ В КРОВИ ЧЕЛОВЕКА | 2014 |
|
RU2583940C1 |
| МАРКЕРЫ АТЕРОСКЛЕРОЗА | 2005 |
|
RU2384847C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИМФОЦИТОВ ИЗ ТОНКОГО КИШЕЧНИКА МЫШИ | 2012 |
|
RU2514653C1 |
| ПРИМЕНЕНИЕ ЭКЗОСОМ РАСТЕНИЙ ДЛЯ ДЕМОНСТРАЦИИ МОДУЛИРУЮЩИХ ЭФФЕКТОВ НА КЛЕТКИ ИММУННОЙ СИСТЕМЫ | 2019 |
|
RU2806367C2 |
| СПОСОБ ПРИМЕНЕНИЯ ZOT ИЛИ ЗОНУЛИНА ДЛЯ ИНГИБИРОВАНИЯ АНТИГЕН-СПЕЦИФИЧЕСКОЙ ПРОЛИФЕРАЦИИ ЛИМФОЦИТОВ | 1999 |
|
RU2214271C2 |
| КОМПОЗИЦИЯ ДНК ДЛЯ ВЫЗОВА ИММУННОГО ОТВЕТА ПРОТИВ ОПУХОЛЕАССОЦИИРОВАННЫХ МАКРОФАГОВ | 2007 |
|
RU2459631C2 |
| ПРИМЕНЕНИЕ ИНГИБИТОРОВ СОХ-2 ДЛЯ ПРЕДУПРЕЖДЕНИЯ ИММУНОДЕФИЦИТА | 2001 |
|
RU2303452C2 |
| ЛЕЧЕНИЕ АУТОИММУННОГО ЗАБОЛЕВАНИЯ ПУТЕМ МОДУЛИРОВАНИЯ АКТИВНОСТИ АННЕКСИНА-1 (ЛИПОКОРТИНА-1) | 2009 |
|
RU2554801C2 |
| Способ оценки эффективности терапии in vitro и in vivo в мышиной экспериментальной модели имиквимод-индуцированного псориазоподобного дерматита | 2023 |
|
RU2829630C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СУБПОПУЛЯЦИОННОГО СОСТАВА КЛЕТОК КОЖИ И ПОЛУЧЕНИЯ ЦИТОИММУНОГРАММЫ КОЖИ | 2016 |
|
RU2630607C1 |
Изобретение относится к медицине, а именно к клеточной и молекулярной технологии, и может быть использовано в медицинских исследованиях в кардиологии для изучения клеточного состава в атеросклеротических бляшках с целью выявления иммунологических механизмов их созревания и разрыва. Способ заключается в заборе операционного материала, измельчении бляшки, ее ферментативной обработке, фильтрации, окрашивании клеточной суспензии для определения живых/мертвых клеток, затем в окрашивании моноклональными антителами, проведении проточной цитометрии, при приготовлении клеточной суспензии используют нейлоновый фильтр с размером пор 40 мкм. Применение изобретения обеспечивает повышение эффективности выделения и точности определения популяции живых клеток, необходимых для исследования состава иммунных клеток из атеросклеротических бляшек на различных моделях проточного цитометра. 1 ил., 2 табл., 1 пр.
Способ определения клеточного состава атеросклеротических бляшек, заключающийся в заборе операционного материала, измельчении бляшки, ее ферментативной обработке, фильтрации, окрашивании клеточной суспензии для определения живых/мертвых клеток, затем в окрашивании моноклональными антителами и проведении проточной цитометрии, отличающийся тем, что при приготовлении клеточной суспензии используют нейлоновый фильтр с размером пор 40 мкм.
| Новый метод анализа клеточного состава атеросклеротических бляшек / Гривель Ж | |||
| Ш | |||
| // Креативная кардиология | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| С | |||
| Прибор для получения стереоскопических впечатлений от двух изображений различного масштаба | 1917 |
|
SU26A1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ ЭКСПЛАНТОВ АТЕРОСКЛЕРОТИЧЕСКИХ БЛЯШЕК ex vivo | 2012 |
|
RU2515371C1 |
| СПОСОБ ПОЛУЧЕНИЯ КЛЕТОК И НЕКЛЕТОЧНЫХ ЭЛЕМЕНТОВ АТЕРОСКЛЕРОТИЧЕСКОЙ БЛЯШКИ | 2013 |
|
RU2552314C2 |
| А.А | |||
| Худяков и др | |||
| ПОЛУЧЕНИЕ ПРЕДШЕСТВЕННИКОВ КАРДИОМИОЦИТОВ ЧЕЛОВЕКА ИЗ ТКАНИ МИОКАРДА | |||
| БЮЛЛЛЕТЕНЬ ФЕДЕРАЛЬНОГО ЦЕНТРА СЕРДЦА, КРОВИ И ЭНДОКРИНОЛОГИИ ИМ | |||
| В.А | |||
| АЛМАЗОВА | |||
| Февраль, 2013, с | |||
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
| А | |||
| М | |||
| Лебедева и др | |||
| Атеросклеротические бляшки в системе ex vivo | |||
| Клеточная и молекулярная кардиология | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Зубчатое колесо со сменным зубчатым ободом | 1922 |
|
SU43A1 |
| Libby Р Inflammation in atherosclerosis | |||
| Nature | |||
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| Приспособление для нагревания воздуха теплотой отработавшего воздуха | 1924 |
|
SU420A1 |
| Запорный к лапан для тушения горящих нефтяных фонтанов | 1914 |
|
SU868A1 |
| Dollery CM, Libby P | |||
| Atherosclerosis and proteinase activation | |||
| Cardiovasc Res | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Vol | |||
| Способ приготовления пищевого продукта сливкообразной консистенции | 1917 |
|
SU69A1 |
| Р | |||
| ТАНК-ПАРОВОЗ | 1923 |
|
SU625A1 |
Авторы
Даты
2017-04-13—Публикация
2015-12-10—Подача