Изобретение относится к области органической химии и может найти применение в аналитической химии и биологических исследованиях.
При изучении физиологически активных соединений необходимы их равномерномеченые аналоги.
Известно, что замена атомов соединений на их меченые аналоги не приводит к изменению каких-либо свойств исходного соединения (Evans Е.А. - Tritium and its compounds London Butterworths, 1974, p. 48) [1].
Известен 3-(1-метилпирролидин-2-ил)пиридин формулы:
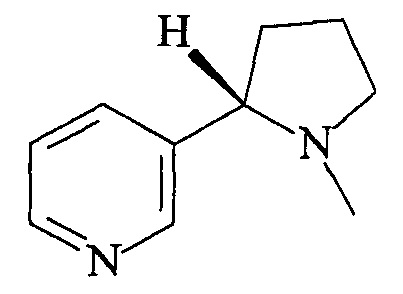
Данное соединение способствует выбросу адреналина, увеличивает уровень дофамина и действует как психостимулятор, кроме того, он стимулирует ПОМК-нейроны (Y.S. Mineur et al. // Science. 2011. V. 332. P. 1330-1332 [2]; T. Yoshida et al. // Physiol. Behav. 1994. V. 55. N1. P. 53-57 [3]).
В литературе приводятся методики получения специфически меченного дейтерием и тритием 3-(1-метилпирролидин-2-ил)пиридина, например, исходя из 5-бромо-производного 3-(1-метилпирролидин-2-ил)пиридина (M.K. Shigenaga et al. // J. Label. Comp. Radiopharm. 1987. vol. 24. N 6. P. 713-723 [4]), однако его равномерномеченный тритием и дейтерием аналог не описан.
Техническим результатом, достигаемым настоящим изобретением, является расширение ассортимента меченых аналогов физиологически активных соединений.
Достигается указанный технический результат получением равномерномеченного дейтерием или тритием 3-(1-метилпирролидин-2-ил)пиридин формулы:
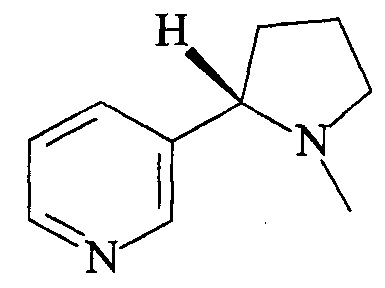
Ниже приведен пример реализации изобретения.
Пример I
Раствор 10 мг 3-(1-метилпирролидин-2-ил)пиридина в 0.1 мл метанола добавляли к 300 мг окиси алюминия и обрабатывали ультразвуком. Метанол удаляли упариванием на роторном испарителе и остаток лиофилизировали. Аликвоту сухой смеси механически перемешивали с 30 мг 5% Pd/CaCO3 (Флюка). Затем 100 мг смеси помещали в ампулу, которую вакуумировали до давления 0.1 Па, заполняли газообразным дейтерием до давления 333 гПа и выдерживали при температуре 95°C 5 мин. Избыток газообразного дейтерия удаляли вакуумированием. Вещество с катализатора экстрагировали метанолом (5×2 мл) и отделяли фильтрованием. Лабильный дейтерий удаляли несколько раз, растворяя вещество в метаноле (5×2 мл) и упаривая последний.
Анализ проводили на колонке ProntoSIL-120-5-C18 AQ DB-2003, 2×75 мм, 5 мкм, детектирование при 210 нм. Градиент метанола (0-60%), элюент А: 0.1% гептафтормасляная кислота в течение 12.5 минут при температуре 35°C, скорость 0.2 мл/мин, время удерживания 7.33 мин. Для сбора и обработки хроматографических данных использовалась система "МультиХром 1.5" (ЗАО "Амперсенд", Россия).
Масс-спектрометрические данные получали на приборе LCQ Advantage МАХ (Термоэлектрон, США), с ионизацией электрораспылением, прямым вводом раствора образца с концентрацией 10 мкг/мл в 0.1% уксусной кислоте и дальнейшей фрагментацией молекулярного пика в анализаторе методом ионных соударений при 35 эВ.
Выход искомого продукта 5-10%, среднее содержание 0.9 атома дейтерия на молекулу 3-(1-метилпирролидин-2-ил)пиридина.
Пример II
100 мг Смеси 3-(1-метилпирролидин-2-ил)пиридина, окиси алюминия и 5% Pd/CaCO3 (соотношение 1:30:3) помещали в ампулу, которую вакуумировали до давления 0.1 Па, заполняли газообразным тритием до давления 333 гПа и выдерживали при температуре 85°C 15 мин. Избыток газообразного трития удаляли вакуумированием. Вещество с катализатора экстрагировали метанолом (5×2 мл) и отделяли фильтрованием. Лабильный тритий удаляли несколько раз, растворяя вещество в метаноле (5×2 мл) и упаривая последний.
Радиоактивность выделенных продуктов реакции около 100 мКи, содержание 3-(1-метилпирролидин-2-ил)пиридина примерно 10%.
Препаративную хроматографию проводили в три этапа. Первый на колонке Kromasil 100 С18, 7 мкм, 8×150 мм, элюент А: МеОН - (25 мМ NH4H2PO4 pH 2.8 + 5 мМ октансульфонат натрия) (30:70), элюент Б: метанол, линейный градиент 0-100% В за 30 мин, скорость 2 мл/мин, время удерживания никотина 14.5 мин (радиохимическая чистота 65%). Второй на той же колонке, элюент А: метанол-вода-гептафтормасляная кислота (10:90:0.1), элюент Б: метанол, линейный градиент 0-100% В за 30 мин, скорость 2 мл/мин, время удерживания никотина 13.8 мин (радиохимическая чистота 90%). Третий на колонке Reprosil pur 120Sil 3 мкм, 4×150 мм, в режиме гидрофильной хроматографии (HILIC), элюент ацетонитрил-(5 мМ H3PO4 + 10 мМ AcONH4) (70:30), скорость 1 мл/мин, время удерживания никотина 5.4 мин. В результате получен препарат с радиохимической чистотой 97%, выходом 5-7%, молярной радиоактивностью 10 Ки/ммоль.
Таким образом, получено новое меченное тритием соединение.
| название | год | авторы | номер документа |
|---|---|---|---|
| РАВНОМЕРНО МЕЧЕННЫЙ ТРИТИЕМ [H]-14-ГИДРОКСИДАУНОМИЦИН АДРИАМИЦИНОНА | 2006 |
|
RU2305103C1 |
| РАВНОМЕРНОМЕЧЕННЫЙ ТРИТИЕМ АЛЬФА-ХЕДЕРИН | 2006 |
|
RU2326889C1 |
| РАВНОМЕРНОМЕЧЕННЫЙ ТРИТИЕМ ПИРО-Glu-His-Pro-NH | 2013 |
|
RU2513852C1 |
| РАВНОМЕРНО МЕЧЕННЫЙ ТРИТИЕМ (R)-(+)-[5-МЕТИЛ-3-(4-МОРФОЛИНИЛМЕТИЛ)-2,3-ДИГИДРО-[1,4]ОКСАЗИНО [2,3,4-hi]-6-ИНДОЛИЛ]-1-НАФТАЛИНИЛМЕТАНОН АЦЕТАТ | 2009 |
|
RU2404185C1 |
| РАВНОМЕРНОМЕЧЕННЫЙ ТРИТИЕМ (3aS,5S,6R,7aR,7bS,9aS,10R,12aS,12bS)-10-[(2S,3R,4R,5S)-3,4-ДИГИДРОКСИ-5,6-ДИМЕТИЛ-2-ГЕПТАНИЛ]-5,6-ДИГИДРОКСИ-7а,9а-ДИМЕТИЛГЕКСАДЕКАНГИДРО-3Н-БЕНЗО[c]ИНДЕНО[5,4-е]ОКСЕПИН-3-ОН | 2012 |
|
RU2499786C1 |
| РАВНОМЕРНО МЕЧЕННЫЙ ТРИТИЕМ 5-(1,1-ДИМЕТИЛГЕПТИЛ)-2-[5-ГИДРОКСИ-2-(3-ГИДРОКСИПРОПИЛ)ЦИКЛОГЕКСИЛ]ФЕНОЛ | 2009 |
|
RU2398755C1 |
| РАВНОМЕРНО МЕЧЕННЫЙ ТРИТИЕМ ТИЛОЗИН | 2008 |
|
RU2360896C1 |
| РАВНОМЕРНО МЕЧЕННЫЙ ТРИТИЕМ 2-АМИНО-4-[БЕТА-ГИДРОКСИЭТИЛАМИНО]АНИЗОЛ | 2005 |
|
RU2291142C1 |
| РАВНОМЕРНОМЕЧЕННАЯ ТРИТИЕМ [H]ТРАНС-3,7-ДИМЕТИЛ-9-(2,6,6-ТРИМЕТИЛ-3-ОКСО-1-ЦИКЛОГЕКСЕН-1-ИЛ)-2,4,6,8-НОНАТЕТРАЕНОВАЯ КИСЛОТА | 2006 |
|
RU2318806C1 |
| РАВНОМЕРНОМЕЧЕННЫЙ ТРИТИЕМ [Н]АМФОТЕРИЦИН В | 2006 |
|
RU2323224C1 |
Изобретение относится к новому равномерномеченному тритием 3-(1-метилпирролидин-2-ил)пиридину, имеющему молярную радиоактивность 10 Ки/ммоль формулы:
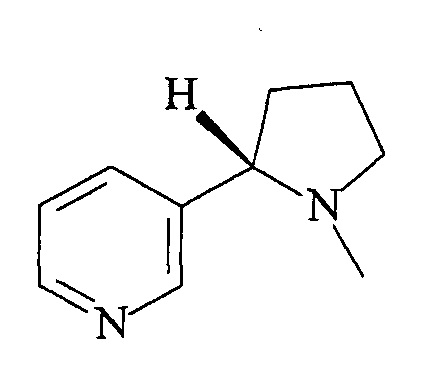
2 пр.
Равномерномеченный тритием 3-(1-метилпирролидин-2-ил)пиридин, имеющий молярную радиоактивность 10 Ки/ммоль формулы:
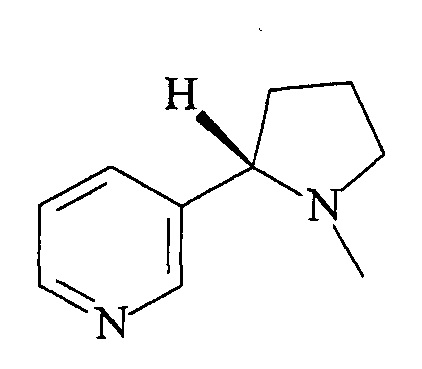
| Mark K | |||
| Shigenaga et al.,;Synthesis of specifically labeled (S)-nicotine-5-3H and (S)-cotinine-5-3H BY carrier free tritiolysis of the corresponding 5-bromo derivatives", Journal of Labelled Compounds and Radiopharmaceuticals, Volume 24, Issue 6, pages 713"723, June 1987 | |||
| US 20100125094, A1, 20.05.2010 | |||
| В.Дедек, И.Прайза: "Некоторые вопросы, связанные с правилами обозначения органических меченных соединений", Органические соединения, меченные радиоктивными изотопами, сборник докладов, ЧССР, май 1978 | |||
| ВЫСОКОМЕЧЕННЫЙ ТРИТИЕМ ДИГИДРОХЛОРИД [H]САКСИТОКСИНА | 2004 |
|
RU2277097C1 |
| Прибор с двумя призмами | 1917 |
|
SU27A1 |
| US 7576202 B2 | |||
| Способ использования делительного аппарата ровничных (чесальных) машин, предназначенных для мериносовой шерсти, с целью переработки на них грубых шерстей | 1921 |
|
SU18A1 |
Авторы
Даты
2017-05-23—Публикация
2014-05-20—Подача