Изобретение относится к области здравоохранения, в частности к контролю качества биологических лекарственных препаратов (БЛП) и может быть использовано для количественного определения глицина в БЛП, содержащих глицин в качестве вспомогательного вещества.
Глицин - незаменимая аминокислота, используемая в качестве стабилизатора при производстве препаратов крови.
Известны разные методы количественного определения аминокислот. Наиболее распространены хроматографические методы: ионообменная хроматография (ИОХ) [1], обращенно-фазовая высокоэффективная жидкостная хроматография (ОФ ВЭЖХ) [2-7], газовая хроматография (ГХ) [8]. Во всех вышеупомянутых методах присутствует стадия химической модификации аминокислоты. В газохроматографическом анализе это обусловлено тем, что аминокислоты в свободном виде представляют собой малолетучие соединения. Необходимость модификации аминокислоты при анализе аминокислот методами ИОХ и ОФ ВЭЖХ вызвана трудностями при их детектировании в свободном виде, так как растворы аминокислот, как правило, слабо поглощают ультрафиолетовый и видимый свет, не обладают собственной флуоресценцией, и их молекулы не имеют электроактивных групп.
Для разделения полярных соединений также применяется метод хроматографии гидрофильного взаимодействия (HILIC-хроматография) [9-12]. В качестве подвижной фазы в этом варианте хроматографии используются смеси ацетонитрила и различных буферных растворов. Неподвижными фазами, как правило, являются силикагели, модифицированные полярными группами (амино-, диольные, цианопропильные группы и т.д.).
Известен способ определения аминокислот в коллагене [13], состоящий в анализе содержания аминокислот без предварительной дериватизации. Определение содержания глицина проводят методом высокоэффективной гидрофильной жидкостной хроматографии на колонке TSK-GEL Amide 80 путем градиентного элюирования компонентов с использованием масс-спектрометрического детектора. Детекция проводится методом ионизации в электрическом поле. К недостаткам этого способа следует отнести использование градиентного элюирования, высокую стоимость оборудования, трудности в эксплуатации прибора, а, следовательно, и значительную себестоимость одного анализа, Данный способ имеет узкое применение для рутинного анализа.
Известен способ определения глицина в дерматологических препаратах для местного применения [14], состоящий в растворении образца в дихлорметане, выделении аминокислоты при помощи 1 н. раствора натрия гидроксида, предколоночной дериватизации с использованием фенилтиоизоцианата. Определение содержания глицина проводят методом высокоэффективной ОФ ВЭЖХ с УФ-детектированием при длине волны 245 нм на колонке LiChrospher 100 RP-18 путем градиентного элюирования компонентов. К недостаткам этого способа следует отнести высокую трудоемкость, связанную с дериватизацией образцов, использование градиентного элюирования, недостаточную специфичность и воспроизводимость, длительное время анализа, высокую стоимость реактивов.
В качестве прототипа был выбран способ определения аминокислот в плазме крови человека [15], состоящий в удалении белков плазмы осаждением 5% раствором хлорной кислоты и фильтрованием, предколоночной дериватизации с использованием 6-аминохинолин-N-гидроксисукцинимид карбамата. Определение содержания глицина проводят методом ОФ ВЭЖХ с УФ-детектированием (длина волны 248 нм) на колонке Nova-Pak путем градиентного элюирования компонентов. К недостаткам этого способа следует отнести сложную пробоподготовку, связанную с необходимостью удаления белка; высокую трудоемкость, связанную с необходимостью дериватизации образцов; относительную специфичность, связанную с образованием неспецифических продуктов дериватизации; высокую стоимость реактивов, используемых для дериватизации.
Техническим результатом изобретения является количественное определение глицина в БЛП методом гидрофильной высокоэффективной жидкостной хроматографии, упрощение способа и повышение его специфичности.
В данном тексте под термином специфичность [16] подразумевается способность аналитической методики однозначно оценивать определяемое вещество в присутствии сопутствующих компонентов.
Достижение технического результата обеспечивается благодаря следующим техническим решениям:
- исключение стадии дериватизации при осуществлении пробоподготовки образцов;
- предварительное удаление белка методом твердофазной экстракции на картриджах Amicon Ultra® при осуществлении пробоподготовки образцов;
- подбор хроматографической колонки и условий хроматографирования (режима элюирования, состава и скорости потока подвижной фазы, температуры термостата хроматографической колонки), позволяющих обеспечить эффективное отделение глицина от веществ, входящих в состав образца;
- подбор линейной области заявляемого способа, соответствующей содержанию глицина в БЛП.
В заявляемом изобретении способ количественного определения глицина в БЛП реализуется следующим образом.
Предварительное удаление белка в исследуемых препаратах проводится методом твердофазной экстракции на картриджах Amicon Ultra®.
Количественное содержание глицина определяют в сравнении со стандартными растворами с содержанием глицина в диапазоне концентраций от 1,2 до 3,6 мг/мл. Аналитический диапазон способа от 1,2 до 3,6 мг/мл выбирают в процессе исследования линейной области зависимости аналитического сигнала от концентрации, с учетом требований к содержанию глицина в препаратах. Аналитический диапазон способа включает в себя диапазон возможного содержания глицина в препарате от 12 до 36 мг/мл. Последующее разведение препарата в соотношении 1:10 приводит к концентрации глицина от 1,2 до 3,6 мг/мл.
I. Приготовление стандартных растворов с концентрацией глицина для оценки линейности 12-36 мг/мл:
1) Стандартный раствор глицина (концентрация 12 мг/мл)
Около 240 мг (точная навеска) стандартного образца глицина помещают в мерную колбу вместимостью 20 мл, добавляют около 15 мл воды очищенной, перемешивают и доводят водой очищенной до метки.
2) Стандартный раствор глицина (концентрация 18 мг/мл)
Около 360 мг (точная навеска) стандартного образца глицина помещают в мерную колбу вместимостью 20 мл, добавляют около 15 мл воды очищенной, перемешивают и доводят водой очищенной до метки.
3) Стандартный раствор глицина (концентрация 24 мг/мл)
Около 480 мг (точная навеска) стандартного образца глицина помещают в мерную колбу вместимостью 20 мл, добавляют около 15 мл воды очищенной, перемешивают и доводят водой очищенной до метки.
4) Стандартный раствор глицина (концентрация 30 мг/мл)
Около 600 мг (точная навеска) стандартного образца глицина помещают в мерную колбу вместимостью 20 мл, добавляют около 15 мл воды очищенной, перемешивают и доводят водой очищенной до метки.
5) Стандартный раствор глицина (концентрация 36 мг/мл)
Около 720 мг (точная навеска) стандартного образца глицина помещают в мерную колбу вместимостью 20 мл, добавляют около 15 мл воды очищенной, перемешивают и доводят водой очищенной до метки.
По 0,5 мл каждого из стандартных растворов глицина, полученных согласно пп. 1-5 раздела I, помещают на картридж Amicon Ultra® и центрифугируют при 16099 g при температуре 15°С в течение 40 мин.
0,1 мл каждого из фильтратов, полученных после центрифугирования, помещают в соответствующую виалу для хроматографирования объемом 1,5 мл. В виалы добавляют 0,9 мл подвижной фазы, перемешивают.
II. Приготовление раствора плацебо:
0,5 г стандарта иммуноглобулина человека (Biological Reference Preparation, Y0001512) помещают в мерную колбу вместимостью 5 мл, добавляют около 3 мл воды очищенной, перемешивают и доводят водой очищенной до метки.
0,5 мл полученного раствора помещают на картридж Amicon Ultra® и центрифугируют при 16099 g при температуре 15°С в течение 40 мин.
0,1 мл фильтрата, полученного после центрифугирования, помещают в виалу для хроматографирования объемом 1,5 мл. В ту же виалу добавляют 0,9 мл подвижной фазы, перемешивают.
III. Приготовление растворов для оценки специфичности, воспроизводимости и правильности заявляемого способа:
1) Раствор плацебо с концентрацией глицина 12 мг/мл
0,5 г стандарта иммуноглобулина человека (Biological Reference Preparation, Y0001512) помещают в мерную колбу вместимостью 5 мл, добавляют около 3 мл стандартного раствора глицина с концентрацией 12 мг/мл, перемешивают и доводят тем же раствором до метки.
2) Раствор плацебо с концентрацией глицина 24 мг/мл
0,5 г стандарта иммуноглобулина человека (Biological Reference Preparation, Y0001512) помещают в мерную колбу вместимостью 5 мл, добавляют около 3 мл стандартного раствора глицина с концентрацией 24 мг/мл, перемешивают и доводят тем же раствором до метки.
3) Раствор плацебо с концентрацией глицина 36 мг/мл
0,5 г стандарта иммуноглобулина человека (Biological Reference Preparation, Y0001512) помещают в мерную колбу вместимостью 5 мл, добавляют около 3 мл стандартного раствора глицина с концентрацией 36 мг/мл, перемешивают и доводят тем же раствором до метки.
По 0,5 мл каждого из растворов плацебо с добавкой глицина, полученных согласно пп. 1-3 раздела III, помещают на картридж Amicon Ultra® и центрифугируют при 16099 g при температуре 15°С в течение 40 мин.
0,1 мл каждого из фильтратов, полученных после центрифугирования, помещают в соответствующую виалу для хроматографирования объемом 1,5 мл. В виалы добавляют 0,9 мл подвижной фазы, перемешивают.
IV. Приготовление буферного раствора аммония формиата 20 мМ (рН 4,5):
1,36 г аммония формиата помещают в мерную колбу вместимостью 1000 мл, добавляют около 700 мл воды очищенной, перемешивают до растворения. рН раствора доводят до 4,5 муравьиной кислотой, затем доводят объем раствора до метки, перемешивают.
Буферный раствор фильтруют через гидрофильный мембранный фильтр с размером пор 0,45 мкм, дегазируют.
V. Приготовление подвижной фазы:
Смешивают 700 мл ацетонитрила и 300 мл буферного раствора аммония формиата 20 мМ (рН 4,5).
Условия хроматографирования образцов с применением метода гидрофильной высокоэффективной жидкостной хроматографии по заявляемому способу.
Оптимальные условия хроматографирования подобраны для колонки SeQuant ZIC-HILIC (размер 250 мм × 4,6 мм × 5 мкм) фирмы Merck; температура термостата хроматографической колонки 30°С; объем пробы 20 мкл; режим элюирования - изократический; подвижная фаза: аммония формиата (20 мМ) - ацетонитрил (30:70, об/об), рН 4,5; скорость потока - 0,8 мл/мин; спектрофотометрический детектор, длина волны - 210 нм; время анализа 14 мин.
Эффективность хроматографического разделения контролируют при помощи регистрации пяти хроматограмм стандартного раствора с концентрацией глицина 24 мг/мл.
Критерии пригодности хроматографической системы, установленные в процессе валидации способа:
- число теоретических тарелок пика глицина: не менее 10000;
- фактор асимметрии пика глицина: не более 1,5;
- относительное стандартное отклонение площади пика глицина (RSD): не более 2%;
- относительное стандартное отклонение времени удерживания глицина (RSD): не более 1%.
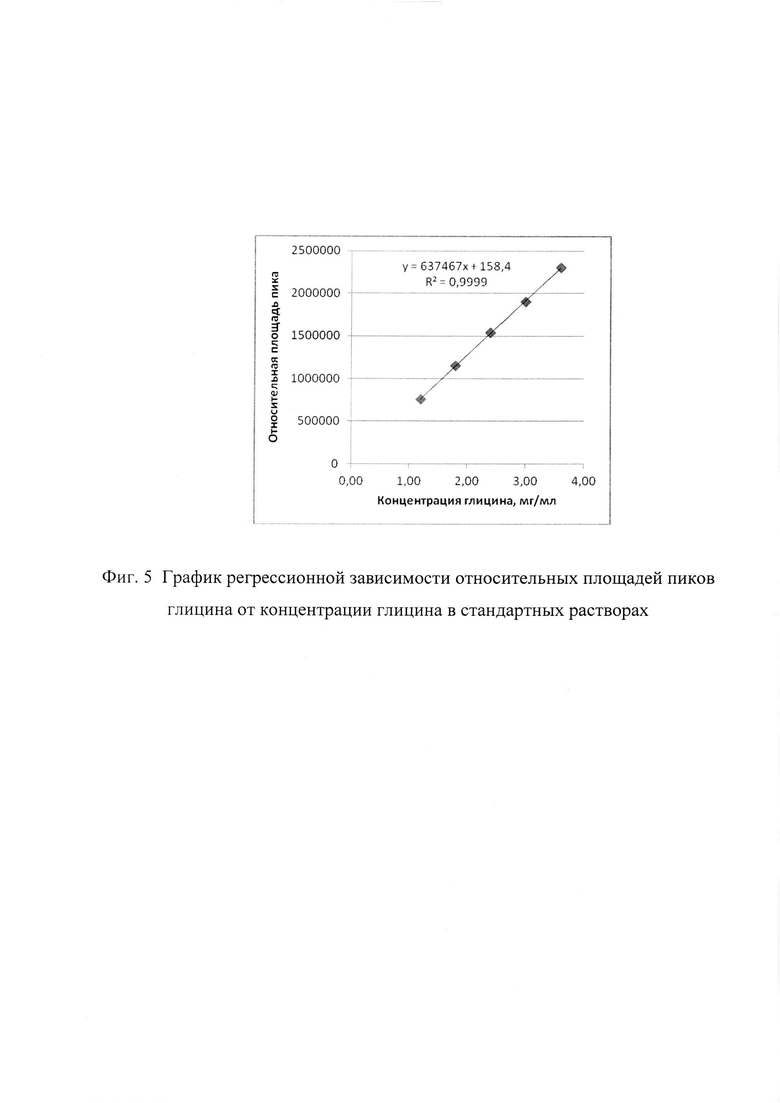
Расчет содержания глицина производят, используя график регрессионной зависимости относительных площадей пика глицина от концентрации глицина в стандартных растворах.
Существенные отличительные признаки заявляемого изобретения:
1. Упрощение способа за счет исключения стадии дериватизации при осуществлении пробоподготовки образцов, а также за счет удаления белка методом твердофазной экстракции на картриджах Amicon Ultra® при осуществлении пробоподготовки образцов.
2. Повышение специфичности способа за счет исключения стадии дериватизации, подбора хроматографической колонки и условий хроматографирования, позволяющих обеспечить эффективное отделение глицина от веществ, входящих в состав образца, а также за счет подбора линейной области способа, соответствующей содержанию глицина в БЛП.
Краткое описание чертежей и иных материалов (Приложения 1-4):
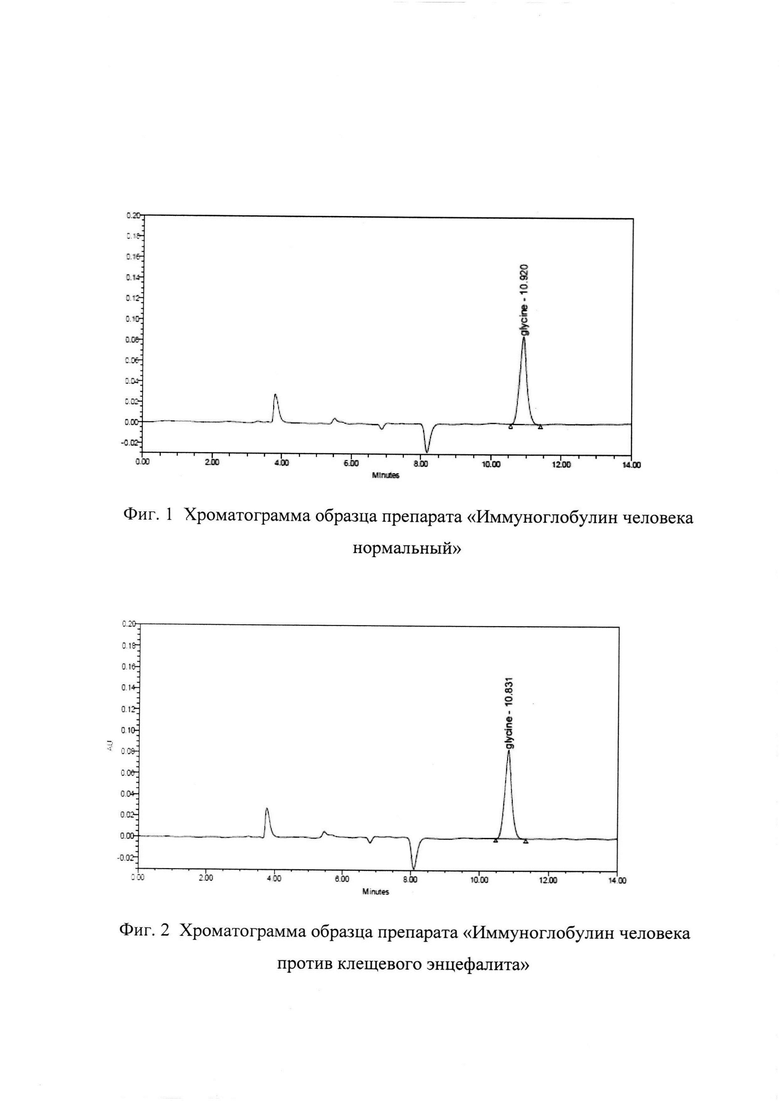
Фиг. 1. Хроматограмма образца препарата «Иммуноглобулин человека нормальный». На хроматограмме обозначен пик глицина (время удерживания 10,920 мин).
Фиг. 2. Хроматограмма образца препарата «Иммуноглобулин человека против клещевого энцефалита». На хроматограмме обозначен пик глицина (время удерживания 10,831 мин).
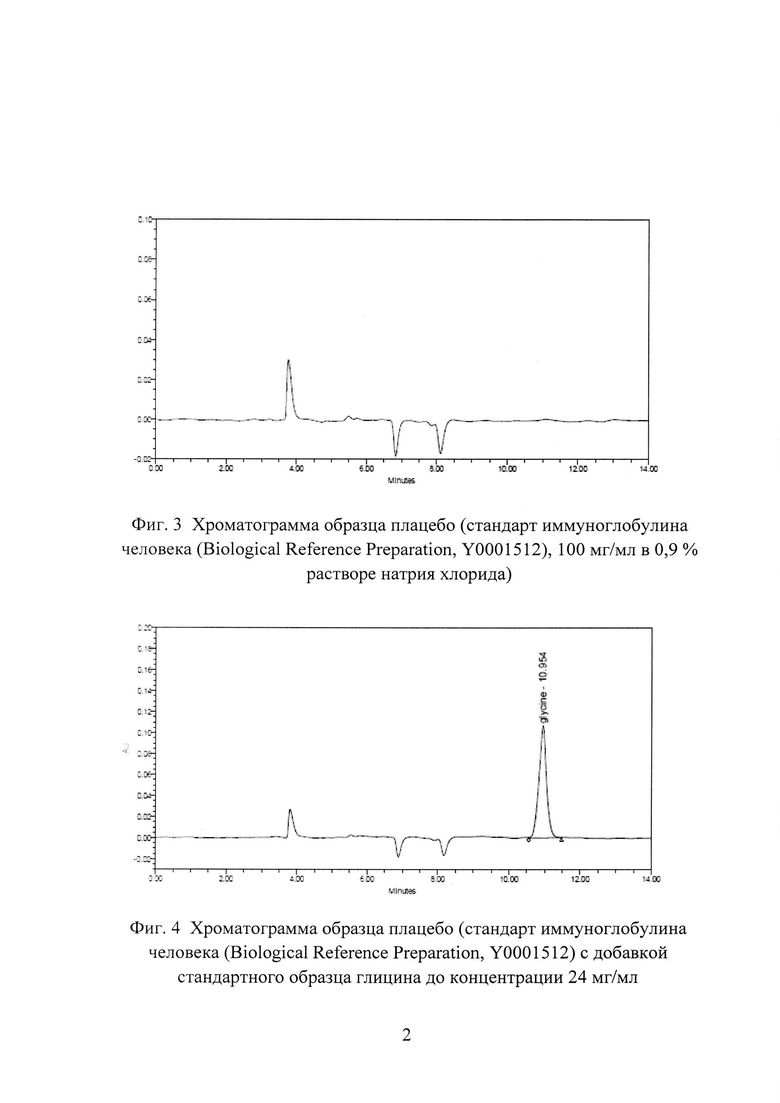
Фиг. 3. Хроматограмма образца плацебо (стандарт иммуноглобулина человека (Biological Reference Preparation, Y0001512), 100 мг/мл в 0,9% растворе натрия хлорида). На хроматограмме отсутствует пик глицина.
Фиг. 4. Хроматограмма образца плацебо (стандарт иммуноглобулина человека (Biological Reference Preparation, Y0001512) с добавкой стандартного образца глицина до концентрации 24 мг/мл. На хроматограмме обозначен пик глицина (время удерживания 10,954 мин).
Фиг. 5. График регрессионной зависимости относительных площадей пиков глицина от концентрации глицина в стандартных растворах. На рисунке представлен калибровочный график, полученный при воспроизведении способа и отражающий зависимость величины оптической плотности от концентрации глицина в стандартном растворе.
Таблица 1. Оценка воспроизводимости заявляемого способа количественного определения глицина. Исследования проводят на образцах препарата «Иммуноглобулин человека нормальный».
Таблица 2. Оценка правильности заявляемого способа количественного определения глицина. Исследования проводят на растворах плацебо с концентрацией глицина 12, 24, 36 мг/мл.
Возможность применения заявляемого изобретения показана следующими примерами:
Пример 1. Определение глицина в препарате «Иммуноглобулин человека нормальный» (Фиг. 1) заявляемым способом.
Приготовление стандартных растворов с концентрацией глицина 12-36 мг/мл проводят в соответствии с описанием изобретения.
Исследуемый образец:
0,5 мл препарата «Иммуноглобулин человека нормальный» помещают на картридж Amicon Ultra® и центрифугируют при 16099 g при температуре 15°С в течение 40 мин.
0,1 мл фильтрата, полученного после центрифугирования, помещают в виалу для хроматографирования объемом 1,5 мл. В ту же виалу добавляют 0,9 мл подвижной фазы, перемешивают.
Подтверждение критериев пригодности хроматографической системы:
- коэффициент асимметрии пика: 1,0;
- число теоретических тарелок: 13829;
- RSD площади пика глицина, %: 0,9;
- RSD времени удерживания глицина, %: 0.
Результат: содержание глицина в препарате 18,6 мг/мл.
Данный пример показывает возможность использования заявляемого способа для определения глицина в указанном препарате.
Пример 2. Определение глицина в препарате «Иммуноглобулин человека против клещевого энцефалита» (Фиг. 2) заявляемым способом.
Приготовление стандартных растворов с концентрацией глицина 12-36 мг/мл проводят в соответствии с описанием изобретения.
Исследуемый образец:
0,5 мл препарата «Иммуноглобулин человека против клещевого энцефалита» помещают на картридж Amicon Ultra® и центрифугируют при 16099 g при температуре 15°С в течение 40 мин.
0,1 мл фильтрата, полученного после центрифугирования, помещают в виалу для хроматографирования объемом 1,5 мл. В ту же виалу добавляют 0,9 мл подвижной фазы, перемешивают.
Подтверждение критериев пригодности хроматографической системы:
- коэффициент асимметрии пика: 1,0;
- число теоретических тарелок: 13425;
- RSD площади пика глицина, %: 0,9;
- RSD времени удерживания пика глицина, %: 0.
Результат: содержание глицина в препарате 20,3 мг/мл.
Данный пример показывает возможность использования заявляемого способа для определения глицина в указанном препарате.
Пример 3. Оценка специфичности способа количественного определения глицина.
Приготовление раствора плацебо и раствора плацебо с добавкой стандартного образца глицина до концентрации 24 мг/мл проводят в соответствии с описанием изобретения.
Специфичность способа подтверждается:
1. Отсутствием пика глицина на хроматограмме образца плацебо (Фиг. 3), наличием пиков глицина на хроматограммах образца плацебо с добавкой стандартного образца глицина до концентрации 24 мг/мл, образцов препаратов «Иммуноглобулин человека нормальный» и «Иммуноглобулин человека против клещевого энцефалита» (Фиг. 1-4).
2. Выполнением критериев пригодности хроматографической системы, подтверждающее, что входящие в состав препаратов компоненты не влияют на определение глицина (Примеры 1, 2):
- времена удерживания пиков глицина на хроматограммах испытуемых образцов соответствуют временам удерживания пиков глицина на хроматограммах стандартных растворов;
- разрешение между пиком глицина и ближайшим пиком неидентифицируемой примеси более 9,0 на хроматограммах препаратов «Иммуноглобулин человека нормальный» и «Иммуноглобулин человека против клещевого энцефалита» (Фиг. 1, 2);
- число теоретических тарелок пика глицина: более 10000 (13829 для препаратов «Иммуноглобулин человека нормальный» и «Иммуноглобулин человека против клещевого энцефалита»);
- фактор асимметрии пика глицина: не более 1,5 (1,0 для препаратов «Иммуноглобулин человека нормальный» и «Иммуноглобулин человека против клещевого энцефалита»).
Данный пример показывает, что заявляемый способ обладает специфичностью за счет возможности разделения компонентов исследуемого образца БЛП с последующими идентификацией пика глицина и его количественным определением.
Пример 4. Оценка линейности способа количественного определения глицина.
Приготовление стандартных растворов с концентрацией глицина 12-36 мг/мл проводят в соответствии с описанием изобретения.
Линейность способа подтверждается:
1. Соответствием аналитической области способа (диапазон концентраций 12-36 мг/мл глицина) диапазону концентраций допустимого содержания глицина в БЛП (17,5-22,5 мг/мл глицина).
2. Построением графика регрессионной зависимости относительных площадей пика глицина от концентраций глицина в стандартном растворе.
3. Уравнением регрессионной зависимости линейного вида:
Y=637466,5х+158,4
4. Коэффициентом детерминации линейной регрессии R2=0,9999 (Фиг. 5).
Данный пример показывает, что заявляемый способ обладает линейностью в диапазоне концентраций 12-36 мг/мл глицина.
Пример 5. Оценка воспроизводимости способа количественного определения глицина.
Подготовка образцов препарата «Иммуноглобулин человека нормальный» проводится в соответствии с описанием изобретения (Пример 1).
Для подтверждения воспроизводимости заявляемого способа в одной лаборатории два химика-аналитика на разных приборах в течение трех дней проводят три независимых серии испытаний образцов препарата «Иммуноглобулин человека нормальный». Каждый образец готовят в шести повторностях. Общее количество измерений для каждого химика-аналитика - 18.
Результаты определения воспроизводимости способа приведены в Таблице 1.
Воспроизводимость подтверждается:
- оценкой величины относительного стандартного отклонения площадей пиков глицина, полученной на 18 образцах испытуемого препарата каждым химиком-аналитиком: RSD менее 2% (0,74% и 0,52%);
- оценкой величины относительного стандартного отклонения площадей пиков глицина, полученной на 36 образцах испытуемого препарата двумя химиками-аналитиками: RSD менее 2% (0,63%);
- сравнением экспериментально найденного значения критерия Фишера (F) с табличным при 95% доверительной вероятности: 0,57 меньше 4,13.
Данный пример показывает, что заявляемый способ обладает достаточной воспроизводимостью.
Пример 6. Оценка правильности способа количественного определения глицина.
Правильность способа подтверждают с помощью метода добавок. Подготовка образцов растворов для оценки правильности заявляемого способа проводится в соответствии с описанием изобретения.
Вычисляют процент выявления глицина (открываемость) в образце относительно теоретического (истинного) значения. За теоретическое содержание глицина в пробе принимают количество глицина, добавленного в препарат (плацебо).
Рассчитывают средние значения открываемости в процентах для каждой из взятых концентраций и для трех концентраций. Результаты приведены в Таблице 2.
Правильность заявляемого способа подтверждается оценкой открываемости глицина, добавленного в плацебо: диапазон средних значений процента открываемости для трех концентраций: 99,42-101,08%, среднее значение процента открываемости: 100,32%. Результаты определения правильности заявляемого способа приведены в Таблице 2.
Данный пример показывает, что заявляемый способ обладает правильностью.
Представленные примеры не ограничивают объем притязаний настоящего изобретения и служат только для цели иллюстрации.
Источники информации:
1.  Albert С,
Albert С, 
 Separation and determination of the amino acids by ion exchange column chromatography applying postcolumn derivatization. Acta Univ. Sapientiae, Alimentaria, 1. 2008; 5(29): 5-29.
Separation and determination of the amino acids by ion exchange column chromatography applying postcolumn derivatization. Acta Univ. Sapientiae, Alimentaria, 1. 2008; 5(29): 5-29.
2. Fekkes D., van Dalen A., Edelman M., Voskuilen A. Validation of the determination of amino acids in plasma by high-performance liquid chromatography using automated pre-column derivatization with o-phtaldialdehyde. J. Chromatogr. В Biomed. Appl. 1995; 669: 177-186.
3. Fekkes D. State-of-the-art of high-performance liquid chromatographic analysis of amino acids in physiological samples. J. Chromatogr. В Biomed. Appl. 1996; 682: 3-22.
4. Bosch L.,  A.,
A.,  R. Application of the 6-aminoquinolyl-N-hydroxysccinimidyl carbamate (AQC) reagent to the RP-HPLC determination of amino acids in infant foods. J. Chromatogr. В Analyt. Technol. Biomed. Life Sci. 2006; 831: 176-183.
R. Application of the 6-aminoquinolyl-N-hydroxysccinimidyl carbamate (AQC) reagent to the RP-HPLC determination of amino acids in infant foods. J. Chromatogr. В Analyt. Technol. Biomed. Life Sci. 2006; 831: 176-183.
5. Cohen S.A. Amino acid analysis using precolumn derivatization with 6-aminoquinolyl-N-hydroxysuccinimidyl carbamate. Methods Mol. Biol. 2000; 159: 39-47.
6. Лисицын А.Б., Иванкин A.H., Вострикова Н.Л. Способ определения природных аминокислот в составе белков пищевых продуктов. Патент RU 2517628 С1, опубл. 27.05.2014.
7. Комиссарова И.А., Нарциссов Я.Р., Волченкова Т.А. Способ определения в таблетке количества активных компонентов в виде аминокислот глицина, l-глутаминовой кислоты и l-цистина. Патент WO 2011075002 А1, опубл. 18.12.2009.
8. Sobolevsky T.G., Revelsky A.I., Revelsky I.A. Simultaneous determination of fatty, dicarboxylic and amino acids based on derivatization with isobutyl chloroformate followed by gas chromatography-positive ion chemical ionization mass spectrometry. J. Chromatogr. B. 2004; 800: 101-107.
9. Periat A., Krull I., Guillarme D. Applications of hydrophilic interaction chromatography to amino acids, peptides, and proteins. J. Sep. Sci. 2015; 38(3): 357-367.
10. Socia A., Foley J. Direct determination of amino acids by hydrophilic interaction chromatography with charged aerosol detection. J. Chromatogr. A. 2016; 1446: 41-49.
11. Kato M., Kato H., Evama S., Takatsu A. Application of amino acids analysis using hydrophilic interaction liquid chromatography coupled with isotope dilution mass spectrometry for peptide and protein quantification. J. Chromatogr. В Analyt. Technol. Biomed. Life Sci. 2009; 877(27): 3059-3064.
12.  M., Jaitz L., Oburger E., Puschenreiter M., Koellensperger G., Hann S. Hydrophilic interaction LC combined with electrospray MS for highly sensitive analysis of underivatized amino acids in rhizosphere research. J. Sep. Sci. 2010; 33(6-7): 911-922.
M., Jaitz L., Oburger E., Puschenreiter M., Koellensperger G., Hann S. Hydrophilic interaction LC combined with electrospray MS for highly sensitive analysis of underivatized amino acids in rhizosphere research. J. Sep. Sci. 2010; 33(6-7): 911-922.
13. Langrock T., Czihal P., Hoffmann R. Amino acids analysis by hydrophilic interaction chromatography coupled on-line to electrospray ionization mass spectrometry. Amino acids. 2006; 30: 291-297.
14. Marrubini G., Caccialanza G., Massolini G. Determination of glycine and threonine in topical dermatological preparations. J. Pharm. Biomed. Anal. 2008; 47(4-5): 716-722.
15. Zhong Q., Huang Q., Li S., Yang M., Rao B. Simultaneous determination of glutamate, glycine, and alanine in human plasma using precolumn derivatization with 6-aminoquinolyl-N-hydroxysuccinimidyl carbamate and high-performance liquid chromatography. Korean J. Physiol. Pharmacol. 2012; 16(5): 355-360.
16. Государственная фармакопея РФ. ГФ XIV. ОФС.1.1.0012.15 Валидация аналитических методик.
Приложение 4


* Теоретическое содержание глицина в пробе - это концентрация глицина в образце, разведенном 1:10 подвижной фазой.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ количественного определения фенола в биологических лекарственных препаратах методом газожидкостной хроматографии | 2018 |
|
RU2693518C1 |
| Определение стабилизаторов углеводной природы в биологически активных препаратах | 2023 |
|
RU2816030C1 |
| Способ количественного определения фтивазида | 2024 |
|
RU2828350C1 |
| Определение полисорбата 80 в биологических лекарственных препаратах | 2023 |
|
RU2812788C1 |
| Способ количественного определения аскорбиновой кислоты в лекарственных растительных препаратах | 2023 |
|
RU2801885C1 |
| Способ количественного определения конваллятоксина в лекарственных препаратах, содержащих сердечные гликозиды ландыша | 2024 |
|
RU2837486C1 |
| Способ определения парабенов методом ГЖХ в лекарственных препаратах | 2020 |
|
RU2747370C1 |
| Способ количественного определения папаверина гидрохлорида и его родственных примесей в лекарственных средствах | 2021 |
|
RU2772608C1 |
| Способ определения арбутина в листьях толокнянки | 2023 |
|
RU2802173C1 |
| Способ определения амиодарона и его основного метаболита дезэтиламиодарона в сыворотке крови человека | 2020 |
|
RU2749566C1 |
Изобретение относится к области здравоохранения, в частности к контролю качества биологических лекарственных препаратов, и может быть использовано для количественного определения глицина в биологических лекарственных препаратах, содержащих глицин в качестве вспомогательного вещества. Способ количественного определения глицина в биологических лекарственных препаратах методом гидрофильной высокоэффективной жидкостной хроматографии характеризуется тем, что используют хроматографическую колонку SeQuant ZIC-HILIC, спектрофотометрический детектор при длине волны 210 нм, изократический режим элюирования со скоростью потока подвижной фазы 0,8 мл/мин при температуре термостата хроматографической колонки 30°С и объеме пробы 20 мкл, далее производят расчет результатов с использованием графика регрессионной зависимости относительных площадей пика глицина от концентрации глицина в стандартных растворах. Техническим результатом является упрощение и повышение специфичности способа количественное определение глицина в биологических лекарственных препаратах методом гидрофильной высокоэффективной жидкостной хроматографии. 2 з.п. ф-лы, 5 ил., 2 табл.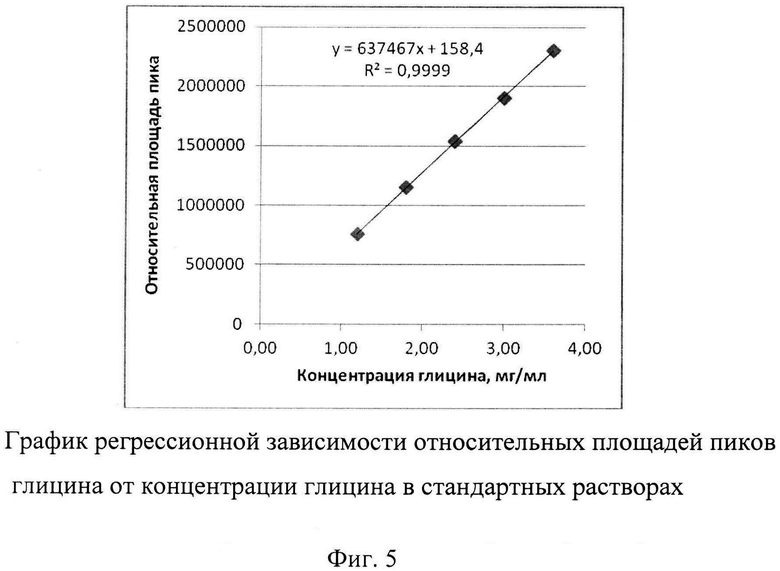
1. Способ количественного определения глицина в биологических лекарственных препаратах методом гидрофильной высокоэффективной жидкостной хроматографии, характеризующийся тем, что используют хроматографическую колонку SeQuant ZIC-HILIC, спектрофотометрический детектор при длине волны 210 нм, изократический режим элюирования со скоростью потока подвижной фазы 0,8 мл/мин при температуре термостата хроматографической колонки 30°С и объеме пробы 20 мкл, далее производят расчет результатов с использованием графика регрессионной зависимости относительных площадей пика глицина от концентрации глицина в стандартных растворах.
2. Способ по п. 1, отличающийся тем, что предварительное удаление белка проводится методом твердофазной экстракции на картриджах Amicon Ultra®.
3. Способ по п. 1, отличающийся тем, что размер хроматографической колонки 250 мм × 4,6 мм × 5 мкм.
| Способ получения светильного и отопительного газа | 1927 |
|
SU13977A1 |
| ВЫСОКОЧУВСТВИТЕЛЬНЫЙ СПОСОБ ОПРЕДЕЛЕНИЯ КОЛИЧЕСТВА КОМПОНЕНТОВ, ПОЛУЧЕННЫХ ИЗ ЛЕКАРСТВЕННЫХ ТРАВ | 2011 |
|
RU2558042C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ГЛИЦИНА В ВОДНОМ РАСТВОРЕ | 2005 |
|
RU2277085C1 |
| Способ качественного определения смеси желчных кислот и их комплексов с таурином и глицерином | 1972 |
|
SU440600A1 |
| СПОСОБ ИОНООБМЕННОГО РАЗДЕЛЕНИЯ МЕТИОНИНА И ГЛИЦИНА | 2010 |
|
RU2435755C1 |
Авторы
Даты
2019-09-23—Публикация
2019-01-24—Подача