ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к иммуногенному продукту и его применению для лечения нарушений, ассоциированных с аберрантной экспрессией или активностью IL-4 и/или IL-13, в частности, астмы, атопического дерматита и аллергических нарушений.
УРОВЕНЬ ТЕХНИКИ
Аллергические нарушения представляют собой комплексные заболевания, возникающие в результате взаимодействий между множеством генетических факторов и факторов окружающей среды. Увеличение количества аллергий, наблюдаемое в последние десятилетия, объясняют в основном изменениями окружающей среды, происходящими в этот же период. Среди всех видов аллергии основными проблемами общественного здравоохранения являются аллергическая астма, аллергический ринит и разные виды пищевой аллергии, каждая(ый) из которых в настоящее время поражает по меньшей мере 300 миллионов человек во всем мире. Более того, по оценкам половина мирового населения будет поражена аллергическим заболеванием к 2050 году. В отношении ежегодной смертности во всем мире насчитывается почти 300000 смертей, связанных с аллергией, вызванных астмой, пищевой аллергией или анафилаксией, которые можно предотвратить. Таким образом, увеличение количества аллергических заболеваний стало важным вопросом здравоохранения по всему миру, что приводит к значительному социально-экономическому бремени, и для которых до сих пор нет эффективной долгосрочной терапии.
Патогенез аллергических нарушений возникает в результате воздействия аллергенов на иммунную систему. Считается, что такие воздействия ответственны за нарушение толерантности, что приводит к иммунным ответам 2 типа, характеризующимся выработкой цитокинов Т-хелперов 2 типа (Th2), таких как интерлейкин 4 (IL-4) и интерлейкин 13 (IL-13), высоким уровням таких антител как иммуноглобулин E (IgE), а также инфильтрации и распространению иммунных клеток в воспаленной ткани. Тучные клетки, базофилы и эозинофилы в первую очередь вовлечены в высвобождение цитоплазматических гранул, содержащих выработанные заранее медиаторы воспаления, такие как гистамин. При воздействии аллергена такой аллерген распознается IgE и связывается с рецепторами на поверхности тучных клеток, базофилов и эозинофилов, что стимулирует дегрануляцию этих клеток и, следовательно, появление клинических симптомов. Следует отметить, что по этим причинам клинические диагнозы разных видов аллергии в основном основываются на измерениях аллергенспецифичных IgE.
Интересно отметить, что цитокины IL-4 и IL-13 играют ключевые роли в патогенезе аллергических нарушений. Оба цитокина уже давно ассоциированы с патогенезом аллергических нарушений и являются терапевтически важными цитокинами на основании их биологических функций. Эти два цитокина имеют сходную структуру и имеют одну общую субъединицу рецептора (IL-4Rα). Однако, несмотря на их многочисленные сходства, полагают, что IL-4 и IL-13 также имеют некоторые недублирующиеся функции при аллергии.
IL-4 представляет собой плейотропный цитокин, который вовлечен в развитие аллергии (Gour N. & Wills-Karp M., 2015), поскольку у пациентов с астмой наблюдают повышенные уровни IL-4 в сыворотке и в бронхоальвеолярном лаваже. Считают, что IL-4 специфически действует в ранней фазе развития аллергии. Важнейшая роль IL-4 заключается в его множественных эффектах, вызывающих аллергию, таких как индукция выработки IgE, положительная регуляция экспрессии рецептора IgE и дифференцировка наивных хелперных Т-клеток 0 типа (Th0) в лимфоциты Th2.
Иммунные клетки 2 типа играют ключевую роль в аллергическом процессе, контролируя гуморальный иммунитет и переключение B-клеток на класс IgE при ответе с участием антител. Таким образом, Th2-клетки являются медиаторами выработки Ig (например, IgE, IgG) и вырабатывают различные цитокины, а также IL-4 и IL-13.
Напротив, IL-13 в большей степени вовлечен в эффекторную и позднюю фазы аллергических реакций (Gour N. & Wills-Karp M., 2015). Было показано, что IL-13 достаточен для индукции основных проявлений аллергических заболеваний, включая, но не ограничиваясь ими, гиперчувствительность дыхательных путей, выработку слизи, изменения гладких мышц дыхательных путей и субэпителиальный фиброз.
С учетом целого ряда клеток, вовлеченных в астму, на которые, как известно, действуют IL-4 и IL-13, и патогенных функций, ассоциированных с этими интерлейкинами, нейтрализация одного или обоих цитокинов является надежным подходом к лечению аллергических воспалительных нарушений. Таким образом, поскольку IL-4 и IL-13 представляют собой перспективные терапевтические мишени для лечения разных видов аллергии, существует явная потребность в улучшении существующих стратегий блокирования этих молекул для того чтобы достичь долгосрочных терапевтических эффектов.
Недавно были разработаны новые виды терапии для лечения разных видов аллергии. Эти способы лечения, основанные на пассивной иммунизации, специфично нацелены на патогенные факторы, вовлеченные в аллергию. Например, в данной области техники было описано применение рекомбинантных антител, направленных к IL-4 и IL-13 или их рецепторам. Однако применение рекомбинантных антител ограничено высокой стоимостью, необходимостью выполнения повторных инъекций и потенциальными рисками появления антител к лекарственным средствам (ADA) или других нежелательных реакций.
В настоящей заявке автором настоящего изобретения предложен новый иммуногенный продукт, основанный на комбинации цитокина, выбранного из IL-4 и IL-13, с CRM197. Новый иммуногенный продукт представляет особый интерес в отношении лечения воспалительных нарушений, таких как, в частности, астма, атопический дерматит и аллергические нарушения.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к иммуногенному продукту, содержащему по меньшей мере один цитокин, конъюгированный с белком-носителем, причем указанный по меньшей мере один цитокин выбран из группы, включающей IL-4, IL-13 и их смеси, и при этом указанный белок-носитель представляет собой CRM197.
Согласно одному варианту реализации настоящего изобретения по меньшей мере один цитокин представляет собой IL-4.
Согласно одному варианту реализации настоящего изобретения по меньшей мере один цитокин представляет собой IL-13.
Согласно одному варианту реализации настоящего изобретения иммуногенный продукт согласно настоящему изобретению содержит CRM197, связанный как с IL-4, так и с IL-13.
Настоящее изобретение также относится к композиции, содержащей по меньшей мере один иммуногенный продукт, описанный в настоящей заявке выше.
Согласно одному варианту реализации настоящего изобретения композиция содержит смесь по меньшей мере двух иммуногенных продуктов, описанных в настоящей заявке выше.
Согласно одному варианту реализации настоящего изобретения композиция содержит смесь иммуногенного продукта, содержащего IL-4 и CRM197, с иммуногенным продуктом, содержащим IL-13 и CRM197.
Согласно одному варианту реализации настоящего изобретения композиция содержит смесь иммуногенного продукта, содержащего IL-4 и CRM197, с иммуногенным продуктом, содержащим IL-13 и CRM197, в массовом соотношении в диапазоне от приблизительно 10:1 до приблизительно 1:10.
Согласно одному варианту реализации настоящего изобретения композиция дополнительно содержит по меньшей мере одно фармацевтически приемлемое вспомогательное вещество и/или по меньшей мере один адъювант.
Согласно одному варианту реализации настоящего изобретения композиция представляет собой эмульсию.
Настоящее изобретение также относится к способу получения иммуногенного продукта, описанного в настоящей заявке, причем указанный способ включает этапы:
a) приведения по меньшей мере одного цитокина в контакт с гетеробифункциональным перекрёстносшивающим агентом, содержащим сложный эфир NHS, предпочтительно сложный эфир, представляющий собой N-[γ-малеимидобутирилокси]-сукцинимид (sGMBS);
b) приведения белка-носителя в контакт с гетеробифункциональным перекрёстносшивающим агентом, содержащим сложный эфир NHS, предпочтительно N-сукцинимидил-S-ацетилтиоацетат (SATA), с получением комплекса носитель-SATA;
c) приведения комплекса sGMBS-цитокин, полученного на этапе (а), в контакт с комплексом носитель-SATA, полученным на этапе (b).
Настоящее изобретение также относится к иммуногенному продукту, описанному в настоящей заявке, или композиции, описанной в настоящей заявке, для лечения воспалительного нарушения.
Согласно одному варианту реализации настоящего изобретения воспалительное нарушение представляет собой нарушение, ассоциированное с аберрантной экспрессией или активностью IL-4 и/или IL-13.
Согласно одному варианту реализации настоящего изобретения воспалительное нарушение выбрано из группы, включающей астму (как аллергическую, так и неаллергическую), аллергические состояния (такие как, например, разные виды пищевой аллергии, аллергия на яд, аллергия на животных, аллергия на лекарство, синдром гипер-IgE, аллергический ринит, аллергический конъюнктивит и аллергический энтерогастрит), атопические нарушения (такие как, например, атопический дерматит, крапивница (включая хроническую идиопатическую крапивницу и хроническую спонтанную крапивницу), экзема), буллезный пемфигоид, респираторные нарушения (такие как аллергическая и неаллергическая астма, хроническая обструктивная болезнь легких (ХОБЛ)), полипоз носа и другие состояния, вовлекающие воспаление дыхательных путей (такие как, например, эозинофилия, фиброз и избыточная выработка слизи, включая муковисцидоз и легочный фиброз, системный склероз (SSc)); воспалительные и/или аутоиммунные нарушения или состояния, желудочно-кишечные нарушения или состояния (такие как, например, воспалительные заболевания кишечника (IBD) и эозинофильный эзофагит (EE), а также желудочно-кишечное заболевание, опосредуемое эозинофилами, язвенный колит и болезнь Крона); системную красную волчанку, нарушения или состояния печени (такие как, например, цирроз и гепатоцеллюлярная карцинома), склеродермию; фиброзные заболевания или нарушения (такие как, например, фиброз печени (такой как, например, фиброз, вызванный вирусом гепатита B и/или C)), склеродермию; солидные опухоли или разные виды рака, такие как лейкоз (такой как, например, хронический В-клеточный лимфоцитарный лейкоз), глиобластому, лимфому (такую как, например, лимфома Ходжкина) и мастоцитоз.
Согласно одному варианту реализации настоящего изобретения воспалительное заболевание выбрано из группы, включающей астму (например, аллергическую астму), атопический дерматит, хроническую обструктивную болезнь легких (ХОБЛ), легочный фиброз, пищевую аллергию, полипоз носа и эозинофильный эзофагит.
Согласно одному варианту реализации настоящего изобретения воспалительное заболевание выбрано из группы, включающей астму (например, аллергическую астму), атопический дерматит, хроническую обструктивную болезнь легких (ХОБЛ), легочный фиброз и пищевую аллергию.
Согласно одному варианту реализации настоящего изобретения воспалительное заболевание представляет собой аллергию, астму или атопический дерматит.
Согласно одному варианту реализации настоящего изобретения иммуногенный продукт или композиция, описанные в настоящей заявке, индуцируют десенсибилизацию субъекта, имеющего аллергию, в отношении аллергена.
Настоящее изобретение также относится к иммуногенному продукту или композиции, описанным в настоящей заявке, для индукции десенсибилизации субъекта, имеющего аллергию, к специфичному антигену, причем указанный иммуногенный продукт или композиция и указанный специфичный антиген должны быть введены субъекту, имеющего аллергию.
Настоящее изобретение также относится к способу индукции десенсибилизации субъекта, имеющего аллергию, к специфичному антигену, причем указанный способ включает введение субъекту иммуногенного продукта или композиции, описанных в настоящей заявке, и указанного специфичного антигена.
Настоящее изобретение также относится к способу повышения эффективности и/или уменьшения продолжительности десенсибилизации субъекта, имеющего аллергию, к специфичному аллергену, причем указанному субъекту вводят иммуногенный продукт или композицию, описанные в настоящей заявке, и затем лечат путем десенсибилизации.
ОПРЕДЕЛЕНИЯ
В настоящем изобретении следующие термины имеют следующие значения:
-В настоящей заявке термин «приблизительно», когда он относится к измеряемому значению, такому как количество, продолжительность периода времени и т. п., предназначен для включения отклонений ±20% или в некоторых случаях ±10%, или в некоторых случаях ±5%, или в некоторых случаях ±1%, или в некоторых случаях ±0,1% от указанного значения, поскольку такие отклонения подходят для выполнения раскрытых способов.
-В настоящей заявке «адъювант» представляет собой вещество, которое повышает иммуногенность иммуногенного продукта согласно настоящему изобретению. Адъюванты часто вводят для стимуляции иммунного ответа, и они хорошо известны квалифицированным специалистам.
-В настоящей заявке термин «молекула белка-носителя» относится к белку или пептиду из по меньшей мере 15, 30 или 50 аминокислот в длину, который, когда он частично ковалентно ассоциирован с по меньшей мере одним цитокином, выбранным из IL-4; IL-13 и их смесей, для получения гетерокомплексов, обеспечивает презентацию большого количества антигенов указанного по меньшей мере одного цитокина В-лимфоцитам.
-В настоящей заявке термин «иммунный ответ» относится к действию, например, лимфоцитов, антигенпрезентирующих клеток, фагоцитарных клеток и макромолекул, вырабатываемых указанными выше клетками или печенью (включая антитела, цитокины и комплемент).
-В настоящей заявке термин «иммуногенный продукт» относится к по меньшей мере одного цитокину, связанному с белком-носителем, который индуцирует иммунный ответ у субъекта, предпочтительно млекопитающего, которому вводят указанный иммуногенный продукт, включая гуморальный иммунный ответ, т. е. выработку антител, которые нейтрализуют свойства, такие как, например, биологическая активность эндогенного цитокина.
-В настоящей заявке термин антитело, которое «ингибирует биологическую активность» или «нейтрализует биологическую активность» по меньшей мере одного цитокина, выбранного из IL-4, IL-13 или их смесей, предназначен для обозначения антитела, которое ингибирует активность указанного цитокина на по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70% или 80% или более, по сравнению с уровнем активности цитокина в отсутствие антитела, например, используя функциональный анализ, такой как те, которые описаны в Примерах.
-В настоящей заявке термин «фармацевтически приемлемое вспомогательное вещество» относится к вспомогательному веществу, которое не вызывает нежелательную, аллергическую или другую неблагоприятную реакцию при введении млекопитающему, предпочтительно человеку. Он включает любые и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические агенты и агенты, замедляющие всасывание, и тому подобное. Фармацевтически приемлемый носитель или вспомогательное вещество относится к нетоксичному твердому, полутвердому или жидкому наполнителю, разбавителю, инкапсулирующему материалу или вспомогательному веществу для изготовления любого типа. Для введения человеку препараты должны соответствовать стандартам стерильности, пирогенности, общей безопасности и чистоты, согласно требованиям регуляторных органов, таких как Управление по контролю качества пищевых продуктов и лекарственных средств США (FDA) или Европейское агентство по лекарственным средствам (EMA).
-В настоящей заявке термин «рекомбинантный белок» относится к белку (например, цитокину или белку-носителю CRM197), который получают с использованием технологии рекомбинантной ДНК, такому как, например, белок (например, цитокин или белок-носитель CRM197), экспрессируемый в прокариотических клетках (с использованием бактериофаговой или плазмидной системы экспрессии) или в эукариотических клетках (таких как, например, система экспрессии дрожжей, насекомых или млекопитающих). Этот термин также должен быть истолкован как означающий белок (например, цитокин или белок-носитель CRM197), который был получен путем синтеза молекулы ДНК, кодирующей белок (например, цитокин или белок-носитель CRM197), и молекула ДНК которого экспрессирует белок (например, цитокин или белок-носитель CRM197) или аминокислотную последовательность, определяющую белок (например, цитокин или белок-носитель CRM197), причем указанная ДНК или аминокислотная последовательность была получена с использованием технологии рекомбинантной ДНК или аминокислотных последовательностей, которая доступна и хорошо известна в данной области техники.
-В настоящей заявке термин «субъект» предназначен для включения живых организмов, у которых может быть вызван иммунный ответ (например, млекопитающих, в частности, человека, приматов, собак, кошек, лошадей, овец и т. п.). Предпочтительно субъект представляет собой человека. Согласно одному варианту реализации настоящего изобретения субъект может представлять собой «пациента», то есть теплокровное животное, предпочтительно человека, который/которое ожидает получения или получает медицинскую помощь, или был(о)/является/будет объектом медицинской процедуры или находится под наблюдением для выявления развития целевого заболевания или состояния, такого как, например, воспалительное нарушение. Согласно одному варианту реализации настоящего изобретения субъект представляет собой взрослого (например, субъект старше 18 лет). Согласно другому варианту реализации настоящего изобретения субъект представляет собой ребенка (например, субъект моложе 18 лет). Согласно одному варианту реализации настоящего изобретения субъект мужского пола. Согласно другому варианту реализации настоящего изобретения субъект женского пола. Согласно одному варианту реализации настоящего изобретения субъект поражен, предпочтительно у него диагностировано воспалительное нарушение. Согласно одному варианту реализации настоящего изобретения субъект подвержен риску развития воспалительного нарушения. Примеры факторов риска включают, но не ограничиваются ими, генетическую предрасположенность или семейный анамнез воспалительных нарушений.
-В настоящей заявке термин «терапевтически эффективное количество» относится к количеству иммуногенного продукта, описанного в настоящей заявке, эффективному для достижения конкретного биологического результата. Таким образом, термины «терапевтически эффективное количество» означают уровень или количество иммуногенного продукта, которое предназначено, без вызова значительных отрицательных или нежелательных побочных эффектов для мишени, для (1) отсрочки или предотвращения начала целевого заболевания или состояния; (2) замедления или остановки прогрессирования, обострения или ухудшения одного или более симптомов целевого заболевания или состояния; (3) улучшения симптомов целевого заболевания или состояния; (4) снижения степени тяжести или частоты целевого заболевания или состояния; или (5) излечения целевого заболевания или состояния. Терапевтически эффективное количество может быть введено до начала целевого заболевания или состояния для профилактического или превентивного действия. В качестве альтернативы или дополнительно, терапевтически эффективное количество может быть введено после начала целевого заболевания или состояния для терапевтического действия.
-В настоящей заявке термин «лечение» или «лечить» относится как к терапевтическому лечению, так и к профилактическим или превентивным мерам; при этом цель состоит в том, чтобы предотвратить или замедлить (уменьшить) целевое заболевание или состояние. Нуждающиеся в лечении включают тех, кто уже имеет состояние, а также тех, кто склонен иметь состояние, или тех, у кого состояние должно быть предотвращено. Субъекта успешно «лечат» от заболевания или состояния, если после получения терапевтического количества иммуногенного продукта, описанного в настоящей заявке, субъект показывает наблюдаемое и/или измеримое улучшение одного или более из следующих: снижение количества патогенных клеток; снижение процента всех клеток, которые являются патогенными; облегчение до некоторой степени одного или более симптомов, ассоциированных с конкретным состоянием; снижение заболеваемости и смертности и/или улучшение проблемных аспектов качества жизни. Указанные выше параметры для оценки успешного лечения и улучшения состояния легко измерить с помощью обычных процедур, известных врачу.
ПОДРОБНОЕ ОПИСАНИЕ
Настоящее изобретение относится к иммуногенному продукту, содержащему по меньшей мере один цитокин, конъюгированный с белком-носителем, причем указанный по меньшей мере один цитокин выбран из группы, включающей IL-4, IL-13 и их смеси, и при этом указанный белок-носитель представляет собой CRM197.
В настоящей заявке Авторы настоящего изобретения продемонстрировали, что иммуногенный продукт согласно настоящему изобретению обеспечивает преимущества по сравнению с таким же иммуногенным продуктом, содержащим KLH вместо CRM197, в частности, в отношении иммуногенности.
CRM197 представляет собой нетоксичный мутант дифтерийного токсина, имеющий последовательность SEQ ID NO: 1, без токсической активности из-за замены одного основания (мутационная замена глицина на остаток глутаминовой кислоты в положении 52).
SEQ ID NO: 1
GADDVVDSSKSFVMENFSSYHGTKPGYVDSIQKGIQKPKSGTQGNYDDDWKEFYSTDNKYDAAGYSVDNENPLSGKAGGVVKVTYPGLTKVLALKVDNAETIKKELGLSLTEPLMEQVGTEEFIKRFGDGASRVVLSLPFAEGSSSVEYINNWEQAKALSVELEINFETRGKRGQDAMYEYMAQACAGNRVRRSVGSSLSCINLDWDVIRDKTKTKIESLKEHGPIKNKMSESPNKTVSEEKAKQYLEEFHQTALEHPELSELKTVTGTNPVFAGANYAAWAVNVAQVIDSETADNLEKTTAALSILPGIGSVMGIADGAVHHNTEEIVAQSIALSSLMVAQAIPLVGELVDIGFAAYNFVESIINLFQVVHNSYNRPAYSPGHKTQPFLHDGYAVSWNTVEDSIIRTGFQGESGHDIKITAENTPLPIAGVLLPTIPGKLDVNKSKTHISVNGRKIRMRCRAIDGDVTFCRPKSPVYVGNGVHANLHVAFHRSSSEKIHSNEISSDSIGVLGYQKTVDHTKVNSKLSLFFEIKS
Согласно одному варианту реализации настоящего изобретения CRM197 может быть получен с помощью обычных способов, известных в данной области техники, в аутологичных (C. diphtheriae) или гетерологичных системах (E. coli и P. fluorescens), как описано Hickey в 2018 (Hickey et al. 2018). Например, рекомбинантный CRM197 может быть получен путем культивирования клеток, содержащих вектор экспрессии, содержащий ген CRM197, сбора телец включения и очистки CRM197. CRM197 также можно экстрагировать из культуры Corynebacterium diphtheriae из штамма бактерий, приобретенного в ATCC (ATCC39255). Согласно одному варианту реализации настоящего изобретения CRM197 доступен коммерчески и может быть приобретен, например, у Reagent Proteins (Сан-Диего, Калифорния, США).
Согласно одному варианту реализации настоящего изобретения иммуногенный продукт согласно настоящему изобретению содержит вариант CRM197, причем указанный вариант проявляет по меньшей мере приблизительно 70%, 75, 80, 85, 90, 95% или более идентичность с SEQ ID NO: 1. Согласно одному варианту реализации настоящего изобретения указанный вариант CRM197 содержит мутационную замену глицина на остаток глутаминовой кислоты в положении 52 и, таким образом, является нетоксичным.
Термин «идентичность» или «идентичный», при использовании в отношении взаимосвязи между последовательностями двух или более последовательностей нуклеиновых кислот или двух или более полипептидов, относится к степени родства последовательностей между последовательностями нуклеиновых кислот или полипептидами, определенной по количеству совпадений между цепями двух или более нуклеиновых остатков или аминокислотных остатков, соответственно. «Идентичность» измеряет процент идентичных совпадений между меньшей из двух или более последовательностей с выравниванием пропусков (если таковые имеются), установленный с помощью конкретной математической модели или компьютерной программы (то есть «алгоритмов»). Идентичность родственных последовательностей нуклеиновых кислот или полипептидов можно легко вычислить с помощью известных способов. Такие способы включают, но не ограничиваются ими, те, которые описаны в Computational Molecular Biology, Lesk, A. M., ред., Oxford University Press, New York, 1988; Biocomputing: Informatics and Genome Projects, Smith, D. W., ред., Academic Press, New York, 1993; Computer Analysis of Sequence Data, Part 1, Griffin, A. M., and Griffin, H. G., ред., Humana Press, New Jersey, 1994; Sequence Analysis in Molecular Biology, von Heinje, G., Academic Press, 1987; Sequence Analysis Primer, Gribskov, M. and Devereux, J., ред., M. Stockton Press, New York, 1991; и Carillo et al., SIAM J. Applied Math. 48, 1073 (1988). Предпочтительные способы определения идентичности разработаны для обеспечения максимального совпадения между тестируемыми последовательностями. Способы определения идентичности описаны в общедоступных компьютерных программах. Предпочтительные способы на основе компьютерной программы для определения идентичности между двумя последовательностями включают ClustalO (Sievers F., et al 2011), пакет программ GCG, включая GAP (Devereux et al., Nucl. Acid. Res. \2, 387 (1984); Genetics Computer Group, University of Wisconsin, Madison, Wis.), BLASTP, BLASTN и FASTA (Altschul et al., J. MoI. Biol. 215, 403-410 (1990)). Программа BLASTX общедоступна в Национальном центре биотехнологической информации (NCBI) и из других источников (BLAST Manual, Altschul et al. NCB/NLM/NIH, Бетесда, Мэриленд, США. 20894; Altschul et al., выше). Для определения идентичности также можно использовать хорошо известный алгоритм Смита-Ватермана.
Согласно одному варианту реализации настоящего изобретения CRM197 представляет собой полноразмерный CRM197.
Согласно одному варианту реализации настоящего изобретения иммуногенный продукт согласно настоящему изобретению содержит фрагмент CRM197, такой как, например, фрагмент, содержащий по меньшей мере приблизительно 50, 100, 150, 200, 250, 300, 350, 400, 450 или 500 аминокислот (предпочтительно смежных аминокислот) из SEQ ID NO: 1.
Согласно одному варианту реализации настоящего изобретения по меньшей мере один цитокин представляет собой IL-4.
Согласно одному варианту реализации настоящего изобретения IL-4 является рекомбинантным. Рекомбинантный IL-4 может быть получен с помощью обычных способов, известных в данной области техники, с использованием нуклеиновой последовательности, кодирующей IL-4. Например, рекомбинантный IL-4 может быть получен путем культивирования клеток, содержащих вектор экспрессии, содержащий ген IL-4, сбора телец включения и очистки цитокина IL-4. Рекомбинантный IL-4 доступен коммерчески и может быть приобретен, например, у PeproTech (Роки Хил, Нью-Джерси, США).
Согласно одному варианту реализации настоящего изобретения IL-4 происходит из млекопитающего.
Согласно одному варианту реализации настоящего изобретения IL-4 представляет собой вариант IL-4 млекопитающего, причем указанный вариант проявляет по меньшей мере приблизительно 70%, 75, 80, 85, 90, 95% или более идентичность с IL-4 млекопитающего, из которого он происходит.
Согласно одному варианту реализации настоящего изобретения IL-4 представляет собой полноразмерный IL-4.
Согласно другому варианту реализации настоящего изобретения по меньшей мере один цитокин представляет собой фрагмент IL-4, такой как, например, фрагмент IL-4, содержащий по меньшей мере приблизительно 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115, 120 или 125 аминокислот (предпочтительно смежных аминокислот) IL-4, из которого он происходит.
Согласно одному варианту реализации настоящего изобретения указанный фрагмент содержит по меньшей мере один специфический эпитоп IL-4.
Согласно одному варианту реализации настоящего изобретения IL-4 представляет собой IL-4 человека, предпочтительно рекомбинантный IL-4 человека. IL-4 человека имеет последовательность SEQ ID NO: 2 (UniProt ID: P05112-1).
SEQ ID NO: 2
HKCDITLQEIIKTLNSLTEQKTLCTELTVTDIFAASKNTTEKETFCRAATVLRQFYSHHEKDTRCLGATAQQFHRHKQLIRFLKRLDRNLWGLAGLNSCPVKEANQSTLENFLERLKTIMREKYSKCSS
Согласно одному варианту реализации настоящего изобретения IL-4 представляет собой вариант SEQ ID NO: 2, причем указанный вариант проявляет по меньшей мере приблизительно 70%, 75, 80, 85, 90, 95% или более идентичность с SEQ ID NO: 2.
Согласно одному варианту реализации настоящего изобретения IL-4 представляет собой полноразмерный IL-4 человека.
Согласно другому варианту реализации настоящего изобретения по меньшей мере один цитокин представляет собой фрагмент IL-4 человека, такой как, например, фрагмент IL-4 человека, содержащий по меньшей мере приблизительно 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115, 120 или 125 аминокислот (предпочтительно смежных аминокислот) SEQ ID NO: 2.
Согласно одному варианту реализации настоящего изобретения указанный фрагмент содержит по меньшей мере один специфический эпитоп IL-4 человека.
Согласно одному варианту реализации настоящего изобретения указанный фрагмент содержит или состоит из следующей последовательности: AQQFHRHKQLIRFLKRLDRNLW (SEQ ID NO: 3).
Согласно одному варианту реализации настоящего изобретения IL-4 представляет собой IL-4 мыши, предпочтительно рекомбинантный IL-4 мыши. IL-4 мыши имеет последовательность SEQ ID NO: 4 (UniProt ID: P07750-1).
SEQ ID NO: 4
HIHGCDKNHLREIIGILNEVTGEGTPCTEMDVPNVLTATKNTTESELVCRASKVLRIFYLKHGKTPCLKKNSSVLMELQRLFRAFRCLDSSISCTMNESKSTSLKDFLESLKSIMQMDYS
Согласно одному варианту реализации настоящего изобретения IL-4 представляет собой вариант SEQ ID NO: 4, причем указанный вариант проявляет по меньшей мере приблизительно 70%, 75, 80, 85, 90, 95% или более идентичность с SEQ ID NO: 4.
Согласно одному варианту реализации настоящего изобретения IL-4 представляет собой полноразмерный IL-4 мыши.
Согласно другому варианту реализации настоящего изобретения по меньшей мере один цитокин представляет собой фрагмент IL-4 мыши, такой как, например, фрагмент IL-4 мыши, содержащий по меньшей мере приблизительно 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110 или 115 аминокислот (предпочтительно смежных аминокислот) SEQ ID NO: 4.
Согласно одному варианту реализации настоящего изобретения указанный фрагмент содержит по меньшей мере один специфический эпитоп IL-4 мыши.
Согласно одному варианту реализации настоящего изобретения IL-4 представляет собой IL-4 собаки, предпочтительно рекомбинантный IL-4 собаки. IL-4 собаки имеет последовательность SEQ ID NO: 5 (UniProt ID: O77762-1).
SEQ ID NO: 5
HNFNITIKEIIKMLNILTARNDSCMELTVKDVFTAPKNTSDKEIFCRAATVLRQIYTHNCSNRYLRGLYRNLSSMANKTCSMNEIKKSTLKDFLERLKVIMQKKYYRH
Согласно одному варианту реализации настоящего изобретения IL-4 представляет собой вариант SEQ ID NO: 5, причем указанный вариант проявляет по меньшей мере приблизительно 70%, 75, 80, 85, 90, 95% или более идентичность с SEQ ID NO: 5.
Согласно одному варианту реализации настоящего изобретения IL-4 представляет собой полноразмерный IL-4 собаки.
Согласно другому варианту реализации настоящего изобретения по меньшей мере один цитокин представляет собой фрагмент IL-4 собаки, такой как, например, фрагмент IL-4 собаки, содержащий по меньшей мере приблизительно 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100 или 105 аминокислот (предпочтительно смежных аминокислот) SEQ ID NO: 5.
Согласно одному варианту реализации настоящего изобретения указанный фрагмент содержит по меньшей мере один специфический эпитоп IL-4 собаки.
Согласно одному варианту реализации настоящего изобретения иммуногенный продукт согласно настоящему изобретению содержит IL-4, связанный с CRM197, в молярном соотношении IL-4:CRM197, варьирующемся (в диапазоне) от приблизительно 16:1 до приблизительно 1:2, предпочтительно от приблизительно 8:1 до приблизительно 2:1, более предпочтительно приблизительно 4:1.
Согласно одному варианту реализации настоящего изобретения иммуногенный продукт согласно настоящему изобретению содержит IL-4, связанный с CRM197, и распознается антителами к IL-4.
Тот факт, что иммуногенный продукт содержит IL-4, связанный с CRM197, и распознается антителами к IL-4, может быть проверен с помощью обычных способов, известных в данной области техники. Примером таких способов является ИФА в формате «сэндвич», направленный против цитокина/белка-носителя, с использованием, например, антитела для обнаружения, меченного биотином, системы усиления сигнала на основе стрептавидина-ПХ и раствора субстрата гидрохлорида о-фенилендиамина (OPD).
Согласно одному варианту реализации настоящего изобретения TEST AIL-4, описанный в настоящей заявке, можно применять для проверки того, что иммуногенный продукт согласно настоящему изобретению содержит IL-4, связанный с CRM197, и распознается антителами к IL-4. TEST AIL-4 представляет собой тест на основе ИФА, направленный против IL-4/CRM197.
TEST AIL-4 проводят следующим образом:
-Планшет покрывают захватывающим антителом, направленным к CRM197, таким как, например, антитела к дифтерийному токсину от Abcam (AB53828) или Bio-Rad (3710-0956, 3710-0150 или 3710-0100),
-Блокируют планшет блокирующим буфером (таким как, например, 2% казеин (масс./об.) в фосфатно-солевом буфере (ФСБ), например) в течение приблизительно 90 мин при приблизительно 37°C,
-Инкубируют планшет в течение приблизительно 90 мин при приблизительно 37°C с двукратным последовательным разведением иммуногенного продукта, начиная с 250 нг/мл, или с отрицательными контролями, такими как, например, IL-4 и CRM197,
-Инкубируют планшет в течение приблизительно 90 мин при приблизительно 37°C с биотинилированным антителом для обнаружения, направленным к IL-4, таким как, например, биотинилированные антитела к IL-4 от Abcam (AB84278), R&D systems (BAF204) или PeproTech (500-P24BT), или биотинилированными мышиными антителами к IL-4 от Southern Biotech (10204-08), R&D systems (BAF404) или PeproTech (500-P54BT),
-Инкубируют планшет со стрептавидином-ПХ в течение приблизительно 30 мин при приблизительно 37°C и проявляют комплекс с использованием раствора субстрата OPD в течение приблизительно 30 мин,
-После остановки ферментативной реакции интенсивность полученного цвета определяют с помощью спектрофотометрических способов при 490 нм.
Согласно одному варианту реализации настоящего изобретения, если оптическая плотность лунок, содержащих иммуногенный продукт согласно настоящему изобретению при приблизительно 25 нг на лунку, превышает по меньшей мере приблизительно в 3 раза, предпочтительно по меньшей мере приблизительно в 5 раз и более предпочтительно по меньшей мере приблизительно в 10 раз оптическую плотность лунок, содержащих отрицательный контроль, квалифицированный специалист в данной области техники может сделать вывод о том, что иммуногенный продукт согласно настоящему изобретению (i) распознается антителами к IL-4, и (ii) содержит IL-4, связанный с CRM197.
Согласно одному варианту реализации настоящего изобретения иммуногенный продукт согласно настоящему изобретению содержит IL-4, связанный с CRM197, и сильно инактивирован, это означает, что иммуногенный продукт показывает менее приблизительно 10% от начальной активности IL-4, предпочтительно менее приблизительно 5% и предпочтительно менее приблизительно 1% от начальной активности IL-4 в условии TEST BIL-4, упомянутого в настоящей заявке ниже. TEST BIL-4 представляет колориметрический анализ пролиферации T-клеток или биотест репортерного гена с использованием линии клеток, экспрессирующих IL-4Rα, который может быть функционально активирован под действием IL-4, содержащегося в иммуногенном продукте согласно настоящему изобретению (т.е., который может связывать IL-4, содержащийся в иммуногенном продукте согласно настоящему изобретению, и активироваться после этого связывания).
Согласно одному варианту реализации настоящего изобретения иммуногенный продукт согласно настоящему изобретению содержит IL-4 мыши, а TEST BIL-4 представляет собой колориметрический анализ пролиферации Т-клеток, проводимый с использованием клеток CTLL-2 (из линий клеток ECACC, предоставленных Sigma-Aldrich, ссылка 93042610-1VL) в соответствии со следующим способом:
-Клетки CTLL-2 выращивают в присутствии IL-2 в конечной концентрации 10 нг/мл с RPMI с добавлением 2 мМ глутамина, 1 мМ пирувата натрия, 1 мМ HEPES, 100 ед./мл пенициллина, 100 мкг/мл стрептомицина (полная RMPI или RPMIc) и 10% (об./об.) фетальной бычьей сыворотки (ФБС),
-Иммуногенный продукт согласно настоящему изобретению (IL-4/CRM197) и контроль muIL-4 двукратно последовательно разводят в RPMIc + 10% (об./об.) ФБС в 96-луночных планшетах, начиная с 1000 нг/мл до конечной концентрации 4 нг/мл для иммуногенного продукта и с 10 нг/мл до конечной концентрации 0,04 нг/мл для muIL-4,
-В качестве положительного контроля были добавлены шесть лунок с muIL-4 при 10 нг/мл, которые использовали в качестве контроля максимальной пролиферации клеток,
-Эти образцы добавляют к 20000 клеток CTLL-2 на лунку, и планшеты инкубируют в течение приблизительно 48 ч при приблизительно 37°C в увлажненном инкубаторе с 5% CO2,
-В конце культивирования жизнеспособность клеток оценивают с использованием способов, хорошо известных в данной области техники. Один из примеров таких способов упомянут далее: 40 мкл/лунку раствора MTS/PMS (Promega, Мэдисон, Висконсин, США) (где MTS обозначает 3-(4,5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2H-тетразолий, внутренняя соль; и PMS обозначает феназинметосульфат) добавляют в лунки, и планшет инкубируют еще 4 часа при 37°C, 5% CO2, в соответствии с инструкцией производителя. Затем планшет считывают при 490 нм на спектрофотометре.
Согласно другому варианту реализации настоящего изобретения иммуногенный продукт согласно настоящему изобретению содержит IL-4 человека, а TEST BIL-4 представляет собой анализ репортерного гена, который проводят с использованием линии клеток HEK-Blue™ IL-4/IL-13, приобретенной у InvivoGen (Сан-Диего, Калифорния, США). В этих клетках стимуляция с использованием IL-4 или IL-13 активирует путь JAK/STAT6 с последующей выработкой SEAP. Биологическую активность IL-4, содержащегося в иммуногенном продукте согласно настоящему изобретению, затем можно оценить путем оценки уровней SEAP в супернатанте.
В соответствии с этим вариантом реализации TEST BIL-4 включает следующие этапы:
-Клетки HEK-Blue™ IL-4/IL-13 культивируют в среде для анализа, состоящей из DMEM GlutaMAX™ с добавлением 10% (об./об.) ФБС, 10 мМ HEPES, 50 ед./мл пенициллина и 50 мкг/мл стрептомицина,
-Иммуногенный продукт (IL-4/CRM197) и контроль IL-4 двукратно последовательно разводят в среде для анализа в конечной концентрации 8000 и 1 нг/мл, соответственно.
-Эти образцы разведения затем переносят в планшеты с предварительно высаженными клетками, содержащие 40000 клеток HEK-Blue™ IL-4/IL-13 на лунку. Планшеты инкубируют в течение приблизительно 24 ч при приблизительно 37°C в увлажненном инкубаторе с 5% CO2.
-В конце культивирования путь активации оценивают с использованием способов, хорошо известных в данной области техники. Один из примеров таких способов упомянут далее: 90 мкл/лунку раствора QUANTI-Blue™ (приобретенного у InvivoGen) добавляют к 10 мкл/лунку клеточного супернатанта. Затем планшет инкубируют приблизительно 1 ч при приблизительно 37°C в увлажненном инкубаторе с 5% CO2. Затем планшет считывают при 625 нм на спектрофотометре.
Значение эффективной дозы 50 (ЭД50) соответствует количеству иммуногенного продукта или цитокина, приводящему к 50% от максимального сигнала клетки. Это значение определяют путем интерполяции 50% от максимального сигнала клетки на ось абсцисс с использованием формулы y = ax + b на основании кривой, проходящей через точки разведения, окружающие 50% точку перегиба.
В TEST BIL-4 коэффициент инактивации рассчитывают путем деления ЭД50 тестируемого иммуногенного продукта на среднее значение ЭД50 стандартных кривых для контроля IL-4. Результат с коэффициентом инактивации >100 означает, что для этого же количества белка активность IL-4 в иммуногенном продукте соответствует менее чем 1% от активности нативного IL-4. Согласно одному варианту реализации настоящего изобретения коэффициент инактивации выше приблизительно 2, 2,5, 3,33, 5 или 10, предпочтительно приблизительно 20, более предпочтительно приблизительно 100, указывает на то, что иммуногенный продукт сильно инактивирован. Согласно одному варианту реализации настоящего изобретения остаточная активность менее приблизительно 50%, 40%, 30%, 20% или 10%, предпочтительно менее приблизительно 5% и более предпочтительно менее приблизительно 1% от активности нативного IL-4 указывает на то, что иммуногенный продукт сильно инактивирован.
Согласно одному варианту реализации настоящего изобретения иммуногенный продукт согласно настоящему изобретению содержит IL-4, связанный с CRM197, и является иммуногенным, это означает, что иммуногенный продукт способен индуцировать антитела к IL-4 in vivo в условиях TEST CIL-4. Согласно одному варианту реализации настоящего изобретения иммуногенный продукт согласно настоящему изобретению способен индуцировать поликлональные антитела к IL-4 in vivo, например, в условиях TEST CIL-4.
TEST CIL-4 проводят в соответствии со следующим способом:
Определенные количества общих белков (как определено, например, с помощью анализа белка по Бредфорд) иммуногенного продукта вводят путем инъекции мышам (старше 3-недельного возраста) от трех до четырех раз в течение 120 дней. Согласно одному варианту реализации настоящего изобретения TEST CIL-4 представляет собой гетерологичную систему, например, иммуногенный продукт, содержащий IL-4, полученный не от мыши, вводят путем инъекции мыши, и тест включает введение дозы общих белков, варьирующейся от приблизительно 0,3 до 30 мкг. Согласно другому варианту реализации настоящего изобретения TEST CIL-4 представляет собой гомологичную систему, т. е. иммуногенный продукт, содержащий IL-4 мыши, вводят путем инъекции мыши, и тест включает введение дозы общих белков, варьирующейся от приблизительно 5 до приблизительно 30 мкг. Образцы сыворотки получают до иммунизации (образец сыворотки до иммунизации), а также между днем 39 и днем 120 (тестируемый образец сыворотки). ИФА, направленный против IL-4, проводят, как объясняется ниже.
В общих чертах, 96-луночный планшет покрывают 1 мкг/мл IL-4, использованного для получения иммуногенного продукта, и инкубируют в течение ночи при температуре, варьирующейся от приблизительно 2°C до приблизительно 8°C. Затем планшет блокируют блокирующим буфером в течение приблизительно 90 мин при приблизительно 37°C. По 100 мкл образца до иммунизации и образцов сыворотки (до иммунизации и тестируемый) добавляют в лунки в двукратном последовательном разведении, таком как, например, начиная с 500 развед.-1 до 256000 развед.-1. В завершение в лунки добавляют меченое вторичное антитело против мышиного иммуноглобулина (такое как, например, ПХ-конъюгированное антитело), и ИФА проявляют с использованием любых колориметрических средств, известных в данной области техники, таких как, например, раствор субстрата OPD.
Согласно одному варианту реализации настоящего изобретения, если оптическая плотность лунок (490 нм), содержащих тестируемый образец сыворотки, превышает по меньшей мере приблизительно в 1,5 раза, предпочтительно по меньшей мере приблизительно в 2 раза оптическую плотность лунок, содержащих образец сыворотки до иммунизации, иммуногенный продукт считают иммуногенным, это означает, что он индуцировал антитела к IL-4 in vivo.
В этом тесте титры определяли как разведение сыворотки, при котором в анализе достигается 50% от ODmax минус OD соответствующего образца до иммунизации. Этот способ расчета является гораздо более жестким, чем определение хорошо известных титров сероконверсии, но обеспечивает более надежный анализ и меньше ложноположительных результатов. Титры выражали как коэффициенты разведения сыворотки (развед.-1).
Согласно другому варианту реализации настоящего изобретения в TEST CIL-4 значение титра ≥250 развед.-1, предпочтительно ≥500 развед.-1, указывает на то, что иммуногенный продукт согласно настоящему изобретению обеспечивает выработку связывающих антител против IL-4.
Согласно одному варианту реализации настоящего изобретения иммуногенный продукт согласно настоящему изобретению содержит IL-4, связанный с CRM197, и способен нейтрализовать активность IL-4 в условиях TEST DIL-4, упомянутого в настоящей заявке ниже. В соответствии с настоящим изобретением TEST DIL-4 выполняют для оценки нейтрализующей способности сыворотки, полученной от мышей, иммунизированных иммуногенным продуктом. Такая оценка может быть оценена с помощью колориметрического анализа пролиферации T-клеток для мышиного продукта или биотеста репортерного гена для человеческого продукта, используя клетки HEK-Blue™ IL-4/IL-13. В этих клетках стимуляция с использованием IL-4 или IL-13 активирует путь JAK/STAT6 с последующей выработкой SEAP. Нейтрализующие антитела к IL-4, индуцированные иммунизацией иммуногенными продуктами, затем можно оценить путем оценки уровней SEAP в супернатанте.
Согласно одному варианту реализации настоящего изобретения иммуногенный продукт согласно настоящему изобретению содержит IL-4 мыши, а TEST DIL-4 представляет собой колориметрический анализ пролиферации Т-клеток, который проводят с использованием клеток CTLL-2 в соответствии со следующим способом:
-Клетки CTLL-2 выращивают в присутствии IL-2 в конечной концентрации 10 нг/мл с RPMIc и 10% (об./об.) ФБС,
-В культуральные планшеты добавляют образцы сыворотки в конечном соотношении 1/200 и положительный контроль поликлональное антитело к IL-4 в конечной концентрации 1 мкг/мл и двукратно последовательно разводят в 25 мкл на лунку RPMIc + 10% (об./об.) ФБС.
-Затем к образцам сыворотки и контролю добавляют muIL-4 в конечной концентрации 2 нг/мл и инкубируют в течение 1 часа при комнатной температуре.
-Затем 20000 клеток CTLL-2 на лунку добавляют к предварительно проинкубированным образцам. Планшеты затем инкубируют в течение приблизительно 48 ч при приблизительно 37°C в увлажненном инкубаторе с 5% CO2.
-В конце культивирования жизнеспособность клеток оценивают с использованием способов, хорошо известных в данной области техники. Один из примеров таких способов упомянут далее: 40 мкл/лунку раствора MTS/PMS добавляют в лунки, и планшет инкубируют еще 4 ч при 37°C, 5% CO2. Затем планшет считывают при 490 нм на спектрофотометре.
Согласно другому варианту реализации настоящего изобретения иммуногенный продукт согласно настоящему изобретению содержит IL-4 человека, а TEST DIL-4 представляет собой биотест репортерного гена, который проводят с использованием клеток HEK-Blue™ IL-4/IL-13, и включает следующие этапы:
-Клетки HEK-Blue™ IL-4/IL-13 высевают в среду для анализа, состоящую из DMEM GlutaMAX™ с добавлением 10% (об./об.) ФБС, 10 мМ HEPES, 50 ед./мл пенициллина и 50 мкг/мл стрептомицина.
-Образцы сыворотки, контрольное антитело (поликлональное козье антитело к IL-4) разводили в среде для анализа в конечной концентрации 1/200 и 1 мкг/мл, соответственно. Образцы сыворотки или контрольное антитело двукратно последовательно разводили в 96-луночных планшетах с круглым дном в присутствии IL-4 в конечной концентрации 0,25 нг/мл и инкубировали в течение одного часа при комнатной температуре.
-Эти смеси затем добавляли в планшеты с предварительно высаженными клетками, содержащие 40000 клеток HEK-Blue™ IL-4/IL-13 на лунку. Планшеты инкубировали в течение приблизительно 24 ч при приблизительно 37°C в увлажненном инкубаторе с 5% CO2.
-В конце культивирования путь активации оценивают с использованием способов, хорошо известных в данной области техники. Один из примеров таких способов упомянут далее: 90 мкл/лунку раствора QUANTI-Blue™ добавляют к 10 мкл/лунку клеточного супернатанта. Затем планшеты инкубируют в течение 1 ч при 37°C в увлажненном инкубаторе с 5% CO2. Планшеты затем считывают при 625 нм на спектрофотометре.
Результаты НС50 выражали как коэффициент разведения сыворотки (развед.-1), нейтрализующий 50% от активности muIL-4 или IL-4. НС50 определяют путем интерполяции разведения сыворотки, приводящего к 50% от активности IL-4, на ось абсцисс.
В TEST DIL-4 значение НС50≥100 развед.-1, предпочтительно ≥200 развед.-1 указывает на то, что иммуногенный продукт согласно настоящему изобретению обеспечивает выработку нейтрализующих антител против IL-4. Согласно одному варианту реализации настоящего изобретения нейтрализующие антитела против IL-4, индуцированные введением иммуногенного продукта согласно настоящему изобретению, являются поликлональными.
Согласно одному варианту реализации настоящего изобретения по меньшей мере один цитокин представляет собой IL-13.
Согласно одному варианту реализации настоящего изобретения IL-13 является рекомбинантным. Рекомбинантный IL-13 может быть получен с помощью обычных способов, известных в данной области техники, с использованием нуклеиновой последовательности, кодирующей IL-13. Например, рекомбинантный IL-13 может быть получен путем культивирования клеток, содержащих вектор экспрессии, содержащий ген IL-13, сбора телец включения и очистки цитокина IL-13. Рекомбинантный IL-13 доступен коммерчески и может быть приобретен, например, у PeproTech (Роки Хил, Нью-Джерси, США).
Согласно одному варианту реализации настоящего изобретения IL-13 происходит из млекопитающего.
Согласно одному варианту реализации настоящего изобретения IL-13 представляет собой вариант IL-13 млекопитающего, причем указанный вариант проявляет по меньшей мере приблизительно 70%, 75, 80, 85, 90, 95% или более идентичность с IL-13 млекопитающего, из которого он происходит.
Согласно одному варианту реализации настоящего изобретения IL-13 представляет собой полноразмерный IL-13.
Согласно другому варианту реализации настоящего изобретения по меньшей мере один цитокин представляет собой фрагмент IL-13, такой как, например, фрагмент IL-13, содержащий по меньшей мере приблизительно 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115 или 120 аминокислот (предпочтительно смежных аминокислот) IL-13, из которого он происходит.
Согласно одному варианту реализации настоящего изобретения указанный фрагмент содержит по меньшей мере один специфический эпитоп IL-13.
Согласно одному варианту реализации настоящего изобретения IL-13 представляет собой IL-13 человека, предпочтительно рекомбинантный IL-13 человека. IL-13 человека имеет последовательность SEQ ID NO: 6 (UniProt ID: P35225-1).
SEQ ID NO: 6
LTCLGGFASPGPVPPSTALRELIEELVNITQNQKAPLCNGSMVWSINLTAGMYCAALESLINVSGCSAIEKTQRMLSGFCPHKVSAGQFSSLHVRDTKIEVAQFVKDLLLHLKKLFREGRFN
Согласно одному варианту реализации настоящего изобретения IL-13 представляет собой вариант SEQ ID NO: 6, причем указанный вариант проявляет по меньшей мере приблизительно 70%, 75, 80, 85, 90, 95% или более идентичность с SEQ ID NO: 6.
Согласно одному варианту реализации настоящего изобретения IL-13 представляет собой полноразмерный IL-13 человека.
Согласно другому варианту реализации настоящего изобретения по меньшей мере один цитокин представляет собой фрагмент IL-13 человека, такой как, например, фрагмент IL-13 человека, содержащий по меньшей мере приблизительно 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 115 или 120 аминокислот (предпочтительно смежных аминокислот) SEQ ID NO: 6.
Согласно одному варианту реализации настоящего изобретения указанный фрагмент содержит по меньшей мере один специфический эпитоп IL-13 человека.
Согласно одному варианту реализации настоящего изобретения IL-13 представляет собой IL-13 мыши, предпочтительно рекомбинантный IL-13 мыши. IL-13 мыши содержит последовательность SEQ ID NO: 7 (UniProt ID: P20109-1).
SEQ ID NO: 7
PVPRSVSLPLTLKELIEELSNITQDQTPLCNGSMVWSVDLAAGGFCVALDSLTNISNCNAIYRTQRILHGLCNRKAPTTVSSLPDTKIEVAHFITKLLSYTKQLFRHGPF
Согласно одному варианту реализации настоящего изобретения IL-13 представляет собой вариант SEQ ID NO: 7, причем указанный вариант проявляет по меньшей мере приблизительно 70%, 75, 80, 85, 90, 95% или более идентичность с SEQ ID NO: 7.
Согласно одному варианту реализации настоящего изобретения IL-13 представляет собой полноразмерный IL-13 мыши.
Согласно другому варианту реализации настоящего изобретения по меньшей мере один цитокин представляет собой фрагмент IL-13 мыши, такой как, например, фрагмент IL-13 мыши, содержащий по меньшей мере приблизительно 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100 или 105 аминокислот (предпочтительно смежных аминокислот) SEQ ID NO: 7.
Согласно одному варианту реализации настоящего изобретения указанный фрагмент содержит по меньшей мере один специфический эпитоп IL-13 мыши.
Согласно одному варианту реализации настоящего изобретения IL-13 представляет собой IL-13 собаки, предпочтительно рекомбинантный IL-13 собаки. IL-13 собаки содержит последовательность SEQ ID NO: 8 (UniProt ID: Q9N0W9-1).
SEQ ID NO: 8
SPSPVTPSPTLKELIEELVNITQNQASLCNGSMVWSVNLTAGMYCAALESLINVSDCSAIQRTQRMLKALCSQKPAAGQISSERSRDTKIEVIQLVKNLLTYVRGVYRHGNFR
Согласно одному варианту реализации настоящего изобретения IL-13 представляет собой вариант SEQ ID NO: 8, причем указанный вариант проявляет по меньшей мере приблизительно 70%, 75, 80, 85, 90, 95% или более идентичность с SEQ ID NO: 8.
Согласно одному варианту реализации настоящего изобретения IL-13 представляет собой полноразмерный IL-13 собаки.
Согласно другому варианту реализации настоящего изобретения по меньшей мере один цитокин представляет собой фрагмент IL-13 собаки, такой как, например, фрагмент IL-13 собаки, содержащий по меньшей мере приблизительно 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105 или 110 аминокислот (предпочтительно смежных аминокислот) SEQ ID NO: 8.
Согласно одному варианту реализации настоящего изобретения указанный фрагмент содержит по меньшей мере один специфический эпитоп IL-13 собаки.
Согласно одному варианту реализации настоящего изобретения иммуногенный продукт согласно настоящему изобретению содержит IL-13, связанный с CRM197, в молярном соотношении IL-13:CRM197, варьирующемся от приблизительно 16:1 до приблизительно 1:2, предпочтительно от приблизительно 8:1 до приблизительно 2:1, более предпочтительно приблизительно 4:1.
Согласно одному варианту реализации настоящего изобретения иммуногенный продукт содержит IL-13, связанный с CRM197, и распознается антителами к IL-13.
Тот факт, что иммуногенный продукт содержит IL-13, связанный с CRM197, и распознается антителами к IL-13, может быть проверен с помощью обычных способов, известных в данной области техники. Примером таких способов является ИФА в формате «сэндвич», направленный против цитокина/белка-носителя, с использованием, например, антитела для обнаружения, меченного биотином, системы усиления сигнала на основе стрептавидина-ПХ и/или раствора субстрата OPD.
Согласно одному варианту реализации настоящего изобретения TEST AIL-13, описанный в настоящей заявке, можно применять для проверки того, что иммуногенный продукт согласно настоящему изобретению содержит IL-13, связанный с CRM197, и распознается антителами к IL-13. TEST AIL-13 представляет собой тест на основе ИФА, направленный против IL-13/CRM197.
TEST AIL-13 проводят следующим образом:
-Планшет покрывают захватывающим антителом, направленным к CRM197, таким как, например, антитела к дифтерийному токсину от Abcam (AB53828) или Bio-Rad (3710-0956, 3710-0150 или 3710-0100),
-Планшет блокируют блокирующим буфером (таким как, например, 2% казеин (масс./об.) в ФСБ, например) в течение приблизительно 90 мин при приблизительно 37°C,
-Планшет инкубируют в течение приблизительно 90 мин при приблизительно 37°C с двукратным последовательным разведением иммуногенного продукта, начиная с 250 нг/мл, или с отрицательными контролями, такими как, например, IL-13 и CRM197,
-Планшет инкубируют в течение приблизительно 90 мин при приблизительно 37°C с биотинилированным антителом для обнаружения, направленным к IL-13, таким как, например, биотинилированные антитела к IL-13 от SouthernBiotech (10126-08), PeproTech (500-P13BT) или R&D systems (BAF213), или биотинилированные антитела мыши к IL-13 от Bio-Rad (AAM34B), PeproTech (500-P178BT) или R&D systems (BAF413),
-Планшет инкубируют со стрептавидином-ПХ в течение приблизительно 30 мин при приблизительно 37°C, и проявляют комплекс с использованием раствора субстрата OPD в течение приблизительно 30 мин,
-После остановки ферментативной реакции интенсивность полученного цвета определяют спектрофотометрическими способами при 490 нм.
Согласно одному варианту реализации настоящего изобретения, если оптическая плотность лунок, содержащих иммуногенный продукт согласно настоящему изобретению при 25 нг на лунку, превышает по меньшей мере приблизительно в 3 раза, предпочтительно по меньшей мере приблизительно в 5 раз и более предпочтительно по меньшей мере приблизительно в 10 раз оптическую плотность лунок, содержащих отрицательный контроль, квалифицированный специалист в данной области техники может сделать вывод о том, что иммуногенный продукт согласно настоящему изобретению (i) распознается антителами к IL-13 и (ii) содержит IL-13, связанный с CRM197.
Согласно другому варианту реализации настоящего изобретения иммуногенный продукт согласно настоящему изобретению содержит IL-13, связанный с CRM197, и сильно инактивирован, это означает, что иммуногенный продукт показывает менее приблизительно 15% остаточной активности в условии TEST BIL-13, упомянутого в настоящей заявке ниже, предпочтительно менее приблизительно 10% остаточной активности и более предпочтительно менее приблизительно 5% остаточной активности. TEST BIL-13 представляет собой биотест репортерного гена с использованием клеток HEK-Blue™ IL-4/IL-13. В этих клетках стимуляция с использованием IL-4 или IL-13 активирует путь JAK/STAT6 с последующей выработкой SEAP. Затем биологическую активность IL-13, содержащегося в иммуногенном продукте согласно настоящему изобретению, можно оценить путем оценки уровней SEAP в супернатанте.
Согласно одному варианту реализации настоящего изобретения в TEST BIL-13 используется линия клеток HEK-Blue™ IL-4/IL-13, приобретенная у InvivoGen. В присутствии IL-13 мыши или человека путь STAT6 линии клеток HEK-Blue™ IL-4/IL-13 активирован и вырабатывает SEAP, который можно определить количественно с помощью способов, хорошо известных в данной области техники.
TEST BIL-13 включает следующие этапы:
-Клетки HEK-Blue™ IL-4/IL-13 высевают в среде для анализа, состоящей из DMEM GlutaMAX™ с добавлением 10% (об./об.) ФБС, 10 мМ HEPES, 50 ед./мл пенициллина и 50 мкг/мл стрептомицина,
-Человеческий иммуногенный продукт (IL-13/CRM197) и контроль IL-13 двукратно последовательно разводят в среде для анализа в конечной концентрации 8000 и 10 нг/мл, соответственно.
-Мышиный иммуногенный продукт (muIL-13/CRM197) и контроль muIL-13 двукратно последовательно разводят в среде для анализа в конечной концентрации 250 и 10 нг/мл, соответственно.
-Образцы затем переносят в планшеты с предварительно высаженными клетками, содержащие 40000 клеток HEK-Blue™ IL-4/IL-13 на лунку. Планшеты инкубируют в течение приблизительно 24 ч при приблизительно 37°C в увлажненном инкубаторе с 5% CO2.
-В конце культивирования путь активации оценивают с использованием способов, хорошо известных в данной области техники. Один из примеров таких способов упомянут далее: 90 мкл/лунку раствора QUANTI-Blue™ (приобретенного у InvivoGen) добавляют к 10 мкл/лунку клеточного супернатанта. Затем планшеты инкубируют в течение приблизительно 1 ч при приблизительно 37°C в увлажненном инкубаторе с 5% CO2. Планшеты затем считывают при 625 нм на спектрофотометре.
Значение эффективной дозы 50 (ЭД50), соответствующее количеству иммуногенного продукта (или IL-13), которое приводит к 50% от максимального сигнала, зарегистрированного для рассматриваемых образцов, определяют путем интерполяции значений ODmax/2 к соответствующим концентрациям образца с использованием четырехпараметрической логистической (4PL) нелинейной регрессии на основании всех точек разведения.
В TEST BIL-13 коэффициент инактивации рассчитывают путем деления ЭД50 тестируемого иммуногенного продукта согласно настоящему изобретению на соответствующее значение ЭД50 стандартных кривых для контроля IL-13. Результат с коэффициентом инактивации >20 означает, что для этого же количества белка активность IL-13 в иммуногенном продукте соответствует менее чем 5% от активности нативного IL-13. Согласно одному варианту реализации настоящего изобретения коэффициент инактивации выше приблизительно 2, 2,5, 3,33, 5 или 10, предпочтительно приблизительно 20, указывает на то, что иммуногенный продукт сильно инактивирован. Согласно одному варианту реализации настоящего изобретения остаточная активность менее приблизительно 50%, 40%, 30%, 20% или 10%, предпочтительно менее приблизительно 5% от активности нативного IL-13, указывает на то, что иммуногенный продукт сильно инактивирован.
Согласно одному варианту реализации настоящего изобретения иммуногенный продукт согласно настоящему изобретению содержит IL-13, связанный с CRM197, и является иммуногенным, это означает, что иммуногенный продукт способен индуцировать антитела к IL-13 in vivo в условиях TEST CIL-13. Согласно одному варианту реализации настоящего изобретения иммуногенный продукт согласно настоящему изобретению способен индуцировать поликлональные антитела к IL-13 in vivo, например, в условиях TEST CIL-13.
TEST CIL-13 проводят в соответствии со следующим способом:
Определенные количества общих белков (как определено, например, с помощью анализа белка по Бредфорд) иммуногенного продукта вводят путем инъекции мышам (старше 3-недельного возраста) по меньшей мере три раза в течение 120 дней. Согласно одному варианту реализации настоящего изобретения TEST CIL-13 представляет собой гетерологичную систему, например, иммуногенный продукт, содержащий IL-13, полученный не от мыши, вводят путем инъекции мыши, и тест включает введение дозы общих белков, варьирующейся от приблизительно 0,3 до 10 мкг. Согласно другому варианту реализации настоящего изобретения TEST CIL-13 представляет собой гомологичную систему, т. е. иммуногенный продукт, содержащий IL-13 мыши, вводят путем инъекции мыши, и тест включает введение дозы общих белков, варьирующейся от приблизительно 5 до приблизительно 30 мкг. Образцы сыворотки получают до иммунизации (образец сыворотки до имунизации), а также между днем 39 и днем 120 (тестируемый образец сыворотки). ИФА, направленный против IL-13, проводят, как объясняется ниже.
В общих чертах, 96-луночный планшет покрывают 1 мкг/мл IL-13, использованного для получения иммуногенного продукта, и инкубируют в течение ночи при температуре, варьирующейся от приблизительно 2°C до приблизительно 8°C. Затем планшет блокируют блокирующим буфером в течение приблизительно 90 мин при приблизительно 37°C. По 100 мкл образца до иммунизации и образцов сыворотки (до иммунизации и тестируемый) добавляют в лунки в двукратном последовательном разведении, таком как, например, начиная с 500 развед.-1 до 256000 развед.-1. В завершение в лунки добавляют меченое вторичное антитело к иммуноглобулину мыши (такое как, например, ПХ-конъюгированное антитело), и ИФА проявляют с использованием любых колориметрических средств, известных в данной области техники, таких как, например, раствор субстрата OPD.
Согласно одному варианту реализации настоящего изобретения, если оптическая плотность лунок, содержащих тестируемый образец сыворотки, превышает по меньшей мере приблизительно в 1,5 раза, предпочтительно по меньшей мере приблизительно в 2 раза оптическую плотность лунок, содержащих образец сыворотки до иммунизации, иммуногенный продукт считают иммуногенным, это означает, что он индуцировал антитела к IL-13 in vivo.
В этом тесте титры определяли как разведение сыворотки, при котором в анализе достигается 50% от ODmax минус OD соответствующего образца до иммунизации. Этот способ расчета является гораздо более жестким, чем определение хорошо известных титров сероконверсии, но обеспечивает более надежный анализ и меньше ложноположительных результатов. Титры выражали как коэффициенты разведения сыворотки (развед.-1).
Согласно другому варианту реализации настоящего изобретения в TEST CIL-13 значение титра ≥250 развед.-1, предпочтительно ≥500 развед.-1 указывает на то, что иммуногенный продукт согласно настоящему изобретению обеспечивает выработку связывающих антител против IL-13.
Согласно одному варианту реализации настоящего изобретения иммуногенный продукт согласно настоящему изобретению содержит IL-13, связанный с CRM197, и способен нейтрализовать активность IL-13 в условиях TEST DIL-13, упомянутого в настоящей заявке ниже. В соответствии с настоящим изобретением TEST DIL-13 выполняют для оценки нейтрализующей способности сыворотки, полученной от мышей, иммунизированных иммуногенным продуктом, с использованием репортерной линии клеток HEK-Blue™ IL-4/IL-13. В этих клетках стимуляция с использованием IL-4 или IL-13 активирует путь JAK/STAT6 с последующей выработкой SEAP. Нейтрализующие антитела к IL-13, индуцированные иммунизацией иммуногенными продуктами, затем можно оценить путем оценки уровней SEAP в супернатанте.
TEST DIL-13 проводят с использованием клеток HEK-Blue™ IL-4/IL-13 в соответствии со следующим способом:
В присутствии биоактивного IL-13 путь STAT6 линии клеток HEK-Blue™ IL-4/IL-13 активирован и вырабатывает SEAP, который можно определить количественно с помощью способов, хорошо известных в данной области техники. Этот анализ проводят в соответствии со следующим способом:
-Клетки HEK-Blue™ IL-4/IL-13 культивируют в среде для анализа, состоящей из DMEM GlutaMAX™ с добавлением 10% (об./об.) ФБС, 10 мМ HEPES, 50 ед./мл пенициллина и 50 мкг/мл стрептомицина.
-Образцы сыворотки, полученные после введения человеческого иммуногенного продукта, и контрольное антитело (поликлональное козье антитело к IL-13, такое как, например, AF-213-NA), разводили в среде для анализа до конечной концентрации 1/100 и 4 мкг/мл, соответственно, и добавляли к 2 нг/мл IL-13.
-Образцы сыворотки, полученные после введения мышиного иммуногенного продукта, и контрольное антитело (поликлональное козье антитело к muIL-13, такое как AF-413-NA), разводили в среде для анализа до конечной концентрации 1/100 и 1 мкг/мл, соответственно, и добавляли к 2 нг/мл muIL-13.
-Эти смеси затем инкубировали 1 час при комнатной температуре перед добавлением к 40000 клеток HEK-Blue™ IL 4/IL-13 на лунку. Планшеты инкубировали в течение приблизительно 24 ч при приблизительно 37°C в увлажненном инкубаторе с 5% CO2.
-В конце культивирования путь активации оценивают с использованием способов, хорошо известных в данной области техники. Один из примеров таких способов упомянут далее: 90 мкл/лунку раствора QUANTI-Blue™ добавляют к 10 мкл/лунку клеточного супернатанта. Затем планшеты инкубируют в течение 1 ч при 37°C в увлажненном инкубаторе с 5% CO2. Затем планшеты считывают при 625 нм на спектрофотометре.
Результаты НС50 выражали как коэффициент разведения сыворотки (развед.-1), нейтрализующий 50% от активности muIL-13 или IL-13. НС50 определяют путем интерполяции разведения сыворотки, приводящего к 50% от активности IL-13, на ось абсцисс.
В TEST DIL-13 значение НС50 ≥50, предпочтительно значение НС50 ≥100 развед.-1 указывает на то, что иммуногенный продукт согласно настоящему изобретению обеспечивает выработку нейтрализующих антител против IL-13. Согласно одному варианту реализации настоящего изобретения нейтрализующие антитела против IL-13, индуцированные введением иммуногенного продукта согласно настоящему изобретению, являются поликлональными.
Согласно одному варианту реализации настоящего изобретения иммуногенный продукт согласно настоящему изобретению содержит IL-4 и IL-13.
Согласно одному варианту реализации настоящего изобретения IL-4, IL-13 или они оба являются рекомбинантными.
Согласно одному варианту реализации настоящего изобретения как IL-4, так и IL-13 происходят от одного и того же млекопитающего. Согласно одному варианту реализации настоящего изобретения IL-4, IL-13 или они оба являются человеческими.
Согласно одному варианту реализации настоящего изобретения IL-4 представляет собой вариант IL-4 человека, причем указанный вариант проявляет по меньшей мере приблизительно 70%, 75, 80, 85, 90, 95% или более идентичность с IL-4 человека. Согласно одному варианту реализации настоящего изобретения IL-13 представляет собой вариант IL-13 человека, причем указанный вариант проявляет по меньшей мере приблизительно 70%, 75, 80, 85, 90, 95% или более идентичность с IL-13 человека.
Согласно одному варианту реализации настоящего изобретения IL-4, IL-13 или они оба являются полноразмерными.
Согласно одному варианту реализации настоящего изобретения IL-4 представляет собой фрагмент полноразмерного IL-4. Согласно одному варианту реализации настоящего изобретения IL-13 представляет собой фрагмент полноразмерного IL-13.
Согласно одному варианту реализации настоящего изобретения иммуногенный продукт согласно настоящему изобретению содержит IL-4 и IL-13, которые оба связаны с CRM197.
Согласно одному варианту реализации настоящего изобретения молярное соотношение цитокинов (т. е., IL-4 и IL-13):CRM197, варьируется от приблизительно 16:1 до приблизительно 1:2, предпочтительно от приблизительно 8:1 до приблизительно 2:1, более предпочтительно приблизительно 4:1.
Согласно одному варианту реализации настоящего изобретения молярное соотношение IL-4:CRM197, варьируется от приблизительно 8:1 до приблизительно 1:2, предпочтительно от приблизительно 4:1 до приблизительно 1:1, более предпочтительно приблизительно 2:1.
Согласно одному варианту реализации настоящего изобретения молярное соотношение IL-13:CRM197, варьируется от приблизительно 8:1 до приблизительно 1:2, предпочтительно от приблизительно 4:1 до приблизительно 1:1, более предпочтительно приблизительно 2:1.
Согласно одному варианту реализации настоящего изобретения молярное соотношение IL-4:IL-13, варьируется от приблизительно 5:1 до приблизительно 1:5, предпочтительно от приблизительно 2:1 до приблизительно 1:2, более предпочтительно приблизительно 1:1.
Согласно одному варианту реализации настоящего изобретения иммуногенный продукт согласно настоящему изобретению содержит IL-4 и IL-13, связанные с CRM197, и распознается антителами к IL-4 и антителами к IL-13.
Тот факт, что иммуногенный продукт содержит IL-4 и IL-13, связанные с CRM197, и распознается антителами к IL-4 и антителами к IL-13, можно проверить с помощью обычных способов, известных в данной области техники. Примером таких способов является ИФА в формате «сэндвич», направленный против цитокина/белка-носителя, с использованием, например, антитела для обнаружения, меченного биотином, системы усиления сигнала на основе стрептавидина-ПХ и/или раствора субстрата OPD.
Согласно одному варианту реализации настоящего изобретения распознавание иммуногенного продукта антителами к IL-4 и антителами к IL-13 может быть проверено с применением TESTS A (TEST AIL-4 и TEST AIL-13), описанных в настоящей заявке.
Согласно одному варианту реализации настоящего изобретения иммуногенный продукт согласно настоящему изобретению содержит IL-4 и IL-13, связанные с CRM197, и сильно инактивирован, это означает, что иммуногенный продукт показывает менее приблизительно 10% от начальной активности IL-4, предпочтительно менее приблизительно 5% и предпочтительно менее приблизительно 1% от начальной активности IL-4 и менее приблизительно 15% от начальной активности IL-13, предпочтительно менее приблизительно 10% и предпочтительно менее приблизительно 5% от начальной активности IL-13 в условии TESTS B (TEST BIL-4 и TEST BIL13), упомянутых в настоящей заявке ниже.
Согласно одному варианту реализации настоящего изобретения иммуногенный продукт содержит IL-4 и IL-13, связанные с CRM197, и является иммуногенным, это означает, что иммуногенный продукт способен (i) индуцировать антитела к IL-4 in vivo в условиях TEST CIL-4 и (i) индуцировать антитела к IL-13 in vivo в условиях TEST CIL-13. Согласно одному варианту реализации настоящего изобретения иммуногенный продукт согласно настоящему изобретению способен индуцировать поликлональные антитела к IL-4 in vivo, например, в условиях TEST CIL-4, и антитела к IL-13 in vivo, такие как, например, в условиях TEST CIL-13.
Согласно одному варианту реализации настоящего изобретения иммуногенный продукт согласно настоящему изобретению содержит IL-4 и IL-13, связанные с CRM197, и способен к (i) нейтрализации активности IL-4 в условии TEST DIL-4, упомянутого в настоящей заявке, и (ii) нейтрализации активности IL-13 в условии TEST DIL-13, упомянутого в настоящей заявке ниже. Согласно одному варианту реализации настоящего изобретения нейтрализующие антитела против IL-4 и IL-13, индуцированные введением иммуногенного продукта согласно настоящему изобретению, являются поликлональными.
Настоящее изобретение также относится к способу получения иммуногенного продукта, содержащего по меньшей мере один цитокин, выбранный из IL-4, IL-13 и их смесей, связанный с белком-носителем, предпочтительно CRM197, причем указанный способ включает следующие этапы:
а) приведения по меньшей мере одного цитокина в контакт с гетеробифункциональным перекрестносшивающим агентом, содержащим сложный эфир NHS, предпочтительно сложный эфир, представляющий собой N-[γ-малеимидобутирилокси]-сукцинимид (sGMBS);
b) приведения белка-носителя в контакт с гетеробифункциональным перекрестносшивающим агентом, содержащим сложный эфир NHS, предпочтительно N-сукцинимидил-S-ацетилтиоацетат (SATA), для образования комплекса носитель-SATA;
c) приведения комплекса sGMBS-цитокин, полученного на этапе (а), в контакт с комплексом носитель-SATA, полученным на этапе (b).
Согласно одному варианту реализации настоящего изобретения, на этапе а), реакционный буфер находится в жидком, предпочтительно водном, растворе.
Согласно одному варианту реализации настоящего изобретения, на этапе а), реакционный буфер имеет pH, варьирующийся от приблизительно 6 до приблизительно 8, предпочтительно варьирующийся от приблизительно 6,5 до приблизительно 7,5, более предпочтительно приблизительно pH=7,2.
Согласно одному варианту реализации настоящего изобретения, на этапе а), цитокин присутствует в растворе в концентрации, варьирующейся от приблизительно 0,1 до приблизительно 10 мг/мл, предпочтительно от приблизительно 0,5 до приблизительно 5 мг/мл, более предпочтительно приблизительно 1 мг/мл.
Согласно одному варианту реализации настоящего изобретения, на этапе а), гетеробифункциональный перекрестносшивающий агент, содержащий сложный эфир NHS, предпочтительно sGMBS, готовят в реакционном буфере в концентрации, варьирующейся от 1 мМ до 100 мМ, предпочтительно от 5 мМ до 50 мМ и более предпочтительно 10 мМ.
Согласно одному варианту реализации настоящего изобретения, на этапе а), IL-4 и гетеробифункциональный перекрёстносшивающий агент, содержащий сложный эфир NHS, предпочтительно sGMBS, смешивают в молярном соотношении IL-4:гетеробифункциональный перекрестносшивающий агент, содержащий сложный эфир NHS, предпочтительно sGMBS, варьирующемся от приблизительно 1:120 до приблизительно 1:1, предпочтительно от приблизительно 1:50 до приблизительно 1:10.
Согласно одному варианту реализации настоящего изобретения, на этапе а), IL-13 и гетеробифункциональный перекрестносшивающий агент, содержащий сложный эфир NHS, предпочтительно sGMBS, смешивают в молярном соотношении IL-13:гетеробифункциональный перекрестносшивающий агент, содержащий сложный эфир NHS, предпочтительно sGMBS, варьирующемся от приблизительно 1:120 до приблизительно 1:1, предпочтительно от приблизительно 1:50 до приблизительно 1:10.
Согласно одному варианту реализации настоящего изобретения, на этапе а), по меньшей мере один цитокин инкубируют с гетеробифункциональным перекрестносшивающим агентом, содержащим сложный эфир NHS, предпочтительно sGMBS, в течение периода, варьирующегося от приблизительно 30 мин до приблизительно 120 мин, предпочтительно от приблизительно 45 до приблизительно 90 минут и более предпочтительно в течение по меньшей мере 60 минут.
Согласно одному варианту реализации настоящего изобретения, на этапе а), этап приведения по меньшей мере одного цитокина в контакт с гетеробифункциональным перекрестносшивающим агентом, содержащим сложный эфир NHS, предпочтительно sGMBS, выполняют при температуре, варьирующейся от приблизительно 15°C до приблизительно 35°C, предпочтительно от приблизительно 18°C до приблизительно 27°C.
Согласно одному варианту реализации настоящего изобретения, после этапа а), удаляют небольшие соединения, имеющие молекулярную массу менее приблизительно 10 кДа, менее приблизительно 5 кДа или менее приблизительно 3 кДа, которые присутствуют в реакционной смеси. Эти небольшие соединения включают главным образом избыток гетеробифункционального перекрестносшивающего агента, содержащего сложный эфир NHS (и побочные продукты, связанные с гидролизом сложного эфира NHS), предпочтительно sGMBS, и избыточные молекулы, которые не вступили в реакцию. Такое удаление может быть выполнено с помощью способов, хорошо известных в данной области техники.
Согласно одному варианту реализации настоящего изобретения, в конце этапа а), содержание белка определяют с помощью анализа по Бредфорд или с помощью любого способа, хорошо известного в данной области техники.
Согласно одному варианту реализации настоящего изобретения, на этапе b), реакционный буфер находится в жидком, предпочтительно водном, растворе.
Согласно одному варианту реализации настоящего изобретения, на этапе b), реакционный буфер имеет pH, варьирующийся от приблизительно 6 до приблизительно 8, предпочтительно варьирующийся от приблизительно 6,5 до приблизительно 7,5, более предпочтительно приблизительно pH=7,2.
Согласно одному варианту реализации настоящего изобретения, на этапе b), CRM197 присутствует в растворе в концентрации, варьирующейся от приблизительно 0,2 до приблизительно 20 мг/мл, предпочтительно от приблизительно 1 до приблизительно 10 мг/мл, более предпочтительно приблизительно 2 мг/мл.
Согласно одному варианту реализации настоящего изобретения, на этапе b), гетеробифункциональный перекрестносшивающий агент, содержащий сложный эфир NHS, предпочтительно SATA, присутствует в растворе, предпочтительно в ДМСО, в концентрации, варьирующейся от 20 мМ до приблизительно 500 мМ, предпочтительно от приблизительно 50 мМ до приблизительно 200 мМ и более предпочтительно в концентрации приблизительно 100 мМ.
Согласно одному варианту реализации настоящего изобретения, на этапе b), CRM197 и гетеробифункциональный перекрестносшивающий агент, содержащий сложный эфир NHS, предпочтительно SATA, смешивают в молярном соотношении носитель:гетеробифункциональный перекрестносшивающий агент, содержащий сложный эфир NHS, предпочтительно SATA, варьирующемся от приблизительно 1:320 до приблизительно 1:10.
Согласно одному варианту реализации настоящего изобретения, на этапе b), CRM197 инкубируют с гетеробифункциональным перекрёстносшивающим агентом, содержащим сложный эфир NHS, предпочтительно SATA, в течение периода времени, варьирующегося от приблизительно 10 мин до приблизительно 60 мин, предпочтительно от приблизительно 15 минут до приблизительно 45 минут и наиболее предпочтительно в течение 30 минут.
Согласно одному варианту реализации настоящего изобретения этап приведения в контакт b) выполняют при температуре, варьирующейся от приблизительно 15°C до приблизительно 35°C, предпочтительно от приблизительно 18°C до приблизительно 27°C.
Согласно одному варианту реализации настоящего изобретения, после этапа b), удаляют небольшие соединения, имеющие молекулярную массу менее приблизительно 10 кДа, менее приблизительно 5 кДа или менее приблизительно 3 кДа, которые присутствуют в реакционной смеси. Эти небольшие соединения включают главным образом избыток гетеробифункционального перекрестносшивающего агента, содержащего сложный эфир NHS (и побочных продуктов, связанных с гидролизом сложного эфира NHS), предпочтительно SATA, ДМСО, и избыточные молекулы, которые не вступили в реакцию. Такое удаление может быть выполнено с помощью способов, хорошо известных в данной области техники.
Согласно одному варианту реализации настоящего изобретения, после этапа b), с комплексов между CRM197 и гетеробифункциональным перекрёстносшивающим агентом, содержащим сложный эфир NHS, предпочтительно SATA, снимают защиту, чтобы превратить защищаемую группу (гетеробифункциональный перекрёстносшивающий агент, содержащий сложный эфир NHS, предпочтительно SATA) в функциональную группу. Согласно одному варианту реализации настоящего изобретения указанный этап снятия защиты проводят после этапа удаления небольших соединений, имеющих молекулярную массу менее приблизительно 10 кДа, менее приблизительно 5 кДа или менее приблизительно 3 кДа, которые присутствуют в реакционной смеси.
Примеры способов снятия защиты с молекулы хорошо известны в данной области техники и включают, без ограничения, использование гидроксиламина, использование метоксиламина или использование основания (такого как, например, NaOH, KOH, K2CO3, MeONa, NH3 в метаноле).
Согласно одному варианту реализации настоящего изобретения этап снятия защиты включает добавление к реакционной смеси раствора гидроксиламина, предпочтительно в конечной концентрации, варьирующейся от приблизительно 10 мМ до приблизительно 500 мМ, предпочтительно от приблизительно 20 мМ до приблизительно 100 мМ, более предпочтительно приблизительно 50 мМ.
Согласно одному варианту реализации настоящего изобретения раствор гидроксиламина инкубируют с реакционной смесью в течение периода времени, варьирующегося от приблизительно 60 мин до приблизительно 180 мин, предпочтительно от приблизительно 90 минут до приблизительно 150 минут и более предпочтительно в течение 120 минут.
Согласно одному варианту реализации настоящего изобретения раствор гидроксиламина добавляют при 50 мМ в течение 120 минут.
Согласно одному варианту реализации настоящего изобретения инкубацию раствора гидроксиламина с реакционной смесью выполняют при температуре, варьирующейся от приблизительно 15°C до приблизительно 35°C, предпочтительно от приблизительно 18°C до приблизительно 27°C.
Согласно одному варианту реализации настоящего изобретения, после этапа снятия защиты, удаляют небольшие соединения, имеющие молекулярную массу менее приблизительно 10 кДа, 5 кДа или 3 кДа, которые присутствуют в реакционной смеси. Эти небольшие соединения включают главным образом избыток гидроксиламина и возможный остаточный SATA с предыдущего этапа. Такое удаление может быть выполнено с помощью способов, хорошо известных в данной области техники.
Согласно одному варианту реализации настоящего изобретения, в конце этапа b), содержание белка определяют с помощью анализа по Бредфорд или с помощью любого способа, хорошо известного в данной области техники.
Затем на этапе c) способа согласно настоящему изобретению конечный продукт этапа a) приводят в контакт с конечным продуктом этапа b) с получением посредством этого иммуногенного продукта согласно настоящему изобретению.
Согласно одному варианту реализации настоящего изобретения, на этапе с), конечный продукт этапа а), содержащий IL-4, и конечный продукт этапа b), содержащий CRM197, приводят в контакт в молярном соотношении IL-4:CRM197, варьирующемся от приблизительно 16:1 до приблизительно 1:2, предпочтительно от приблизительно 8:1 до приблизительно 2:1, более предпочтительно приблизительно 4:1.
Согласно одному варианту реализации настоящего изобретения, на этапе c), конечный продукт этапа a), содержащий IL-13, и конечный продукт этапа b), содержащий CRM197, приводят в контакт в соотношении IL-13:CRM197, варьирующемся от приблизительно 16:1 до приблизительно 1:2, предпочтительно от приблизительно 8:1 до приблизительно 2:1, более предпочтительно приблизительно 4:1.
Согласно другому варианту реализации этапа c) в контакт приводят конечный продукт этапа a), содержащий IL-4, конечный продукт этапа a), содержащий IL-13, и конечный продукт этапа b). Согласно одному варианту реализации настоящего изобретения указанный этап приведения в контакт проводят при молярном соотношении цитокинов (т. е. IL-4 и IL-13):CRM197, варьирующемся от приблизительно 16:1 до приблизительно 1:2, предпочтительно от приблизительно 8:1 до приблизительно 2:1, более предпочтительно приблизительно 4:1. Согласно одному варианту реализации настоящего изобретения указанный этап приведения в контакт проводят при молярном соотношении IL-4:CRM197, варьирующемся от приблизительно 8:1 до приблизительно 1:2, предпочтительно от приблизительно 4:1 до приблизительно 1:1, более предпочтительно приблизительно 2:1. Согласно одному варианту реализации настоящего изобретения указанный этап приведения в контакт проводят при молярном соотношении IL-13:CRM197, варьирующемся от приблизительно 8:1 до приблизительно 1:2, предпочтительно от приблизительно 4:1 до приблизительно 1:1, более предпочтительно приблизительно 2:1. Согласно одному варианту реализации настоящего изобретения указанный этап приведения в контакт проводят при молярном соотношении IL-4:IL-13, варьирующемся от приблизительно 5:1 до приблизительно 1:5, предпочтительно от приблизительно 2:1 до приблизительно 1:2, более предпочтительно приблизительно 1:1.
Согласно одному варианту реализации настоящего изобретения, на этапе c), реакционный буфер находится в жидком, предпочтительно водном, растворе.
Согласно одному варианту реализации настоящего изобретения, на этапе с), реакционный буфер имеет pH, варьирующийся от приблизительно 6 до приблизительно 8, предпочтительно варьирующийся от приблизительно 6,5 до приблизительно 7,5, более предпочтительно приблизительно pH=7,2.
Согласно одному варианту реализации этапа с) этап приведения в контакт проводят в течение периода времени, варьирующегося от приблизительно 2 часов до приблизительно 26 часов, предпочтительно от приблизительно 10 до 18 часов, более предпочтительно от приблизительно 12 до приблизительно 18 часов.
Согласно одному варианту реализации настоящего изобретения этап инкубации с) проводят при температуре, варьирующейся от приблизительно 2°C до 10°C, предпочтительно от приблизительно 3°C до приблизительно 7°C, и более предпочтительно при приблизительно 4°C.
Согласно одному варианту реализации настоящего изобретения, после этапа с), удаляют небольшие соединения, имеющие молекулярную массу менее приблизительно 100 кДа, менее приблизительно 50 кДа, менее приблизительно 25 кДа, менее приблизительно 10 кДа, менее приблизительно 5 кДа или менее приблизительно 3 кДа, которые присутствуют в реакционной смеси. Эти небольшие соединения включают главным образом избыточные молекулы, которые не вступили в реакцию. Такое удаление может быть выполнено с помощью способов, хорошо известных в данной области техники.
Согласно одному варианту реализации настоящего изобретения иммуногенный продукт, полученный на этапе с), концентрируют. Концентрирование иммуногенного продукта может быть выполнено квалифицированным специалистом в данной области техники с помощью любой методики, известной в данной области техники, такой как, например, способ центробежной ультрафильтрации, который необязательно можно комбинировать со стерильной фильтрацией.
Согласно одному варианту реализации настоящего изобретения иммуногенный продукт, полученный на этапе c) и необязательно концентрированный, лиофилизируют.
Настоящее изобретение также относится к иммуногенному продукту, который может быть получен с помощью способа согласно настоящему изобретению.
Настоящее изобретение также относится к композиции, содержащей, по существу состоящей или состоящий из по меньшей мере одного иммуногенного продукта, описанного в настоящей заявке выше. Согласно одному варианту реализации настоящего изобретения указанная композиция может называться иммуногенной композицией.
Настоящее изобретение также относится к фармацевтической композиции, содержащей, по существу состоящей или состоящей из по меньшей мере одного иммуногенного продукта, описанного выше, и по меньшей мере одного фармацевтически приемлемого вспомогательного вещества.
Фармацевтически приемлемые вспомогательные вещества, которые можно применять в фармацевтической композиции согласно настоящему изобретению, включают, но не ограничиваются ими, ионообменники, глинозем, стеарат алюминия, лецитин, белки сыворотки, такие как, например, сывороточный альбумин человека, буферные вещества, такие как, например, фосфаты, глицин, сорбиновая кислота, сорбат калия, смеси неполных глицеридов насыщенных растительных алифатических кислот, вода, соли или электролиты, такие как, например, сульфат протамина, двузамещенный гидрофосфат натрия, однозамещенный гидрофосфат калия, хлорид натрия, соли цинка, коллоидный диоксид кремния, трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы (например, карбоксиметилцеллюлозу натрия), полиэтиленгликоль, полиакрилаты, воски, блок-полимеры полиэтилен-полиоксипропилен, полиэтиленгликоль и ланолин.
Настоящее изобретение также относится к лекарственному средству, содержащему, по существу состоящему или состоящему из по меньшей мере одного иммуногенного продукта, описанного в настоящей заявке выше.
В настоящей заявке термин «состоящий по существу из», применительно к композиции, фармацевтической композиции или лекарственному средству, означает, что по меньшей мере один иммуногенный продукт согласно настоящему изобретению является единственным терапевтическим агентом или агентом, обладающим биологической активностью, в указанной композиции, фармацевтической композиции или лекарственном средстве.
Согласно одному варианту реализации настоящего изобретения композиция, фармацевтическая композиция или лекарственное средство согласно настоящему изобретению содержит или по существу состоит из иммуногенного продукта, содержащего IL-4, связанный с CRM197.
Согласно одному варианту реализации настоящего изобретения композиция, фармацевтическая композиция или лекарственное средство согласно настоящему изобретению содержит или по существу состоит из иммуногенного продукта, содержащего IL-13, связанный с CRM197.
Согласно одному варианту реализации настоящего изобретения композиция, фармацевтическая композиция или лекарственное средство согласно настоящему изобретению содержит или по существу состоит из иммуногенного продукта, содержащего CRM197, связанный как с IL-4, так и с IL-13.
Согласно одному варианту реализации настоящего изобретения композиция, фармацевтическая композиция или лекарственное средство согласно настоящему изобретению содержит или по существу состоит из смеси иммуногенного продукта, содержащего IL-4, связанный с CRM197, и иммуногенного продукта, содержащего IL-13, связанный с CRM197, в массовом соотношении, варьирующемся от приблизительно 10:1 до приблизительно 1:10, предпочтительно в массовом соотношении, варьирующемся от приблизительно 4:1 до 1:4.
Согласно одному варианту реализации настоящего изобретения композиция, фармацевтическая композиция или лекарственное средство согласно настоящему изобретению представляет собой вакцинную композицию. Согласно одному варианту реализации настоящего изобретения вакцинная композиция согласно настоящему изобретению содержит по меньшей мере один адъювант.
Настоящее изобретение также относится к составу композиции, фармацевтической композиции, лекарственного средства или вакцины согласно настоящему изобретению, причем указанная композиция, фармацевтическая композиция, лекарственное средство или вакцина содержат адъювант.
Согласно одному варианту реализации настоящего изобретения композиция, фармацевтическая композиция, лекарственное средство или вакцина согласно настоящему изобретению, таким образом, содержит один или более адъювантов.
Подходящие адъюванты, которые можно применять в настоящем изобретении, включают, но не ограничиваются ими:
(1) соли алюминия (квасцы), такие как, например, гидроксид алюминия, фосфат алюминия, сульфат алюминия и т. д.;
(2) эмульсионные составы типа «масло-в-воде» (с другими специфическими иммуностимулирующими агентами или без них, такими как, например, мурамиловые пептиды (определенные ниже) или компоненты бактериальной клеточной стенки), такие как, например, эмульсии на основе сквалена (например, эмульсии на основе сквалена типа «масло-в-воде») или эмульсии на основе сквалана, такие как, например,
(a) MF59 (адъювант на основе сквалена типа «масло-в-воде», описанный в РСТ публикации № WO 90/14837), содержащий 5% сквалена, 0,5% твин 80 и 0,5% спан 85 (необязательно содержащий различные количества MTP-PE (см. ниже, но необязательно)), изготовленный в виде субмикронных частиц с использованием микрофлюидизатора, такого как микрофлюидизатор модели 110Y (Microfluidics, Ньютон, Массачусетс, США),
(b) SAF, содержащий 10% сквалена, 0,4% твин 80, 5% блокированного плюроновым агентом полимера L121 и thr-MDP (см. ниже), либо микрофлюидизированный с получением субмикронной эмульсии, либо встряхиваемый с получением эмульсии с частицами большего размера, и
(c) адъювантная система Ribi™ (RAS), (Corixa, Гамильтон, Монтана, США), содержащая 2% сквалена, 0,2% твин 80 и один или более компонентов бактериальной клеточной стенки из группы, состоящей из 3-O-деацилированного монофосфориллипида A (MPL™), описанного в патенте США № 4,912,094 (Corixa), димиколата трегалозы (TDM) и скелета клеточной стенки (CWS), предпочтительно MPL+CWS (Detox™);
(d) адъювант на основе сквалана, содержащий, но не ограничиваясь этим, следующую композицию: сквалан 3,9%, масс./об., триолеат сорбитана (0,47%, масс./об.) и полиоксиэтилен (80), моноолеат сорбитана (0,47%, масс./об.), диспергированные в цитратном буфере;
(3) эмульсионные составы типа «вода-в-масле», такие как, например, ISA-51 или адъювант на основе сквалена типа «вода-в-масле» (например, ISA-720); масляные адъюванты, подходящие для использования в эмульсиях типа «вода-в-масле», могут включать минеральные масла и/или метаболизируемые масла. Минеральные масла могут быть выбраны из Bayol®, Marcol® и Drakeol, включая Drakeol® 6VR (SEPPIC, France). Метаболизируемые масла могут быть выбраны из масла SP (описанного в настоящей заявке ниже), Emulsigen (MPV Laboratories, Ралстон, Новая Зеландия), Montanide 264,266,26 (Seppic SA, Париж, Франция), а также растительных масел, животных масел, таких как рыбьи масла сквалан и сквален, и токоферола и его производных.
(4) можно применять сапониновые адъюванты, такие как Quil A или STIMULON™ QS-21 (Antigenics, Фреймингем, Массачусетс, США) (патент США № 5,057,540), или частицы, полученные из них, такие как ISCOM (иммуностимулирующие комплексы);
(5) бактериальные липополисахариды, синтетические аналоги липида A, такие как аминоалкилглюкозаминфосфатные соединения (AGP), или их производные или аналоги, которые доступны от Corixa и которые описаны в патенте США № 6,113,918; один из AGP представляет собой 2-[(R)-3-тетрадеканоилокситетрадеканоиламино]этил 2-дезокси-4-O-фосфоно-3-Oi[(R)-3-тетрадеканоилокситетрадеканоил]-2-[(R)-3-тетрадеканоилокситетрадеканоил]-b-D-глюкопиранозид, также известный как 529 (ранее известный как RC529), который изготовлен в водной форме или в виде стабильной эмульсии, синтетические полинуклеотиды, такие как олигонуклеотиды, содержащие мотив (ы) CpG (патент США № 6,207,646);
(6) цитокины, такие как интерлейкины (например, IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-12, IL-15, IL-18 и т. д.), интерфероны (например, гамма-интерферон), гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ), макрофагальный колониестимулирующий фактор (М-КСФ), фактор некроза опухоли (TNF), костимулирующие молекулы B7-1 и B7-2 и т. д.;
(7) детоксифицированные мутанты бактериального ADP-рибозилирующего токсина, такого как токсин холеры (CT), либо в виде дикого типа, либо в мутантной форме, например, в которой глутаминовая кислота в аминокислотном положении 29 заменена другой аминокислотой, предпочтительно гистидином, в соответствии с опубликованной международной заявкой на патент WO 00/18434 (см. также WO 02/098368 и WO 02/098369), токсин коклюша (PT) или термолабильный токсин E. coli (LT), в частности, LT-K63, LT-R72, CT-S109, PT-K9/G129 (см., например, WO 93/13302 и WO92/19265); и
(8) другие вещества, которые действуют как иммуностимулирующие агенты для повышения эффективности композиции. Мурамиловые пептиды включают, но не ограничиваются ими, N-ацетилмурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетилнормурамил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)-этиламин (MTP-PE) и др.
Используемый адъювант может зависеть, отчасти, от организма-реципиента. Более того, количество адъюванта для введения будет зависеть от типа и размера животного.
Согласно одному варианту реализации настоящего изобретения композиция, фармацевтическая композиция, лекарственное средство или вакцинная композиция согласно настоящему изобретению представляет собой (или содержат) эмульсию, дополнительно содержащую один или более поверхностно-активных агентов и необязательно по меньшей мере один адъювант, описанный в настоящей заявке выше. Согласно одному варианту реализации настоящего изобретения эмульсия представляет собой эмульсию типа «вода-в-масле» или эмульсию типа «масло-в-воде».
Примеры поверхностно-активных веществ, которые можно применять в настоящем изобретении, хорошо известны в данной области техники и включают, но не ограничиваются ими, моноолеат маннида, такой как Montanide® 80, коммерчески доступный у Arlacel (SEPPIC, Франция), твин 20, твин 80, спан 85, тритон X-100.
Согласно одному варианту реализации настоящего изобретения композиция, фармацевтическая композиция, лекарственное средство, вакцинная композиция согласно настоящему изобретению содержит терапевтически эффективное количество по меньшей мере одного иммуногенного продукта согласно настоящему изобретению.
Согласно одному варианту реализации настоящего изобретения и для целей хранения иммуногенный продукт или композицию, фармацевтическую композицию, лекарственное средство, вакцинную композицию или эмульсию согласно настоящему изобретению лиофилизируют.
Согласно одному варианту реализации настоящего изобретения композиция, фармацевтическая композиция, лекарственное средство, вакцинная композиция или эмульсия согласно настоящему изобретению, таким образом, могут быть обеспечены в сублимированном (лиофилизированном) виде. В соответствии с этим вариантом реализации иммуногенный продукт согласно настоящему изобретению комбинируют с одним или более вспомогательными веществами для лиофилизации. Различные вспомогательные вещества для лиофилизации хорошо известны специалисту в данной области техники и включают, без ограничения, сахара, такие как лактоза и маннит.
Согласно одному варианту реализации настоящего изобретения композиция, фармацевтическая композиция, лекарственное средство, вакцинная композиция или эмульсия согласно настоящему изобретению могут быть смешаны со стабилизаторами, например, чтобы защитить от разрушения белки, склонные к разрушению, чтобы увеличить срок годности иммуногенного продукта или улучшить эффективность сублимационной сушки. Подходящие стабилизаторы включают, но не ограничиваются ими, SPGA, углеводы (например, сорбит, маннит, трегалозу, крахмал, сахарозу, декстран или глюкозу), белки (такие как, например, альбумин или казеин, или продукты их разрушения), смеси аминокислот, таких как, например, лизин или глицин, и буферы, такие как, например, фосфаты щелочных металлов.
Согласно одному варианту реализации настоящего изобретения иммуногенный продукт, композиция, фармацевтическая композиция, вакцинная композиция или эмульсия согласно настоящему изобретению могут быть введены путем инъекции, местно (например, путем трансдермальной доставки), ректально, назально или вагинально.
Согласно одному варианту реализации настоящего изобретения иммуногенный продукт, композиция, фармацевтическая композиция, лекарственное средство, вакцинная композиция или эмульсия согласно настоящему изобретению находится в адаптированной форме для инъекции. Таким образом, согласно одному варианту реализации настоящего изобретения иммуногенный продукт, композиция, фармацевтическая композиция, лекарственное средство или вакцинная композиция согласно настоящему изобретению должны быть инъецированы субъекту путем внутримышечной, внутрибрюшинной или подкожной инъекции.
Примеры форм, подходящих для инъекционного использования, включают, но не ограничиваются ими, стерильные растворы или дисперсии и стерильные порошки для приготовления стерильных инъекционных растворов или дисперсий для немедленного введения. Предотвращение загрязнения микроорганизмами может быть достигнуто путем добавления в композицию консервантов, таких как, например, различные антибактериальные и противогрибковые агенты (например, парабены, хлорбутанол, фенол, сорбиновая кислота, тимеросал и тому подобное). Согласно одному варианту реализации настоящего изобретения предпочтительным может быть включение изотонических агентов, например, сахаров или хлорида натрия, для уменьшения боли во время инъекции. Согласно одному варианту реализации настоящего изобретения пролонгированное всасывание композиций для инъекций может быть достигнуто за счет использования в композициях агентов, замедляющих всасывание, например, моностеарата алюминия и желатина.
Согласно одному варианту реализации настоящего изобретения лиофилизированную вакцинную композицию согласно настоящему изобретению растворяют в воде для инъекций и осторожно перемешивают; затем добавляют иммуноадъювант, описанный в настоящей заявке выше; смесь осторожно перемешивают и вносят в подходящий шприц. Таким образом, настоящее изобретение также относится к медицинскому устройству, включая шприц, заполненный или предварительно заполненный вакцинной композицией согласно настоящему изобретению.
Согласно одному варианту реализации настоящего изобретения иммуногенный продукт, композиция, фармацевтическая композиция, лекарственное средство или вакцинная композиция согласно настоящему изобретению находится в адаптированной форме для местного введения. Примеры форм, адаптированных для местного введения, включают, но не ограничиваются ими, полимерный пластырь или пластырь с контролируемым высвобождением и т. п.
Согласно другому варианту реализации настоящего изобретения иммуногенный продукт, композиция, фармацевтическая композиция, лекарственное средство, вакцинная композиция или эмульсия согласно настоящему изобретению находится в адаптированной форме для ректального введения. Примеры форм, адаптированных для ректального введения, включают, но не ограничиваются ими, суппозиторий, микроклизмы, клизмы, гель, ректальную пену, крем, мазь и т. п.
Настоящее изобретение также относится к медицинскому устройству, которое представляет собой шприц, заполненный или предварительно заполненный композицией, фармацевтической композицией, лекарственным средством или вакцинной композицией согласно настоящему изобретению.
Согласно одному варианту реализации настоящего изобретения указанный шприц представляет собой двухкамерный шприц, в котором одна камера содержит раствор с иммуногенным продуктом согласно настоящему изобретению, а другая камера содержит адъювант.
Настоящее изобретение также относится к медицинскому устройству, содержащему флакон, предварительно заполненный иммуногенным продуктом согласно настоящему изобретению или композицией, фармацевтической композицией, лекарственным средством или вакцинной композицией согласно настоящему изобретению.
Настоящее изобретение также относится к иммуногенному продукту, композиции, фармацевтической композиции, лекарственному средству или вакцинной композиции согласно настоящему изобретению для лечения воспалительного нарушения у субъекта.
Таким образом, настоящее изобретение также относится к способу лечения воспалительного нарушения у субъекта, включающему введение субъекту иммуногенного продукта, композиции, фармацевтической композиции, лекарственного средства, вакцинной композиции или эмульсии согласно настоящему изобретению.
Настоящее изобретение также относится к способу индукции иммунного ответа против IL-4, IL-13 или их обоих у субъекта, включающему введение субъекту иммуногенного продукта, композиции, фармацевтической композиции, лекарственного средства или вакцинной композиции согласно настоящему изобретению.
Настоящее изобретение также относится к способу индукции у субъекта выработки антител, которые ингибируют биологическую активность или нейтрализуют биологическую активность IL-4, IL-13 или их обоих, включающему введение субъекту иммуногенного продукта, композиции, фармацевтической композиции, лекарственного средства или вакцинной композиции согласно настоящему изобретению. Согласно одному варианту реализации настоящего изобретения антитела представляют собой поликлональные антитела.
Согласно одному варианту реализации настоящего изобретения субъект поражен, предпочтительно у него диагностировано воспалительное нарушение, в частности, нарушение, ассоциированное с аберрантной экспрессией или активностью IL-4 и/или IL-13.
Согласно одному варианту реализации настоящего изобретения субъект представляет собой человека. Предпочтительно в соответствии с этим вариантом реализации по меньшей мере один цитокин, содержащийся в иммуногенном продукте согласно настоящему изобретению, является человеческим.
Согласно одному варианту реализации настоящего изобретения субъект представляет собой млекопитающее, не являющееся человеком (такое как, например, домашнее животное). Предпочтительно в соответствии с этим вариантом реализации по меньшей мере один цитокин, содержащийся в иммуногенном продукте согласно настоящему изобретению, происходит из указанного млекопитающего, не являющегося человеком.
Согласно одному варианту реализации настоящего изобретения воспалительное нарушение представляет собой нарушение, ассоциированное с аберрантной экспрессией или активностью IL-4 и/или IL-13.
Примеры воспалительного нарушения включают, но не ограничиваются ими, астму (как аллергическую, так и неаллергическую), аллергические состояния (такие как, например, разные виды пищевой аллергии, аллергия на яд, аллергия на кошек, аллергия на лекарство, синдром гипер-IgE, аллергический ринит, аллергический конъюнктивит и аллергический энтерогастрит), атопические нарушения (такие как, например, атопический дерматит, крапивница (включая хроническую идиопатическую крапивницу и хроническую спонтанную крапивницу), экзема), буллезный пемфигоид, респираторные нарушения (такие как аллергическая и неаллергическая астма, хроническая обструктивная болезнь легких (ХОБЛ)), полипоз носа и другие состояния, вовлекающие воспаление дыхательных путей (такие как, например, эозинофилия, фиброз и избыточная выработка слизи, включая муковисцидоз и легочный фиброз, системный склероз (SSc)); воспалительные и/или аутоиммунные нарушения или состояния, желудочно-кишечные нарушения или состояния (такие как, например, воспалительные заболевания кишечника (ВЗК) и эозинофильный эзофагит (ЭЭ), а также желудочно-кишечные заболевания, опосредуемые эозинофилами, язвенный колит, болезнь Крона и системная красная волчанка); системную красную волчанку, нарушения или состояния печени (такие как, например, цирроз и гепатоцеллюлярная карцинома), склеродермию; фиброзные заболевания или нарушения (такие как, например, фиброз печени (такой как, например, фиброз, вызванный вирусом гепатита B и/или C)), склеродермию; солидные опухоли или разные виды рака, такие как лейкоз (такой как, например, хронический В-клеточный лимфоцитарный лейкоз), глиобластому, лимфому (такую как, например, лимфома Ходжкина) и мастоцитоз.
Согласно одному варианту реализации настоящего изобретения воспалительное нарушение выбрано из группы, включающей астму (например, аллергическую астму), атопический дерматит, хроническую обструктивную болезнь легких (ХОБЛ), легочный фиброз, пищевую аллергию, полипоз носа и эозинофильный эзофагит.
Согласно одному варианту реализации настоящего изобретения воспалительное нарушение выбрано из группы, включающей астму (например, аллергическую астму), атопический дерматит, хроническую обструктивную болезнь легких (ХОБЛ), легочный фиброз и пищевую аллергию.
Согласно одному варианту реализации настоящего изобретения воспалительное нарушение представляет собой аллергию, астму или атопический дерматит.
Согласно одному варианту реализации настоящего изобретения воспалительное нарушение представляет собой аллергическую астму.
Согласно одному варианту реализации настоящего изобретения воспалительное нарушение представляет собой солидную опухоль. Согласно одному варианту реализации настоящего изобретения способ согласно настоящему изобретению предназначен для предотвращения метастазов из солидной опухоли.
Настоящее изобретение также относится к способу индукции десенсибилизации субъекта, имеющего аллергию, к специфичному антигену, причем указанный способ включает введение субъекту иммуногенного продукта, композиции, фармацевтической композиции, лекарственного средства или вакцинной композиции согласно настоящему изобретению и указанного аллергена.
В настоящей заявке термин «десенсибилизация», также известный как иммунотерапия аллергеном, десенсибилизация или гипосенсибилизация, или вакцинация против аллергии, относится к медикаментозному лечению разных видов аллергии на факторы окружающей среды, таких как аллергическая астма. Такое лечение включает воздействие на людей повышающихся количеств аллергена, чтобы уменьшить ответ иммунной системы в присутствии аллергена.
Примеры аллергенов включают, но не ограничиваются ими, вдыхаемые аллергены, проглатываемые аллергены и контактные аллергены.
Примеры вдыхаемых аллергенов включают, но не ограничиваются ими, аллергены из Astigmata (например, Acarus siro (амбарный клещ, Aca s 13), Blomia tropicalis (клещ, Blo t), Dermatophagoides farinae (американский клещ домашней пыли, Der f), Dermatophagoides microceras (клещ домашней пыли, Der m), Dermatophagoides pteronyssinus (европейский клещ домашней пыли, Der p), Euroglyphus maynei (клещ домашней пыли, Eur m), Glycyphagus domesticus (амбарный клещ, Gly d 2), Lepidoglyphus destructor (амбарный клещ, Lep d), Tyrophagus putrescentiae (амбарный клещ, Tyr p); Blattaria (например, Blattella germanica (немецкий таракан, Bla g), Periplaneta americana (американский таракан, Per a); Coleoptera (например, Harmonia axyridis (азиатская божья коровка, Har a)), Diptera (например, Aedes aegypti (комар желтой лихорадки, Aed a)), Chironomus kiiensis (комар-дергун, Chi k), Chironomus thummi thummi (комар-дергун, Chi t), Forcipomyia taiwana (мокрец, For t), Glossina morsitans (муха цеце из группы саванна, Glo m), Hemidiptera: Triatoma protracta (калифорнийский конусоносный клоп, Tria p), Hymenoptera (например, Apis cerana (восточная медоносная пчела, Api c), Apis dorsata (гигантская медоносная пчела, Api d), Apis mellifera (медоносная пчела, Api m)), Bombus pennsylvanicus (шмель, Bom p), Bombus terrestris (шмель, Bom t), Dolichovespula arenaria (желтый шершень, Dol a), Dolichovespula maculata (оса пятнистая, Dol m), Myrmecia pilosula (австралийский муравей-бульдог, Myr p), Polistes annularis (оса, Pol a), Polistes dominulus (средиземноморская бумажная оса, Pol d), Polistes exclamans (оса, Pol e), Polistes fuscatus (оса, Pol f), Polistes gallicus (оса, Pol g), Polistes metricus (оса, Pol m), Polybia paulista (оса, Pol p), Polybia scutellaris (оса, Pol s), Solenopsis geminata (тропический огненный муравей, Sol g), Solenopsis invicta (завезенный красный огненный муравей, Sol i), Solenopsis richteri (черный огненный муравей, Sol r), Solenopsis saevissima (бразильский огненный муравей, Sol s), Vespa crabro (европейский шершень, Vesp c), Vespa mandarinia (гигантский азиатский шершень, Vesp m), Vespula fiavopilosa (складчатокрылая оса, Vesp f), Vespula germanica (складчатокрылая оса, Vesp g), Vespula maculifrons (складчатокрылая оса, Vesp m), Vespula pensylvanica (складчатокрылая оса, Vesp p), Vespula squamosa (складчатокрылая оса, Vesp s), Vespula vidua (оса, Vesp vi), Vespula vulgaris (складчатокрылая оса, Vesp v), Ixodida (например, Argas reflexus (голубиный клещ, Arg r), Lepidoptera (например, Bombyx niori (тутовый шелкопряд, Bomb n)), Plodia interpunctella (индийская мучная моль, Plo i), Thaumetopoea pityocampa (сосновый походный шелкопряд, Tha p), Thysanura (например, Lepisma saccharina (чешуйница обыкновенная, Lep s)), Siphonaptera (например, Ctenocephalides felis felis (блоха кошачья, Cte f)), Carnivora (например, Canis familiaris (собака, Can f)), Felis domesticus (кошка, Fel d); Lagomorpha (например, Oryctolagus cuniculus (кролик, Ory c)), Perissodactlyla: Equus caballus (домашняя лошадь, Equ c), Pleuronectiformes (например, Lepidorhombus whiffiagonis (мегрим, цитарихт, галло, Lep w)), Rodentia (например, Cavia porcellus (морская свинка, Cav p)), Mus musculus (мышь, Mus m), Rattus norvegius (крыса, Rat n)); Coniferales: Chamaecyparis obtusa (японский кипарис, Cha o), Cupressus arizonica (кипарис, Cup a), Cryptomeria japonica (суги, Cry j), Cupressus sempervirens (обычный кипарис, Cup s), Juniperus ashei (можжевельник мексиканский, Jun a), Juniperus oxycedrus (можжевельник красный, Jun o), Juniperus sabinoides (можжевельник мексиканский, Jun s), Juniperus virginiana (можжевельник виргинский, Jun v); Gentianales (например, Catharanthus roseus (розовый барвинок, Cat r)); Poales (например, Anthoxanthum odoratum (душистый колосок, Ant o 1)), Cynodon dactylon (свинорой пальчатый, Cyn d 1, Cyn d 7, Cyn d 12, Cyn d 15, Cyn d 22w, Cyn d 23, Cyn d 24), Dactylis glomerata (ежа обыкновенная, Dae g 1, Dae g 2, Dae g 3, Dae g 4, Dae g 5), Festuca pratensis (овсяница луговая, Fes p 4), Holcus lanatus (бухарник шерстистый, Hol l 1, Hol l 5), Hordeum vulgare (ячмень, Hor v 1, Hor v 5, Hor v 12, Hor v 15, Hor v 16, Hor v 17, Hor v 21), Lolium perenne (райграс многолетний пастбищный, Lol p 1, Lol p 2, Lol p 3, Lol p 4, Lol p 5, Lol p 11), Oryza sativa (рис, Ory s 1, Ory s 12), Paspalum notarum (гречка заметная, Pas n 1), Phalaris aquatica (канареечник водный, Pha a 1, Pha a 5), Phleum pratense (тимофеевка, Phl p 1, Phl p 2, Phl p 4, Phl p 5, Phl p 6, Phl p 7, Phl p 11, Phl p 12, Phl p 13), Poa pratensis (мятлик луговой, Poa p 1, Poa p 5), Secale cereale (рожь, Sec c 1, Sec c 20), Sorghum halepense (сорго алеппское, Sor h 1), Triticum aestivum (пшеница, Tri a 12, Tri a 14, Tri a 185, Tri a 19, Tri a 25, Tri a 26, Tri a 27, Tri a 28, Tri a 29, Tri a 30), Zea mays (маис, Zea m 1 , Zea m 12, Zea m 14, Zea m 25), Fagales: Alnus glutinosa (ольха, Aln g 1, Aln g 4), Betula verrucosa (береза повислая, Bet v 1, Bet v 2, Bet v 3, Bet v 4 , Bet v 5, Bet v 6, Bet v 7), Carpinus betuhxs (граб, Car b 1); Lamiales (например, Fraxinus excelsior (ясень обыкновенный, Fra e l)), Ligustrum vulgare (бирючина обыкновенная, Lig v), Syringa vulgaris (сирень обыкновенная, Syr v); Malpighiales (например, Hevea brasiliensis (гевея бразильская (латекс), Hev b 1, Hev b 2, Hev b 3, Hev b 4, Hev b 5, Hev b 6, Hev b 7, Hev b 8, Hev b 9, Hev b 10, Hev b 11, Hev b 12, Hev b 13)); Proteales (например, Platanus acerifolia (кленолистный платан, Pla a 1, Pla a 2, Pla a 3), Platanus orientalis (платан восточный, Pla или 1, Pla или 2, Pla или 3)).
Согласно одному варианту реализации вдыхаемый аллерген выбран из группы, включающей или состоящей из Acarus siro (амбарный клещ, Aca s 13), Dermatophagoides farinae (американский клещ домашней пыли, Der f), Dermatophagoides microceras (клещ домашней пыли, Der m), Dermatophagoides pteronyssinus (европейский клещ домашней пыли, Der p), Euroglyphus maynei (клещ домашней пыли, Eur m), Glycyphagus domesticus (амбарный клещ, Gly d 2), Polistes annularis (оса, Pol a), Polistes dominulus (средиземноморская бумажная оса, Pol d), Polistes exclamans (оса, Pol e), Polistes fuscatus (оса, Pol f), Polistes gallicus (оса, Pol g), Polistes metricus (оса, Pol m), Polybia paulista (оса, Pol p), Polybia scutellaris (оса, Pol s), Felis domesticus (кошка, Fel d), Poales и Betula verrucosa (береза повислая, Bet v 1, Bet v 2, Bet v 3, Bet v 4, Bet v 5, Bet v 6, Bet v 7).
Примеры проглатываемых аллергенов включают, но не ограничиваются ими, аллергены из грибов Ascomycota, таких как, например, Dothideales (например, Alternaria alternata (гриб альтернариозной гнили, Alt a), Cladosporium cladosporioides (Cla c), Cladosporium herbarum (Cla h), Curvularia lunata (Cur l), - Eurotiales: Aspergillus flavus (Asp fl), Aspergillus fumigatus (Asp f), Aspergillus niger (Asp n), Aspergillus oryzae (Asp o), Penicillium brevicompactum (Pen b), Penicillium chrysogenum (Pen ch), Penicillium citrinum (Pen c), Penicillium oxalicum (Pen o), Hypocreales (например, Fusarium culmorum (Fus c)); Onygenales (например, Trichophyton rubrum (Tri r), Trichophyton tonsurans (Tri t)), Saccharomycetales: Candida albicans (дрожжи, Cand a), Candida boidinii (дрожжи, Cand b); Tuberculariales (например, Epicoccum purpurascens (Epi p)), аллергены из базидиальных грибов (Basidiomycota), таких как, например, Hymenomycetes (например, Coprinus comatus (навозник белый, Cop c)), Psilocybe cubensis (галлюциногенный гриб, Psi c), Urediniomycetes (например, Rhodotorula mucilaginosa (дрожжи, Rho m)); Ustilaginomycetes (например, Malassezia furfur (инф. агент лишая отрубевидного, Mala f), Malassezia sympodialis (Mala s)); антибиотики (такие как, например, пенициллины, цефалоспорины, аминозиды, хинолоны, макролиды, тетрациклин, сульфамиды); лекарственные средства (такие как, например, ацетилсалициловая кислота, вакцины, морфины и производные); витамины, например, витамин K1; и пищевые аллергены (такие как, например, аллерген из молока, яйца, арахиса, древесного ореха (грецкого ореха, кешью и т. д.), рыбы, моллюска, сои, пшеницы, а также моркови, яблока, груши, авокадо, абрикоса, персика).
Согласно одному варианту реализации настоящего изобретения проглатываемый аллерген представляет собой пищевой аллерген.
Согласно одному варианту реализации настоящего изобретения пищевой аллерген выбран из группы, включающей или состоящей из аллергена из молока, яйца, арахиса, древесного ореха (грецкого ореха, кешью и т. д.), рыбы, моллюска, сои, пшеницы, а также моркови, яблока, груши, авокадо, абрикоса, персика.
Примеры контактных аллергенов включают, но не ограничиваются ими, тяжелые металлы (такие как, например, никель, хром, золото), латекс, гаптены, такие как, например, галотан, гидралазин.
Согласно одному варианту реализации настоящего изобретения аллерген выбран из группы, включающей или состоящей из Acarus siro (амбарный клещ, Aca s 13), Dermatophagoides farinae (американский клещ домашней пыли, Der f), Dermatophagoides microceras (клещ домашней пыли, Der m), Dermatophagoides pteronyssinus (европейский клещ домашней пыли, Der p), Euroglyphus maynei (клещ домашней пыли, Eur m), Glycyphagus domesticus (амбарный клещ, Gly d 2), Polistes annularis (оса, Pol a), Polistes dominulus (средиземноморская бумажная оса, Pol d), Polistes exclamans (оса, Pol e), Polistes fuscatus (оса, Pol f), Polistes gallicus (оса, Pol g), Polistes metricus (оса, Pol m), Polybia paulista (оса, Pol p), Polybia scutellaris (оса, Pol s), Felis domesticus (кошка, Fel d), Poales и Betula verrucosa (береза повислая, Bet v 1, Bet v 2, Bet v 3, Bet v 4, Bet v 5, Bet v 6, Bet v 7) и пищевых аллергенов.
Настоящее изобретение также относится к способу повышения эффективности и/или уменьшения продолжительности десенсибилизации субъекта, имеющего аллергию, к специфичному аллергену, причем указанного субъекта лечат путем десенсибилизации и дополнительно вводят иммуногенный продукт, композицию, фармацевтическую композицию, лекарственное средство или вакцинную композицию согласно настоящему изобретению.
Согласно одному варианту реализации настоящего изобретения в способах согласно настоящему изобретению субъекту вводят сначала иммуногенный продукт, композицию, фармацевтическую композицию, лекарственное средство или вакцинную композицию согласно настоящему изобретению, а затем аллерген.
Согласно одному варианту реализации настоящего изобретения в способах согласно настоящему изобретению субъекту вводят сначала аллерген, а затем иммуногенный продукт, композицию, фармацевтическую композицию, лекарственное средство или вакцинную композицию согласно настоящему изобретению.
Согласно другому варианту реализации настоящего изобретения в способе согласно настоящему изобретению субъект получает комбинированное введение иммуногенного продукта, композиции, фармацевтической композиции, лекарственного средства или вакцинной композиции согласно настоящему изобретению и аллергена.
Настоящее изобретение также относится к композиции, фармацевтической композиции, лекарственному средству или вакцине, описанным в настоящей заявке выше, причем указанная композиция, фармацевтическая композиция, лекарственное средство или вакцина также содержит по меньшей мере один аллерген.
Согласно одному варианту реализации настоящего изобретения терапевтически эффективное количество по меньшей мере одного иммуногенного продукта согласно настоящему изобретению вводят или оно должно быть введено субъекту. Согласно одному варианту реализации настоящего изобретения терапевтически эффективное количество соответствует количеству общих белков, определенному с использованием анализа белков по Бредфорд, хорошо известного в данной области техники.
Согласно одному варианту реализации настоящего изобретения количество иммуногенного продукта, подлежащее введению субъекту, индуцирует иммунозащитный ответ без значительных нежелательных эффектов.
Согласно одному варианту реализации настоящего изобретения количество иммуногенного продукта, подлежащее введению субъекту, индуцирует десенсибилизацию к аллергену без значительных нежелательных эффектов.
Оптимальные количества компонентов для иммуногенного продукта согласно настоящему изобретению могут быть установлены с помощью стандартных исследований, включающих наблюдение соответствующих иммунных ответов у субъектов. После первоначальной вакцинации субъекты могут получить одну или более стимулирующих иммунизаций с целесообразным интервалом.
Согласно одному варианту реализации настоящего изобретения лечение состоит из однократной дозы или множества доз в течение определенного периода времени.
Согласно одному варианту реализации настоящего изобретения субъекту, подлежащему лечению, вводят по меньшей мере дважды в месяц терапевтически эффективное количество иммуногенного продукта, описанного в настоящей заявке выше.
Согласно другому варианту реализации настоящего изобретения субъекту, подлежащему лечению, вводят дважды в течение 1 месяца терапевтически эффективное количество иммуногенного продукта согласно настоящему изобретению. В этом варианте реализации введение субъекту можно осуществлять один раз в день 0 и второй раз между днем 7 и днем 28. Согласно одному варианту реализации настоящего изобретения введение субъекту осуществляют один раз в день 0 и второй раз в день 28.
Согласно другому варианту реализации настоящего изобретения субъекту, подлежащему лечению, вводят три раза в течение 1 месяца терапевтически эффективное количество иммуногенного продукта согласно настоящему изобретению. В этом варианте реализации введение субъекту, подлежащему лечению, можно осуществлять один раз в день 0, второй раз между днем 7 и днем 14 и третий раз между днем 21 и днем 28. Согласно одному варианту реализации настоящего изобретения введение субъекту осуществляют один раз в день 0, второй раз в день 7 и третий раз в день 28.
Согласно другому варианту реализации настоящего изобретения субъекту, подлежащему лечению, можно дополнительно вводить один раз каждые три месяца терапевтически эффективное количество иммуногенного продукта согласно настоящему изобретению.
Согласно одному варианту реализации настоящего изобретения терапевтически эффективное количество иммуногенного продукта согласно настоящему изобретению может быть введено субъекту, подлежащему лечению, три раза в течение одного месяца, как описано в настоящей заявке выше, а затем дополнительно один раз каждые три месяца.
Согласно другому варианту реализации настоящего изобретения субъекту, подлежащему лечению, может быть дополнительно введено терапевтически эффективное количество иммуногенного продукта, описанного в настоящей заявке выше, когда количество антител против IL-4 не поддается обнаружению в образце сыворотки, полученном от субъекта.
Согласно другому варианту реализации настоящего изобретения субъекту, подлежащему лечению, может быть дополнительно введено терапевтически эффективное количество иммуногенного продукта, описанного в настоящей заявке выше, когда количество антител против IL-13 не поддается обнаружению в образце сыворотки, полученном от субъекта.
Согласно другому варианту реализации настоящего изобретения субъекту, подлежащему лечению, может быть дополнительно введено терапевтически эффективное количество иммуногенного продукта, описанного в настоящей заявке выше, когда количество антител против IL-4 и IL-13 не поддается обнаружению в образце сыворотки, полученном от субъекта.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1 представляет собой схему химической конъюгации sGMBS-модифицированного IL-4 или IL-13 и SATA-меченого белка-носителя посредством добавления тиол-малеимида для изготовления иммуногенных продуктов согласно настоящему изобретению.
Фигура 2 представляет собой набор графиков, показывающих антигенность иммуногенных продуктов muIL-4 и muIL-13. Захват выполняли с использованием антитела к CRM197 (A, C) или антитела к KLH (B, D), а обнаружение выполняли с использованием биотинилированного поликлонального антитела к muIL-4 (A, B) или биотинилированного поликлонального антитела к muIL-13 (C, D). Представленные значения OD представляют собой средние значения OD для двух повторов.
Фигура 3 представляет собой исследовательскую схему иммунизаций у мышей Balb/с. Четыре иммунизации в дни 0, 7, 28 и 49 иммуногенного продукта (с CRM197 или KLH в качестве белка-носителя), неконъюгированного muIL-4 или muIL-13 + CRM197 и только CRM197 и ФСБ, все эмульгированные в адъюванте на основе сквалена и введенные путем внутримышечной (в/м) инъекции у 10 мышей на группу, за исключением контрольной группы только из 5 мышей. Образцы крови были взяты перед дозированием и в день 39 и день 120.
Фигура 4 представляет собой набор графиков, показывающих титры антител к muIL-4 (A), muIL-13 (B), CRM197 (C) и KLH (D) в сыворотках мышей. Десять мышей на группу использовали в группах иммуногенных продуктов и 5 мышей использовали в контрольных группах. Полоски представляют собой медиану.
Фигура 5 представляет собой график, показывающий muIL-4-нейтрализующую способность в сыворотках мышей. Десять мышей на группу использовали в группах иммуногенных продуктов и 5 мышей использовали в контрольных группах. Полоски представляют собой медиану.
Фигура 6 представляет собой график, показывающий muIL-13-нейтрализующую способность в сыворотках мышей. Десять мышей на группу использовали в группах иммуногенных продуктов и 5 мышей использовали в контрольных группах. Полоски представляют собой медиану.
Фигура 7 представляет собой исследовательскую схему иммунизаций и сенсибилизации астмы у мышей Balb/c.
Фигура 8 представляет собой набор графиков, показывающих титры антител к muIL-4 (A) и антител к muIL-13 (B) в сыворотках мышей. Двенадцать мышей на группу. Полоски представляют собой медиану.
Фигура 9 представляет собой набор графиков, показывающих muIL-4 (A) и muIL-13 (B) нейтрализующую способность в сыворотках мышей. Двенадцать мышей на группу. Полоски представляют собой медиану.
Фигура 10 представляет собой график, показывающий гиперчувствительность дыхательных путей на вдыхаемый метахолин. Значения индекса PenH (enhanced pause, скорректированная пауза, Penh) измеряли с помощью неинвазивной плетизмографии всего тела. Данные были получены с использованием 7-8 мышей на группу для мышей, сенсибилизированных/стимулированных HDM, и n = 16 для контролей ФСБ. * или ** или ***:P<0,5, или 0,1, или 0,001 в сравнении с группой CRM197-HDM, с использованием непарного U-критерия Манна-Уитни.
Фигура 11 представляет собой набор графиков, показывающих уровни циркулирующего IgE в сыворотке, собранной до вакцинации (A) и через 24 часа после последней стимуляции с использованием HDM или ФСБ (B). Данные были получены с использованием 7-8 мышей на группу для мышей, сенсибилизированных/стимулированных HDM, и n = 16 для контролей ФСБ. ***:P<0,001 в сравнении с группой CRM197-HDM, с использованием непарного U-критерия Манна-Уитни.
Фигура 12 представляет собой набор графиков, показывающих уровни CD45+ клеток (A) и эозинофилов (B) в БАЛ, собранном через 24 ч после последней стимуляции HDM. Данные были получены с использованием 7-8 мышей на группу для мышей, сенсибилизированных/стимулированных HDM, и n = 16 для контролей ФСБ. * или ** или ***:P<0,5 или 0,1, или 0,001 в сравнении с группой CRM197-HDM, с использованием непарного U-критерия Манна-Уитни.
Фигура 13 представляет собой набор графиков, показывающих антигенность иммуногенного продукта IL-4 (А), иммуногенного продукта IL-13 (В) и комбинированного (Combo) иммуногенного продукта (А и В). Захват выполняли с использованием антитела к CRM197, а обнаружение выполняли с использованием биотинилированного поликлонального антитела к huIL-4 (A) или биотинилированного поликлонального антитела к huIL-13 (B). Представленные значения OD представляют собой средние значения OD для двух повторов.
Фигура 14 представляет собой исследовательскую схему иммунизации у мышей Balb/с.
Фигура 15 представляет собой набор графиков, показывающих титры антител к IL-4 (А) и антител к IL-13 (В) в сыворотках мышей. Десять мышей на группу. Полоски представляют собой медиану.
Фигура 16 представляет собой набор графиков, показывающих нейтрализующую способность антител к IL-4 (А) и антител к IL-13 (B) в сыворотках мышей. Десять мышей на группу. Полоски представляют собой медиану.
ПРИМЕРЫ
Настоящее изобретение дополнительно иллюстрируется следующими примерами.
Настоящее изобретение относится к иммуногенному продукту, в котором в качестве белка-носителя применяется CRM197. Свойства иммуногенного продукта согласно настоящему изобретению проиллюстрированы следующими примерами. Кроме того, продукт согласно настоящему изобретению сравнивали с иммуногенным продуктом, изготовленным с KLH, чтобы отличить настоящее изобретение от предшествующего уровня техники и показать его преимущество в сравнении с предшествующим уровнем техники.
CRM197 представляет собой нетоксичную форму дифтерийного токсина, не обладающую токсической активностью из-за замены одного основания, в его токсиновом домене, с глицина на остаток глутаминовой кислоты в положении 52 (Uchida et al. 1973 J Biol Chem). В качестве альтернативы также тестировали гемоцианин лимфы улитки (KLH), медьсодержащий белок, который обнаруживается у членистоногих и моллюсков (Swaminathan et al. 2014), и сравнивали его с CRM197.
Иммуногенные продукты согласно настоящему изобретению получали с помощью способа изготовления, разработка которого описана ниже.
Конъюгацию тиол-малеимид применяют для получения иммуногенных продуктов IL-4 и IL-13. Сульфгидрильные группы вводили на белок-носитель CRM197 с использованием SATA и последующего снятия защиты гидроксиламином, в то время как цитокин muIL-4 или muIL-13 дериватизировали с использованием sGMBS, малеимидсодержащего агента. Как SATA, так и sGMBS представляют собой гетеробифункциональные перекрестносшивающие агенты, содержащие сложный эфир NHS, который реагирует с первичными аминами (такими как ε-аминогруппы остатков лизина и N-концы белка). Обзор синтеза иммуногенного продукта за счет конъюгации тиол-малеимид представлен на Фигуре 1.
Пример 1. Получение мышиных иммуногенных продуктов IL-4 и IL-13 согласно настоящему изобретению с двумя белками-носителями
а) Функционализация белка-носителя
CRM197 или KLH разводили в буфере для модификации, содержащем 70 мМ буфер на основе фосфата натрия, 150 мМ NaCl, 5 мМ ЭДТА (pH=7,2). SATA разводили в ДМСО до достижения концентрации 100 мМ. Затем SATA добавляли к CRM197 или KLH, и через 30 минут инкубации на шейкере-качалке при комнатной температуре избыток SATA удаляли с использованием обессоливающей центрифужной колонки Zeba™ в соответствии с инструкциями производителя.
Затем гидроксиламин разбавляли в том же буфере до 500 мМ. Затем CRM197-SATA или KLH-SATA инкубировали с раствором гидроксиламина в конечной концентрации 50 мМ в течение 2 часов на шейкере-качалке при комнатной температуре. Наконец, смесь обессоливали, и избыток реагентов удаляли с использованием обессоливающей центрифужной колонки Zeba™.
b) Функционализация muIL-4 и muIL-13
muIL-4 или muIL-13 растворяли в буфере для модификации (70 мМ буфер на основе фосфата натрия, 150 мМ NaCl, 5 мМ ЭДТА, pH=7,2). sGMBS разводили в буфере для модификации до 10 мМ. Затем sGMBS добавляли к muIL-4 или muIL-13 и после одного часа инкубации на шейкере-качалке при комнатной температуре избыток sGMBS удаляли с помощью обессоливающей центрифужной колонки Zeba™.
c) Конъюгация
После функционализации CRM197, KLH, muIL-4 и muIL-13 содержание белка для каждого препарата определяли с помощью анализа по Бредфорд.
Функционализированный CRM197 или функционализированный KLH добавляли к функционализированному muIL-4 или функционализированному muIL-13 в молярном соотношении 1:2 (носитель:muIL-4 или носитель:muIL-13) и 1:20, соответственно. Соотношение 1:20 для KLH было выбрано на основании различия по молекулярной массе между KLH и CRM197 (CRM197 ~58 кДа в сравнении с субъединицей KLH, используемой в данном изготовлении, ~400 кДа) и на основании предыдущего опыта получения иммуногенного продукта ИФН, вакцина, которая в настоящее время проходит оценку в клиническом исследовании фазы IIb с участием пациентов с волчанкой (NCT02665364), что позволяет смешивать сходное количество цитокина и носителя во всех способах изготовления.
Препараты отдельных иммуногенных продуктов инкубировали в течение ночи при 4°C на шейкере-качалке. Полученные иммуногенные продукты затем концентрировали с использованием Amicon (мембрана с отсечением 3 кДа), фильтровали через фильтр с размером пор 0,22 мкм и хранили при 4°C.
d) Контроль (неконъюгированные цитокины и CRM197)
В качестве контролей готовили две смеси (называемые неконъюгированными цитокинами и CRM197) без функционализации белков:
-muIL-4 и CRM197 смешивали в молярном соотношении 1:2 (CRM197:цитокин). Смесь готовили из расчета 700 мкг/мл без использования какого-либо связывающего реагента.
-muIL-13 и CRM197 смешивали в молярном соотношении 1:2 (CRM197:цитокин). Смесь готовили из расчета 700 мкг/мл без использования какого-либо связывающего реагента.
Обе смеси фильтровали через фильтр с размером пор 0,22 мкм и хранили при 4°C.
e) Количественные оценки иммуногенных продуктов
Концентрации иммуногенного продукта muIL-4 и иммуногенного продукта muIL-13 определяли с помощью анализа белка Coomassie Plus (Бредфорд) в соответствии с инструкциями производителя.
Пример 2: Антигенность мышиных продуктов
ИФА в формате «сэндвич» выполняли для оценки связывания цитокина с белком-носителем, а также для оценки сохранения эпитопов во время способа изготовления.
В общих чертах, 96-луночные планшеты покрывали захватывающим антителом (антитело к белку-носителю). После этапа блокирования 2% (масс./об.) казеином в ФСБ добавляли образцы иммуногенного продукта и двукратно последовательно разводили. После 90 минут инкубации при 37°C связанные иммуногенные продукты обнаруживали с использованием биотинилированного антитела к muIL-4 (поликлонального козьего IgG к muIL-4) или биотинилированного антитела к muIL-13 (поликлонального козьего IgG к muIL-13), а затем проявляли с использованием стрептавидина-ПХ и субстрата OPD. Ферментативную реакцию останавливали серной кислотой, и оптическую плотность (OD) считывали при 490 нм. Результаты показаны на Фигуре 2.
Этот тест подтвердил, что иммуногенные продукты согласно настоящему изобретению содержат muIL-4 или muIL-13, связанные с CRM197 или KLH. Кроме того, эти результаты подтверждают, что иммуногенные продукты являются антигенными (т. е. распознаются антителами к muIL-4 или антителами к muIL-13).
Пример 3: Иммуногенность иммуногенных продуктов
У мышей иммуногенные продукты вводили в виде эмульсии с адъювантом на основе сквалена. Иммуногенные продукты разводили в ФСБ до целевой концентрации, и разведения смешивали с равным объемом адъюванта.
Протокол иммунизации мышей
Каждая мышь Balb/с получила четыре внутримышечные (в/м) инъекции иммуногенных продуктов (с CRM197 или KLH) или контролей, таких как ФСБ, неконъюгированные цитокины с CRM197 или только CRM197, все эмульгированные (1:1) с адъювантом на основе сквалена. Инъекции выполняли в дни 0, 7, 28 и 49, как подробно описано в Таблице 1 и на Фигуре 3. Первую иммунизацию выполняли в возрасте 7 недель.
Таблица 1. График введения доз
Сбор образцов крови выполняли перед дозированием и в дни 39, 60 и 120. Образцы сыворотки готовили после коагуляции при комнатной температуре и центрифугирования для удаления сгустка. Мышей умерщвляли путем смертельной анестезии в день 120.
Определение титров антител к цитокинам и антител к белкам-носителям с помощью ИФА
Образцы сыворотки иммунизированных мышей оценивали на наличие антител к цитокинам и антител к белку-носителю с помощью ИФА.
В общих чертах, 96-луночные планшеты покрывали muIL-4, muIL-13, CRM197 или KLH. После блокирования казеином добавляли образцы сыворотки и двукратно последовательно разводили. После инкубации при 37°C связанные антитела обнаруживали с использованием ПХ-конъюгированного IgG к белку мыши, и проявляли планшеты с использованием субстрата OPD. Реакцию останавливали серной кислотой, а затем регистрировали поглощение при 490 нм.
Положительные контроли, использованные для определения титров антитела к muIL-4 и антитела к muIL-13, антитела к KLH и антитела к CRM197, соответственно, представляли собой моноклональное крысиное антитело IgG1 к muIL-4, моноклональное мышиное антитело к muIL13, пул сывороток, собранных у мышей, иммунизированных KLH, и моноклональный мышиный IgG1 к дифтерийному токсину A.
Образцы анализировали, начиная с разведения 500 развед.-1 до 256000 развед.-1, за исключением сывороток до иммунизации, которые анализировали только при 500 развед.-1.
Титры антител к muIL-4, антител к muIL-13, антител к CRM197 и антител к KLH выражали как разведения сыворотки, приводящие к половине максимальной OD.
Результаты представлены на Фигуре 4. Во всех группах, обработанных иммуногенными продуктами, а также у мышей, которым вводили путем инъекции ДФСБ с адъювантом или белок-носитель, или неконъюгированные препараты, перед дозированием не были обнаружены антитела к muIL-4, антитела к muIL-13, антитела к KLH и антитела к CRM197. Кроме того, у мышей, получавших ДФСБ с адъювантом, ни в одной временной точке не были обнаружены антитела к цитокинам или носителю.
Титры антител к CRM197 обнаруживали во всех группах, обработанных контролем CRM197, в дни 39, 60 и 120, а также в группе, обработанной неконъюгированным muIL-4 + CRM197 или неконъюгированным muIL-13 + CRM197. Титры антител к muIL-4, антител к muIL-13 и антител к CRM197 обнаруживали во всех группах, обработанных иммуногенными продуктами, изготовленными с CRM197, в дни 39, 60 и 120. Титры антител к muIL-4, антител к muIL-13 и антител к KLH были обнаружены, но не у всех мышей во всех группах, обработанных иммуногенными продуктами, изготовленными с KLH, в дни 39, 60 и 120. Следует отметить, что уровень антител к IL-4 был выше у мышей, иммунизированных иммуногенными продуктами, изготовленными с CRM197, чем иммуногенными продуктами, изготовленными с KLH.
Биотест нейтрализации muIL-4
Антитела, индуцированные введениями иммуногенных продуктов muIL-4, дополнительно оценивали в отношении их нейтрализующей способности против muIL-4 в пролиферативном анализе с использованием клеток CTLL-2, адаптированном из Soman et al, 2009. В общих чертах, клетки CTLL-2 выращивали в присутствии IL-2 в конечной концентрации 10 нг/мл с RPMI с добавлением 2 мМ глутамина, 1 мМ пирувата натрия, 1 мМ HEPES, 100 ед./мл пенициллина, 100 мкг/мл стрептомицина и 10% (об./об.) ФБС. Для биотестов нейтрализации IL-2 заменяли muIL-4. Таким образом, потенциальные нейтрализующие антитела к muIL-4, индуцированные после инъекций иммуногенных продуктов, будут предотвращать размножение CTLL-2.
В культуральные планшеты вносили образцы сыворотки в конечном соотношении 1/200 и поликлональное антитело к muIL-4 в качестве положительного контроля в конечной концентрации 1 мкг/мл и двукратно последовательно разводили в 25 мкл на лунку RPMI + 10% (об./об.) ФБС. Затем к образцам сыворотки добавляли muIL-4 в конечной концентрации 2 нг/мл и инкубировали в течение 1 часа при комнатной температуре. Затем 20000 клеток CTLL-2 добавляли к предварительно проинкубированным образцам (сыворотка или положительный контроль плюс muIL-4). Планшеты инкубировали в течение 48 ч при 37°C в увлажненном инкубаторе с 5% CO2. Жизнеспособность клеток определяли количественно с помощью анализа MTS/PMS. Добавляли сорок микролитров MTS/PMS на лунку и через 4 ч при 37°C в увлажненном инкубаторе с 5% CO2 считывали OD при 490 нм.
Результаты НС50 выражали как коэффициент разведения сыворотки (развед.-1), нейтрализующий 50% от активности muIL-4 в присутствии сыворотки. НС50 определяют путем интерполяции разведения сыворотки, приводящего к 50% от активности IL-4, на ось абсцисс. Следует отметить, что мышь рассматривают, как имеющую ответ в этом эксперименте, если НС50 ≥200 развед.-1.
Ни одна из мышей не имела нейтрализующих антител к muIL-4 до введения дозы (Фигура 5 и Таблица 2). В контрольных группах не были обнаружены антитела к muIL-4, обладающие нейтрализующей способностью, в какой-либо временной точке. Для мышей, иммунизированных иммуногенным продуктом, изготовленным с CRM197, антитела с нейтрализующей способностью против muIL-4 обнаруживали у 9 из 10 мышей. Напротив, у мышей, иммунизированных иммуногенным продуктом, изготовленным с KLH, уровень нейтрализующих антител против IL-4 был ниже в любой временной точке, чем тот, который наблюдали, если носитель представлял собой CRM197, и меньшее количество сывороток проявило нейтрализующие антитела (в лучший момент времени только 6 сывороток проявили нейтрализующую способность (в день 120)). Эти результаты продемонстрировали, что обработка иммуногенным продуктом muIL-4, изготовленным с CRM197, была более иммуногенной, чем конъюгированная вакцина, изготовленная с KLH.
Таблица 2. НС50 мышей с ответом в отношении IL-4
(НС50 >200 развед.-1)
Биотест нейтрализации muIL-13
Нейтрализующую способность антител, индуцированных введением иммуногенного продукта muIL-13, оценивали с помощью биотеста нейтрализации muIL-13 перед дозированием и в дни 39, 60 и 120.
Нейтрализующую способность антител к muIL-13 оценивали с использованием биотеста репортерного гена HEK-Blue™ IL-4/IL-13 (InvivoGen, номер по каталогу hkb-il413) путем наблюдения за активацией пути STAT6. В ответ на такую активацию эта линия клеток продуцирует секретируемую эмбриональную щелочную фосфатазу (SEAP), которую можно количественно определить с использованием QUANTI-Blue™ (при λ = 625 нм). Таким образом, потенциальные антитела, нейтрализующие muIL-13, индуцированные после инъекций иммуногенных продуктов, будут предотвращать активацию пути STAT6 и могут быть оценены.
В общих чертах, клетки HEK-Blue™ IL-4/IL-13 высевали в среде для анализа, состоящей из DMEM GlutaMAX™ с добавлением 10% (об./об.) ФБС, 10 мМ HEPES, 50 ед./мл пенициллина и 50 мкг/мл стрептомицина. Затем смесь muIL-13 (в конечной концентрации 2 нг/мл) и образца сыворотки, двукратно последовательно разведенного, начиная с конечного соотношения 1/100, или контрольное антитело, двукратно последовательно разведенное, начиная с конечной концентрации 1 мкг/мл (поликлональное козье антитело к muIL-13), добавляли к 40000 клеток HEK-Blue™ IL-4/IL-13. Планшеты инкубировали 24 ч при 37°C в увлажненном инкубаторе с 5% CO2. Затем в новых планшетах с плоским дном по 10 мкл на лунку клеточного супернатанта добавляли к 90 мкл на лунку QUANTI-Blue™ и через 1 ч при 37°C в увлажненном инкубаторе с 5% CO2 считывали поглощение при 625 нм.
Результаты НС50 выражали как коэффициент разведения сыворотки (развед.-1), нейтрализующий 50% от активности muIL-13 в присутствии сыворотки. НС50 определяют путем интерполяции разведения сыворотки, приводящего к 50% от активности muIL-13, на ось абсцисс. Следует отметить, что в этом эксперименте мышь рассматривают, как имеющую ответ, если НС50 ≥100 развед.-1.
Нейтрализующие muIL-13 антитела не были обнаружены до дозирования во всех группах, а также в контрольных группах в какой-либо временной точке (Фигура 6 и Таблица 3). Мыши, обработанные иммуногенным продуктом, изготовленным с CRM197, продуцировали антитела с обнаруживаемой нейтрализующей способностью против muIL-13 (Фигура 6 и Таблица 3). У мышей, иммунизированных иммуногенным продуктом, изготовленным с KLH, сыворотки мышей не показывали нейтрализующие антитела к muIL-13. Следует отметить, что даже если одна мышь показывала антитела к muIL-13, согласно оценке с помощью ИФА в группе, получавшей неконъюгированный muIL-13 и CRM197 (Фигура 4-B), эти антитела не были нейтрализующими антителами. Эти результаты продемонстрировали, что обработка иммуногенным продуктом, изготовленным с CRM197, является более иммуногенной, чем обработка иммуногенным продуктом, изготовленным с KLH.
Таблица 3. НС50 мышей с ответом в отношении IL-13
(НС50 >100 развед.-1)
(НС50 >100 развед.-1)
Как и ожидалось, нейтрализующие антитела к muIL-4 и к muIL-13 не были обнаружены в контрольных группах CRM197 и ДФСБ в какой-либо временной точке. В контрольных группах, в которых цитокины и CRM197 смешивали без химической функционализации (неконъюгированные), иммунизация не вызвала выработку нейтрализующих антител к muIL-4 и к muIL-13, это подчеркивает, что конъюгация между цитокином и белком-носителем является обязательной для нарушения собственной толерантности B-клеток против цитокинов. Кроме того, у мышей, иммунизированных иммуногенным продуктом, изготовленным с KLH, не наблюдали нейтрализующие антитела к IL-13, в то время как у мышей, иммунизированных иммуногенным продуктом, изготовленным с CRM197, антитела с нейтрализующей способностью против muIL-13 обнаруживали у 5 из 10 мышей. Эти результаты продемонстрировали, что обработка иммуногенным продуктом muIL-13, изготовленным с CRM197, была более иммуногенной, чем конъюгированная вакцина, изготовленная с KLH.
Пример 4: Остаточная активность иммуногенных продуктов
Остаточная активность иммуногенных продуктов muIL-4
Остаточную активность иммуногенных продуктов muIL-4 оценивали, как описано ниже (адаптировано из Soman et al, 2009).
В общих чертах, клетки CTLL-2 выращивают с IL-2. Культуральная среда состояла из среды RPMIc с добавлением IL-2 в конечной концентрации 10 нг/мл и 10% (об./об.) ФБС.
Для биотестов остаточной активности IL-2 заменяли на muIL-4. Иммуногенные продукты (с CRM197 или KLH) согласно настоящему изобретению и контроль muIL-4 двукратно последовательно разводили в RPMI + 10% (об./об.) ФБС в 96-луночных планшетах, начиная с 1000 нг/мл до конечной концентрации 4 нг/мл для иммуногенных продуктов и с 10 нг/мл до конечной концентрации 0,04 нг/мл для muIL-4. В качестве положительного контроля добавляли шесть лунок с muIL-4 при 10 нг/мл и использовали в качестве контроля максимальной пролиферации клеток. Эти образцы добавляют к 20000 клеток CTLL-2 на лунку, и планшеты инкубировали в течение 48 ч при 37°C в увлажненном инкубаторе с 5% CO2. Пролиферацию клеток количественно оценивали с помощью анализа MTS/PMS. Добавляли по сорок микролитров MTS/PMS на лунку и через 4 ч при 37°C в увлажненном инкубаторе с 5% CO2 планшеты считывали при 490 нм.
Значение 50% эффективной дозы (ЭД50) соответствует количеству иммуногенного продукта или цитокина, которое приводит к 50% от максимального сигнала клетки. Значение определяют путем интерполяции 50% от максимального сигнала клетки на ось абсцисс с использованием формулы y = ax + b на основании кривой, проходящей через точки разведения, окружающие 50% точку перегиба.
Коэффициент инактивации рассчитывали путем деления ЭД50 тестируемого иммуногенного продукта на среднее значение ЭД50 стандартных кривых для контроля muIL-4.
Таблица 4. ЭД50 и коэффициенты инактивации
Как показано в Таблице 4, остаточная активность muIL-4 была снижена в большей степени в иммуногенном продукте, изготовленном с CRM197, по сравнению с продуктом, изготовленным с KLH (значительно более высокий коэффициент инактивации для иммуногенного продукта muIL-4, изготовленного с CRM197).
Остаточная активность иммуногенных продуктов muIL-13
Остаточную активность иммуногенных продуктов muIL-13 наблюдали с использованием репортерной линии клеток HEK-Blue™ IL-4/IL-13, как описано ниже.
В общих чертах, иммуногенные продукты muIL-13 и контроль muIL-13 двукратно последовательно разводили в среде для анализа (DMEM, 10% (об./об.) ФБС, 10 мМ буфер HEPES, 50 ед./мл пенициллина, 50 мкг/мл стрептомицина) в планшетах с круглым дном, начиная с конечной концентрации 250 нг/мл и 10 нг/мл, соответственно. Эти смеси добавляли к 40000 клеток HEK-Blue™ IL-4/IL-13 на лунку. Планшеты инкубировали 24 ч при 37°C в увлажненном инкубаторе с 5% CO2. Затем в новых планшетах с плоским дном по 10 мкл на лунку супернатанта культуры добавляли к 90 мкл на лунку QUANTI-Blue™ и через 1 ч при 37°C в увлажненном инкубаторе с 5% CO2 считывали OD при 625 нм.
Значение 50% эффективной дозы (ЭД50), соответствующее количеству иммуногенного продукта (или IL-13), которое приводит к 50% от максимального сигнала, зарегистрированного для рассматриваемых образцов, определяют путем интерполяции значений ODmax/2 к соответствующим концентрациям образца с использованием четырехпараметрической логистической (4PL) нелинейной регрессии на основании всех точек разведения.
Коэффициенты инактивации рассчитывали путем деления ЭД50 иммуногенных продуктов muIL-13 на соответствующее значение ЭД50 стандартных кривых для контроля muIL-13.
Таблица 5. ЭД50 и коэффициенты инактивации
ЭД50 [нг.мл-1]
Как показано в Таблице 5, остаточная активность muIL-13 была снижена в большей степени в иммуногенном продукте, изготовленном с CRM197, по сравнению с продуктом, изготовленным с KLH (значительно более высокий коэффициент инактивации для иммуногенного продукта muIL-13, изготовленного с CRM197).
Интенсивность иммунного ответа против IL-4 и IL-13 была выше, если иммуногенный продукт был изготовлен с CRM197 по сравнению с продуктом, изготовленным с KLH в качестве носителя. Кроме того, остаточная активность цитокинов была снижена в большей степени в иммуногенном продукте, изготовленном с CRM197, по сравнению с продуктом, изготовленным с KLH. Основываясь на этих результатах, мы решили получить доказательство концепции с использованием продуктов согласно настоящему изобретению, изготовленных с CRM197 в качестве белка-носителя. Кроме того, при аллергии вовлечен как IL-4, так и IL-13, поэтому мы решили ввести группу мышей, которые получат иммуногенный продукт, содержащий конъюгаты как IL-4, так и IL-13 с CRM197. С этого момента все иммуногенные продукты будут изготовлены с использованием CRM197 в качестве белка-носителя, а их смесь будет называться иммуногенным продуктом Combo.
Пример 5: Эффективность иммуногенного продукта согласно настоящему изобретению в модели аллергии на мышах
Среди всех видов аллергии основными проблемами общественного здравоохранения являются аллергическая астма и пищевая аллергия, каждая из которых поражает более 300 миллионов человек во всем мире. Считается, что разные виды аллергии возникают в результате нарушения толерантности, что приводит к иммунным ответам 2 типа, характеризующимся выработкой цитокинов TH2, таких как IL-4 и IL-13, высоким уровням антител IgE, а также инфильтрации и распространению иммунных клеток (в частности, тучных клеток, базофилов, эозинофилов и Т-клеток) в воспаленной ткани.
Клещ домашней пыли (HDM) является основным источником аллергена, который поражает более 50% пациентов с аллергией (Meyer et al. 1994). У мышей повторные интраназальные стимуляции с использованием HDM воспроизводили ключевые признаки хронической астмы человека, включая гиперчувствительность дыхательных путей (AHR), обструкцию дыхательных путей, ремоделирование стенок дыхательных путей, выработку слизи и воспалительные ответы в легких, характеризующиеся высокими уровнями эозинофилов.
Получение иммуногенных продуктов muIL-4/IL-13
а) Функционализация CRM197
CRM197 разбавляли в буфере для модификации, содержащем 70 мМ буфера на основе фосфата натрия, 150 мМ NaCl, 5 мМ ЭДТА (pH=7,2). SATA разводили в ДМСО, чтобы достичь 100 мМ концентрации. Затем к CRM197 добавляли SATA, и после 30 минут инкубации на шейкере-качалке при комнатной температуре избыток SATA удаляли с использованием обессоливающей центрифужной колонки Zeba™ в соответствии с инструкциями производителя.
Затем гидроксиламин разводили в том же буфере до 500 мМ. Затем CRM197-SATA инкубировали с раствором гидроксиламина в конечной концентрации 50 мМ в течение 2 часов на шейкере-качалке при комнатной температуре. Наконец, смесь обессоливали, и избыток реагентов удаляли с помощью обессоливающей центрифужной колонки Zeba™.
b) Функционализация muIL-4 и muIL-13
muIL-4 растворяли в буфере для модификации (70 мМ буфера на основе фосфата натрия, 150 мМ NaCl, 5 мМ ЭДТА, pH=7,2). sGMBS разводили в буфере для модификации до 10 мМ. Затем sGMBS добавляли к muIL-4 и после одного часа инкубации на шейкере-качалке при комнатной температуре избыток sGMBS удаляли с использованием обессоливающей центрифужной колонки Zeba™.
muIL-13 растворяли в буфере для модификации (70 мМ буфера на основе фосфата натрия, 150 мМ NaCl, 5 мМ ЭДТА, pH=7,2). sGMBS разводили в буфере для модификации до 10 мМ. Затем sGMBS добавляли к muIL-13 и после одного часа инкубации на шейкере-качалке при комнатной температуре избыток sGMBS удаляли с использованием обессоливающей центрифужной колонки Zeba™.
c) Конъюгация
После функционализации CRM197, muIL-4 и muIL-13 содержание белка для каждого препарата определяли с помощью анализа по Бредфорд.
Функционализированный CRM197 добавляли к функционализированному muIL-4 или функционализированному muIL-13 в молярном соотношении 1:2 (носитель:muIL-4) и 1:4 (или носитель:muIL-13). Препараты отдельных иммуногенных продуктов инкубировали в течение ночи при 4°C на шейкере-качалке. Полученные иммуногенные продукты затем концентрировали с использованием Amicon® (мембрана с отсечением 3 кДа), фильтровали через фильтр с размером пор 0,22 мкм и хранили при 4°C.
d) Количественные оценки иммуногенных продуктов
Концентрации иммуногенного продукта muIL-4 и иммуногенного продукта muIL-13 определяли с помощью анализа белка Coomassie Plus (Бредфорд) в соответствии с инструкциями производителя.
Препарат иммуногенного продукта muCombo
Независимо синтезированный иммуногенный продукт muIL-4 и иммуногенный продукт muIL-13 смешивали в массовом соотношении 1-1 после этапов концентрирования и стерильной фильтрации через фильтр с размером пор 0,22 мкм, а полученный иммуногенный продукт muCombo хранили при 4°C.
Иммунизация мышей, протокол аллергической астмы и забор крови
Каждая мышь Balb/c получила четыре внутримышечные (в/м) инъекции только иммуногенных продуктов или иммуногенного продукта muCombo или только CRM197 в качестве контроля, все эмульгированные с адъювантом на основе сквалена в дни 0, 7, 28 и 55, как подробно описано в Таблице 6 и на Фигуре 7. Первую иммунизацию выполняли на мышах в возрасте 7 недель.
Таблица 6. График введения доз
Через тридцать девять дней после первой иммунизации иммуногенным продуктом у мышей индуцировали хроническое воспаление дыхательных путей с помощью трех интраназальных инъекций 100 мкг HDM из Dermatophagoides farinae (приобретен у Greer) в дни 39, 43 и 46. Начиная с 50 дня, мышей стимулировали с помощью интраназальных инъекций 25 мкг HDM два раза в неделю (всего 9 стимуляций).
Сбор образцов крови проводили за семь дней до введения дозы, в дни 39, 64 и через 24 часа после последней стимуляции HDM (умерщвление мышей). Образцы сыворотки готовили, как описано ранее, и хранили при -20°C до анализа.
В этом исследовании оценивали:
- Иммуногенность инъецированных продуктов, измеренную с помощью ИФА и биотеста,
- Гиперчувствительность дыхательных путей (AHR), измеренную с помощью плетизмографии всего тела,
- Биологические маркеры: уровни циркулирующего IgE в сыворотке с помощью ИФА, воспаление дыхательных путей в легком и бронхоальвеолярном лаваже (BAL) с помощью анализа FACS, а также гистологию дыхательных путей и инфильтрацию воспалительных клеток.
а) Иммуногенность инъецированных продуктов, измеренная с помощью ИФА и биотеста
Титры антител к muIL-4 и антител к muIL-13 измеряли с помощью ИФА (как описано выше) в сыворотках мышей, собранных в четырех обработанных группах.
Титры антител к цитокинам не обнаруживали перед началом дозирования во всех группах и в группе, получавшей CRM197, во всех временных точках. Титры антител к muIL-4 обнаруживали у всех мышей во всех временных точках после иммунизации иммуногенным продуктом muIL-4 и иммуногенным продуктом muCombo (Фигура 8-A). Более высокие уровни наблюдали у мышей, получавших иммуногенный продукт muIL-4, по сравнению с иммуногенным продуктом muCombo. Титры антител к muIL-13 обнаруживали у мышей, начиная с D39, и у мышей со 100% ответом на D65 в группе иммуногенного продукта muIL-13 (Фигура 8-B). В группе иммуногенного продукта muCombo антитела к muIL-13 также обнаруживали уже на D39 и у 9 из 12 мышей с ответом на D65. В целом, более высокие титры антител наблюдали в сыворотках после иммунизации иммуногенными продуктами muIL-4 и muIL-13, чем иммуногенным продуктом muCombo, как и ожидалось, поскольку мыши в группе muCombo получали половину дозы отдельного иммуногенного продукта (Фигура 14).
Нейтрализующую активность каждого иммуногенного продукта оценивали in vitro с использованием двух различных биотестов, описанных выше. Следует отметить, что мышь рассматривают, как имеющую ответ в этом эксперименте, если НС50 составляет ≥200 развед.-1 для IL-4 и ≥100 развед.-1 для IL-13.
Высокую нейтрализующую способность против muIL-4 наблюдали у мышей, иммунизированных иммуногенным продуктом muIL-4 и иммуногенным продуктом muCombo (Фигура 9-A и Таблица 7), n = 11 из 12 или n = 9 из 12 в по меньшей мере одной временной точке, соответственно.
Таблица 7. НС50 мышей с ответом в отношении IL-4
Интересно отметить, что через один год после иммунизации иммуногенным продуктом muIL-4 или muCombo у мышей все еще обнаруживали антитела к IL-4 (данные не показаны).
Также наблюдали индукцию нейтрализующей активности против muIL-13 у мышей, иммунизированных иммуногенным продуктом muIL-13 и иммуногенным продуктом muCombo, с n=10 из 12 или n=7 из 12 в по меньшей мере одной временной точке, соответственно (Фигура 9-B и Таблица 8).
Таблица 8. НС50 мышей с ответом в отношении IL-13
(НС50>100 развед.-1)
Интересно отметить, что через один год после иммунизации иммуногенным продуктом muIL-13 или muCombo у мышей все еще обнаруживали антитела к IL-13 (данные не показаны).
Следует отметить, что совместная инъекция muIL-4 и/или muIL-13 и CRM197 без предварительного химического связывания не вызывала выработку антител к IL-4 и антител к IL-13, это подчеркивает, что конъюгация между цитокином и белком-носителем является обязательной для нарушения собственной толерантности B-клеток против цитокинов.
После иммунизации вырабатывались различные классы (включая, в частности, IgG1, IgG2a, IgG2b, IgG3, IgA, IgE и IgM) антител к IL-4 и антител к IL-13, в основном IgG1 (данные не показаны).
b) Гиперчувствительность дыхательных путей (AHR), измеренная с помощью плетизмографии всего тела
Через двадцать четыре часа после последней стимуляции AHR оценивали с помощью плетизмографии всего тела. Ответы на метахолин, бронхосуживающий агент, измеряли у мышей, находящихся в сознании.
Различные дозы метахолина вводили с помощью аэрозоля: 0 мг/мл, 3,5 мг/мл, 7 мг/мл и 14 мг/мл. Индекс PenH (Penh) использовали для оценки изменений легочной функции (Hamelmann et al., 1997). Это измерение дало представление о фазовом сдвиге между кривыми грудного потока и назального потока: увеличение фазового сдвига коррелировало с повышенным сопротивлением дыхательной системы. PenH рассчитывают по формуле Penh = (Te/RT-1)×PEF/PIF, где Te представляет собой время выдоха, RT представляет собой время релаксации, PEF представляет собой максимальную скорость выдоха, а PIF представляет собой максимальную скорость вдоха. Значения PenH регистрировали в течение 5 минут после каждой стимуляции метахолином, и максимальное значение в течение периода представили на графике.
У мышей, сенсибилизированных HDM, в контрольной группе CRM197 наблюдали сильный бронхоспазм (Фигура 10). Бронхоспазм частично ингибировался иммуногенным продуктом muIL-13 и иммуногенным продуктом muIL-4, в то время как у мышей, иммунизированных иммуногенным продуктом muCombo, он почти исчезал, это указывает на высокий защитный эффект продуктов согласно настоящему изобретению. Действительно, уровень остаточного бронхоспазма, который наблюдали в группе muCombo, был сходен с тем, который наблюдали у мышей, не сенсибилизированных HDM (круг на Фигуре 10).
Эти результаты подтверждали с помощью инвазивных измерений ответа дыхательных путей. Действительно, HDM-обработанные контрольные мыши проявляли значительно более сильные изменения сопротивления и эластичности легких при стимуляции метахолином, по сравнению с ФСБ-обработанной контрольной группой, в то время как у мышей, обработанных иммуногенным продуктом muIL-4, muIL-13 или muCombo, эти два признака были частично снижены (данные не показаны).
В совокупности эти результаты свидетельствуют о том, что AHR можно блокировать при двойной вакцинации против IL-4 и IL-13.
c) Биологические маркеры
Уровни циркулирующего IgE в сыворотке, измеренные с помощью ИФА
Общее уровни циркулирующего IgE измеряли с помощью ИФА в соответствии с инструкциями производителя (набор для количественного ИФА IgE у мышей, Bethyl Labs E90-115) перед вакцинацией иммуногенным продуктом и через 24 часа после последней стимуляции HDM (Фигура 11).
Перед вакцинацией циркулирующий IgE не обнаруживался. Через двадцать четыре часа после последней стимуляции HDM происходила индукция общего циркулирующего IgE из-за сенсибилизации HDM (Фигура 11-B). Уровни были снижены во всех группах, получавших иммуногенные продукты, что демонстрирует защитный эффект продуктов согласно настоящему изобретению по сравнению с мышами, иммунизированными CRM197. Следует отметить, что сходные результаты получали при измерении только HDM-специфичного IgE с помощью ИФА (данные не показаны).
У мышей, обработанных HDM, также наблюдали повышенные уровни HDM-специфичных антител IgG. Однако обработка иммуногенным продуктом muIL-4 и/или muIL-13 не влияла на эти уровни (данные не показаны).
Воспаление дыхательных путей в легком и бронхоальвеолярном лаваже (БАЛ)
Проводили тщательный временной анализ клеточных изменений в легком и бронхоальвеолярном лаваже (БАЛ) мышей, сенсибилизированных HDM или ФСБ.
Воспалительные клетки из БАЛ анализировали с помощью FACS с использованием следующих антител (Таблица 9): CD45-FITC, Ly6G-PE, CD11b-VG, SiglecF-PECy7, B220-APC и CD3-APC в соответствии с инструкциями производителя.
В легких контрольных мышей хроническое интраназальное воздействие HDM приводило к значительному увеличению количества инфильтрировавших CD45+ клеток гемопоэтического происхождения, в основном состоящих из эозинофилов (CD45+, Ly6G-, CD11b+, SiglecF+), по сравнению с животными, обработанными ФСБ (данные не показаны). Интересно отметить, что вакцинация иммуногенными продуктами предотвращала инфильтрацию эозинофилов среди инфильтрирующих CD45+ клеток, в частности, в группе иммуногенного продукта muCombo, которая проявила статистически значимое снижение.
В бронхоальвеолярном лаваже сенсибилизация HDM привела к воспалительному ответу, характеризующемуся инфильтрацией CD45+ клеток гемопоэтического происхождения, в основном состоящих из эозинофилов (CD45+, Ly6G-, CD11b+, SiglecF+) (Фигура 12). Интересно отметить, что вакцинация иммуногенными продуктами предотвращала инфильтрацию эозинофилов среди инфильтрирующих CD45+ клеток, в частности, в группе иммуногенного продукта muCombo, которая проявила статистически значимое снижение.
Интересно отметить, что вакцинация иммуногенными продуктами согласно настоящему изобретению не влияла на уровень эозинофилов в крови (данные не показаны), это указывает на то, что снижение эозинофилии дыхательных путей, наблюдаемое у вакцинированных мышей, является следствием сниженного привлечения эозинофилов в легкие, а не системных эффектов на количество эозинофилов или предшественников эозинофилов.
Гистология дыхательных путей
Эффекты сенсибилизации и вакцинации на дыхательный путь исследовали с помощью гистологических анализов. В общих чертах, левое легкое вырезали после смерти, фиксировали 4% ПФА в течение 24 ч при комнатной температуре и консервировали в 70% этаноле. Делали продольные срезы и окрашивали:
-гематоксилином и эозином (H&E) для оценки инфильтрации лейкоцитов,
-толуидиновым синим для количественного определения количества тучных клеток, или
-окрашивали йодной кислотой и реактивом Шиффа (PAS) для оценки гиперплазии бокаловидных клеток и выработки слизи.
В целом эти гистологические анализы легких подтверждают, что у HDM-обработанных животных вакцинация иммуногенным продуктом muIL-4, muIL-13 или muCombo значительно снижала количество лейкоцитов и интраэпителиальных тучных клеток, по сравнению с невакцинированными HDM-обработанными животными (данные не показаны).
Гистологические анализы PAS также подтверждают, что у HDM-обработанных животных вакцинация иммуногенным продуктом muIL-4, muIL-13 или muCombo значительно снижала гиперплазию бокаловидных клеток/выработку слизи, по сравнению с невакцинированными HDM-обработанными животными (данные не показаны). Эти результаты подтверждают, что иммуногенные продукты (в частности, иммуногенные продукты muIL-13 и muCombo), могут контролировать гиперсекрецию слизи, индуцированную сенсибилизацией HDM.
В заключение, мы продемонстрировали, что продукты согласно настоящему изобретению, изготовленные с CRM197, были иммуногенными и индуцировали антитела, нейтрализующие цитокины, будь то при введении путем инъекции по отдельности или в комбинации (иммуногенный продукт muCombo). Присутствие антител, нейтрализующих цитокины, было ассоциировано со снижением HDM-индуцированной AHR, измеренной на основании значения Penh после ингаляции метахолина. Кроме того, антитела, нейтрализующие цитокины, были способны ограничивать уровни циркулирующего IgE, а также количество тучных клеток в легком и инфильтрацию эозинофилов в дыхательных путях.
Следовательно, эти результаты демонстрируют, что иммуногенные продукты согласно настоящему изобретению способны нарушать толерантность B-клеток против IL-4 и IL-13, и позволяют предположить, что эти иммуногенные продукты могут представлять собой новые перспективные терапевтические стратегии в лечении астмы и/или аллергии и, в частности, в лечении аллергической астмы.
Интересно отметить, что отдельные иммуногенные продукты были активными, но превосходящие благоприятные эффекты на симптомы астмы и/или аллергии (и, в частности, на симптомы аллергической астмы) и биологические маркеры наблюдали при комбинировании иммуногенных продуктов (иммуногенный продукт muCombo).
Пример 6: Получение человеческих иммуногенных продуктов согласно настоящему изобретению
Получение человеческого иммуногенного продукта IL-4, иммуногенного продукта IL-13 и иммуногенного продукта Combo проводили в соответствии с тем же способом изготовления, который описан выше, с использованием цитокинов IL-4 и IL-13 человека вместо цитокинов мыши.
Получение иммуногенного продукта IL-4 и IL-13
a) Функционализация CRM197
Функционализацию CRM197 выполняли, как описано для мышиного продукта.
b) Функционализация IL-4 и IL-13
IL-4 или IL-13, растворенные в буфере (70 мМ буфера на основе фосфата натрия, 150 мМ NaCl, 5 мМ ЭДТА, pH=7,2), вступали в реакцию с sGMBS, предварительно растворенным в буфере в концентрации 10 мМ. После одного часа реакции при комнатной температуре при легком перемешивании избыток sGMBS удаляли с помощью обессоливающей колонки Zeba.
с) Конъюгация
После функционализации CRM197, IL-4 и IL-13 содержание белка для каждого препарата определяли с помощью анализа по Бредфорд. Функционализированный CRM197 добавляли к функционализированному muIL-4 или функционализированному IL-13 в молярном соотношении 1:4 (носитель:IL-4 или носитель:IL-13). Препараты отдельных иммуногенных продуктов инкубировали в течение ночи при 4°C на шейкере-качалке. Конъюгаты вносили в обессоливающую колонку для удаления возможных примесей, таких как оставшийся гидроксиламин, с предыдущих этапов. Полученный иммуногенный продукт концентрировали, фильтровали через фильтр с размером пор 0,22 мкм и хранили при 4°C.
Получение иммуногенного продукта Combo
Получение иммуногенного продукта Combo может быть выполнено с использованием двух разных способов: путем инкубации обоих модифицированных цитокинов одновременно с модифицированным белком-носителем (одновременный синтез) или путем смешивания двух независимо синтезированных иммуногенных продуктов IL-4 и IL-13 (смешанный препарат).
Получение иммуногенного продукта Combo путем одновременного синтеза
a) Функционализация CRM197
Функционализацию CRM197 выполняли, как описано для мышиного продукта.
b) Функционализация IL-4 и IL-13
Функционализацию IL-4 или IL-13 выполняли, как описано для получения отдельного иммуногенного продукта.
c) Конъюгация
После функционализации CRM197, IL-4 и IL-13 содержание белка для каждого препарата определяли с помощью анализа по Бредфорд. Все три модифицированных белка в фосфатном буфере, 150 мМ NaCl, 5 мМ ЭДТА, pH=7,2 смешивали в молярном соотношении 2-2-1 IL-4-IL-13-CRM197. Реакцию проводили при 4°C в течение ночи. Конъюгат вносили в обессоливающую колонку для удаления возможных примесей, таких как оставшийся гидроксиламин, с предыдущих этапов. Полученный иммуногенный продукт концентрировали, фильтровали через фильтр с размером пор 0,22 мкм и хранили при 4°C.
Получение иммуногенного продукта Combo путем получения смеси
Независимо синтезированные иммуногенные продукты IL-4 и IL-13 смешивали в массовом соотношении 1-1 после этапов концентрирования и стерильной фильтрации через фильтр с размером пор 0,22 мкм. Иммуногенный продукт Combo хранили при 4°C до использования.
Пример 7: Антигенность человеческого продукта
ИФА в формате «сэндвич» выполняли для оценки связывания цитокина с белком-носителем, а также для оценки сохранения эпитопов во время способа изготовления. Использованный протокол был таким же, как описано в настоящей заявке выше, с использованием биотинилированных антител к IL-4 человека и антител к IL-13 человека.
Результаты показаны на Фигуре 13. Этот тест подтвердил, что иммуногенный продукт согласно настоящему изобретению содержит IL-4 или IL-13, связанные с CRM197. Кроме того, эти результаты подтверждают, что иммуногенный продукт является антигенным (т. е. распознается антителом к IL-4 или антителом к IL-13), а также в иммуногенном продукте Combo.
Пример 8: Иммуногенность человеческого продукта
Протокол иммунизации мышей
Каждая мышь Balb/с (10 мышей на группу) получила четыре внутримышечные (в/м) инъекции иммуногенного продукта, эмульгированного с адъювантом на основе сквалена, в дни 0, 7, 28 и 49, все инъекции выполняли в дозе 4 мкг, как подробно описано на Фигуре 14. Первую иммунизацию выполняли в возрасте 7 недель. Сбор образцов крови проводили перед дозированием и в дни 38, 59, 90 и 120. Образцы сыворотки готовили после коагуляции при комнатной температуре и центрифугирования для удаления сгустка.
Определение титров антител к IL4 и антител к IL-13 с помощью ИФА
Титры антител к цитокинам измеряли с помощью ИФА сывороток мышей, собранных в каждой группе.
Определение титров каждого антитела в сыворотках после иммунизации иммуногенными продуктами или иммуногенным продуктом Combo оценивали, как описано выше, путем покрытия 96-луночных планшетов IL-4 и IL-13 человека.
Во всех группах перед введением дозы не обнаруживали титры антител к цитокинам. Титры антител к IL-4 обнаруживали у всех мышей во всех временных точках после иммунизации иммуногенным продуктом IL-4 и иммуногенным продуктом muCombo (Фигура 15-A). Сходные уровни наблюдали у мышей, получавших иммуногенный продукт IL-4 и иммуногенный продукт Combo, это указывает на то, что мы, возможно, достигли плато иммунного ответа. Титры антител к IL-13 обнаруживали у всех мышей во всех временных точках после иммунизации в группе иммуногенного продукта IL-13 (Фигура 15-B). В группе иммуногенного продукта Combo антитела к IL-13 также обнаруживали уже на D38 и у 8 из 10 мышей на D59. Более высокие титры антител к IL-13 наблюдали в сыворотках после иммунизации иммуногенным продуктом IL-13, по сравнению с иммуногенным продуктом Combo, поскольку мыши в группе Combo получали половину дозы отдельного иммуногенного продукта.
Определение нейтрализующей способности после иммунизаций
Нейтрализующую способность против IL-4 и против IL-13 оценивали с использованием репортерной линии клеток HEK-Blue™ IL-4/IL-13, как описано выше. Следует отметить, что в этом эксперименте мышь рассматривали, как имеющую ответ, если НС50 составляет ≥200 развед.-1 для IL-4 и ≥100 развед.-1 для IL-13.
Высокую нейтрализующую способность против IL-4 наблюдали в группах, иммунизированных иммуногенным продуктом IL-4 и иммуногенным продуктом Combo, при этом 100% мышей имели ответ во всех временных точках после иммунизации (Фигура 16-A и Таблица 10).
Таблица 10. НС50 мышей с ответом в отношении IL-4
Антитела с нейтрализующей способностью против IL-13 также были индуцированы у мышей, иммунизированных иммуногенным продуктом IL-13 и иммуногенным продуктом Combo, при этом 100% мышей имели ответ на D59 (Фигура 16-В и Таблица 11).
Таблица 11. НС50 мышей с ответом в отношении IL-13
В совокупности продукты согласно настоящему изобретению были способны индуцировать высокие титры антител против цитокинов с сильной нейтрализующей способностью.
Остаточная активность человеческих иммуногенных продуктов
Остаточную активность человеческого иммуногенного продукта IL-4, иммуногенного продукта IL-13 и иммуногенного продукта Combo наблюдали с использованием репортерной линии клеток HEK-Blue™ IL-4/IL-13, как описано выше для остаточной активности IL-4 и IL-13.
Таблица 12. ЭД50 и коэффициенты инактивации в отношении IL-4
ЭД50 [нг.мл-1]
Таблица 13. ЭД50 и коэффициенты инактивации в отношении IL-13
ЭД50 [нг.мл-1]
Как показано в Таблице 12 и Таблице 13, все коэффициенты инактивации в отношении IL-4 или IL-13 в человеческих иммуногенных продуктах превышали 1000 (и до 8765), это указывает на то, что остаточная активность цитокинов в иммуногенных продуктах была снижена минимум на три порядка величины по сравнению с нативными цитокинами.
Сильно сниженная остаточная активность является важным элементом, поддерживающим профиль безопасности продуктов согласно настоящему изобретению.
Пример 9: Терапевтическая эффективность иммуногенного продукта согласно настоящему изобретению в модели пищевой аллергии на мышах
Пищевая аллергия является основной проблемой здравоохранения в западных странах, при этом ее распространенность растет в последние десятилетия, а радикальное лечение отсутствует. Некоторые основные продукты питания, включая молоко, арахис, сою и пшеницу, могут индуцировать пищевые аллергические реакции. Разные виды пищевой аллергии представляют собой нарушение пероральной толерантности к безвредным пищевым аллергенам, что приводит к развитию Th2-иммунного ответа с нарушенной регуляцией, секреции цитокинов Th2 (в основном IL-4 и IL-13), секреции аллергенспецифичных IgE и привлечению эффекторных клеток в желудочно-кишечный тракт (ЖКТ).
Терапевтическую эффективность иммуногенного продукта согласно настоящему изобретению при пищевой аллергии изучали с использованием мутантных мышей IL-4raF709. Мыши IL-4raF709 несут мутацию с приобретением функции в альфа-цепи рецептора IL-4 (IL-4R), которая нарушает связывание Src-гомологичного домена 2, содержащего протеинтирозинфосфатазу 1 (SHP-1), с субъединицей рецептора и приводит к усиленной активации трансдуктора сигнала и активатора транскрипции 6 (STAT6) под действием IL-4 и IL-13. Эти мыши проявляют усиленные ответы Th2-клеток и выработку IgE. Таким образом, эта мутация является прототипом ряда полиморфизмов IL-4R-альфа человека, которые стимулируют передачу сигнала посредством рецептора и ассоциированы с атопией.
Получение иммуногенных продуктов muIL-4/IL-13 и muCombo
Иммуногенные продукты muIL-4, muIL-13 и muCombo синтезируют, как описано в настоящей заявке выше.
Иммунизация мышей, модель пищевой аллергии, анафилактический ответ, гистологические анализы и забор крови
Каждую мутантную мышь IL-4raF709 иммунизировали иммуногенными продуктами muIL-4, muIL-13 или muCombo или CRM197, в качестве контроля, все эмульгированные с адъювантом на основе сквалена, в дни 0, 7, 28, а затем стимулировали.
Одновременно с этим мышей сенсибилизировали путем введения через желудочный зонд либо ФСБ, либо 23 мг арахисового (PE) масла, что соответствует 5 мг арахисового белка, суспендированного в 250 мкл 0,1 М бикарбоната натрия (pH=8,0). Мышей стимулировали с использованием энтерального болюса из 450 мг арахисового масла (100 мг белка), разведенного в воде (Burton et al., 2014).
Немедленно после стимуляции в течение одного часа наблюдали за внутренней температурой тела, а также за началом диареи.
Также определяли клиническую оценку: 0, отсутствие клинического симптома; 1, повторяющееся чесание рта/уха и копание слухового прохода задними лапами; 2, сниженная активность, самоизоляция, отечность вокруг глаз и/или рта; 3, периоды неподвижности более одной минуты, лежа на животе; 4, отсутствие ответа на раздражители усов, снижение или отсутствие реакции на толчки; 5, тремор, судороги или смерть.
Срезы тканей кишечника собирали для гистологических анализов (например, для количественной оценки тучных клеток).
Кровь также собирали для исследования уровня воспаления (например, продукта дегрануляции тучных клеток), уровней антител (например, титров антител к цитокинам, нейтрализующей способности, аллергенспецифичных IgG и IgE и общего IgE).
Пример 10: Терапевтическая эффективность иммуногенного продукта согласно настоящему изобретению в модели атопического дерматита на мышах
Атопический дерматит (АД) представляет собой хроническое или хронически рецидивирующее зудящее воспалительное заболевание кожи. Частота АД резко возросла за последние три десятилетия в промышленно развитых странах. Иммунологические патологии АД обычно характеризуются сенсибилизацией различными аллергенами (например, продуктами питания, аэроаллергенами, микробами и аутоаллергенами), высокими сывороточными уровнями IgE и поражениями кожи с апоптотическими кератиноцитами и инфильтрацией иммунных клеток, которые секретируют цитокины Th2, такие как IL-4, IL-5 и IL-13.
Терапевтическую эффективность иммуногенных продуктов согласно настоящему изобретению при АД изучали с использованием модели на животных, в которой повторное накожное нанесение экстракта клеща домашней пыли (HDM) и стафилококкового энтеротоксина B индуцирует экзематозные поражения кожи.
Получение иммуногенных продуктов muIL-4/IL-13 и muCombo
Иммуногенные продукты muIL-4, muIL-13 и muCombo синтезировали, как описано в настоящей заявке выше.
Иммунизация мышей, индукция атопического дерматита, измерение клинической степени тяжести, гистологические анализы и забор крови
Мышей иммунизировали иммуногенными продуктами muIL-4, muIL-13 или muCombo или CRM197, в качестве контроля, все эмульгированные с адъювантом на основе сквалена.
Одновременно с этим атопический дерматит индуцировали, как описано ранее в Ando et al. (J Invest Dermatol. 2013 Dec;133(12):2695-2705). В общих чертах, растворы 500 нг стафилококкового энтеротоксина (SEB) и 10 мкг экстракта Dermatophagoides farinae (Der f представляет собой клеща домашней пыли, HDM) наносили на марлевую подушечку, помещенную на выбритую область. Эту часть кожи спины закрывали прозрачной повязкой Tegaderm™ с использованием бандажей. Через три дня повязки заменяли новой. По прошествии дополнительных 4 дней повязки снимали, и мышей оставляли без лечения в течение следующей недели. Обработку Der f/SEB в течение одной недели повторяли еще два раза, таким образом, мышей подвергали трем циклам такой обработки.
Клиническую степень тяжести оценивал исследователь, не осведомленный об идентификаторах мышей, через 2 дня после снятия повязок в последнем цикле. Клинические оценки основывались на степени тяжести (0, без симптомов; 1, легкая; 2, умеренная; 3, тяжелая) четырех возможных симптомов (покраснение, кровотечение, высыпание и шелушение). Максимально возможный балл составляет 12.
Мышей умерщвляли немедленно после получения оценок, получали образцы кожи спины, соответствующие обработанным областям, для гистологических анализов толщины эпидермиса и эозинофилии. Кровь также собирали для исследования уровня воспаления и уровней антител (например, титров антител к цитокинам, нейтрализующей способности, аллергенспецифичных IgG и IgE и общего IgE).
Пример 11: Терапевтическая эффективность иммуногенного продукта согласно настоящему изобретению в модели хронической обструктивной болезни легких (ХОБЛ) на мышах
ХОБЛ характеризуется прогрессирующим ограничением воздушного потока, обычно ассоциированным с усиленными воспалительными ответами на вдыхаемые раздражители, что приводит к хроническому обструктивному бронхиту и разрушению паренхимы легких, называемому эмфиземой.
Было создано несколько моделей ХОБЛ на животных для выяснения возможных механизмов, лежащих в основе начала и прогрессирования ХОБЛ. В настоящей заявке для оценки терапевтической эффективности иммуногенного продукта согласно настоящему изобретению при ХОБЛ использовали модель, индуцированную протеазой.
Получение иммуногенных продуктов muIL-4/IL-13 и muCombo
Иммуногенные продукты muIL-4, muIL-13 и muCombo синтезируют, как описано в настоящей заявке выше.
Иммунизация мышей, индукция атопического дерматита, количественная оценка лейкоцитов и гистологические анализы
Мышей иммунизировали иммуногенными продуктами muIL-4, muIL-13 или muCombo или CRM197, в качестве контроля, все эмульгированные с адъювантом на основе сквалена.
Одновременно с этим для запуска ХОБЛ-подобных симптомов, таких как, например, образование эмфиземы, использовали интраназальную инстилляцию эластолитических ферментов, таких как эластаза поджелудочной железы свиньи. В общих чертах, мышей BALB/с обрабатывали интраназально 0,6 Ед. эластазы поджелудочной железы свиньи в 30 мкл ФСБ (Shibata et al. Proc Natl Acad Sci USA. 2018 Dec 18;115(51):13057-13062).
В первом эксперименте мышей умерщвляли на день 5 для оценки лейкоцитов: количество лейкоцитов (например, моноцитов, макрофагов, нейтрофилов, Т-клеток, В-клеток и эозинофилов) количественно определяли с помощью проточной цитометрии в жидкостях бронхоальвеолярного лаважа (BAL) и суспензиях отдельных клеток легких. Дополнительную оценку инфильтрации лейкоцитов в легких выполняли с помощью гистологических исследований тканей легких, предварительно окрашенных гематоксилином и эозином (H&E). Кровь также собирали для исследования уровня воспаления и уровней антител (например, титров антител к цитокинам, нейтрализующей способности).
Во втором эксперименте мышей умерщвляли на день 21 после обработки эластазой для гистологической оценки эмфиземы легких в Н&Е-окрашенных срезах ткани легкого, используя средний линейный отрезок (MLI) в качестве индикатора расширения воздушного пространства легких. Кровь также собирали для исследования уровня воспаления и уровней антител (например, титров антител к цитокинам, нейтрализующей способности, аллергенспецифичных IgG и IgE и общего IgE).
Пример 12: Терапевтическая эффективность иммуногенного продукта согласно настоящему изобретению в модели фиброза легких на мышах
Легочный фиброз представляет собой широкий спектр заболеваний, которые характеризуются различными степенями воспаления легких, чрезмерной пролиферацией фибробластов легких и повышенным содержанием коллагена в легких.
Терапевтическую эффективность иммуногенного продукта согласно настоящему изобретению при легочном фиброзе изучали с использованием модели на животных, в которой введение блеомицина (BLM) в легких приводит к секреции провоспалительных цитокинов и хемокинов, привлечению лейкоцитов, увеличению выработки коллагена, ремоделированию и фибротическому воспалению легких.
Получение иммуногенных продуктов muIL-4/IL-13 и muCombo
Иммуногенные продукты muIL-4, muIL-13 и muCombo синтезируют, как описано в настоящей заявке выше.
Иммунизация мышей, индукция легочного фиброза, количественное определение лейкоцитов и гистологические анализы
Мышей иммунизировали иммуногенными продуктами muIL-4, muIL-13 или muCombo или CRM197, в качестве контроля, все эмульгированные с адъювантом на основе сквалена.
Одновременно с этим у мышей C57BL/6 индуцировали легочный фиброз, как описано ранее Reber et al. (J Immunol 2014 Feb 15;192(4):1847-54). В общих чертах, легочный фиброз индуцировали путем интраназального (и/н) введения гидрохлорида BLM (0,1 мг в 25 мкл ФСБ; 12,5 мкл/ноздрю).
Массу тела контролировали 5 раз в неделю до конца эксперимента, и мышей умерщвляли через 7 или 14 дней после обработки BLM для оценки фиброза легких.
Количество лейкоцитов (например, моноцитов, макрофагов, нейтрофилов, Т-лимфоцитов, В-клеток и эозинофилов) определяли количественно с помощью проточной цитометрии в жидкостях бронхоальвеолярного лаважа (БАЛ) и суспензиях отдельных клеток легких.
Выполняли гистологические исследования тканей легких, окрашенных гематоксилином и эозином (для оценки инфильтрации лейкоцитов), трихромом по Массону (для оценки фиброза) или толуидиновым синим (для оценки количества тучных клеток).
Кровь также собирали для исследования уровня воспаления и уровней антител (например, титров антител к цитокинам, нейтрализующей способности).
--->
Перечень последовательностей
<110> NEOVACS
INSERM (Institut National de la Santé et de la Recherche
Médicale)
INSTITUT PASTEUR
Grouard-Vogel Géraldine
Conde García Eva
Bertrand Romain
Caillot Noémie
Reber Laurent
Bruhns Pierre
Serra Vincent
<120> Иммуногенный продукт, содержащий IL-4 и/или IL-13
для лечения нарушений, ассоциированных с аберрантной экспрессией
или активностью IL-4 и/или IL-13
<130> CV-1058/PCT/2
<160> 8
<170> BiSSAP 1.3.6
<210> 1
<211> 535
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> CRM197
<400> 1
Gly Ala Asp Asp Val Val Asp Ser Ser Lys Ser Phe Val Met Glu Asn
1 5 10 15
Phe Ser Ser Tyr His Gly Thr Lys Pro Gly Tyr Val Asp Ser Ile Gln
20 25 30
Lys Gly Ile Gln Lys Pro Lys Ser Gly Thr Gln Gly Asn Tyr Asp Asp
35 40 45
Asp Trp Lys Glu Phe Tyr Ser Thr Asp Asn Lys Tyr Asp Ala Ala Gly
50 55 60
Tyr Ser Val Asp Asn Glu Asn Pro Leu Ser Gly Lys Ala Gly Gly Val
65 70 75 80
Val Lys Val Thr Tyr Pro Gly Leu Thr Lys Val Leu Ala Leu Lys Val
85 90 95
Asp Asn Ala Glu Thr Ile Lys Lys Glu Leu Gly Leu Ser Leu Thr Glu
100 105 110
Pro Leu Met Glu Gln Val Gly Thr Glu Glu Phe Ile Lys Arg Phe Gly
115 120 125
Asp Gly Ala Ser Arg Val Val Leu Ser Leu Pro Phe Ala Glu Gly Ser
130 135 140
Ser Ser Val Glu Tyr Ile Asn Asn Trp Glu Gln Ala Lys Ala Leu Ser
145 150 155 160
Val Glu Leu Glu Ile Asn Phe Glu Thr Arg Gly Lys Arg Gly Gln Asp
165 170 175
Ala Met Tyr Glu Tyr Met Ala Gln Ala Cys Ala Gly Asn Arg Val Arg
180 185 190
Arg Ser Val Gly Ser Ser Leu Ser Cys Ile Asn Leu Asp Trp Asp Val
195 200 205
Ile Arg Asp Lys Thr Lys Thr Lys Ile Glu Ser Leu Lys Glu His Gly
210 215 220
Pro Ile Lys Asn Lys Met Ser Glu Ser Pro Asn Lys Thr Val Ser Glu
225 230 235 240
Glu Lys Ala Lys Gln Tyr Leu Glu Glu Phe His Gln Thr Ala Leu Glu
245 250 255
His Pro Glu Leu Ser Glu Leu Lys Thr Val Thr Gly Thr Asn Pro Val
260 265 270
Phe Ala Gly Ala Asn Tyr Ala Ala Trp Ala Val Asn Val Ala Gln Val
275 280 285
Ile Asp Ser Glu Thr Ala Asp Asn Leu Glu Lys Thr Thr Ala Ala Leu
290 295 300
Ser Ile Leu Pro Gly Ile Gly Ser Val Met Gly Ile Ala Asp Gly Ala
305 310 315 320
Val His His Asn Thr Glu Glu Ile Val Ala Gln Ser Ile Ala Leu Ser
325 330 335
Ser Leu Met Val Ala Gln Ala Ile Pro Leu Val Gly Glu Leu Val Asp
340 345 350
Ile Gly Phe Ala Ala Tyr Asn Phe Val Glu Ser Ile Ile Asn Leu Phe
355 360 365
Gln Val Val His Asn Ser Tyr Asn Arg Pro Ala Tyr Ser Pro Gly His
370 375 380
Lys Thr Gln Pro Phe Leu His Asp Gly Tyr Ala Val Ser Trp Asn Thr
385 390 395 400
Val Glu Asp Ser Ile Ile Arg Thr Gly Phe Gln Gly Glu Ser Gly His
405 410 415
Asp Ile Lys Ile Thr Ala Glu Asn Thr Pro Leu Pro Ile Ala Gly Val
420 425 430
Leu Leu Pro Thr Ile Pro Gly Lys Leu Asp Val Asn Lys Ser Lys Thr
435 440 445
His Ile Ser Val Asn Gly Arg Lys Ile Arg Met Arg Cys Arg Ala Ile
450 455 460
Asp Gly Asp Val Thr Phe Cys Arg Pro Lys Ser Pro Val Tyr Val Gly
465 470 475 480
Asn Gly Val His Ala Asn Leu His Val Ala Phe His Arg Ser Ser Ser
485 490 495
Glu Lys Ile His Ser Asn Glu Ile Ser Ser Asp Ser Ile Gly Val Leu
500 505 510
Gly Tyr Gln Lys Thr Val Asp His Thr Lys Val Asn Ser Lys Leu Ser
515 520 525
Leu Phe Phe Glu Ile Lys Ser
530 535
<210> 2
<211> 129
<212> БЕЛОК
<213> Homo sapiens
<220>
<223> IL-4 человека
<400> 2
His Lys Cys Asp Ile Thr Leu Gln Glu Ile Ile Lys Thr Leu Asn Ser
1 5 10 15
Leu Thr Glu Gln Lys Thr Leu Cys Thr Glu Leu Thr Val Thr Asp Ile
20 25 30
Phe Ala Ala Ser Lys Asn Thr Thr Glu Lys Glu Thr Phe Cys Arg Ala
35 40 45
Ala Thr Val Leu Arg Gln Phe Tyr Ser His His Glu Lys Asp Thr Arg
50 55 60
Cys Leu Gly Ala Thr Ala Gln Gln Phe His Arg His Lys Gln Leu Ile
65 70 75 80
Arg Phe Leu Lys Arg Leu Asp Arg Asn Leu Trp Gly Leu Ala Gly Leu
85 90 95
Asn Ser Cys Pro Val Lys Glu Ala Asn Gln Ser Thr Leu Glu Asn Phe
100 105 110
Leu Glu Arg Leu Lys Thr Ile Met Arg Glu Lys Tyr Ser Lys Cys Ser
115 120 125
Ser
<210> 3
<211> 22
<212> БЕЛОК
<213> Homo sapiens
<220>
<223> Фрагмент IL-4 человека
<400> 3
Ala Gln Gln Phe His Arg His Lys Gln Leu Ile Arg Phe Leu Lys Arg
1 5 10 15
Leu Asp Arg Asn Leu Trp
20
<210> 4
<211> 120
<212> БЕЛОК
<213> Mus musculus
<220>
<223> IL-4 мыши
<400> 4
His Ile His Gly Cys Asp Lys Asn His Leu Arg Glu Ile Ile Gly Ile
1 5 10 15
Leu Asn Glu Val Thr Gly Glu Gly Thr Pro Cys Thr Glu Met Asp Val
20 25 30
Pro Asn Val Leu Thr Ala Thr Lys Asn Thr Thr Glu Ser Glu Leu Val
35 40 45
Cys Arg Ala Ser Lys Val Leu Arg Ile Phe Tyr Leu Lys His Gly Lys
50 55 60
Thr Pro Cys Leu Lys Lys Asn Ser Ser Val Leu Met Glu Leu Gln Arg
65 70 75 80
Leu Phe Arg Ala Phe Arg Cys Leu Asp Ser Ser Ile Ser Cys Thr Met
85 90 95
Asn Glu Ser Lys Ser Thr Ser Leu Lys Asp Phe Leu Glu Ser Leu Lys
100 105 110
Ser Ile Met Gln Met Asp Tyr Ser
115 120
<210> 5
<211> 108
<212> БЕЛОК
<213> Canis
<220>
<223> IL-4 собаки
<400> 5
His Asn Phe Asn Ile Thr Ile Lys Glu Ile Ile Lys Met Leu Asn Ile
1 5 10 15
Leu Thr Ala Arg Asn Asp Ser Cys Met Glu Leu Thr Val Lys Asp Val
20 25 30
Phe Thr Ala Pro Lys Asn Thr Ser Asp Lys Glu Ile Phe Cys Arg Ala
35 40 45
Ala Thr Val Leu Arg Gln Ile Tyr Thr His Asn Cys Ser Asn Arg Tyr
50 55 60
Leu Arg Gly Leu Tyr Arg Asn Leu Ser Ser Met Ala Asn Lys Thr Cys
65 70 75 80
Ser Met Asn Glu Ile Lys Lys Ser Thr Leu Lys Asp Phe Leu Glu Arg
85 90 95
Leu Lys Val Ile Met Gln Lys Lys Tyr Tyr Arg His
100 105
<210> 6
<211> 122
<212> БЕЛОК
<213> Homo sapiens
<220>
<223> IL-13 человека
<400> 6
Leu Thr Cys Leu Gly Gly Phe Ala Ser Pro Gly Pro Val Pro Pro Ser
1 5 10 15
Thr Ala Leu Arg Glu Leu Ile Glu Glu Leu Val Asn Ile Thr Gln Asn
20 25 30
Gln Lys Ala Pro Leu Cys Asn Gly Ser Met Val Trp Ser Ile Asn Leu
35 40 45
Thr Ala Gly Met Tyr Cys Ala Ala Leu Glu Ser Leu Ile Asn Val Ser
50 55 60
Gly Cys Ser Ala Ile Glu Lys Thr Gln Arg Met Leu Ser Gly Phe Cys
65 70 75 80
Pro His Lys Val Ser Ala Gly Gln Phe Ser Ser Leu His Val Arg Asp
85 90 95
Thr Lys Ile Glu Val Ala Gln Phe Val Lys Asp Leu Leu Leu His Leu
100 105 110
Lys Lys Leu Phe Arg Glu Gly Arg Phe Asn
115 120
<210> 7
<211> 110
<212> БЕЛОК
<213> Mus musculus
<220>
<223> IL-13 мыши
<400> 7
Pro Val Pro Arg Ser Val Ser Leu Pro Leu Thr Leu Lys Glu Leu Ile
1 5 10 15
Glu Glu Leu Ser Asn Ile Thr Gln Asp Gln Thr Pro Leu Cys Asn Gly
20 25 30
Ser Met Val Trp Ser Val Asp Leu Ala Ala Gly Gly Phe Cys Val Ala
35 40 45
Leu Asp Ser Leu Thr Asn Ile Ser Asn Cys Asn Ala Ile Tyr Arg Thr
50 55 60
Gln Arg Ile Leu His Gly Leu Cys Asn Arg Lys Ala Pro Thr Thr Val
65 70 75 80
Ser Ser Leu Pro Asp Thr Lys Ile Glu Val Ala His Phe Ile Thr Lys
85 90 95
Leu Leu Ser Tyr Thr Lys Gln Leu Phe Arg His Gly Pro Phe
100 105 110
<210> 8
<211> 113
<212> БЕЛОК
<213> Canis
<220>
<223> IL-13 собаки
<400> 8
Ser Pro Ser Pro Val Thr Pro Ser Pro Thr Leu Lys Glu Leu Ile Glu
1 5 10 15
Glu Leu Val Asn Ile Thr Gln Asn Gln Ala Ser Leu Cys Asn Gly Ser
20 25 30
Met Val Trp Ser Val Asn Leu Thr Ala Gly Met Tyr Cys Ala Ala Leu
35 40 45
Glu Ser Leu Ile Asn Val Ser Asp Cys Ser Ala Ile Gln Arg Thr Gln
50 55 60
Arg Met Leu Lys Ala Leu Cys Ser Gln Lys Pro Ala Ala Gly Gln Ile
65 70 75 80
Ser Ser Glu Arg Ser Arg Asp Thr Lys Ile Glu Val Ile Gln Leu Val
85 90 95
Lys Asn Leu Leu Thr Tyr Val Arg Gly Val Tyr Arg His Gly Asn Phe
100 105 110
Arg
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ИММУНОЦИТОКИНЫ НА ОСНОВЕ IL-15 И IL-15Rα ДОМЕНА SUSHI | 2012 |
|
RU2763298C2 |
| ИНГИБИТОРЫ ПУТИ IL-4/IL-13 ДЛЯ ПОВЫШЕННОЙ ЭФФЕКТИВНОСТИ ПРИ ЛЕЧЕНИИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ | 2020 |
|
RU2836467C2 |
| МУЛЬТИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО СО СПЕЦИФИЧНОСТЬЮ СВЯЗЫВАНИЯ IL-13 И IL-17 ЧЕЛОВЕКА | 2020 |
|
RU2827946C1 |
| СЛИТЫЕ БЕЛКИ IL-10/FC, ПРИГОДНЫЕ В КАЧЕСТВЕ ЭНХАНСЕРОВ ИММУНОТЕРАПИИ | 2020 |
|
RU2825306C1 |
| Анти-PD-L1 и IL-2 цитокины | 2017 |
|
RU2769282C2 |
| АНТИ-IL-22R-АНТИТЕЛА | 2017 |
|
RU2758721C2 |
| АНТИТЕЛА ПРОТИВ BTN3A И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ РАКА ИЛИ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ | 2019 |
|
RU2800726C2 |
| КОМПОЗИЦИИ IL-12, НАЦЕЛЕННЫЕ НА EDB | 2019 |
|
RU2758143C1 |
| ПЕПТИДНЫЕ ИММУНОГЕНЫ, НАЦЕЛЕННЫЕ НА ИНТЕРЛЕЙКИН 6 (IL-6), И ИХ СОСТАВЫ ДЛЯ ИММУНОТЕРАПИИ ЗАБОЛЕВАНИЙ, НА КОТОРЫЕ ВЛИЯЕТ НАРУШЕНИЕ РЕГУЛЯЦИИ IL-6 | 2019 |
|
RU2780161C1 |
| ПОЛИПЕПТИДЫ, СОДЕРЖАЩИЕ ОДИНОЧНЫЕ ВАРИАБЕЛЬНЫЕ ДОМЕНЫ ИММУНОГЛОБУЛИНОВ, НАЦЕЛИВАЮЩИЕСЯ НА IL-13 И TSLP | 2020 |
|
RU2836310C1 |

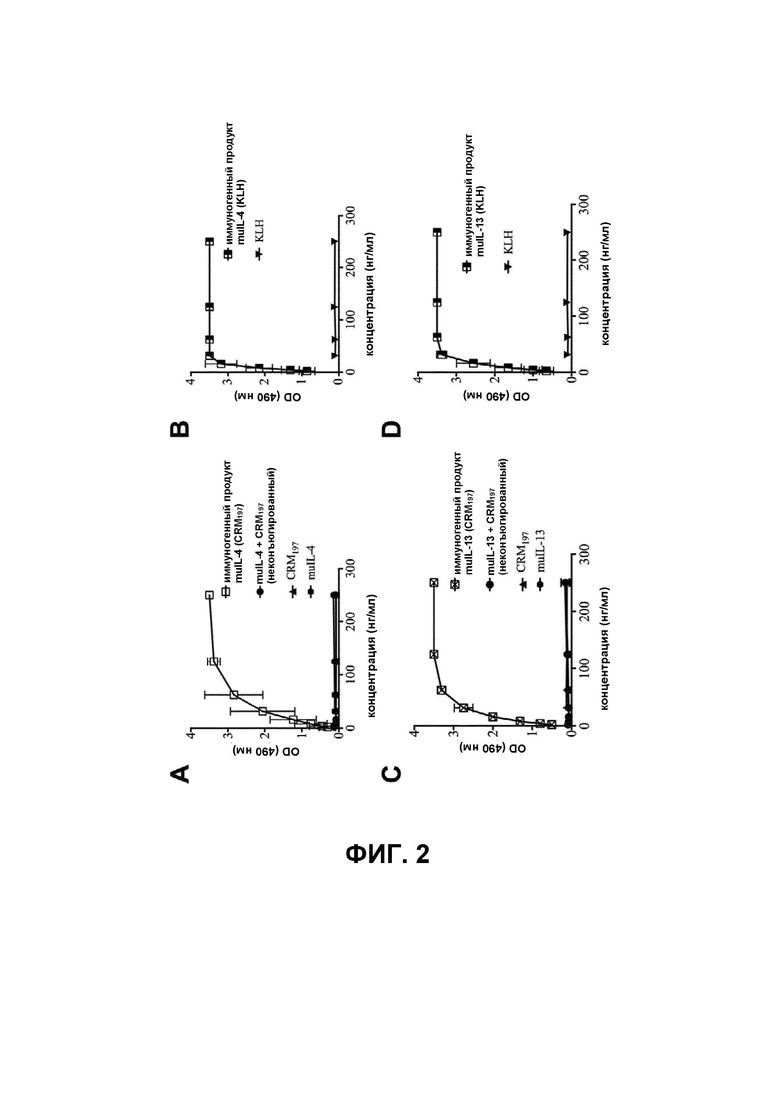

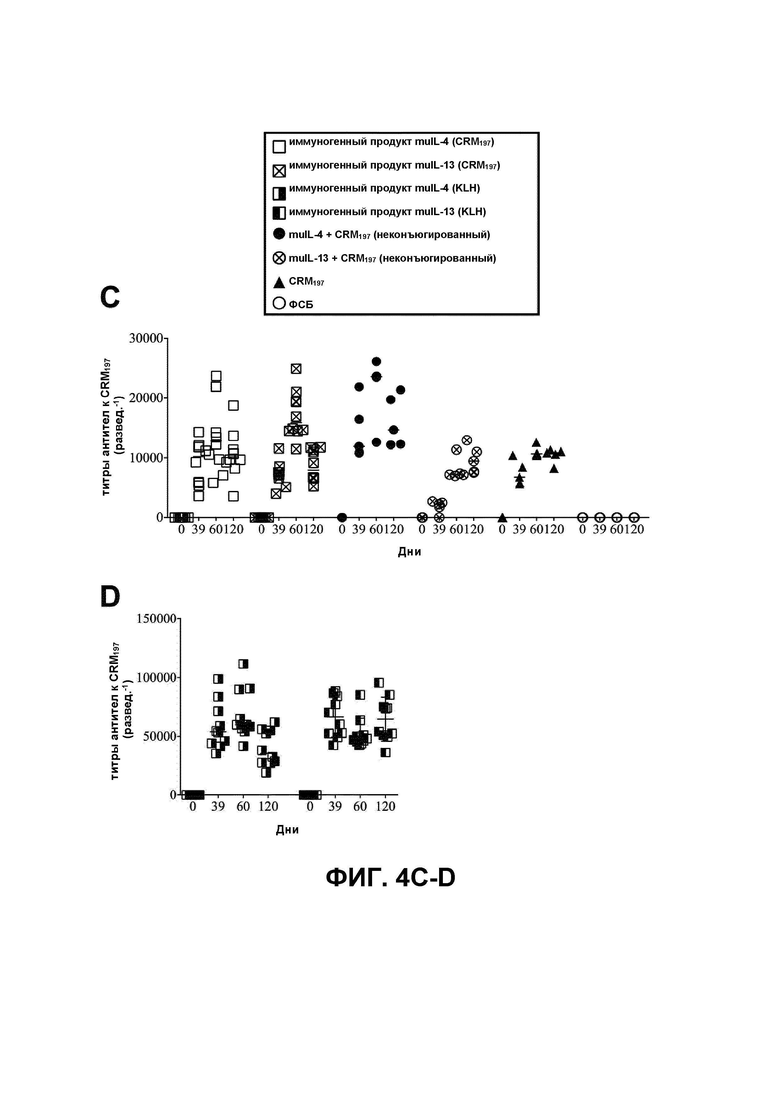



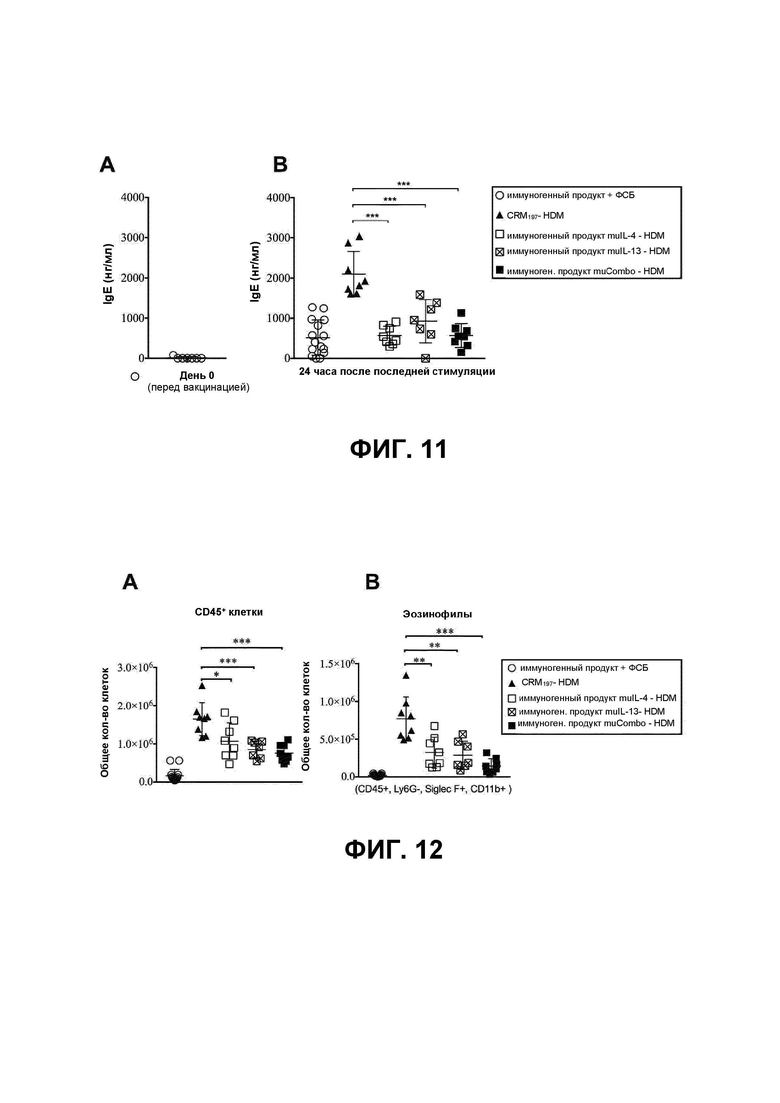


Группа изобретений относится к области фармацевтики и медицины. 1 объект представляет собой иммуногенный продукт для лечения воспалительного нарушения, содержащий по меньшей мере один цитокин, конъюгированный с белком-носителем, причем указанный по меньшей мере один цитокин представляет собой IL-13 или вариант IL-13 млекопитающего, причем указанный вариант демонстрирует по меньшей мере 80% идентичности с IL-13 млекопитающего, от молекулы которого он происходит, при этом указанный белок-носитель представляет собой CRM197. 2 объект – композицию для лечения воспалительного нарушения, содержащую по меньшей мере один иммуногенный продукт. 3 объект – способ получения иммуногенного продукта с использованием гетеробифункционального перекрестносшивающего агента, содержащего сложный эфир NHS. 4 и 5 объекты – применение иммуногенного продукта или композиции для лечения воспалительного нарушения, которое ассоциировано с аберрантной экспрессией или активностью IL-13, и для индукции десенсибилизации субъекта, имеющего аллергию к специфичному антигену. Технический результат заключается в эффективности иммуногенного продукта и продукции нейтрализующих антител при его введении. 5 н. и 11 з.п. ф-лы, 16 ил., 13 табл., 12 пр.
1. Иммуногенный продукт для лечения воспалительного нарушения, содержащий по меньшей мере один цитокин, конъюгированный с белком-носителем, причем указанный по меньшей мере один цитокин представляет собой IL-13 или вариант IL-13 млекопитающего, причем указанный вариант демонстрирует по меньшей мере 80% идентичности с IL-13 млекопитающего, от молекулы которого он происходит, при этом указанный белок-носитель представляет собой CRM197, и причем указанный иммуногенный продукт получен способом, включающим следующие стадии:
(a) приведения в контакт IL-13 или его варианта с гетеробифункциональным перекрёстносшивающим агентом, содержащим сложный эфир NHS, с получением комплекса сложный эфир NHS-IL-13;
(b) приведения в контакт CRM197 с гетеробифункциональным перекрёстносшивающим агентом, содержащим сложный эфир NHS, с получением комплекса CRM197-сложный эфир NHS;
(c) приведения в контакт указанного гетеробифункционального перекрёстносшивающего агента, содержащего комплекс сложный эфир NHS-IL-13, полученного на стадии (a), с комплексом CRM197-сложный эфир NHS, полученным на стадии (b).
2. Иммуногенный продукт по п. 1, отличающийся тем, что указанный иммуногенный продукт дополнительно содержит IL-4, причем IL-4 и IL-13 оба соединены с CRM197.
3. Композиция для лечения воспалительного нарушения, содержащая по меньшей мере один иммуногенный продукт по п. 1 или 2 и дополнительно содержащая по меньшей мере одно фармацевтически приемлемое вспомогательное вещество и/или по меньшей мере один адъювант.
4. Композиция по п. 3, причем указанная композиция дополнительно содержит иммуногенный продукт, содержащий IL-4 и CRM197.
5. Композиция по п. 4, причем указанная композиция содержит смесь иммуногенного продукта, содержащего IL-4 и CRM197, с иммуногенным продуктом, содержащим IL-13 и CRM197, в массовом соотношении в диапазоне от 10:1 до 1:10.
6. Композиция по любому из пп. 3-5, которая представляет собой эмульсию.
7. Способ получения иммуногенного продукта по п. 1 или 2, причем указанный способ включает стадии:
а) приведения IL-13 или его варианта, причем указанный вариант демонстрирует по меньшей мере 80% идентичности с IL-13 млекопитающего, от молекулы которого он происходит, в контакт с гетеробифункциональным перекрёстносшивающим агентом, содержащим сложный эфир NHS, с получением комплекса сложный эфир NHS-IL-13;
b) приведения CRM197 в контакт с гетеробифункциональным перекрёстносшивающим агентом, содержащим сложный эфир NHS, с получением комплекса CRM197-сложный эфир NHS;
с) приведения указанного гетеробифункционального перекрёстносшивающего агента, содержащего комплекс сложный эфир NHS-IL-13, полученного на стадии (a), в контакт с указанным комплексом CRM197-сложный эфир NHS, полученным на стадии (b).
8. Способ получения иммуногенного продукта по п. 7, отличающийся тем, что указанный сложный эфир NHS на стадии (a) представляет собой N-[γ-малеимидобутирилокси]-сукцинимид (GMBS).
9. Способ получения иммуногенного продукта по п. 7, отличающийся тем, что указанный сложный эфир NHS на стадии (b) представляет собой N-сукцинимидил-S-ацетилтиоацетат (SATA).
10. Способ получения иммуногенного продукта по п. 7, включающий следующие стадии:
a) приведение указанного IL-13 или его варианта в контакт с GMBS с получением комплекса GMBS-IL-13;
b) приведение CRM197 в контакт с N-сукцинимидил-S-ацетилтиоацетатом (SATA) с получением комплекса CRM197-SATA;
c) приведение указанного комплекса GMBS- IL-13, полученного на стадии (a), в контакт с комплексом CRM197-SATA, полученным на стадии (b).
11. Применение иммуногенного продукта по п. 1 или 2 или композиции по любому из пп. 3-6 для лечения воспалительного нарушения, которое ассоциировано с аберрантной экспрессией или активностью IL-13.
12. Применение по п. 11, отличающееся тем, что указанное воспалительное нарушение выбрано из группы, включающей астму, аллергические состояния, атопические нарушения, буллезный пемфигоид, респираторные нарушения, полипоз носа и другие состояния, вовлекающие воспаление дыхательных путей; воспалительные и/или аутоиммунные нарушения или состояния, желудочно-кишечные нарушения или состояния; системную красную волчанку, нарушения или состояния печени, склеродермию; фиброзные заболевания или нарушения, склеродермию; солидные опухоли или разные виды рака, глиобластому, лимфому и мастоцитоз.
13. Применение по п. 11 или 12, отличающееся тем, что указанное воспалительное нарушение выбрано из группы, включающей аллергическую астму, неаллергическую астму, пищевые аллергии, аллергию на яд, аллергию на животных, лекарственную аллергию, синдром гипер-IgE, аллергический ринит, аллергический конъюнктивит, аллергический энтерогастрит, атопический дерматит, крапивницу, экзему, хроническую обструктивную болезнь легких (ХОБЛ), эозинофилию, фиброз и избыточную выработку слизи, включая муковисцидоз и легочный фиброз, системный склероз (SSc), воспалительные заболевания кишечника (IBD), эозинофильный эзофагит (EE), желудочно-кишечное заболевание, опосредуемое эозинофилами, язвенный колит, болезнь Крона, цирроз, гепатоцеллюлярную карциному, фиброз печени, лейкемию и лимфому Ходжкина.
14. Применение по любому из пп. 11-13, отличающееся тем, что указанное воспалительное нарушение выбрано из группы, включающей хроническую идиопатическую крапивницу, хроническую спонтанную крапивницу, фиброз, вызванный вирусом гепатита B и/или С, и хронический B-клеточный лимфоцитарный лейкоз.
15. Применение по любому из пп. 11-14, отличающееся тем, что указанное воспалительное нарушение выбрано из астмы, атопического дерматита, хронической обструктивной болезни легких (ХОБЛ), легочного фиброза, пищевой аллергии, полипоза носа и эозинофильного эзофагита, причем предпочтительно указанное воспалительное нарушение представляет собой аллергию, астму или атопический дерматит.
16. Применение иммуногенного продукта по п. 1 или 2 или композиции по любому из пп. 3-6 для индукции десенсибилизации субъекта, имеющего аллергию к специфичному антигену, причем указанный иммуногенный продукт или композиция и указанный специфичный антиген предназначены для введения указанному субъекту, имеющему аллергию.
| US 2006104943 A1, 18.05.2006 | |||
| TOBIAS J | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| - Vol | |||
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
| - No | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| - P | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| LE BUANEC H | |||
| et al | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
Авторы
Даты
2023-12-12—Публикация
2019-05-29—Подача