Настоящая заявка испрашивает приоритет на основании заявки на патент Китая №2019109276005, поданной в Национальное управление интеллектуальной собственности Китая 27 сентября 2019 г., и заявки на патент Китая №2019108040353 от 28 августа 2019 г, содержание которых полностью включено в настоящий документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области генной инженерии и микроорганизмов, и, в частности, к рекомбинантному штамму на основе Escherichia coli, способу его конструирования и его применению.
УРОВЕНЬ ТЕХНИКИ
L-треонин является одной из восьми незаменимых аминокислот и представляет собой аминокислоту, которую люди и животные не могут синтезировать самостоятельно. L-треонин может улучшать усвояемость зерна, регулировать баланс метаболизма in vivo и способствовать росту и развитию организмов, поэтому он широко применяется в кормовой, медицинской и пищевой промышленности.
В настоящее время L-треонин может быть получен главным образом методом химического синтеза, методом гидролиза белка и методом микробной ферментации, при этом метод микробной ферментации обладает преимуществами в виде низкой стоимости производства, высокой интенсивности производства и малого загрязнения окружающей среды, тем самым становясь наиболее широко применяемым методом промышленного производства L-треонина. Для продуцирования L-треонина путем микробной ферментации могут быть использованы различные бактерии, такие как мутанты, полученные путем индукции Escherichia coli (Ε. coli), Corynebacterium и Serratia дикого типа, взятых в качестве штаммов-продуцентов. Конкретные примеры включают в себя мутантов или различных ауксотрофов, устойчивых к аналогам аминокислот, таких как метионин, треонин и изолейцин. Однако при традиционной мутационной селекции штамм растет медленно и производит больше побочных продуктов из-за случайной мутации, так что получить высокопроизводительный штамм непросто. Следовательно, конструирование рекомбинантной Е. coli с помощью метаболической инженерии является эффективным способом получения L-треонина. В настоящее время сверхэкспрессия или аттенуация ключевых генов ферментов в биосинтезе аминокислот и конкурентном пути, опосредованном экспрессионными плазмидами, является основным средством генетической модификации Е. coli. По-прежнему существует необходимость в разработке более экономичного способа получения L-треонина с высоким выходом.
Е. coli в качестве хозяина для экзогенной экспрессии генов обладает преимуществами в виде чистого генетического фона, простых технических условий эксплуатации и культивирования, а также экономичной крупномасштабной ферментации, и поэтому специалисты по генной инженерии уделяют ей все больше внимания. Геномная ДНК Е. coli представляет собой кольцевую молекулу в нуклеоиде, а также может быть представлено множество кольцевых плазмидных ДНК. Нуклеоид в клетках Е. coli состоит из одной молекулы ДНК длиной около 4 700 000 пар нуклеотидов и содержит около 4400 генов, распределенных по молекуле ДНК, причем средняя длина каждого гена составляет около 1000 пар нуклеотидов. Для штаммов Е. coli, обычно используемых в молекулярной биологии, наиболее часто используемыми штаммами в экспериментах по рекомбинации ДНК, за некоторыми исключениями, являются штамм Е. coli K12 и его производные.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Согласно настоящему изобретению предложены рекомбинантный штамм Escherichia coli на основе штамма К12 или его производный штамм, способ его рекомбинантного конструирования и его применение в ферментативном получении аминокислоты.
Настоящее изобретение главным образом относится к гену deoB дикого типа (последовательность ORF (Открытая Рамка Считывания) представлена в последовательности 3902352 3903575 в GenBank под идентификационным номером СР032667.1) и последовательности промотора гена rhtA дикого типа PrhtA (представлена в последовательности 850520 850871 в GenBank под идентификационным номером АР009048.1) штамма Е. coli К12 и его производного штамма (например, MG1655 и W3110), а также в настоящем изобретении обнаружено, что мутантный ген, полученный путем сайт-направленного мутагенеза, и рекомбинантный штамм, содержащий мутантный ген, можно применять для получения L-треонина, и, по сравнению с немутированным штаммом дикого типа, полученный штамм может значительно улучшить выход L-треонина, данный штамм обладает хорошей стабильностью, а также имеет более низкую стоимость производства и повышенную эффективность производства в качестве штамма для получения L-треонина.
На основании указанной выше информации, согласно настоящему изобретению предложены два следующих технических решения:
Согласно первому техническому решению предложена нуклеотидная последовательность, содержащая последовательность, образованную посредством мутации, возникшей в 1049-м основании кодирующей последовательности гена deoB дикого типа, представленной в SEQ ID NO: 1.
Согласно настоящему изобретению мутация относится к изменению основания/нуклеотида в сайте, и способ мутации может быть по меньшей мере одним, выбранным из следующих способов: мутагенез, ПЦР сайт-направленный мутагенез и/или гомологичная рекомбинации, и тому подобное.
Согласно настоящему изобретению мутация состоит в том, что гуанин (G) заменен на аденин (А) в 1049-м основании в SEQ ID NO: 1; в частности, мутированная нуклеотидная последовательность представлена в SEQ ID NO: 2
Согласно настоящему изобретению также предложен рекомбинантный белок, кодируемый указанной выше нуклеотидной последовательностью.
Описанный в данном документе рекомбинантный белок содержит аминокислотную последовательность, представленную в SEQ ID NO: 4.
Согласно настоящему изобретению также предложен рекомбинантный вектор, содержащий указанную выше нуклеотидную последовательность.
Описанный в данном документе рекомбинантный вектор сконструирован путем введения указанной выше нуклеотидной последовательности в плазмиду; в одном из вариантов осуществления плазмида представляет собой плазмиду pKOV. В частности, нуклеотидная последовательность и плазмида могут быть расщеплены эндонуклеазой с образованием комплементарных когезионных концов, которые лигируют для конструирования рекомбинантного вектора.
Согласно настоящему изобретению также предложен рекомбинантный штамм, который содержит кодирующую нуклеотидную последовательность гена deoB с точечной мутацией, возникшей в кодирующей последовательности.
Описанный в данном документе рекомбинантный штамм содержит указанную выше мутированную нуклеотидную последовательность.
В одном из вариантов осуществления настоящего изобретения рекомбинантный штамм содержит нуклеотидную последовательность, представленную в SEQ ID NO: 2.
В одном из вариантов осуществления настоящего изобретения рекомбинантный штамм содержит аминокислотную последовательность, представленную в SEQ ID NO: 4.
Описанный в данном документе рекомбинантный штамм сконструирован путем введения указанного выше рекомбинантного вектора в штамм-хозяин; штамм-хозяин конкретно не определен и может быть выбран из известного в данной области техники штамма, продуцирующего L-треонин, который сохраняет ген deoB, например, из Escherichia coli. В одном из вариантов осуществления настоящего изобретения штамм-хозяин представляет собой штамм Е. coli K12 (W3110) или штамм Е. coli CGMCC 7.232.
Для описанного в данном документе рекомбинантного штамма использовали плазмиду pKOV в качестве вектора.
Описанный в данном документе рекомбинантный штамм может дополнительно содержать другие модификации.
Согласно настоящему изобретению также предложен способ конструирования рекомбинантного штамма, который включает следующую стадию:
модификация нуклеотидной последовательности области открытой рамки считывания гена deoB дикого типа, представленной в SEQ ID NO: 1, для обеспечения возможности возникновения мутации в 1049-м основании последовательности для получения продуцирующего L-треонин рекомбинантного штамма, содержащего мутированный кодирующий ген deoB.
Согласно способу конструирования по настоящему изобретению, модификация включает по меньшей мере один из следующих способов: мутагенез, ПЦР сайт-направленный мутагенез и/или гомологичная рекомбинация, и тому подобное.
Согласно способу конструирования по настоящему изобретению, мутация состоит в том, что гуанин (G) заменен на аденин (А) в 1049-м основании в SEQ ID NO: 1, в частности, мутированная нуклеотидная последовательность представлена в SEQ ID NO: 2.
Иллюстративно, способ конструирования включает следующие этапы:
(1) модификация нуклеотидной последовательности области открытой рамки считывания гена deoB дикого типа, представленной в SEQ ID NO: 1, для обеспечения возможности возникновения мутации в 1049-м основании последовательности, для того чтобы получить мутированную нуклеотидную последовательность области открытой рамки считывания гена deoB;
(2) лигирование мутированной нуклеотидной последовательности с плазмидой для конструирования рекомбинантного вектора; и
(3) введение рекомбинантного вектора в штамм-хозяин для получения продуцирующего L-треонин рекомбинантного штамма, содержащего точечную мутацию.
Согласно способу конструирования по настоящему изобретению, этап (1) включает: конструирование кодирующей области гена deoB, содержащей точечную мутацию, в частности, включающее синтез двух пар праймеров для амплификации фрагментов кодирующей области гена deoB в соответствии с кодирующей последовательностью гена deoB, и введение точечной мутации в кодирующую область гена deoB дикого типа (SEQ ID NO: 1) путем ПЦР сайт-направленного мутагенеза для получения нуклеотидной последовательности (SEQ ID NO: 2) кодирующей области гена deoB, содержащей точечную мутацию, где нуклеотидная последовательность обозначена как deoB(G1049A).
В одном из вариантов осуществления настоящего изобретения на этапе (1) праймеры представляют собой:
П1: 5' CGGGATCCATGGACGGCAACGCTGAAG 3' (подчеркнутая часть обозначает сайт разрезания эндонуклеазой рестрикции ВаmH I) (SEQ ID NO: 5);
П2: 5' GATCGTAACCGTGGTCAG 3' (SEQ ID NO: 6);
П3: 5' CTGACCACGGTTACGАТС 3' (SEQ ID NO: 7); и
П4: 5' AAGGAAAAAAGCGGCCGCGCTCGTGAGTGCGGATGT 3' (подчеркнутая часть обозначает сайт разрезания эндонуклеазой рестрикции Not I) (SEQ ID NO: 8).
В одном из вариантов осуществления настоящего изобретения этап (1) включает: применение праймеров П1/П2 и П3/П4 для ПЦР-амплификации путем применения Е. coli K12 в качестве матрицы для получения двух выделенных фрагментов ДНК (deoB Up и deoB Down), составляющих в длину 836 п. н. и 890 п. н. и содержащих кодирующие области гена deoB; и разделение и очистку данных двух фрагментов ДНК с помощью электрофореза в агарозном геле, а затем выполнение ПЦР с перекрывающимися праймерами путем применения П1 и П4 в качестве праймеров и двух фрагментов ДНК в качестве матрицы для получения deoB(G1049A)-Up-Down.
В одном из вариантов осуществления настоящего изобретения нуклеотидная последовательность deoB(G1049A)-Up-Down имеет длину 1726 п.н.
В одном из вариантов осуществления настоящего изобретения ПЦР-амплификацию осуществляют следующим образом: денатурация при 94°С в течение 30 с, отжиг при 52°С в течение 30 с и элонгация при 72°С в течение 30 с (всего 30 циклов).
В одном из вариантов осуществления настоящего изобретения ПЦР-амплификацию осуществляют следующим образом: денатурация при 94°С в течение 30 с, отжиг при 52°С в течение 30 с и элонгация при 72°С в течение 60 с (всего 30 циклов).
Согласно способу конструирования по настоящему изобретению, этап (2) включает: конструирование рекомбинантного вектора, в частности, отделение и очистку фрагмента deoB(G1049A)-Up-Down с помощью электрофореза в агарозном геле, затем двойное расщепление очищенного фрагмента и плазмиды pKOV с помощью ВаmН I/Not I, и отделение и очистку расщепленного фрагмента deoB(G1049A)-Up-Down и расщепленной плазмиды pKOV с помощью электрофореза в агарозном геле с последующим лигированием для получения рекомбинантного вектора pKOV- deoB(G1049A).
Согласно способу конструирования по настоящему изобретению, этап (3) включает: конструирование рекомбинантного штамма, в частности, трансформацию рекомбинантного вектора pKOV-deoB(G1049A)- в штамм-хозяин для получения рекомбинантного штамма.
В одном из вариантов осуществления настоящего изобретения трансформация на этапе (3) представляет собой процесс электротрансформации; иллюстративно, на этапе (3) рекомбинантный вектор вводят в штамм-хозяин.
Согласно способу конструирования по настоящему изобретению, указанный способ дополнительно включает стадию скрининга рекомбинантного штамма; иллюстративно, скрининг осуществляют с использованием питательной среды с добавлением хлорамфеникола.
Согласно настоящему изобретению также предложен рекомбинантный штамм, полученный указанным выше способом конструирования.
Согласно настоящему изобретению также предложено применение указанного выше рекомбинантного штамма для получения L-треонина или увеличения объема ферментации L-треонина.
Применение данного рекомбинантного штамма для получения L-треонина включает ферментацию рекомбинантного штамма для получения L-треонина.
Согласно второму техническому решению предложен промотор, содержащий нуклеотидную последовательность, образованную посредством мутации, возникшей в 67-м основании выше по нуклеотидной последовательности, представленной в SEQ ID NO: 13.
Согласно настоящему изобретению мутация относится к изменению основания в сайте, и способ мутации может быть по меньшей мере одним, выбранным из следующих способов: мутагенез, ПЦР сайт-направленный мутагенез и/или гомологичной рекомбинации, и тому подобное.
Согласно настоящему изобретению мутация состоит в том, что аденин (А) заменен на гуанин (G) в 67-м основании в SEQ ID NO: 13, в частности, мутированная нуклеотидная последовательность представлена в SEQ ID NO: 14.
Согласно настоящему изобретению предложена экспрессионная кассета, содержащая указанный выше промотор и кодирующую нуклеотидную последовательность гена rhtA. В одном из вариантов осуществления настоящего изобретения промотор расположен на 5' конце выше по кодирующей нуклеотидной последовательности гена rhtA, образуя экспрессионную кассету.
Согласно экспрессионной кассете по настоящему изобретению кодирующая нуклеотидная последовательность гена rhtA содержит нуклеотидную последовательность, представленную в SEQ ID NO: 15, и данная нуклеотидная последовательность кодирует последовательность, содержащую аминокислотную последовательность, представленную в SEQIDNO: 16.
Согласно настоящему изобретению предложен рекомбинантный вектор, который содержит указанный выше промотор.
Описанный в данном документе рекомбинантный вектор сконструирован путем введения нуклеотидной последовательности, содержащей указанную выше промоторную нуклеотидную последовательность, в плазмиду; в одном из вариантов осуществления плазмида представляет собой плазмиду pKOV. В частности, нуклеотидная последовательность, содержащая промоторную нуклеотидную последовательность, и плазмида могут быть расщеплены эндонуклеазой для образования комплементарных когезионных концов, которые лигируют для конструирования рекомбинантного вектора.
Согласно настоящему изобретению также предложен рекомбинантный штамм, который содержит указанный выше промотор.
Описанный в данном документе рекомбинантный штамм содержит промоторную нуклеотидную последовательность, представленную в SEQ ID NO: 14; кроме того, данный рекомбинантный штамм содержит указанную выше экспрессионную кассету.
Описанный в данном документе рекомбинантный штамм получают путем введения указанного выше рекомбинантного вектора в штамм-хозяин; штамм-хозяин конкретно не определен и может быть выбран из известного в данной области техники штамма, продуцирующего L-треонин, который сохраняет ген rhtA, например, из Escherichia coli. В одном из вариантов осуществления настоящего изобретения штамм-хозяин представляет собой штамм Е. coli K12 (W3110), или его производный штамм Е. coli K12 (W3110), или штамм coli CGMCC 7.232.
Для описанного в данном документе рекомбинантного штамма использовали плазмиду pKOV в качестве вектора.
Согласно настоящему изобретению рекомбинантный штамм может содержать или не содержать дополнительно другие модификации.
Согласно настоящему изобретению также предложен способ конструирования рекомбинантного штамма, который включает следующий этап:
модификация промоторной области, представленной в SEQ ID NO: 13 для обеспечения возможности возникновения мутации в -67-м основании области, для получения рекомбинантного штамма промотора, содержащего точечную мутацию.
Согласно способу конструирования настоящего изобретения, модификация включает по меньшей мере один способ, выбранный из следующих способов: мутагенез, ПЦР сайт-направленный мутагенез и/или гомологичной рекомбинации, и тому подобное.
Согласно способу конструирования настоящего изобретения, мутация состоит в том, что аденин (А) заменен на гуанин (G) в -67-м основании в SEQ ID NO: 13; в частности, промоторная нуклеотидная последовательность гена rhtA с точечной мутацией представлена в SEQ ID NO: 14.
Кроме того, способ конструирования включает следующие этапы:
(1) модификация промоторной области гена rhtA дикого типа, представленной в SEQ ID NO: 13 для обеспечения возможности возникновения мутации в -67-м основании области, для получения нуклеотидной последовательности мутированной промоторной области;
(2) лигирование нуклеотидной последовательности мутированной промоторной области с плазмидой для конструирования рекомбинантного вектора; и
(3) введение рекомбинантного вектора в штамм-хозяин для получения рекомбинантного штамма, содержащего мутированную промоторную область.
Согласно настоящему изобретению на этапе (1) способ мутации основания включает мутагенез, ПЦР сайт-направленный мутагенез или гомологичную рекомбинацию, и предпочтительно ПЦР сайт-направленный мутагенез.
Согласно настоящему изобретению этап (1) включает:
синтез двух пар праймеров для амплификации фрагментов промоторной области гена rhtA в соответствии с последовательностью промотора гена rhtA дикого типа в GenBank и замена промоторной области гена rhtA в штамме-хозяине аллелями.
В одном из вариантов осуществления настоящего изобретения праймеры представляют собой:
П1: 5' CGGGATCCTCGCTGGTGTCGTGTTTGTAGG 3' (подчеркнутая часть обозначает сайт разрезания эндонуклеазой рестрикции BamH I) (SEQ ID NO: 17);
Π2: 5' ΤATACCСAATGCTGGTCGAG 3' (SEQ ID NO: 18);
ПЗ: 5' CGACCAGCATTGGGTATATC 3' (SEQ ID NO: 19); и
П4: 5' AAGGAAAAAAGCGGCCGCCGAAAATTAACGCTGCAATCAAC 3' (подчеркнутая часть обозначает сайт разрезания эндонуклеазой рестрикции Not I) (SEQ ID NO: 20).
В одном из вариантов осуществления настоящего изобретения этап (1) включает: применение праймеров П1/П2 и П3/П4 для ПЦР-амплификации путем применения Е. coli K12 в качестве матрицы для получения двух выделенных фрагментов ДНК, составляющих в длину 690 п. н. и 640 п. н. и содержащих промоторные области гена rhtA, в частности фрагменты PrthA(А(-67)G)-Up и PrthA(A(-67)G)-Down; и затем выполнение ПЦР с перекрывающимися прайм ерами путем применения П1 и П4 в качестве праймеров и двух фрагментов ДНК в качестве матрицы для получения фрагмента PrthA(А(-67)G)-Up-Down, где ПЦР с перекрывающимися праймерами выполняют следующим образом: денатурирование при 94°С в течение 30 с, отжиг при 52°С в течение 30 с и элонгация при 72°С в течение 60 с (всего 30 циклов).
Согласно настоящему изобретению этап (2) включает: отделение и очистку фрагмента PrthA(А(-67)G)- Up-Down с помощью электрофореза в агарозном геле, затем двойное расщепление очищенного фрагмента с помощью ΒamH I/INot I и лигирование дважды расщепленной плазмиды с помощью EcoR I/Sph I для получения аллель-замещенного рекомбинантного вектора.
В одном из вариантов осуществления настоящего изобретения трансформация на этапе (3) представляет собой процесс электротрансформации.
Согласно настоящему изобретению также предложен рекомбинантный штамм, полученный указанным выше способом конструирования.
Согласно настоящему изобретению предложено применение указанного выше рекомбинантного штамма для получения L-треонина.
Применение рекомбинантного штамма для получения L-треонина включает ферментацию рекомбинантного штамма для получения L-треонина.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Указанные выше и другие признаки и преимущества настоящего изобретения объяснены и проиллюстрированы более подробно в следующем описании примеров настоящего изобретения. Следует понимать, что следующие примеры предназначены для иллюстрации технических решений настоящего изобретения и никоим образом не предназначены для ограничения объема правовой охраны настоящего изобретения, определенного в формуле изобретения и ее эквивалентах.
Если не указано иное, материалы и реагенты согласно настоящему описанию либо коммерчески доступны, либо могут быть приготовлены специалистом в данной области техники в свете предшествующего уровня техники.
Пример 1
(1) Конструирование плазмиды pKOV- deoB(G1049A) с кодирующей областью гена deoB, содержащей сайт-направленную мутацию (G1049А) (эквивалентно тому, что цистеин замещен тирозином в 350-м положении (C350Y) в кодирующей белок аминокислотной последовательности SEQ ID NO: 3, замещенная аминокислотная последовательность представлена в SEQ ID NO: 4)
Пентозофосфат мутазу кодировали геном deoB, и в штамме Е. coli K12 и его производном штамме (например, MG1655), последовательность ORF гена deoB дикого типа представлена в последовательности 3902352-3903575 в GenBank под идентификационным номером СР032667.1. Две пары праймеров для амплификации deoB разработали и синтезировали в соответствии с последовательностью, и сконструировали вектор для осуществления замены основания G на основание А в 1049-м положении в кодирующей области гена deoB последовательности (в SEQ ID NO: 1) исходного штамма (для получения мутированной нуклеотидной последовательности SEQ ID NO: 2). Праймеры (синтезированные Шанхайской корпорацией Invitrogen) сконструировали следующим образом:
П1: 5' CGGGATCCATGGACGGCAACGCTGAAG 3' (подчеркнутая часть обозначает сайт разрезания эндонуклеазой рестрикции ВаmН I) (SEQ ID NO: 5);
П2: 5' GATCGTAACCGTGGTCAG 3' (SEQ ID NO: 6);
ПЗ: 5' CTGACCACGGTTACGАТС 3' (SEQ ID NO: 7); и
П4: 5' AAGGAAAAAAGCGGCCGCGCTCGTGAGTGCGGATGT 3' (подчеркнутая часть обозначает сайт разрезания эндонуклеазой рестрикции Not I) (SEQ ID NO: 8).
Способ конструирования был следующим: применение праймеров П1/П2 и ПЗ/П4 для ПЦР-амплификации путем применения гена Е. coli K12 дикого типа в качества матрицы для получения двух фрагментов ДНК, составляющих в длину 836 п. н. и 890 п.н. и содержащих точечную мутацию (фрагменты deoB(G1049)A)-Up и deoB(Gl049A)-Down). ПЦР система: 10-кратный буффер Ex Taq 5 мкл, dNTP (дезоксинуклеозидтрифосфаты) смесь (2.5 мМ каждого) 4 мкл, MgCh (25 мМ) 4 мкл, праймеры (10 пМ) 2 мкл каждого, образец 1 мкл, Ех Taq (5 Ед/мкл) 0.25 мкл, общий объем 50 мкл, где ПЦР-амплификацию проводили следующим образом: предварительная денатурация при 94°С в течение 5 минут, (денатурация при 94°С в течение 30 с, отжиг при 52°С в течение 30 с и элонгация при 72°С в течение 90 с, всего 30 циклов), и финальная элонгация при 72°С в течение 10 минут. Два фрагмента ДНК разделили и очистили электрофорезом в агарозном геле, а затем два очищенных фрагмента ДНК использовали в качестве образцов, и П1 и П4 применяли в качестве праймеров для выполнения ПЦР с перекрывающимися последовательностями для получения фрагмента (deoB(G1049A)-Up-Down), составляющего в длину около 1726 п. н. ПЦР с перекрывающимися последовательностями: 10-кратный буффер Ex Taq 5 мкл, dNTP смесь (2.5 мМ каждого) 4 мкл, MgCh (25 мМ) 4 мкл, праймеры (10 пм) 2 мкл каждого, образец 1 мкл, Ex Taq (5 Ед/мкл) 0.25 мкл, общий объем 50 мкл, где ПЦР-амплификацию проводили следующим образом: предварительная денатурация при 94°С в течение 5 минут, (денатурация при 94°С в течение 30 секунд, отжиг при 52°С в течение 30 секунд и элонгация при 72°С в течение 90 секунд, всего 30 циклов), и финальная элонгация при 72°С в течение 10 минут. Фрагмент deoB(G1049A)-Up-Down разделили и очистили электрофорезом в агарозном геле, затем очищенный фрагмент и плазмиду pKOV (приобретенную у Addgene) дважды обработали с помощью ΒamH I/Not I, и обработанные фрагмент deoB(G1049A)-Up-Down и плазмиду pKOV разделили и очистили электрофорезом в агарозном геле с последующим лигированием для получения вектора pKOY- deoB(G1049A). Вектор pKOV- deoB(G1049A отправили в компанию по секвенированию для секвенирования и идентификации, и результат представлен в SEQ ID NO: 11. Вектор pKOV- deoB(G1049A) с правильной точечной мутацией (deoB(G1049A)) сохранили для последующего применения.
(2) Конструирование модифицированного штамма с геном deoB(G1049A) содержащим точечную мутацию
Ген deoB дикого типа был сохранен в хромосомах Escherichia coli дикого типа штамма Е. coli K12 (W3110) и штамма Е. coli CGMCC 7.232, продуцирующего L-треонин с высоким выходом (хранится в Общем центре сбора микробиологических культур Китая (CGMCC)). Сконструированную плазмиду pKOV- deoB(G1049A) перенесли в Е. coli K12 (W3110) и Ε. coli CGMCC 7.232 соответственно, и путем замены аллеля основание G заменили на основание А в 1049-м участке последовательности гена deoB в хромосомах двух штаммов, как представлено в SEQ ID NO: 1.
Указанный способ заключался в следующем: трансформация плазмиды pKOV- deoB(G1049A) в компетентные клетки бактерии-хозяина путем процесса электротрансформации и добавление данных клеток в 0,5 мл жидкой питательной среды SOC; перемешивание смеси в шейкере при температуре 30°С и 100 об/мин в течение 2 ч.; покрытие твердой питательной среды LB с содержанием хлорамфеникола 34 мг/мл питательным раствором в количестве 100 мкл и культивирование при 30°С в течение 18 ч; отбор выращенных моноклональных колоний, инокуляция колоний в 10 мл жидкой питательной среды LB и культивирование при 37°С и 200 об/мин в течение 8 ч; покрытие твердой питательной среды LB с содержанием хлорамфеникола 34 мг/мл питательным раствором в количестве 100 мкл и культивирование при 42°С в течение 12 ч; отбор 1-5 одиночных колоний, инокуляция колоний в 1 мл жидкой среды LB и культивирование при 37°С и 200 об/мин в течение 4 ч; покрытие твердой питательной среды LB, содержащей 10% сахарозы, питательным раствором в количестве 100 мкл и культивирование при 30°С в течение 24 часов; отбор моноклональных колоний и нанесение колоний на твердую питательную среду LB с содержанием хлорамфеникола 34 мг/мл и твердую питательную среду LB в соотношении один к одному; и отбор штаммов, которые выросли на твердой питательной среде LB и не смогли вырасти на твердой питательной среде L B с содержанием хлорамфеникола 34 мг/мл, для идентификации методом ПЦР-амплификации. Праймеры (синтезированные Шанхайской корпорацией Invitrogen) для применения в ПЦР-амплификации были следующими:
П5: 5' TGACGCCАССАТСAAAGAGА 3' (SEQ ID NO: 9); и
П6: 5' GTCAACGCTCCGCCCAAAT 3' (SEQ ID NO: 10).
SSCP (одноцепочечный конформационный полиморфизм) анализ с помощью электрофореза проводили на ПЦР-амплифицированном продукте; амплифицированный фрагмент плазмиды pKOV- deoB(G1049A) использовали в качестве положительного контроля, амплифицированный фрагмент Escherichia coli дикого типа использовали в качестве отрицательного контроля, и воду использовали в качестве пустого контроля. В SSCP анализе методом электрофореза одноцепочечные олигонуклеотидные цепи, имеющие одинаковую длину, но различное расположение последовательностей, образовывали разные пространственные структуры в ледяной ванне, а также обладали разной подвижностью во время электрофореза. Следовательно, положение фрагмента при электрофорезе не соответствовало положению отрицательного контроля, и штамм, положение фрагмента которого при электрофорезе соответствовало положению положительного контроля, является штаммом с успешно замененным аллелем. ПЦР-амплификацию проводили на фрагменте-мишени, использовав штамм с успешно замененным аллелем в качестве образца и праймеры П5 и П6, и затем фрагмент-мишень лигировали с вектором pMD19-T для секвенирования. Путем сравнения последовательностей результатов секвенирования, результат секвенирования показан в SEQ ID NO: 12, рекон, образованный путем замены основания G на основание А в 1049-м положении последовательности кодирующей области гена deoB, позволяет судить об успешной модификации штамма. Рекон, полученный из Е. coli K12 (W3110), был назван YPThr09, а рекон, полученный из Е. coli CGMCC 7.232, был назван YPThr10.
(3) Эксперимент по ферментации треонина
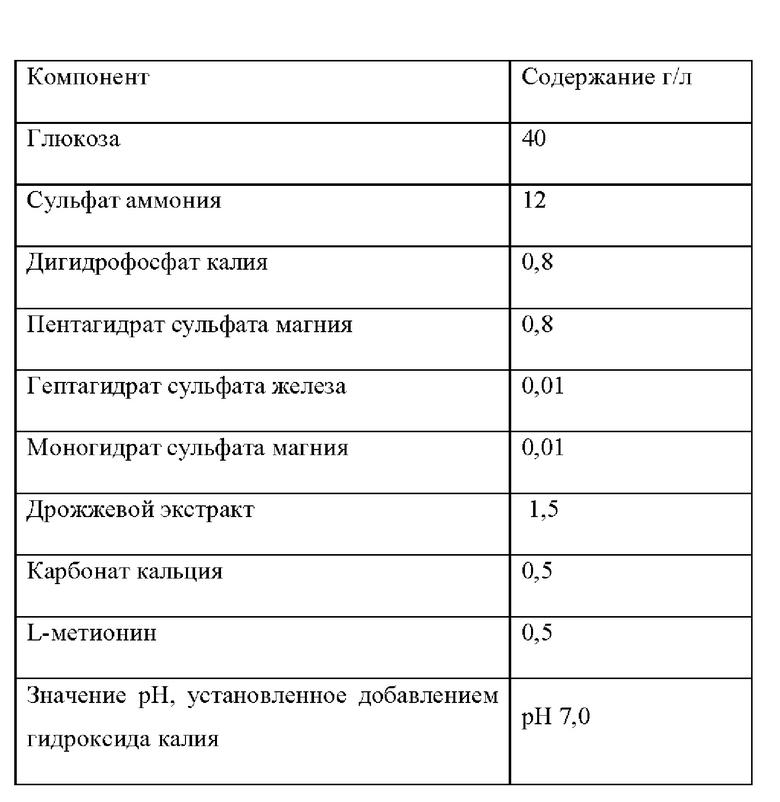
Штамм Е. coli K12 (W3110), штамм Е. coli CGMCC 7.232 и мутантные штаммы YPThr09 и YPThr10 инокулировали в 25 мл жидкой питательной среды, описанной в таблице 1 соответственно, и культивировали при 37°С и 200 об/мин в течение 12 ч. Затем 1 мл полученной культуры каждого штамма инокулировали в 25 мл жидкой питательной среды, описанной в таблице 1, и подвергали культуру ферментации при 37°С и 200 об/мин в течение 36 ч. Содержание L-треонина определяли методом ВЭЖХ, отбирали три копии каждого штамма, рассчитывали среднее значение, результаты приведены в таблице 2.
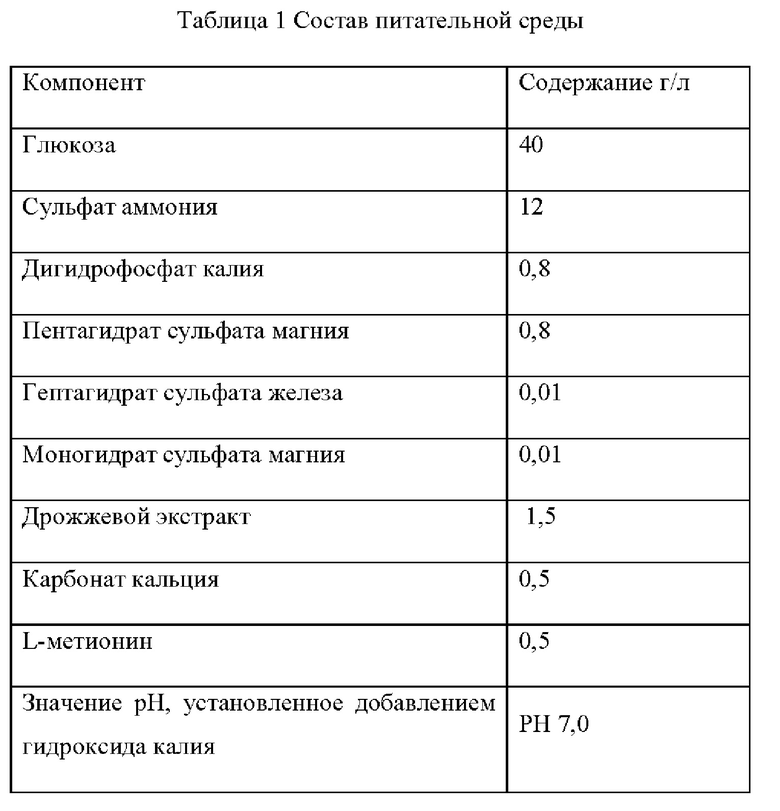
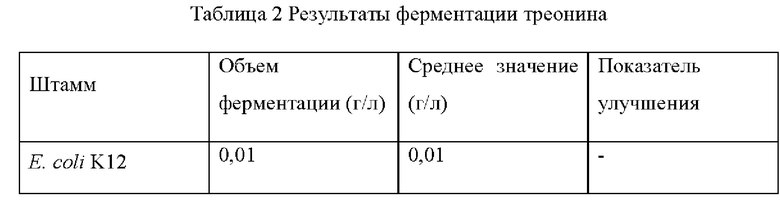
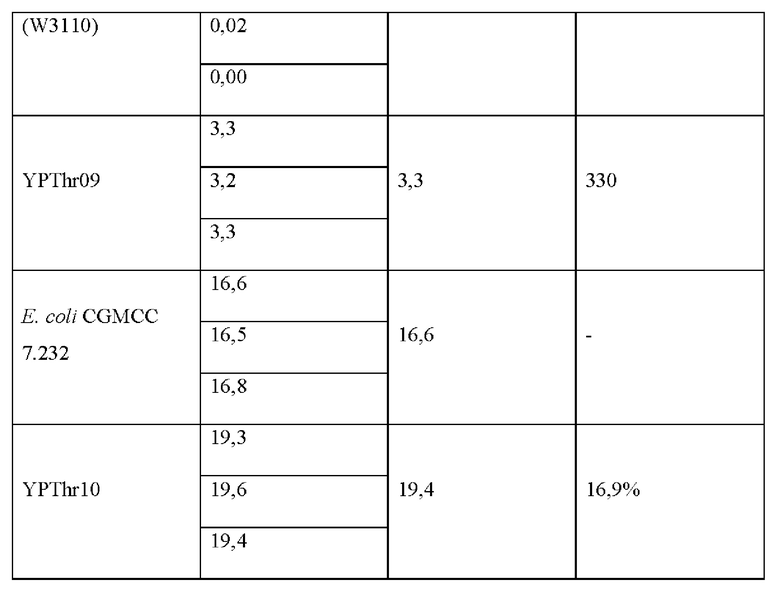
Как видно из результатов таблицы 2, замена цистеина в 350-м положении аминокислотной последовательности гена deoB на тирозин способствует улучшению выхода L-треонина для исходного штамма, продуцирующего L-треонин как с высоким, так и с низким выходом.
Пример 2
(1) Конструирование трансформационного вектора pKOY-PrhtA(A(-67)G) с промотором гена rhtA, содержащим сайт-направленную мутацию
Экспортеры гомосерина и треонина (ферменты RHTA) кодировали генами rhtA, и в штамме Е. coli K12 и его производном штамме (например, W3110) последовательность промотора гена rhtA дикого типа PrhtA представлена в последовательности 850520-850871 в GenBank под идентификационным номером АР009048.1. Согласно указанной последовательности разработали и синтезировали две пары праймеров для амплификации промотора FrhtA, и сконструировали вектор для осуществления замены основания А на основание G в -67-м положении выше по нуклеотидной последовательности (SEQ ID NO: 13) промотора PrhtA исходного штамма (для получения нуклеотидной последовательности SEQ ID NO: 14).
Праймеры (синтезированные Шанхайской корпорацией hwitrogen) разработали следующим образом:
П1: 5' CGGGATCCTCGCTGGTGTCGTGTTTGTAGG 3' (подчеркнутая часть обозначает сайт разрезания эндонуклеазой рестрикции ВаmН I) (SEQ ID NO: 17);
П2: 5' ΤATАСССAATGCTGGTCGAG 3' (SEQ ID NO: 18);
П.3: 5' CGACCAGCATTGGGTATATC 3' (SEQ ID NO: 19); и
П4: 5' AAGGAAAAAAGCGGCCGCCGAAAATTAACGCTGCAATCAAC 3' (подчеркнутая часть обозначает сайт разрезания эндонуклеазой рестрикции Not I) (SEQ ID NO: 20).
Способ конструирования был следующим: применение праймеров П1/П2 и П3/П4 для ПЦР-амплификации путем применения гена Е. coli K12 дикого типа в качества матрицы для получения двух фрагментов ДНК, составляющих в длину 690 п. н. и 640 п. н. и содержащих точечную мутацию (фрагменты PrhtA(A(-67)G-Up и PrhtA(A(-67)G)-Dowm). ПЦР система: 10-кратный буффер Ex Taq 5 мкл, dNTP смесь (2,5 мМ каждого) 4 мкл, Mg2+ (25 мМ) 4 мкл, праймеры (10 пМ) 2 мкл каждого, Ex Taq (5 Ед/мкл) 0,25 мкл, общий объем 50 мкл, где ПЦР-амплификацию проводили следующим образом: предварительная денатурация при 94°С в течение 5 минут (денатурация при 94°С в течение 30 с, отжиг при 52°С в течение 30 с и элонгация при 72°С в течение 30 с, всего 30 циклов) и финальная элонгация при 72°С в течение 10 мин.
Два фрагмента ДНК разделили и очистили электрофорезом в агарозном геле, а затем два очищенных фрагмента ДНК использовали в качестве образцов, и П1 и П4 использовали в качестве праймеров для выполнения ПЦР с перекрывающимися последовательностями для получения фрагмента (PrhtA(A(-67)G)-Up-Down), составляющего в длину около 1310 п. н.
ПЦР система: 10-кратный буффер Ex Taq 5 мкл, dNTP смесь (2,5 мМ каждого) 4 мкл, Mg2+(25 мМ) 4 мкл, праймеры (10 пМ) 2 мкл каждого, Ex Taq (5 Ед/мкл) 0.25 мкл, общий объем 50 мкл, где ПЦР с перекрывающимися последовательностями проводили следующим образом: денатурирование при 94°С в течение 30 с, отжиг при 52°С в течение 30 с и элонгация при 72°С в течение 60 с (всего 30 циклов).
Фрагмент PrhtA(A(-67)G)-Up-Down разделили и очистили электрофорезом в агарозном геле, затем очищенный фрагмент и плазмиду pKOV (приобретенную у Addgene) дважды обработали с помощью ВаmН I/Not I, и обработанные фрагмент deoB(G1049A)-Up-Down и плазмиду pKOV разделили и очистили электрофорезом в агарозном геле с последующим лигированием для получения вектора pKOV- PrhtA(A(-67)G). Вектор pKOV- PrhtA(A(-67)G) отправили в компанию по секвенированию для секвенирования и идентификации, и вектор pKOV- PrhtA(A(-67)G) с правильной точечной мутацией (PrhtA(A(-67)G)) сохранили для последующего применения.
(2) Конструирование модифицированного штамма с геном PrhtA(A(-67)G содержащим точечную мутацию
Ген PrhtA дикого типа был сохранен в хромосомах Escherichia coli дикого типа штамма Е. coli K12 (W3110) и штамма Е. coli CGMCC 7.232, продуцирующего L-треонин с высоким выходом (хранится в Общем центре сбора микробиологических культур Китая). Сконструированную плазмиду pKOY- PrhtA(A(-67)G) перенесли вЕ. coli K12 (W3110) и Ε. coli CGMCC 7.232 соответственно, и путем замены аллеля основание А заменили на основание G в -67-м участке выше по нуклеотидной последовательностям промоторов YrhtA в хромосомах двух штаммов.
Указанный способ заключался в следующем: трансформация плазмиды pKOY- PrhtA(A(-67)G) в компетентные клетки бактерии-хозяина путем процесса электротрансформации, и добавление данных клеток в 0,5 мл жидкой питательной среды SOC; перемешивание смеси в шейкере при температуре 30°С и 100 об/мин в течение 2 ч.; покрытие твердой питательной среды LB с содержанием хлорамфеникола 34 мг/мл питательным раствором в количестве 100 мкл и культивирование при 30°С в течение 18 ч; отбор выращенных моноклональных колоний, инокуляция колоний в 10 мл жидкой питательной среды LB и культивирование при 37°С и 200 об/мин в течение 8 ч; покрытие твердой питательной среды LB с содержанием хлорамфеникола 34 мг/мл питательным раствором в количестве 100 мкл и культивирование при 42°С в течение 12 ч; отбор 1-5 одиночных колоний, инокуляция колоний в 1 мл жидкой среды LB и культивирование при 37°С и 200 об/мин в течение 4 ч; покрытие твердой питательной среды LB, содержащей 10% сахарозы, питательным раствором в количестве 100 мкл и культивирование при 30°С в течение 24 часов; отбор моноклональных колоний и нанесение колоний на твердую питательную среду LB с содержанием хлорамфеникола 34 мг/мл и твердую культуральную среду LB в соотношении один к одному; и отбор штаммов, которые выросли на твердой питательной среде LB и не смогли вырасти на твердой питательной среде LB с содержанием хлорамфеникола 34 мг/мл, для идентификации методом ПЦР-амплификации. Праймеры (синтезированные Шанхайской корпорацией mvitrogen) для применения в ПЦР-амплификации были следующими:
П5: 5' ATACАССGCTАТССATCT 3' (SEQ ID NO: 21); и
П6: 5' AACCAGGCATCCTTTCTC 3' (SEQ ID NO: 22).
ПЦР система: 10-кратный буффер Ex Taq 5 мкл, dNTP смесь (2,5 мМ каждого) 4 мкл, Mg2+ (25 мМ) 4 мкл, праймеры (10 пМ) 2 мкл каждого, Ex Taq (5 Ед/мкл) 0,25 мкл, общий объем 50 мкл, где ПЦР-амплификацию проводили следующим образом: предварительная денатурация при 94°С в течение 5 минут (денатурация при 94°С в течение 30 с, отжиг при 52°С в течение 30 с и элонгация при 72°С в течение 30 с, всего 30 циклов) и финальная элонгация при 72°С в течение 10 мин. SSCP (одноцепочечный конформационный полиморфизм) анализ с помощью электрофореза проводили на ПЦР-амплифицированном продукте; амплифицированный фрагмент плазмиды pKOY-Prht(A(-67)G) использовали в качестве положительного контроля, амплифицированный фрагмент Escherichia coli дикого типа использовали в качестве отрицательного контроля, и воду использовали в качестве пустого контроля. В SSCP анализе методом электрофореза одноцепочечные олигонуклеотидные цепи, имеющие одинаковую длину, но различное расположение последовательностей, образовывали разные пространственные структуры в ледяной ванне, а также обладали разной подвижностью во время электрофореза. Следовательно, положение фрагмента при электрофорезе не соответствовало положению отрицательного контроля, и штамм, положение фрагмента которого при электрофорезе соответствовало положению положительного контроля, является штаммом с успешно замененным аллелем. ПЦР-амплификацию проводили на фрагменте-мишени, использовав штамм с успешно замененным аллелем в качестве образца и праймеры П5 и П6, и затем фрагмент-мишень лигировали с вектором pMD19-T для секвенирования. Путем сравнения последовательностей результатов секвенирования, рекон, образованный заменой основания А на основание G в -67-м положении выше по нуклеотидной последовательности промотора PrhtA, позволяет судить об успешной модификации штамма. Рекон, полученный из Е. coli K12 (W3110), был назван YPThr01, а рекон, полученный из Е. coli CGMCC 7.232, был назван YPThr02.
(3) Эксперимент по ферментации треонина
Штамм E. coli K12 (W3110), штамм Е. coli CGMCC 7.232 и мутантные штаммы YPThr01 и YPThr02 инокулировали в 25 мл жидкой питательной среды, описанной в таблице 1, и культивировали при 37°С и 200 об/мин в течение 12 ч. Затем 1 мл полученной культуры каждого штамма инокулировали в 25 мл жидкой питательной среды, описанной в таблице 1, и подвергали культуру ферментации при 37°С и 200 об/мин в течение 36 ч. Содержание L-треонина определяли методом ВЭЖХ, отбирали три копии каждого штамма, рассчитывали среднее значение, результаты приведены в таблице 2.
Таблица 1 Состав питательной среды
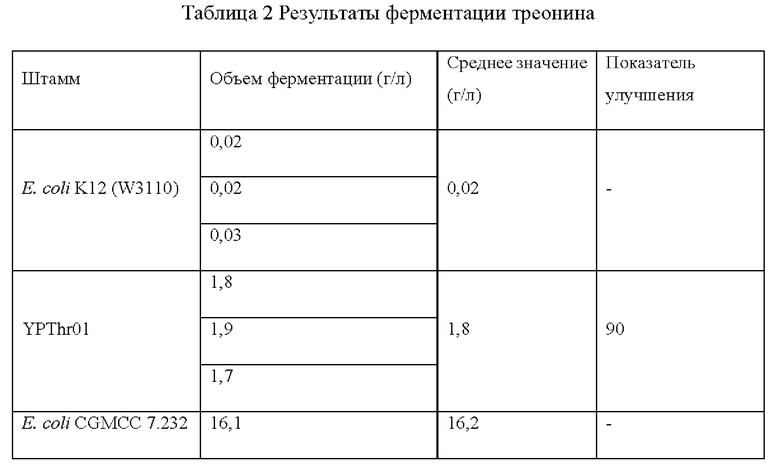
Как видно из результатов таблицы 2, замена основания А в -67-м положении промоторной последовательности гена rhtA на основание G способствует улучшению выхода L-треонина для исходного штамма, продуцирующего L-треонин как с высоким, так и с низким выходом.
Примеры настоящего изобретения были описаны выше. Однако настоящее изобретение не ограничивается приведенными выше примерами. Любые изменения, эквиваленты, улучшения и тому подобное, сделанные без отступления от сущности и принципа настоящего изобретения, подпадают под объем правовой охраны настоящего изобретения.
--->
Sequence listing
<110> Inner Mongolia Eppen Biotech Co., Ltd
<120> Рекомбинантный Штамм На Основе Escherichia Coli, Способ Его
Конструирования И Его Применение
<130> CPWO20110938
<160> 22
<170> SIPOSequenceListing 1.0
<210> 1
<211> 1224
<212> ДНК
<213> Escherichia coli
<400> 1
atgaaacgtg catttattat ggtgctggac tcattcggca tcggcgctac agaagatgca
60
gaacgctttg gtgacgtcgg ggctgacacc ctgggtcata tcgcagaagc ttgtgccaaa
120
ggcgaagctg ataacggtcg taaaggcccg ctcaatctgc caaatctgac ccgtctgggg
180
ctggcgaaag cacacgaagg ttctaccggt ttcattccgg cgggaatgga cggcaacgct
240
gaagttatcg gcgcgtacgc atgggcgcac gaaatgtcat ccggtaaaga taccccgtct
300
ggtcactggg aaattgccgg tgtcccggtt ctgtttgagt ggggatattt ctccgatcac
360
gaaaacagct tcccgcaaga gctgctggat aaactggtcg aacgcgctaa tctgccgggt
420
tacctcggta actgccactc ttccggtacg gtcattctgg atcaactggg cgaagagcac
480
atgaaaaccg gcaagccgat tttctatacc tccgctgact ccgtgttcca gattgcctgc
540
catgaagaaa ctttcggtct ggataaactc tacgaactgt gcgaaatcgc ccgtgaagag
600
ctgaccaacg gcggctacaa tatcggtcgt gttatcgctc gtccgtttat cggcgacaaa
660
gccggtaact tccagcgtac cggtaaccgt cacgacctgg ctgttgagcc gccagcaccg
720
accgtgctgc agaaactggt tgatgaaaaa cacggccagg tggtttctgt cggtaaaatt
780
gcggacatct acgccaactg cggtatcacc aaaaaagtga aagcgactgg cctggacgcg
840
ctgtttgacg ccaccatcaa agagatgaaa gaagcgggtg ataacaccat cgtcttcacc
900
aacttcgttg acttcgactc ttcctggggc caccgtcgcg acgtcgccgg ttatgccgcg
960
ggtctggaac tgttcgaccg ccgtctgccg gagctgatgt ctctgctgcg cgatgacgac
1020
atcctgatcc tcaccgctga ccacggttgc gatccgacct ggaccggtac tgaccacacg
1080
cgtgaacaca ttccggtact ggtatatggc ccgaaagtaa aaccgggctc actgggtcat
1140
cgtgaaacct tcgcggatat cggccagact ctggcaaaat attttggtac ttctgatatg
1200
gaatatggca aagccatgtt ctga
1224
<210> 2
<211> 1224
<212> ДНК
<213> Искусственная последовательность
<400> 2
atgaaacgtg catttattat ggtgctggac tcattcggca tcggcgctac agaagatgca
60
gaacgctttg gtgacgtcgg ggctgacacc ctgggtcata tcgcagaagc ttgtgccaaa
120
ggcgaagctg ataacggtcg taaaggcccg ctcaatctgc caaatctgac ccgtctgggg
180
ctggcgaaag cacacgaagg ttctaccggt ttcattccgg cgggaatgga cggcaacgct
240
gaagttatcg gcgcgtacgc atgggcgcac gaaatgtcat ccggtaaaga taccccgtct
300
ggtcactggg aaattgccgg tgtcccggtt ctgtttgagt ggggatattt ctccgatcac
360
gaaaacagct tcccgcaaga gctgctggat aaactggtcg aacgcgctaa tctgccgggt
420
tacctcggta actgccactc ttccggtacg gtcattctgg atcaactggg cgaagagcac
480
atgaaaaccg gcaagccgat tttctatacc tccgctgact ccgtgttcca gattgcctgc
540
catgaagaaa ctttcggtct ggataaactc tacgaactgt gcgaaatcgc ccgtgaagag
600
ctgaccaacg gcggctacaa tatcggtcgt gttatcgctc gtccgtttat cggcgacaaa
660
gccggtaact tccagcgtac cggtaaccgt cacgacctgg ctgttgagcc gccagcaccg
720
accgtgctgc agaaactggt tgatgaaaaa cacggccagg tggtttctgt cggtaaaatt
780
gcggacatct acgccaactg cggtatcacc aaaaaagtga aagcgactgg cctggacgcg
840
ctgtttgacg ccaccatcaa agagatgaaa gaagcgggtg ataacaccat cgtcttcacc
900
aacttcgttg acttcgactc ttcctggggc caccgtcgcg acgtcgccgg ttatgccgcg
960
ggtctggaac tgttcgaccg ccgtctgccg gagctgatgt ctctgctgcg cgatgacgac
1020
atcctgatcc tcaccgctga ccacggttac gatccgacct ggaccggtac tgaccacacg
1080
cgtgaacaca ttccggtact ggtatatggc ccgaaagtaa aaccgggctc actgggtcat
1140
cgtgaaacct tcgcggatat cggccagact ctggcaaaat attttggtac ttctgatatg
1200
gaatatggca aagccatgtt ctga
1224
<210> 3
<211> 407
<212> БЕЛОК
<213> Escherichia coli
<400> 3
Met Lys Arg Ala Phe Ile Met Val Leu Asp Ser Phe Gly Ile Gly Ala
1 5 10 15
Thr Glu Asp Ala Glu Arg Phe Gly Asp Val Gly Ala Asp Thr Leu Gly
20 25 30
His Ile Ala Glu Ala Cys Ala Lys Gly Glu Ala Asp Asn Gly Arg Lys
35 40 45
Gly Pro Leu Asn Leu Pro Asn Leu Thr Arg Leu Gly Leu Ala Lys Ala
50 55 60
His Glu Gly Ser Thr Gly Phe Ile Pro Ala Gly Met Asp Gly Asn Ala
65 70 75 80
Glu Val Ile Gly Ala Tyr Ala Trp Ala His Glu Met Ser Ser Gly Lys
85 90 95
Asp Thr Pro Ser Gly His Trp Glu Ile Ala Gly Val Pro Val Leu Phe
100 105 110
Glu Trp Gly Tyr Phe Ser Asp His Glu Asn Ser Phe Pro Gln Glu Leu
115 120 125
Leu Asp Lys Leu Val Glu Arg Ala Asn Leu Pro Gly Tyr Leu Gly Asn
130 135 140
Cys His Ser Ser Gly Thr Val Ile Leu Asp Gln Leu Gly Glu Glu His
145 150 155 160
Met Lys Thr Gly Lys Pro Ile Phe Tyr Thr Ser Ala Asp Ser Val Phe
165 170 175
Gln Ile Ala Cys His Glu Glu Thr Phe Gly Leu Asp Lys Leu Tyr Glu
180 185 190
Leu Cys Glu Ile Ala Arg Glu Glu Leu Thr Asn Gly Gly Tyr Asn Ile
195 200 205
Gly Arg Val Ile Ala Arg Pro Phe Ile Gly Asp Lys Ala Gly Asn Phe
210 215 220
Gln Arg Thr Gly Asn Arg His Asp Leu Ala Val Glu Pro Pro Ala Pro
225 230 235 240
Thr Val Leu Gln Lys Leu Val Asp Glu Lys His Gly Gln Val Val Ser
245 250 255
Val Gly Lys Ile Ala Asp Ile Tyr Ala Asn Cys Gly Ile Thr Lys Lys
260 265 270
Val Lys Ala Thr Gly Leu Asp Ala Leu Phe Asp Ala Thr Ile Lys Glu
275 280 285
Met Lys Glu Ala Gly Asp Asn Thr Ile Val Phe Thr Asn Phe Val Asp
290 295 300
Phe Asp Ser Ser Trp Gly His Arg Arg Asp Val Ala Gly Tyr Ala Ala
305 310 315 320
Gly Leu Glu Leu Phe Asp Arg Arg Leu Pro Glu Leu Met Ser Leu Leu
325 330 335
Arg Asp Asp Asp Ile Leu Ile Leu Thr Ala Asp His Gly Cys Asp Pro
340 345 350
Thr Trp Thr Gly Thr Asp His Thr Arg Glu His Ile Pro Val Leu Val
355 360 365
Tyr Gly Pro Lys Val Lys Pro Gly Ser Leu Gly His Arg Glu Thr Phe
370 375 380
Ala Asp Ile Gly Gln Thr Leu Ala Lys Tyr Phe Gly Thr Ser Asp Met
385 390 395 400
Glu Tyr Gly Lys Ala Met Phe
405
<210> 4
<211> 407
<212> БЕЛОК
<213> Искусственная последовательность
<400> 4
Met Lys Arg Ala Phe Ile Met Val Leu Asp Ser Phe Gly Ile Gly Ala
1 5 10 15
Thr Glu Asp Ala Glu Arg Phe Gly Asp Val Gly Ala Asp Thr Leu Gly
20 25 30
His Ile Ala Glu Ala Cys Ala Lys Gly Glu Ala Asp Asn Gly Arg Lys
35 40 45
Gly Pro Leu Asn Leu Pro Asn Leu Thr Arg Leu Gly Leu Ala Lys Ala
50 55 60
His Glu Gly Ser Thr Gly Phe Ile Pro Ala Gly Met Asp Gly Asn Ala
65 70 75 80
Glu Val Ile Gly Ala Tyr Ala Trp Ala His Glu Met Ser Ser Gly Lys
85 90 95
Asp Thr Pro Ser Gly His Trp Glu Ile Ala Gly Val Pro Val Leu Phe
100 105 110
Glu Trp Gly Tyr Phe Ser Asp His Glu Asn Ser Phe Pro Gln Glu Leu
115 120 125
Leu Asp Lys Leu Val Glu Arg Ala Asn Leu Pro Gly Tyr Leu Gly Asn
130 135 140
Cys His Ser Ser Gly Thr Val Ile Leu Asp Gln Leu Gly Glu Glu His
145 150 155 160
Met Lys Thr Gly Lys Pro Ile Phe Tyr Thr Ser Ala Asp Ser Val Phe
165 170 175
Gln Ile Ala Cys His Glu Glu Thr Phe Gly Leu Asp Lys Leu Tyr Glu
180 185 190
Leu Cys Glu Ile Ala Arg Glu Glu Leu Thr Asn Gly Gly Tyr Asn Ile
195 200 205
Gly Arg Val Ile Ala Arg Pro Phe Ile Gly Asp Lys Ala Gly Asn Phe
210 215 220
Gln Arg Thr Gly Asn Arg His Asp Leu Ala Val Glu Pro Pro Ala Pro
225 230 235 240
Thr Val Leu Gln Lys Leu Val Asp Glu Lys His Gly Gln Val Val Ser
245 250 255
Val Gly Lys Ile Ala Asp Ile Tyr Ala Asn Cys Gly Ile Thr Lys Lys
260 265 270
Val Lys Ala Thr Gly Leu Asp Ala Leu Phe Asp Ala Thr Ile Lys Glu
275 280 285
Met Lys Glu Ala Gly Asp Asn Thr Ile Val Phe Thr Asn Phe Val Asp
290 295 300
Phe Asp Ser Ser Trp Gly His Arg Arg Asp Val Ala Gly Tyr Ala Ala
305 310 315 320
Gly Leu Glu Leu Phe Asp Arg Arg Leu Pro Glu Leu Met Ser Leu Leu
325 330 335
Arg Asp Asp Asp Ile Leu Ile Leu Thr Ala Asp His Gly Tyr Asp Pro
340 345 350
Thr Trp Thr Gly Thr Asp His Thr Arg Glu His Ile Pro Val Leu Val
355 360 365
Tyr Gly Pro Lys Val Lys Pro Gly Ser Leu Gly His Arg Glu Thr Phe
370 375 380
Ala Asp Ile Gly Gln Thr Leu Ala Lys Tyr Phe Gly Thr Ser Asp Met
385 390 395 400
Glu Tyr Gly Lys Ala Met Phe
405
<210> 5
<211> 27
<212> ДНК
<213> Искусственная последовательность
<400> 5
cgggatccat ggacggcaac gctgaag
27
<210> 6
<211> 18
<212> ДНК
<213> Искусственная последовательность
<400> 6
gatcgtaacc gtggtcag
18
<210> 7
<211> 18
<212> ДНК
<213> Искусственная последовательность
<400> 7
ctgaccacgg ttacgatc
18
<210> 8
<211> 36
<212> ДНК
<213> Искусственная последовательность
<400> 8
aaggaaaaaa gcggccgcgc tcgtgagtgc ggatgt
36
<210> 9
<211> 20
<212> ДНК
<213> Искусственная последовательность
<400> 9
tgacgccacc atcaaagaga
20
<210> 10
<211> 19
<212> ДНК
<213> Искусственная последовательность
<400> 10
gtcaacgctc cgcccaaat
19
<210> 11
<211> 1684
<212> ДНК
<213> Искусственная последовательность
<400> 11
gacggcaacg ctgaagttat cggcgcgtac gcatgggcgc acgaaatgtc atccggtaaa
60
gataccccgt ctggtcactg ggaaattgcc ggtgtcccgg ttctgtttga gtggggatat
120
ttctccgatc acgaaaacag cttcccgcaa gagctgctgg ataaactggt cgaacgcgct
180
aatctgccgg gttacctcgg taactgccac tcttccggta cggtcattct ggatcaactg
240
ggcgaagagc acatgaaaac cggcaagccg attttctata cctccgctga ctccgtgttc
300
cagattgcct gccatgaaga aactttcggt ctggataaac tctacgaact gtgcgaaatc
360
gcccgtgaag agctgaccaa cggcggctac aatatcggtc gtgttatcgc tcgtccgttt
420
atcggcgaca aagccggtaa cttccagcgt accggtaacc gtcacgacct ggctgttgag
480
ccgccagcac cgaccgtgct gcagaaactg gttgatgaaa aacacggcca ggtggtttct
540
gtcggtaaaa ttgcggacat ctacgccaac tgcggtatca ccaaaaaagt gaaagcgact
600
ggcctggacg cgctgtttga cgccaccatc aaagagatga aagaagcggg tgataacacc
660
atcgtcttca ccaacttcgt tgacttcgac tcttcctggg gccaccgtcg cgacgtcgcc
720
ggttatgccg cgggtctgga actgttcgac cgccgtctgc cggagctgat gtctctgctg
780
cgcgatgacg acatcctgat cctcaccgct gaccacggtt acgatccgac ctggaccggt
840
actgaccaca cgcgtgaaca cattccggta ctggtatatg gcccgaaagt aaaaccgggc
900
tcactgggtc atcgtgaaac cttcgcggat atcggccaga ctctggcaaa atattttggt
960
acttctgata tggaatatgg caaagccatg ttctgatgga tttgggcgga gcgttgactc
1020
cgcctttgtt atgtcacaaa aaggataaaa caatggctac cccacacatt aatgcagaaa
1080
tgggcgattt cgctgacgta gttttgatgc caggcgaccc gctgcgtgcg aagtatattg
1140
ctgaaacttt ccttgaagat gcccgtgaag tgaacaacgt tcgcggtatg ctgggcttca
1200
ccggtactta caaaggccgc aaaatttccg taatgggtca cggtatgggt atcccgtcct
1260
gctccatcta caccaaagaa ctgatcaccg atttcggcgt gaagaaaatt atccgcgtgg
1320
gttcctgtgg cgcagttctg ccgcacgtaa aactgcgcga cgtcgttatc ggtatgggtg
1380
cctgcaccga ttccaaagtt aaccgcatcc gttttaaaga ccatgacttt gccgctatcg
1440
ctgacttcga catggtgcgt aacgcagtag atgcagctaa agcactgggt attgatgctc
1500
gcgtgggtaa cctgttctcc gctgacctgt tctactctcc ggacggcgaa atgttcgacg
1560
tgatggaaaa atacggcatt ctcggcgtgg aaatggaagc ggctggtatc tacggcgtcg
1620
ctgcagaatt tggcgcgaaa gccctgacca tctgcaccgt atctgaccac atccgcactc
1680
acga
1684
<210> 12
<211> 401
<212> ДНК
<213> Искусственная последовательность
<400> 12
tgacgccacc atcaaagaga tgaaagaagc gggtgataac accatcgtct tcaccaactt
60
cgttgacttc gactcttcct ggggccaccg tcgcgacgtc gccggttatg ccgcgggtct
120
ggaactgttc gaccgccgtc tgccggagct gatgtctctg ctgcgcgatg acgacatcct
180
gatcctcacc gctgaccacg gttacgatcc gacctggacc ggtactgacc acacgcgtga
240
acacattccg gtactggtat atggcccgaa agtaaaaccg ggctcactgg gtcatcgtga
300
aaccttcgcg gatatcggcc agactctggc aaaatatttt ggtacttctg atatggaata
360
tggcaaagcc atgttctgat ggatttgggc ggagcgttga c
401
<210> 13
<211> 355
<212> ДНК
<213> Искусственная последовательность
<400> 13
cataaccacc tcaaatgtga ttcaaataag tcctaagttt taaatatatc aaaaattaat
60
gggaaactct tcgcgatttg tgatgtctaa cgggccattt catgtaacag aacgtttcca
120
tacaccgcta tccatctaaa tttaaatcac tttttcagag aactgcgtaa gtattacgca
180
tgttttccct gtcattcatc cagattattc ctaatcacca gactaatgat tccatcaatc
240
ctggcgcatt ttagtcaaaa cgggggaaaa ttttttcaac aaatgctcaa ccagcattgg
300
gtatatccag tacactccac gctttactta agtctagata tttgtgggag aaagg
355
<210> 14
<211> 355
<212> ДНК
<213> Искусственная последовательность
<400> 14
cataaccacc tcaaatgtga ttcaaataag tcctaagttt taaatatatc aaaaattaat
60
gggaaactct tcgcgatttg tgatgtctaa cgggccattt catgtaacag aacgtttcca
120
tacaccgcta tccatctaaa tttaaatcac tttttcagag aactgcgtaa gtattacgca
180
tgttttccct gtcattcatc cagattattc ctaatcacca gactaatgat tccatcaatc
240
ctggcgcatt ttagtcaaaa cgggggaaaa ttttttcaac aaatgctcga ccagcattgg
300
gtatatccag tacactccac gctttactta agtctagata tttgtgggag aaagg
355
<210> 15
<211> 888
<212> ДНК
<213> Искусственная последовательность
<400> 15
atgcctggtt cattacgtaa aatgccggtc tggttaccaa tagtcatatt gctcgttgcc
60
atggcgtcta ttcagggtgg agcctcgtta gctaagtcac tttttcctct ggtgggcgca
120
ccgggtgtca ctgcgctgcg tctggcatta ggaacgctga tcctcatcgc gttctttaag
180
ccatggcgac tgcgctttgc caaagagcaa cggttaccgc tgttgtttta cggcgtttcg
240
ctgggtggga tgaattatct tttttatctt tctattcaga cagtaccgct gggtattgcg
300
gtggcgctgg agttcaccgg accactggcg gtggcgctgt tctcttctcg tcgcccggta
360
gatttcgtct gggttgtgct ggcggttctt ggtctgtggt tcctgctacc gctggggcaa
420
gacgtttccc atgtcgattt aaccggctgt gcgctggcac tgggggccgg ggcttgttgg
480
gctatttaca ttttaagtgg gcaacgcgca ggagcggaac atggccctgc gacggtggca
540
attggttcgt tgattgcagc gttaattttc gtgccaattg gagcgcttca ggctggtgaa
600
gcactctggc actggtcggt tattccattg ggtctggctg tcgctattct ctcgaccgct
660
ctgccttatt cgctggaaat gattgccctc acccgtttgc caacacggac atttggtacg
720
ctgatgagca tggaaccggc gctggctgcc gtttccggga tgattttcct cggagaaaca
780
ctgacaccca tacagctact ggcgctcggc gctatcatcg ccgcttcaat ggggtctacg
840
ctgacagtac gcaaagagag caaaataaaa gaattagaca ttaattaa
888
<210> 16
<211> 295
<212> БЕЛОК
<213> Escherichia coli
<400> 16
Met Pro Gly Ser Leu Arg Lys Met Pro Val Trp Leu Pro Ile Val Ile
1 5 10 15
Leu Leu Val Ala Met Ala Ser Ile Gln Gly Gly Ala Ser Leu Ala Lys
20 25 30
Ser Leu Phe Pro Leu Val Gly Ala Pro Gly Val Thr Ala Leu Arg Leu
35 40 45
Ala Leu Gly Thr Leu Ile Leu Ile Ala Phe Phe Lys Pro Trp Arg Leu
50 55 60
Arg Phe Ala Lys Glu Gln Arg Leu Pro Leu Leu Phe Tyr Gly Val Ser
65 70 75 80
Leu Gly Gly Met Asn Tyr Leu Phe Tyr Leu Ser Ile Gln Thr Val Pro
85 90 95
Leu Gly Ile Ala Val Ala Leu Glu Phe Thr Gly Pro Leu Ala Val Ala
100 105 110
Leu Phe Ser Ser Arg Arg Pro Val Asp Phe Val Trp Val Val Leu Ala
115 120 125
Val Leu Gly Leu Trp Phe Leu Leu Pro Leu Gly Gln Asp Val Ser His
130 135 140
Val Asp Leu Thr Gly Cys Ala Leu Ala Leu Gly Ala Gly Ala Cys Trp
145 150 155 160
Ala Ile Tyr Ile Leu Ser Gly Gln Arg Ala Gly Ala Glu His Gly Pro
165 170 175
Ala Thr Val Ala Ile Gly Ser Leu Ile Ala Ala Leu Ile Phe Val Pro
180 185 190
Ile Gly Ala Leu Gln Ala Gly Glu Ala Leu Trp His Trp Ser Val Ile
195 200 205
Pro Leu Gly Leu Ala Val Ala Ile Leu Ser Thr Ala Leu Pro Tyr Ser
210 215 220
Leu Glu Met Ile Ala Leu Thr Arg Leu Pro Thr Arg Thr Phe Gly Thr
225 230 235 240
Leu Met Ser Met Glu Pro Ala Leu Ala Ala Val Ser Gly Met Ile Phe
245 250 255
Leu Gly Glu Thr Leu Thr Pro Ile Gln Leu Leu Ala Leu Gly Ala Ile
260 265 270
Ile Ala Ala Ser Met Gly Ser Thr Leu Thr Val Arg Lys Glu Ser Lys
275 280 285
Ile Lys Glu Leu Asp Ile Asn
290 295
<210> 17
<211> 30
<212> ДНК
<213> Искусственная последовательность
<400> 17
cgggatcctc gctggtgtcg tgtttgtagg
30
<210> 18
<211> 20
<212> ДНК
<213> Искусственная последовательность
<400> 18
tatacccaat gctggtcgag
20
<210> 19
<211> 20
<212> ДНК
<213> Искусственная последовательность
<400> 19
cgaccagcat tgggtatatc
20
<210> 20
<211> 41
<212> ДНК
<213> Искусственная последовательность
<400> 20
aaggaaaaaa gcggccgccg aaaattaacg ctgcaatcaa c
41
<210> 21
<211> 18
<212> ДНК
<213> Искусственная последовательность
<400> 21
atacaccgct atccatct
18
<210> 22
<211> 18
<212> ДНК
<213> Искусственная последовательность
<400> 22
aaccaggcat cctttctc
18
<---
Изобретение относится к биотехнологии. Предложен нуклеотид для ферментативного получения L-треонина, содержащий промоторную нуклеотидную последовательность, образованную посредством мутации, заключающейся в замене аденина (A) на гуанин (G) в 289-м основании нуклеотидной последовательности, представленной в SEQ ID NO: 13. Также предложены экспрессионная кассета, содержащая указанный нуклеотид, вектор, содержащий указанный нуклеотид, рекомбинантная бактерия, содержащая указанный нуклеотид, их применение для ферментативного получения L-треонина, а также способ конструирования указанной рекомбинантной бактерии. Изобретение обеспечивает продукцию L-треонина в высокой концентрации. 6 н. и 4 з.п. ф-лы, 2 табл., 2 пр.
1. Нуклеотид для ферментативного получения L-треонина, содержащий промоторную нуклеотидную последовательность, образованную посредством мутации, заключающейся в замене аденина (A) на гуанин (G) в 289-м основании нуклеотидной последовательности, представленной в SEQ ID NO: 13.
2. Нуклеотид по п. 1, отличающийся тем, что мутированная нуклеотидная последовательность представлена в SEQ ID NO: 14.
3. Экспрессионная кассета, содержащая нуклеотид по п. 1 и кодирующую нуклеотидную последовательность гена rhtA, где кодирующая нуклеотидная последовательность гена rhtA содержит нуклеотидную последовательность, представленную в SEQ ID NO: 15.
4. Рекомбинантный вектор для ферментативного получения L-треонина, содержащий нуклеотид по п. 1.
5. Рекомбинантный вектор по п. 4, отличающийся тем, что рекомбинантный вектор сконструирован путем введения нуклеотидной последовательности в плазмиду.
6. Рекомбинантная бактерия для ферментативного получения L-треонина, содержащая нуклеотид по п. 1.
7. Рекомбинантная бактерия по п. 6, отличающаяся тем, что указанная рекомбинантная бактерия образована путем введения рекомбинантного вектора по п. 4 в штамм-хозяин; где штамм-хозяин выбран из E. coli K12, его производного штамма E. coli K12 (W3110) или штамма E. coli CGMCC 7.232.
8. Способ конструирования рекомбинантной бактерии по п. 6, включающий следующие этапы:
(1) модификация нуклеотидной последовательности гена дикого типа, представленного в SEQ ID NO: 13, для получения мутированной нуклеотидной последовательности, представленной в SEQ ID NO: 14;
(2) лигирование мутированной нуклеотидной последовательности с плазмидой для конструирования рекомбинантного вектора; и
(3) введение рекомбинантного вектора в штамм-хозяин для получения рекомбинантной бактерии.
9. Способ конструирования по п. 8, отличающийся тем, что плазмида представляет собой плазмиду pKOV.
10. Применение нуклеотида по п. 1, экспрессионной кассеты по п. 3, рекомбинантного вектора по п. 4 или рекомбинантной бактерии по п. 6 в ферментативном получении L-треонина.
| ZHAO H | |||
| ET AL | |||
| Increasing L-threonine production in Escherichia coli by engineering the glyoxylate shunt and the L-threonine biosynthesis pathway | |||
| Appl Microbiol Biotechnol | |||
| Способ получения цианистых соединений | 1924 |
|
SU2018A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Пишущая машина для тюркско-арабского шрифта | 1922 |
|
SU24A1 |
| US | |||
Авторы
Даты
2024-02-12—Публикация
2020-08-27—Подача