ОБЛАСТЬ ТЕХНИКИ
Данная заявка относится к варианту белка, экспортирующего О-фосфосерин (ОФС), и способу получения O-фосфосерина, цистеина и производных цистеина с его использованием.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
L-цистеин, аминокислота, играющая важную роль в метаболизме серы у всех живых организмов, используется не только в синтезе таких биологических белков, как кератин волос, глутатион, биотин, метионин и другие серосодержащие метаболиты, но также является предшественником биосинтеза кофермента А.
Способы получения L-цистеина с использованием микроорганизмов, известные в области техники, включают: 1) способ биологического превращения D,L-2-аминотиазолин-4-карбоновой кислоты (D,L-ATC) в L-цистеин с использованием микроорганизмов, 2) способ получения L-цистеина путем непосредственной ферментации с использованием Е.coli (US 5972663 A; Wada М and Takagi Н, Appl. Microbiol. Biochem., 73:48-54, 2006) и 3) способ получения О-фосфосерина (далее «ОФС») посредством ферментации с использованием микроорганизмов, а затем превращение О-фосфосерина в L-цистеин посредством реакции О-фосфосерина с серой при каталитическом действии O-фосфосеринсульфгидрилазы (далее «ОФСС») (US 8557549 В2).
В частности, для получения цистеина способом 3) с высоким выходом предшественник, ОФС, необходимо получить в избыточном количестве.
Техническая задача
Авторы настоящего изобретения завершили настоящее изобретение, идентифицировав вариант с повышенной активностью фактора экспорта, способного обеспечивать бесперебойный экспорт ОФС, полученного в штамме, продуцирующем ОФС, из клетки и подтвердив, что экспорт ОФС улучшается благодаря указанному варианту.
Техническое решение
Одной из задач настоящего изобретения является предоставление полипептида, обладающего О-фосфосерин (ОФС)-экспортирующей активностью.
Другой задачей настоящего изобретения является предоставление полинуклеотида, кодирующего указанный полипептид по настоящему изобретению.
Еще одной задачей настоящего изобретения является предоставление вектора, содержащего указанный полинуклеотид по настоящему изобретению.
Следующей задачей настоящего изобретения является предоставление О-фосфосерин-продуцирующего микроорганизма, содержащего любое одно или более из полипептида по настоящему изобретению, полинуклеотида по настоящему изобретению и вектора по настоящему изобретению.
Еще одной задачей настоящего изобретения является предоставление способа получения О-фосфосерина, включающего культивирование в среде указанного О-фосфосерин-продуцирующего микроорганизма по настоящему изобретению.
Еще одной задачей настоящего изобретения является предоставление способа получения цистеина или его производного, который включает:
a) получение О-фосфосерина (ОФС) или содержащей его среды посредством культивирования в среде О-фосфосерин-продуцирующего микроорганизма, который содержит любое одно или более из полипептида по настоящему изобретению, полинуклеотида, кодирующий полипептид по настоящему изобретению, и вектора, содержащего полинуклеотид по настоящему изобретению; и
b) реакцию О-фосфосерина или содержащей его среды, полученных на стадии а), с сульфидом в присутствии О-фосфосеринсульфгидрилазы (ОФСС) или экспрессирующего ее микроорганизма.
Полезные эффекты
Когда микроорганизм, обладающий способностью продуцировать О-фосфосерин, культивируют с использованием полипептида, обладающего О-фосфосерин-экспортирующей активностью, по настоящему изобретению, это может обеспечить получение ОФС с высоким выходом по сравнению с использованием существующего немодифицированного белка или варианта.
Предпочтительные воплощения изобретения
Далее настоящее изобретение будет описано более подробно. При этом, каждое описание и воплощение, раскрытое в настоящем изобретении, также может быть применено к другим описаниям и воплощениям, соответственно. Таким образом, все комбинации различных элементов, описанных в настоящем изобретении, входят в объем настоящего изобретения. Более того, объем настоящего изобретения не ограничивается конкретным описанием, приведенным ниже.
В одном аспекте настоящего изобретения для решения указанных выше задач в настоящем изобретении предложен полипептид, обладающий О-фосфосерин (ОФС)-экспортирующей активностью, включающий а) замену изолейцина (I) в положении, соответствующем 241 в аминокислотной последовательности SEQ ID NO: 11, на треонин (Т), замену аспарагиновой кислоты (D) в положении, соответствующем 246 в аминокислотной последовательности SEQ ID NO: 11, на валин (V), и замену валина (V) в положении, соответствующем 330 в аминокислотной последовательности SEQ ID NO: 11, на изолейцин (I), и имеющему аминокислотную последовательность, где b) аминокислота в положении, соответствующем 88, представляет собой фенилаланин и с) аминокислота в положении, соответствующем 207, представляет собой лизин (K).
В настоящем документе термин «О-фосфосерин» (далее «ОФС») относится к сложному эфиру фосфорной кислоты и серина, являющегося составным компонентом многих белков. В частности, ОФС является предшественником L-цистеина и может быть конвертирован в цистеин посредством реакции с сульфидом при каталитическом действии ОФС сульфгидрилазы (далее «ОФСС»), но не ограничиваясь указанным (US 8557549 В2).
В настоящем документе термин «полипептид, обладающий ОФС-экспортирующей активностью», относится к мембранному белку, обладающему активностью экспорта ОФС за пределы клетки, и указанный мембранный белок может происходить из Е. coli. В настоящем изобретении полипептид, обладающий ОФС-экспортирующей активностью, может быть транспортером YhhS суперсемейства MFS (major facilitator superfamily) или его вариантом. В частности, полипептид по настоящему изобретению может представлять собой вариант транспортера YhhS MFS, демонстрирующий улучшенную активность по сравнению с таковой у транспортера YhhS MFS дикого типа, идентифицированного в качестве белка, обладающего ОФС-экспортирующей активностью у Е. coli, свободных от подавления роста при условии существования избытка ОФС.
В настоящем документе термин «вариант» относится к белку, в котором по меньшей мере одна аминокислотная последовательность отличается от указанной последовательности вследствие консервативной замены и/или модификации, при этом функции и свойства этого белка сохраняются. Варианты отличаются от установленной последовательности заменой, делецией или добавлением нескольких аминокислот. Такие варианты как правило можно идентифицировать посредством модификации одной из вышеупомянутых аминокислотных последовательностей белка и оценки свойств модифицированного белка. Таким образом, активность вариантов может быть усилена, оставлена без изменений или ослаблена по сравнению с нативным белком. Кроме того, некоторые варианты могут включать варианты, у которых были удалены одна или более чем одна часть, такая как N-концевая лидерная последовательность или транс мембранный домен. Другие варианты могут включать варианты, у которых была удалена часть с N- и/или С-конца зрелого белка. Термин «вариант» может использоваться взаимозаменяемо с такими терминами, как модифицированный, модификация, модифицированный белок, модифицированный полипептид, мутант, мутеин, дивергент, вариант и т.д., без ограничения, при условии, что эти термины используются для обозначения вариации. В настоящем документе вариант может относиться к вариантам, обладающим повышенной активностью модифицированного белка по сравнению с таковой у белка дикого типа или немодифицированного белка, однако не ограничивается ими.
В настоящем документе термин «консервативная замена» относится к замене одной аминокислоты на другую аминокислоту, имеющую схожую структуру и/или химические свойства. Например, вариант может иметь одну или более чем одну консервативную замену, при этом сохраняя одну или более чем одну биологическую активность. Такие аминокислотные замены, как правило, могут возникать на основании сходства в полярности, заряде, растворимости, гидрофобности, гидрофильности и/или амфипатической природы остатка. Например, среди электрически заряженных аминокислот положительно заряженные (основные) аминокислоты включают аргинин, лизин и гистидин, а отрицательно заряженные (кислые) аминокислоты включают глутаминовую кислоту и аспарагиновую кислоту; среди незаряженных аминокислот неполярные аминокислоты включают глицин, аланин, валин, лейцин, изолейцин, метионин, фенилаланин, триптофан и пролин; полярные или гидрофильные аминокислоты включают серин, треонин, цистеин, тирозин, аспарагин и глутамин, и ароматические аминокислоты включают фенилаланин, триптофан и тирозин.
Кроме того, варианты могут также включать делецию или добавление аминокислот, которые оказывают минимальное влияние на свойства и вторичную структуру полипептида. Например, полипептид может быть конъюгирован с сигнальной (или лидерной) последовательностью на N-конце белка, задействованного в транспортировке белков одновременно с трансляцией или после ее завершения. Кроме того, полипептид может также быть конъюгирован с другой последовательностью или линкером для обнаружения, очистки или синтеза полипептида.
В частности, полипептид, обладающий ОФС-экспортирующей активностью по настоящему изобретению, может представлять собой полипептид, обладающий ОФС-экспортирующей активностью, содержащий а) замену изолейцина (I) в положении, соответствующем 241 в аминокислотной последовательности SEQ ID NO: 11, на треонин (Т), замену аспарагиновой кислоты (D) в положении, соответствующем 246 в аминокислотной последовательности SEQ ID NO: 11, на валин (V), и замену валина (V) в положении, соответствующем 330 в аминокислотной последовательности SEQ ID NO: 11, на изолейцин (I), и имеющему аминокислотную последовательность, где b) аминокислота в положении, соответствующем 88, представляет собой фенилаланин и с) аминокислота в положении, соответствующем 207, представляет собой лизин (K), либо полипептид, обладающий ОФС-экспортирующей активностью, содержащий а) замену изолейцина (I) в положении, соответствующем 241 в аминокислотной последовательности SEQ ID NO: 11, на треонин (Т), замену аспарагиновой кислоты (D) в положении, соответствующем 246 в аминокислотной последовательности SEQ ID NO: 11, на валин (V), и замену валина (V) в положении, соответствующем 330 в аминокислотной последовательности SEQ ID NO: 11, на изолейцин (I), и имеющему аминокислотную последовательность, где b) аминокислота в положении, соответствующем 88, представляет собой фенилаланин и с) аминокислота в положении, соответствующем 207, представляет собой лизин (K).
Полипептид, обладающий ОФС-экспортирующей активностью по настоящему изобретению, может представлять собой полипептид, обладающий ОФС-экспортирующей активностью, содержащий а) замену изолейцина (I) в положении, соответствующем 241 в аминокислотной последовательности SEQ ID NO: 11, на треонин (Т), замену аспарагиновой кислоты (D) в положении, соответствующем 246 в аминокислотной последовательности SEQ ID NO: 11, на валин (V), и замену валина (V) в положении, соответствующем 330 в аминокислотной последовательности SEQ ID NO: 11, на изолейцин (I), и имеющему аминокислотную последовательность, где b) аминокислота в положении, соответствующем 88, представляет собой фенилаланин и с) аминокислота в положении, соответствующем 207, представляет собой лизин (K), либо полипептид, обладающий ОФС-экспортирующей активностью, содержащий а) замену изолейцина (I) в положении, соответствующем 241 в аминокислотной последовательности SEQ ID NO: 11, на треонин (Т), замену аспарагиновой кислоты (D) в положении, соответствующем 246 в аминокислотной последовательности SEQ ID NO: 11, на валин (V), и замену валина (V) в положении, соответствующем 330 в аминокислотной последовательности SEQ ID NO: 11, на изолейцин (I), и состоящему или по существу состоящему из аминокислотной последовательности, где b) аминокислота в положении, соответствующем 88, представляет собой фенилаланин и с) аминокислота в положении, соответствующем 207, представляет собой лизин (K).
Кроме того, полипептид, обладающий ОФС-экспортирующей активностью по настоящему изобретению может включать, без ограничения, любой полипептид, имеющий аминокислотную последовательность, демонстрирующую идентичность по меньшей мере 70%, 80%, 90%, 95% или 99% или выше и менее чем 100% с аминокислотной последовательностью SEQ ID NO: 11 либо SEQ ID NO: 1 и демонстрирующий ОФС-экспортирующую способность, по существу идентичную или соответствующую таковой полипептида, при этом представляет собой полипептид, содержащий а) замену изолейцина (I) в положении, соответствующем 241 в аминокислотной последовательности SEQ ID NO: 11, на треонин (Т), замену аспарагиновой кислоты (D) в положении, соответствующем 246 в аминокислотной последовательности SEQ ID NO: 11, на валин (V), и замену валина (V) в положении, соответствующем 330 в аминокислотной последовательности SEQ ID NO: 11, на изолейцин (I), и имеющему аминокислотную последовательность, где b) аминокислота в положении, соответствующем 88, представляет собой фенилаланин и с) аминокислота в положении, соответствующем 207, представляет собой лизин (K). Кроме того, очевидно, что любой вариант полипептида, имеющий аминокислотную последовательность, у которой осуществлена делеция, модификация, замена или добавление части аминокислотной последовательности в аминокислотных положениях, соответствующих 88, 207, 241, 246 и 330 аминокислотной последовательности SEQ ID NO: 11, может также входить в объем настоящего изобретения, при условии, что он является полипептидом, имеющим аминокислотную последовательность, по существу обладающую ОФС-экспортирующей активностью, будучи последовательностью, обладающей такой идентичностью.
В частности, полипептид, обладающий ОФС-экспортирующей активностью по настоящему изобретению, может представлять собой полипептид, имеющий аминокислотную последовательность SEQ ID NO: 1.
В настоящем изобретении полипептид, обладающий О-фосфосерин-экспортирующей активностью, имеющий аминокислотную последовательность SEQ ID NO: 1, может представлять собой полипептид, обладающий О-фосфосерин-экспортирующей активностью, содержащий аминокислотную последовательность SEQ ID NO: 1, полипептид, обладающий О-фосфосерин-экспортирующей активностью, представленный аминокислотной последовательностью SEQ ID NO: 1, полипептид, обладающий О фосфосерин-экспортирующей активностью, по существу состоящий из аминокислотной последовательности SEQ ID NO: 1, или полипептид, обладающий О-фосфосерин-экспортирующей активностью, состоящий из аминокислотной последовательности SEQ ID NO: 1. Кроме того, полипептид, обладающий О-фосфосерин-экспортирующей активностью по настоящему изобретению не исключает незначащего добавления последовательности в направлении против или по ходу транскрипции от аминокислотной последовательности SEQ ID NO: 1.
В настоящем документе SEQ ID NO: 1 может означать аминокислотную последовательность, обладающую ОФС-экспортирующей активностью. В частности, SEQ ID NO: 1 может представлять собой аминокислотную последовательность, составляющую вариант переносчика YhhS MFS, белка, проявляющего ОФС-экспортирующую активность, кодируемого геном yhhS.
Аминокислотная последовательность переносчика YhhS MFS, белка, проявляющего ОФС-экспортирующую активность, кодируемого геном yhhS, может быть получена из известной базы данных GenBank of NCBI. Аминокислотная последовательность переносчика YhhS MFS может, например, представлять собой SEQ ID NO: 11. Кроме того, аминокислотная последовательность переносчика YhhS MFS может представлять собой аминокислотную последовательность, происходящую из Escherichia coli (Е. coli), но не ограничиваться ей.
В другом аспекте настоящего изобретения в настоящем изобретении предложен полинуклеотид, кодирующий полипептид, обладающий О-фосфосерин-экспортирующей активностью, содержащий а) замену изолейцина (I) в положении, соответствующем 241 в аминокислотной последовательности SEQ ID NO: 11, на треонин (Т), замену аспарагиновой кислоты (D) в положении, соответствующем 246 в аминокислотной последовательности SEQ ID NO: 11, на валин (V), и замену валина (V) в положении, соответствующем 330 в аминокислотной последовательности SEQ ID NO: 11, на изолейцин (I), и имеющий аминокислотную последовательность, где b) аминокислота в положении, соответствующем 88, представляет собой фенилаланин и с) аминокислота в положении, соответствующем 207, представляет собой лизин (K), или полипептид, обладающий О-фосфосерин-экспортирующей активностью, имеющий аминокислотную последовательность SEQ ID NO: 1.
SEQ ID NO: 11, SEQ ID NO: 1, О фосфосерин и полипептид, обладающий О-фосфосерин-экспортирующей активностью, являются такими, как описано выше.
В настоящем документе «полинуклеотид», представляющий собой полимер нуклеотидов, состоящий из мономеров нуклеотидов, соединенных в длинную цепочку ковалентными связями, является цепью ДНК или РНК определенной длины.
Полинуклеотид может включать в себя любой полинуклеотид, кодирующий полипептид, обладающий ОФС-экспортирующей активностью по настоящему изобретению, без ограничения. В настоящем изобретении ген, кодирующий аминокислотную последовательность ОФС-экспортирующего белка, может представлять собой ген yhhS. Кроме того, ген может происходить из Escherichia coli (Е. coli), но не ограничиваться указанным.
В частности, полинуклеотид, кодирующий полипептид, обладающий ОФС-экспортирующей активностью по настоящему изобретению, может иметь или содержать нуклеотидную последовательность, кодирующую аминокислотную последовательность, представленную SEQ ID NO: 1. Кроме того, полинуклеотид, кодирующий полипептид, обладающий ОФС-экспортирующей активностью по настоящему изобретению, может состоять или по существу состоять из нуклеотидной последовательности, кодирующей аминокислотную последовательность, представленную SEQ ID NO: 1. Вследствие вырожденности кодонов или с учетом предпочтения кодонов у организма, в котором экспрессируется полипептид, могут происходить различные модификации в кодирующей области полинуклеотида по настоящему изобретению, в том объеме, который не меняет аминокислотную последовательность полипептида. Полипептид по настоящему изобретению может содержать или иметь, например, нуклеотидную последовательность, обладающую гомологией или идентичностью по меньшей мере 80%, 90%, 95%, 95% или 99% или выше с нуклеотидной последовательностью SEQ ID NO: 2, но не ограничивается указанным. В одном воплощении полинуклеотид по настоящему изобретению может состоять или по существу состоять из нуклеотидной последовательности, обладающей гомологией или идентичностью по меньшей мере 80%, 90%, 95%, 95% или 99% или выше с нуклеотидной последовательностью SEQ ID NO: 2, но не ограничивается указанным.
Кроме того, полинуклеотид по настоящему изобретению может включать в себя зонд, который может быть получен из известной генной последовательности, например, последовательности, которая гибридизуется в жестких условиях с последовательностью, комплементарной всей или части нуклеотидной последовательности, кодирующей аминокислотную последовательность SEQ ID NO: 1, без ограничения. «Жесткие условия» относятся к условиям, при которых обеспечивается специфическая гибридизация между полинуклеотидами. Такие условия отдельно описаны в литературе (см. J. Sambrook et al., Molecular Cloning, A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory press, Cold Spring Harbor, New York, 1989; F.M. Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons, Inc., New York). Например, жесткие условия могут включать условия, при которых гены, обладающие высокой гомологией или идентичностью 40% или более, в частности, 90% или более, более конкретно, 95% или более, еще более конкретно, 97% или более, особенно 99% или более, гибридизуются друг с другом, а гены, обладающие гомологией или идентичностью меньше указанных, не гибридизуются друг с другом, или стандартные условия отмывки при гибридизации по Саузерну, т.е., в частности, однократную, двукратную или трехкратную отмывку при концентрации соли и температуре, соответствующих 60°С, 1X SSC, 0,1% SDS, в частности, 60°С, 0,1Х SSC, 0,1% SDS, и более конкретно, 68°С, 0,1Х SSC, 0,1% SDS.
Для гибридизации необходимо, чтобы две нуклеиновых кислоты содержали комплементарные последовательности, хотя, в зависимости от строгости гибридизации, возможны несовпадения между основаниями. Термин «комплементарный» используется для описания взаимодействия между нуклеотидными основаниями, которые могут гибридизоваться друг с другом. Например, в случае ДНК аденозин комплементарен тимину, а цитозин комплементарен гуанину. Таким образом, полинуклеотид по настоящему изобретению может включать выделенные фрагменты нуклеотидов, комплементарные полной последовательности, а также по существу схожие с ними последовательности нуклеиновых кислот.
В настоящем документе термин «гомология» или «идентичность» относится к степени соответствия двух заданных аминокислотных последовательностей или нуклеотидных последовательностей и может выражаться в процентах. Термины «гомология» и «идентичность» зачастую могут использоваться взаимозаменяемо друг с другом.
Гомология или идентичность последовательностей консервативных полипептидов или полинуклеотидов может быть установлена при помощи стандартных алгоритмов выравнивания, можно применять значения штрафов за открытие гэпа, установленные в используемой программе по умолчанию. Обычно предполагается, что гомологичные или идентичные последовательности гибридизуются друг с другом в условиях умеренной или высокой жесткости по всей длине их последовательности или по меньшей мере на протяжение приблизительно 50%, 50%, 60%, 70%, 80% или 90% от всей длины. Кроме того, подразумеваются и полинуклеотиды, которые в гибридизующихся полинуклеотидах вместо кодонов содержат вырожденные кодоны.
Установить, обладают ли две любые полинуклеотидные последовательности гомологией, сходством или идентичностью, можно, например, при помощи известного компьютерного алгоритма, такого как программа FASTA с использованием параметров по умолчанию (Pearson et al., (1988) Proc. Natl. Acad. Sci. USA 85:2444). В альтернативном варианте, это можно установить при помощи алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48:443-453), используемого в программе Needleman пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16:276-277) (версии 5.0.0 или более поздней) (пакет программ GCG (Devereux, J., et al., Nucleic Acids Research 12:387 (1984)), BLASTP, BLASTN, FASTA (Atschul, S.F., et al., J MOLEC BIOL 215:403 (1990); Guide to Huge Computers, Martin J. Bishop, ed., Academic Press, San Diego, 1994, and CARILLO et al. (1988) SIAM J Applied Math 48:1073). Например, гомологию, сходство или идентичность можно установить при помощи BLAST или ClustalW Национального Центра Биотехнологической Информации (NCBI).
Гомологию, сходство или идентичность полипептидов или полинуклеотидов можно устанавливать путем сравнения информации о последовательности с использованием компьютерной программы GAP, такой как Needleman et al. (1970), J Mol Biol. 48:443, как описано Smith and Waterman, Adv. Appl. Math (1981) 2:482. Вкратце, программа GAP устанавливает гомологию, сходство или идентичность как значение, полученное путем деления количества одинаковых выровненных символов (т.е. нуклеотидов или аминокислот) на общее количество символов в более короткой из двух последовательностей. Параметры по умолчанию для программы GAP могут включать (1) унарную матрицу сравнения (содержащую значение 1 для идентичных и 0 для неидентичных символов) и взвешенную матрицу сравнения, предложенную Gribskov et al. (1986), Nucl. Acids Res. 14:6745, как описано в Атласе белковых последовательностей и структур под ред. Schwartz and Dayhoff, Atlas of Protein Sequence and Structure, National Biomedical Research Foundation, pp. 353-358 (1979) (или подстановочную матрицу EDNAFULL (EMBOSS версия NCBI NUC4.4)); (2) штраф 3,0 за каждый пропуск и дополнительный штраф 0,10 за каждый символ в каждом пропуске (или штраф за открытие пропуска 10 и штраф за продолжение пропуска 0,5); и (3) отсутствие штрафа за концевые пропуски.
Кроме того, установить, обладают ли две любых полинуклеотидных или полипептидных последовательности гомологией, сходством или идентичностью друг с другом, можно путем сравнения последовательностей в эксперименте с гибридизацией по Саузерну в определенных строгих условиях, а определение надлежащих условий гибридизации известно из уровня техники и может быть установлено способами, хорошо известными специалистам в данной области техники (например, J. Sambrook et al.).
В частности, полинуклеотиды, обладающие гомологией или идентичностью, можно обнаружить с использованием условий гибридизации, включающих стадию гибридизации при значении Tm 55°С в описанных выше условиях. Кроме того, значение Tm может быть 60°С, 63°С или 65°С, не ограничиваясь указанными значениями и может быть соответствующим образом скорректировано специалистом в области техники в зависимости от задачи.
Надлежащая строгость для гибридизации полинуклеотидов зависит от длины полинуклеотидов и степени комплементарности, и эти переменные хорошо известны в области техники (см. Sambrook et al., выше, 9.50-9.51, 11.7-11.8).
В еще одном аспекте настоящего изобретения в настоящем изобретении предложен вектор, содержащий полинуклеотид, кодирующий полипептид, обладающий О-фосфосерин-экспортирующей активностью, включающий а) замену изолейцина (I) в положении, соответствующем 241 в аминокислотной последовательности SEQ ID NO: 11 на треонин (Т), замену аспарагиновой кислоты (D) в положении, соответствующем 246 в аминокислотной последовательности SEQ ID NO: 11 на валин (V), и замену валина (V) в положении, соответствующем 330 в аминокислотной последовательности SEQ ID NO: 11 на изолейцин (I), и имеющий аминокислотную последовательность, где b) аминокислота в положении, соответствующем 88, представляет собой фенилаланин и с) аминокислота в положении, соответствующем 207, представляет собой лизин (K), либо полинуклеотид, кодирующий полипептид, обладающий О фосфосерин-экспортирующей активностью, имеющий аминокислотную последовательность SEQ ID NO: 1.
SEQ ID NO: 11, SEQ ID NO: 1, О-фосфосерин, полипептид, обладающий O-фосфосерин-экспортирующей активностью, и полинуклеотид являются такими, как описано выше.
В настоящем документе термин «вектор» относится к ДНК-конструкции, содержащей нуклеотидную последовательность полинуклеотида, кодирующего целевой полипептид или белок, функционально связанную с подходящей регуляторной последовательностью, обеспечивающей экспрессию целевого полипептида или белка в подходящей клетке-хозяине. Регуляторная последовательность может включать промотор, способный инициировать транскрипцию, любую последовательность оператора для регуляции транскрипции, последовательность, кодирующую подходящий сайт связывания рибосомы на мРНК, и последовательность для регуляции терминации транскрипции и трансляции. После трансформации в подходящую клетку-хозяин вектор может реплицироваться или функционировать независимо от генома хозяина или может интегрироваться в его геном.
Вектор, используемый в настоящем изобретении, не ограничивается конкретными векторами, при условии, что он способен реплицироваться в клетке-хозяине, и можно использовать любой вектор, известный в области техники. Примеры типично используемых векторов могут включать природные или рекомбинантные плазмиды, космиды, вирусы и бактериофаги. Например, в качестве фагового вектора или космидного вектора можно использовать pWE15, М13, MBL3, MBL4, IХII, ASHII, APII, t10, t11, Charon4A и Charon21A, а в качестве плазмидного вектора использовать вектор на основе pBR, pUC, pBluescriptII, pGEM, pTZ, pCL, pSK, pSKH и pET. В частности, можно использовать векторы pCL, pSK, pSKH130, pDZ, pACYC177, pACYC184, pECCG117, pUC19, pBR322, pMW118 и pCC1BAC.
Встраивание полинуклеотида в хромосому можно осуществлять любым известным в области техники способом, например, посредством гомологичной рекомбинации, но способ этим не ограничивается.
Вектор может дополнительно включать в себя селективный маркер для подтверждения встраивания в хромосому. Селективный маркер используют для отбора клеток, трансформированных вектором, т.е. для подтверждения того, встроилась ли целевая молекула нуклеиновой кислоты, и могут использоваться маркеры, обеспечивающие фенотип, позволяющий осуществлять отбор, такой как устойчивость к лекарственным средствам, ауксотрофия, устойчивость к цитотоксическим агентам или экспрессия модифицированных поверхностных белков. В среде, обработанной селективным агентом, могут выживать или демонстрировать различные фенотипы только клетки, экспрессирующие селективный маркер, таким образом можно осуществлять отбор трансформированных клеток.
В настоящем документе термин «трансформация» относится к внедрению вектора, который включает в себя полинуклеотид, кодирующий целевой полипептид или белок, в клетку-хозяина, так чтобы белок, кодируемый полинуклеотидом, был способен экспрессироваться в клетке-хозяине. Для трансформированного полинуклеотида не имеет значения, встроен ли он в хромосому клетки-хозяина и находится в ней или находится за пределами хромосомы, и могут быть включены оба варианта, лишь бы только трансформированный полинуклеотид мог экспрессироваться в клетке-хозяине. Кроме того, полинуклеотид может включать ДНК и РНК, которые кодируют целевой полипептид или белок.
Полинуклеотид может быть внедрен в любой форме, при условии, что он может быть внедрен в клетку-хозяина и экспрессироваться в ней. Например, полинуклеотид может быть внедрен в клетку-хозяина в форме экспрессионной кассеты, которая представляет собой генную конструкцию, включающую в себя все элементы, необходимые для ее автономной экспрессии. Экспрессионная кассета как правило может включать в себя промотор, функционально связанный с полинуклеотидом, сигнал терминации транскрипции, сайт связывания рибосомы и сигнал терминации трансляции. Экспрессионная кассета может быть в форме самореплицирующегося экспрессирующего вектора. Кроме того, полинуклеотид может быть внедрен в клетку-хозяина как таковой и функционально связан с последовательностями, необходимыми для его экспрессии в клетке-хозяине, без конкретного ограничения.
Кроме того, в настоящем документе термин «функционально связанный» означает, что последовательность гена функционально связана с последовательностью промотора, который инициирует и опосредует транскрипцию полинуклеотида, кодирующего целевой полипептид или белок по настоящему изобретению.
В другом аспекте настоящего изобретения в настоящем изобретении предложен О фосфосерин-продуцирующий микроорганизм, включающий любое одно или более из полипептида, обладающего О-фосфосерин (ОФС)-экспортирующей активностью, содержащего а) замену изолейцина (I) в положении, соответствующем 241 в аминокислотной последовательности SEQ ID NO: 11, на треонин (Т), замену аспарагиновой кислоты (D) в положении, соответствующем 246 в аминокислотной последовательности SEQ ID NO: 11, на валин (V), и замену валина (V) в положении, соответствующем 330 в аминокислотной последовательности SEQ ID NO: 11, на изолейцин (I), и имеющего аминокислотную последовательность, где b) аминокислота в положении, соответствующем 88, представляет собой фенилаланин и с) аминокислота в положении, соответствующем 207, представляет собой лизин (K), либо полипептида, обладающего О-фосфосерин-экспортирующей активностью, имеющего аминокислотную последовательность SEQ ID NO: 1, полинуклеотида, кодирующего полипептид по настоящему изобретению, и вектора, содержащего полинуклеотид, кодирующий полипептид по настоящему изобретению.
SEQ ID NO: 11, SEQ ID NO: 1, О-фосфосерин, полипептид, обладающий О-фосфосерин-экспортирующей активностью, полинуклеотид и вектор являются такими, как описано выше.
В настоящем документе термин «ОФС-продуцирующий микроорганизм» относится к микроорганизму, обладающему от природы слабой способностью продуцировать ОФС, или к микроорганизму, которому придали ОФС-продуцирующую способность в результате природных или искусственных генетических модификаций родительского штамма, не обладающего ОФС-продуцирующей способностью. В частности, микроорганизм может представлять собой микроорганизм, экспрессирующий полипептид, имеющий аминокислотную последовательность SEQ ID NO: 1, но не ограничивается им. В настоящем изобретении «ОФС-продуцирующий микроорганизм» может использоваться взаимозаменяемо с «микроорганизмом, обладающим ОФС-продуцирующей способностью», «ОФС-продуцирующим штаммом» и «линией ОФС-продуцирующего штамма».
Для задач настоящего изобретения в случае ОФС-продуцирующего микроорганизма, микроорганизм может включать любое одно или более из полипептида, обладающего ОФС-экспортирующей активностью по настоящему изобретению, полинуклеотида, кодирующего полипептид по настоящему изобретению, и вектора, содержащего полинуклеотид по настоящему изобретению, за счет чего усиливается активность экспрессируемого с него полипептида, и, таким образом, количество продуцируемого ОФС может повышаться по сравнению с таковым у микроорганизма дикого типа до модификации. Важно, что продуцирование ОФС может быть повышено в результате внедрения полипептида, обладающего ОФС-экспортирующей активностью по настоящему изобретению, и усиления его активности, тогда как микроорганизмы дикого типа не способны продуцировать ОФС или могут продуцировать только следовые количества даже если они способны продуцировать ОФС. Таким образом, ОФС-продуцирующий микроорганизм по настоящему изобретению может быть таким, у которого активность полипептида, обладающего ОФС-экспортирующей активностью по настоящему изобретению, усилена по сравнению с его эндогенной активностью, но не ограничивается им.
В настоящем документе термин «усиление по сравнению с его эндогенной активностью» относится к повышенной активности белка по сравнению с активностью белка, имеющегося у микроорганизма в естественном состоянии.
В настоящем документе термин «экспрессируемый/экспрессирующийся» относится к состоянию, в котором целевой полипептид или белок вводят в микроорганизм или в котором целевой полипептид или белок модифицируют для его экспрессии в микроорганизме. Когда целевой полипептид или белок представляет собой полипептид или белок, присутствующий в микроорганизме, это может означать состояние, в котором его активность усилена по сравнению с эндогенной активностью или активностью до модификации.
В настоящем документе термин «усиление активности» полипептида или белка означает, что активность полипептида или белка усиливается по сравнению с его эндогенной активностью. В настоящем документе термин «эндогенная активность» относится к активности конкретного полипептида или белка, которой исходно обладал родительский штамм до трансформации или немодифицированный микроорганизм, в случае, когда свойство микроорганизма изменено вследствие генетической модификации, вызванной фактором природного или искусственного происхождения, и может использоваться взаимозаменяемо с «активностью до модификации». «Усиление» или «повышение» активности полипептида или белка по сравнению с его эндогенной активностью означает, что активность усиливается по сравнению с активностью конкретного полипептида или белка, которой исходно обладал родительский штамм до трансформации или немодифицированный микроорганизм.
«Повышение активности» может достигаться посредством внедрения чужеродного полипептида или белка или посредством усиления активности эндогенного полипептида или белка, но, в частности, может достигаться посредством усиления активности эндогенного полипептида или белка. Подтвердить, усилилась или нет активность полипептида или белка можно по повышению уровня активности, уровня экспрессии целевого полипептида или белка или по количеству продукта, экспортируемого целевым белком.
В настоящем изобретении полипептид или белок, предназначенный для усиления активности, то есть целевой полипептид или белок, может быть вариантом переносчика YhhS MFS, и в частности, может быть вариантом переносчика YhhS MFS, обладающего ОФС-экспортирующей активностью, которая усилена по сравнению с таковой у переносчика YhhS MFS дикого типа, но не ограничивается им.
Кроме того, в настоящем изобретении продукт, экспортируемый целевым полипептидом или белком, может представлять собой О-фосфосерин, но не ограничивается им.
Усиление активности полипептида или белка может достигаться различными способами, хорошо известными в области техники, и может не ограничиваться конкретными способами, при условии, что активность целевого полипептида или белка может усиливаться по сравнению с таковой у микроорганизма до модификации. Способ может включать генную инженерию или белковую инженерию, но не ограничивается ими.
Способ усиления активности полипептида или белка с использованием генной инженерии может достигаться, например, посредством:
1) способа увеличения числа внутриклеточных копий гена или полинуклеотида, кодирующих полипептид или белок;
2) способа замены регулирующей экспрессию последовательности гена, кодирующего полипептид или белок, на хромосоме последовательностью, обладающей сильной активностью;
3) способа модификации нуклеотидной последовательности инициирующего кодона или 5'-нетранслируемой области (5'-UTR) полипептида или белка;
4) способа модификации полинуклеотидной последовательности на хромосоме с усилением активности полипептида или белка;
5) способа внедрения чужеродного полинуклеотида, обладающего активностью полипептида или белка или модифицированного полинуклеотида с оптимизированным составом кодонов полинуклеотида; или
6) их комбинации, не ограничиваясь перечисленным.
Способ усиления активности полипептида или белка с использованием белковой инженерии может достигаться, например, посредством анализа третичной структуры полипептида или белка, а также выбора и модификации экспонированного сайта или его химической модификации, не ограничиваясь перечисленным.
1) способ увеличения числа копий гена, кодирующего полипептид или белок может осуществляться методом, известным в области техники, например, внедрением в клетку-хозяина вектора, функционально связанного с геном или полинуклеотидом, кодирующим полипептид или белок и способного реплицироваться и функционировать независимо от клетки-хозяина. В альтернативном варианте указанный способ может осуществляться путем внедрения в клетку-хозяина вектора, способного встраивать ген или полинуклеотид в хромосому клетки-хозяина, с которой ген функционально связан, однако способ не ограничивается перечисленными. Указанный вектор является таким, как описано выше.
2) способ замены регулирующей экспрессию последовательности гена, кодирующего полипептид или белок на хромосоме последовательностью, имеющей сильную активность, можно осуществлять известным в области техники методом, например, путем осуществления модификации последовательности посредством делеции, вставки, неконсервативной или консервативной замены последовательности нуклеиновой кислоты или их комбинации для дополнительного усиления активности регулирующей экспрессию последовательности, или путем замены полинуклеотидной последовательности последовательностью нуклеиновых кислот с более высокой активностью. Регулирующая экспрессию последовательность, может включать промотор, последовательность оператора, последовательность, кодирующую сайт связывания рибосомы и последовательность, регулирующую терминацию транскрипции и трансляции, не ограничиваясь перечисленным. В частности, указанный способ может включать присоединение сильного гетерологичного промотора вместо исходного промотора, но не ограничивается этим.
Примеры сильного промотора могут включать промотор CJ7 (US 7662943 В2), промотор CJ1 (US 7662943 В2), промотор lac, промотор trp, промотор trc, промотор tac, промотор PR фага лямбда, промотор PL и промотор tet, но не ограничиваются указанными.
3) способ модификации нуклеотидной последовательности инициирующего кодона или 5'-UTR полипептида или белка можно осуществлять известным в области техники методом, например, путем замены эндогенного инициирующего кодона полипептида или белка другим инициирующим кодоном, имеющим более высокую степень экспрессии полипептида или белка по сравнению с эндогенным инициирующим кодоном, не ограничиваясь указанным.
4) способ модификации полинуклеотидной последовательности на хромосоме, обеспечивающий усиление активности полипептида или белка, можно осуществлять известным в области техники методом, например, путем включения модификации в регулирующую экспрессию последовательность посредством делеции, вставки, неконсервативной или консервативной замены нуклеотидной последовательности или их комбинации для дополнительного усиления активности полинуклеотидной последовательности или путем замены полинуклеотидной последовательности модифицированной полинуклеотидной последовательностью с более высокой активностью. В частности, замена может достигаться путем встраивания гена в хромосому посредством гомологичной рекомбинации, но не ограничивается этим.
Используемый при этом вектор может дополнительно включать в себя селективный маркер для подтверждения встраивания в хромосому. Селективный маркер является таким, как описано выше.
5) способ внедрения чужеродного полинуклеотида, обладающего активностью полипептида или белка, может осуществляться известным в области техники методом, например, посредством внедрения в клетку-хозяина чужеродного полинуклеотида, кодирующего полипептид или белок, демонстрирующий такую же или схожую активность с полипептидом или белком или его модифицированным полинуклеотидом с оптимизированным кодонным составом. Чужеродный полинуклеотид может применяться без ограничения, независимо от его происхождения или последовательности, при условии, что он демонстрирует такую же или схожую активность с полипептидом или белком. Кроме того, для оптимизированной транскрипции и трансляции чужеродного полинуклеотида в клетке-хозяине его кодоны могут быть оптимизированы и внедрены в клетку-хозяина. Внедрение может быть осуществлено специалистом в области техники посредством выбора подходящего способа трансформации, известного в области техники, а экспрессия внедренного полинуклеотида в клетке-хозяине обеспечивает продуцирование полипептида или белка, тем самым увеличивая его активность.
Наконец, 6) комбинация способов, указанных выше, может осуществляться путем применения любых одного или более способов с 1) по 5) в комбинации.
Такое усиление активности полипептида или активности белка может представлять собой увеличение активности или концентрации целевого полипептида или белка по сравнению с активностью или концентрацией полипептида или белка, экспрессируемых в штамме дикого типа или штамме микроорганизма до модификации, или может представлять собой увеличение количества продукта, получаемого из целевого полипептида или белка, но не ограничивается указанным. В настоящем документе термин «штамм до модификации» или «микроорганизм до модификации» не исключает штаммов, содержащих мутации, которые могут возникать естественным путем в микроорганизмах, и может относиться к самому природному штамму или к штамму до модификации, у которого свойство изменено вследствие генетической мутации, вызванной природными или искусственными факторами. «Штамм до модификации» или «микроорганизм до модификации» может использоваться взаимозаменяемо с «немутированным штаммом», «немодифицированный штаммом», «немутированным микроорганизмом» или «платформенным микроорганизмом».
В настоящем изобретении платформенный микроорганизм может представлять собой СА07-0012 - известный микроорганизм, продуцирующий ОФС, СА07-0022/pCL_Prmf-serA*(G336V)-serC(KCCM11103P (US 8557549 В2) - штамм, у которого активности эндогенных SerA (D-3-фосфоглицератдегидрогеназы) и SerC (3-фосфосеринаминотрансферазы) усилены, и СА07-0012 (KCCM11121P, US 8557549 В2), или штамм, у которого активность эндогенной фосфосеринфосфатазы (SerB) ослаблена, но не ограничивается указанными.
Микроорганизм по настоящему изобретению может представлять собой рекомбинантный микроорганизм, полученный путем трансформации вектором, содержащим полинуклеотид, кодирующий полипептид, но не ограничивается указанным.
Микроорганизм по настоящему изобретению не ограничивается его типом при условии, что он способен продуцировать ОФС, и может быть любым прокариотическим или эукариотическим микроорганизмом, в частности, прокариотическим микроорганизмом. Прокариотический микроорганизм может включать штаммы микроорганизмов, относящиеся к роду Escherichia, роду Erwinia, роду Serratia, роду Providencia, роду Corynebacterium и роду Brevibacterium, в частности, микроорганизм, относящийся к роду Escherichia, и более конкретно, Escherichia coli, но не ограничиваться указанным. В частности, в случае микроорганизма, относящегося к роду Escherichia, ОФС и L-серин могут продуцироваться при помощи SerA, SerC и SerB, которые являются ферментами пути биосинтеза L-серина (Ahmed Zahoor, Computational and structural biotechnology journal, Vol. 3, 2012 October; Wendisch V. F. et al., Curr Opin Microbiol. 2006 Jun; 9(3):268-74; Peters-Wendisch P. et al., Appl Environ Microbiol. 2005 Nov; 71(11):7139-44.).
ОФС-продуцирующий микроорганизм по настоящему изобретению может являться таким, у которого активность фосфосеринфосфатазы (SerB) может быть дополнительно ослаблена по сравнению с его эндогенной активностью.
SerB по настоящему изобретению обладает активностью превращения ОФС в L-серин, и таким образом, модифицированный микроорганизм с ослабленной активностью SerB обладает свойством накопления в нем ОФС, и поэтому полезен для получения ОФС.SerB по настоящему изобретению может представлять собой белок, имеющий или включающий в себя аминокислотную последовательность, представленную SEQ ID NO: 3, или может представлять собой белок, состоящий или по существу состоящий из аминокислотной последовательности, представленной SEQ ID NO: 3, но не ограничивается таковым. Кроме того, SerB может иметь или включать в себя аминокислотную последовательность, обладающую гомологией или идентичностью 80%, 90%, 95% или 99% или выше с аминокислотной последовательностью, представленной SEQ ID NO: 3, при условии, что она демонстрирует активность SerB. Кроме того, SerB по настоящему изобретению может состоять или по существу состоять из аминокислотной последовательности, обладающей гомологией или идентичностью 80%, 90%, 95% или 99% или выше с аминокислотной последовательностью, представленной SEQ ID NO: 3, но не ограничивается таковым. Кроме того, полинуклеотид, кодирующий SerB, может иметь или включать в себя нуклеотидную последовательность, кодирующую аминокислотную последовательность, представленную SEQ ID NO: 3. Кроме того, полинуклеотид, кодирующий SerB, может состоять или по существу состоять из нуклеотидной последовательности, кодирующей аминокислотную последовательность, представленную SEQ ID NO: 3. Вследствие вырожденности кодонов или с учетом предпочтения кодонов у организма, в котором будет экспрессироваться полипептид, полинуклеотид, кодирующий SerB по настоящему изобретению, может претерпевать различные модификации в кодирующей области, в том объеме, который не изменяет аминокислотную последовательность белка SerB. Полинуклеотид, кодирующий SerB по настоящему изобретению, может иметь или включать в себя нуклеотидную последовательность, обладающую гомологией или идентичностью по меньшей мере 80%, 90%, 95%, 95% или 99% или выше и менее 100% с нуклеотидной последовательностью SEQ ID NO: 4. Кроме того, полинуклеотид, кодирующий SerB по настоящему изобретению, может состоять или по существу состоять из нуклеотидной последовательности, обладающей гомологией или идентичностью 80%, 90%, 95%, 95% или 99% или выше и менее 100% с нуклеотидной последовательностью SEQ ID NO: 4, но не ограничивается таковым.
В настоящем документе термин «ослабление активности по сравнению с его эндогенной активностью» означает, что природный штамм дикого типа, родительский штамм или целевой белок не экспрессируют фермент или белок или не обладают активностью или обладают пониженной активностью даже при экспрессии по сравнению с немодифицированный штаммом. В частности, понижение является широким понятием, включающим случай, когда активность белка понижается по сравнению с активностью белка, которой исходно обладал микроорганизм вследствие мутации гена, кодирующего белок, модификации регулирующей экспрессию последовательности, или делеции части или всех генов и так далее; случай, когда суммарный уровень активности внутриклеточных белков понижен по сравнению с таковым у природного штамма или штамма до модификации вследствие ингибирования экспрессии гена, кодирующего белок или ингибирования трансляции; и их комбинации.
Ослабление активности белка может достигаться различными способами, хорошо известными в области техники. Примеры способов могут включать: способ модификации последовательности гена, кодирующего белок, так чтобы активность белка была устранена или ослаблена; способ модификации регулирующей экспрессию последовательности, так чтобы экспрессия гена понизилась; способ делеции части или всего гена, кодирующего белок; способ внедрения антисмыслового олигонуклеотида (например, антисмысловой РНК), подавляющий трансляцию мРНК в белок через комплементарное связывание с транскриптом гена на хромосоме; способ, делающий невозможным присоединение рибосомы вследствие образования вторичной структуры путем искусственного добавления комплементарной последовательности к последовательности Шайн-Далгарно (ШД) на переднем конце последовательности ШД гена, кодирующего белок; и способ инженерии обратной транскрипции (RTE), при котором добавляют промотор для обратной транскрпции к 3' концу открытой рамки считывания (ORF) полинуклеотидной последовательности гена, кодирующего белок; и их комбинации, но не ограничивается перечисленным.
В частности, способ модификации последовательности гена на хромосоме можно осуществлять посредством индуцирования модификации в указанной последовательности путем делеции, вставки, неконсервативной замены, консервативной замены или их комбинации, так чтобы дополнительно ослабить активность белка; или путем замены последовательности последовательностью гена, модифицированной таким образом, чтобы иметь ослабленную активность, либо последовательностью гена, модифицированной таким образом, чтобы активность полностью отсутствовала.
Способ модификации регулирующей экспрессию последовательности, может осуществляться посредством индуцирования модификации в последовательности, регулирующую экспрессию, путем делеции, вставки, консервативной замены, неконсервативной замены или их комбинации для дальнейшего ослабления активности регулирующей экспрессию последовательности; или путем замены последовательности последовательностью нуклеиновых кислот, обладающей более слабой активностью. Регулирующая экспрессию последовательность может включать промотор, последовательность оператора, последовательность, кодирующую сайт связывания рибосомы, и последовательность регуляции транскрипции и трансляции.
Способ делеции части или всего гена, кодирующего белок, может осуществляться путем замены полинуклеотида, кодирующего эндогенный целевой белок в составе хромосомы полинуклеотидом или маркерным геном, имеющим частичную делецию последовательности нуклеиновых кислот с использованием вектора для встраивания в хромосому бактерий. Например, может применяться способ делеции гена посредством гомологичной рекомбинации. Кроме того, в настоящем документе термин «часть», хотя он может варьировать в зависимости от типов полинуклеотида, может относиться в частности к 1-300 нуклеотидам, более конкретно к 1-100 нуклеотидам, и еще более конкретно к 1-50 нуклеотидам, но не ограничивается указанным.
Кроме того, способ модификации регулирующей экспрессию последовательности, может осуществляться путем включения модификации в регулирующую экспрессию последовательность путем делеции, вставки, консервативной замены, неконсервативной замены или их комбинации для дальнейшего ослабления активности регулирующей экспрессию последовательности; или путем замены последовательности последовательностью нуклеиновых кислот, обладающей более слабой активностью. Выражение регуляторная последовательность может включать промотор, последовательность оператора, последовательность, кодирующую сайт связывания рибосомы, и последовательность регуляции транскрипции и трансляции.
Кроме того, способ модификации последовательности гена на хромосоме можно осуществлять путем индуцирования модификации в последовательности путем делеции, вставки, консервативной замены, неконсервативной замены или их комбинации, так чтобы дополнительно ослабить активность белка; или путем замены последовательности последовательностью гена, модифицированной таким образом, чтобы иметь ослабленную активность, либо последовательностью гена, модифицированной таким образом, чтобы активность полностью отсутствовала.
Кроме того, ОФС-продуцирующий микроорганизм по настоящему изобретению может быть таким, у которого активность фосфоглицератдегидрогеназы (SerA) или фосфосеринаминотрансферазы (SerC) дополнительно усилена по сравнению с их эндогенной активностью.
SerA представляет собой белок, способный конвертировать 3-фосфоглицерат в 3-фосфогидроксипируват.SerC представляет собой белок, способный конвертировать 3-фосфогидроксипируват в ОФС. Соответственно, любой микроорганизм с усиленными активностями SerA и/или SerC может эффективно применяться в качестве ОФС-продуцирующего микроорганизма.
SerA может представлять собой белок, имеющий или включающий в себя аминокислотную последовательность, представленную SEQ ID NO: 5 или 6, или белок, состоящий или по существу состоящий из аминокислотной последовательности, представленной SEQ ID NO: 5 или 6, но не ограничивается таковым. Аминокислотная последовательность, представленная SEQ ID NO: 5, представляет собой последовательность SerA дикого типа, а аминокислотная последовательность, представленная SEQ ID NO: 6, представляет собой последовательность варианта SerA, свободного от ингибирования серином по механизму обратной связи. Кроме того, SerA по настоящему изобретению может иметь или включать в себя аминокислотную последовательность, обладающую гомологией или идентичностью по меньшей мере 80%, 90%, 95% или 99% или выше и менее 100% с аминокислотной последовательностью, представленной SEQ ID NO: 5 или 6, при условии, что она демонстрирует активность SerA дикого типа или активность варианта SerA, свободного от ингибирования серином по механизму обратной связи, но не ограничивается указанным. Кроме того, SerA по настоящему изобретению может состоять или по существу состоять из аминокислотной последовательности, обладающей гомологией или идентичностью по меньшей мере 80%, 90%, 95% или 99% или выше и менее 100% с аминокислотной последовательностью, представленной SEQ ID NO: 5 или 6, при условии, что она демонстрирует активность SerA дикого типа или активность варианта SerA, свободного от ингибирования серином по механизму обратной связи. Варианты SerA, свободные от ингибирования серином по механизму обратной связи, относятся к таким белкам, у которых внедрена модификация в ген, кодирующий SerA, посредством вставки нуклеотида гена, кодирующего SerA, или замены гена, кодирующего SerA дикого типа, и так далее, тем самым сохраняющие активность при ингибировании серином или глицином по механизму обратной связи, или обладающие их усиленными активностями, и такие варианты, которые свободны от ингибирования серином по механизму обратной связи, уже хорошо известны (Grant G.A. et al., J. Biol. Chem., 39:5357-5361, 1999; Grant G. A. et al., Biochem., 39:7316-7319, 2000; Grant G.A. et al., J. Biol. Chem., 276:17844-17850, 2001; Peters-Wendisch P. et al., Appl. Microbiol. Biotechnol., 60:37-441, 2002; US 6258573 B1).
Кроме того, полинуклеотид, кодирующий SerA дикого типа или вариант SerA, свободные от ингибирования серином по механизму обратной связи, может иметь или включать в себя нуклеотидную последовательность, кодирующую любую из аминокислотных последовательностей, представленных SEQ ID NO: 5 или 6. Кроме того, последовательность полинуклеотида, кодирующего SerA дикого типа или вариант SerA, свободный от ингибирования серином по механизму обратной связи, может состоять или по существу состоять из нуклеотидной последовательности, кодирующей любую из аминокислотных последовательностей, представленных SEQ ID NO: 5 или SEQ ID NO: 6, но не ограничивается таковым. Вследствие вырожденности кодонов или с учетом предпочтения кодонов у организма, в котором будет экспрессироваться полипептид, полинуклеотидная последовательность, кодирующая SerA дикого типа или вариант SerA, свободный от ингибирования серином по механизму обратной связи, может претерпевать различные модификации в кодирующей области, в том объеме, который не меняет аминокислотную последовательность полипептида, кодирующего SerA дикого типа или вариант SerA, свободный от ингибирования серином по механизму обратной связи. Например, нуклеотидная последовательность, кодирующая аминокислотную последовательность, представленную SEQ ID NO: 5, может представлять собой нуклеотидную последовательность, обладающую гомологией или идентичностью по меньшей мере 80%, 90%, 95% или 99% или выше с нуклеотидной последовательностью SEQ ID NO: 7. Кроме того, нуклеотидная последовательность, кодирующая аминокислотную последовательность, представленную SEQ ID NO: 6, может представлять собой нуклеотидную последовательность, обладающую гомологией или идентичностью по меньшей мере 80%, 90%, 95% или 99% или выше с нуклеотидной последовательностью SEQ ID NO: 8, но не ограничивается таковой.
SerC может, например, представлять собой белок, имеющий или включающий в себя аминокислотную последовательность, представленную SEQ ID NO: 9, или белок, состоящий или по существу состоящий из аминокислотной последовательности, представленной SEQ ID NO: 9, но не ограничивается таковым. Кроме того, SerC может иметь или включать в себя аминокислотную последовательность, обладающую гомологией или идентичностью по меньшей мере 80%, 90%, 95% или 99% или выше и менее 100% с аминокислотной последовательностью, представленной SEQ ID NO: 9, при условии, что она демонстрирует активность SerC. Кроме того, SerC может состоять или по существу состоять из аминокислотной последовательности, обладающей гомологией или идентичностью по меньшей мере 80%, 90%, 95% или 99% или выше и менее 100% с аминокислотной последовательностью, представленной SEQ ID NO: 9, при условии, что она демонстрирует активность SerC.
Кроме того, полинуклеотид, кодирующий SerC, может иметь нуклеотидную последовательность, кодирующую аминокислотную последовательность, представленную SEQ ID NO: 9. Вследствие вырожденности кодонов или с учетом предпочтения кодонов у организма, в котором будет экспрессироваться полипептид, полинуклеотид может претерпевать различные модификации в кодирующей области в том объеме, который не меняет аминокислотную последовательность полипептида. Полинуклеотид, кодирующий SerC, может иметь или включать в себя нуклеотидную последовательность, обладающую гомологией или идентичностью 80%, 90%, 95% или 99% или выше с нуклеотидной последовательностью SEQ ID NO: 10, но не ограничивается таковым. Кроме того, полинуклеотид, кодирующий SerC, может состоять или по существу состоять из нуклеотидной последовательности, обладающей гомологией или идентичностью 80%, 90%, 95% или 99% или выше с нуклеотидной последовательностью SEQ ID NO: 10, но не ограничивается таковым.
В настоящем документе термин «усиление по сравнению с его эндогенной активностью» и способ усиления являются такими, как описано выше.
Кроме того, микроорганизм может представлять собой микроорганизм, у которого способность внедрять ОФС в клетку или разлагать ОФС может быть дополнительно ослаблена.
В отношение содержимого ОФС-продуцирующих микроорганизмов, в качестве документа уровня техники в настоящем изобретении можно указать содержание US 8557549 В2, в дополнение к тому, что описано выше.
В еще одном аспекте настоящего изобретения в настоящем изобретении предложен способ получения О-фосфосерина, включающий культивирование О-фосфосерин-продуцирующего микроорганизма, который содержит любое одно или более из полипептида, обладающего О фосфосерин-экспортирующей активностью, содержащего а) замену изолейцина (I) в положении, соответствующем 241 в аминокислотной последовательности SEQ ID NO: 11, на треонин (Т), замену аспарагиновой кислоты (D) в положении, соответствующем 246 в аминокислотной последовательности SEQ ID NO: 11, на валин (V), и замену валина (V) в положении, соответствующем 330 в аминокислотной последовательности SEQ ID NO: 11, на изолейцин (I), и имеющего аминокислотную последовательность, где b) аминокислота в положении, соответствующем 88, представляет собой фенилаланин и с) аминокислота в положении, соответствующем 207, представляет собой лизин (K), либо полипептида, обладающего О-фосфосерин-экспортирующей активностью, имеющего аминокислотную последовательность SEQ ID NO: 1, полинуклеотида, кодирующего полипептид по настоящему изобретению, и вектора, содержащего полинуклеотид по настоящему изобретению.
SEQ ID NO: 11, SEQ ID NO: 1, О-фосфосерин, полипептид, обладающий О-фосфосерин-экспортирующей активностью, полинуклеотид, вектор и микроорганизм являются такими, как описано выше.
В настоящем документе термин «культивирование» означает, что микроорганизм выращивают в надлежащим образом контролируемых внешних условиях. Процесс культивирования по настоящему изобретению можно осуществлять в подходящей культуральной среде и условиях культивирования, известных в области техники. Такой способ культивирования может быть легко адаптирован специалистом в области техники в зависимости от отбираемого штамма. В частности, культивирование может представлять собой периодическое культивирование, непрерывное культивирование и непрерывное культивирование с подпиткой, не ограничиваясь перечисленным.
При культивировании рекомбинантного микроорганизма, обладающего пониженной активностью SerB по сравнению с его эндогенной активностью, среда может дополнительно содержать глицин или серии, по причине индуцированной потребности рекомбинантного микроорганизма в серине. Глицин может быть представлен в форме очищенного глицина, глицин-содержащего экстракта дрожжей или триптона. Концентрация глицина в среде обычно должна составлять от 0,1 г/л до 10 г/л, и в частности, от 0,5 г/л до 3 г/л. Кроме того, серин может быть представлен в форме очищенного серина, серин-содержащего экстракта дрожжей или триптона. Концентрация серина в среде обычно должна составлять от 0,1 г/л до 5 г/л, и в частности, от 0,1 г/л до 1 г/л.
Примеры источника углерода, присутствующего в среде, могут включать сахариды и углеводы, такие как глюкоза, сахароза, лактоза, фруктоза, мальтоза, крахмал и целлюлоза; масла и жиры, такие как соевое масло, масло семян подсолнечника, касторовое масло и кокосовое масло; жирные кислоты, такие как пальмитиновая кислота, стеариновая кислота и линолевая кислота; спирты, такие как глицерин и этанол; и органические кислоты, такие как уксусная кислота. Такие источники углерода можно использовать по-отдельности или в комбинации, без ограничения.
Примеры источника азота, присутствующего в среде, могут включать источники органического азота, такие как пептон, дрожжевой экстракт, мясной экстракт, мальтозный экстракт, кукурузный экстракт и соевую муку; и источники неорганического азота, такие как мочевина, сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония и нитрат аммония. Такие источники азота можно использовать по-отдельности или в комбинации, без ограничения.
Примеры источника фосфора, присутствующего в среде, могут включать однозамещенный фосфат калия, двузамещенный фосфат калия и соответствующие натрий-содержащие соли, без ограничения.
Кроме того, среда для культивирования может содержать соли металлов, такие как сульфат магния или сульфат железа, и может дополнительно содержать аминокислоты, витамины и соответствующие предшественники. Такие культуральные среды или предшественники можно добавлять в культуру при периодическом культивировании или непрерывном культивировании, и они не ограничиваются перечисленными.
В процессе культивирования можно корректировать рН среды путем добавления надлежащим образом такого соединения как гидроксид аммония, гидроксид калия, аммоний, фосфорная кислота и серная кислота. Кроме того, можно предупреждать образование пены в ходе культивирования при помощи пеногасителя, такого как сложный полигликолевый эфир жирной кислоты. Кроме того, для поддержания аэробных условий культивирования в культуру можно инжектировать газообразный кислород или газ, содержащий кислород; или для поддержания анаэробных или микроаэробных условий можно инжектировать газообразный азот, газообразный водород или двуокись углерода, без инжектирования газа. Температура культуры может находиться в диапазоне от 25°С до 40°С, в частности, от 30°С до 35°С. Культивирование можно продолжать до тех пор, пока удается продуцировать желаемый материал, и в частности, в течение 10-100 часов, но эти приведенные в качестве иллюстрации примеры не являются исчерпывающими.
Данное изобретение может дополнительно включать стадию приготовления среды до стадии культивирования в способе по настоящему изобретению, но не ограничивается этим.
Данное изобретение может дополнительно включать стадию выделения ОФС, полученного на стадии культивирования, в способе по настоящему изобретению после стадии культивирования. В частности, требуемый ОФС можно выделять из культуры путем отделения и очистки при помощи соответствующего способа, известного в области техники, в соответствии со способом культивирования, например, периодического культивирования, непрерывного культивирования и непрерывного культивирование с подпиткой, не ограничиваясь перечисленным.
В еще одном аспекте настоящего изобретения в настоящем изобретении предложен способ получения цистеина или его производного, включающий:
а) получение О-фосфосерина (ОФС) или содержащей его среды посредством культивирования в среде О-фосфосерин-продуцирующего микроорганизма, содержащего любое одно или более из полипептида, обладающего О-фосфосерин-экспортирующей активностью, содержащего а) замену изолейцина (I) в положении, соответствующем 241 в аминокислотной последовательности SEQ ID NO: 11, на треонин (Т), замену аспарагиновой кислоты (D) в положении, соответствующем 246 в аминокислотной последовательности SEQ ID NO: 11, на валин (V), и замену валина (V) в положении, соответствующем 330 в аминокислотной последовательности SEQ ID NO: 11, на изолейцин (I), и имеющего аминокислотную последовательность, где b) аминокислота в положении, соответствующем 88, представляет собой фенилаланин и с) аминокислота в положении, соответствующем 207, представляет собой лизин (K), либо полипептида, обладающего О-фосфосерин-экспортирующей активностью, имеющего аминокислотную последовательность SEQ ID NO: 1, полинуклеотида, кодирующего полипептид по настоящему изобретению, и вектора, содержащего полинуклеотид по настоящему изобретению; и
b) проведение реакции между О-фосфосерином или содержащей его средой, полученными на стадии а), и сульфидом в присутствии О-фосфосеринсульфгидрилазы (ОФСС) или экспрессирующего ее микроорганизма.
SEQ ID NO: 11, SEQ ID NO: 1, О-фосфосерин, полипептид, обладающий О-фосфосерин-экспортирующей активностью, полинуклеотид, вектор и микроорганизм являются такими, как описано выше.
В настоящем документе термин «производное» относится к схожим соединениям, полученным путем химической модификации части любого соединения. Указанный термин обычно относится к соединениям, в которых атом водорода или конкретная группа атомов заменен(а) другим атомом или группой атомов.
В настоящем документе термин «производное цистеина» относится к соединениям, в которых атом водорода или конкретная группа атомов заменен(а) другим атомом или группой атомов. Например, производные цистеина могут находиться в форме, в которой атом азота аминогруппы (-NH2) или атом серы тиоловой группы (-SH) в цистеине имеет другой атом или группу атомов, присоединенные к нему, и примеры производных цистеина могут включать NAC (N-ацетилцистеин), SCMC (S-карбоксиметилцистеин), Boc-Cys(Me)-OH, (R)-S-(2-амино-2-карбоксиэтил)-L-гомоцистеин, (R)-2-амино-3-сульфопропионовую кислоту, D-2-амино-4-(этилтио)бутировую кислоту, 3-сульфино-L-аланин, Fmoc-Cys(Boc-метил)-OH, селено-L-цистеин, 5-(2-тиазолил)-L-цистеин, 5-(2-тиенил)-L-цистеин, 5-(4-толил)-L-цистеин и так далее, без ограничения.
При получении цистеина в соответствии со способом по настоящему изобретению превращение в производные цистеина может легко осуществляться в разные производные цистеина любым методом, хорошо известным в области техники.
В частности, способ получения производных цистеина может дополнительно включать превращение цистеина, полученного на стадии b), в производное цистеина. Например, можно осуществить синтез N-ацетилцистеина (NAC) из цистеина путем реакции с ацетилирующим реагентом, или можно осуществить синтез S-карбоксиметилцистеина (SCMC) из цистеина путем реакции с галогенуксусной кислотой в щелочных условиях, без ограничения.
Такие производные цистеина используют преимущественно в качестве фармацевтических материалов для средств от кашля, уменьшающих кашель средств и терапевтических средств против бронхита, бронхиальной астмы, ларингофарингита и так далее, без ограничения.
В настоящем документе термин «О-фосфосеринсульфгидрилаза (ОФСС)» относится к ферменту, катализирующему реакцию, в ходе которой ОФС из тиоловой группы превращается в цистеин. Фермент может быть первоначально обнаруженным у Aeropyrum pernix, Mycobacterium tuberculosis, Mycobacterium smegmatis, and Trichomonas vaginalis (Mino K. and Ishikawa K., FEBS Letters, 551:133-138, 2003; Burns K.E. et al., J. Am. Chem. Soc., 127:11602-11603, 2005). Кроме того, ОФСС может включать не только белки ОФСС дикого типа, но также варианты белков, которые включают делецию, замену или вставку в части полинуклеотидной последовательности, кодирующей ОФСС, которые демонстрируют активность, равную или превосходящую биологическую активность белков ОФСС дикого типа, а также может включать все белки ОФСС, раскрытые в US 8557549 В2 и US 9127324 В2 и их варианты.
Сульфид, который может применяться в настоящем изобретении, может представлять собой любой сульфид, например, в форме сульфида (S2-) или тиосульфата (S2O32-), находящийся не только в твердой форме, обычно используемой в области техники, но также в жидкой или газообразной форме вследствие разницы в рН, давлении и растворимости, и, следовательно, может быть конвертирован в тиоловую группу. В частности, сульфид может включать Na2S, NaSH, H2S, (NH4)2S и Na2S2O3, которые могут быть источником тиоловой группы для ОФС, но не ограничивается ими. В ходе реакции единственная тиоловая группа встречается с единственной реакционноспособной группой ОФС с образованием одного цистеина или его производного. В данной реакции сульфид добавляют, в частности, в количестве от 0,1 до 3 молярных эквивалентов и, в частности, от 1 до 2 молярных эквивалентов, в зависимости от молярной концентрации ОФС, без ограничения.
Кроме того, способ по настоящему изобретению может дополнительно включать выделение цистеина, полученного на вышеупомянутой реакционной стадии. В частности, необходимый цистеин может быть выделен путем разделения и очистки из реакционного раствора с использованием подходящей реакции, известной в области техники.
В еще одном аспекте настоящего изобретения в настоящем изобретении предложено применение полипептида, обладающего О фосфосерин-экспортирующей активностью, содержащего а) замену изолейцина (I) в положении, соответствующем 241 в аминокислотной последовательности SEQ ID NO: 11, на треонин (Т), замену аспарагиновой кислоты (D) в положении, соответствующем 246 в аминокислотной последовательности SEQ ID NO: 11, на валин (V), и замену валина (V) в положении, соответствующем 330 в аминокислотной последовательности SEQ ID NO: 11, на изолейцин (I), и имеющего аминокислотную последовательность, где b) аминокислота в положении, соответствующем 88, представляет собой фенилаланин и с) аминокислота в положении, соответствующем 207, представляет собой лизин (K), или полипептида, обладающего О-фосфосерин-экспортирующей активностью, имеющего аминокислотную последовательность SEQ ID NO: 1, для получения О-фосфосерина, цистеина или производных цистеина.
В еще одном аспекте настоящего изобретения в настоящем изобретении предложено применение полипептида, обладающего О-фосфосерин-экспортирующей активностью, содержащего а) замену изолейцина (I) в положении, соответствующем 241 в аминокислотной последовательности SEQ ID NO: 11, на треонин (Т), замену аспарагиновой кислоты (D) в положении, соответствующем 246 в аминокислотной последовательности SEQ ID NO: 11, на валин (V), и замену валина (V) в положении, соответствующем 330 в аминокислотной последовательности SEQ ID NO: 11, на изолейцин (I), и имеющего аминокислотную последовательность, где b) аминокислота в положении, соответствующем 88, представляет собой фенилаланин и с) аминокислота в положении, соответствующем 207, представляет собой лизин (K), или полипептида, обладающего О-фосфосерин-экспортирующей активностью, имеющего аминокислотную последовательность SEQ ID NO: 1 для экспортирования О-фосфосерина из микроорганизмов.
SEQ ID NO: 11, SEQ ID NO: 1, О-фосфосерин, цистеин, производное цистеина и микроорганизм являются такими, как описано выше.
ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Далее настоящее изобретение будет описано более подробно посредством примеров. Однако, данные Примеры являются лишь предпочтительными примерами, приведенными в целях иллюстрации и, следовательно, объем настоящего изобретения не ограничивается указанными Примерами. При этом, технические признаки, которые не описаны в настоящем документе, могут быть в достаточной степени поняты и легко реализованы специалистами в области техники, к которой относится настоящее изобретение, или в схожей области техники.
Пример 1. Получение вариантов переносчика YhhS суперсемейства MFS (Major Facilitator Superfamily)
Для того, чтобы улучшить активность экспортера О-фосфосерина (далее «ОФС») для улучшения ОФС-экспортирующей активности у ОФС-продуцирующего штамма получали варианты переносчика YhhS суперсемейства MFS (major facilitator superfamily) (SEQ ID NO: 11), экспортирующего ОФС белка, и кодирующего его гена yhhS (SEQ ID NO: 12). Способ подробно описан ниже.
Вначале конструировали библиотеку вариантов гена yhhS. С этой целью проводили случайный мутагенез посредством ПЦР (ПЦР сниженной точности от JENA) с использованием геноспецифической пары праймеров (SEQ ID NO: 13 и 14) с использованием в качестве матрицы геномной ДНК Escherichia coli K12_W3110 (АТСС27325). Проводили ПЦР с денатурацией при 94°С в течение 5 мин; последующих 20 циклов денатурации при 94°С в течение 30 сек, отжига при 55°С в течение 30 сек и полимеризации при 72°С в течение 1 мин; и затем полимеризацией при 72°С в течение 5 мин. Для встраивания полученных таким образом фрагментов мутантного гена в вектор pCL1920 с промотором rhtB вначале конструировали вектор pCL PrhtB. Осуществляли ПЦР с использованием геноспецифической пары праймеров (SEQ ID NO: 16 и 17) для обеспечения промотора rhtB (SEQ ID NO: 15). Проводили ПЦР с денатурацией при 94°С в течение 5 мин; последующих 30 циклов денатурации при 94°С в течение 30 сек, отжига при 55°С в течение 30 сек и полимеризации при 72°С в течение 1 мин; и затем полимеризацией при 72°С в течение 5 мин. Фрагмент промотора rhtB встраивали в вектор pCL1920 (GenBank No. АВ236930), разрезали SacI и SmaI с получением pCLPrhtB. Вектор pCLPrhtB разрезали SmaI и PstI, и затем в него клонировали фрагменты мутантного гена с использованием набора для клонирования Infusion (Clontech Laboratories, Inc.). Осуществляли клонирование при 50°С в течение 60 минут с конструированием таким образом плазмидных библиотек вариантов гена pCL PrhtB yhhS. Использованные последовательности праймеров приведены в Таблице 1 ниже.

Проводили скрининг сконструированных таким образом рекомбинантных плазмидных библиотек при помощи высокопроизводительного скрининга (HTS). В частности, платформенный штамм, использованный для скрининга, представлял собой СА07-0012 (KCCM11121P, US 8557549 В2), являющийся штаммом с ослабленной активностью эндогенной фосфосеринфосфатазы (SerB) на основе штамма Е. coli дикого типа W3110.
Затем для получения вариантов с улучшенной ОФС-экспортирующей активностью платформенный штамм СА07-0012 трансформировали сконструированными таким образом плазмидными библиотеками вариантов гена pCL_PrhtB-yhhS посредством электропорации, а затем культивировали в среде, содержащей избыточное количество ОФС и отбирали три колонии, освободившиеся от подавления роста. Затем из трех отобранных колоний получали плазмиды и анализировали при помощи технологии секвенирования.
Из них отбирали три варианта гена yhhS, задействованные в освобождении от подавления роста в условиях избыточного добавления ОФС, и получали вариант, превосходящий yhhS М45 (US 2019-0233859 А1), являющийся существующим вариантом гена yhhS с повышенной ОФС-экспортирующей активностью, и обозначали его yhhS453.
Путем анализа аминокислотной последовательности полипептида, кодируемого yhhS453, подтверждали, что YhhS453 имел аминокислотную последовательность SEQ ID NO: 1.
Пример 2. Подтверждение ОФС-экспортирующей активности варианта yhhS453 гена yhhS
2-1. Конструирование штамма с внедренным yhhS453 с использованием ОФС-продуцирующего штамма и оценка ОФС-продуцирующей способности
Одним вариантом плазмиды pCL_PrhtB-yhhS453, обнаруженным в Примере 1, трансформировали ОФС-продуцирующий штамм СА07-0012 посредством электропорации, традиционно используемой в данной области техники. Таким образом конструировали ОФС-продуцирующий штамм CA07-0012/pCL_PrhtB-yhhS453 с внедренными вариантами yhhS453 гена yhhS и оценивали его ОФС-продуцирующую способность.
В частности, каждый из штаммов высаживали на твердую среду LB и культивировали в инкубаторе при 33°С в течение ночи. Штаммами, которые культивировали на твердой среде LB в течение ночи, инокулировали в 25 мл среды, показанной в Таблице 2 ниже, и затем культивировали в инкубаторе при 33°С при скорости 200 об/мин в течение 48 часов. Результаты приведены в Таблице 3 ниже.
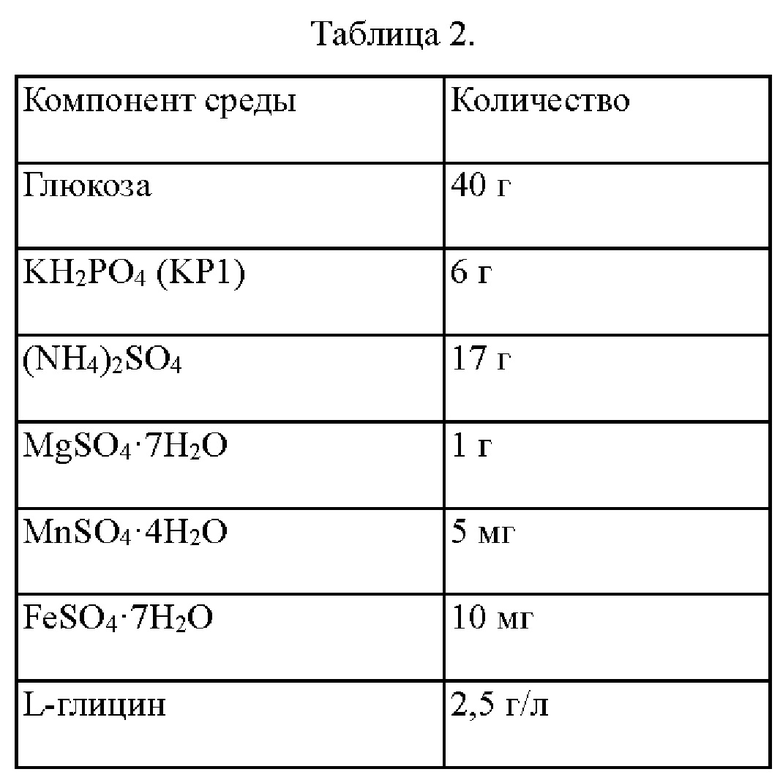
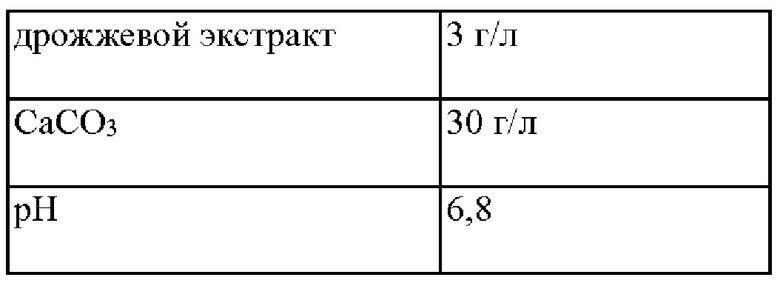

Как показано в Таблице 3, в случае штамма с внедренным вариантом гена yhhS' по настоящему изобретению, подтверждали, что количество продуцируемого ОФС повышалось по сравнению со штаммом с внедренным геном yhhS дикого типа. Кроме того, подтверждали, что количество продуцируемого ОФС повышалось по сравнению с yhhS М45, представляющим собой платформенный вариант гена yhhS. В частности, yhhS453 продемонстрировал, что концентрация ОФС повышалась на 82% по сравнению с yhhS дикого типа и на 35% по сравнению с yhhS М45, платформенным вариантом гена yhhS.
CA07-0012/pCL_PrhtB-yhhS453 получил название Escherichia coli СА07-0352, и штамм СА07-0352 депонировали в Центре культур микроорганизмов Кореи (KCCM) в соответствии с Будапештским Соглашением 14 мая 2020 под регистрационным номером KCCM12720P.
2-2. Конструирование штамма с внедренным yhhS453 с использованием штаммов с усиленными SerA и SerC и оценка ОФС-продуцирующей способности
Для повторного подтверждения активности yhhS453 использовали СА07-0022/pCL-Prmf-serA*(G336V)-serC (KCCM11103P, US 8557549 В2), который как ОФС-продуцирующий штамм с улучшенной ОФС-продуцирующей способностью, обладает усиленной активностью D-3-фосфоглицератдегидрогеназы (SerA) и 3-фосфосеринаминотрансферазы (SerC) как путей биосинтеза ОФС.
yhhS453 клонировали в сайт рестрикционного фермента HindIII вектора pCL_Prmf-serA*(G336V)-serC. Вначале проводили ПЦР с использованием пары праймеров с последовательностями SEQ ID NO: 18 и 19 с использованием в качестве матрицы pCL_PrhtB-yhhS453 для получения фрагмента гена yhhS453. Проводили ПЦР с денатурацией при 94°С в течение 5 мин; последующих 30 циклов денатурации при 94°С в течение 30 сек, отжига при 55°С в течение 30 сек и полимеризации при 72°С в течение 1 мин; и затем полимеризацией при 72°С в течение 5 мин. Фрагмент гена yhhS453, полученный посредством ПЦР, клонировали с использованием набора для клонирования In-fusion. Осуществляли клонирование при 50°С в течение 60 минут с конструированием таким образом варианта плазмиды pCL_Prmf-serA*(G336V)-(RBS)serC_PrhtB-yhhS. В качестве контроля использовали CA07-0022/pCL_Prmf-serA*(G336V)-(RBS)serC_PrhtB-yhhS M25 и CA07-0022/pCL_Prmf-serA*(G336V)-(RBS)serC_PrhtB-yhhS M45 (US 2019-0233859 A1). Использованные последовательности праймеров приведены в Таблице 4 ниже.
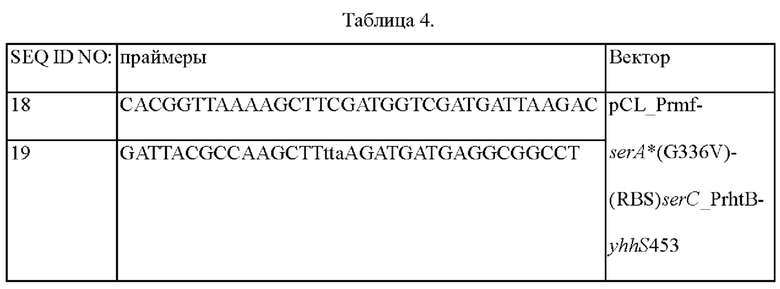
Каждой из полученных таким образом плазмид трансформировали ОФС-продуцирующий штамм СА07-0012 посредством электропорации, традиционно используемой в данной области техники. Таким образом конструировали ОФС-продуцирующий штамм CA07-0022/pCL_Prmf-serA*(G336V)-(RBS)serC_PrhtB-yhhS453 с внедренным вариантом yhhS453 гена yhhS и оценивали его ОФС-продуцирующую способность.
В частности, каждый из штаммов высаживали на твердую среду LB и затем культивировали в инкубаторе при 33°С в течение ночи. Штаммами, которые культивировали на твердой среде LB в течение ночи, инокулировали в 25 мл среды, показанной в Таблице 1 выше, и затем культивировали в инкубаторе при 33°С при скорости 200 об/мин в течение 48 часов. Результаты приведены в Таблице 5 ниже.
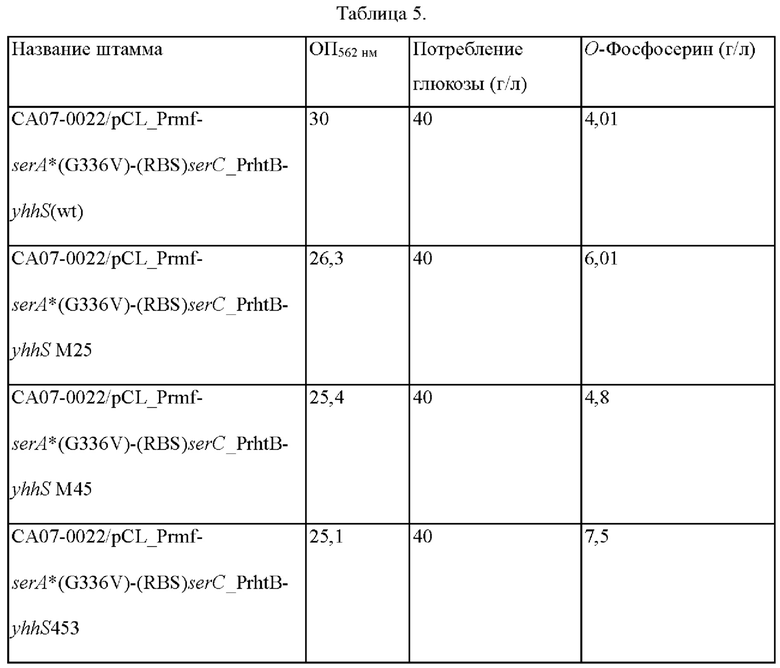
Как показано в Таблице 5, когда yhhS453 по настоящему изобретению внедряли в ОФС-продуцирующий штамм, в котором был усилен ген пути биосинтеза ОФС, подтверждали, что количество продуцируемого ОФС может улучшаться. Это позволяет предположить, что yhhS453 по настоящему изобретению можно эффективно применять для получения ОФС.
CA07-0022/pCL_Prmf-serA*(G336V)-(RBS)serC_PrhtB-yhhS453 обозначали Echerichia coli СА07-0353 и депонировали штамм СА07-0353 в Центре культур микроорганизмов Кореи (КССМ) в соответствии с Будапештским Соглашением 14 мая 2020 под регистрационным номером KCCM12721P.
2-3. Конструирование штамма с внедренным yhhS453 в зависимости от силы промотора на хромосоме и оценка ОФС-продуцирующей способности
Для подтверждения того, что внедрение yhhS453 в хромосому улучшало ОФС-экспортирующую активность, производили замену аутологичного промотора микроорганизма промотором trc и конструировали штамм с внедренным yhhS453 по настоящему изобретению и оценивали его ОФС-продуцирующую способность. В частности, для встраивания промотора trc в хромосому Е. coli использовали вектор pSKH130 (SEQ ID NO: 30). Указанный вектор содержал белок PI (ген pir)-зависимый репликон R6K, ген SacB (ген левансахаразы) и ген устойчивости к канамицину. После получения необходимого штамма с использованием R6K и канамицина при первом кроссовере с использованием вектора антибиотики удаляли из среды, содержащей сахарозу, для получения штамма. Более конкретно, конструировали вектор pSKH130_yhhS453, чтобы заменить аутологичный yhhS в штамме СА07-0022 на yhhS453. Для конструирования pSKH130-yhhS453 проводили ПЦР с использованием пары праймеров с последовательностями SEQ ID NO: 20 и 21 с использованием в качестве матрицы pCL_PrhtB-yhhS453, полученного в Примере 1, для получения фрагмента гена yhhS453. Проводили ПЦР с денатурацией при 94°С в течение 5 мин; последующих 30 циклов денатурации при 94°С в течение 30 сек, отжига при 55°С в течение 30 сек и полимеризации при 72°С в течение 1 мин; и затем полимеризацией при 72°С в течение 5 мин. Амплифицированный фрагмент гена клонировали с использованием вектора pSKH130, обработанного рестрикционным ферментом EcoRV и набора для клонирования In-fusion (Clontech Laboratories, Inc.) для получения pSK-yhhS453. Полученной плазмидой трансформировали штамм СА7-0022 посредством электропорации. Среди трансформированных штаммов отбирали штамм с внедрением в хромосому в результате рекомбинации (кроссовера) на твердой среде LB, содержащей канамицин, а затем вырезали сайт плазмиды из хромосомы посредством второй рекомбинации (замены) в среде, содержащей сахарозу. После завершения второй рекомбинации штамм использовали для проведения ПЦР с использованием пары праймеров с последовательностями SEQ ID NO: 22 и 23 и анализировали последовательность для конструирования штамма СА07-0022::yhhS453.
Конструировали PSKH130-Ptrc-yhhS453' для усиления промотора yhhS453 в сконструированном таким образом штамме СА07-0022::yhhS453. Более конкретно, проводили ПЦР с использованием пары праймеров с последовательностями SEQ ID NO: 24 и 25 с использованием в качестве матрицы штамма Е. coli дикого типа W3110 для получения фрагмента ДНК yhhSUP. Проводили ПЦР с денатурацией при 94°С в течение 5 мин; последующих 30 циклов денатурации при 94°С в течение 30 сек, отжига при 55°С в течение 30 сек и полимеризации при 72°С в течение 1 мин; и затем полимеризацией при 72°С в течение 5 мин. Затем проводили ПЦР с использованием пары праймеров с последовательностями SEQ ID NO: 26 и 27 с использованием в качестве матрицы pCL_Ptrc-gfp (US 2017-0247727 А1) для получения фрагмента ДНК Ptrc. Проводили ПЦР с денатурацией при 94°С в течение 5 мин; последующих 30 циклов денатурации при 94°С в течение 30 сек, отжига при 55°С в течение 30 сек и полимеризации при 72°С в течение 1 мин; и затем полимеризацией при 72°С в течение 5 мин. Затем проводили ПЦР с использованием пары праймеров с последовательностями SEQ ID NO: 28 и 29 с использованием в качестве матрицы pCL_PrhtB-yhhS453 для получения фрагмента гена yhhS453. Проводили ПЦР с денатурацией при 94°С в течение 5 мин; последующих 30 циклов денатурации при 94°С в течение 30 сек, отжига при 55°С в течение 30 сек и полимеризации при 72°С в течение 1 мин; и затем полимеризацией при 72°С в течение 5 мин. Амплифицированные фрагменты гена клонировали с использованием вектора pSKH130, обработанного рестрикционным ферментом EcoRV и IST для получения pSKH_yhhSUP_Ptrc-yhhS453. Полученной плазмидой трансформировали штамм СА7-0022::yhhS453 посредством электропорации. Среди трансформированных штаммов отбирали штамм с внедрением в хромосому в результате рекомбинации (кроссовера) на твердой среде LB, содержащей канамицин, а затем вырезали сайт плазмиды из хромосомы посредством второй рекомбинации (замены) в среде, содержащей сахарозу. После завершения второй рекомбинации штамм верифицировали с использованием пары праймеров с последовательностями SEQ ID NO: 22 и 23. Сконструированный штамм обозначали CA07-0022::Ptrc-yhhS453. Использованные последовательности праймеров приведены в Таблице 6 ниже.
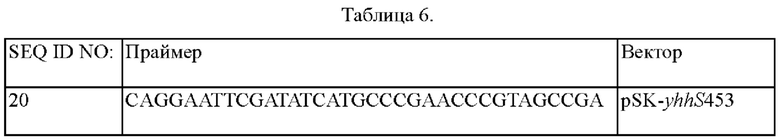

В качестве контрольной группы использовали сконструированные таким же образом CA07-0022::Ptrc-yhhS, CA07-0022::Ptrc-yhhS М25 и CA07-0022::Ptrc-yhhS М45. Нуклеотидные последовательности праймеров, использованных для ПЦР, были такими же, как описано выше. Для подтверждения ОФС-продуцирующей способности полученный таким образом штамм трансформировали путем внедрения вектора pCL_Prmf-serA*(G336V)-(RBS)serC. усиленного serA и serC, посредством электропорации, стандартно используемой в области техники.
Каждый из штаммов высаживали на твердую среду LB и затем культивировали в инкубаторе при 33°С в течение ночи. Штаммами, которые культивировали на твердой среде LB в течение ночи, инокулировали в 25 мл среды, показанной в Таблице 1 выше, и затем культивировали в инкубаторе при 33°С при скорости 200 об/мин в течение 48 часов. Результаты приведены в Таблице 7 ниже.
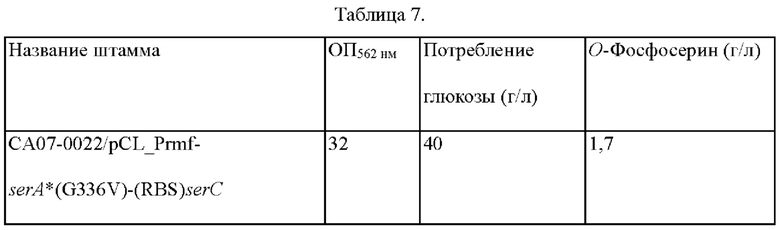
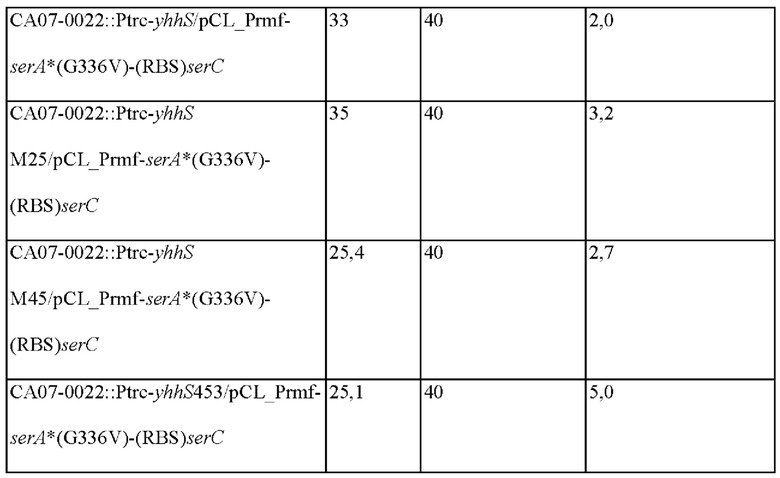
Как показано в Таблице 7 выше, когда активность yhhS453 повышалась в результате усиления промотора на хромосоме, подтверждали, что количество продуцируемого ОФС повышалось более чем двукратно по сравнению со штаммом с внедренным yhhS дикого типа, и также подтверждали, что концентрация ОФС была существенно выше по сравнению с другими вариантами гена yhhS М45 и М25.
Специалистам в области техники очевидно, что возможны и другие конкретные воплощения настоящего изобретения, без отклонения от его сущности или существенных характеристик. Описанные воплощения следует считать только иллюстративными во всех отношениях, но не ограничивающими изобретение. Таким образом, объем настоящего изобретения определяется представленной формулой изобретения, а не описанием, приведенным выше. Все изменения, охватываемые значениями и диапазоном эквивалентности формулы изобретения, следует считать входящими в объем настоящего изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> CJ CheilJedang Corporation
<120> Вариант белка, экспортирующего O-фосфосерин, и способ получения
O-фосфосерина, цистеина и его производных с его использованием
<130> OPA21198
<150> KR 10-2020-0069753
<151> 2020-06-09
<160> 30
<170> KoPatentIn 3.0
<210> 1
<211> 405
<212> PRT
<213> Artificial Sequence
<220>
<223> yhhS453
<400> 1
Met Pro Glu Pro Val Ala Glu Pro Ala Leu Asn Gly Leu Arg Leu Asn
1 5 10 15
Leu Arg Ile Val Ser Ile Val Met Phe Asn Phe Ala Ser Tyr Leu Thr
20 25 30
Ile Gly Leu Pro Leu Ala Val Leu Pro Gly Tyr Val His Asp Val Met
35 40 45
Gly Phe Ser Ala Phe Trp Ala Gly Leu Val Ile Ser Leu Gln Tyr Phe
50 55 60
Ala Thr Leu Leu Ser Arg Pro His Ala Gly Arg Tyr Ala Asp Ser Leu
65 70 75 80
Gly Pro Lys Lys Ile Val Val Phe Gly Leu Cys Gly Cys Phe Leu Ser
85 90 95
Gly Leu Gly Tyr Leu Thr Ala Gly Leu Thr Ala Ser Leu Pro Val Ile
100 105 110
Ser Leu Leu Leu Leu Cys Leu Gly Arg Val Ile Leu Gly Ile Gly Gln
115 120 125
Ser Phe Ala Gly Thr Gly Ser Thr Leu Trp Gly Val Gly Val Val Gly
130 135 140
Ser Leu His Ile Gly Arg Val Ile Ser Trp Asn Gly Ile Val Thr Tyr
145 150 155 160
Gly Ala Met Ala Met Gly Ala Pro Leu Gly Val Val Phe Tyr His Trp
165 170 175
Gly Gly Leu Gln Ala Leu Ala Leu Ile Ile Met Gly Val Ala Leu Val
180 185 190
Ala Ile Leu Leu Ala Ile Pro Arg Pro Thr Val Lys Ala Ser Lys Gly
195 200 205
Lys Pro Leu Pro Phe Arg Ala Val Leu Gly Arg Val Trp Leu Tyr Gly
210 215 220
Met Ala Leu Ala Leu Ala Ser Ala Gly Phe Gly Val Ile Ala Thr Phe
225 230 235 240
Thr Thr Leu Phe Tyr Val Ala Lys Gly Trp Asp Gly Ala Ala Phe Ala
245 250 255
Leu Thr Leu Phe Ser Cys Ala Phe Val Gly Thr Arg Leu Leu Phe Pro
260 265 270
Asn Gly Ile Asn Arg Ile Gly Gly Leu Asn Val Ala Met Ile Cys Phe
275 280 285
Ser Val Glu Ile Ile Gly Leu Leu Leu Val Gly Val Ala Thr Met Pro
290 295 300
Trp Met Ala Lys Ile Gly Val Leu Leu Ala Gly Ala Gly Phe Ser Leu
305 310 315 320
Val Phe Pro Ala Leu Gly Val Val Ala Ile Lys Ala Val Pro Gln Gln
325 330 335
Asn Gln Gly Ala Ala Leu Ala Thr Tyr Thr Val Phe Met Asp Leu Ser
340 345 350
Leu Gly Val Thr Gly Pro Leu Ala Gly Leu Val Met Ser Trp Ala Gly
355 360 365
Val Pro Val Ile Tyr Leu Ala Ala Ala Gly Leu Val Ala Ile Ala Leu
370 375 380
Leu Leu Thr Trp Arg Leu Lys Lys Arg Pro Pro Glu His Val Pro Glu
385 390 395 400
Ala Ala Ser Ser Ser
405
<210> 2
<211> 1218
<212> DNA
<213> Artificial Sequence
<220>
<223> yhhS453
<400> 2
atgcccgaac ccgtagccga acccgcgcta aacggattgc gcctgaattt gcgcattgtc 60
tctatagtca tgtttaactt cgccagctac ctcaccatcg ggttgccgct cgctgtatta 120
ccgggctatg tccatgatgt gatgggcttt agcgccttct gggcaggatt ggttatcagc 180
ctgcaatatt tcgccacctt gctgagccgc cctcatgccg gacgttacgc cgattcgctg 240
ggacccaaaa agattgtcgt cttcggttta tgcggctgct ttttgagcgg tctggggtat 300
ctgacggcag gattaaccgc cagtctgcct gtcatcagcc tgttattact ttgcctgggg 360
cgcgtcatcc ttgggattgg gcaaagtttt gccggaacgg gatcgaccct atggggcgtt 420
ggcgtggttg gctcgctgca tatcgggcgg gtgatttcgt ggaacggcat tgtcacttac 480
ggggcgatgg cgatgggtgc gccgttaggc gtcgtgtttt atcactgggg cggcttgcag 540
gcgttagcgt taatcattat gggcgtggcg ctggtggcca ttttgttggc gatcccgcgt 600
ccgacggtaa aagccagtaa aggcaaaccg ctgccgtttc gcgcggtgct tgggcgcgtc 660
tggctgtacg gtatggcgct ggcactggct tccgccggat ttggcgtcat cgccaccttt 720
accacgctgt tttatgtcgc taaaggttgg gacggtgcgg ctttcgcgct gacgctgttt 780
agctgtgcgt ttgtcggtac gcgtttgtta ttccctaacg gcattaaccg tatcggtggc 840
ttaaacgtag cgatgatttg ctttagcgtt gagataatcg gcctgctact ggttggcgtg 900
gcgactatgc cgtggatggc gaaaatcggc gtcttactgg cgggggccgg gttttcgctg 960
gtgttcccgg cattgggtgt agtggcgata aaagcggttc cgcagcaaaa tcagggggcg 1020
gcgctggcaa cttacaccgt atttatggat ttatcgcttg gcgtgactgg accactggct 1080
gggctggtga tgagctgggc gggcgtaccg gtgatttatc tggcggcggc gggactggtc 1140
gcaatcgcgt tattactgac gtggcgatta aaaaaacggc ctccggaaca cgtccctgag 1200
gccgcctcat catcttaa 1218
<210> 3
<211> 322
<212> PRT
<213> Artificial Sequence
<220>
<223> serB
<400> 3
Met Pro Asn Ile Thr Trp Cys Asp Leu Pro Glu Asp Val Ser Leu Trp
1 5 10 15
Pro Gly Leu Pro Leu Ser Leu Ser Gly Asp Glu Val Met Pro Leu Asp
20 25 30
Tyr His Ala Gly Arg Ser Gly Trp Leu Leu Tyr Gly Arg Gly Leu Asp
35 40 45
Lys Gln Arg Leu Thr Gln Tyr Gln Ser Lys Leu Gly Ala Ala Met Val
50 55 60
Ile Val Ala Ala Trp Cys Val Glu Asp Tyr Gln Val Ile Arg Leu Ala
65 70 75 80
Gly Ser Leu Thr Ala Arg Ala Thr Arg Leu Ala His Glu Ala Gln Leu
85 90 95
Asp Val Ala Pro Leu Gly Lys Ile Pro His Leu Arg Thr Pro Gly Leu
100 105 110
Leu Val Met Asp Met Asp Ser Thr Ala Ile Gln Ile Glu Cys Ile Asp
115 120 125
Glu Ile Ala Lys Leu Ala Gly Thr Gly Glu Met Val Ala Glu Val Thr
130 135 140
Glu Arg Ala Met Arg Gly Glu Leu Asp Phe Thr Ala Ser Leu Arg Ser
145 150 155 160
Arg Val Ala Thr Leu Lys Gly Ala Asp Ala Asn Ile Leu Gln Gln Val
165 170 175
Arg Glu Asn Leu Pro Leu Met Pro Gly Leu Thr Gln Leu Val Leu Lys
180 185 190
Leu Glu Thr Leu Gly Trp Lys Val Ala Ile Ala Ser Gly Gly Phe Thr
195 200 205
Phe Phe Ala Glu Tyr Leu Arg Asp Lys Leu Arg Leu Thr Ala Val Val
210 215 220
Ala Asn Glu Leu Glu Ile Met Asp Gly Lys Phe Thr Gly Asn Val Ile
225 230 235 240
Gly Asp Ile Val Asp Ala Gln Tyr Lys Ala Lys Thr Leu Thr Arg Leu
245 250 255
Ala Gln Glu Tyr Glu Ile Pro Leu Ala Gln Thr Val Ala Ile Gly Asp
260 265 270
Gly Ala Asn Asp Leu Pro Met Ile Lys Ala Ala Gly Leu Gly Ile Ala
275 280 285
Tyr His Ala Lys Pro Lys Val Asn Glu Lys Ala Glu Val Thr Ile Arg
290 295 300
His Ala Asp Leu Met Gly Val Phe Cys Ile Leu Ser Gly Ser Leu Asn
305 310 315 320
Gln Lys
<210> 4
<211> 969
<212> DNA
<213> Artificial Sequence
<220>
<223> serB
<400> 4
atgcctaaca ttacctggtg cgacctgcct gaagatgtct ctttatggcc gggtctgcct 60
ctttcattaa gtggtgatga agtgatgcca ctggattacc acgcaggtcg tagcggctgg 120
ctgctgtatg gtcgtgggct ggataaacaa cgtctgaccc aataccagag caaactgggt 180
gcggcgatgg tgattgttgc cgcctggtgc gtggaagatt atcaggtgat tcgtctggca 240
ggttcactca ccgcacgggc tacacgcctg gcccacgaag cgcagctgga tgtcgccccg 300
ctggggaaaa tcccgcacct gcgcacgccg ggtttgctgg tgatggatat ggactccacc 360
gccatccaga ttgaatgtat tgatgaaatt gccaaactgg ccggaacggg cgagatggtg 420
gcggaagtaa ccgaacgggc gatgcgcggc gaactcgatt ttaccgccag cctgcgcagc 480
cgtgtggcga cgctgaaagg cgctgacgcc aatattctgc aacaggtgcg tgaaaatctg 540
ccgctgatgc caggcttaac gcaactggtg ctcaagctgg aaacgctggg ctggaaagtg 600
gcgattgcct ccggcggctt tactttcttt gctgaatacc tgcgcgacaa gctgcgcctg 660
accgccgtgg tagccaatga actggagatc atggacggta aatttaccgg caatgtgatc 720
ggcgacatcg tagacgcgca gtacaaagcg aaaactctga ctcgcctcgc gcaggagtat 780
gaaatcccgc tggcgcagac cgtggcgatt ggcgatggag ccaatgacct gccgatgatc 840
aaagcggcag ggctggggat tgcctaccat gccaagccaa aagtgaatga aaaggcggaa 900
gtcaccatcc gtcacgctga cctgatgggg gtattctgca tcctctcagg cagcctgaat 960
cagaagtaa 969
<210> 5
<211> 410
<212> PRT
<213> Artificial Sequence
<220>
<223> SerA дикого типа
<400> 5
Met Ala Lys Val Ser Leu Glu Lys Asp Lys Ile Lys Phe Leu Leu Val
1 5 10 15
Glu Gly Val His Gln Lys Ala Leu Glu Ser Leu Arg Ala Ala Gly Tyr
20 25 30
Thr Asn Ile Glu Phe His Lys Gly Ala Leu Asp Asp Glu Gln Leu Lys
35 40 45
Glu Ser Ile Arg Asp Ala His Phe Ile Gly Leu Arg Ser Arg Thr His
50 55 60
Leu Thr Glu Asp Val Ile Asn Ala Ala Glu Lys Leu Val Ala Ile Gly
65 70 75 80
Cys Phe Cys Ile Gly Thr Asn Gln Val Asp Leu Asp Ala Ala Ala Lys
85 90 95
Arg Gly Ile Pro Val Phe Asn Ala Pro Phe Ser Asn Thr Arg Ser Val
100 105 110
Ala Glu Leu Val Ile Gly Glu Leu Leu Leu Leu Leu Arg Gly Val Pro
115 120 125
Glu Ala Asn Ala Lys Ala His Arg Gly Val Trp Asn Lys Leu Ala Ala
130 135 140
Gly Ser Phe Glu Ala Arg Gly Lys Lys Leu Gly Ile Ile Gly Tyr Gly
145 150 155 160
His Ile Gly Thr Gln Leu Gly Ile Leu Ala Glu Ser Leu Gly Met Tyr
165 170 175
Val Tyr Phe Tyr Asp Ile Glu Asn Lys Leu Pro Leu Gly Asn Ala Thr
180 185 190
Gln Val Gln His Leu Ser Asp Leu Leu Asn Met Ser Asp Val Val Ser
195 200 205
Leu His Val Pro Glu Asn Pro Ser Thr Lys Asn Met Met Gly Ala Lys
210 215 220
Glu Ile Ser Leu Met Lys Pro Gly Ser Leu Leu Ile Asn Ala Ser Arg
225 230 235 240
Gly Thr Val Val Asp Ile Pro Ala Leu Cys Asp Ala Leu Ala Ser Lys
245 250 255
His Leu Ala Gly Ala Ala Ile Asp Val Phe Pro Thr Glu Pro Ala Thr
260 265 270
Asn Ser Asp Pro Phe Thr Ser Pro Leu Cys Glu Phe Asp Asn Val Leu
275 280 285
Leu Thr Pro His Ile Gly Gly Ser Thr Gln Glu Ala Gln Glu Asn Ile
290 295 300
Gly Leu Glu Val Ala Gly Lys Leu Ile Lys Tyr Ser Asp Asn Gly Ser
305 310 315 320
Thr Leu Ser Ala Val Asn Phe Pro Glu Val Ser Leu Pro Leu His Gly
325 330 335
Gly Arg Arg Leu Met His Ile His Glu Asn Arg Pro Gly Val Leu Thr
340 345 350
Ala Leu Asn Lys Ile Phe Ala Glu Gln Gly Val Asn Ile Ala Ala Gln
355 360 365
Tyr Leu Gln Thr Ser Ala Gln Met Gly Tyr Val Val Ile Asp Ile Glu
370 375 380
Ala Asp Glu Asp Val Ala Glu Lys Ala Leu Gln Ala Met Lys Ala Ile
385 390 395 400
Pro Gly Thr Ile Arg Ala Arg Leu Leu Tyr
405 410
<210> 6
<211> 410
<212> PRT
<213> Artificial Sequence
<220>
<223> Мутантный SerA
<400> 6
Met Ala Lys Val Ser Leu Glu Lys Asp Lys Ile Lys Phe Leu Leu Val
1 5 10 15
Glu Gly Val His Gln Lys Ala Leu Glu Ser Leu Arg Ala Ala Gly Tyr
20 25 30
Thr Asn Ile Glu Phe His Lys Gly Ala Leu Asp Asp Glu Gln Leu Lys
35 40 45
Glu Ser Ile Arg Asp Ala His Phe Ile Gly Leu Arg Ser Arg Thr His
50 55 60
Leu Thr Glu Asp Val Ile Asn Ala Ala Glu Lys Leu Val Ala Ile Gly
65 70 75 80
Cys Phe Cys Ile Gly Thr Asn Gln Val Asp Leu Asp Ala Ala Ala Lys
85 90 95
Arg Gly Ile Pro Val Phe Asn Ala Pro Phe Ser Asn Thr Arg Ser Val
100 105 110
Ala Glu Leu Val Ile Gly Glu Leu Leu Leu Leu Leu Arg Gly Val Pro
115 120 125
Glu Ala Asn Ala Lys Ala His Arg Gly Val Trp Asn Lys Leu Ala Ala
130 135 140
Gly Ser Phe Glu Ala Arg Gly Lys Lys Leu Gly Ile Ile Gly Tyr Gly
145 150 155 160
His Ile Gly Thr Gln Leu Gly Ile Leu Ala Glu Ser Leu Gly Met Tyr
165 170 175
Val Tyr Phe Tyr Asp Ile Glu Asn Lys Leu Pro Leu Gly Asn Ala Thr
180 185 190
Gln Val Gln His Leu Ser Asp Leu Leu Asn Met Ser Asp Val Val Ser
195 200 205
Leu His Val Pro Glu Asn Pro Ser Thr Lys Asn Met Met Gly Ala Lys
210 215 220
Glu Ile Ser Leu Met Lys Pro Gly Ser Leu Leu Ile Asn Ala Ser Arg
225 230 235 240
Gly Thr Val Val Asp Ile Pro Ala Leu Cys Asp Ala Leu Ala Ser Lys
245 250 255
His Leu Ala Gly Ala Ala Ile Asp Val Phe Pro Thr Glu Pro Ala Thr
260 265 270
Asn Ser Asp Pro Phe Thr Ser Pro Leu Cys Glu Phe Asp Asn Val Leu
275 280 285
Leu Thr Pro His Ile Gly Gly Ser Thr Gln Glu Ala Gln Glu Asn Ile
290 295 300
Gly Leu Glu Val Ala Gly Lys Leu Ile Lys Tyr Ser Asp Asn Gly Ser
305 310 315 320
Thr Leu Ser Ala Val Asn Phe Pro Glu Val Ser Leu Pro Leu His Val
325 330 335
Gly Arg Arg Leu Met His Ile His Glu Asn Arg Pro Gly Val Leu Thr
340 345 350
Ala Leu Asn Lys Ile Phe Ala Glu Gln Gly Val Asn Ile Ala Ala Gln
355 360 365
Tyr Leu Gln Thr Ser Ala Gln Met Gly Tyr Val Val Ile Asp Ile Glu
370 375 380
Ala Asp Glu Asp Val Ala Glu Lys Ala Leu Gln Ala Met Lys Ala Ile
385 390 395 400
Pro Gly Thr Ile Arg Ala Arg Leu Leu Tyr
405 410
<210> 7
<211> 1233
<212> DNA
<213> Artificial Sequence
<220>
<223> SerA дикого типа
<400> 7
atggcaaagg tatcgctgga gaaagacaag attaagtttc tgctggtaga aggcgtgcac 60
caaaaggcgc tggaaagcct tcgtgcagct ggttacacca acatcgaatt tcacaaaggc 120
gcgctggatg atgaacaatt aaaagaatcc atccgcgatg cccacttcat cggcctgcga 180
tcccgtaccc atctgactga agacgtgatc aacgccgcag aaaaactggt cgctattggc 240
tgtttctgta tcggaacaaa ccaggttgat ctggatgcgg cggcaaagcg cgggatcccg 300
gtatttaacg caccgttctc aaatacgcgc tctgttgcgg agctggtgat tggcgaactg 360
ctgctgctat tgcgcggcgt gccggaagcc aatgctaaag cgcaccgtgg cgtgtggaac 420
aaactggcgg cgggttcttt tgaagcgcgc ggcaaaaagc tgggtatcat cggctacggt 480
catattggta cgcaattggg cattctggct gaatcgctgg gaatgtatgt ttacttttat 540
gatattgaaa ataaactgcc gctgggcaac gccactcagg tacagcatct ttctgacctg 600
ctgaatatga gcgatgtggt gagtctgcat gtaccagaga atccgtccac caaaaatatg 660
atgggcgcga aagaaatttc actaatgaag cccggctcgc tgctgattaa tgcttcgcgc 720
ggtactgtgg tggatattcc ggcgctgtgt gatgcgctgg cgagcaaaca tctggcgggg 780
gcggcaatcg acgtattccc gacggaaccg gcgaccaata gcgatccatt tacctctccg 840
ctgtgtgaat tcgacaacgt ccttctgacg ccacacattg gcggttcgac tcaggaagcg 900
caggagaata tcggcctgga agttgcgggt aaattgatca agtattctga caatggctca 960
acgctctctg cggtgaactt cccggaagtc tcgctgccac tgcacggtgg gcgtcgtctg 1020
atgcacatcc acgaaaaccg tccgggcgtg ctaactgcgc tgaacaaaat cttcgccgag 1080
cagggcgtca acatcgccgc gcaatatctg caaacttccg cccagatggg ttatgtggtt 1140
attgatattg aagccgacga agacgttgcc gaaaaagcgc tgcaggcaat gaaagctatt 1200
ccgggtacca ttcgcgcccg tctgctgtac taa 1233
<210> 8
<211> 1233
<212> DNA
<213> Artificial Sequence
<220>
<223> Мутантный SerA
<400> 8
atggcaaagg tatcgctgga gaaagacaag attaagtttc tgctggtaga aggcgtgcac 60
caaaaggcgc tggaaagcct tcgtgcagct ggttacacca acatcgaatt tcacaaaggc 120
gcgctggatg atgaacaatt aaaagaatcc atccgcgatg cccacttcat cggcctgcga 180
tcccgtaccc atctgactga agacgtgatc aacgccgcag aaaaactggt cgctattggc 240
tgtttctgta tcggaacaaa ccaggttgat ctggatgcgg cggcaaagcg cgggatcccg 300
gtatttaacg caccgttctc aaatacgcgc tctgttgcgg agctggtgat tggcgaactg 360
ctgctgctat tgcgcggcgt gccggaagcc aatgctaaag cgcaccgtgg cgtgtggaac 420
aaactggcgg cgggttcttt tgaagcgcgc ggcaaaaagc tgggtatcat cggctacggt 480
catattggta cgcaattggg cattctggct gaatcgctgg gaatgtatgt ttacttttat 540
gatattgaaa ataaactgcc gctgggcaac gccactcagg tacagcatct ttctgacctg 600
ctgaatatga gcgatgtggt gagtctgcat gtaccagaga atccgtccac caaaaatatg 660
atgggcgcga aagaaatttc actaatgaag cccggctcgc tgctgattaa tgcttcgcgc 720
ggtactgtgg tggatattcc ggcgctgtgt gatgcgctgg cgagcaaaca tctggcgggg 780
gcggcaatcg acgtattccc gacggaaccg gcgaccaata gcgatccatt tacctctccg 840
ctgtgtgaat tcgacaacgt ccttctgacg ccacacattg gcggttcgac tcaggaagcg 900
caggagaata tcggcctgga agttgcgggt aaattgatca agtattctga caatggctca 960
acgctctctg cggtgaactt cccggaagtc tcgctgccac tgcacgttgg gcgtcgtctg 1020
atgcacatcc acgaaaaccg tccgggcgtg ctaactgcgc tgaacaaaat cttcgccgag 1080
cagggcgtca acatcgccgc gcaatatctg caaacttccg cccagatggg ttatgtggtt 1140
attgatattg aagccgacga agacgttgcc gaaaaagcgc tgcaggcaat gaaagctatt 1200
ccgggtacca ttcgcgcccg tctgctgtac taa 1233
<210> 9
<211> 362
<212> PRT
<213> Artificial Sequence
<220>
<223> SerC
<400> 9
Met Ala Gln Ile Phe Asn Phe Ser Ser Gly Pro Ala Met Leu Pro Ala
1 5 10 15
Glu Val Leu Lys Gln Ala Gln Gln Glu Leu Arg Asp Trp Asn Gly Leu
20 25 30
Gly Thr Ser Val Met Glu Val Ser His Arg Gly Lys Glu Phe Ile Gln
35 40 45
Val Ala Glu Glu Ala Glu Lys Asp Phe Arg Asp Leu Leu Asn Val Pro
50 55 60
Ser Asn Tyr Lys Val Leu Phe Cys His Gly Gly Gly Arg Gly Gln Phe
65 70 75 80
Ala Ala Val Pro Leu Asn Ile Leu Gly Asp Lys Thr Thr Ala Asp Tyr
85 90 95
Val Asp Ala Gly Tyr Trp Ala Ala Ser Ala Ile Lys Glu Ala Lys Lys
100 105 110
Tyr Cys Thr Pro Asn Val Phe Asp Ala Lys Val Thr Val Asp Gly Leu
115 120 125
Arg Ala Val Lys Pro Met Arg Glu Trp Gln Leu Ser Asp Asn Ala Ala
130 135 140
Tyr Met His Tyr Cys Pro Asn Glu Thr Ile Asp Gly Ile Ala Ile Asp
145 150 155 160
Glu Thr Pro Asp Phe Gly Ala Asp Val Val Val Ala Ala Asp Phe Ser
165 170 175
Ser Thr Ile Leu Ser Arg Pro Ile Asp Val Ser Arg Tyr Gly Val Ile
180 185 190
Tyr Ala Gly Ala Gln Lys Asn Ile Gly Pro Ala Gly Leu Thr Ile Val
195 200 205
Ile Val Arg Glu Asp Leu Leu Gly Lys Ala Asn Ile Ala Cys Pro Ser
210 215 220
Ile Leu Asp Tyr Ser Ile Leu Asn Asp Asn Gly Ser Met Phe Asn Thr
225 230 235 240
Pro Pro Thr Phe Ala Trp Tyr Leu Ser Gly Leu Val Phe Lys Trp Leu
245 250 255
Lys Ala Asn Gly Gly Val Ala Glu Met Asp Lys Ile Asn Gln Gln Lys
260 265 270
Ala Glu Leu Leu Tyr Gly Val Ile Asp Asn Ser Asp Phe Tyr Arg Asn
275 280 285
Asp Val Ala Lys Ala Asn Arg Ser Arg Met Asn Val Pro Phe Gln Leu
290 295 300
Ala Asp Ser Ala Leu Asp Lys Leu Phe Leu Glu Glu Ser Phe Ala Ala
305 310 315 320
Gly Leu His Ala Leu Lys Gly His Arg Val Val Gly Gly Met Arg Ala
325 330 335
Ser Ile Tyr Asn Ala Met Pro Leu Glu Gly Val Lys Ala Leu Thr Asp
340 345 350
Phe Met Val Glu Phe Glu Arg Arg His Gly
355 360
<210> 10
<211> 1089
<212> DNA
<213> Artificial Sequence
<220>
<223> SerC
<400> 10
atggctcaaa tcttcaattt tagttctggt ccggcaatgc taccggcaga ggtgcttaaa 60
caggctcaac aggaactgcg cgactggaac ggtcttggta cgtcggtgat ggaagtgagt 120
caccgtggca aagagttcat tcaggttgca gaggaagccg agaaggattt tcgcgatctt 180
cttaatgtcc cctccaacta caaggtatta ttctgccatg gcggtggtcg cggtcagttt 240
gctgcggtac cgctgaatat tctcggtgat aaaaccaccg cagattatgt tgatgccggt 300
tactgggcgg caagtgccat taaagaagcg aaaaaatact gcacgcctaa tgtctttgac 360
gccaaagtga ctgttgatgg tctgcgcgcg gttaagccaa tgcgtgaatg gcaactctct 420
gataatgctg cttatatgca ttattgcccg aatgaaacca tcgatggtat cgccatcgac 480
gaaacgccag acttcggcgc agatgtggtg gtcgccgctg acttctcttc aaccattctt 540
tcccgtccga ttgacgtcag ccgttatggt gtaatttacg ctggcgcgca gaaaaatatc 600
ggcccggctg gcctgacaat cgtcatcgtt cgtgaagatt tgctgggcaa agcgaatatc 660
gcgtgtccgt cgattctgga ttattccatc ctcaacgata acggctccat gtttaacacg 720
ccgccgacat ttgcctggta tctatctggt ctggtcttta aatggctgaa agcgaacggc 780
ggtgtagctg aaatggataa aatcaatcag caaaaagcag aactgctata tggggtgatt 840
gataacagcg atttctaccg caatgacgtg gcgaaagcta accgttcgcg gatgaacgtg 900
ccgttccagt tggcggacag tgcgcttgac aaattgttcc ttgaagagtc ttttgctgct 960
ggccttcatg cactgaaagg tcaccgtgtg gtcggcggaa tgcgcgcttc tatttataac 1020
gccatgccgc tggaaggcgt taaagcgctg acagacttca tggttgagtt cgaacgccgt 1080
cacggttaa 1089
<210> 11
<211> 405
<212> PRT
<213> Artificial Sequence
<220>
<223> yhhS MFS
<400> 11
Met Pro Glu Pro Val Ala Glu Pro Ala Leu Asn Gly Leu Arg Leu Asn
1 5 10 15
Leu Arg Ile Val Ser Ile Val Met Phe Asn Phe Ala Ser Tyr Leu Thr
20 25 30
Ile Gly Leu Pro Leu Ala Val Leu Pro Gly Tyr Val His Asp Val Met
35 40 45
Gly Phe Ser Ala Phe Trp Ala Gly Leu Val Ile Ser Leu Gln Tyr Phe
50 55 60
Ala Thr Leu Leu Ser Arg Pro His Ala Gly Arg Tyr Ala Asp Ser Leu
65 70 75 80
Gly Pro Lys Lys Ile Val Val Phe Gly Leu Cys Gly Cys Phe Leu Ser
85 90 95
Gly Leu Gly Tyr Leu Thr Ala Gly Leu Thr Ala Ser Leu Pro Val Ile
100 105 110
Ser Leu Leu Leu Leu Cys Leu Gly Arg Val Ile Leu Gly Ile Gly Gln
115 120 125
Ser Phe Ala Gly Thr Gly Ser Thr Leu Trp Gly Val Gly Val Val Gly
130 135 140
Ser Leu His Ile Gly Arg Val Ile Ser Trp Asn Gly Ile Val Thr Tyr
145 150 155 160
Gly Ala Met Ala Met Gly Ala Pro Leu Gly Val Val Phe Tyr His Trp
165 170 175
Gly Gly Leu Gln Ala Leu Ala Leu Ile Ile Met Gly Val Ala Leu Val
180 185 190
Ala Ile Leu Leu Ala Ile Pro Arg Pro Thr Val Lys Ala Ser Lys Gly
195 200 205
Lys Pro Leu Pro Phe Arg Ala Val Leu Gly Arg Val Trp Leu Tyr Gly
210 215 220
Met Ala Leu Ala Leu Ala Ser Ala Gly Phe Gly Val Ile Ala Thr Phe
225 230 235 240
Ile Thr Leu Phe Tyr Asp Ala Lys Gly Trp Asp Gly Ala Ala Phe Ala
245 250 255
Leu Thr Leu Phe Ser Cys Ala Phe Val Gly Thr Arg Leu Leu Phe Pro
260 265 270
Asn Gly Ile Asn Arg Ile Gly Gly Leu Asn Val Ala Met Ile Cys Phe
275 280 285
Ser Val Glu Ile Ile Gly Leu Leu Leu Val Gly Val Ala Thr Met Pro
290 295 300
Trp Met Ala Lys Ile Gly Val Leu Leu Ala Gly Ala Gly Phe Ser Leu
305 310 315 320
Val Phe Pro Ala Leu Gly Val Val Ala Val Lys Ala Val Pro Gln Gln
325 330 335
Asn Gln Gly Ala Ala Leu Ala Thr Tyr Thr Val Phe Met Asp Leu Ser
340 345 350
Leu Gly Val Thr Gly Pro Leu Ala Gly Leu Val Met Ser Trp Ala Gly
355 360 365
Val Pro Val Ile Tyr Leu Ala Ala Ala Gly Leu Val Ala Ile Ala Leu
370 375 380
Leu Leu Thr Trp Arg Leu Lys Lys Arg Pro Pro Glu His Val Pro Glu
385 390 395 400
Ala Ala Ser Ser Ser
405
<210> 12
<211> 1218
<212> DNA
<213> Artificial Sequence
<220>
<223> yhhS
<400> 12
atgcccgaac ccgtagccga acccgcgcta aacggattgc gcctgaattt gcgcattgtc 60
tctatagtca tgtttaactt cgccagctac ctcaccatcg ggttgccgct cgctgtatta 120
ccgggctatg tccatgatgt gatgggcttt agcgccttct gggcaggatt ggttatcagc 180
ctgcaatatt tcgccacctt gctgagccgc cctcatgccg gacgttacgc cgattcgctg 240
ggacccaaaa agattgtcgt cttcggttta tgcggctgct ttttgagcgg tctggggtat 300
ctgacggcag gattaaccgc cagtctgcct gtcatcagcc tgttattact ttgcctgggg 360
cgcgtcatcc ttgggattgg gcaaagtttt gccggaacgg gatcgaccct atggggcgtt 420
ggcgtggttg gctcgctgca tatcgggcgg gtgatttcgt ggaacggcat tgtcacttac 480
ggggcgatgg cgatgggtgc gccgttaggc gtcgtgtttt atcactgggg cggcttgcag 540
gcgttagcgt taatcattat gggcgtggcg ctggtggcca ttttgttggc gatcccgcgt 600
ccgacggtaa aagccagtaa aggcaaaccg ctgccgtttc gcgcggtgct tgggcgcgtc 660
tggctgtacg gtatggcgct ggcactggct tccgccggat ttggcgtcat cgccaccttt 720
atcacgctgt tttatgacgc taaaggttgg gacggtgcgg ctttcgcgct gacgctgttt 780
agctgtgcgt ttgtcggtac gcgtttgtta ttccctaacg gcattaaccg tatcggtggc 840
ttaaacgtag cgatgatttg ctttagcgtt gagataatcg gcctgctact ggttggcgtg 900
gcgactatgc cgtggatggc gaaaatcggc gtcttactgg cgggggccgg gttttcgctg 960
gtgttcccgg cattgggtgt agtggcggta aaagcggttc cgcagcaaaa tcagggggcg 1020
gcgctggcaa cttacaccgt atttatggat ttatcgcttg gcgtgactgg accactggct 1080
gggctggtga tgagctgggc gggcgtaccg gtgatttatc tggcggcggc gggactggtc 1140
gcaatcgcgt tattactgac gtggcgatta aaaaaacggc ctccggaaca cgtccctgag 1200
gccgcctcat catcttaa 1218
<210> 13
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> pCL_PrhtB-yhhS library_F
<400> 13
caccgggagc ccgggatgcc cgaacccgta gccga 35
<210> 14
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> pCL_PrhtB-yhhS library_R
<400> 14
cttgcatgcc tgcagttaag atgatgaggc ggcct 35
<210> 15
<211> 341
<212> DNA
<213> Artificial Sequence
<220>
<223> Промотор rhtB
<400> 15
cgatggtcga tgattaagac atcaaacccc aaatggaaca ggtcataggc cagttccgca 60
tattttacgt agctctcaat acgccccggg cagatgacta ccacccggtc atggtgctgt 120
gcgcgaaaac ggacaaagcg caccggaatg tcatccacac cagtaaactc tgcttcatca 180
cgctgacgcc agaaatcagt cagcggtccc atggtaaaag cagcaaacgc gttttctctt 240
gtttcccagt ctttttgctg ctgaaacatc gggtaatctg cctcttaaac cacgtaaaat 300
cgtttttttt agcgtgcctg acacaacgct gcgacagtag c 341
<210> 16
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> pCL_PrhtB_F
<400> 16
cggggatcct ctagacgctt gctgcaactc tctca 35
<210> 17
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> pCL_PrhtB_R
<400> 17
tacgggttcg ggcatgatat ctttcctgtg tgaaa 35
<210> 18
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> pCL_Prmf-serA*(G336V)-(RBS)serC_PrhtB-yhhS453_F
<400> 18
cacggttaaa agcttcgatg gtcgatgatt aagac 35
<210> 19
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> pCL_Prmf-serA*(G336V)-(RBS)serC_PrhtB-yhhS453_R
<400> 19
gattacgcca agcttttaag atgatgaggc ggcct 35
<210> 20
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> pSK-yhhS453_F
<400> 20
caggaattcg atatcatgcc cgaacccgta gccga 35
<210> 21
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> pSK-yhhS453_R
<400> 21
gactagcgtg atatcttaag atgatgaggc ggcct 35
<210> 22
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> yhhS-out-F
<400> 22
atgtgaatct gtggattatt 20
<210> 23
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> yhhS-out-R
<400> 23
gttatggccg tttatcgaaa 20
<210> 24
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> W3110 yhhSUP_F
<400> 24
caggaattcg atatctcgct ccggcgacat atgca 35
<210> 25
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> W3110 yhhSUP_R
<400> 25
cagcaagcgg gtaccgagga tcaccacatt tttac 35
<210> 26
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> pCL_Ptrc-gfp_F
<400> 26
aatgtggtga tcctcggtac ccgcttgctg caact 35
<210> 27
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> pCL_Ptrc-gfp_R
<400> 27
tacgggttcg ggcatgatat ctttcctgtg tgaaa 35
<210> 28
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> pCL_PrhtB-yhhS453_F
<400> 28
cacaggaaag atatcatgcc cgaacccgta gccga 35
<210> 29
<211> 35
<212> DNA
<213> Artificial Sequence
<220>
<223> pCL_PrhtB-yhhS453_R
<400> 29
gactagcgtg atatcgcacc catcgccatc gcccc 35
<210> 30
<211> 4695
<212> DNA
<213> Artificial Sequence
<220>
<223> pSKH130
<400> 30
tcgaggccgc gattaaattc caacatggat gctgatttat atgggtataa atgggctcgc 60
gataatgtcg ggcaatcagg tgcgacaatc tatcgattgt atgggaagcc cgatgcgcca 120
gagttgtttc tgaaacatgg caaaggtagc gttgccaatg atgttacaga tgagatggtc 180
agactaaact ggctgacgga atttatgcct cttccgacca tcaagcattt tatccgtact 240
cctgatgatg catggttact caccactgcg atccccggga aaacagcatt ccaggtatta 300
gaagaatatc ctgattcagg tgaaaatatt gttgatgcgc tggcagtgtt cctgcgccgg 360
ttgcattcga ttcctgtttg taattgtcct tttaacagcg atcgcgtatt tcgtctcgct 420
caggcgcaat cacgaatgaa taacggtttg gttgatgcga gtgattttga tgacgagcgt 480
aatggctggc ctgttgaaca agtctggaaa gaaatgcata agcttttgcc attctcaccg 540
gattcagtcg tcactcatgg tgatttctca cttgataacc ttatttttga cgaggggaaa 600
ttaataggtt gtattgatgt tggacgagtc ggaatcgcag accgatacca ggatcttgcc 660
atcctatgga actgcctcgg tgagttttct ccttcattac agaaacggct ttttcaaaaa 720
tatggtattg ataatcctga tatgaataaa ttgcagtttc atttgatgct cgatgagttt 780
ttctaatcag aattggttaa ttggttgtaa cactggcaga gcattacgct gacttgacgg 840
gacggcggct ttgttgaata aatcgaactt ttgctgagtt gaaggatcag atcacgcatc 900
ttcccgacaa cgcagaccgt tccgtggcaa agcaaaagtt caaaatcacc aactggtcca 960
cctacaacaa agctctcatc aaccgtggct ccctcacttt ctggctggat gatggggcga 1020
ttcaggcctg gtatgagtca gcaacacctt cttcacgagg cagacctcag cgctcaaaga 1080
tgcaggggta aaagctaacc gcatctttac cgacaaggca tccggcagtt caacagatcg 1140
ggaagggctg gatttgctga ggatgaaggt ggaggaaggt gatgtcattc tggtgaagaa 1200
gctcgaccgt cttggccgcg acaccgccga catgatccaa ctgataaaag agtttgatgc 1260
tcagggtgta gcggttcggt ttattgacga cgggatcagt accgacggtg atatggggca 1320
aatggtggtc accgcgcgta atacgactca ctatagggcg aattggagct ccaccgcggt 1380
ggcggccgct ctagacttta cggtatcgcc gctcccgatt cgcagcgcat cgccttctat 1440
cgccttcttg acgagttctt ctgagcggga ctctggggtt cgctagagga tcgatccttt 1500
ttaacccatc acatatacct gccgttcact attatttagt gaaatgagat attatgatat 1560
tttctgaatt gtgattaaaa aggcaacttt atgcccatgc aacagaaact ataaaaaata 1620
cagagaatga aaagaaacag atagattttt tagttcttta ggcccgtagt ctgcaaatcc 1680
ttttatgatt ttctatcaaa caaaagagga aaatagacca gttgcaatcc aaacgagagt 1740
ctaatagaat gaggtcgaaa agtaaatcgc gcgggtttgt tactgataaa gcaggcaaga 1800
cctaaaatgt gtaaagggca aagtgtatac tttggcgtca ccccttacat attttaggtc 1860
tttttttatt gtgcgtaact aacttgccat cttcaaacag gagggctgga agaagcagac 1920
cgctaacaca gtacataaaa aaggagacat gaacgatgaa catcaaaaag tttgcaaaac 1980
aagcaacagt attaaccttt actaccgcac tgctggcagg aggcgcaact caagcgtttg 2040
cgaaagaaac gaaccaaaag ccatataagg aaacatacgg catttcccat attacacgcc 2100
atgatatgct gcaaatccct gaacagcaaa aaaatgaaaa atatcaagtt cctgaattcg 2160
attcgtccac aattaaaaat atctcttctg caaaaggcct ggacgtttgg gacagctggc 2220
cattacaaaa cgctgacggc actgtcgcaa actatcacgg ctaccacatc gtctttgcat 2280
tagccggaga tcctaaaaat gcggatgaca catcgattta catgttctat caaaaagtcg 2340
gcgaaacttc tattgacagc tggaaaaacg ctggccgcgt ctttaaagac agcgacaaat 2400
tcgatgcaaa tgattctatc ctaaaagacc aaacacaaga atggtcaggt tcagccacat 2460
ttacatctga cggaaaaatc cgtttattct acactgattt ctccggtaaa cattacggca 2520
aacaaacact gacaactgca caagttaacg tatcagcatc agacagctct ttgaacatca 2580
acggtgtaga ggattataaa tcaatctttg acggtgacgg aaaaacgtat caaaatgtac 2640
agcagttcat cgatgaaggc aactacagct caggcgacaa ccatacgctg agagatcctc 2700
actacgtaga agataaaggc cacaaatact tagtatttga agcaaacact ggaactgaag 2760
atggctacca aggcgaagaa tctttattta acaaagcata ctatggcaaa agcacatcat 2820
tcttccgtca agaaagtcaa aaacttctgc aaagcgataa aaaacgcacg gctgagttag 2880
caaacggcgc tctcggtatg attgagctaa acgatgatta cacactgaaa aaagtgatga 2940
aaccgctgat tgcatctaac acagtaacag atgaaattga acgcgcgaac gtctttaaaa 3000
tgaacggcaa atggtacctg ttcactgact cccgcggatc aaaaatgacg attgacggca 3060
ttacgtctaa cgatatttac atgcttggtt atgtttctaa ttctttaact ggcccataca 3120
agccgctgaa caaaactggc cttgtgttaa aaatggatct tgatcctaac gatgtaacct 3180
ttacttactc acacttcgct gtacctcaag cgaaaggaaa caatgtcgtg attacaagct 3240
atatgacaaa cagaggattc tacgcagaca aacaatcaac gtttgcgcca agcttcctgc 3300
tgaacatcaa aggcaagaaa acatctgttg tcaaagacag catccttgaa caaggacaat 3360
taacagttaa caaataaaaa cgcaaaagaa aatgccgatg ggtaccgagc gaaatgaccg 3420
accaagcgac gcccaacctg ccatcggatc ccccgggctg caggaattcg atatcacgct 3480
agtcgaccta gctagcatat ggggagatct actagtaaag catgccaatt ggtattctat 3540
agtgtcacct aaatcgtatg tgtatgatac ataaggttat gtattaattg tagccgcgtt 3600
ctaacgacaa tatgtacaag cctaattgtg tagcatctgg cttactgaag cagaccctat 3660
catctctctc gtaaactgcc gtcagagtcg gtttggttgg acgaaccttc tgagtttctg 3720
gtaacgccgt cccgcacccg gaaatggtca gcgaaccaat cagcagggtc atcgctagcc 3780
catggctaat tcccatgtca gccgttaagt gttcctgtgt cactcaaaat tgctttgaga 3840
ggctctaagg gcttctcagt gcgttacatc cctggcttgt tgtccacaac cgttaaacct 3900
taaaagcttt aaaagcctta tatattcttt tttttcttat aaaacttaaa accttagagg 3960
ctatttaagt tgctgattta tattaatttt attgttcaaa catgagagct tagtacgtga 4020
aacatgagag cttagtacgt tagccatgag agcttagtac gttagccatg agggtttagt 4080
tcgttaaaca tgagagctta gtacgttaaa catgagagct tagtacgtga aacatgagag 4140
cttagtacgt actatcaaca ggttgaactg ctgatcttca gatcctctac gccggacgca 4200
tcgtggccgg atcttgcggc cgcaaaaatt aaaaatgaag ttttaaatca atctaaagta 4260
tatatgagta aacttggtct gacagttacc aatgcttaat cagtgaggca ccaataactg 4320
ccttaaaaaa actagcgctg aggtctgcct cgtgaagaag gtgttgctga ctcataccag 4380
gcctgaatcg ccccatcatc cagccagaaa gtgagggagc cacggttgat gagagctttg 4440
ttgtaggtgg accagttggt gattttgaac ttttgctttg ccacggaacg gtctgcgttg 4500
tcgggaagat gcgtgatctg atccttcaac tcagcaaaag ttcgatttat tcaacaaagc 4560
cacgttgtgt ctcaaaatct ctgatgttac attgcacaag ataaaaatat atcatcatga 4620
acaataaaac tgtctgctta cataaacagt aatacaaggg gtgttatgag ccatattcaa 4680
cgggaaacgt cttgc 4695
<---
Изобретение относится к области биотехнологии, конкретно к варианту белка, экспортирующего О-фосфосерин (ОФС), и может быть использовано для получения O-фосфосерина, цистеина и производных цистеина в Escherichia coli. Предложен полипептид, обладающий ОФС-экспортирующей активностью и содержащий SEQ ID NO: 1 или идентичную ей на 90% или более аминокислотную последовательность, которая содержит а) замену изолейцина (I) в положении, соответствующем 241 в SEQ ID NO: 11, на треонин, замену аспарагиновой кислоты в положении, соответствующем 246 в SEQ ID NO: 11, на валин и замену валина в положении, соответствующем 330 в SEQ ID NO: 11, на изолейцин и имеет b) фенилаланин в положении, соответствующем 88, и c) лизин в положении, соответствующем 207. Изобретение обеспечивает повышение выхода ОФС в клетках Escherichia coli - продуцента ОФС. 10 н. и 4 з.п. ф-лы, 7 табл., 2 пр.
1. Полипептид, обладающий О-фосфосерин-экспортирующей активностью и содержащий аминокислотную последовательность SEQ ID NO: 1 или идентичную ей на 90% или более, которая содержит а) замену изолейцина (I) в положении, соответствующем 241 в аминокислотной последовательности SEQ ID NO: 11, на треонин (T), замену аспарагиновой кислоты (D) в положении, соответствующем 246 в аминокислотной последовательности SEQ ID NO: 11, на валин (V) и замену валина (V) в положении, соответствующем 330 в аминокислотной последовательности SEQ ID NO: 11, на изолейцин (I) и имеет аминокислотную последовательность, где b) аминокислота в положении, соответствующем 88, представляет собой фенилаланин и c) аминокислота в положении, соответствующем 207, представляет собой лизин (K).
2. Полипептид по п. 1, содержащий аминокислотную последовательность SEQ ID NO: 1.
3. Полинуклеотид, кодирующий полипептид по п. 1.
4. О-фосфосерин-продуцирующий микроорганизм, содержащий любое одно или более из полипептида по п. 1, полинуклеотида, кодирующего указанный полипептид, и вектора, содержащего указанный полинуклеотид, где указанный микроорганизм представляет собой Escherichia coli.
5. Микроорганизм по п. 4, у которого активность фосфосеринфосфатазы (SerB) дополнительно ослаблена по сравнению с ее эндогенной активностью.
6. Микроорганизм по п. 4, у которого активность фосфоглицератдегидрогеназы (SerA) или фосфосеринаминотрансферазы (SerC) дополнительно усилена по сравнению с ее эндогенной активностью.
7. Способ получения О-фосфосерина, включающий культивирование в среде О-фосфосерин-продуцирующего микроорганизма по п. 4 и выделение О-фосфосерина из культуральной среды или из микроорганизма.
8. Способ получения цистеина, включающий:
a) получение О-фосфосерина (ОФС) или содержащей его среды посредством способа по п. 7; и
b) проведение реакции между О-фосфосерином или содержащей его средой, полученных на стадии a), и сульфидом в присутствии О-фосфосеринсульфгидрилазы (ОФСС) или экспрессирующего ее микроорганизма.
9. Способ получения производного цистеина, включающий:
a) получение О-фосфосерина (ОФС) или содержащей его среды посредством способа по п. 7;
b) проведение реакции между О-фосфосерином или содержащей его средой, полученных на стадии a), и сульфидом в присутствии О-фосфосеринсульфгидрилазы (ОФСС) или экспрессирующего ее микроорганизма; и
c) превращение цистеина, полученного на стадии b), в производное цистеина.
10. Способ по п. 8, где сульфид представляет собой по меньшей мере один сульфид, выбранный из группы, состоящей из Na2S, NaSH, (NH4)2S, H2S и Na2S2O3.
11. Применение полипептида по п. 1 для получения О-фосфосерина.
12. Применение полипептида по п. 1 для получения цистеина.
13. Применение полипептида по п. 1 для получения производного цистеина.
14. Применение полипептида по п. 1 для высвобождения О-фосфосерина из О-фосфосерин-продуцирующего микроорганизма, где указанный микроорганизм представляет собой Escherichia coli.
| Новый вариант эффлюксного белка О-фосфосерина и способ продуцирования О-фосфосерина, цистеина и его производного с использованием этого варианта | 2016 |
|
RU2694589C1 |
| МИКРООРГАНИЗМ, ПРОДУЦИРУЮЩИЙ О-ФОСФОСЕРИН, И СПОСОБ ПОЛУЧЕНИЯ О-ФОСФОСЕРИНА ИЛИ L-ЦИСТЕИНА С ИСПОЛЬЗОВАНИЕМ ЭТОГО МИКРООРГАНИЗМА | 2015 |
|
RU2663726C1 |
| Способ изготовления собранной предварительно на колодке резиновой и матерчатой, с резиновой подошвой, обуви - прессованием и тепловой обработкой | 1926 |
|
SU37621A1 |
| GOUDE R | |||
| et al., Electroporation of Mycobacteria, Mycobacteria Protocols, Methods in Molecular Biology, 2009, v.465, р.203-215, с.203 | |||
| EP 3564359 A1, 06.11.2019. | |||
Авторы
Даты
2024-06-20—Публикация
2021-06-08—Подача