[Область техники]
Настоящее изобретение относится к продуцирующим L-глутаминовую кислоту микроорганизмам, содержащим белок SbtA или полинуклеотид, кодирующий белок SbtA, а также к способам получения L-глутаминовой кислоты с использованием указанных микроорганизмов.
[Предшествующий уровень техники]
L-глутаминовая кислота, представляющая собой типичную аминокислоту, получаемую путем ферментации, является одной из важных аминокислот, которые широко применяются в области пищевых продуктов благодаря своему уникальному характерному вкусу, а также в области медицинских продуктов и в области других кормов для животных. Известны способы получения L-глутаминовой кислоты с использованием микроорганизмов рода Corynebacterium, Escherichia coli, рода Bacillus, Streptomyces, Penicillium, Klebsiella, Erwinia или Pantoea и т.п. (патенты США №3220929 и 6682912).
В настоящее время проводятся различные исследования для разработки микроорганизмов и технологии процесса ферментации, которые обеспечивают получение L-глутаминовой кислоты с высокой эффективностью. Например, для повышения выработки L-глутаминовой кислоты в основном применяют подходы, специализированные для целевого вещества, такие как повышение экспрессии генов, кодирующих ферменты, участвующие в биосинтезе аминокислот, или удаление генов, которые не являются необходимыми для биосинтеза аминокислот, в микроорганизмах рода Corynebacterium (патенты США №9109242 В2 и 8030036 В2).
[Техническая проблема]
Авторы настоящего изобретения провели интенсивные исследования по получению L-глутаминовой кислоты в высокой концентрации, в результате которых разработали микроорганизм рода Corynebacterium, продуцирующий L-глутаминовую кислоту в высокой концентрации благодаря введению в него экзогенного белка, создав, таким образом, настоящее изобретение.
[Техническое решение]
Задачей настоящего изобретения является обеспечение рекомбинантного микроорганизма рода Corynebacterium, продуцирующего L-глутаминовую кислоту, где указанный рекомбинантный микроорганизм содержит белок SbtA или полинуклеотид, кодирующий указанный белок SbtA.
Задачей настоящего изобретения также является обеспечение способа получения L-глутаминовой кислоты, включающего культивирование в среде рекомбинантного микроорганизма рода Corynebacterium, продуцирующего L-глутаминовую кислоту, где указанный рекомбинантный микроорганизм содержит белок SbtA или полинуклеотид, кодирующий указанный белок SbtA.
[Полезные эффекты]
Рекомбинантный микроорганизм рода Corynebacterium, продуцирующий L-глутаминовую кислоту и содержащий белок SbtA или полинуклеотид, кодирующий указанный белок SbtA, может продуцировать L-глутаминовую кислоту с высоким выходом и, таким образом, может быть с успехом использован в промышленном производстве L-глутаминовой кислоты.
[Краткое описание графических материалов]
ФИГ. 1 представляет собой схематическое изображение плазмиды pDCM2.
[Лучший вариант]
Настоящее изобретение будет конкретно описано следующим образом. Каждое описание и воплощение, раскрытое в настоящем документе, также может быть применено к другим описаниям и воплощениям. То есть все комбинации различных элементов, раскрытые в настоящем документе, входят в объем настоящего изобретения. Кроме того, объем настоящего изобретения не ограничивается приведенным ниже конкретным описанием. Также специалисты в данной области техники обнаружат или будут способны установить, используя лишь стандартные эксперименты, многие эквиваленты для конкретных воплощений настоящего изобретения, описанных в настоящем документе. Подразумевается, что такие эквиваленты охватываются настоящим изобретением.
В соответствии с одним из аспектом настоящего изобретения предложен рекомбинантный микроорганизм рода Corynebacterium, продуцирующий L-глутаминовую кислоту, где указанный рекомбинантный микроорганизм содержит белок SbtA или полинуклеотид, кодирующий указанный белок SbtA.
В настоящем документе термин «белок SbtA» относится, в качестве одного из переносчиков бикарбоната, к одному из белков, участвующих в ускорении переработки диоксида углерода (СО2) путем стимулирования прохождения через мембраны бикарбоната НСО3-, для которого мембраны являются непроницаемыми, и экспрессирующихся для поглощения и эффективного использования диоксида углерода. Переносчики бикарбоната включают белок SbtA, белок BicA и т.п., которые транспортируют бикарбонат в клетки, что приводит к накоплению бикарбоната в клетках.
В настоящем изобретении белок SbtA может представлять собой белок, имеющий происхождение из микроорганизма, отличного от микроорганизма согласно настоящему изобретению, или может отличаться от белка, который изначально присутствует в микроорганизме согласно настоящему изобретению.
В настоящем изобретении белок SbtA может представлять собой белок, имеющий происхождение из цианобактерий, но не ограничивается этим. В частности, белок SbtA представлять собой белок, имеющий происхождение из микроорганизма рода Synechocystis, и, более конкретно, он может представлять собой белок, имеющий происхождение из Synechocystis sp.РСС 6803 или Synechocystis sp.РСС 6714.
Белок SbtA согласно настоящему изобретению может содержать аминокислотную последовательность, имеющую по меньшей мере 90% идентичности последовательностей с аминокислотной последовательностью SEQ ID NO: 1. Аминокислотная последовательность SEQ ID NO: 1 может быть получена из известной базы данных GenBank Национального института здравоохранения США (NIH). В частности, аминокислотная последовательность, имеющая по меньшей мере 90% идентичности с SEQ ID NO: 1 согласно настоящему изобретению, может представлять собой аминокислотную последовательность, имеющую гомологию или идентичность с SEQ ID NO: 1, составляющую по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 96,26%, по меньшей мере 97%, по меньшей мере 97,5%, по меньшей мере 97,7%, по меньшей мере 97,8%, по меньшей мере 98%, по меньшей мере 98,5%, по меньшей мере 98,7%, по меньшей мере по меньшей мере 98,8%, по меньшей мере 99%, по меньшей мере 99,5%, по меньшей мере 99,7% или по меньшей мере 99,8%, но менее 100%. Например, аминокислотная последовательность, имеющая по меньшей мере 90%, но менее 100% гомологии или идентичности с аминокислотной последовательностью SEQ ID NO: 1, может представлять собой аминокислотную последовательность SEQ ID NO: 30. Также очевидно, что, когда аминокислотная последовательность имеет такую гомологию или идентичность и демонстрирует активность, эквивалентную или соответствующую активности белка SbtA или переносчика бикарбоната, то белок, содержащий такую аминокислотную последовательность, также подпадает под определение белка SbtA согласно настоящему изобретению даже несмотря на то, что часть его аминокислотной последовательности содержит делецию, модификацию, консервативную замену или добавление.
Белок SbtA согласно настоящему изобретению может содержать аминокислотную последовательность, имеющую по меньшей мере 90% идентичности с аминокислотной последовательностью SEQ ID NO: 1. Кроме того, белок SbtA согласно настоящему изобретению может содержать, состоять из или состоять по существу из аминокислотной последовательности, имеющей по меньшей мере 90% идентичности с аминокислотной последовательностью SEQ ID NO: 1. Белок SbtA согласно настоящему изобретению не исключает добавление несмысловой последовательности до или после аминокислотной последовательности SEQ ID NO: 1 (то есть добавление последовательности, которая не изменяет функции белка, к N-концу и/или С-концу аминокислотной последовательности), или природную мутацию, или молчащую мутацию, или консервативную замену.
В белке SbtA термин «консервативная замена» относится к замене одной аминокислоты на другую аминокислоту, имеющую сходные структурные и/или химические свойства. Такая аминокислотная замена обычно может возникать на основании сходства полярности, заряда, растворимости, гидрофобности, гидрофильности и/или амфипатической природы остатков. Как правило, консервативная замена может иметь незначительное влияние или не иметь влияния на активность белка или полипептида.
В настоящем изобретении полинуклеотид, кодирующий белок SbtA, может представлять собой ген sbtA. Кроме того, полинуклеотид, кодирующий белок SbtA, может иметь происхождение из цианобактерий. В частности, полинуклеотид, кодирующий белок SbtA согласно настоящему изобретению, может содержать нуклеотидную последовательность, кодирующую аминокислотную последовательность, имеющую по меньшей мере 90% идентичности с аминокислотной последовательностью SEQ ID NO: 1. В частности, полинуклеотид, кодирующий белок SbtA согласно настоящему изобретению, может содержать нуклеотидную последовательность SEQ ID NO: 2, нуклеотидную последовательность SEQ ID NO: 31 или нуклеотидную последовательность, имеющую по меньшей мере 90% идентичности с указанными последовательностями и кодирующую аминокислотную последовательность, имеющую по меньшей мере 90% идентичности с аминокислотной последовательностью SEQ ID NO: 1, но не ограничивается этим. Полинуклеотид, содержащий нуклеотидную последовательность, кодирующую аминокислотную последовательность, имеющую по меньшей мере 90% идентичности с аминокислотной последовательностью SEQ ID NO: 1, может представлять собой полинуклеотид, содержащий нуклеотидную последовательность, кодирующую аминокислотную последовательность, имеющую по меньшей мере 90% идентичности с аминокислотной последовательностью SEQ ID NO: 1, или полинуклеотид, состоящий из или состоящий по существу из нуклеотидной последовательности, кодирующей аминокислотную последовательность, имеющую по меньшей мере 90% идентичности с аминокислотной последовательностью SEQ ID NO: 1.
В настоящем документе термин «полинуклеотид» относится к полимеру из нуклеотидов, в котором нуклеотидные мономеры соединены в форме цепи посредством ковалентных связей, и который представляет собой цепь ДНК, имеющую заданную или большую длину.
Очевидно, что, когда полинуклеотид содержит нуклеотидную последовательность SEQ ID NO: 2, нуклеотидную последовательность SEQ ID NO: 3, нуклеотидную последовательность SEQ ID NO: 31 или нуклеотидную последовательность, имеющую по меньшей мере 90% идентичности с указанными нуклеотидными последовательностями и кодирующую аминокислотную последовательность, имеющую по меньшей мере 90% идентичности с аминокислотной последовательностью SEQ ID NO: 1, то такой полинуклеотид подпадает под определение полинуклеотида согласно настоящему изобретению даже несмотря на присутствие делеции, модификации, консервативной замены или добавления в части каждой из указанных нуклеотидных последовательностей. В полинуклеотиде согласно настоящему изобретению термин «консервативная замена» относится к замене одного нуклеотида на другой нуклеотид, имеющий сходные структурные и/или химические свойства.
Полинуклеотид согласно настоящему изобретению может содержать различные модификации в его кодирующей области в тех пределах, в которых последовательность полинуклеотида не изменена вследствие вырожденности кодонов или при замене кодонов на предпочтительные для организма, в котором предполагается экспрессия полинуклеотида.
В частности, полинуклеотид согласно настоящему изобретению может представлять собой полинуклеотид, содержащий нуклеотидную последовательность SEQ ID NO: 2.
Кроме того, полинуклеотид согласно настоящему изобретению может содержать, без ограничения, любую полинуклеотидную последовательность, которая может гибридизоваться с зондом, получаемым из известной последовательности гена sbtA, например, последовательность, комплементарную части или всей нуклеотидной последовательности в жестких условиях, при этом указанная полинуклеотидная последовательность может повышать способность продуцировать L-глутаминовую кислоту не будучи природной последовательностью, присутствующей в микроорганизме для введения.
В качестве альтернативы, полинуклеотид согласно настоящему изобретению может содержать, без ограничения, любую последовательность, которая может гибридизоваться с зондом, получаемым из известной последовательности гена, например, последовательность, комплементарную части или всей полинуклеотидной последовательности согласно настоящему изобретению в жестких условиях. Термин «жесткое условие» относится к условию, которое обеспечивает специфичную гибридизацию между полинуклеотидами. Эти условия подробно описаны в литературе (см. J. Sambrook et al. Molecular Cloning, A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory press, Cold Spring Harbor, New York, 1989; F.M. Ausubel et al. Current Protocols in Molecular Biology, John Wiley & Sons, Inc., New York, 9.50-9.51, 11.7-11.8). Примеры жестких условий могут включать: условие, при котором полинуклеотиды, имеющие более высокую гомологию или идентичность, например, полинуклеотиды, имеющие по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 76%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% гомологии или идентичности гибридизуются друг с другом, но полинуклеотиды, имеющие более низкую гомологию или идентичность, не гибридизуются друг с другом; или условие, при котором промывку выполняют один раз, в частности два или три раза, при концентрации соли и температуре, составляющим 60°С, 1×раствор цитрата и хлорида натрия (SSC), 0,1% додецилсульфата натрия (SDS), в частности 60°С, 0,1×SSC, 0,1% SDS, и, более конкретно, 68°С, 0,1×SSC, 0,1% SDS, что соответствует условиям промывки для типичной гибридизации по Саузерну.
Для гибридизации требуются две нуклеиновые кислоты, имеющие комплементарные последовательности, хотя возможны ошибочные спаривания между нуклеотидами в зависимости от строгости гибридизации. Термин «комплементарный» используется для иллюстрации взаимосвязи между нуклеотидами, которые могут гибридизоваться друг с другом. Например, что касается ДНК, то аденин комплементарен тимину, а цитозин комплементарен гуанину. Таким образом, полинуклеотид согласно настоящему изобретению также может содержать не только по существу сходные последовательности нуклеиновых кислот, но также и выделенные фрагменты нуклеиновых кислот, комплементарные всей последовательности.
В частности, полинуклеотид, имеющий гомологию или идентичность с полинуклеотидом согласно настоящему изобретению, можно детектировать с использованием описанных выше условий и с использованием условий гибридизации, включая стадию гибридизации при Tm 55°С. Кроме того, значение Tm может составлять 60°С, 63°С или 65°С, но не ограничивается этим, и может регулироваться соответствующим образом в зависимости от цели специалистом в данной области техники.
Надлежащая строгость гибридизации полинуклеотидов зависит от длины полинуклеотидов и степени комплементарности между ними, и определяющие строгость переменные величины хорошо известны в данной области техники (например, Sambrook et al., см. выше).
В настоящем документе термин «гомология» или «идентичность» относится к степени сходства между двумя заданными аминокислотными последовательностями или нуклеотидными последовательностями и может быть выражен в процентах. Термины гомология и идентичность часто могут использоваться взаимозаменяемо.
Гомология или идентичность последовательностей консервативных полинуклеотидов или полипептидов может быть определена с использованием стандартного алгоритма выравнивания, и штрафы за пропуски, установленные по умолчанию в используемой программе, могут использоваться вместе. По существу, гомологичные или идентичные последовательности обычно могут гибридизоваться друг с другом полностью или частично в условиях умеренной или высокой жесткости. Очевидно, что гибридизация также включает гибридизацию с полинуклеотидом, содержащим обычные кодоны или кодоны, используемые с учетом вырожденности кодонов в полинуклеотиде.
Наличие гомологии, сходства или идентичности каких-либо двух полинуклеотидных или полипептидных последовательностей можно определить с использованием известного компьютерного алгоритма, такого как программа «FASTA», с использованием параметров по умолчанию, как описано в Pearson et al. (1988) Proc. Natl. Acad. Sci. USA 85:2444. В качестве альтернативы, это может быть определено с помощью алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48:443-453), который выполняется так же, как и в программе Нидлмана из Европейского открытого пакета программного обеспечения для молекулярной биологии (EMBOSS) (Rice et al. 2000, Trends Genet. 16:276-277) (версия 5.0.0 или более поздние версии) (включая программный пакет GCG (Devereux, J. et al. Nucleic Acids Research 12:387 (1984)), BLASTP, BLASTN, FASTA (Atschul, S.F. et al. J MOLEC BIOL 215:403 (1990); Guide to Huge Computers, Martin J. Bishop, ed., Academic Press, San Diego, 1994 и CARILLO et al. (1988) SIAM J Applied Math 48:1073). Например, гомология, сходство или идентичность могут быть определены с использованием алгоритмов BLAST или ClustalW Национального центра биотехнологической информации (NCBI).
Гомология, сходство или идентичность полинуклеотидов или полипептидов могут быть определены путем сравнения информации о последовательностях с помощью компьютерной программы GAP, например, Needleman et al. (1970), J Mol Biol. 48:443, как известно в Smith and Waterman, Adv. Appl. Math (1981) 2:482. Вкратце, программа GAP определяет гомологию, сходство или идентичность как значение, полученное путем деления числа одинаковым образом выравненных символов (то есть нуклеотидов или аминокислот) на общее количество символов в более короткой из двух последовательностей. Параметры по умолчанию для программы GAP могут включать: (1) унарную матрицу сравнения (содержащую значение 1 для идентичности и 0 для не идентичности) и взвешенную матрицу сравнения согласно Gribskov et al. (1986) Nucl. Acids Res. 14:6745, как раскрыто в Schwartz and Dayhoff, eds., Atlas Of Protein Sequence And Structure, National Biomedical Research Foundation, pp.353-358 (1979) (или версию матрицы замещения EMOSSS NUC4.4 NCBI);
(2) штраф за каждый пропуск 3,0 и дополнительный штраф за каждый символ в каждом пропуске 0,10 (или штраф за открытие пропуска 10 и штраф за продление пропуска 0,5); и
(3) отсутствие штрафа за внесение концевого пропуска.
Белок SbtA, содержащийся в рекомбинантном микроорганизме согласно настоящему изобретению, может быть экспрессирован в микроорганизме рода Corynebacterium с применением обычного способа, известного в данной области техники.
В настоящем документе термин «экспрессия» применительно к белку относится к состоянию, в котором целевой белок введен в микроорганизм или целевой белок модифицирован для экспрессии в микроорганизме. Для целей настоящего изобретения «целевой белок» может представлять собой описанный выше белок SbtA.
В настоящем документе термин «введение» применительно к белку относится к введению активности конкретного белка в микроорганизм, в котором отсутствует активность этого белка. Этот термин также может быть выражен как повышение активности конкретного белка в микроорганизме, в котором отсутствует активность этого белка.
Введение белка может быть осуществлено путем введения в клетку-хозяина экзогенного полинуклеотида, кодирующего белок, демонстрирующий эквивалентную целевому белку/сходную с целевым белком активность, или оптимизированного по кодонам полинуклеотида мутантного типа. Экзогенный полинуклеотид может быть применен без ограничений по его происхождению или последовательности при условии, что этот экзогенный полинуклеотид демонстрирует эквивалентную целевому белку/сходную с целевым белком активность. Кроме того, для оптимизации транскрипции и трансляции введенного экзогенного полинуклеотида в клетке-хозяине его кодон может быть оптимизирован и введен в клетку-хозяина. Введение может быть осуществлено с применением любого известного способа трансформации, выбранного соответствующим образом специалистом в данной области техники, и посредством экспрессии введенного полинуклеотида в клетке-хозяине продуцируется белок, активность которого может быть повышена.
В настоящем документе термин «повышение» активности полипептида относится к увеличению активности полипептида по сравнению с его эндогенной активностью. «Повышение» может использоваться взаимозаменяемо с терминами «активация», «повышающая регуляция», «сверхэкспрессия», «увеличение» и т.п. В настоящем документе «активация», «повышение», «повышающая регуляция», «сверхэкспрессия» и «увеличение» могут включать все из следующего: проявление изначально отсутствующей активности; или проявление активности, улучшенной по сравнению с эндогенной активностью или активностью до модификации. «Эндогенная активность» относится к активности конкретного полипептида, изначально присущей родительскому штамму до модификации, или активности немодифицированного микроорганизма, когда трансформация происходит вследствие генетической вариации, вызванной природными или искусственными факторами. Указанный термин может использоваться взаимозаменяемо с «активностью до модификации». «Повышение», «повышающая регуляция», «сверхэкспрессия» или «увеличение» активности полипептида по сравнению с его собственной активностью означает повышение активности и/или концентрации (уровня экспрессии) конкретного полипептида, изначально присущей родительскому штамму до модификации или немодифицированному микроорганизму.
Такое повышение может быть обеспечено путем введения экзогенного полипептида или повышения присущей полипептиду активности и/или его концентрации (уровня экспрессии). Повышение активности полипептида можно идентифицировать по увеличению степени активности или уровня экспрессии соответствующего полипептида или количества продукта, получаемого с помощью соответствующего полипептида.
Повышение активности полипептида может быть обеспечено путем применения различных способов, хорошо известных в данной области техники, и не ограничивается ими при условии, что активность целевого полипептида повышена по сравнению с микроорганизмом до модификации. В частности, можно использовать генетическую и/или белковую инженерию, хорошо известную специалисту в данной области техники, которая является стандартным методом молекулярной биологии, но не ограничиваясь этим (например, Sitnicka et al. Functional Analysis of Genes. Advances in Cell Biology. 2010, Vol. 2. 1-16, Sambrook et al. Molecular Cloning 2012 и т.д.).
В частности, повышение активности полипептида согласно настоящему изобретению может представлять собой:
1) увеличение числа внутриклеточных копий полинуклеотида, кодирующего полипептид;
2) замену области, регулирующей экспрессию гена, на хромосоме, кодирующей полипептид, на последовательность с высокой активностью;
3) модификацию нуклеотидной последовательности, кодирующей инициирующий кодон или область 5-UTR транскрипта гена, кодирующего полипептид;
4) модификацию аминокислотной последовательности полипептида для повышения активности полипептида;
5) модификацию полинуклеотидной последовательности, кодирующей полипептид, для повышения активности полипептида (например, модификацию полинуклеотидной последовательности гена полипептида, таким образом, чтобы он кодировал полипептид, модифицированный для повышения активности);
6) введение экзогенного полипептида, демонстрирующего активность целевого полипептида, или кодирующего его экзогенного полинуклеотида;
7) оптимизацию кодонов полинуклеотида, кодирующего полипептид;
8) модификацию или химическую модификацию подвергаемого воздействию участка, выбранного с помощью анализа третичной структуры полипептида; или
9) комбинацию двух или более пунктов, выбранных из пунктов (1)-(8), без ограничения конкретно ими.
Приведенные пункты более конкретно описаны следующим образом.
Увеличение числа внутриклеточных копий полинуклеотида, кодирующего полипептид, согласно пункту (1) может быть обеспечено путем введения в клетку-хозяина вектора, с которым функционально связан полинуклеотид, кодирующий соответствующий полипептид, и который может реплицироваться и функционировать независимо от хозяина. В качестве альтернативы, пункт (1) может быть обеспечен путем введения одной копии или двух или более копий полинуклеотида, кодирующего соответствующий полипептид, в хромосому клетки-хозяина. Введение в хромосому может быть осуществлено путем введения в клетку-хозяина вектора, способного встраивать полинуклеотид в хромосому клетки-хозяина, но не ограничивается этим.
Замена области, регулирующей экспрессию гена, на хромосоме, кодирующей полипептид, на последовательность с высокой активностью согласно пункту (2) может представлять собой, например, мутацию, вводимую в последовательность путем делеции, инсерции, неконсервативной или консервативной замены или их комбинации для дополнительного повышения активности регулирующей экспрессию области, либо замену последовательностью, обладающей более высокой активностью. Регулирующая экспрессию область может содержать, но не ограничивается конкретно этим, промотор, операторную последовательность, последовательность, кодирующую сайт связывания рибосомы, последовательность, регулирующую терминацию транскрипции и трансляции, и т.п. Например, замена может представлять собой замену исходного промотора на сильный промотор, но не ограничивается этим.
Известными примерами сильного промотора могут являться промоторы CJ1-CJ7 (US 7662943 В2), промотор lac, промотор trp, промотор trc, промотор tac, промотор PR фага лямбда, промотор PL фага лямбда, промотор tet, промотор gapA, промотор SPL7, промотор SPL13 (sm3) (US 10584338 В2), промотор 02 (US 10273491 В2), промотор tkt, промотор уссА и т.п., но не ограничиваются этим.
Модификация нуклеотидной последовательности, кодирующей инициирующий кодон или область 5'-UTR транскрипта гена, кодирующего полипептид, согласно пункту (3) может представлять собой, например, замену на нуклеотидную последовательность, кодирующую инициирующий кодон, обеспечивающий более высокую скорость экспрессии полипептида по сравнению с эндогенным инициирующим кодоном, но не ограничивается этим.
Модификация аминокислотной последовательности или полинуклеотидной последовательности согласно пунктам (4) и (5) может представлять собой мутацию, вводимую путем делеции, инсерции, неконсервативной или консервативной замены или их комбинации в аминокислотную последовательность полипептида или полинуклеотидную последовательность, кодирующую полипептид, для повышения активности полипептида, или замену на аминокислотную последовательность или полинуклеотидную последовательность, модифицированную для усиления активности, или на аминокислотную последовательность или полинуклеотидную последовательность, модифицированную для повышения активности, но не ограничивается этим. В частности, замена может быть осуществлена путем встраивания полинуклеотида в хромосому посредством гомологичной рекомбинации, но не ограничивается этим. Вектор, применяемый в настоящем изобретении, может дополнительно содержать селективный маркер для проверки встраивания в хромосому. Селективный маркер используют для отбора клеток, трансформированных вектором, то есть для подтверждения того, что целевая молекула нуклеиновой кислоты была встроена, и могут быть применены маркеры, которые обеспечивают селектируемые фенотипы (например, устойчивость к лекарственным средствам, ауксотрофию, устойчивость к цитотоксическим агентам, экспрессию поверхностно-модифицированных белков и т.д.). В условиях обработки селективными агентами только клетки, способные экспрессировать селективные маркеры, могут выживать или демонстрировать другие фенотипические признаки, что обеспечивает легкую селекцию трансформированных клеток.
Введение экзогенного полипептида, демонстрирующего активность целевого полипептида, согласно пункту (6) может представлять собой введение в клетку-хозяина экзогенного полинуклеотида, кодирующего полипептид, демонстрирующий эквивалентную целевому полипептиду/сходную с целевым полипептидом активность. Экзогенный полинуклеотид не имеет ограничений по его происхождению или последовательности при условии, что экзогенный полинуклеотид демонстрирует эквивалентную целевому полипептиду/сходную с целевым полипептидом активность. Введение может быть осуществлено с применением любого известного способа трансформации, выбранного соответствующим образом специалистом в данной области техники, и посредством экспрессии введенного полинуклеотида в клетке-хозяине продуцируется полипептид, активность которого может быть повышена.
Оптимизация кодонов полинуклеотида, кодирующего полипептид, согласно пункту (7) может представлять собой оптимизацию кодонов эндогенного полинуклеотида для увеличения его транскрипции или трансляции в клетке-хозяине или оптимизацию кодонов экзогенного полинуклеотида для оптимизации его транскрипции или трансляции в клетке-хозяине.
Модификация или химическая модификация подвергаемого воздействию участка, выбранного с помощью анализа третичной структуры полипептида, согласно пункту (8) может быть осуществлена, например, таким образом, что эталонные белки-кандидаты определяют в соответствии со степенью сходства последовательностей путем сравнения информации о последовательности подлежащего анализу полипептида с информацией о последовательностях белков, хранящейся в базе данных, подвергаемый воздействию участок, подлежащий модификации или химической модификации, выбирают путем идентификации структуры на основе кандидатов, и подвергаемый воздействию участок модифицируют или химически модифицируют.
Такое повышение активности полипептида может означать увеличение активности или концентрации (уровня экспрессии) соответствующего полипептида по сравнению с активностью или концентрацией полипептида, экспрессируемого в штаммах микроорганизмов дикого типа или немодифицированных штаммах; или увеличение количества продукта, получаемого с помощью соответствующего полипептида, но не ограничивается этим.
Модификация части или всего полинуклеотида в микроорганизме согласно настоящему изобретению может быть обусловлена: (а) редактированием генома с применением гомологичной рекомбинации или сконструированной нуклеазы (например, CRISPR-Cas9) с использованием вектора для хромосомного встраивания в микроорганизм и/или (б) обработку светом, таким как ультрафиолетовый свет и излучение, и/или химическими веществами, без ограничения этим. Способ модифицирования части или всего гена может включать способ с использованием технологии рекомбинантной ДНК. Например, нуклеотидная последовательность или вектор, содержащие нуклеотидную последовательность, гомологичную целевому гену, могут быть введены в микроорганизм для обеспечения гомологичной рекомбинации, приводящей к делеции части или всего гена. Вводимые нуклеотидная последовательность или вектор могут содержать доминантный селективный маркер, но не ограничиваются этим.
В настоящем документе термин «вектор» относится к конструкции ДНК, которая содержит целевую полинуклеотидную последовательность, функционально связанную с подходящей регуляторной последовательностью таким образом, что целевой ген может быть введен соответствующему хозяину. Регуляторная последовательность может содержать промотор, способный инициировать транскрипцию, любую операторную последовательность для регуляции транскрипции, последовательность для кодирования подходящего сайта связывания рибосомы с мРНК и последовательность для регуляции терминации транскрипции и трансляции. После трансформации в подходящего хозяина вектор может реплицироваться или функционировать независимо от генома хозяина, либо может интегрироваться в сам геном. Например, целевой полинуклеотид в хромосоме может быть заменен на модифицированный полинуклеотид с помощью вектора для хромосомного встраивания в клетку. Встраивание полинуклеотида в хромосому может быть осуществлено с использованием любого способа, известного в данной области техники, например, гомологичной рекомбинации, но не ограничивается этим.
Вектор согласно настоящему изобретению конкретно не ограничивается, и может быть использован любой вектор, известный в данной области техники. Примеры широко используемых векторов могут включать природные или рекомбинантные плазмиды, космиды, вирусы и бактериофаги. Например, в качестве фаговых векторов или космидных векторов могут быть использованы pWE15, М13, MBL3, MBL4, ГХII, ASHII, АРII, t10, t11, Charon4A, Charon21 А и т.п.; и векторы на основе pBR, pUC, pBluescriptII, pGEM, pTZ, pCL и pET могут быть использованы в качестве плазмидных векторов. В частности, может быть использован вектор pDZ, pACYC177, pACYC184, pCL, pECCG117, pUC19, pBR322, pMW118 или pCC1BAC. Более конкретно, вектор, применяемый в настоящем изобретении, может представлять собой pDCM2 (ФИГ. 1, SEQ ID NO: 32), сконструированный для встраивания и замены гена в хромосоме Corynebacterium, но не ограничивающийся конкретно этим, и может быть применен известный вектор экспрессии.
В настоящем документе термин «трансформация» означает, что вектор, содержащий полинуклеотид, кодирующий целевой белок, вводят в клетку-хозяина для экспрессии кодируемого полинуклеотидом белка в клетке-хозяине. Трансформированный полинуклеотид может включать любой полипептид, который может экспрессироваться в клетке-хозяине, независимо от того, встроен ли полинуклеотид в хромосому и расположен в ней или расположен вне хромосомы клетки-хозяина. Кроме того, полинуклеотид включает ДНК и РНК, кодирующие целевые белки. Полинуклеотид может быть введен в любой форме при условии, что он может быть введен в клетку-хозяина и экспрессирован в ней. Например, полинуклеотид может быть введен в форме экспрессионной кассеты, которая представляет собой генетическую конструкцию, содержащую все факторы, необходимые для автономной экспрессии. Экспрессионная кассета обычно может содержать промотор, функционально связанный с полинуклеотидом, сигнал терминации транскрипции, сайт связывания рибосомы и сигнал терминации трансляции. Экспрессионная кассета может находиться в форме вектора экспрессии, обеспечивающего автономную репликацию. Кроме того, полинуклеотид может быть введен введен в клетку-хозяина сам по себе и функционально связан с последовательностью, необходимой для экспрессии в клетке-хозяине, без ограничения этим.
В настоящем документе термин «функционально связанный» относится к функциональной связи между последовательностью гена и промоторной последовательностью для инициации и обеспечения транскрипции полинуклеотида, кодирующего целевой белок согласно настоящему изобретению.
Способ трансформации вектором согласно настоящему изобретению включает любой способ введения нуклеиновой кислоты в клетку, и любая подходящая стандартная методика, известная в данной области техники, может быть выбрана и выполнена в зависимости от клетки-хозяина. Примерами методик могут являться электропорация, осаждение фосфатом кальция (CaPO4), осаждение хлоридом кальция (CaCl2), микроинъекция, метод с использованием полиэтиленгликоля (PEG), метод с использованием DEAE (диэтиламиноэтил)-декстрана, метод катионных липосом, метод с использованием ацетата лития-DMSO (диметилсульфоксид) и т.п., но не ограничиваясь этим.
В настоящем документе термин «рекомбинантный микроорганизм» включает все микроорганизмы с искусственными генетическими модификациями и относится к микроорганизму, в котором конкретный механизм ослаблен или усилен вследствие встраивания экзогенного гена для экспрессии экзогенного белка или усиления или ослабления активности эндогенного гена и который может представлять собой микроорганизм, содержащий генетическую модификацию для получения целевого белка или продукта.
Например, рекомбинантный микроорганизм согласно настоящему изобретению может представлять собой: микроорганизм, генетически модифицированный с помощью любого из белка SbtA или полинуклеотида, кодирующего белок SbtA, и вектора, содержащего полинуклеотид; микроорганизм, модифицированный для экспрессии данного белка или полинуклеотида, кодирующего данный белок; рекомбинантный микроорганизм, экспрессирующий данный белок или кодирующий его полинуклеотид; или рекомбинантный микроорганизм, обладающий активностью данного белка, но не ограничивается этим.
Кроме того, рекомбинантный микроорганизм согласно настоящему изобретению может представлять собой микроорганизм, обладающий повышенной способностью продуцировать L-глутаминовую кислоту за счет дополнительного усиления активности некоторых белков в пути биосинтеза L-глутаминовой кислоты или дополнительного ослабления активности некоторых белков в пути деградации L-глутаминовой кислоты.
В частности, микроорганизм согласно настоящему изобретению может представлять собой микроорганизм с дополнительно ослабленной функцией белка OdhA. Более конкретно, микроорганизм согласно настоящему изобретению может представлять собой микроорганизм с делетированным геном OdhA. Последовательности белка OdhA могут быть получены из известной базы данных GenBank NCBI и, например, могут иметь номер доступа в базе данных GenBank WP 060564343.1, но не ограничиваются этим, и могут включать последовательности, демонстрирующие эквивалентную активность, без ограничения.
Ослабление функции белка OdhA или делеция гена OdhA являются лишь одним из примеров, и, не ограничиваясь этим, микроорганизм согласно настоящему изобретению может включать различные микроорганизмы, в которых повышена активность белков в пути биосинтеза L-глутаминовой кислоты или снижена активность белков в пути деградации L-глутаминовой кислоты.
В качестве еще одного примера, рекомбинантный микроорганизм согласно настоящему изобретению может быть использован в качестве родительского штамма микроорганизма, обработанного соединением для обеспечения продуцирования L-глутаминовой кислоты, и указанное соединение может представлять собой, в частности, N-метил-N'-нитро-N-нитрозогуанидин (NTG), но не ограничивается этим.
Для целей настоящего изобретения рекомбинантный микроорганизм согласно настоящему изобретению относится к микроорганизму с улучшенной способностью продуцировать L-глутаминовую кислоту по сравнению с родительским штаммом до модификации, или к немодифицированному микроорганизму. «Немодифицированный микроорганизм» не исключает штамм, содержащий встречающуюся в микроорганизмах природную мутацию, и может представлять собой природный микроорганизм как таковой, микроорганизм дикого типа как таковой, или микроорганизм до регуляции уровня экспрессии гена, участвующего в пути биосинтеза L-глутаминовой кислоты, или микроорганизм до введения гена sbtA, который эндогенно не присутствует.
В настоящем изобретении родительский штамм может представлять собой Corynebacterium glutamicum дикого типа АТСС13869, Corynebacterium glutamicum со сниженной функцией OdhA в Corynebacterium glutamicum АТСС13869, штамм с делетированным OdhA в Corynebacterium glutamicum АТСС13869 или Corynebacterium glutamicum BL2 (номер доступа KFCC-11074, патент Кореи №10-0292299), полученный путем обработки штамма Corynebacterium glutamicum KFCC 10656 мутагенным агентом, таким как N-метил-N'-нитро-N-нитрозогуанидин (NTG).
В настоящем документе термин «ослабление» полипептида имеет смысл, включающий снижение или отсутствие активности по сравнению с характерной для полипептида активностью. «Ослабление» может использоваться взаимозаменяемо с «инактивацией», «недостаточностью», «понижающей регуляцией», «уменьшением», «снижением», «ослаблением» и т.п.
Ослабление функции также может включать: случай, когда активность самого полипептида снижена или устранена по сравнению с активностью самого полипептида, которой обладает исходный микроорганизм, вследствие мутации полинуклеотида, кодирующего этот полипептид, или подобного мутации события; случай, когда активность и/или концентрация (уровень экспрессии) целых полипептидов в клетке снижена по сравнению с природным штаммом за счет ингибирования экспрессии гена полинуклеотида, кодирующего этот полипептид, или ингибирования трансляции в этот полипептид; случай, когда экспрессия полинуклеотида не происходит; и/или случай, когда полипептид не обладает активностью несмотря на экспрессию полинуклеотида. «Эндогенная активность» относится к активности конкретного полипептида, изначально присущего родительскому штамму до модификации, или микроорганизму дикого типа или немодифицированному микроорганизму, когда трансформация происходит вследствие генетической вариации, вызванной природными или искусственными факторами. Этот термин может использоваться взаимозаменяемо с «активностью до модификации». «Ослабление функции», «инактивация», «недостаточность», «уменьшение», «понижающая регуляция», «снижение» или «ослабление» активности полипептида по сравнению с эндогенной активностью означает, что активность полипептида снижена по сравнению с активностью конкретного полипептида, изначально присущего родительскому штамму до модификации, или немодифицированному микроорганизму.
Снижение активности полипептида может быть обеспечено любым способом, известным в данной области техники, но не ограничивается этим, и может быть обеспечено путем применения различных способов, хорошо известных в данной области техники (например, Nakashima N et al. Bacterial cellular engineering by genome editing and gene silencing. Int JMolSci. 2014;15(2):2773-2793, Sambrook et al. Molecular Cloning 2012, и т.д.).
В частности, ослабление функции полипептида согласно настоящему изобретению может представлять собой:
1) делецию части или всего гена, кодирующего полипептид;
2) модификацию регулирующей экспрессию области (или регулирующей экспрессию последовательности) для снижения экспрессии гена, кодирующего полипептид;
3) модификацию аминокислотной последовательности, составляющей полипептид, для устранения или снижения активности полипептида (например делецию/замену/добавление по меньшей мере одной аминокислоты в аминокислотной последовательности);
4) модификацию последовательности гена, кодирующего полинуклеотид, для устранения или снижения активности полипептида (например, делецию/замену/добавление по меньшей мере одного нуклеотида в нуклеотидной последовательности гена полипептида, так что указанный ген кодирует полипептид, модифицированный для устранения или снижения его активности);
5) модификацию нуклеотидной последовательности, кодирующей инициирующий кодон или область 5'-UTR транскрипта гена, кодирующего полипептид;
6) введение антисмыслового олигонуклеотида (например, антисмысловой РНК), комплементарно связывающегося с транскриптом гена, кодирующего полипептид;
7) добавление последовательности, комплементарной последовательности Шайна-Дальгарно, перед последовательностью Шайна-Дальгарно гена, кодирующего полипептид, для формирования вторичной структуры, делающей невозможным присоединение рибосом;
8) добавление промотора, обеспечивающего транскрипцию в обратном направлении, к 3'-концу открытой рамки считывания (ORF) последовательности гена, кодирующей полипептид (инженерия с транскрипцией в обратном направлении, RTE); или
9) комбинацию двух или более пунктов, выбранных из пунктов (1)-(8), без ограничения конкретно ими.
Например, приведенные пункты описаны следующим образом.
Делеция части или всего гена, кодирующего полипептид, согласно пункту (1) может представлять собой удаление всего полинуклеотида, кодирующего эндогенный целевой белок в хромосоме, замену на полинуклеотид с делецией некоторых нуклеотидов или замену на маркерный ген.
Модификация регулирующей экспрессию области (или регулирующей экспрессию последовательности) согласно пункту (2) может представлять собой мутацию, вводимую в регулирующую экспрессию область (или регулирующую экспрессию последовательность) путем делеции, инсерции, неконсервативной или консервативной замены или их комбинации, или замену на последовательность, обладающую более низкой активностью. Регулирующая экспрессию область включает промотор, операторную последовательность, последовательность для кодирования сайта связывания рибосомы и последовательность для регуляции терминации транскрипции и трансляции, но не ограничивается этим.
Модификация нуклеотидной последовательности, кодирующей инициирующий кодон или область 5'-UTR транскрипта гена, кодирующего полипептид, согласно пункту (5) может представлять собой, например, замену на нуклеотидную последовательность, кодирующую вместо эндогенного инициирующего кодона другой инициирующий кодон, обеспечивающий более низкую скорость экспрессии полипептида, но не ограничивается этим.
Модификация аминокислотной последовательности или полинуклеотидной последовательности согласно пунктам (3) и (4) может представлять собой модификацию последовательности посредством делеции, инсерции, неконсервативной или консервативной замены или их комбинации в аминокислотной последовательности полипептида или полинуклеотидной последовательности, кодирующей полипептид, для снижения активности полипептида, или замену на аминокислотную последовательность или полинуклеотидную последовательность, модифицированную для снижения активности, или на аминокислотную последовательность или полинуклеотидную последовательность, модифицированную для устранения активности, но не ограничивается этим. Например, экспрессия гена может быть ингибирована или ослаблена путем введения мутации в полинуклеотидную последовательность с образованием терминирующего кодона.
Введение антисмыслового олигонуклеотида (например, антисмысловой РНК), комплементарно связывающегося с транскриптом гена, кодирующего полипептид, согласно пункту (6) можно найти, например, в литературе (Weintraub, Н. et al. Antisense-RNA as a Genetics, Vol. 1(1) 1986).
Добавление последовательности, комплементарной последовательности Шайна-Дальгарно, перед последовательностью Шайна-Дальгарно гена, кодирующего полипептид, для формирования вторичной структуры, делающей невозможным присоединение рибосом, согласно пункту (7) может сделать невозможной трансляцию мРНК или снизить ее скорость.
Добавление промотора, обеспечивающего транскрипцию в обратном направлении, к 3'-концу открытой рамки считывания (ORF) последовательности гена, кодирующей полипептид (инженерия с транскрипцией в обратном направлении, RTE), согласно пункту (8) может обеспечить образование антисмыслового полинуклеотида, комплементарного транскрипту гена, кодирующего полипептид, для снижения таким образом активности полипептида.
Рекомбинантный микроорганизм согласно настоящему изобретению может представлять собой Corynebacterium glutamicum, Corynebacterium crudilactis, Corynebacterium deserti, Corynebacterium efficiens, Corynebacterium callunae, Corynebacterium stationis, Corynebacterium singulare, Corynebacterium halotolerans, Corynebacterium striatum, Corynebacterium ammoniagenes, Corynebacterium pollutisoli, Corynebacterium imitans, Corynebacterium testudinoris или Corynebacterium flavescens и, более конкретно, Corynebacterium glutamicum, но не ограничивается этим.
Рекомбинантный микроорганизм согласно настоящему изобретению может обладать повышенной или улучшенной способностью продуцировать L-глутаминовую кислоту по сравнению с немодифицированными микроорганизмами.
В соответствии с другим аспектом настоящего изобретения предложен способ получения L-глутаминовой кислоты, включающий культивирование рекомбинантного микроорганизма рода Corynebacterium, продуцирующего L-глутаминовую кислоту, где указанный рекомбинантный микроорганизм содержит белок SbtA или полинуклеотид, кодирующий указанный белок SbtA.
«Белок SbtA», «полинуклеотид, кодирующий указанный белок SbtA», и «рекомбинантный микроорганизм» имеют значения, описанные выше.
Белок SbtA может иметь происхождение из цианобактерий, но не ограничивается этим, как описано выше.
Белок SbtA может иметь по меньшей мере 90% идентичности с SEQ ID NO: 1, но не ограничивается этим, как описано выше.
Рекомбинантный микроорганизм рода Corynebacterium может представлять собой Corynebacterium glutamicum, но не ограничивается этим, как описано выше.
В рекомбинантном микроорганизме функция OdhA может быть дополнительно снижена или OdhA может быть удален. Кроме того, OdhA может содержать аминокислотную последовательность SEQ ID NO: 29, но не ограничивается этим, как описано выше.
Кроме того, рекомбинантный микроорганизм может быть применен в качестве родительского штамма для обработанного NTG микроорганизма, но не ограничивается этим, как описано выше.
В настоящем документе термин «культура» относится к выращиванию микроорганизма в надлежащим образом подобранных условиях. Процедура культивирования согласно настоящему изобретению может быть выполнена с использованием подходящих сред или условий культивирования, известных в данной области техники. Эта процедура культивирования может быть легко изменена и использована специалистом в данной области техники в зависимости от штамма. В частности, культивирование может представлять собой периодическое культивирование, непрерывное культивирование и культивирование с периодическим добавлением питательной среды, но не ограничивается этим.
В настоящем документе термин «среда» относится к смеси, содержащей в качестве основных ингредиентов питательные вещества, необходимые для культивирования микроорганизма, при этом среда обеспечивает питательные вещества, факторы роста и т.п., включая воду, необходимые для выживания и роста. В частности, что касается среды и других условий культивирования, применяемых для культивирования микроорганизма согласно настоящему изобретению, то любая среда, используемая для обычного культивирования микроорганизмов, может быть применена без конкретных ограничений. Однако микроорганизмы согласно настоящему изобретению можно культивировать в аэробных условиях в обычной среде, содержащей подходящие источники углерода, источники азота, источники фосфора, неорганические соединения, аминокислоты и/или витамины, при этом корректируют температуру, рН и т.п. В частности, культуральную среду для рода Corynebacterium можно найти в литературе ("Manual of Methods for General Bacteriology" by the American Society for Bacteriology (Washington D.C., USA, 1981)).
В настоящем изобретении источники углерода могут включать: углеводы, такие как глюкоза, сахароза, лактоза, фруктоза, сахароза и мальтоза; сахарные спирты, такие как маннит и сорбит; органические кислоты, такие как пировиноградная кислота, молочная кислота и лимонная кислота; и аминокислоты, такие как глутаминовая кислота, метионин и лизин. Кроме того, могут использоваться природные органические источники питательных веществ, такие как гидролизаты крахмала, меласса, тростниковая меласса, рисовые отруби, маниока, багасса сахарного тростника и кукурузный экстракт и, в частности, углеводы, такие как глюкоза и стерильная предварительно обработанная меласса (то есть меласса, превращенная в восстановленные сахара), и подходящие количества других источников углерода могут использоваться без ограничения. Эти источники углерода могут использоваться по отдельности или в комбинации из двух или более источников, без ограничения этим.
Что касается источников азота, могут быть использованы неорганические источники азота, такие как аммиак, сульфат аммония, хлорид аммония, ацетат аммония, фосфат аммония, карбонат аммония и нитрат аммония; аминокислоты, такие как глутаминовая кислота, метионин и глутамин; и органические источники азота, такие как пептон, NZ-амин, мясные экстракты, дрожжевые экстракты, солодовые экстракты, кукурузный экстракт, гидролизаты казеина, рыба или продукты ее переработки, обезжиренный соевый жмых или продукты его переработки и т.п. Эти источники азота могут использоваться по отдельности или в комбинации из двух или более источников, без ограничения этим.
Источники фосфора могут включать одноосновный фосфат калия, двухосновный фосфат калия и соответствующие содержащие натрий соли. Что касается неорганических соединений, то могут быть использованы хлорид натрия, хлорид кальция, хлорид железа, сульфат магния, сульфат железа, сульфат марганца, карбонат кальция и т.п., и дополнительно могут быть включены аминокислоты, витамины и/или подходящие предшественники. Эти составляющие ингредиенты или предшественники можно добавлять в среду периодическим или непрерывным способом. Однако среда согласно настоящему изобретению не ограничивается этим.
рН среды можно регулировать путем добавления таких соединений как гидроксид аммония, гидроксид калия, аммиак, фосфорная кислота и серная кислота в среду подходящим способом в процессе культивирования микроорганизма. Кроме того, для подавления пенообразования может быть добавлен предупреждающий вспенивание агент, такой как полигликолевый эфир жирной кислоты. Кроме того, в среду может быть введен кислород или кислородсодержащий газ для поддержания аэробного состояния среды, или, для поддержания анаэробного или неаэробного состояния среды, может быть введен азот, водород или диоксид углерода, или газ можно не вводить, без ограничения этим.
Температура среды может составлять от 20°С до 45°С и, в частности, от 25°С до 40°С, но не ограничивается этим. Период культивирования может продолжаться до тех пор, пока не будет получено желаемое количество продуцируемого полезного вещества, и он может составлять, в частности, от 10 до 160 часов, но не ограничивается этим.
L-глутаминовая кислота, продуцируемая культурой, может высвобождаться в среду или может оставаться в клетках без высвобождения.
Способ получения L-глутаминовой кислоты согласно настоящему изобретению может дополнительно включать стадию получения рекомбинантного микроорганизма рода Corynebacterium, продуцирующего L-глутаминовую кислоту, перед стадией культивирования или стадию приготовления среды для культивирования рекомбинантного микроорганизма.
Кроме того, способ получения L-глутаминовой кислоты согласно настоящему изобретению может дополнительно включать стадию извлечения L-глутаминовой кислоты из рекомбинантного микроорганизма или среды после стадии культивирования.
Способ извлечения L-глутаминовой кислоты может представлять собой сбор целевой L-глутаминовой кислоты с использованием подходящего способа, известного в данной области техники, в соответствии со способом культивирования микроорганизма согласно настоящему изобретению, например, способом периодического культивирования, непрерывного культивирования и культивирования с периодическим добавлением питательной среды. Например, могут быть использованы центрифугирование, фильтрование, анионообменная хроматография, кристаллизация, ВЭЖХ и т.п., и целевая L-глутаминовая кислота может быть извлечена из среды или микроорганизма с использованием подходящего способа, известного в данной области техники.
Кроме того, стадия извлечения может включать процесс очистки и может быть проведена с использованием подходящего способа, известного в данной области техники.
Извлеченная L-глутаминовая кислота может находиться в очищенной форме или может представлять собой ферментационную жидкость, полученную при культивировании микроорганизма, содержащую L-глутаминовую кислоту, но не ограничивается этим.
В соответствии с еще одним аспектом настоящего изобретения предложена композиция для получения L-глутаминовой кислоты, содержащая: рекомбинантный микроорганизм рода Corynebacterium, продуцирующий L-глутаминовую кислоту, где указанный рекомбинантный микроорганизм содержит белок SbtA или полинуклеотид, кодирующий указанный белок SbtA; или среду, содержащую культивируемый в ней рекомбинантный микроорганизм.
«Белок SbtA», «полинуклеотид, кодирующий белок SbtA», «рекомбинантный микроорганизм» и «среда» имеют значения, описанные выше.
Композиция согласно настоящему изобретению может дополнительно содержать любой подходящий эксципиент, который обычно используют в композиции для получения L-глутаминовой кислоты, и примерами эксципиента могут являться консервирующий агент, смачивающий агент, диспергирующий агент, суспендирующий агент, буфер, стабилизирующий агент или изотонический агент, но не ограничиваются этим.
[Осуществление изобретения]
Далее настоящее изобретение будет подробно описано со ссылкой на иллюстративные воплощения. Однако эти иллюстративные воплощения представляют собой исключительно предпочтительные воплощения для иллюстрации настоящего изобретения и, таким образом, не предназначены для ограничения объема прав настоящего изобретения. Между тем, технические вопросы, не описанные в настоящем документе, могут быть в достаточной степени поняты и легко реализованы специалистом в данной области техники или технических областях, сходных с областью, к которой относится настоящее изобретение.
Пример 1: Конструирование плазмиды
Была сконструирована плазмида (pDCM2, ФИГ. 1, SEQ ID NO: 32) для встраивания и замены гена в хромосоме Corynebacterium, и указанная плазмида была синтезирована с участием службы синтеза генов компании BIONICS Co., Ltd. Плазмида была сконструирована таким образом, что она содержала сайты для рестриктаз, облегчающие использование при клонировании, в соответствии со статьей, касающейся общеизвестной системы sacB (Gene, 145 (1994) 69-73). Синтезированная таким образом плазмида pDCM2 имела следующие характеристики.
1) Плазмида содержит точку начала репликации, функционирующую только в Е. coli, и, таким образом, ее автономная репликация возможна в Е. coli, но невозможна в Corynebacterium.
2) Плазмида содержит ген устойчивости к канамицину в качестве селективного маркера.
3) Плазмида содержит ген левансахарозы (sacB) в качестве маркера для вторичной позитивной селекции.
4) В окончательно сконструированном штамме не остается никакой генетической информации, полученной из плазмиды pDCM2.
Пример 2: Конструирование векторов для экспрессии переносчиков бикарбоната, полученных из цианобактерий
Для исследования улучшения способности продуцировать L-глутаминовую кислоту, когда при введении в штаммы генов sbtA и bicA, кодирующих переносчики бикарбоната (НСО3-), имеющие происхождение из цианобактерий, в частности Synechocystis sp. РСС6803, сначала были сконструированы векторы для экспрессии sbtA или bicA.
Для встраивания двух генов в Corynebacterium glutamicum была синтезирована последовательность полученного из Synechocystis sp. РСС6803 sbtA (SEQ ID NO: 3), оптимизированная по кодонам для Corynebacterium glutamicum (SEQ ID NO: 2), и последовательность полученного из Synechocystis sp. PCC6803 bicA (SEQ ID NO: 6), оптимизированная по кодонам для Corynebacterium glutamicum (SEQ ID NO: 5).
Вектор pDCM2 использовали для встраивания этих двух генов, и в качестве промотора для экспрессии использовали синтетический промотор CJ7 (патент Кореи №10-0620092 и WO 2006-065095).
В частности, вектор pDCM2-ΔCglE0286::CJ7-sbtA и вектор pDCM2-ΔCglE0085::CJ7-bicA были сконструированы, соответственно, с использованием сайтов BBD29_01410 (в дальнейшем называемом CglE0286) и BBD29_00440 (в дальнейшем называемом CglE0085) в транспозазах или интегразах Corynebacterium glutamicum в качестве сайтов хромосомной гомологичной рекомбинации.
В частности, фрагменты гена из вышележащей и нижележащей областей CglE0286, где происходит хромосомная гомологичная рекомбинация, были получены с помощью ПЦР с использованием хромосомной ДНК Corynebacterium glutamicum АТСС13869 в качестве матрицы вместе с набором праймеров, имеющих последовательности SEQ ID NO: 7 и SEQ ID NO: 8, SEQ ID NO: 9 и SEQ ID NO: 10. В качестве полимеразы использовали ДНК-полимеразу Solg™ Pfu-X, и условия ПЦР-амплификации представляли собой следующие: денатурация при 95°С в течение 5 минут; 30 циклов, включающих денатурацию при 95°С в течение 30 секунд, отжиг при 58°С в течение 30 секунд и полимеризацию при 72°С в течение 60 секунд; и затем полимеризация при 72°С в течение 5 минут.
Амплифицированные вышележащую и нижележащую области CglE0286 и вектор pDCM2 для хромосомной трансформации, расщепленный рестриктазами EcoRI и SalI, клонировали с использованием метода сборки Гибсона (DG Gibson et al. NATURE METHODS, Vol.6 No. 5, MAY 2009, NEBuilder HiFi DNA Assembly Master Mix) с получением таким образом рекомбинантной плазмиды, которая затем была названа pDCM2-ΔCglE0286. Клонирование выполняли путем смешивания реагента Гибсона для сборки фрагментов и каждого из фрагментов гена в рассчитанном количестве молей с последующим выдерживанием при 50°С в течение 1 часа.
ПЦР проводили с использованием синтезированного CJ7-sbtA, имеющего последовательность SEQ ID NO: 11, в качестве матрицы вместе с праймерами, имеющими последовательности SEQ ID NO: 12 и SEQ ID NO: 13, и фрагмент гена CJ7-sbtA получали с помощью ПЦР. В качестве полимеразы использовали ДНК-полимеразу Solg™ Pfu-X, и условия ПЦР-амплификации представляли собой следующие: денатурация при 95°С в течение 5 минут; 30 циклов, включающих денатурацию при 95°С в течение 30 секунд, отжиг при 58°С в течение 30 секунд и полимеризацию при 72°С в течение 60 секунд; и затем полимеризация при 72°С в течение 5 минут.
Амплифицированный CJ7-sbtA и вектор pDCM2-ΔCglE0286 для хромосомной трансформации, расщепленный рестриктазой SeaI, клонировали с использованием метода сборки Гибсона с получением таким образом рекомбинантной плазмиды, которая затем была названа pDCM2-ΔCglE0286::CJ7-sbtA. Клонирование выполняли путем смешивания реагента Гибсона для сборки фрагментов и каждого из фрагментов гена в рассчитанном количестве молей с последующим выдерживанием при 50°С в течение 1 часа.
Кроме того, фрагменты гена из вышележащей и нижележащей областей CglE0085, где происходит хромосомная гомологичная рекомбинация, были получены с помощью ПЦР с использованием хромосомной ДНК Corynebacterium glutamicum АТСС13869 в качестве матрицы вместе с набором праймеров, имеющих последовательности SEQ ID NO: 14 и SEQ ID NO: 15, SEQ ID NO: 16 и SEQ ID NO: 17. В качестве полимеразы использовали ДНК-полимеразу Solg™ Pfu-X, и условия ПЦР-амплификации представляли собой следующие: денатурация при 95°С в течение 5 минут; 30 циклов, включающих денатурацию при 95°С в течение 30 секунд, отжиг при 58°С в течение 30 секунд и полимеризацию при 72°С в течение 60 секунд; и затем полимеризация при 72°С в течение 5 минут.
Амплифицированные вышележащую и нижележащую области CglE0085 и вектор pDCM2 для хромосомной трансформации, расщепленный рестриктазами EcoRI и SalI, клонировали с использованием метода сборки Гибсона с получением таким образом рекомбинантной плазмиды, которая затем была названа pDCM2-ΔCglE0085. Клонирование выполняли путем смешивания реагента Гибсона для сборки фрагментов и каждого из фрагментов гена в рассчитанном количестве молей с последующим выдерживанием при 50°С в течение 1 часа.
ПЦР проводили с использованием синтезированного CJ7-bicA, имеющего последовательность SEQ ID NO: 18, в качестве матрицы вместе с праймерами, имеющими последовательности SEQ ID NO: 12 и SEQ ID NO: 13, с получением таким образом генного фрагмента CJ7-bicA. В качестве полимеразы использовали ДНК-полимеразу Solg™ Pfu-X, и условия ПЦР-амплификации представляли собой следующие: денатурация при 95°С в течение 5 минут; 30 циклов, включающих денатурацию при 95°С в течение 30 секунд, отжиг при 58°С в течение 30 секунд и полимеризацию при 72°С в течение 60 секунд; и затем полимеризация при 72°С в течение 5 минут.
Амплифицированный CJ7-bicA и вектор pDCM2-ΔCglE0085 для хромосомной трансформации, расщепленный рестриктазой ScaI, клонировали с использованием метода сборки Гибсона с получением таким образом рекомбинантной плазмиды, которая затем была названа pDCM2-ΔCglE0085::CJ7-bicA. Клонирование выполняли путем смешивания реагента Гибсона для сборки фрагментов и каждого из генных фрагментов в рассчитанном количестве молей с последующим выдерживанием при 50°С в течение 1 часа.
Последовательности праймеров, применяемых в настоящем изобретении, представлены в Таблице 1 ниже.
Вектор pDCM2-ΔCglE0286::CJ7-sbtA и вектор pDCM2-ΔCglE0085::CJ7-bicA, сконструированные таким образом, вводили в штаммы согласно следующим примерам.
Пример 3: Получение продуцирующего L-глутаминовую кислоту штамма, имеющего происхождение из Corynebacterium glutamicum дикого типа, и получение штаммов с введенными в них переносчиками бикарбоната
Пример 3-1: Получение Corynebacterium glutamicum, происходящего из Corynebacterium glutamicum дикого типа и обладающего способностью продуцировать L-глутаминовую кислоту Для получения штамма, происходящего из Corynebacterium glutamicum АТСС13869 и обладающего способностью продуцировать L-глутаминовую кислоту, получали штамм Corynebacterium glutamicum ATCC13869ΔodhA с делецией гена odhA на основании предшествующего уровня техники (Appl Environ Microbiol. 2007 Feb;73(4): 1308-19. Epub 2006 Dec 8.)
В частности, для осуществления делеции odhA вышележащую и нижележащую области гена odhA получали с помощью ПЦР с использованием хромосомной ДНК Corynebacterium glutamicum АТСС13869 в качестве матрицы вместе с набором праймеров с SEQ ID NO: 19 и SEQ ID NO: 20, SEQ ID NO: 21 и SEQ ID NO: 22. В качестве полимеразы использовали ДНК-полимеразу Solg™ Pfu-X, и условия ПЦР-амплификации представляли собой следующие: денатурация при 95°С в течение 5 минут; 30 циклов, включающих денатурацию при 95°С в течение 30 секунд, отжиг при 58°С в течение 30 секунд и полимеризацию при 72°С в течение 60 секунд; и затем полимеризация при 72°С в течение 5 минут.
Амплифицированные вышележащую и нижележащую области odhA и вектор pDCM2 для хромосомной трансформации, расщепленный рестриктазой SmaI, клонировали с использованием метода сборки Гибсона с получением таким образом рекомбинантной плазмиды, которая затем была названа pDCM2-ΔodhA. Клонирование выполняли путем смешивания реагента Гибсона для сборки фрагментов и каждого из генных фрагментов в рассчитанном количестве молей с последующим выдерживанием при 50°С в течение 1 часа.
Сконструированным вектором pDCM2-ΔodhA трансформировали штамм Corynebacterium glutamicum АТСС13869 путем электропорации с последующим вторичным кроссинговером с получением таким образом штамма с делецией гена odhA на хромосоме. Делецию гена идентифицировали с помощью ПЦР с использованием SEQ ID NO: 23 и SEQ ID NO: 24 и секвенирования генома, и полученный штамм был назван ATCC13869ΔodhA.
Последовательности использованных праймеров представлены в Таблице 2 ниже.


Пример 3-2: Получение штаммов с введенными в них переносчиками бикарбоната, имеющих происхождение из Corynebacterium glutamicum и обладающих способностью продуцировать L-глутаминовую кислоту
Влияние введения переносчика бикарбоната на способность продуцировать L-глутаминовую кислоту исследовали путем введения вектора pDCM2-ΔCglE0286::CJ7-sbtA и вектора pDCM2-ΔCglE0085::CJ7-bicA, сконструированных согласно примеру 2, в штамм ATCC13869ΔodhA, полученный согласно примеру 3-1.
В частности, сконструированным согласно примеру 2 вектором pDCM2-ΔCglE0286::CJ7-sbtA трансформировали штамм Corynebacterium glutamicum ATCC13869ΔodhA путем электропорации с последующим вторичным кроссинговером с получением таким образом штамма с инсерцией CJ7-sbtA в сайт CglE0286 на хромосоме.
Соответствующая генная манипуляция была идентифицирована с помощью ПЦР с использованием SEQ ID NO: 25 и SEQ ID NO: 26, обеспечивающих амплификацию внешних сайтов вышележащей и нижележащей областей гомологичной рекомбинации, в которые был введен ген CJ7-sbtA, и путем секвенирования генома, и полученный штамм был назван СА02-1474.
Кроме того, вектором pDCM2-ΔCglE0085::CJ7-bicA согласно примеру 2 трансформировали штамм Corynebacterium glutamicum ATCC13869ΔodhA путем электропорации с последующим вторичным кроссинговером с получением таким образом штамма с инсерцией CJ7-bicA в сайт CglE0085 на хромосоме.
Соответствующая генная манипуляция была идентифицирована с помощью ПЦР с использованием SEQ ID NO: 27 и SEQ ID NO: 28, обеспечивающих амплификацию внешних сайтов вышележащей и нижележащей областей гомологичной рекомбинации, в которые был введен ген CJ7-bicA, и путем секвенирования генома, и полученный штамм был назван СА02-1475.
Последовательности использованных праймеров представлены в Таблице 3 ниже.
Штаммы СА02-1474 и СА02-1475, полученные, как описано выше, культивировали следующим способом для исследования их способности продуцировать L-глутаминовую кислоту, при этом штамм ATCC13869ΔodhA использовали в качестве контроля.
Каждый штамм инокулировали в чашку со средой, состоящей из среды для посева, и культивировали при 30°С в течение 20 часов. Затем материал штамма с одной петли инокулировали в колбу с угловыми элементами объемом 250 мл, содержащую 25 мл среды для получения продукта, как указано ниже, и культивировали со встряхиванием при 30°С при 200 об./мин в течение 40 часов. После завершения культивирования количество полученной L-глутаминовой кислоты определяли посредством высокоэффективной жидкостной хроматографии (ВЭЖХ), и результаты определений представлены в Таблице 4.
<Среда для посева>
1% глюкозы, 0,5% говяжьего экстракта, 1% полипептона, 0,25% хлорида натрия, 0,5% дрожжевого экстракта, 2% агара, 0,2% мочевины, рН 7,2.
<Среда для получения продукта>
6% сахара-сырца, 5% карбоната кальция, 2,25% сульфата аммония, 0,1% монофосфата калия, 0,04% сульфата магния, 10 мг/л сульфата железа, 0,2 мг/л тиамина гидрохлорида, 50 мкг/л биотина.

Как показано в Таблице 4, концентрация L-глутаминовой кислоты была значительно повышена в штамме СА02-1474 с введенным в него геном sbtA по сравнению с АТСС13869ΔodhA геном или штаммом СА02-1475 с введенным в него геном bicA.
СА02-1474 был депонирован в Корейском центре хранения микроорганизмов, полномочие на хранение в соответствии с Будапештским договором от 28 июля 2020 года, и ему был присвоен номер доступа KССМ12775Р.
Пример 4: Получение штамма Corynebacterium glutamicum с введенным в него переносчиком бикарбоната, имеющего происхождение из N-метил-N'-нитро-N-нитрозогуанидинового (NTG) мутанта и обладающего способностью продуцировать L-глутаминовую кислоту
Для определения того, демонстрировал ли исследуемый ген эквивалентный эффект даже в штамме, имеющем происхождение из NTG мутанта Corynebacterium sp.и также обладающим повышенной способностью продуцировать L-глутаминовую кислоту, в дополнение к штамму, имеющему происхождение из Corynebacterium sp. дикого типа, ген был введен в штамм KFCC11074 (патент Кореи №10-0292299), известный как продуцирующий L-глутаминовую кислоту NTG мутант.
Вектором pDCM2-ΔCglE0286::CJ7-sbtA согласно примеру 2 трансформировали штамм KFCC11074 путем электропорации с последующим вторичным кроссинговером с получением таким образом штамма с инсерцией гена на хромосоме. Соответствующая генная манипуляция была идентифицирована с помощью ПЦР с использованием SEQ ID NO: 25 и SEQ ID NO: 26 и путем секвенирования генома, и штамм был назван СА02-1476.
Полученные штаммы СА02-1476 и Corynebacterium glutamicum KFCC11074 подвергали титриметрическому анализу в процессе ферментации в соответствии со следующим методом.
Каждый штамм инокулировали в чашку со средой, состоящей из среды для посева, и культивировали при 30°С в течение 20 часов. Затем материал штамма с одной петли инокулировали в колбу с угловыми элементами объемом 250 мл, содержащую 25 мл среды для получения продукта, и культивировали со встряхиванием при 30°С при 200 об/мин в течение 40 часов. После завершения культивирования количество полученной L-глутаминовой кислоты определяли посредством высокоэффективной жидкостной хроматографии (ВЭЖХ), и результаты определений представлены в таблице 5.
<Среда для посева>
1% глюкозы, 0,5% говяжьего экстракта, 1% полипептона, 0,25% хлорида натрия, 0,5% дрожжевого экстракта, 2% агара, 0,2% мочевины, рН 7,2.
<Среда для получения продукта>
6% сахара-сырца, 5% карбоната кальция, 2,25% сульфата аммония, 0,1% монофосфата калия, 0,04% сульфата магния, 10 мг/л сульфата железа, 0,2 мг/л тиамина гидрохлорида, 500 мкг/л биотина.

Как показано в Таблице 5, штамм СА02-1476 демонстрировал повышение концентрации L-глутаминовой кислоты на 34,8% по сравнению со штаммом KFCC11074.
Из приведенного выше описания специалист в области техники, к которой относится настоящее изобретение, сможет понять, что настоящее изобретение может быть воплощено в других конкретных формах без отступления от его технической сущности или существенных признаков. В этом отношении иллюстративные воплощения, раскрытые в настоящем документе, предназначены только для иллюстративных целей и не должны рассматриваться как ограничивающие объем настоящего изобретения. Следует понимать, что все изменения или модификации, вытекающие из определений и объема формулы изобретения и их эквивалентов, входят в объем настоящего изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> СИДЖЕЙ ЧЕИЛДЖЕДАНГ КОРПОРЕЙШН
<120> Рекомбинантный микроорганизм для получения l-глутаминовой кислоты и
способ получения L-глутаминовой кислоты с его использованием
<130> OPA21083-PCT
<150> KR 10-2020-0115570
<151> 2020-09-09
<160> 32
<170> KoPatentIn 3.0
<210> 1
<211> 374
<212> PRT
<213> Unknown
<220>
<223> SbtA
<400> 1
Met Asp Phe Leu Ser Asn Phe Leu Thr Asp Phe Val Gly Gln Leu Gln
1 5 10 15
Ser Pro Thr Leu Ala Phe Leu Ile Gly Gly Met Val Ile Ala Ala Leu
20 25 30
Gly Thr Gln Leu Val Ile Pro Glu Ala Ile Ser Thr Ile Ile Val Phe
35 40 45
Met Leu Leu Thr Lys Ile Gly Leu Thr Gly Gly Met Ala Ile Arg Asn
50 55 60
Ser Asn Leu Thr Glu Met Leu Leu Pro Val Ala Phe Ser Val Ile Leu
65 70 75 80
Gly Ile Leu Ile Val Phe Ile Ala Arg Phe Thr Leu Ala Lys Leu Pro
85 90 95
Asn Val Arg Thr Val Asp Ala Leu Ala Thr Gly Gly Leu Phe Gly Ala
100 105 110
Val Ser Gly Ser Thr Met Ala Ala Ala Leu Thr Thr Leu Glu Glu Ser
115 120 125
Lys Ile Ser Tyr Glu Ala Trp Ala Gly Ala Leu Tyr Pro Phe Met Asp
130 135 140
Ile Pro Ala Leu Val Thr Ala Ile Val Val Ala Asn Ile Tyr Leu Asn
145 150 155 160
Lys Arg Lys Arg Lys Ser Ala Ala Ala Ser Ile Glu Glu Ser Phe Ser
165 170 175
Lys Gln Pro Val Ala Ala Gly Asp Tyr Gly Asp Gln Thr Asp Tyr Pro
180 185 190
Arg Thr Arg Gln Glu Tyr Leu Ser Gln Gln Glu Pro Glu Asp Asn Arg
195 200 205
Val Lys Ile Trp Pro Ile Ile Glu Glu Ser Leu Gln Gly Pro Ala Leu
210 215 220
Ser Ala Met Leu Leu Gly Leu Ala Leu Gly Ile Phe Thr Lys Pro Glu
225 230 235 240
Ser Val Tyr Glu Gly Phe Tyr Asp Pro Leu Phe Arg Gly Leu Leu Ser
245 250 255
Ile Leu Met Leu Ile Met Gly Met Glu Ala Trp Ser Arg Ile Gly Glu
260 265 270
Leu Arg Lys Val Ala Gln Trp Tyr Val Val Tyr Ser Leu Ile Ala Pro
275 280 285
Ile Val His Gly Phe Ile Ala Phe Gly Leu Gly Met Ile Ala His Tyr
290 295 300
Ala Thr Gly Phe Ser Leu Gly Gly Val Val Val Leu Ala Val Ile Ala
305 310 315 320
Ala Ser Ser Ser Asp Ile Ser Gly Pro Pro Thr Leu Arg Ala Gly Ile
325 330 335
Pro Ser Ala Asn Pro Ser Ala Tyr Ile Gly Ser Ser Thr Ala Ile Gly
340 345 350
Thr Pro Ile Ala Ile Gly Val Cys Ile Pro Leu Phe Ile Gly Leu Ala
355 360 365
Gln Thr Leu Gly Ala Gly
370
<210> 2
<211> 1125
<212> DNA
<213> Artificial Sequence
<220>
<223> Оптимизированный по кодонам sbtA
<400> 2
atggattttc tttctaattt cttgaccgac ttcgtgggtc aactgcagtc acccactctg 60
gcgtttctga tcggcggtat ggtaatcgcc gctctgggaa ctcaattggt tattcccgaa 120
gccatctcaa cgattatcgt tttcatgttg cttactaaaa ttggacttac cggaggtatg 180
gcgattcgga atagcaacct gaccgagatg cttttgcccg tggccttctc cgtcattttg 240
ggaattttga tcgtatttat cgcgcgtttc actttggcta agctccccaa tgtgcgcact 300
gtggacgccc ttgctacggg tggtctcttc ggtgcggtgt caggaagcac gatggccgcc 360
gccctgacta cgcttgagga atcaaaaatt tcatatgaag catgggcagg agctttgtac 420
ccttttatgg atattccggc cttggtcacg gcaattgttg ttgccaacat ctatttgaat 480
aaacggaaac gtaaaagcgc cgcagcatca atcgaagaga gcttctcgaa gcagcccgta 540
gcggctggcg actatggaga tcagactgat tatccacgta cccgtcagga atacctctct 600
cagcaagagc cggaggacaa tcgcgtcaaa atttggccaa tcattgaaga gtcgcttcaa 660
ggcccagccc tttcagctat gttgttggga cttgcactgg gtattttcac gaaacctgaa 720
tcggtgtatg agggattcta cgatcctctt tttcgcggac tcctgtcgat tctgatgctg 780
attatgggca tggaagcctg gagccgtatc ggcgagcttc gtaaggtagc tcagtggtat 840
gtcgtttact ctttgatcgc tccgatcgta cacggattta tcgcttttgg actgggtatg 900
atcgcccatt acgctacggg attcagcctc ggtggagtgg tcgttctggc cgtaattgcc 960
gcatcttctt ctgatatctc tggcccacct accctgcgtg ccggcattcc gagcgcaaat 1020
ccgtcggcat atatcggtag ctctactgca atcggaaccc ccatcgcaat cggtgtgtgt 1080
attcctctct tcatcggtct cgcccagacg cttggcgcgg gctaa 1125
<210> 3
<211> 1125
<212> DNA
<213> Unknown
<220>
<223> sbtA
<400> 3
atggattttt tgtccaattt cttgacggac ttcgtgggac aattgcagtc cccaacccta 60
gcctttctga ttggggggat ggttattgcc gcccttggca cccaattggt aattccagag 120
gcgatttcta cgatcatcgt ctttatgttg ctcactaaga ttggcctaac cgggggcatg 180
gcaattcgga actccaactt gacggaaatg ctcctacccg tggcattctc tgtgatattg 240
ggaattctta ttgtcttcat cgcccgtttt accctggcta aactgcctaa cgtcagaacc 300
gtggatgccc tggccaccgg cggcttgttt ggggcagtca gtggctctac aatggctgcc 360
gccctcacta cgttggaaga atcaaaaatt tcctacgaag cctgggctgg tgctctgtat 420
ccctttatgg atattcctgc cctggtaacg gcgatcgtcg tagctaatat ttatctcaat 480
aagagaaaac gtaagtctgc tgctgctagt attgaggaat cgttcagcaa gcaacccgtt 540
gccgccgggg attatggcga ccaaacggat tatcctcgta cccgccaaga gtatttaagc 600
cagcaagaac cggaagataa tcgggtcaaa atctggccaa ttatcgaaga aagtttacaa 660
ggccctgccc tatcagccat gttgttaggt cttgccctgg gcatatttac caagccggaa 720
agtgtctatg aaggttttta tgatcctctt tttcgaggac tactttccat cttgatgctg 780
attatgggca tggaagcttg gtccagaatt ggtgaactac gtaaagtagc tcaatggtat 840
gtggtctata gcctaatagc tcccatagtg cacgggttta ttgcctttgg tcttggtatg 900
attgcccact atgctacggg tttcagtctg ggtggtgtgg tagttttagc agttatcgcc 960
gcttctagct ctgatatctc cgggcctcct accttgcgag caggtatccc atctgccaac 1020
ccctctgcct atatcggttc atccaccgcc atcggtactc ccattgccat cggcgtgtgc 1080
ataccgcttt tcattgggct tgcccagacc cttggtgcag gttaa 1125
<210> 4
<211> 564
<212> PRT
<213> Unknown
<220>
<223> BicA
<400> 4
Met Gln Ile Thr Asn Lys Ile His Phe Arg Asn Leu Gln Gly Asp Leu
1 5 10 15
Phe Gly Gly Val Thr Ala Ala Val Ile Ala Leu Pro Met Ala Leu Ala
20 25 30
Phe Gly Ile Ala Ser Gly Ala Gly Ala Thr Ala Gly Leu Trp Gly Ala
35 40 45
Val Ile Val Gly Phe Phe Ala Ala Leu Phe Gly Gly Thr Pro Thr Leu
50 55 60
Ile Ser Glu Pro Thr Gly Pro Met Thr Val Val Gln Thr Ala Val Ile
65 70 75 80
Ala Ser Leu Val Ala Ala Asp Pro Asp Asn Gly Leu Ala Met Ala Phe
85 90 95
Thr Val Val Met Met Ala Gly Leu Phe Gln Ile Ala Phe Gly Leu Leu
100 105 110
Lys Leu Gly Lys Tyr Val Thr Met Met Pro Tyr Thr Val Ile Ser Gly
115 120 125
Phe Met Ser Gly Ile Gly Ile Ile Leu Val Ile Leu Gln Leu Ala Pro
130 135 140
Phe Leu Gly Gln Ala Ser Pro Lys Gly Gly Val Ile Gly Thr Leu Gln
145 150 155 160
Ala Leu Pro Asn Leu Val Ser Asn Val Arg Pro Val Glu Thr Leu Leu
165 170 175
Ala Leu Met Thr Val Gly Ile Ile Trp Phe Met Pro Ser Arg Trp Lys
180 185 190
Lys Phe Ala Pro Pro Gln Leu Val Ala Leu Val Leu Gly Thr Ile Ile
195 200 205
Ser Ile Thr Leu Phe Gly Asp Leu Asp Ile Arg Arg Ile Gly Glu Ile
210 215 220
Gln Ala Gly Leu Pro Ala Leu Gln Leu Pro Val Phe Gln Ala Asp Gln
225 230 235 240
Leu Gln Arg Met Leu Ile Asp Ala Ala Val Leu Gly Met Leu Gly Cys
245 250 255
Ile Asp Ala Leu Leu Thr Ser Val Val Ala Asp Ser Leu Thr Arg Thr
260 265 270
Glu His Asn Ser Asn Lys Glu Leu Val Gly Gln Gly Ile Gly Asn Val
275 280 285
Met Ser Gly Leu Phe Gly Gly Leu Gly Gly Ala Gly Ala Thr Met Gly
290 295 300
Thr Val Val Asn Ile Gln Ser Gly Gly Arg Thr Ala Leu Ser Gly Leu
305 310 315 320
Ile Arg Ala Met Val Leu Leu Val Val Ile Leu Gly Ala Ala Lys Leu
325 330 335
Ala Ala Thr Ile Pro Leu Ala Val Leu Ala Gly Ile Ala Phe Lys Val
340 345 350
Gly Val Asp Ile Ile Asp Trp Gly Phe Leu Lys Arg Ala His His Val
355 360 365
Ser Ile Lys Gly Ala Leu Ile Met Tyr Ala Val Ile Val Leu Thr Val
370 375 380
Leu Val Asp Leu Ile Ala Ala Val Gly Ile Gly Val Phe Ile Ala Asn
385 390 395 400
Ile Leu Thr Ile Asp Arg Met Ser Ala Leu Gln Ser Lys Ala Val Lys
405 410 415
Ser Ile Ser Asp Ala Asp Asp Glu Ile Leu Leu Ser Ala Asn Glu Lys
420 425 430
Arg Trp Leu Asp Glu Gly Asn Gly Arg Val Leu Leu Phe Gln Leu Ser
435 440 445
Gly Pro Met Ile Phe Gly Val Ala Lys Ala Ile Ala Arg Glu His Asn
450 455 460
Ala Ile Gln Glu Cys Ala Ala Ile Val Phe Asp Leu Ser Asp Val Pro
465 470 475 480
His Leu Gly Val Thr Ala Ser Leu Ala Leu Glu Asn Ala Ile Glu Glu
485 490 495
Ala Ala Glu Lys Gly Arg Ala Val Tyr Ile Val Gly Ala Thr Gly Gln
500 505 510
Thr Lys Arg Arg Leu Glu Lys Leu Gln Val Phe Arg Phe Val Pro Glu
515 520 525
Ser Asn Cys Tyr Asp Asp Arg Ser Glu Ala Leu Lys Asp Ala Val Leu
530 535 540
Ala Leu Gly Pro His Glu Ser Glu Asp Ser Pro Ser Ser Ser Ser Val
545 550 555 560
Gln Thr Thr Tyr
<210> 5
<211> 1695
<212> DNA
<213> Artificial Sequence
<220>
<223> Оптимизированный по кодонам bicA
<400> 5
atgcagatta cgaacaagat tcactttcgt aatttgcagg gtgatctttt tggcggcgtt 60
acggccgctg ttattgcatt gcctatggct ttggcttttg gaattgcatc gggtgcgggt 120
gccacggccg gactctgggg agccgtaatt gtgggcttct tcgccgcact gttcggagga 180
acccctacgc ttatttcaga gccaaccgga cccatgaccg ttgtgcagac cgccgtgatc 240
gcttctcttg tagctgcgga tcccgataac ggccttgcta tggcattcac ggtggtgatg 300
atggccggtt tgtttcagat tgccttcggt ctgctcaaac ttggaaaata tgtgaccatg 360
atgccatata cggtaatctc tggctttatg tccggcattg gtattatttt ggtaattctg 420
caacttgcgc ccttccttgg acaagcttct ccgaaaggag gcgtgatcgg aacgctgcaa 480
gcacttccca acctcgtgtc gaatgtacgg cccgtagaaa cgttgctggc attgatgacc 540
gtcggtatta tctggttcat gccttctcgt tggaagaaat tcgcgcctcc gcaactcgta 600
gccctggtac tcggcacgat tatttctatc acccttttcg gagatcttga cattcgccgg 660
atcggagaaa tccaagcggg cttgccagcc cttcaactcc cggttttcca agccgatcag 720
ttgcagcgga tgctgatcga tgcagcagtc ctcggaatgc ttggatgtat tgacgccctc 780
cttacgtcgg tagttgccga ttctctgacc cgcaccgagc ataactcgaa taaagaactc 840
gttggccaag gtatcggaaa cgtaatgtca ggcttgttcg gtggtctggg cggcgccggc 900
gcaacgatgg gcactgtggt gaacatccaa tccggaggcc gcacggccct gtctggtttg 960
attcgcgcta tggttctgct ggtggtcatc ttgggagctg caaagctggc agccaccatt 1020
ccgcttgctg tgcttgctgg aattgcgttt aaggtaggtg tagacattat cgactggggc 1080
tttctgaagc gcgcacacca tgtgtcaatt aagggcgcac ttatcatgta tgctgttatc 1140
gtcctcactg tcctggtaga tctcatcgcc gcggttggta ttggagtctt tatcgcgaac 1200
attcttacca tcgaccggat gtcggccttg caatcaaaag cggtgaaatc aatttctgat 1260
gcagatgacg aaattctttt gtctgccaat gaaaaacgtt ggttggacga aggcaatggt 1320
cgcgtcttgc tctttcagtt gagcggacct atgatctttg gagtggcaaa agcgatcgca 1380
cgggaacaca atgcgatcca ggaatgtgct gccatcgtat ttgacttgag cgacgttccc 1440
catctcggtg tcaccgcatc attggctctt gagaacgcaa ttgaagaggc agcagagaag 1500
ggacgtgccg tttatatcgt gggcgccacc ggacagacca agcgccgttt ggagaaactt 1560
caagtctttc gcttcgtccc agaaagcaac tgttacgacg accgctctga ggcgcttaaa 1620
gacgccgtgc tcgcgttggg accccatgag tcggaagatt cgccgagcag ctcttccgtg 1680
cagaccactt attga 1695
<210> 6
<211> 1695
<212> DNA
<213> Unknown
<220>
<223> bicA
<400> 6
atgcaaataa ctaacaaaat tcattttagg aacctgcagg gggacctttt tggcggggtt 60
acagcggcgg ttattgccct gcccatggcc ttagccttcg ggattgcttc cggagcaggg 120
gctacggccg gactctgggg ggcggtgatc gtagggtttt tcgcggcctt atttggcggc 180
acccccacct taatttccga accgactggg cccatgacgg tggtgcaaac ggcggttatt 240
gctagtttag tggcggcaga tcccgacaat ggcttggcca tggccttcac tgtggtaatg 300
atggcggggt tgttccagat tgcctttggt ctgctcaaat tgggcaaata tgtcaccatg 360
atgccctaca cagtcatttc cggctttatg tccggcattg ggattatttt ggtgattttg 420
caactggctc cctttcttgg ccaagctagt cccaagggag gggtaatcgg caccctccag 480
gccctcccta acctagtaag caatgtcagg ccggtggaaa ccctattggc gctcatgacg 540
gtgggcatta tttggtttat gccttcccgt tggaaaaagt ttgctccgcc ccaattggtg 600
gctttagtgt tggggacaat tatttccatc accctatttg gcgatctgga tatccgtcgc 660
attggggaaa ttcaggccgg tttgcccgct ctacagctac cagtgtttca ggctgatcaa 720
ttacagagaa tgctgattga tgcggctgtt ctgggaatgc tgggctgtat tgatgccctc 780
ctgacttcgg tggtggctga tagcttgacc cgcacagaac ataactccaa caaggaatta 840
gtcggccagg gcatcggcaa tgtaatgtcc ggtttatttg gtggcttggg gggagctggg 900
gccaccatgg ggacggtggt aaatatccag tccgggggac gcacagctct gtctggcttg 960
atccgggcga tggtgttgct ggtggtaatt ttaggcgcag ctaaattggc ggctaccatt 1020
cccctagccg tattggctgg tattgcgttc aaagttgggg tggacattat tgattggggg 1080
ttcctcaagc gggctcacca tgtctccatc aaaggggcct tgattatgta tgccgtcatt 1140
gtcctgacgg tgttggtgga tttaattgcg gcagtaggta ttggtgtatt tattgccaat 1200
attctcacca ttgaccgtat gagtgcgttg cagtccaaag ctgtgaaaag tattagcgat 1260
gccgacgacg aaattctcct ttccgccaat gagaaacgtt ggctagatga gggcaatggc 1320
cgggtcttgc ttttccaact cagtggccca atgatttttg gggtggccaa ggcgatcgcc 1380
agggaacata atgccattca agaatgtgcc gccattgttt ttgatctgag cgatgtgccc 1440
catttgggag taaccgcttc cctggccctg gaaaatgcca ttgaagaagc ggcggaaaaa 1500
ggtcgggccg tttacattgt gggggcaaca gggcaaacca agcgacgctt ggaaaaattg 1560
caagtgttcc gctttgttcc tgaaagtaat tgctatgacg accgttctga agctctcaag 1620
gacgctgtcc tagctttggg acctcatgaa agtgaggact ccccttccag ttcttccgtc 1680
cagaccacat actga 1695
<210> 7
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> CglE0286_up_F
<400> 7
aacgacggcc agtgaattcc ggacgtttac gctgat 36
<210> 8
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> CglE0286_up_R
<400> 8
agtactaaac cggaagggcc tgtaaaggcc 30
<210> 9
<211> 37
<212> DNA
<213> Artificial Sequence
<220>
<223> CglE0286_down_F
<400> 9
ccttccggtt tagtactaaa caggaagagc cccttta 37
<210> 10
<211> 36
<212> DNA
<213> Artificial Sequence
<220>
<223> CglE0286_down_R
<400> 10
tgcatgcctg caggtcgacc gcatgtggtg gcaaaa 36
<210> 11
<211> 1477
<212> DNA
<213> Artificial Sequence
<220>
<223> CJ7-sbtA
<400> 11
ggcccttccg gtttagtaga aacatcccag cgctactaat agggagcgtt gaccttcctt 60
ccacggaccg gtaatcggag tgcctaaaac cgcatgcggc ttaggctcca agataggttc 120
tgcgcggccg ggtaatgcat cttctttagc aacaagttga ggggtaggtg caaataagaa 180
cgacatagaa atcgtctcct ttctgttttt aatcaacata caccaccacc taaaaattcc 240
ccgaccagca agttcacagt attcgggcac aatatcgttg ccaaaatatt gtttcggaat 300
atcatgggat acgtacccaa cgaaaggaaa cactcatgga ttttctttct aatttcttga 360
ccgacttcgt gggtcaactg cagtcaccca ctctggcgtt tctgatcggc ggtatggtaa 420
tcgccgctct gggaactcaa ttggttattc ccgaagccat ctcaacgatt atcgttttca 480
tgttgcttac taaaattgga cttaccggag gtatggcgat tcggaatagc aacctgaccg 540
agatgctttt gcccgtggcc ttctccgtca ttttgggaat tttgatcgta tttatcgcgc 600
gtttcacttt ggctaagctc cccaatgtgc gcactgtgga cgcccttgct acgggtggtc 660
tcttcggtgc ggtgtcagga agcacgatgg ccgccgccct gactacgctt gaggaatcaa 720
aaatttcata tgaagcatgg gcaggagctt tgtacccttt tatggatatt ccggccttgg 780
tcacggcaat tgttgttgcc aacatctatt tgaataaacg gaaacgtaaa agcgccgcag 840
catcaatcga agagagcttc tcgaagcagc ccgtagcggc tggcgactat ggagatcaga 900
ctgattatcc acgtacccgt caggaatacc tctctcagca agagccggag gacaatcgcg 960
tcaaaatttg gccaatcatt gaagagtcgc ttcaaggccc agccctttca gctatgttgt 1020
tgggacttgc actgggtatt ttcacgaaac ctgaatcggt gtatgaggga ttctacgatc 1080
ctctttttcg cggactcctg tcgattctga tgctgattat gggcatggaa gcctggagcc 1140
gtatcggcga gcttcgtaag gtagctcagt ggtatgtcgt ttactctttg atcgctccga 1200
tcgtacacgg atttatcgct tttggactgg gtatgatcgc ccattacgct acgggattca 1260
gcctcggtgg agtggtcgtt ctggccgtaa ttgccgcatc ttcttctgat atctctggcc 1320
cacctaccct gcgtgccggc attccgagcg caaatccgtc ggcatatatc ggtagctcta 1380
ctgcaatcgg aacccccatc gcaatcggtg tgtgtattcc tctcttcatc ggtctcgccc 1440
agacgcttgg cgcgggctaa actaaacagg aagagcc 1477
<210> 12
<211> 17
<212> DNA
<213> Artificial Sequence
<220>
<223> CJ7-sbtA_F
<400> 12
ggcccttccg gtttagt 17
<210> 13
<211> 17
<212> DNA
<213> Artificial Sequence
<220>
<223> CJ7-sbtA_R
<400> 13
ggctcttcct gtttagt 17
<210> 14
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> CglE0085_up_F
<400> 14
aacgacggcc agtgaattcg ctcgaatgcc tgactgaca 39
<210> 15
<211> 44
<212> DNA
<213> Artificial Sequence
<220>
<223> CglE0085_up_R
<400> 15
gtttagtact aaaccggaag ggccaaagga cgacttcacg gtta 44
<210> 16
<211> 46
<212> DNA
<213> Artificial Sequence
<220>
<223> CglE0085_down_F
<400> 16
ccggtttagt actaaacagg aagagccatt gaggatgcga aactgt 46
<210> 17
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> CglE0085_down_R
<400> 17
tgcatgcctg caggtcgacg taatcgaatc accggccag 39
<210> 18
<211> 2047
<212> DNA
<213> Artificial Sequence
<220>
<223> CJ7-bicA
<400> 18
ggcccttccg gtttagtaga aacatcccag cgctactaat agggagcgtt gaccttcctt 60
ccacggaccg gtaatcggag tgcctaaaac cgcatgcggc ttaggctcca agataggttc 120
tgcgcggccg ggtaatgcat cttctttagc aacaagttga ggggtaggtg caaataagaa 180
cgacatagaa atcgtctcct ttctgttttt aatcaacata caccaccacc taaaaattcc 240
ccgaccagca agttcacagt attcgggcac aatatcgttg ccaaaatatt gtttcggaat 300
atcatgggat acgtacccaa cgaaaggaaa cactcatgca gattacgaac aagattcact 360
ttcgtaattt gcagggtgat ctttttggcg gcgttacggc cgctgttatt gcattgccta 420
tggctttggc ttttggaatt gcatcgggtg cgggtgccac ggccggactc tggggagccg 480
taattgtggg cttcttcgcc gcactgttcg gaggaacccc tacgcttatt tcagagccaa 540
ccggacccat gaccgttgtg cagaccgccg tgatcgcttc tcttgtagct gcggatcccg 600
ataacggcct tgctatggca ttcacggtgg tgatgatggc cggtttgttt cagattgcct 660
tcggtctgct caaacttgga aaatatgtga ccatgatgcc atatacggta atctctggct 720
ttatgtccgg cattggtatt attttggtaa ttctgcaact tgcgcccttc cttggacaag 780
cttctccgaa aggaggcgtg atcggaacgc tgcaagcact tcccaacctc gtgtcgaatg 840
tacggcccgt agaaacgttg ctggcattga tgaccgtcgg tattatctgg ttcatgcctt 900
ctcgttggaa gaaattcgcg cctccgcaac tcgtagccct ggtactcggc acgattattt 960
ctatcaccct tttcggagat cttgacattc gccggatcgg agaaatccaa gcgggcttgc 1020
cagcccttca actcccggtt ttccaagccg atcagttgca gcggatgctg atcgatgcag 1080
cagtcctcgg aatgcttgga tgtattgacg ccctccttac gtcggtagtt gccgattctc 1140
tgacccgcac cgagcataac tcgaataaag aactcgttgg ccaaggtatc ggaaacgtaa 1200
tgtcaggctt gttcggtggt ctgggcggcg ccggcgcaac gatgggcact gtggtgaaca 1260
tccaatccgg aggccgcacg gccctgtctg gtttgattcg cgctatggtt ctgctggtgg 1320
tcatcttggg agctgcaaag ctggcagcca ccattccgct tgctgtgctt gctggaattg 1380
cgtttaaggt aggtgtagac attatcgact ggggctttct gaagcgcgca caccatgtgt 1440
caattaaggg cgcacttatc atgtatgctg ttatcgtcct cactgtcctg gtagatctca 1500
tcgccgcggt tggtattgga gtctttatcg cgaacattct taccatcgac cggatgtcgg 1560
ccttgcaatc aaaagcggtg aaatcaattt ctgatgcaga tgacgaaatt cttttgtctg 1620
ccaatgaaaa acgttggttg gacgaaggca atggtcgcgt cttgctcttt cagttgagcg 1680
gacctatgat ctttggagtg gcaaaagcga tcgcacggga acacaatgcg atccaggaat 1740
gtgctgccat cgtatttgac ttgagcgacg ttccccatct cggtgtcacc gcatcattgg 1800
ctcttgagaa cgcaattgaa gaggcagcag agaagggacg tgccgtttat atcgtgggcg 1860
ccaccggaca gaccaagcgc cgtttggaga aacttcaagt ctttcgcttc gtcccagaaa 1920
gcaactgtta cgacgaccgc tctgaggcgc ttaaagacgc cgtgctcgcg ttgggacccc 1980
atgagtcgga agattcgccg agcagctctt ccgtgcagac cacttattga actaaacagg 2040
aagagcc 2047
<210> 19
<211> 38
<212> DNA
<213> Artificial Sequence
<220>
<223> odhA_up_F
<400> 19
tgaattcgag ctcggtaccc ttgaacggaa ttgggtgg 38
<210> 20
<211> 38
<212> DNA
<213> Artificial Sequence
<220>
<223> odhA_up_R
<400> 20
cccaggtggc atcggtacct tcacccagcg ccacgcag 38
<210> 21
<211> 39
<212> DNA
<213> Artificial Sequence
<220>
<223> odhA_down_F
<400> 21
cgctgggtga aggtaccgat gccacctggg ttggtcaag 39
<210> 22
<211> 38
<212> DNA
<213> Artificial Sequence
<220>
<223> odhA_down_R
<400> 22
gtcgactcta gaggatcccc ggacaaggaa tggagaga 38
<210> 23
<211> 18
<212> DNA
<213> Artificial Sequence
<220>
<223> odhA_del_F
<400> 23
cttaccgttg ttgccctt 18
<210> 24
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<223> odhA_del_R
<400> 24
ctccttcacc cacatcatt 19
<210> 25
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<223> CJ7-sbtA_confirm_F
<400> 25
caagcagcaa gtgccacac 19
<210> 26
<211> 18
<212> DNA
<213> Artificial Sequence
<220>
<223> CJ7-sbtA_confirm_R
<400> 26
ccaactgctc cgacgaag 18
<210> 27
<211> 18
<212> DNA
<213> Artificial Sequence
<220>
<223> CJ7-bicA_confirm_F
<400> 27
attcccaaag gtgccagc 18
<210> 28
<211> 18
<212> DNA
<213> Artificial Sequence
<220>
<223> CJ7-bicA_confirm_R
<400> 28
cagtgcgcaa aaggcctc 18
<210> 29
<211> 1221
<212> PRT
<213> Unknown
<220>
<223> OdhA
<400> 29
Met Ser Ser Ala Ser Thr Phe Gly Gln Asn Ala Trp Leu Val Asp Glu
1 5 10 15
Met Phe Gln Gln Phe Gln Lys Asp Pro Lys Ser Val Asp Lys Glu Trp
20 25 30
Arg Glu Leu Phe Glu Ala Gln Gly Gly Pro Asn Ala Thr Pro Ala Thr
35 40 45
Thr Glu Ala Gln Pro Ser Ala Pro Lys Glu Ser Ala Lys Pro Ala Pro
50 55 60
Lys Ala Ala Pro Ala Ala Lys Ala Ala Pro Arg Val Glu Thr Lys Pro
65 70 75 80
Ala Ala Lys Thr Ala Pro Lys Ala Lys Glu Ser Ser Val Pro Gln Gln
85 90 95
Pro Lys Leu Pro Glu Pro Gly Gln Thr Pro Ile Arg Gly Ile Phe Lys
100 105 110
Ser Ile Ala Lys Asn Met Asp Ile Ser Leu Glu Ile Pro Thr Ala Thr
115 120 125
Ser Val Arg Asp Met Pro Ala Arg Leu Met Phe Glu Asn Arg Ala Met
130 135 140
Val Asn Asp Gln Leu Lys Arg Thr Arg Gly Gly Lys Ile Ser Phe Thr
145 150 155 160
His Ile Ile Gly Tyr Ala Met Val Lys Ala Val Met Ala His Pro Asp
165 170 175
Met Asn Asn Ser Tyr Asp Val Ile Asp Gly Lys Pro Thr Leu Ile Val
180 185 190
Pro Glu His Ile Asn Leu Gly Leu Ala Ile Asp Leu Pro Gln Lys Asp
195 200 205
Gly Ser Arg Ala Leu Val Val Ala Ala Ile Lys Glu Thr Glu Lys Met
210 215 220
Asn Phe Ser Glu Phe Leu Ala Ala Tyr Glu Asp Ile Val Thr Arg Ser
225 230 235 240
Arg Lys Gly Lys Leu Thr Met Asp Asp Tyr Gln Gly Val Thr Val Ser
245 250 255
Leu Thr Asn Pro Gly Gly Ile Gly Thr Arg His Ser Val Pro Arg Leu
260 265 270
Thr Lys Gly Gln Gly Thr Ile Ile Gly Val Gly Ser Met Asp Tyr Pro
275 280 285
Ala Glu Phe Gln Gly Ala Ser Glu Asp Arg Leu Ala Glu Leu Gly Val
290 295 300
Gly Lys Leu Val Thr Ile Thr Ser Thr Tyr Asp His Arg Val Ile Gln
305 310 315 320
Gly Ala Val Ser Gly Glu Phe Leu Arg Thr Met Ser Arg Leu Leu Thr
325 330 335
Asp Asp Ser Phe Trp Asp Glu Ile Phe Asp Ala Met Asn Val Pro Tyr
340 345 350
Thr Pro Met Arg Trp Ala Gln Asp Val Pro Asn Thr Gly Val Asp Lys
355 360 365
Asn Thr Arg Val Met Gln Leu Ile Glu Ala Tyr Arg Ser Arg Gly His
370 375 380
Leu Ile Ala Asp Thr Asn Pro Leu Ser Trp Val Gln Pro Gly Met Pro
385 390 395 400
Val Pro Asp His Arg Asp Leu Asp Ile Glu Thr His Ser Leu Thr Ile
405 410 415
Trp Asp Leu Asp Arg Thr Phe Ser Val Gly Gly Phe Gly Gly Lys Glu
420 425 430
Thr Met Thr Leu Arg Glu Val Leu Ser Arg Leu Arg Ala Ala Tyr Thr
435 440 445
Leu Lys Val Gly Ser Glu Tyr Thr His Ile Leu Asp Arg Asp Glu Arg
450 455 460
Thr Trp Leu Gln Asp Arg Leu Glu Ala Gly Met Pro Lys Pro Thr Gln
465 470 475 480
Ala Glu Gln Lys Tyr Ile Leu Gln Lys Leu Asn Ala Ala Glu Ala Phe
485 490 495
Glu Asn Phe Leu Gln Thr Lys Tyr Val Gly Gln Lys Arg Phe Ser Leu
500 505 510
Glu Gly Ala Glu Ala Leu Ile Pro Leu Met Asp Ser Ala Ile Asp Thr
515 520 525
Ala Ala Gly Gln Gly Leu Asp Glu Val Val Ile Gly Met Pro His Arg
530 535 540
Gly Arg Leu Asn Val Leu Phe Asn Ile Val Gly Lys Pro Leu Ala Ser
545 550 555 560
Ile Phe Asn Glu Phe Glu Gly Gln Met Glu Gln Gly Gln Ile Gly Gly
565 570 575
Ser Gly Asp Val Lys Tyr His Leu Gly Ser Glu Gly Gln His Leu Gln
580 585 590
Met Phe Gly Asp Gly Glu Ile Lys Val Ser Leu Thr Ala Asn Pro Ser
595 600 605
His Leu Glu Ala Val Asn Pro Val Met Glu Gly Ile Val Arg Ala Lys
610 615 620
Gln Asp Tyr Leu Asp Lys Gly Val Asp Gly Lys Thr Val Val Pro Leu
625 630 635 640
Leu Leu His Gly Asp Ala Ala Phe Ala Gly Leu Gly Ile Val Pro Glu
645 650 655
Thr Ile Asn Leu Ala Lys Leu Arg Gly Tyr Asp Val Gly Gly Thr Ile
660 665 670
His Ile Val Val Asn Asn Gln Ile Gly Phe Thr Thr Thr Pro Asp Ser
675 680 685
Ser Arg Ser Met His Tyr Ala Thr Asp Tyr Ala Lys Ala Phe Gly Cys
690 695 700
Pro Val Phe His Val Asn Gly Asp Asp Pro Glu Ala Val Val Trp Val
705 710 715 720
Gly Gln Leu Ala Thr Glu Tyr Arg Arg Arg Phe Gly Lys Asp Val Phe
725 730 735
Ile Asp Leu Val Cys Tyr Arg Leu Arg Gly His Asn Glu Ala Asp Asp
740 745 750
Pro Ser Met Thr Gln Pro Lys Met Tyr Glu Leu Ile Thr Gly Arg Glu
755 760 765
Thr Val Arg Ala Gln Tyr Thr Glu Asp Leu Leu Gly Arg Gly Asp Leu
770 775 780
Ser Asn Glu Asp Ala Glu Ala Val Val Arg Asp Phe His Asp Gln Met
785 790 795 800
Glu Ser Val Phe Asn Glu Val Lys Glu Gly Gly Lys Lys Gln Ala Glu
805 810 815
Ala Gln Thr Gly Ile Thr Gly Ser Gln Lys Leu Pro His Gly Leu Glu
820 825 830
Thr Asn Ile Ser Arg Glu Glu Leu Leu Glu Leu Gly Gln Ala Phe Ala
835 840 845
Asn Thr Pro Glu Gly Phe Asn Tyr His Pro Arg Val Ala Pro Val Ala
850 855 860
Lys Lys Arg Val Ser Ser Val Thr Glu Gly Gly Ile Asp Trp Ala Trp
865 870 875 880
Gly Glu Leu Leu Ala Phe Gly Ser Leu Ala Asn Ser Gly Arg Leu Val
885 890 895
Arg Leu Ala Gly Glu Asp Ser Arg Arg Gly Thr Phe Thr Gln Arg His
900 905 910
Ala Val Ala Ile Asp Pro Ala Thr Ala Glu Glu Phe Asn Pro Leu His
915 920 925
Glu Leu Ala Gln Ser Lys Gly Asn Asn Gly Lys Phe Leu Val Tyr Asn
930 935 940
Ser Ala Leu Thr Glu Tyr Ala Gly Met Gly Phe Glu Tyr Gly Tyr Ser
945 950 955 960
Val Gly Asn Glu Asp Ser Val Val Ala Trp Glu Ala Gln Phe Gly Asp
965 970 975
Phe Ala Asn Gly Ala Gln Thr Ile Ile Asp Glu Tyr Val Ser Ser Gly
980 985 990
Glu Ala Lys Trp Gly Gln Thr Ser Lys Leu Ile Leu Leu Leu Pro His
995 1000 1005
Gly Tyr Glu Gly Gln Gly Pro Asp His Ser Ser Ala Arg Ile Glu Arg
1010 1015 1020
Phe Leu Gln Leu Cys Ala Glu Gly Ser Met Thr Val Ala Gln Pro Ser
1025 1030 1035 1040
Thr Pro Ala Asn His Phe His Leu Leu Arg Arg His Ala Leu Ser Asp
1045 1050 1055
Leu Lys Arg Pro Leu Val Ile Phe Thr Pro Lys Ser Met Leu Arg Asn
1060 1065 1070
Lys Ala Ala Ala Ser Ala Pro Glu Asp Phe Thr Glu Val Thr Lys Phe
1075 1080 1085
Gln Ser Val Ile Asp Asp Pro Asn Val Ala Asp Ala Ala Lys Val Lys
1090 1095 1100
Lys Val Met Leu Val Ser Gly Lys Leu Tyr Tyr Glu Leu Ala Lys Arg
1105 1110 1115 1120
Lys Glu Lys Asp Gly Arg Asp Asp Ile Ala Ile Val Arg Ile Glu Met
1125 1130 1135
Leu His Pro Ile Pro Phe Asn Arg Ile Ser Glu Ala Leu Ala Gly Tyr
1140 1145 1150
Pro Asn Ala Glu Glu Val Leu Phe Val Gln Asp Glu Pro Ala Asn Gln
1155 1160 1165
Gly Pro Trp Pro Phe Tyr Gln Glu His Leu Pro Glu Leu Ile Pro Asn
1170 1175 1180
Met Pro Lys Met Arg Arg Val Ser Arg Arg Ala Gln Ser Ser Thr Ala
1185 1190 1195 1200
Thr Gly Val Ala Lys Val His Gln Leu Glu Glu Lys Gln Leu Ile Asp
1205 1210 1215
Glu Ala Phe Glu Ala
1220
<210> 30
<211> 373
<212> PRT
<213> Unknown
<220>
<223> SbtA
<400> 30
Met Asp Phe Leu Ser His Phe Leu Thr Asp Phe Val Gly Gln Leu Gln
1 5 10 15
Ser Pro Thr Leu Ala Phe Leu Ile Gly Gly Met Val Ile Ala Ala Leu
20 25 30
Gly Thr Gln Leu Val Ile Pro Glu Ala Ile Ser Thr Ile Ile Val Phe
35 40 45
Met Leu Leu Thr Lys Ile Gly Leu Thr Gly Gly Met Ala Ile Arg Asn
50 55 60
Ser Asn Leu Thr Glu Met Leu Leu Pro Met Ile Phe Ser Val Ile Leu
65 70 75 80
Gly Ile Leu Ile Val Phe Ile Ala Arg Phe Thr Leu Ala Lys Leu Pro
85 90 95
Asn Val Lys Thr Val Asp Ala Leu Ala Thr Gly Gly Leu Phe Gly Ala
100 105 110
Val Ser Gly Ser Thr Met Ala Ala Ala Leu Thr Thr Leu Glu Glu Ser
115 120 125
Lys Ile Ser Tyr Glu Ala Trp Ala Gly Ala Leu Tyr Pro Phe Met Asp
130 135 140
Ile Pro Ala Leu Val Thr Ala Ile Val Val Ala Asn Ile Tyr Leu Asn
145 150 155 160
Lys Lys Lys Arg Arg Ala Ala Ala Ala Ile Glu Gly Ser Leu Ser Lys
165 170 175
Gln Pro Val Ala Ala Gly Asp Tyr Gly Asp Gln Gln Asp Tyr Pro Arg
180 185 190
Thr Arg Gln Glu Tyr Leu Ser Gln Gln Glu Pro Glu Asp Asn Arg Val
195 200 205
Lys Ile Trp Pro Ile Ile Glu Glu Ser Leu Gln Gly Pro Ala Leu Ser
210 215 220
Ala Met Leu Leu Gly Leu Ala Leu Gly Ile Phe Thr Lys Pro Glu Ser
225 230 235 240
Val Tyr Glu Gly Phe Tyr Asp Pro Leu Phe Arg Gly Leu Leu Ser Ile
245 250 255
Leu Met Leu Ile Met Gly Met Glu Ala Trp Ser Arg Ile Gly Glu Leu
260 265 270
Arg Lys Val Ala Gln Trp Tyr Val Val Tyr Ser Leu Val Ala Pro Ile
275 280 285
Val His Gly Phe Ile Ala Phe Gly Leu Gly Met Ile Ala His Tyr Thr
290 295 300
Thr Gly Phe Ser Leu Gly Gly Val Val Val Leu Ala Val Ile Ala Ala
305 310 315 320
Ser Ser Ser Asp Ile Ser Gly Pro Pro Thr Leu Arg Ala Gly Ile Pro
325 330 335
Ser Ala Asn Pro Ser Ala Tyr Ile Gly Ala Ser Thr Ala Ile Gly Thr
340 345 350
Pro Ile Ala Ile Gly Val Cys Ile Pro Leu Phe Ile Gly Leu Ala Gln
355 360 365
Thr Leu Gly Ala Gly
370
<210> 31
<211> 1119
<212> DNA
<213> Unknown
<220>
<223> SbtA
<400> 31
atggattttt tatcccactt tttaacggat tttgttggac agttgcagtc cccaacccta 60
gcctttttga ttggggggat ggttattgcc gcccttggta cccaattggt aattccagag 120
gcgatttcta cgatcatcgt ctttatgttg ctcactaaga ttggcctgac cgggggcatg 180
gcaattcgca actccaactt aacggaaatg ctcctgccga tgatattctc cgtaatattg 240
ggaattctaa ttgtattcat cgcccgtttt accctggcta aacttcccaa tgttaaaacc 300
gtggatgccc ttgccactgg tggcttgttt ggggcagtta gtggttctac gatggccgcc 360
gccctaacta cgttggaaga atcaaaaatt tcctacgaag cttgggctgg tgccctctat 420
ccttttatgg atattcctgc cctagtaacg gcgatcgtag tggccaatat ttatctcaat 480
aagaagaagc gtcgtgccgc ggccgccatt gagggatctt taagcaagca acccgttgcc 540
gcaggggatt atggcgatca gcaggattat cctcgtaccc gccaggagta tttgagccag 600
caggaaccgg aggataatcg ggtcaagatc tggccgatca tcgaagaaag tttacaaggt 660
cccgccctgt cagccatgtt attaggtctt gcccttggca tatttaccaa gccggaaagt 720
gtctatgaag gtttctatga tcctcttttt cgaggcctac tttctatctt gatgctcatt 780
atggggatgg aggcttggtc cagaattggc gaactacgta aagtagctca atggtatgtg 840
gtctatagcc tggtagctcc gatagtgcac gggtttattg cctttggtct tggtatgatt 900
gcccactaca ctacgggatt cagcctgggc ggtgtcgtag ttttagcagt catcgccgct 960
tctagttctg atatctccgg cccccccacc ttgcgagccg gtatcccgtc ggccaatccc 1020
tctgcttata ttggtgcatc caccgctatc ggtactccca ttgccatcgg cgtgtgcata 1080
ccgcttttca ttgggcttgc ccagaccctt ggtgcaggt 1119
<210> 32
<211> 5803
<212> DNA
<213> Artificial Sequence
<220>
<223> pDCM2
<400> 32
gttcgcttgc tgtccataaa accgcccagt ctagctatcg ccatgtaagc ccactgcaag 60
ctacctgctt tctctttgcg cttgcgtttt cccttgtcca gatagcccag tagctgacat 120
tcatccgggg tcagcaccgt ttctgcggac tggctttcta cgtgttccgc ttcctttagc 180
agcccttgcg ccctgagtgc ttgcggcagc gtgaagctag cttttatcgc cattcgccat 240
tcaggctgcg caactgttgg gaagggcgat cggtgcgggc ctcttcgcta ttacgccagc 300
tggcgaaagg gggatgtgct gcaaggcgat taagttgggt aacgccaggg ttttcccagt 360
cacgacgttg taaaacgacg gccagtgaat tcgagctcgg tacccgggga tcctctagag 420
tcgacctgca ggcatgcaag cttggcgtaa tcatggtcat agctgtttcc tgtgtgaaat 480
tgttatccgc tcacaattcc acacaacata cgagccggaa gcataaagtg taaagcctgg 540
ggtgcctaat gagtgagcta actcacatta attgcgttgc gctcactgcc cgctttccag 600
tcgggaaacc tgtcgtgcca gctgcattaa tgaatcggcc aacgcgcggg gagaggcggt 660
ttgcgtattg ggcgctcttc cgcttcctcg ctcactgact cgctgcgctc ggtcgttcgg 720
ctgcggcgag cggtatcagc tcactcaaag gcggtaatac ggttatccac agaatcaggg 780
gataacgcag gaaagaacat gtgagcaaaa ggccagcaaa aggccaggaa ccgtaaaaag 840
gccgcgttgc tggcgttttt ccataggctc cgcccccctg acgagcatca caaaaatcga 900
cgctcaagtc agaggtggcg aaacccgaca ggactataaa gataccaggc gtttccccct 960
ggaagctccc tcgtgcgctc tcctgttccg accctgccgc ttaccggata cctgtccgcc 1020
tttctccctt cgggaagcgt ggcgctttct caatgctcac gctgtaggta tctcagttcg 1080
gtgtaggtcg ttcgctccaa gctgggctgt gtgcacgaac cccccgttca gcccgaccgc 1140
tgcgccttat ccggtaacta tcgtcttgag tccaacccgg taagacacga cttatcgcca 1200
ctggcagcag ccactggtaa caggattagc agagcgaggt atgtaggcgg tgctacagag 1260
ttcttgaagt ggtggcctaa ctacggctac actagaagga cagtatttgg tatctgcgct 1320
ctgctgaagc cagttacctt cggaaaaaga gttggtagct cttgatccgg caaacaaacc 1380
accgctggta gcggtggttt ttttgtttgc aagcagcaga ttacgcgcag aaaaaaagga 1440
tctcaagaag atcctttgat cttttctacg gggtctgacg ctcagtggaa cgaaaactca 1500
cgttaaggga ttttggtcat gagattatca aaaaggatct tcacctagat ccttttgggg 1560
tgggcgaaga actccagcat gagatccccg cgctggagga tcatccagcc ctgatagaaa 1620
cagaagccac tggagcacct caaaaacacc atcatacact aaatcagtaa gttggcagca 1680
tcacccgacg cactttgcgc cgaataaata cctgtgacgg aagatcactt cgcagaataa 1740
ataaatcctg gtgtccctgt tgataccggg aagccctggg ccaacttttg gcgaaaatga 1800
gacgttgatc ggcacgtaag aggttccaac tttcaccata atgaaataag atcactaccg 1860
ggcgtatttt ttgagttatc gagattttca ggagctgata gaaacagaag ccactggagc 1920
acctcaaaaa caccatcata cactaaatca gtaagttggc agcatcaccc gacgcacttt 1980
gcgccgaata aatacctgtg acggaagatc acttcgcaga ataaataaat cctggtgtcc 2040
ctgttgatac cgggaagccc tgggccaact tttggcgaaa atgagacgtt gatcggcacg 2100
taagaggttc caactttcac cataatgaaa taagatcact accgggcgta ttttttgagt 2160
tatcgagatt ttcaggagct ctttggcatc gtctctcgcc tgtcccctca gttcagtaat 2220
ttcctgcatt tgcctgtttc cagtcggtag atattccaca aaacagcagg gaagcagcgc 2280
ttttccgctg cataaccctg cttcggggtc attatagcga ttttttcggt atatccatcc 2340
tttttcgcac gatatacagg attttgccaa agggttcgtg tagactttcc ttggtgtatc 2400
caacggcgtc agccgggcag gataggtgaa gtaggcccac ccgcgagcgg gtgttccttc 2460
ttcactgtcc cttattcgca cctggcggtg ctcaacggga atcctgctct gcgaggctgg 2520
ccggctaccg ccggcgtaac agatgagggc aagcggatgg ctgatgaaac caagccaacc 2580
aggaagggca gcccacctat caaggtgtac tgccttccag acgaacgaag agcgattgag 2640
gaaaaggcgg cggcggccgg catgagcctg tcggcctacc tgctggccgt cggccagggc 2700
tacaaaatca cgggcgtcgt ggactatgag cacgtccgcg agggcgtccc ggaaaacgat 2760
tccgaagccc aacctttcat agaaggcggc ggtggaatcg aaatctcgtg atggcaggtt 2820
gggcgtcgct tggtcggtca tttcgaaaaa ggttaggaat acggttagcc atttgcctgc 2880
ttttatatag ttcantatgg gattcacctt tatgttgata agaaataaaa gaaaatgcca 2940
ataggatatc ggcattttct tttgcgtttt tatttgttaa ctgttaattg tccttgttca 3000
aggatgctgt ctttgacaac agatgttttc ttgcctttga tgttcagcag gaagctcggc 3060
gcaaacgttg attgtttgtc tgcgtagaat cctctgtttg tcatatagct tgtaatcacg 3120
acattgtttc ctttcgcttg aggtacagcg aagtgtgagt aagtaaaggt tacatcgtta 3180
ggcggatcaa gatccatttt taacacaagg ccagttttgt tcagcggctt gtatgggcca 3240
gttaaagaat tagaaacata accaagcatg taaatatcgt tagacgtaat gccgtcaatc 3300
gtcatttttg atccgcggga gtcagtgaac aggtaccatt tgccgttcat tttaaagacg 3360
ttcgcgcgtt caatttcatc tgttactgtg ttagatgcaa tcagcggttt catcactttt 3420
ttcagtgtgt aatcatcgtt tagctcaatc ataccgagag cgccgtttgc taactcagcc 3480
gtgcgttttt tatcgctttg cagaagtttt tgactttctt gacggaagaa tgatgtgctt 3540
ttgccatagt atgctttgtt aaataaagat tcttcgcctt ggtagccatc ttcagttcca 3600
gtgtttgctt caaatactaa gtatttgtgg cctttatctt ctacgtagtg aggatctctc 3660
agcgtatggt tgtcgcctga gctgtagttg ccttcatcga tgaactgctg tacattttga 3720
tacgtttttc cgtcaccgtc aaagattgat ttataatcct ctacaccgtt gatgttcaaa 3780
gagctgtctg atgctgatac gttaacttgt gcagttgtca gtgtttgttt gccgtaatgt 3840
ttaccggaga aatcagtgta gaataaacgg atttttccgt cagatgtaaa tgtggctgaa 3900
cctgaccatt cttgtgtttg gtcttttagg atagaatcat ttgcatcgaa tttgtcgctg 3960
tctttaaaga cgcggccagc gtttttccag ctgtcaatag aagtttcgcc gactttttga 4020
tagaacatgt aaatcgatgt gtcatccgca tttttaggat ctccggctaa tgcaaagacg 4080
atgtggtagc cgtgatagtt tgcgacagtg ccgtcagcgt tttgtaatgg ccagctgtcc 4140
caaacgtcca ggccttttgc agaagagata tttttaattg tggacgaatc aaattcagaa 4200
acttgatatt tttcattttt ttgctgttca gggatttgca gcatatcatg gcgtgtaata 4260
tgggaaatgc cgtatgtttc cttatatggc ttttggttcg tttctttcgc aaacgcttga 4320
gttgcgcctc ctgccagcag tgcggtagta aaggttaata ctgttgcttg ttttgcaaac 4380
tttttgatgt tcatcgttca tgtctccttt tttatgtact gtgttagcgg tctgcttctt 4440
ccagccctcc tgtttgaaga tggcaagtta gttacgcaca ataaaaaaag acctaaaata 4500
tgtaaggggt gacgccaaag tatacacttt gccctttaca cattttaggt cttgcctgct 4560
ttatcagtaa caaacccgcg cgatttactt ttcgacctca ttctattaga ctctcgtttg 4620
gattgcaact ggtctatttt cctcttttgt ttgatagaaa atcataaaag gatttgcaga 4680
ctacgggcct aaagaactaa aaaatctatc tgtttctttt cattctctgt attttttata 4740
gtttctgttg catgggcata aagttgcctt tttaatcaca attcagaaaa tatcataata 4800
tctcatttca ctaaataata gtgaacggca ggtatatgtg atgggttaaa aaggatcacc 4860
ccagagtccc gctcagaaga actcgtcaag aaggcgatag aaggcgatgc gctgcgaatc 4920
gggagcggcg ataccgtaaa gcacgaggaa gcggtcagcc cattcgccgc caagctcttc 4980
agcaatatca cgggtagcca acgctatgtc ctgatagcgg tccgccacac ccagccggcc 5040
acagtcgatg aatccagaaa agcggccatt ttccaccatg atattcggca agcaggcatc 5100
gccatgggtc acgacgagat cctcgccgtc gggcatccgc gccttgagcc tggcgaacag 5160
ttcggctggc gcgagcccct gatgctcttc gtccagatca tcctgatcga caagaccggc 5220
ttccatccga gtacgtgctc gctcgatgcg atgtttcgct tggtggtcga atgggcaggt 5280
agccggatca agcgtatgca gccgccgcat tgcatcagcc atgatggata ctttctcggc 5340
aggagcaagg tgagatgaca ggagatcctg ccccggcact tcgcccaata gcagccagtc 5400
ccttcccgct tcagtgacaa cgtcgagaca gctgcgcaag gaacgcccgt cgtggccagc 5460
cacgatagcc gcgctgcctc gtcttggagt tcattcaggg caccggacag gtcggtcttg 5520
acaaaaagaa ccgggcgccc ctgcgctgac agccggaaca cggcggcatc agagcagccg 5580
attgtctgtt gtgcccagtc atagccgaat agcctctcca cccaagcggc cggagaacct 5640
gcgtgcaatc catcttgttc aatcatgcga aacgatcctc atcctgtctc ttgatcagat 5700
cttgatcccc tgcgccatca gatccttggc ggcaagaaag ccatccagtt tactttgcag 5760
ggcttcccaa ccttaccaga gggcgcccca gctggcaatt ccg 5803
<---
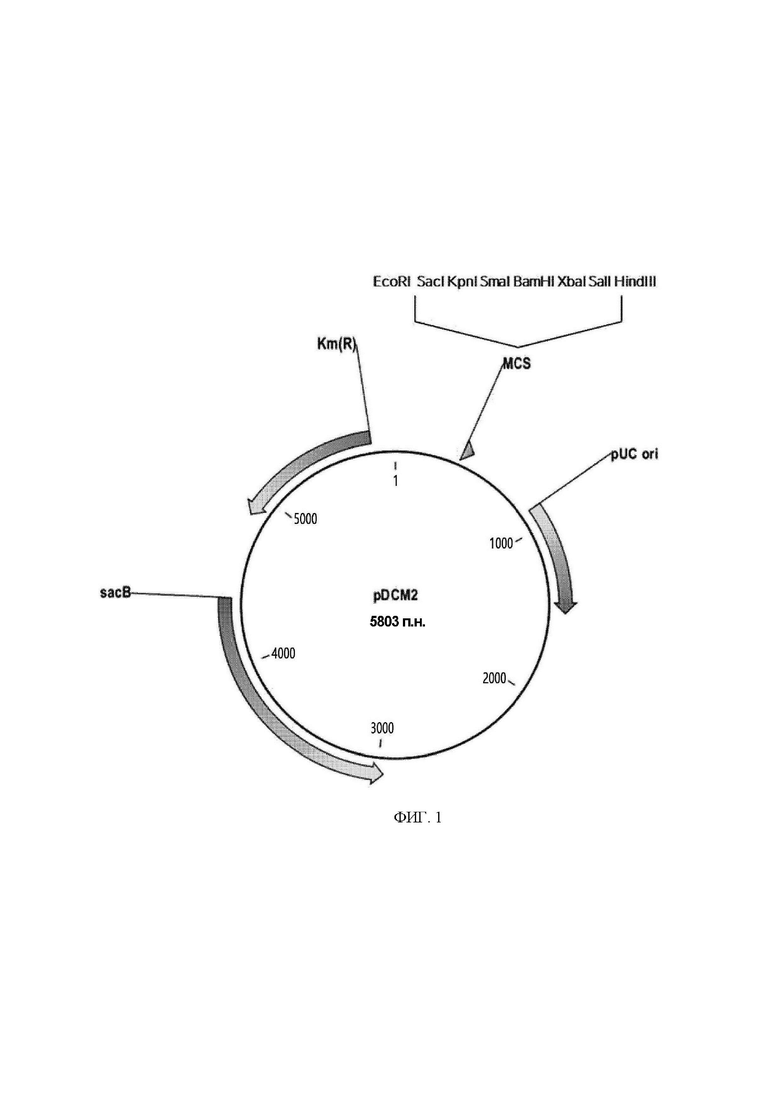
Изобретение относится к биотехнологии. Предложен рекомбинантный микроорганизм рода Corynebacterium, продуцирующий L-глутаминовую кислоту и содержащий белок SbtA или полинуклеотид, кодирующий указанный белок SbtA. Также предложен способ получения L-глутаминовой кислоты, включающий культивирование в среде указанного микроорганизма рода Corynebacterium. Изобретение обеспечивает продуцирование L-глутаминовой кислоты с высоким выходом. 2 н. и 9 з.п. ф-лы, 1 ил., 5 табл., 4 пр.
1. Рекомбинантный микроорганизм рода Corynebacterium, продуцирующий L-глутаминовую кислоту, где указанный рекомбинантный микроорганизм содержит белок SbtA или полинуклеотид, кодирующий указанный белок SbtA.
2. Рекомбинантный микроорганизм по п. 1, где указанный белок SbtA имеет происхождение из цианобактерий.
3. Рекомбинантный микроорганизм по п. 1, где указанный белок SbtA содержит аминокислотную последовательность SEQ ID NO: 1.
4. Рекомбинантный микроорганизм по п. 1, где указанный рекомбинантный микроорганизм рода Corynebacterium представляет собой Corynebacterium glutamicum.
5. Рекомбинантный микроорганизм по п. 1, где дополнительно инактивирована активность белка OdhA.
6. Способ получения L-глутаминовой кислоты, включающий культивирование в среде рекомбинантного микроорганизма рода Corynebacterium, продуцирующего L-глутаминовую кислоту, где указанный рекомбинантный микроорганизм содержит белок SbtA или полинуклеотид, кодирующий указанный белок SbtA.
7. Способ по п. 6, где указанный белок SbtA имеет происхождение из цианобактерий.
8. Способ по п. 6, где указанный белок SbtA содержит аминокислотную последовательность SEQ ID NO: 1.
9. Способ по п. 6, где указанный рекомбинантный микроорганизм рода Corynebacterium представляет собой Corynebacterium glutamicum.
10. Способ по п. 6, дополнительно включающий извлечение L-глутаминовой кислоты из указанных рекомбинантного микроорганизма или среды.
11. Способ по п. 6, где дополнительно инактивирована активность белка OdhA.
| WO 2012040361 A2, 29.03.2012 | |||
| CN 108250278 A, 06.07.2018 | |||
| WO 2006070944 A2, 06.07.2006 | |||
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ СЕМЕЙСТВА ГЛУТАМАТА С ИСПОЛЬЗОВАНИЕМ КОРИНЕФОРМНОЙ БАКТЕРИИ | 2011 |
|
RU2496867C2 |
Авторы
Даты
2024-04-11—Публикация
2021-06-30—Подача