Изобретение относится к ветеринарной вирусологии, к средствам молекулярной диагностики, а именно для генотипирования изолятов и штаммов возбудителя парвовирусного энтерита собак на основе филогенетического анализа с применением оригинальных олигонуклеотидных праймеров для высоковариабельного участка гена VP2.
При проведении генетических исследований требуется достоверно проводить филогенетический анализ за счет исследования полногеномных последовательностей нуклеиновых кислот организмов с выявлением высоко вариабельных областей генома [1].
Опасным инфекционным агентом, для полевых изолятов и штаммов которого требуется проводить генотипирование является возбудитель парвовирусного энтерита Canine parvovirus (CPV), который вызывает острый, иногда с летальным исходом, гастроэнтерит у собак. Данный вирус принадлежит к роду Protoparvovirus семейства Parvoviridae. Возбудитель парвовирусного энтерита собак автономно реплицируется в клетках-хозяев и генетически связан с парвовирусом кошек (FPV) и вирусом энтерита норок (MEV), которые инфицируют разных животных. Оригинальный CPV был впервые идентифицирован в 1978 году и быстро распространился по всему миру [1, 2].
Геном возбудителя парвовирусного энтерита представлен двуцепочечной молекулой ДНК длиной около 4200-4300 п.н. В результате проведения его картирования определили, что участок ДНК в диапазоне 1…2007 п.н. кодирует два неструктурных белка NS1 и NS2. Структурный белок VP1 кодируется участками в диапазонах 2014…2044 и 2117…2514 п.н., a VP2 - 2515…4269 п.н. [3]. Большинство зарегистрированных случаев рекомбинации в гене VP2 возбудителя парвовирусного энтерита собак [4].
В настоящее время известны следующие генотипы CPV: 1, 2а, 2b, 2с, 3, которые по-разному распространены в популяции собак во всем мире [5]. Для изготовления вакцин против парвовирусного энтерита собак в РФ применяются вакцинные штаммы генотипов 2а, 2b, 2с [2, 4].
Парвовирус собак характеризуется высокой степенью изменчивости и большим антигенным разнообразием штаммов, что значительно снижает эффективность существующих вакцин. Генетический анализ возбудителя парвовирусного энтерита собак обычно приводит к звездообразному филогенетическому дереву с небольшой статистической достоверностью, что не позволяет корректно идентифицировать штаммы CPV [4].
Изучение генетической структуры штаммов парвовируса собак, циркулирующих на территории РФ, значительно облегчит разработку средств специфической профилактики, обеспечивающих надежную защиту от данной инфекции [6]. Исходя из этого, актуально проводить генотипирование полевых изолятов и вакцинных штаммов CPV и идентифицированные актуальные штаммы применять для создания эффективных вакцинных препаратов относительно возбудителя того или иного генотипа.
В связи с этим целесообразно провести разработку способа для идентификации генома полевых изолятов и вакцинных штаммов возбудителя парвовирусного энтерита собак. Для решения поставленной задачи требуется осуществить молекулярно-биологический анализ генома CPV, что даст возможность разработать способ генотипирования изолятов и штаммов возбудителя парвовирусного энтерита собак на основе филогенетического анализа с применением оригинальных олигонуклеотидных праймеров для высоковариабельного участка гена VP2.
В настоящее время методы молекулярно-биологического анализа находят широкое применение в диагностике различных инфекционных заболеваний, в частности, обратная транскрипция, полимеразная цепная реакция и секвенирование для исследования генома возбудителя парвовирусного энтерита собак [3, 4, 7].
Прототипным способом для филогенетического анализа CPV в настоящее время является реакция амплификации участка гена VP2 (размер 427 п.н.) с последующим секвенированием (Zaher K.S. et al.) [8]. Однако, ампликоны, которые получают в результате применения указанного способа включают в себя невысокое количество нуклеотидных замен (участок не является высоко вариабельным и содержит в среднем 1,78±0,04% замен, кроме того, участок имеет недостаточную длину для детального генетического анализа). Для проведения достоверного филогенетического анализа требуется определить участок генома CPV в высокой степенью вариабельности и разработать такие олигонуклеотидные праймеры для ПЦР и секвенирования, которые позволят амплифицировать данный продукт. Исходя из этого, необходимо разработать альтернативный способ генотипирования изолятов и штаммов возбудителя парвовирусного энтерита собак.
Задачей настоящего изобретения является разработка способа генотипирования изолятов и штаммов возбудителя парвовирусного энтерита собак на основе филогенетического анализа с применением оригинальных олигонуклеотидных праймеров с целью устранения вышеуказанных недостатков.
Данная задача решена благодаря разработке способа генотипирования изолятов и штаммов возбудителя парвовирусного энтерита собак на основе филогенетического анализа с применением оригинальных олигонуклеотидных праймеров для высоковариабельного участка гена VP2.
Разработанный способ дает возможность: 1) амплифицировать высоковариабельный участок гена VP2 ДНК CPV размером 1308 п.н. (длина в 3 раза больше); 2) проводить достоверный филогенетический анализ полевых изолятов и вакцинных штаммов возбудителя парвовирусного энтерита собак, поскольку в получаемом ампликоне среднее количество замен составляет 28,56±1,21% в сравнении с ПНР-продуктом в прототипном способе. Данная разработка позволит проводить дифференциацию полевых изолятов и штаммов CPV и осуществлять их филогенетический анализ для создания эффективных вакцинных препаратов.
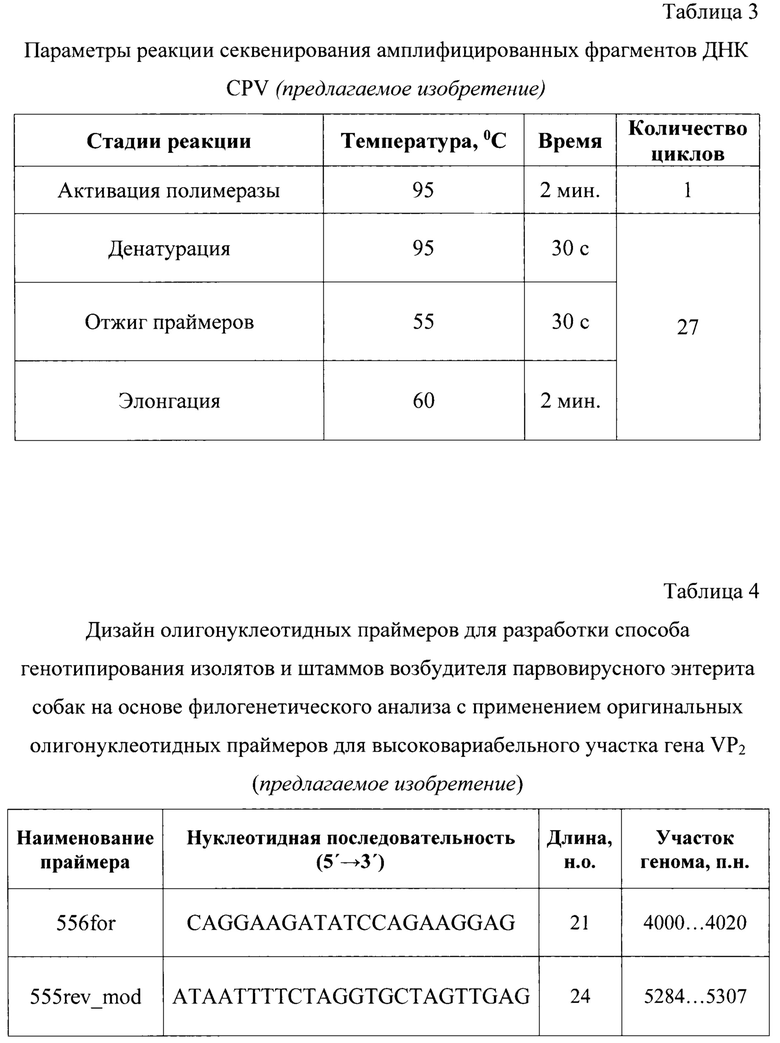
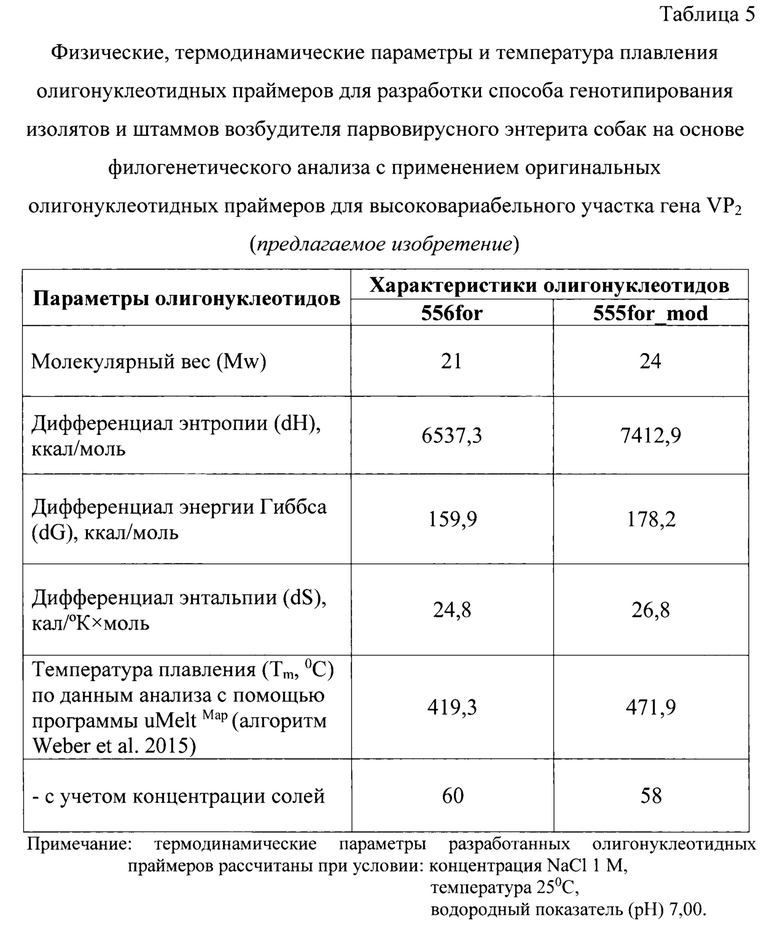
Сущность изобретения отражена на графических изображениях.
Фиг. 1 - Картирование прямого и обратного оригинальных праймеров, разработанных для генотипирования изолятов и штаммов возбудителя парвовирусного энтерита собак на основе филогенетического анализа с применением оригинальных олигонуклеотидных праймеров для высоковариабельного участка гена VP2. Примечание: для обратного праймера дан формат «rev-complement» - обратная комплементарная форма.
Фиг. 2 - Филогенетическое древо для некоторых изолятов/штаммов CPV, построенное по данным, полученным с помощью разработанного способа. Примечание: количество повторов 1000, алгоритм для построения maximum likelihood, маркер «ромб» отражает изученные изоляты/штаммы возбудителя парвовирусного энтерита собак.
Сущность изобретения пояснена в перечне последовательностей, в котором:
SEQ ID NO: 1 представляет последовательность нуклеотидов гена VP2 ДНК CPV штамма «Chip»;
SEQ ID NO: 2 представляет последовательность аминокислот, соответствующих участку гена VP2 ДНК CPV штамма «Chip»;
SEQ ID NO: 3 представляет последовательность нуклеотидов гена VP2 ДНК CPV штамма «Gray»;
SEQ ID NO: 4 представляет последовательность аминокислот, соответствующих участку гена VP2 ДНК CPV штамма «Gray»;
SEQ ID NO: 5 представляет последовательность нуклеотидов гена VP2 ДНК CPV штамма «Valenta»;
SEQ ID NO: 6 представляет последовательность аминокислот, соответствующих участку гена VP2 ДНК CPV штамма «Valenta»;
SEQ ID NO: 7 представляет последовательность нуклеотидов гена VP2 ДНК CPV штамма «Агспу»;
SEQ ID NO: 8 представляет последовательность аминокислот, соответствующих участку гена VP2 ДНК CPV штамма «Archy».
Сущность изобретения заключается в создании способа генотипирования изолятов и штаммов возбудителя парвовирусного энтерита собак на основе филогенетического анализа с применением оригинальных олигонуклеотидных праймеров для высоковариабельного участка гена VP2.
Заявляемый способ основан на:
1) элюировании ДНК из исследуемого биологического материала;
2) осуществлении амплификации специфического фрагмента гена VP2 ДНК парвовируса собак в диапазоне 4000…5307 п.н. с применением разработанных оригинальных олигонуклеотидных высокоспецифичных праймеров 556 for и 555 rev mod (длина ампликона 1308 п.н.);
3) проведении очистки продуктов ПНР;
4) секвенировании ампликона с применением разработанных оригинальных олигонуклеотидных высокоспецифичных праймеров 556 for и 555 rev_mod;
5) проведении филогенетического анализа с применением алгоритма maximum likelyhood и заключение о принадлежности изолята/штамма к определенному генотипу возбудителя парвовирусного энтерита собак.
В публикациях многих авторов также показана необходимость проведения генотипирования полевых изолятов и вакцинных штаммов CPV.
По данным проведенного анализа литературных данных, в настоящее время подобный анализ проводят с помощью ПЦР и секвенирования участка гена VP], однако он содержит недостаточно высокое для проведения глубокого филогенетического анализа количество замен [2]. В наиболее близком прототипе [8] предлагают анализировать короткий участок гена VP2, однако он имеет размер 427 п.н., что недостаточно для детального, достоверного филогенетического анализа. При анализе публикаций способ для проведения филогенетического анализа полевых изолятов и вакцинных штаммов CPV методом секвенирования с применением оригинальных высокоспецифичных олигонуклеотидных праймеров для высоковариабельного участка гена VP2 в диапазоне 4000…5307 п.н. (размер ампликона 1308 п.н.) также не представлен. Таким образом, сведений об аналогах предлагаемого способа генотипирования изолятов и штаммов возбудителя парвовирусного энтерита собак на основе филогенетического анализа с применением оригинальных олигонуклеотидных праймеров для высоковариабельного участка гена VP2 авторами не обнаружено.
Разработанный способ генотипирования изолятов и штаммов возбудителя парвовирусного энтерита собак на основе филогенетического анализа с применением оригинальных олигонуклеотидных праймеров для высоковариабельного участка гена VP2 по сравнению с прототипом отличается высокой достоверностью, что позволяет точно определить принадлежность исследуемого штамма CPV к тому или иному генотипу.
В отличие от прототипа разработанный способ позволяет провести анализ выравнивания множественных нуклеотидных последовательностей геномов штаммов и изолятов возбудителя парвовирусного энтерита собак и идентифицировать область гена VP2 с высоким количеством нуклеотидных замен (в среднем они составляют 28,56±1,21%). Данный способ предусматривает проведение реакции амплификации специфического фрагмента ДНК CPV в диапазоне 4000…5307 п.н. с применением разработанных оригинальных олигонуклеотидных высокоспецифичных праймеров 556 for и 555 rev_mod для амплификации фрагмента размером 1308 п.н., содержащего нуклеотидные замены, позволяющие провести точный филогенетический анализ. Таким образом, актуально применять предложенный способ для генотипирования полевых изолятов и вакцинных штаммов CPV методом секвенирования с применением оригинальных олигонуклеотидных праймеров для высоковариабельного участка гена VP2 в диапазоне 4000…5307 п.н. ДНК возбудителя парвовирусного энтерита собак.
Ключевым элементом заявляемого способа является амплификация участка ДНК CPV гена VP2 в диапазоне 4000…5307 п.н. с высоким количеством нуклеотидных замен с последующим секвенированием ампликонов и проведением детального филогенетического анализа штаммов возбудителя парвовирусного энтерита собак.
Сопоставительный анализ с прототипом позволяет сделать вывод, что новизна и изобретательский уровень заявляемого изобретения заключается в применении способа генотипирования изолятов и штаммов возбудителя парвовирусного энтерита собак на основе филогенетического анализа с применением оригинальных олигонуклеотидных праймеров для высоковариабельного участка гена VP2 в диапазоне 4000…5307 п.н. ДНК CPV.
Технический результат от изобретения заключается в проведении точного филогенетического анализа полевых изолятов и штаммов возбудителя парвовирусного энтерита собак с применением оригинальных олигонуклеотидных праймеров для высоковариабельного участка гена VP2, что позволит осуществлять генотипирование изолятов/штаммов и на основе этого составлять композицию штаммов для эффективных вакцинных препаратов.
Сущность предлагаемого изобретения пояснена на графическом материале: Картирование прямого и обратного оригинальных праймеров, разработанных для генотипирования изолятов и штаммов возбудителя парвовирусного энтерита собак на основе филогенетического анализа с применением оригинальных олигонуклеотидных праймеров для высоковариабельного участка гена VP2 (фиг.1).
На первом этапе исследования проводят выделение ДНК из анализируемых образцов, содержащих возбудитель парвовирусного энтерита собак с применением твердофазного способа экстракции на стекловолокнистых фильтрах GF/F и 4,4 М раствора гуанидинтиоциата в качестве сильного детергента и смеси 85% изопропилового спирта и 80% этилового спирта, взятых в соотношении 2:1, для отмывания остатков балластных компонентов из пробы. Элюирование осуществляют в деионизированной воде объемом 50 мкл.
На этапе выделения нуклеиновой кислоты применяют положительный контроль (ДНК CPV) и отрицательный контроль (деионизированная вода без нуклеаз MilliQ вместо ДНК-матрицы).
Полученный образец, содержащий ДНК, исследуют с помощью спектрофотометра Implen NanoPhotometer P-Class (Р-360) или аналога для определения степени чистоты и концентрации нуклеиновой кислоты. Элюат ДНК считают свободным от примесей белка и карболовой кислоты, если OD260/OD280 (коэффициент экстинкции R1) находится в пределах 1,8-2,2 и оптимально составлял примерно 2,0. Более низкие значения R1 указывают на наличие пептидных связей в экстракте. Более высокие значения коэффициента R1 свидетельствуют о наличии свободных дезоксирибонуклеотидов.
Экстракт нуклеиновой кислоты вируса считали незагрязненным полисахаридами, если OD260/OD235 (коэффициент экстинкции R2) приближен к значению 2,000. При замещении 1% ДНК на полисахаридные составляющие R2 снижался на 0,002. Значения коэффициента R2 большие 2,000 могли указывать на деградацию молекул нуклеиновой кислоты. Отсутствие взвеси крупных частиц в элюате подтверждалось, если OD320 приближена к нулевому значению.
По итогам предварительно проведенной работы определяют, что допустимая концентрация РНК в образце для последующих этапов анализа должна быть не ниже 3 нг/мкл.
На следующем этапе исследования проводят реакцию амплификации в соответствии с прописью, которая отражена в таблице 1. Для анализа на 1 реакцию используют по 2 мкл прямого и обратного праймера (концентрация по 10 пмоль/мкл), дезоксирибонуклеозидтрифосфаты (по 10 мМ каждого) 2 мкл, хлорид магния (концентрация 25 мМ) - 2 мкл, буферный раствор для ПЦР (5х, Promega GoTag Flexi, или аналог) - 10 мкл, GoTaq Flaxi ДНК-пол имераза - 0.5 мкл, деионизированная вода - 22 мкл. Объем вносимого образца ДНК CPV - 6 мкл, общий объем реакционной смеси составляет 50,5 мкл.
Режимы термоциклирования реакции амплификации отражены в таблице 2, из которой следует, что предварительную денатурацию осуществляют при температуре 95°С в течение 5 мин (1 цикл). ПЦР проводят в течение 40 циклов, каждый из которых складывается из трех подэтапов: денатурация при температуре 94°С в течение 30 с, отжиг праймеров при температуре 55°С в течение 30 с, элонгация при температуре 72°С в течение 60 с.
При проведении ПЦР применяют положительный контроль (ДНК CPV) и отрицательный контроль (деионизированная вода без нуклеаз MilliQ вместо ДНК-матрицы).
Для детекции ПЦР-продуктов проводят горизонтальный гель-электрофорез в 1% агарозном геле по стандартной методике, внося в лунку геля весь объем исследуемой пробы. Оценивают наличие ампликонов. Критерии правильности проведенного исследования: для положительного контроля на этапе выделения нуклеиновой кислоты и положительного контроля на этапе проведения реакции амплификации должно быть наличие 1ТЦР-продукта с размером 1308 п.н., что можно оценить с помощью маркера молекулярного веса для фрагментов ДНК. Для отрицательного контроля на этапе выделения нуклеиновой кислоты и постановки ПЦР ампликоны не обнаруживаются. При соблюдении данных условий можно детектировать промежуточные результаты реакции амплификации: при наличии светящихся бендов делают вывод о наличии специфического ПЦР-продукта (проба положительная, ее исследуют далее на следующих этапах работы), в случае отсутствия полос - ампликонов нет (проба отрицательная).
Проводят очистку ПЦР-продуктов из агарозного геля по стандартной методике. Готовят 4,4 М раствор ГТЦ и 80%-ный раствор изопропилового спирта. Выставляют 3 ряда пробирок на 1,5 мл по количеству проб. В первый ряд пробирок вносят по 400 мкл 4М ГТЦ и добавляют пробы. Полученные смеси вносят на фильтр прибора Manifold, включают вакуумный насос и промывают фильтры 3 раза по 700 мкл пропанолом-2. Выключают насос.Переносят колонки в пробирки второго ряда и центрифугируют 1 минуту при скорости 13 400 об/мин. Колонки переносят в пробирки третьего ряда, вносят по 40 мкл деионизированной воды, инкубируют 1 минуту и центрифугируют при 13 400 об/мин. Полученные пробы исследуют с помощью гель-электрофореза для подтверждения очистки и наличия ампликонов. Очищенные ПНР-продукты исследуют с помощью спектрофотометра Implen NanoPhotometer P-Class (Р-360) или аналога для определения степени чистоты ампликонов и концентрации нуклеиновой кислоты (достаточное содержание ПЦР-продуктов составляет 20 нг/мкл).
Проводят секвенирование ПЦР-продуктов. Определение нуклеотидных последовательностей полученных фрагментов генома CPV осуществляют с использованием наборов производства Applied Biosystems (США) на автоматическом секвенаторе ABI Prism 3130/3130×1 (Applied Biosystems, США) согласно инструкциям производителя. Реакцию секвенирования осуществляют в программируемом амплификаторе с использованием набора Big Dye Terminator Kit версия 1.1 или 3.1 (Applied Biosystems, США). Перед началом сбора смеси необходимо разморозить все необходимые компоненты реакции, встряхнуть на шейкере, затем центрифугировать несколько секунд на низкоскоростной центрифуге.
Для реакции секвенирования амплифицированного фрагмента ДНК реакционная смесь собирается отдельно с каждым праймером 556 for и 556 rev_mod. Реакционная смесь общим объемом 17,5 мкл на одну реакцию включает в себя следующие компоненты: Big Dye Terminator Kit - 8,0 мкл, буфер 5х для секвенирования - 8,0 мкл, раствор праймера (10 пмоль/мкл) -1,0 мкл, Dream Taq ДНК-полимераза - 0,5 мкл. Приготовленную реакционную смесь перемешивают, центрифугируют и вносят по 17,5 мкл в соответствующее количество пробирок объемом 0,2 мл. В пробирки с реакционной смесью добавляют 5 мкл очищенного фрагмента кДНК FCV. Общий объем реакции составляет 22,5 мкл.
Поверх смеси наслаивают 15 мкл минерального масла, чтобы исключить возможность ее испарения, даже в случае использования амплификатора с подогреваемой крышкой. Центрифугируют пробирки.
Приготовленные пробирки устанавливают в амплификатор и проводят реакцию в соответствии с температурно-временным режимом, представленном в таблице 3. Активацию ДНК-полимеразы проводят при температуре 95°С в течение 2 мин в течение 1 цикла. Секвенирование осуществляют за 27 циклов, каждый из которых состоит из трех подэтапов: денатурация при температуре 95°С в течение 30 с, отжиг праймеров при температуре 55°С в течение 30 с, элонгация при температуре 60°С в течение 2 мин.
Анализируют сиквенсы, полученные в результате исследования. Проводят выравнивания последовательностей нуклеотидов участка гена VP2 ДНК CPV в диапазоне 4000…5307 п.н. (размер ПЦР-продукта 1308 п.н.). С помощью программы MEGA X дают заключение о принадлежности изолята/штамма к определенному генотипу возбудителя парвовирусного энтерита собак. Проводят построение филогенетического древа с обозначением месторасположения на нем интересующего штамма CPV.
Разработанный в ФГБУ «ВНИИЗЖ» способ является новым и промышленно применимым. Способ создан путем подбора дизайна праймеров и других компонентов реакции, лабораторной оценки основных характеристик и совместного использования сведений, содержащихся в уровне техники, а также общих знаний специалиста в области биотехнологии.
Сущность изобретения поясняется на следующих примерах, полученных при апробации предлагаемого способа.
Пример 1. Разработка оригинальных олигонуклеотидных праймеров для способа генотипирования изолятов и штаммов возбудителя парвовирусного энтерита собак на основе филогенетического анализа с применением оригинальных олигонуклеотидных праймеров для высоковариабельного участка гена VP2
Для проведения генотипирования изолятов и штаммов CPV методом секвенирования разрабатывали оригинальные специфичные олигонуклеотидные праймеры для высоковариабельного участка ДНК возбудителя парвовирусного энтерита собак. Так, для выявления регионов ДНК CPV с высоким количеством различий между изолятами и штаммами данного вируса проводили выравнивание полногеномных последовательностей изолятов и штаммов, опубликованных в GenBank [9]. Для анализа из Genbank были взяты последовательности наиболее часто применяемые 21 следующих изолятов и штаммов CPV: «CPV-H15», «CPV-RS-89», «CPV-98H» (генотип 1), «Beijing 2014», «CPV-N», «KH 18», «CPV/Raccoon/RC14/BC 2010», «CPV/Iran», «CPV01», «SH14» (генотип 2a), «CPV Ankara», «CPV-2b-K5-TR», «5 MGL», «CPV Par2-2022», «CPV QD-202» (генотип 2b), «FM 14», «CPV-BJ-C28», «CPV-SH2003», «НВ2017», «CU24», «CPV-SH1516» (генотип 2c).
В результате сравнительного анализа был выбран регион в диапазоне 4000…5307 п.н., поскольку именно данная область имеет наибольшее количество нуклеотидных замен в геноме CPV. Для данного участка разработали прямой и обратный оригинальные олигонуклеотидные праймеры, которые были гомологичны выбранным 21 последовательностям нуклеотидов исследуемого вируса и позволили проводить амплификацию фрагмента размером 1308 п.н. (длина аминокислотной последовательности составляет 436 а.о.), содержащего высокое количество нуклеотидных замен. Дизайн олигонуклеотидов представлен в таблице 4 и имеет следующий вид: 556 for-праймер - 5'-CAGGAAGATATCCAGAAGGAG-3' и 555 rev_mod-праймер -5'-ATAATTTTCTAGGTGCTAGTTGAG-3'.
Вышеупомянутые праймеры были отобраны, синтезированы и очищены. Специфичность последовательностей праймеров проверяли с помощью базового инструмента поиска локального выравнивания (NCBI/Primer-BLAST). Определены температуры плавления (Tm) для каждого олигонуклеотида. Термодинамические характеристики праймеров отражены в таблице 5, из которой следует, что температуры плавления разработанных олигонуклеотидов составляют около 58-60°С. Проводя эксперименты по использованию данных праймеров выявили, что экспериментальная температура отжига составила 55°С, исходя из этого, для разработанного способа было решено проводить отжиг олигонуклеотидов именно при температуре 55°С, что позволило синтезировать ампликоны в максимальном количестве (концентрация составила не менее 45 нг/мкл).
При анализе нуклеотидных последовательностей олигонуклеотидов установили, что для праймеров не характерно образование «шпилек», а также не выявлено 3'-комплементарности и сайтов, отжигающих сами на себя. Расчет вероятности образования «шпилек» и димеров олигонуклеотидов проводили при условии, что минимальное количество пар оснований, необходимых для димеризации, - 5, а для образования «шпилек», - 4.
Таким образом, были разработаны оригинальные специфичные олигонуклеотидные праймеры, которые позволили использовать для проведения филогенетического анализа изолятов и вакцинных штаммов CPV методом секвенирования с применением оригинальных олигонуклеотидных праймеров для высоковариабельного участка гена VP2 ДНК возбудителя парвовирусного энтерита собак.
Пример 2. Применение способа генотипирования вакцинных штаммов возбудителя парвовирусного энтерита собак на основе филогенетического анализа с применением оригинальных олигонуклеотидных праймеров для высоковариабельного участка гена VP2
Проводили выделение нуклеиновой кислоты из суспензии возбудителя парвовирусного энтерита собак штаммов «Chip», «Gray», «Valenta» и «Archy» с применением твердофазного способа экстракции, представленного выше. На этапе выделения нуклеиновой кислоты применяли положительный контроль (ДНК CPV) и отрицательный контроль (деионизированная вода без нуклеаз MilliQ вместо ДНК-матрицы).
Полученные образцы, содержащие ДНК CPV штаммов «Chip», «Gray», «Valenta» и «Archy», исследовали с помощью спектрофотометра Implen NanoPhotometer P-Class (Р-360) для определения степени чистоты и концентрации нуклеиновой кислоты, как представлено выше. Элюаты ДНК считали свободными от примесей белка, поскольку коэффициент экстинкции OD260/OD280 (R1) находился в пределах 1,80-2,20 и составил 1,979-2,001. Экстракт нуклеиновой кислоты вируса считали незагрязненным полисахаридами, поскольку коэффициент экстинкции OD260/OD235 (R2) приближен к значению 2,000 и находился в диапазоне 1,997-2,001. Отсутствие взвеси крупных частиц в элюате подтверждалось, поскольку OD320 составила не более 0,001. Концентрация ДНК CPV для элюатов ДНК CPV штаммов «Chip», «Gray», «Valenta» и «Archy» составила 48, 42, 45, 58 нг/мкл, что является достаточным для получения надежного результата.
На следующем этапе проводили ПЦР с разработанными оригинальными высокоспецифичными олигонуклеотидными праймерами, как отражено выше. Для детекции ампликонов проводили горизонтальный гель-электрофорез в 1% агарозном геле по стандартной методике, внося в лунку геля весь объем исследуемой пробы. Оценивали наличие ампликонов. Критерии правильности проведенного исследования отражены выше. В результате электрофореза обнаружили наличие бэнда размером 1308 п.н. для положительного контроля на этапе выделения ДНК, положительного контроля на этапе постановки ПЦР и для исследуемой пробы. По данным анализа выявили наличие светящихся продуктов ПЦР требуемого размера для положительных контролей и проб элюатов ДНК возбудителя парвовирусного энтерита собак штаммов «Chip», «Gray», «Valenta» и «Archy».
Проводили очистку ПЦР-продуктов из агарозного геля по стандартной методике, как описано выше. Очищенные ПНР-продукты исследовали с помощью спектрофотометра Implen NanoPhotometer P-Class (Р-360) для определения степени чистоты ампликонов и концентрации нуклеиновой кислоты. По результатам исследования выявили, что ампликоны имели высокую степень чистоты. Элюаты считали свободными от примесей белка и аминокислот, поскольку коэффициент экстинкции OD260/OD280 (R1) находился в пределах 1,80-2,20 и составил 1,998-2,001. ПЦР-продукты были незагрязненным полисахаридами, поскольку коэффициент экстинкции OD260/OD235 (R2) составил 1,998-2,000. Отсутствие взвеси крупных частиц в элюате подтверждилось, поскольку OD320 составила 0,000. Концентрация ПЦР-продукта составила 48, 42, 45, 58 нг/мкл, что является допустимым и высоким значением для получения надежного результата (более 20 нг/мкл). После очистки ПЦР-продуктов проводили гель-электрофорез, результаты которого были удовлетворительными, а именно, ампликоны необходимого размера присутствовали на электрофореграмме.
Провели секвенирование ПЦР-продукта для штаммов «Chip», «Gray», «Valenta» и «Archy» CPV (было изначально получено 10 одинаковых проб для повышения достоверности анализа с помощью секвенирования), как описано выше. Анализировали сиквенсы, полученные в результате исследования. Осуществляли выравнивание последовательностей нуклеотидов участка гена VP2 в диапазоне 4000…5307 п.н. (размер ПЦР-продукта 1308 п.н.) ДНК возбудителя парвовирусного энтерита собак штаммов «Chip», «Gray», «Valenta» и «Archy» со следующей группой изолятов/штаммов: «CPV-H15», «CPV-RS-89», «CPV-98H» (генотип 1), «Beijing 2014», «CPV-N», «КН 18», «CPV/Raccoon/RC14/BC 2010», «CPV/Iran», «CPV01», «SH14» (генотип 2a), «CPV Ankara», «CPV-2b-K5-TR», «5 MGL», «CPV Par2-2022», «CPV QD-202» (генотип 2b), «FM 14», «CPV-BJ-С28», «CPV-SH2003», «НВ2017», «CU24», «CPV-SH1516» (генотип 2c).
С помощью программы MEGA X [10] дали заключение о принадлежности штаммов «Chip», «Gray», «Valenta» к генотипу 2а, а штамма «Archy» - к генотипу 2b возбудителя парвовирусного энтерита собак. Результаты анализа представили на филогенетическом древе с обозначением месторасположения на нем интересующих штаммов (фиг.2).
Пример 3. Применение способа генотипирования полевых изолятов возбудителя парвовирусного энтерита собак на основе филогенетического анализа с применением оригинальных олигонуклеотидных праймеров для высоковариабельного участка гена VP2
Проводили выделение нуклеиновой кислоты из суспензии возбудителя парвовирусного энтерита собак полевых изолятов «K01708-3», «S», «UY247» и «II» с применением твердофазного способа экстракции, представленного выше. На этапе выделения нуклеиновой кислоты применяли положительный контроль (ДНК CPV) и отрицательный контроль (деионизированная вода без нуклеаз MilliQ вместо ДНК-матрицы).
Полученные образцы, содержащие ДНК CPV полевых изолятов «K01708-3», «S», «UY247» и «II», исследовали с помощью спектрофотометра Implen NanoPhotometer P-Class (Р-360) для определения степени чистоты и концентрации нуклеиновой кислоты, как представлено выше. Элюаты ДНК считали свободными от примесей белка, поскольку коэффициент экстинкции OD260/OD280 (R1) находился в пределах 1,80-2,20 и составил 1,98-2,00. Экстракт нуклеиновой кислоты вируса считали незагрязненным полисахаридами, поскольку коэффициент экстинкции OD260/OD235 (R2) приближен к значению 2,000 и находился в диапазоне 1,996-2,000. Отсутствие взвеси крупных частиц в элюате подтверждалось, поскольку OD320 составила не более 0,001. Концентрация ДНК CPV для элюатов ДНК CPV полевых изолятов «K01708-3», «S», «UY247» и «II» составила 52, 54, 48, 45 нг/мкл, что является достаточным для получения надежного результата.
На следующем этапе проводили ПЦР с разработанными оригинальными высокоспецифичными олигонуклеотидными праймерами, как отражено выше. Для детекции ампликонов проводили горизонтальный гель-электрофорез в 1% агарозном геле по стандартной методике, внося в лунку геля весь объем исследуемой пробы. Оценивали наличие ампликонов. Критерии правильности проведенного исследования отражены выше. В результате электрофореза обнаружили наличие бэнда размером 1308 п.н. для положительного контроля на этапе выделения ДНК, положительного контроля на этапе постановки ПЦР и для исследуемой пробы. По данным анализа выявили наличие светящихся продуктов ПЦР требуемого размера для положительных контролей и проб элюатов ДНК возбудителя парвовирусного энтерита собак полевых изолятов «K01708-3», «S», «UY247» и «II».
Проводили очистку ПЦР-продуктов из агарозного геля по стандартной методике, как описано выше. Очищенные ПЦР-продукты исследовали с помощью спектрофотометра Implen NanoPhotometer P-Class (Р-360) для определения степени чистоты ампликонов и концентрации нуклеиновой кислоты. По результатам исследования выявили, что ампликоны имели высокую степень чистоты. Элюаты считали свободным от примесей белка и аминокислот, поскольку коэффициент экстинкции OD260/OD280 (Рм) находился в пределах 1,80-2,20 и составил 1,998-2,000. ПЦР-продукты были незагрязненным полисахаридами, поскольку коэффициент экстинкции OD260/OD235 (R2) составил 1,999-2,000. Отсутствие взвеси крупных частиц в элюате подтверждалось, поскольку OD320 составила 0,000. Концентрация ПЦР-продукта составила 53, 55, 48, 46 нг/мкл, что является допустимым и высоким значением для получения надежного результата (более 20 нг/мкл). После очистки ПЦР-продуктов проводили гель-электрофорез, результаты которого были удовлетворительными, а именно, ампликоны необходимого размера присутствовали на электрофореграмме.
Проводили секвенирование ПЦР-продукта для полевых изолятов «K01708-3», «S», «UY247» и «II» (было изначально получено 10 одинаковых проб для повышения достоверности анализа с помощью секвенирования), как описано выше. Анализировали сиквенсы, полученные в результате исследования. Осуществляли выравнивание последовательностей нуклеотидов участка гена VP2 в диапазоне 4000…5307 п.н. (размер ПЦР-продукта 1308 п.н.) ДНК возбудителя парвовирусного энтерита собак полевых изолятов «K01708-3», «S», «UY247» и «II» со следующей группой штаммов: «CPV-H15», «CPV-RS-89», «CPV-98H» (генотип 1), «Beijing 2014», «CPV-N», «КН 18», «CPV/Raccoon/RC14/BC 2010», «CPV/Iran», «CPV01», «SH14» (генотип 2a), «CPV Ankara», «CPV-2b-K5-TR», «5 MGL», «CPV Par2-2022», «CPV QD-202» (генотип 2b), «FM 14», «CPV-BJ-C28», «CPV-SH2003», «НВ2017», «CU24», «CPV-SH1516» (генотип 2c).
С помощью программы MEGA X дали заключение о принадлежности штаммов полевых изолятов «K01708-3», «S» к генотипу 2а, изолята «II» - к генотипу 2b, изолята «UY247» - к генотипу 2 с возбудителя парвовирусного энтерита собак. Результаты анализа представили на филогенетическом древе с обозначением месторасположения на нем интересующих штаммов (фиг.2).
Пример 4. Исследование аналитической специфичности разработанного способа генотипирования изолятов и штаммов возбудителя парвовирусного энтерита собак на основе филогенетического анализа с применением оригинальных олигонуклеотидных праймеров для высоковариабельного участка гена VP2
Специфичность разработанного способа генотипирования изолятов и штаммов возбудителя парвовирусного энтерита собак на основе филогенетического анализа с применением оригинальных олигонуклеотидных праймеров для высоковариабельного участка гена VP2 оценивали путем тестирования 6 образцов от других патогенов мелких домашних животных (штамм «РВ-97» вируса бешенства, штамм «О/Забайкальский/2016» вируса ящура, штамм «Рокборн» вируса чумы плотоядных, штамм «Рич» возбудителя коронавирусного энтерита собак, штамм «ВГНКИ» аденовируса 1 серотипа). Анализ проводили, как представлено выше. В результате исследования амплификация с неспецифичными нуклеиновыми кислотами других представленных инфекционных агентов не была обнаружена (по данным гель-электрофореза ПЦР-продукты отсутствовали), то есть для проб, не содержащих нуклеиновую кислоту CPV, и отрицательного контроля ПЦР-продукты не амплифицировались. При исследовании положительного контроля получены ампликоны размером 1308 п.н. (n=3). Таким образом, полученные результаты свидетельствовали о 100%-ной специфичности разработанного способа генотипирования изолятов и штаммов возбудителя парвовирусного энтерита собак на основе филогенетического анализа с применением оригинальных олигонуклеотидных праймеров для высоковариабельного участка гена VP2.
Основными преимуществами предлагаемого изобретения является возможность проведения генотипирования полевых изолятов и вакцинных штаммов возбудителя парвовирусного энтерита собак на основе филогенетического анализа с применением оригинальных олигонуклеотидных праймеров для высоковариабельного участка гена VP2. Разработанный способ впервые применили для решения данной задачи. Выявили, что в анализируемом участке ДНК CPV в диапазоне 4000…5307 п.н. имеется максимальное количество нуклеотидных замен (среднее значение замен составляет 28,56±1,21%, что на 25,53-28,03% выше в сравнении с ампликонами прототипного способа). Это позволило разработать оригинальные высокоспецифичные олигонуклеотидные праймеры 556 for и 555 rev mod для детекции данного участка генома размером 1308 п.н. с помощью реакции амплификации. Впервые представлена идентификация нуклеотидных последовательностей данного участка генома полевых изолятов и вакцинных штаммов возбудителя парвовирусного энтерита собак для проведения филогенетического анализа. Разработанный способ является специфичным по отношению к геному CPV, что подтверждено исследованиями. Данная разработка позволила проводить генотипирование вакцинных штаммов возбудителя парвовирусного энтерита для создания эффективных вакцинных препаратов против данного патогена требуемого генотипа.
Источники информации
1. Ahmed N., Riaz A., Zubair Z., Saqib M., Ijaz S., Nawaz-Ul-Rehman M.S, Al-Qahtani A., Mubin M. Molecular analysis of partial VP-2 gene amplified from rectal swab samples of diarrheic dogs in Pakistan confirms the circulation of canine parvovirus genetic variant CPV-2a and detects sequences of feline panleukopenia virus (FPV) Virol. J. 2018;15(1):45.
2. Cotmore S.F., Agbandje-McKenna M., Canuti M., Chiorini J.A., Eis-Hubinger A.M., Hughes J., Mietzsch M., Modha S., Ogliastro M., Penzes J.J., Pintel D.J., Qiu J., Soderlund-Venermo M., Tattersall P., Tijssen P. Ictv Report Consortium. ICTV virus taxonomy profile:Parvoviridae. J. Gen. Virol. 2019;100(3):367-368.
3. Chinchkar S.R., Subramanian B.M., Rao N.H., Rangarajan P.N., Thiagarajan D., Srinivasan V.A. Analysis of VP2 gene sequences of canine parvovirus isolates in India. Arch. Virol. 2006; 151(9): 1881-1887.
4. Clark N.J., Seddon J.M., Kyaw-Tanner M., Al-Alawneh J., Harper G., McDonagh P., Meers J. Emergence of canine parvovirus subtype 2b (CPV-2b) infections in Australian dogs. Infect. Genet. Evol. 2018;58:50-55.
5. Aly N.I., Salama Z.T.S. Preparation of an inactivated penta cell culture vaccine against canine distemper, canine parvo, canine hepatitis "canine adeno-1", canine adeno-2 and rabies viruses for dogs. Beni-Suef Vet Med. J. 2005;15(2):208-214.
6. Aly N.I., Salama Z.T.S., El-Emam H.S. Oral vaccination of puppies with the core vaccines (canine distemper;canine parvo;canine hepatitis and rabies vaccines) Kafrelsheikh Vet. Med. J. 2011;9(2):73-90.
7. Soliman R.M., Baker N.M., Nasr M.Y., Khodeir M.H. Clinical, virological and molecular characterization of canine parvovirus in dogs. Eur. J. Pharm. Med. Res. 2018;5(4):525-535.
8. Zaher K.S., El-Dabae W.H., El-Sebelgy M.M., Aly N.I., Salama Z.T. Genotyping and phylogenetic analysis of canine parvovirus circulating in Egypt. Vet World. 2020 Feb;13(2):326-333.
9. GenBank. Canine parvovirus complete genome URL: https://www.ncbi.nlm.nih.gov/nuccore/?term=Canine+parvovirus+complete+genome (Дата обращения: 01.07.2023).
10. Kumar S., Stecher G., Li M., Knyaz C., Tamura K. MEGA X:Molecular evolutionary genetics analysis across computing platforms. Mol. Biol. Evol. 2018;35(6):1547-1549.

--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing dtdVersion="V1_3" fileName="1710419377887.xml"
softwareName="WIPO Sequence" softwareVersion="2.1.2"
productionDate="2024-03-14">
<ApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>0</ApplicationNumberText>
<FilingDate>2023-07-18</FilingDate>
</ApplicationIdentification>
<ApplicantFileReference>526</ApplicantFileReference>
<EarliestPriorityApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>0</ApplicationNumberText>
<FilingDate>2023-07-18</FilingDate>
</EarliestPriorityApplicationIdentification>
<ApplicantName languageCode="ru">ФГБУ "Федеральный центр охраны
здоровья животных" (ФГБУ "ВНИИЗЖ")</ApplicantName>
<ApplicantNameLatin> Federal State-Financed Institution Federal
Centre for Animal Health (FGBI ARRIAH)</ApplicantNameLatin>
<InventorName languageCode="ru">Чупин Сергей
Александрович</InventorName>
<InventorNameLatin>Chupin Sergey Alexandrovich</InventorNameLatin>
<InventionTitle languageCode="ru">Способ генотипирования изолятов и
штаммов возбудителя парвовирусного энтерита собак на основе
филогенетического анализа с применением оригинальных
олигонуклеотидных праймеров для высоковариабельного участка гена
VP2</InventionTitle>
<SequenceTotalQuantity>10</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>1752</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..1752</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>genomic DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q1">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>CPV</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>atgagtgatggagcagttcaaccagacggtggtcaacctgctgtcagaa
atgaaagagctacaggatctgggaacgggtctggaggcgggggtggtggtggttctgggggtgtggggat
ttctacgggtactttcaataatcagacagaatttaaatttttggaaaacggatgggtggaaatcacagca
aactcaagcagacttgtacatttaaatatgccagaaagtgaaaattatagaagagtggttgtaaataatt
tggataaaactgcagttaacggaaacatggctttagatgatactcatgcacaaattgtaacaccttggtc
attggttgatgcaaatgcttggggagtttggtttaatccaggagattggcaactaattgttaatactatg
agtgagttgcatttagttagttttgaacaagaaatttttaatgttgttttaaagactgtttcagaatctg
ctactcagccaccaactaaagtttataataatgatttaactgcatcattgatggttgcattagacagtaa
taatactatgccatttactccagcagctatgagatctgagacattgggtttttatccatggaaaccaacc
ataccaactccatggagatattattttcaatgggatagaacattaataccatctcatactggaactagtg
gcacaccaacaaatatataccatggtacagatccagatgatgttcaattttacactattgaaaattctgt
gccagtgcacttactaagaacaggtgatgaatttgctacaggaacattttattttgattgtaaaccatgt
agactaacacatacatggcaaacaaatagagcattgggcttaccaccatttctaaattctttgcctcaag
ctgaaggaggtactaactttggttatataggagttcaacaagataaaagacgtggtgtgactcaaatggg
aaatacaaacattattactgaagctactattatgagaccagctgaggttggttatagtgcaccatattat
tcttttgaggcgtctacacaagggccatttaaaacacctattgcagcaggacgggggggagcgcaaacag
atgaaaatcaagcagcagatggtgatccaagatatgcatttggtagacaacatggtcaaaaaactaccac
aacaggagaaacacctgagagatttacatatatagcacatcaagatacaggaagatatccagaaggagat
tggattcaaaatattaactttaaccttcctgtaacagatgataatgtattgctaccaacagatccaattg
gaggtaaagcaggaattaactataccaatatatttaatacttatggtcctttaactgcattaaataatgt
accaccagtttatccaaatggtcaaatttgggataaagaatttgatactgacttaaaaccaagacttcat
gtaaatgcaccatttgtttgtcagaataattgtcctggtcaattatttgtaaaagttgcgcctaatttaa
caaatgaatatgatcctgatgcatctgctaatatgtcaagaattgtaacttactcagatttttggtggaa
aggtaaattagtatttaaagctaaactaagagcctctcatacttggaatccaattcaacaaatgagtatc
aatgtagataaccaatttaactatgtaccaagtaatattggaggtatgaaaattgtatatgaaaaatctc
aactagcacctagaaaattatat</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>584</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..584</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>CPV</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>MSDGAVQPDGGQPAVRNERATGSGNGSGGGGGGGSGGVGISTGTFNNQT
EFKFLENGWVEITANSSRLVHLNMPESENYRRVVVNNLDKTAVNGNMALDDTHAQIVTPWSLVDANAWGV
WFNPGDWQLIVNTMSELHLVSFEQEIFNVVLKTVSESATQPPTKVYNNDLTASLMVALDSNNTMPFTPAA
MRSETLGFYPWKPTIPTPWRYYFQWDRTLIPSHTGTSGTPTNIYHGTDPDDVQFYTIENSVPVHLLRTGD
EFATGTFYFDCKPCRLTHTWQTNRALGLPPFLNSLPQAEGGTNFGYIGVQQDKRRGVTQMGNTNIITEAT
IMRPAEVGYSAPYYSFEASTQGPFKTPIAAGRGGAQTDENQAADGDPRYAFGRQHGQKTTTTGETPERFT
YIAHQDTGRYPEGDWIQNINFNLPVTDDNVLLPTDPIGGKAGINYTNIFNTYGPLTALNNVPPVYPNGQI
WDKEFDTDLKPRLHVNAPFVCQNNCPGQLFVKVAPNLTNEYDPDASANMSRIVTYSDFWWKGKLVFKAKL
RASHTWNPIQQMSINVDNQFNYVPSNIGGMKIVYEKSQLAPRKLY</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="3">
<INSDSeq>
<INSDSeq_length>1752</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..1752</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>genomic DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q3">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>CPV</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>atgagtgatggagcagttcaaccagacggtggtcaacctgctgtcagaa
atgaaagagctacaggatctgggaacgggtctggaggcgggggtggtggtggttctgggggtgtggggat
ttctacgggtactttcaataatcagacagaatttaaatttttggaaaacggatgggtggaaatcacagca
aactcaagcagacttgtacatttaaatatgccagaaagtgaaaattatagaagagtggttgtaaataatt
tggataaaactgcagttaacggaaacatggctttagatgatactcatgcacaaattgtaacaccttggtc
attggttgatgcaaatgcttggggagtttggtttaatccaggagattggcaactaattgttaatactatg
agtgagttgcatttagttagttttgaacaagaaatttttaatgttgttttaaagactgtttcagaatctg
ctactcagccaccaactaaagtttataataatgatttaactgcatcattgatggttgcattagacagtaa
taatactatgccatttactccagcagctatgagatctgagacattgggtttttatccatggaaaccaacc
ataccaactccatggagatattattttcaatgggatagaacattaataccatctcatactggaactagtg
gcacaccaacaaatatataccatggtacagatccagatgatgttcaattttacactattgaaaattctgt
gccagtgcacttactaagaacaggtgatgaatttgctacaggaacattttattttgattgtaaaccatgt
agactaacacatacatggcaaacaaatagagcattgggcttaccaccatttctaaattctttgcctcaag
ctgaaggaggtactaactttggttatataggagttcaacaagataaaagacgtggtgtgactcaaatggg
aaatacaaacattattactgaagctactattatgagaccagctgaggttggttatagtgcaccatattat
tcttttgaggcgtctacacaagggccatttaaaacacctattgcagcaggacgggggggagcgcaaacag
atgaaaatcaagcagcagatggtgatccaagatatgcatttggtagacaacatggtcaaaaaactaccac
aacaggagaaacacctgagagatttacatatatagcacatcaagatacaggaagatatccagaaggagat
tggattcaaaatattaactttaaccttcctgtaacagatgataatgtattgctaccaacagatccaattg
gaggtaaagcaggaattaactataccaatatatttaatacttatggtcctttaactgcattaaataatgt
accaccagtttatccaaatggtcaaatttgggataaagaatttgatactgacttaaaaccaagacttcat
gtaaatgcaccatttgtttgtcagaataattgtcctggtcaattatttgtaaaagttgcgcctaatttaa
caaatgaatatgatcctgatgcatctgctaatatgtcaagaattgtaacttactcagatttttggtggaa
aggtaaattagtatttaaagctaaactaagagcctctcatacttggaatccaattcaacaaatgagtatc
aatgtagataaccaatttaactatgtaccaagtaatattggaggtatgaaaattgtatatgaaaaatctc
aactagcacctagaaaattaggg</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="4">
<INSDSeq>
<INSDSeq_length>584</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..584</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q4">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>CPV</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>MSDGAVQPDGGQPAVRNERATGSGNGSGGGGGGGSGGVGISTGTFNNQT
EFKFLENGWVEITANSSRLVHLNMPESENYRRVVVNNLDKTAVNGNMALDDTHAQIVTPWSLVDANAWGV
WFNPGDWQLIVNTMSELHLVSFEQEIFNVVLKTVSESATQPPTKVYNNDLTASLMVALDSNNTMPFTPAA
MRSETLGFYPWKPTIPTPWRYYFQWDRTLIPSHTGTSGTPTNIYHGTDPDDVQFYTIENSVPVHLLRTGD
EFATGTFYFDCKPCRLTHTWQTNRALGLPPFLNSLPQAEGGTNFGYIGVQQDKRRGVTQMGNTNIITEAT
IMRPAEVGYSAPYYSFEASTQGPFKTPIAAGRGGAQTDENQAADGDPRYAFGRQHGQKTTTTGETPERFT
YIAHQDTGRYPEGDWIQNINFNLPVTDDNVLLPTDPIGGKAGINYTNIFNTYGPLTALNNVPPVYPNGQI
WDKEFDTDLKPRLHVNAPFVCQNNCPGQLFVKVAPNLTNEYDPDASANMSRIVTYSDFWWKGKLVFKAKL
RASHTWNPIQQMSINVDNQFNYVPSNIGGMKIVYEKSQLAPRKLG</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="5">
<INSDSeq>
<INSDSeq_length>1752</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..1752</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>genomic DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q5">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>CPV</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>atgagtgatggagcagttcaaccagacggtggtcaacctgctgtcagaa
atgaaagagctacaggatctgggaacgggtctggaggcgggggtggtggtggttctgggggtgtggggat
ttctacgggtactttcaataatcagacagaatttaaatttttggaaaacggatgggtggaaatcacagca
aactcaagcagacttgtacatttaaatatgccagaaagtgaaaattatagaagagtggttgtaaataatt
tggataaaactgcagttaacggaaacatggctttagatgatactcatgcacaaattgtaacaccttggtc
attggttgatgcaaatgcttggggagtttggtttaatccaggagattggcaactaattgttaatactatg
agtgagttgcatttagttagttttgaacaagaaatttttaatgttgttttaaagactgtttcagaatctg
ctactcagccaccaactaaagtttataataatgatttaactgcatcattgatggttgcattagacagtaa
taatactatgccatttactccagcagctatgagatctgagacattgggtttttatccatggaaaccaacc
ataccaactccatggagatattattttcaatgggatagaacattaataccatctcatactggaactagtg
gcacaccaacaaatatataccatggtacagatccagatgatgttcaattttacactattgaaaattctgt
gccagtgcacttactaagaacaggtgatgaatttgctacaggaacattttattttgattgtaaaccatgt
agactaacacatacatggcaaacaaatagagcattgggcttaccaccatttctaaattctttgcctcaag
ctgaaggaggtactaactttggttatataggagttcaacaagataaaagacgtggtgtgactcaaatggg
aaatacaaacattattactgaagctactattatgagaccagctgaggttggttatagtgcaccatattat
tcttttgaggcgtctacacaagggccatttaaaacacctattgcagcaggacgggggggagcgcaaacag
atgaaaatcaagcagcagatggtgatccaagatatgcatttggtagacaacatggtcaaaaaactaccac
aacaggagaaacacctgagagatttacatatatagcacatcaagatacaggaagatatccagaaggagat
tggattcaaaatattaactttaaccttcctgtaacagatgataatgtattgctaccaacagatccaattg
gaggtaaagcaggaattaactataccaatatatttaatacttatggtcctttaactgcattaaataatgt
accaccagtttatccaaatggtcaaatttgggataaagaatttgatactgacttaaaaccaagacttcat
gtaaatgcaccatttgtttgtcagaataattgtcctggtcaattatttgtaaaagttgcgcctaatttaa
caaatgaatatgatcctgatgcatctgctaatatgtcaagaattgtaacttactcagatttttggtggaa
aggtaaattagtatttaaagctaaactaagagcctctcatacttggaatccaattcaacaaatgagtatc
aatgtagataaccaatttaactatgtaccaagtaatattggaggtatgaaaattgtatatgaaaaatctc
aactagcacctagaaaacccccc</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="6">
<INSDSeq>
<INSDSeq_length>584</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..584</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q6">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>CPV</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>MSDGAVQPDGGQPAVRNERATGSGNGSGGGGGGGSGGVGISTGTFNNQT
EFKFLENGWVEITANSSRLVHLNMPESENYRRVVVNNLDKTAVNGNMALDDTHAQIVTPWSLVDANAWGV
WFNPGDWQLIVNTMSELHLVSFEQEIFNVVLKTVSESATQPPTKVYNNDLTASLMVALDSNNTMPFTPAA
MRSETLGFYPWKPTIPTPWRYYFQWDRTLIPSHTGTSGTPTNIYHGTDPDDVQFYTIENSVPVHLLRTGD
EFATGTFYFDCKPCRLTHTWQTNRALGLPPFLNSLPQAEGGTNFGYIGVQQDKRRGVTQMGNTNIITEAT
IMRPAEVGYSAPYYSFEASTQGPFKTPIAAGRGGAQTDENQAADGDPRYAFGRQHGQKTTTTGETPERFT
YIAHQDTGRYPEGDWIQNINFNLPVTDDNVLLPTDPIGGKAGINYTNIFNTYGPLTALNNVPPVYPNGQI
WDKEFDTDLKPRLHVNAPFVCQNNCPGQLFVKVAPNLTNEYDPDASANMSRIVTYSDFWWKGKLVFKAKL
RASHTWNPIQQMSINVDNQFNYVPSNIGGMKIVYEKSQLAPRKPP</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="7">
<INSDSeq>
<INSDSeq_length>1752</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..1752</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>genomic DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q7">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>CPV</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>atgagtgatggagcagttcaaccagacggtggtcaacctgctgtcagaa
atgaaagagctacaggatctgggaacgggtctggaggcgggggtggtggtggttctgggggtgtggggat
ttctacgggtactttcaataatcagacagaatttaaatttttggaaaacggatgggtggaaatcacagca
aactcaagcagacttgtacatttaaatatgccagaaagtgaaaattatagaagagtggttgtaaataatt
tggataaaactgcagttaacggaaacatggctttagatgatactcatgcacaaattgtaacaccttggtc
attggttgatgcaaatgcttggggagtttggtttaatccaggagattggcaactaattgttaatactatg
agtgagttgcatttagttagttttgaacaagaaatttttaatgttgttttaaagactgtttcagaatctg
ctactcagccaccaactaaagtttataataatgatttaactgcatcattgatggttgcattagacagtaa
taatactatgccatttactccagcagctatgagatctgagacattgggtttttatccatggaaaccaacc
ataccaactccatggagatattattttcaatgggatagaacattaataccatctcatactggaactagtg
gcacaccaacaaatatataccatggtacagatccagatgatgttcaattttacactattgaaaattctgt
gccagtgcacttactaagaacaggtgatgaatttgctacaggaacattttattttgattgtaaaccatgt
agactaacacatacatggcaaacaaatagagcattgggcttaccaccatttctaaattctttgcctcaag
ctgaaggaggtactaactttggttatataggagttcaacaagataaaagacgtggtgtgactcaaatggg
aaatacaaacattattactgaagctactattatgagaccagctgaggttggttatagtgcaccatattat
tcttttgaggcgtctacacaagggccatttaaaacacctattgcagcaggacgggggggagcgcaaacag
atgaaaatcaagcagcagatggtgatccaagatatgcatttggtagacaacatggtcaaaaaactaccac
aacaggagaaacacctgagagatttacatatatagcacatcaagatacaggaagatatccagaaggagat
tggattcaaaatattaactttaaccttcctgtaacagatgataatgtattgctaccaacagatccaattg
gaggtaaagcaggaattaactataccaatatatttaatacttatggtcctttaactgcattaaataatgt
accaccagtttatccaaatggtcaaatttgggataaagaatttgatactgacttaaaaccaagacttcat
gtaaatgcaccatttgtttgtcagaataattgtcctggtcaattatttgtaaaagttgcgcctaatttaa
caaatgaatatgatcctgatgcatctgctaatatgtcaagaattgtaacttactcagatttttggtggaa
aggtaaattagtatttaaagctaaactaagagcctctcatacttggaatccaattcaacaaatgagtatc
aatgtagataaccaatttaactatgtaccaagtaatattggaggtatgaaaattgtatatgaaaaatctc
aactagcagggaaagggcccaaa</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="8">
<INSDSeq>
<INSDSeq_length>584</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..584</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q8">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>CPV</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>MSDGAVQPDGGQPAVRNERATGSGNGSGGGGGGGSGGVGISTGTFNNQT
EFKFLENGWVEITANSSRLVHLNMPESENYRRVVVNNLDKTAVNGNMALDDTHAQIVTPWSLVDANAWGV
WFNPGDWQLIVNTMSELHLVSFEQEIFNVVLKTVSESATQPPTKVYNNDLTASLMVALDSNNTMPFTPAA
MRSETLGFYPWKPTIPTPWRYYFQWDRTLIPSHTGTSGTPTNIYHGTDPDDVQFYTIENSVPVHLLRTGD
EFATGTFYFDCKPCRLTHTWQTNRALGLPPFLNSLPQAEGGTNFGYIGVQQDKRRGVTQMGNTNIITEAT
IMRPAEVGYSAPYYSFEASTQGPFKTPIAAGRGGAQTDENQAADGDPRYAFGRQHGQKTTTTGETPERFT
YIAHQDTGRYPEGDWIQNINFNLPVTDDNVLLPTDPIGGKAGINYTNIFNTYGPLTALNNVPPVYPNGQI
WDKEFDTDLKPRLHVNAPFVCQNNCPGQLFVKVAPNLTNEYDPDASANMSRIVTYSDFWWKGKLVFKAKL
RASHTWNPIQQMSINVDNQFNYVPSNIGGMKIVYEKSQLAGKGPK</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="9">
<INSDSeq>
<INSDSeq_length>21</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..21</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q9">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>CPV</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>caggaagatatccagaaggag</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="10">
<INSDSeq>
<INSDSeq_length>24</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..24</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q10">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>CPV </INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>ataattttctaggtgctagttgag</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ дифференциации вакцинного штамма "Арчи" возбудителя парвовирусного энтерита собак от других штаммов и полевых изолятов ПВЭ собак с помощью высокочувствительного HRM-анализа с применением тандемного флуоресцирующего красителя SN v428 | 2024 |
|
RU2835907C1 |
| Способ опосредованного определения титра инфекционной активности вобудителя парвовирусного энтерита собак в сырье для вакцин методом ПЦР в режиме реального времени | 2023 |
|
RU2812858C1 |
| Способ генотипирования изолятов и штаммов калицивируса кошек посредством филогенетического анализа с применением оргинальных олигонуклеотидных праймеров для высоковариабельного участка генов ORF2-ORF3 | 2023 |
|
RU2822162C1 |
| Способ дифференциации вакцинного штамма "ВГНКИ" возбудителя аденовирусной инфекции от других штаммов и полевых изолятов с помощью анализа максимумов температур плавления ПЦР-продуктов с применением тандемного флуоресцирующего красителя SuperNova v605 | 2023 |
|
RU2825893C1 |
| Способ определения концентрации вирионов возбудителя парвовирусного энтерита собак в сырье для вакцин | 2023 |
|
RU2827231C1 |
| Способ дифференциации вакцинного штамма "Рич" от других штаммов и полевых изолятов возбудителя коронавирусной инфекции собак с помощью анализа максимальных экстремумов графиков температур плавления ампликонов с применением фиолетового лазерного красителя SuperNova v428 | 2023 |
|
RU2826458C1 |
| Штамм "Арчи" вируса Carnivore protoparvovirus 1 парвовирусного энтерита собак для изготовления биопрепаратов для диагностики и специфической профилактики парвовирусного энтерита собак | 2023 |
|
RU2817267C1 |
| Ассоциированная вакцина против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции и бешенства собак | 2023 |
|
RU2817255C1 |
| Способ дифференциации вакцинного штамма "Лавр" возбудителя инфекционного ринотрахеита от других штаммов и полевых изолятов вируса ИРТ кошек с помощью анализа температурного графика плавления продуктов ПЦР V1-гена с применением оранжевого полимерного красителя SuperNova v605 | 2024 |
|
RU2824661C1 |
| Ассоциированная вакцина против чумы плотоядных, парвовирусного и коронавирусного энтеритов, аденовирусной инфекции собак | 2022 |
|
RU2806164C1 |
Изобретение относится к ветеринарной вирусологии. Описан способ молекулярной диагностики, а именно для генотипирования изолятов и штаммов возбудителя парвовирусного энтерита собак на основе филогенетического анализа с применением оригинальных олигонуклеотидных праймеров для высоковариабельного участка гена VP2. Разработанный способ впервые применили для решения данной задачи. Выявили, что в анализируемом участке ДНК CPV в диапазоне 4000…5307 п.н. имеется максимальное количество нуклеотидных замен, среднее значение замен составляет 28,56±1,21%, что на 25,53-28,03% выше в сравнении с ампликонами прототипного способа. Это позволило разработать оригинальные высокоспецифические олигонуклеотидные праймеры 556 for и 555 rev_mod для детекции данного участка генома размером 1308 п.н. с помощью реакции амплификации. Впервые представлена идентификация нуклеотидных последовательностей данного участка генома полевых изолятов и вакцинных штаммов возбудителя парвовирусного энтерита собак для проведения филогенетического анализа. Разработанный способ является специфичным по отношению к геному CPV, что подтверждено исследованиями. 2 з.п. ф-лы, 2 ил., 5 табл., 4 пр.
1. Способ генотипирования изолятов и штаммов возбудителя парвовирусного энтерита собак на основе филогенетического анализа с применением олигонуклеотидных праймеров, включающий проведение следующих этапов анализа и использование следующих компонентов реакции:
- элюирование ДНК из исследуемого биологического материала;
- осуществление амплификации специфического фрагмента гена VP2 ДНК парвовируса собак в диапазоне 4000…5307 п.н. с применением олигонуклеотидных праймеров: 556 for с дизайном 5'-CAGGAAGATATCCAGAAGGAG-3' и 555 rev_mod с дизайном 5'-ATAATTTTCTAGGTGCTAGTTGAG-3' для высоковариабельного участка гена VP2;
- проведение очистки продуктов ПЦР;
- секвенирование очищенных продуктов ПЦР;
- осуществление филогенетического анализа с применением алгоритма maximum likelyhood и заключение о принадлежности полевого изолята или вакцинного штамма к определенному генотипу возбудителя парвовирусного энтерита собак.
2. Способ по п. 1, где аналитическая специфичность составляет 100,0%.
3. Способ по п. 1, где праймеры позволяют синтезировать ампликоны размером 1308 п.н.
| Zaher K.S., El-Dabae W.H., El-Sebelgy M.M., Aly N.I., Salama Z.T | |||
| Genotyping and phylogenetic analysis of canine parvovirus circulating in Egypt | |||
| Vet World | |||
| Способ восстановления спиралей из вольфрамовой проволоки для электрических ламп накаливания, наполненных газом | 1924 |
|
SU2020A1 |
| Способ выявления в биологическом материале ДНК вируса парвовирус В19 на основе двухэтапной ПЦР | 2019 |
|
RU2753310C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ ВРОЖДЕННЫХ ИНФЕКЦИЙ | 2013 |
|
RU2532382C1 |
Авторы
Даты
2024-06-28—Публикация
2023-08-28—Подача