Изобретение относится к области биотехнологии, в частности к способу получения in vitro асептических культур растительных эксплантов (семян и листьев) растений разных таксономических групп, и может быть использовано в исследованиях по биотехнологии растений.
Методы культуры тканей и клеток (клеточная инженерия растений или клеточная биотехнология) является основным разделом современной биотехнологии растений. Благодаря умению правильно создавать благоприятные условия для культивирования изолированных эксплантов in vitro, можно управлять различными морфофизиологическими, морфогенетическими и биохимическими процессами.
Главным и основным условием работы с культурой изолированных тканей in vitro является соблюдение строгой стерильности. Это достигается за счет того, что все используемые в работе материалы (инструменты, посуда, питательные среды, растительные экспланты и др.), а также условия, в которых проводят манипуляции с исследуемыми объектами, должны быть предварительно обеззаражены.
Необходимым условием работы с культурой изолированных тканей, органов и клеток растений in vitro является соблюдение строгой стерильности. Богатая питательная среда является прекрасным субстратом для развития в ней микроорганизмов, а изолированные от растения фрагменты (экспланты), которые помещают на стерильную питательную среду, легко поражаются микроорганизмами (покрываются плесенью). Иногда можно наблюдать появление на питательной среде колонии бактерий, которые появляются вследствие выхода бактерий из клеток самого экспланта. Поэтому необходимо проводить работы по стерилизации не только питательных сред, инструментов, но и самого первичного экспланта, с которым предполагается дальнейшая работа в культуре in vitro.
Главным условием получения асептической культуры растительных эксплантов (введение в культуру in vitro) является правильный подбор стерилизующего вещества, его концентрацию, а также времени воздействия на растительный материал. Выбор оптимальных параметров стерилизации зависит от типа и размера первичного экспланта, его возраста, а также от сезонности изоляции с интактного растения. Режим стерилизации для каждого объекта является индивидуальным и устанавливается экспериментальным путем.
Правильный выбор самого стерилизующего вещества заключается в том, чтобы стерилизатор оказывал максимальное токсичное действие на все микроорганизмы (полностью убивал развитие микроорганизмов), и в то же время не оказывал токсичное действие на растительные ткани. Еще одним важным условием подбора стерилизующего вещества является то, что выбранные вещества должны легко удаляться с поверхности растительных объектов. Иначе остатки стерилизатора на поверхности эксплантов приводят к появлению некротических участков, клетки которых начинают выделять токсины и отравлять живые клетки. Все это ведет в дальнейшем к полной гибели растительного объекта, который исследователь планировал ввести в культуру in vitro.
В качестве стерилизующих веществ применяют препараты, содержащие различные активные вещества: 1) ртутьсодержащие, 2) хлорсодержащие, 3) перекись водорода, 4) перманганат калия, 5) нитрат серебра, 6) антибиотики 7) серная кислота. Из перечисленных стерилизующих веществ для получения асептических культур чаще всего исследователи применяют ртутьсодержащие и хлорсодержащие препараты.
Ртутьсодержащие препараты характеризуются универсальностью фунгицидного действия, что обусловлено самой ртутью, и токсичность их определяется тем, в каких количествах и как быстро она освобождается из состава соединения. Фунгицидная и бактерицидная активность пропорциональна содержанию ртути, но изменяется в зависимости от химического строения. Действующим веществом всех ртутьсодержащих препаратов является ртуть. Среди препаратов, применяемых in vitro для стерилизации растительных тканей, применяют сулему (HgCl2) или диацид.
Хлорсодержащие препараты характеризуются универсальностью фунгицидного действия, что обусловлено присутствием в препаратах активного хлора. Среди препаратов, применяемых in vitro для стерилизации растительных тканей применяют: хлорамин Б, гипохлорид натрия (NaClO), гипохлорид кальция (Са(ClO)2), коммерческий препарат «Белизна» или «Доместос».
Например, для получения асептических эксплантов картофеля (А.А. Чураков, Н.М. Попова, А.Н. Халипский, Ю.А. Пирятенец Способ получения асептических эксплантов картофеля в культуре in vitro. // Вестник КрасГАУ. 2019. №5. с. 16-21) использовали следующие препараты для поверхностной стерилизации: «Доместос» (5% гипохлорит натрия, поверхностноактивные вещества, мыло, отдушка), «Белизна» (гипохлорит натрия, активного хлора 95,2%), с последующей промывкой стерильной дистиллированной. Обработку первичных эксплантов стерилизующими веществами проводили в течение 10 мин. Недостатком данного способа являет ся получение не более 50% асептических растений и замедленный рост побегов.
В работе Сахвон Е.В. и др. (Сахвон Е.В., Кудряшова О.А., Вайновская И.Ф., Волотович А.А. Сравнительный анализ способов асептического введения в культуру in vitro растений Melittis sarmatica Klok // Вестник Полесского государственного университета. Серия природоведческих наук. 2016. с. 22-27) показан способ стерилизации семян с использованием 0,1% раствора нитрата серебра (AgNO3) втечение 5 и 10 мин.Недостатком предлагаемого стерилизующего вещества и временной экспозиции его воздействия на семена явлется очень низкий процент взошедших семян - 1-2% от общего количества высеянных семян.
Известен способ получения асептической культуры одревесневших побегов, изолированных со взрослых растений осины (Шабанова Е.А., Машкина О.С. Способ поверхностной стерилизации эксплантов осины in vitro, RU 2675510 С2, А01Н 4/00, 19.12.2018), заключающийся в применении ступенчатой стерилизации. Первоначально изолированные побеги размером 3-5 см выдерживают в проточной воде в течение 15-20 мин, а затем в нестерильных условиях проводят предварительную стерилизацию 2% раствором средства «Domestos» в течение 8 мин с последующим промыванием в проточной воде 15-20 мин. Основную стерилизацию побегов осуществляют в условиях ламинар-бокса 10%-ным раствором дезинфицирующего средства «Аламинол» (действующее вещество -алкилдиметилбензиламмония хлорид) в течение 10 мин с последующей Зх кратной промывкой стерильной дистиллированной водой. Недостатком данного способа является низкий выход асептической культуры (40-55%), из которых 13-15% являются не жизнеспособными.
Известен способ получения асептической культуры неодревесневших побегов тополя (Сиволапов А.И. Способ выращивания посадочного материала, RU 2485755 С1, 27.06.2013), которые подвергались поэтапной стерилизации: 2% раствором «Domestos» в течение 15 мин с последующей промывкой в проточной водопроводной воде, в асептических условиях (в условиях ламинар-бокса) 0,025% раствором мертиолята в сочетании с жидким дезинфицирующим раствором "Белизна" (7% раствор) и средством «Твин» (0,08…0,12%) в течение 15 мин, с последующей 5-кратной промывкой стерильной дистиллированной водой. Недостатком данного способа является использование мертиолята высокотоксичного ртутьсодержащего соединения (I класс опасности), оказывающего мутагенное и канцерогенное действие.
Известен способ получения асептической культуры винограда (Ребров А.Н., Трофимова М.С. Способ стерилизации зеленых растительных эксплантов перед вводом в культуру in vitro, RU 2720916 С1, МПК A01H 4/00, 05.14.2020). Стерилизация эксплантов осуществляется последовательно в два этапа: в начале 70-75% водным раствором этанола в течение 30 секунд, а затем - 20-30% водным раствором препарата «Дезавид+» с экспозицией 10 мин и промывкой 3-4 раза стерильной дистиллированной водой в течение 5 мин. Недостатком способа является получение высокого процента инфицированных эксплантов (15-17%) и данный показатель находился на уровне контроля.
Известен способ получения асептических культур путем стерилизации эксплантов березы in vitro с использованием наночастиц оксида меди (Гродецкая Т. А., Евлаков П. М. и др. Способ стерилизации эксплантов березы in vitro с использованием наночастиц оксида меди. RU 2780830 С1. МПК А01Н 4/00. 10.04.2022), включающий стадии отмывки молодых побегов в воде с добавлением поверхностно-активных веществ, их разрезки на сегменты длиной 3-5 см, стерилизации в течение 35 мин в растворе, состоящем из 200 мл дистиллированной воды и 200 мкл 5%-ного раствора гипохлорита натрия, с последующей промывкой в дистиллированной воде, основной стерилизации побегов в ламинар-боксе в растворе, содержащем 15 мл 5%-ного раствора гипохлорита натрия и 85 мл стерильной дистиллированной воды, в течение 15 мин, промывки стерильной водой и разрезки стерильных побегов в асептических условиях на сегменты длиной 1,5-2 см с одной пазушной почкой - экспланты, которые впоследствии высаживают на модифицированную питательную среду, отличающийся тем, что в качестве модифицированной питательной среды используют питательную среду WPM, оптимизированную для введения в культуру in vitro эксплантов березы и содержащую сферические наночастицы оксида меди диаметром 30-80 нм в концентрации 0,1 мг/л, что позволяет пролонгировать действие санирующего эффекта, а также сократить сроки получения и увеличить количество стерильных эксплантов. Недостатком данного способа является то, что предлагаемый способ является затратным по времени, не приводит к получению 100% асептической культуры, а также сложность подбора концентрации наночастиц оксида меди (0,1 мг/л) из-за их узкого диапазона воздействия.
Наиболее близким по технической сущности к предлагаемому способу, взятом за прототип, относится способ обработки семян (Жужжалова Т.П., Васильченко Е.Н. Экологические предпосылки использования активированной воды // Сахарная свекла. - 2006. - №1. - с. 24-25), включающий стерилизацию семян раствором анолита, кратковременным воздействием 70% этиловым спиртом и затем хлорамином 10%. Это позволило авторам получить высокий выход асептических семян 97%. Недостатком приведенного способа является низкий выход жизнеспособных проростков (34%) за счет применения хлорамина и применение ступенчатой стерилизации.
Таким образом, все применяемые препараты на основе ртути и хлора, а также наночастиц или нитрата серебра в исследуемых концентрациях могут оказывать токсичное действие на растительные ткани и вызывать некрозы, которые приводят к полной гибели эксплантов. Это заставляет исследователей более тщательно выбирать концентрации и временные экспозиции воздействия стерилизующих веществ на исследуемые растительные ткани.
Из анализа известных аналогичных технических решений выявлено, что технической проблемой в данной области является необходимость поиска новых высокоэффективных, не токсичных на растительные объекты стерилизующих препаратов.
Задача, на решение которой направлено изобретение, заключается в разработке универсального способа получения асептических различных эксплантов (семена и листья) растений разных таксономических групп на этапе введения в культуру in vitro с применением электроактивированной воды.
Технический результат предлагаемого решения - увеличение выхода асептических культур, обладающих высокой скоростью роста и формированием правильных по морфологии растений с высоким морфогенетическим потенциалом.
Для решения указанной проблемы и достижения заявленного технического результата в способе получения асептических культур in vitro в качестве стерилизующего вещества используют электроактивированную воду (анолит). Способ характеризуется тем, что асептический растительный материал семян и листовых эксплантов растений разных таксономических групп получают путем выдерживания исследуемых растительных эксплантов в электроактивированном растворе (анолит) в течение 25-35 мин, полученном из водопроводной воды при использовании прибора Аквалайф в течение 15 мин с параметрами активации рН 5,8 и водородным показателем 2,8-2,9.
Электроактивированная вода - это вода, подвергнутая воздействию электрического тока, в результате чего она выходит из состояния термодинамического равновесия и способна оставаться в новом состоянии в течение продолжительного времени. Одним из способов получения электроактивированной воды является электрохимическая активация (ЭХА). При разделении межэлектродного пространства электролизера диафрагмой на анодную и катодную камеры из них получают воду с избыточным количеством ионов водорода (анолит) или гидроксила (католит). Эти растворы в течение нескольких часов проявляют повышенную реакционную способность в различных физико-химических процессах, а также характеризуются водородным показателем, который создается не за счет добавления веществ в раствор, а благодаря образованию продуктов неполного гидролиза воды, и способен сохраняться вплоть до нескольких месяцев. Электроактивированная вода нашла широкое применение в различных отраслях народного хозяйства: медицине, технике, сельском хозяйстве и других областях.
Анолит - содержит достаточное количество сильных окислителей и свободных радикалов, которые превращают его в раствор с сильно выраженными биоцидными свойствами. По наблюдениям ученых анолит является антисептиком и может использоваться в качестве консерванта, обладает бактерицидными, фунгицидными, спороцидными и дезодорирующими свойствами (Cloete, Т.Е., Thantsha M.S., Maluleke M.R. et al. The antimicrobial mechanism of electrochemically activated water against Pseudomonas aeruginosa and Escherichia coli as determined by SDS-PAGE analysis // Journal of Applied Microbiology, - 2008. - 0931 November.), после использования самопроизвольно разрушается без образования токсичных соединений и не требует нейтрализации. Он обладает ингибирующими свойствами и замедляет биопроцессы. Не обладает мутагенным действием и экологически безопасен (Колмукиди С.В. Повышение устойчивости к инфекции семян зерновых культур при их антисептировании электрохимически активированной водой // Новые материалы и перспективные технологии. - 2019. - с. 547-551).
Известных в научно-технической и патентной литературе способов с использованием электроактивированной воды (анолит) в качестве стерилизующего вещества для получение хорошо растущей асептической культуры различных эксплантов (семена и листья) растений разных таксономических групп in vitro не обнаружено.
Конкретный пример осуществления предполагаемого способа.
Исследования проводили на семенах растений разных таксономических групп (пшеница сорт Немчиновский, томат сорт Чибис и Минибел, базилик сорт Ароматный фиолетовый и Ереванский рубин, салат сорт Дукат и Орфей) и листовых эксплантах (капуста белокочанная сорт Слава). Для получения стерильной культуры использовали электроактивированную воду (анолит), которую получали при использовании прибора Аквалайф (Россия) с параметрами активации, выставленными в ручном режиме на рН 5,8. Время активации воды составляет 15 мин. По измерениям, данные настройки позволили получить анолит с водородным показателем 2,8-2,9. Электроактивированную воду (анолит) получали из водопроводной воды.
Семена и листовые экспланты помещают в марлевые мешочки и в условиях ламинар-бокса проводят обработку электроактивированной водой (анолит) в течение 25-35 мин. После этого растительный материал вынимают из марлевого мешочка и помещают на безгормональную питательную среду Мурасига и Скуга в чашки Петри. Материал переносят в световую комнату, где поддерживается температура 23°С, 16-часовой фотопериод, освещение белыми люминесцентными лампами, интенсивность освещения 3 тыс.лк. В динамике проводят учет основных показателей - количество стерильных эксплантов (%), прорастание семян (%), биометрические показатели проростков (см).
Изобретение проиллюстрировано на рисунках.
На фиг. 1 Внешний вид проростков базелика in vitro после обработки семян NaOCl 9%
На фиг. 2 Внешний вид проростков базелика in vitro после обработки семян H2O2 10%
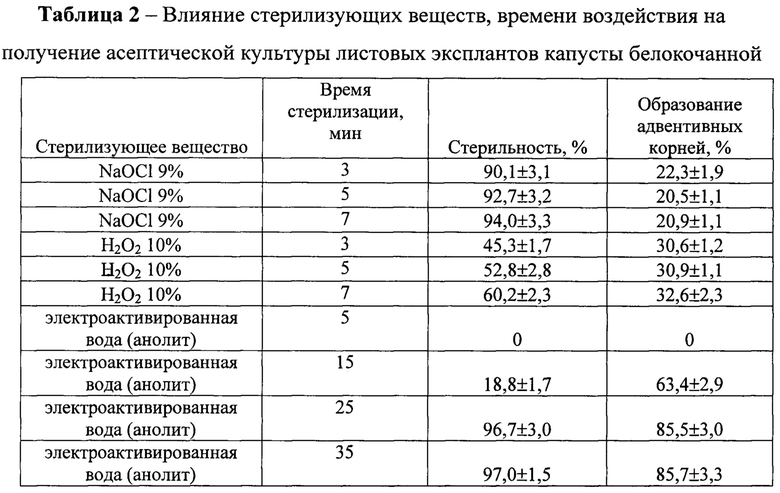
На фиг. 3 Внешний вид проростков базелика in vitro после обработки семян электроактивированной водой (анолит)
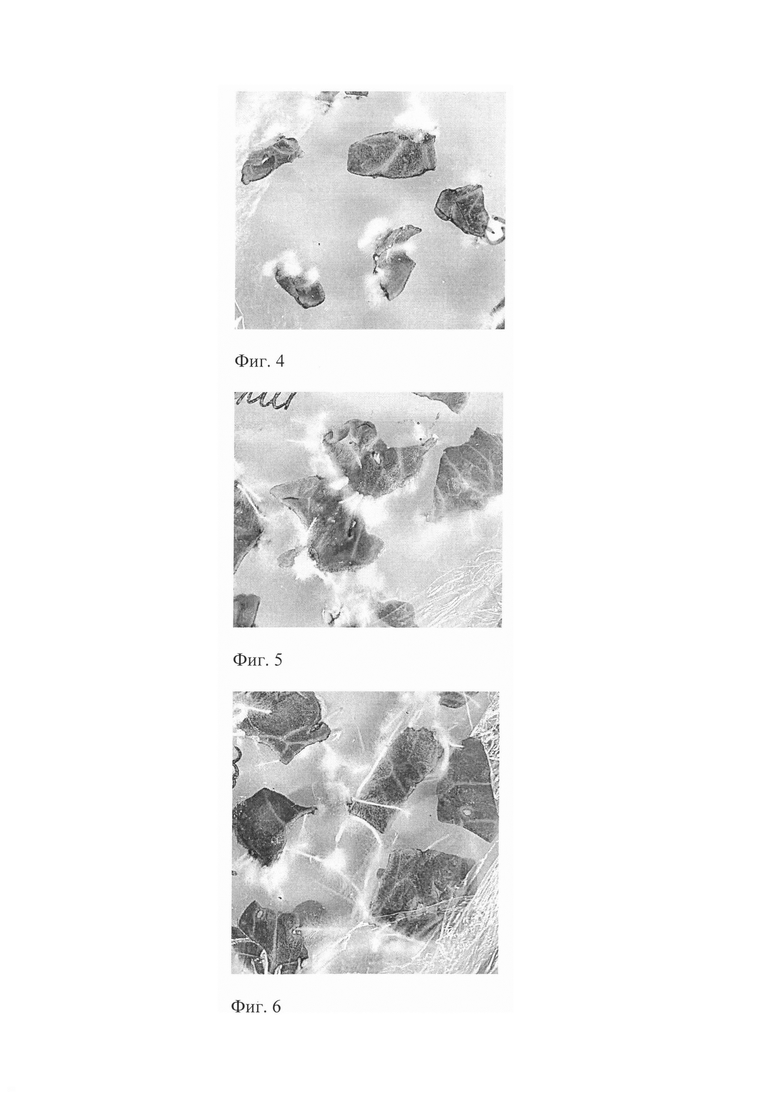
На фиг. 4 Внешний вид листовых эксплантов капусты белокочанной in vitro после обработки их NaOCl 9%
На фиг. 5 Внешний вид листовых эксплантов капусты белокочанной in vitro после обработки их H2O2 10%
На фиг. 6 Внешний вид листовых эксплантов капусты белокочанной in vitro после обработки их электроактивированной водой (анолит)
Пример 1. Для получения асептической культуры семян базелика применяли различные стерилизующие вещества. Первоначально семена помещали в марлевые мешочки и в условиях ламинар-бокса обрабатывают разными стерилизующими веществами: 1) гипохлорит натрия (NaOCl) 9% в течение 3, 5, 7 мин, 2) перекись водорода (H2O2) 10% в течение 3, 5, 7 мин, 3) электроактивированная вода (анолит) полученная на приборе Аквалайф (Россия) с параметрами активации, выставленными в ручном режиме на рН 5,8. Время активации воды составляет 15 мин. По измерениям, данные настройки позволили получить анолит с водородным показателем 2,8-2,9. Электроактивированную воду (анолит) получали из водопроводной воды. Время обработки семян составило 5, 15, 25 и 35 мин. После стерилизации семена промывают стерильной дистиллированной водой и помещают на питательную среду МС. Семена проращивают в условиях световой комнаты, где поддерживается температура 23±1°С, 16-чсовой фотопериод, освещение белыми люминесцентными лампами с интенсивностью 3 тыс.лк. Оценивали количество асептических и зараженных семян, а также определяли всхожесть семян (%).
Основные результаты приведены в таблице 1 и рисунках 1, 2 и 3.
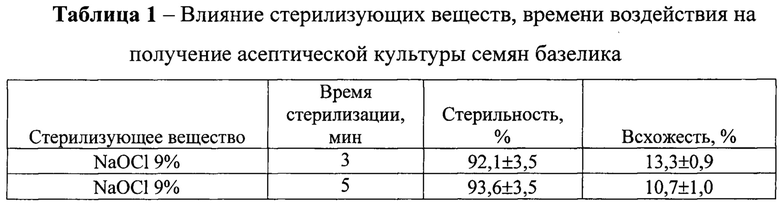
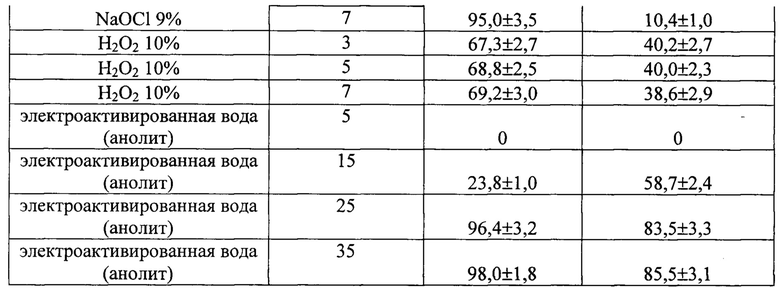
На основании проведенных исследований установлено, что наибольший количество асептических семян (96,4-98,0%) было получено при использовании электроактивированной воды (анолит) при временном воздействии на семена 25-35 мин. В этих вариантах наблюдали формирование из семян проростков правильной морфологии, у которых было отчетливо видно формирование корней и главного побега (Фиг. 3). В остальных вариантах формировались проростки с неправильной морфологией. В варианте с применением гипохлорита натрия формирование корней и главного побега не было отмечено (Фиг. 1), а в варианте с применением перекиси водорода - не развивался главный побег (Фиг. 2).
Пример 2. Для получения асептической культуры листовых эксплантов капусты белокочанной применяли различные стерилизующие вещества. Первоначально листовые экспланты помещали в марлевые мешочки и в условиях ламинар-бокса обрабатывают разными стерилизующими веществами: 1) гипохлорит натрия (NaOCl) 9% в течение 3, 5, 7 мин, 2) перекись водорода (H2O2) 10% в течение 3, 5, 7 мин, 3) электроактивированная вода (анолит) полученная на приборе Аквалайф (Россия) с параметрами, описанными в примере 1. Время обработки листовых эксплантов составило 5, 15, 25 и 35 мин. После стерилизации листовые экспланты промывают стерильной дистиллированной водой и помещают на питательную среду МС. Листовые экспланты культивируют в условиях световой комнаты, где поддерживается температура 23±1°С, 16-чсовой фотопериод, освещение белыми люминесцентными лампами с интенсивностью 3 тыс.лк. Оценивали количество асептических и зараженных листовых эксплантов, а также морфогенетический потенциал (%).
Основные результаты приведены в таблице 2 и рисунках 4, 5 и 6.
На основании проведенных исследований установлено, что наибольший количество асептических листовых эксптантов (96,7-97,0%) было получено при использовании электроактивированной воды (анолит) при временном воздействии на листовые экспланты 25-35 мин. В этих вариантах наблюдали массовое формирование из листовых эксплантов адвентивных корней (Фиг. 6). В остальных вариантах формирование адвентивных корней происходило менее интенсивно (Фиг. 3, 4).
Таким образом, предлагаемый способ включает стерилизацию семян или листовых эксплантов электроактивированной водой (анолит) и позволяет получать в среднем 96,4-98,0% асептических культур с высоким морфогенетическим потенциалом. Данный технологический прием ранее не был использован» в клеточных биотехнологиях растений. Предлагаемый способ получения асептических эксплантов сочетает ряд положительных свойств, которые позволяют использовать ее в практической работе:
1.Технология предполагает использовать водопроводную воду.
2. Время получения электроактивированной воды (анолит) составляет 15 мин.
3. Предлагаемый способ легок в исполнении по сравнению с ранее предложенными разработками авторов.
4. Предлагаемая технология позволяет получать 96,4-98,0% асептических культур.
5. Электроактивированная вода (анолит) - экологически чистый продукт, не вызывает токсичного действия на растительные ткани и клетки.
Заявляемое изобретение направлено на устранение недостатков, которые свойственны наиболее распространенным способам получения асептических культур различных растительных эксплантов (семена, листья, черенки и др) in vitro, которые могут быть использованы в клеточной биотехнологии растений.
Известных в научно-технической и патентной литературе способов с аналогичной технологией не обнаружено. Результат, полученный у данного решения и обусловленный применением технологии стерилизации растительного материала перед помещением его in vitro на питательные среды с использованием в качестве стерилизующего вещества электроактивированную воду (анолит) не достигался в известных решениях.
Использование изобретения позволит увеличить выход асептических культур, обладающих высокой скоростью роста и формированием правильных по морфологии растений, а также высоким морфогенетическим потенциалом, что является необходимым условием при исследованиях по биотехнологии растений, например, при клональном микроразмножении растений.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ культивирования растений in vitro разных таксономических групп | 2023 |
|
RU2804965C1 |
| Способ клонального микроразмножения кардамона черного (Amomum tsao-ko) | 2023 |
|
RU2814183C1 |
| Способ размножения катальпы бигнониевидной (Catalpa bignonioides) | 2024 |
|
RU2834051C1 |
| Способ получения посадочного материала хризантемы в условиях in vitro | 2020 |
|
RU2743967C1 |
| Способ получения каллусной культуры цикория (Cichorium intybus L.) | 2023 |
|
RU2804841C1 |
| Способ выращивания красники (Vaccinium praestans Lamb.) | 2024 |
|
RU2827218C1 |
| Способ клонального микроразмножения секвойи вечнозеленой (Sequoia sempervirens L.) | 2023 |
|
RU2815450C1 |
| Способ получения растений-регенерантов Brassica oleracea L. in vitro | 2021 |
|
RU2759735C1 |
| Способ регуляции морфогенетической активности каллусной ткани лекарственных растений in vitro | 2022 |
|
RU2798292C1 |
| Способ выращивания голубики узколистной (Vaccinium angustifolium Ait.) | 2024 |
|
RU2825762C1 |
Изобретение относится к области биотехнологии. Изобретение представляет собой способ получения асептических культур растительных эксплантов in vitro. Асептическую культуру семян и листовых эксплантов растений разных таксономических групп получают путем выдерживания исследуемых растительных эксплантов в электроактивированной воде (анолит) в течение 25-35 мин, которую получают из водопроводной воды при использовании прибора Аквалайф (Россия) в течение 15 мин с параметрами активации рН 5,8 и водородным показателем 2,8-2,9. Технический результат - увеличение выхода асептических культур, обладающих высокой скоростью роста и формированием правильных по морфологии растений с высоким морфогенетическим потенциалом. 6 ил., 2 табл., 2 пр.
Способ получения асептических культур растительных эксплантов in vitro, характеризующийся тем, что асептический растительный материал семян и листовых эксплантов растений разных таксономических групп получают путем выдерживания исследуемых растительных эксплантов в электроактивированной воде (анолит) в течение 25-35 мин, полученной из водопроводной воды при использовании прибора Аквалайф в течение 15 мин с параметрами активации рН 5,8 и водородным показателем 2,8-2,9.
| ЖУЖЖАЛОВА Т.П., и др., Экологические предпосылки использования активированной воды, Сахарная свекла., 2006., N 1., с | |||
| Пишущая машина для тюркско-арабского шрифта | 1922 |
|
SU24A1 |
| СПОСОБ КЛОНАЛЬНОГО МИКРОРАЗМНОЖЕНИЯ ХРИЗАНТЕМЫ | 2013 |
|
RU2560592C2 |
| CLOETE, Т.Е., et al., The antimicrobial mechanism of electrochemically activated water against Pseudomonas aeruginosa and Escherichia coli as determined by SDS-PAGE analysis, Journal of Applied | |||
Авторы
Даты
2024-09-16—Публикация
2024-02-20—Подача