Изобретение относится к способу получения новых дигидрохлоридов производных ди-0-н-алкилглицеринов которые могут быть использованы в честве неспецифических стимуляторо клеточного промежуточного иммунитета. В частности, эти соединения при годны при стимулировании противоопухолевой активности, а также мог быть использованы в сочетании с из вестными иммунологическими веществ ми в качестве стимуляторов при вак умировании. Известно использование биологических вакцин - синтетического левамизола в качестве иммуностимулятора Cl J. Однако указанные соединения не проявляют цитотоксичность к опухолеобразеваниям. Известны производные глицерина формулы R.-X-CH,, i СН-2-/ Р1 -6. R -Y-CHj где R, R - алкил, алкарил, арил циклоалкил, замещенный нитрогапогенгруп пой арил, X, Y, Z - О, S, SOj, 0 - алкил ей, вклгочакмций t-6 атомов С; В- ди(низший)алкиламино . пиперидино, морфолино пиролидино, низший) алкилпир олидино-, Н- алкил пиперазино, которые получают взаимодействием 1,3-ди (замещенного) 2-пропанола в виде натриевой соли с трет.аминоа килгалоидом. Указанные соединения используют в качестве анестетиков в медицинской практике С21. Целью изобретения является разработка способа получения дигидрохпоридов производных ди-0-н-алкилглицеринов с более широким спектром действия по сравнению с известными Cl. Поставленная цель достигается тем, что согласно способу получения дигидрохлоридов производных ди-0-н-алкилглицеринов общей формулы Г CH,I сн- v CHfORi де один .из Р - yi означает О( CHgNHg а другой OR R, и f каждый означает Cg- или С,д-алкил, соединение формулы и .СНг-2СН- Z CHj-OR где один из 2 и 2 означает О( а другой OR, где Й имеет указанные значения, подвергают каталитической гидрогенизации в присутствии никеля Ренея с последую1дам переводом полученного основания в дигидрохлорид. Предлагаемый способ основан на реакции каталитического восстановления соединений, содержащих циангруппу, в присутствии никеля РенеяL3J. Пример 1. 4-Циано-1-|2,3-(ди-н-децилокси)-н-пропил 4- еннп-пипервдии. 1,2-Ди-0-1Г-децял-(3-0-децил)-3-0-(п-тозил)-глицерин (20 г, 0,0189 моль), полученный из 1,2-ди-)-tн-дeцилЗ-глицepинxлopидa и 4- циано-4-фенилпиперидина (4,5 г, 0,024 моль), соединяют вместе и нагревают до 20 мин. К охладившемуся продукту добавляют воду (50 мл) и эфир (100 мл). Эфирный слой отделяют и промывают насыщенным раствором бикарбоната натрия (2 100 мл) 1 н.раствором хлористоводородной кислоты (100 мл), водой (2 -100 ип), насьш1енньм раствором бикарбоната натрия (100 мл) и водой (100 мл). Затем эфирный раствор высушивают над сульфатом магния, обрабатывают активированньм углем, отфильтровы3вают и концентрируют до маслообразного продукта (10 г). Масло абсорбируют силикагелем, который затем отмывают гексаном (3 200 мл), топу олом(3- 200 мл) ,хлороформом(3 200 мл) и этилацетатом (3 200 мл). После концентрирования этилацетата получают чистое циано-соединениё: масло инфракрасный спектр (точные данные) 2220 см. Пример 2. 4-Аминометил-1-D, З-(ди-н-децилокси)-н-пропил) НИЛ-пиперидин. Нитрил, полученный в примере 1 (1,2 г; 0,0022 моль), растворяют в CHz-CH-CH -ie JX 2НС1 . HjO
ОСмН-йОСиНи
Найдено,%: С 66,46; Н 10,56) N 4,43
2HCt 3/4
,- CH2UH2
(Шг-сн сн2-|( X - нсм/йНаО
1YN-f Г
ОСвНп OCgHn
с т.пл. 176-178 с.
Найдено,%; С 65,27{ Н 9,90N 4,95
нло-сн,
СН-К X 2НС1 J//fH20
I - Ph Н2|СюО-ен2 с т.пл. 190-192 С. Найдено,Z: С 66,70; Н 10,20, N 4,27. 2НС1 -3/4 Н О Вычислено,Z: С 66,53; Н 10,78;, N 4,43 Пример 3. Снижение развития опухоли на модели сарко 180Э Шести самцам СД-1 мывей (2025 г) внутрибрюшинно вводят 106-180 кпеток в возрасте 5-6 дней. Через день после инокулирования опухоли мыаам вводят испытуемое соединение {0,1 мл) в виде водно-жировой эмуль сионной среды (для лекарства типа Интралипид (Куттер Лейбортриз) в нужной дозировке .
СН211Н2 .
Вычислено,ХТ; С66,59; Н 10,78; N4,4 Аналогично получены дигидрохлорид, формулы
Cj HjjOjN 2НС1 - 1/2 Н,0 ,
Вычислено,%:С65,23; Н 10,42; N4,90; а также дигидрохлс ид формулы-; 0 . 4 этаноле (50 мл), затем полученный раствор насыщают газообразным аммиаком и гидрируют под давлением 3,51 кг/см в течение 3ч, применяя скелетный никелевый .катализатор по Ренею (0,7 г). Далее восстановленную смесь отфильтровывают, и фильтрат концентрируют при пониженном давлении до масла (1,1 г). Это масло хроматографируют над силикагелем, отмывают из адсорбента смесью бензол:этанол, превращают в хлористоводородную . соль и перекристаллизовывают из этилацетата, что дает чистую хлористоводородную соль (0,32 г, выход 24%); т.пл. 138-140 0 Затем ведут наблюдение до наступ1ления смерти (в течение 40 дней) . Результаты выражены в возрастающем процентном исчислении периода времени жизни (% ВПВ), определяемом по формуле среднее выяосвание „ леченных мышей Z ВПВ. . too среднее выживание нелеченных контрольных мьшей проведении указанного испытания с использованием соединений фор- , Тн.
где R- и
Rj означают
получены результаты,
в табл. 1.
Пример 4, Оценка внутрибрюшинного активирования макрофага.
Мышам делают внутрибрюшинные инъекции ссотевого раствора испытуемого соединения. Макрофаги вьращиваю через 72 ч посредством внутрибрншинной инъекции 3 мл 8%-ной зародышевой сыворотки теленка - 92% RMI 1А60 среда (Гранд Айленд Байолэджикел К, Нью-Йорк) (leAOjjFCSg) + 5 мл гепарина . Температуру всей среды выдерживают при 37°С, промывают полость 1-2 мин, вскрывают и всю внутрибрюшинную жидкость удаляют посредством стерильной силикониэированной пипетки и переносят.в пластмассовую трубку, вьщерживаемую во льду. Макрофаги подсчитывают с помощью гемоцитометра и доводят до концентрации 1,5 посредством 1640
Затем клетки помещают в пластинки с многочисленными ячейками (1,5 10 клеток в ячейке) и инкубируют 1-2 ч при 37С в атмосфере 5%-ной двуокиси углерода. Всплывший слой отбрасьшают, и ячейки однократно промьгоают средой; макрофаги прилипают к днищам ячеек. 1210 клеток (выращенных из серозной жидкоститранссулата в полости брюшины мьш1ей ДВА, примерно через 5 дней после иннокупяции)суспендируют в 1640,2 FCSj, затем добавляют 1 мп 1-10 клеток/МП в каяд: ую ячейку и инкубируют при 37°С в течение 24-36 ч в атмосфера, содержащей 5% двуокиси . углерода. Затем клетки пульсируют 3H-Tdr (1,0 Ci/мл,Amersham/Searlees) 6 ч при . Всплывший слой отделяют и отбрасывают с помощью фильтра Reeve Angeel для сбора клеток. Клетки промывают пятикратно солевым раствором. Диски фильтра уливают и помещают в сосуды для сдантилляции со сцинтиллирующей жидкостью LSC (5,0 г РРО и 0,2 г РОРОР7л толуола Иорктаун Рисерч). Отсчеты производят 2 мин с применением счет- чика Беекман tS-250. При проведении данной процедуры с использованием соединений формулы
AI О СН
RO-O-CH
получены результаты, приведенные в табл. 2.
Пример 5. Оценка активности моноцита в периферической крови.
Крысам вводят внутривенно испытуемое соединение. Солевой раствор вво дят контрольньв4 животйым. Моноциты собирают через 72 ч посредством отбора 2 МП крови в трубку ЕДТА и разбавления 2 мл солевого раствора. Полученную смесь тщательно разделяют на слои 3 мл LSM (среда для разделения лимфохщтов - Bionetics) и центрифугируют при 800 об/мин 40 мин при комнатной температуре. Для сбора мутного центрального слоя, содержащего моноциты и лимфоциты, используют пипетку. .Эти клетки дважды промывакут балансированным солевым раствором Ханкса, повторно суспендируют в 164052FCSj, помещают в чайки с ячейками и инкубируют при
в 5%-ной двуокиси углерода на 1,5 ч. Затем клетки энергично пpo a raaIoт средой для удаления иеприставших клеток. Оставшиеся моноциты повторно вводят в среду и добавляют L 1210 клеток в соответствии с процедурой, описанной в примере 4. Клетки пульсировапи 3H-Tdr и считали в сцинтилляционном счетчике.
Используя данную процедуру, установлено, что 1,25 мг/кг 4-аминометип-(2,З-ди-й-децилокси)-н-пропил-4-фенилпиперидина обеспечивают 80%-ное ингибирование синтеза ДНК.
П р и м е р 6. Испытание дейст5 ВИЯ прецпагаечвлх. эфиров в качестве вспомогательного вещества для вакцины на ингибирование гемагглюцинации.
Вирус инфлюэнцы, взаимодействия с эритроцитом, вызывает гемагглюти0 нацию. Еспя в пробе сыворотки присутствуют противовирусные антитела, то взаинодействие вируса с крастат клетками крови, приводящее к их склеиванию, предотвращается. Таким S образом, отсутствие агглютинации свидетельствует о наличии противовирусных антител. Определение титра 7 гемагглютинйции обеспечивает измере ние уровня антител. Испытуемые соединения в нужной дозировке вводят в состав рецептуры посредством растворения в 0,3 мл этанола, после ч.его добавляют 0,1 МП Твин-80, и полученную смес добавляют к 4,6 МП Интралипида (Куттер Лейбортриз). Готовят также соответствующие среды без добавления испытуемого соединения. Вирус Флюоген инфлюэнць (Парк-Дэвис и к) смевмвают с каждой из сред с целью получения 250 ССА антигена на 0,5 МП объема для инъекции. Одной группе самок морских свинок Хартг лей (Камм Лейбортриз) вводят внутримьшечно 0,5 мп среды, содержащей Флюоген и испытуемое соединение. Контрольной группе морских свинок делают инъекцию среды, содержащей Флюоген, но без испытуемого соеди нения. Спустя 30 дней после первичной сенсибилизации животнш4 дополни тельно вводят внутримышечно одинаковый античен, тот же, которым они быпи первоначально иммунизированы. У животных берут кровь путем пункщш сердечной мышцы несколько раз посяе первоначальной сенсибилизации Отделяют сыворотку с применением интегрирующей трубки для отделения сыворотки Корвак (фирма Корнинг Гласе Уоркс) и хранят при (-20)С до титрования в ходе гемагглютинационНо1Ч испытания Испытуемую сыворотку, обработанную 0,011 н.раствором йодистого калия для удаления неспецифических факторов сыворотки, котсч ые ингибируют агглютинацию, разливают в серийных двухкратных растворах в 0,025-мшшиметровых емкостях в ячейки |«пфотитратера° (Линбрр Сайентифик Компани, Нью Хейвен, Кон нектикут , .США) типа ISHMRC-96), с одержащие 0,025 мп О,О1-м физиологического солевого раствсфа, буферированного фосфатом (ФБР), при рН 7 Суспензию испытуемого вируса, содержащую гемагглютин единицы на 0,025 МП ФБР, добавляют в казидую ячейку. Включают также ячейку, содержащую один лишь ФБР, и контрольные ячейки с антигеном (ФБР и-вирус антиген) . После инкубирования пластинок при кстнатной температуре в т чение 30 мин в каждую ячейку добав8ЛЯЮТ 0,05 мл эритроцитов крови ЦК Пленка, промытый 0,5%-ным солевым раствором (Флоу Лейбортриз, Роквилл, Мэриленд, США). Инкубирование продолжают до тех пор, пока контрольная ячейка не покажет нормальное осаждение. Сыворотку, полученную у нормальных морских свинок и обработанную перйодатом, включают для оценки уровня ингибирования неспецифической агглютинации,остающейся в испытуемой сыворотке, образованной йодистым калием. Титр ингибирования гемагглютинации определяют как наиболее высокую степень разбавления, при которой происходит полностью ингибированная гемагглютинация с учетом поправки-на неспецифическое ингибирование. Результаты, полученные при испытаннях 4-амино-метил-1- 2,3-(ди-н-дицидокси)-н-пропил А-фенилпиридина, приведены в табл. 3. Наиболее высокий титр ингибироваиия гемагглютинации наблюдают после перевакцинации у тех животных, котог., рым вводят с лечебной целью испытуе-f мое соединение, что свидетельствует об активности соединения в качестве стимулятора при вакцинации. Приведенные результаты соответствуют результатам, наблюдаемым у каждого животного в соответствующих группах. Пример 7. Испытание на цитотоксичность против клеток меланомы В-16 соединения формулы Ph CHiNH-j foHzt-O-CH CioH2i-(bCHQ и левамизола проводят следующим образом. Различные группы здоровых мьтей обрабатывали (внутрибрюшинно) соединением СР-46,6б5 с нормами применения в интервале 0,625-20 мг/кг живого веса, левамизолом с нормами применения в интервале Oj1-10 мг/кг живого веса, или не подвергали обработке (контроль). Через 72 ч у мышей собирали бркипинные экссудатные клетки и испытывали in vitro на их способность к цитотоксичности (т.е. на способность уничтожать) по отношению к клеткам меланомы В-16. Клет91122220
ки, собранные у мышей обработанных леванизолом, не проявляли цитотоксичности в сравнении с клетками, собраннь ш у контрольной группы мышей. Клетки, собранные у мышей, обрабр- 5 танных соединением СР-46,665, демонстрировали следуия ую цитотоксичность относительно контрольной группы: R.R. До Антиген
О .0
О 10 10 10 10 10
Флюоген
Ш
Цитотоксичность,
%
0,625
А 31 64 59 65 1,25 2,5 5 20
Таблица 1
40
40
160
30
10
О
30
10
80
80 100
160
80
1280 640
2360 % ВПВ при дозе, мг/кг 0,251 114I 16 113109154 (1)192 (4) 127(1)139(1)НО108 а, мг/кг Ингибирование синтеза ДНК инкубиро йанных клеток U 1210. лёйке бт (in vitro), Z 1.2576 0,62594 0,31356 Титр ингибирования генагглютинации Сутки I 30 1 44 Т 65 Таблица 2 Та б л и ц а 3
n112222012
Продолжение табл. 3



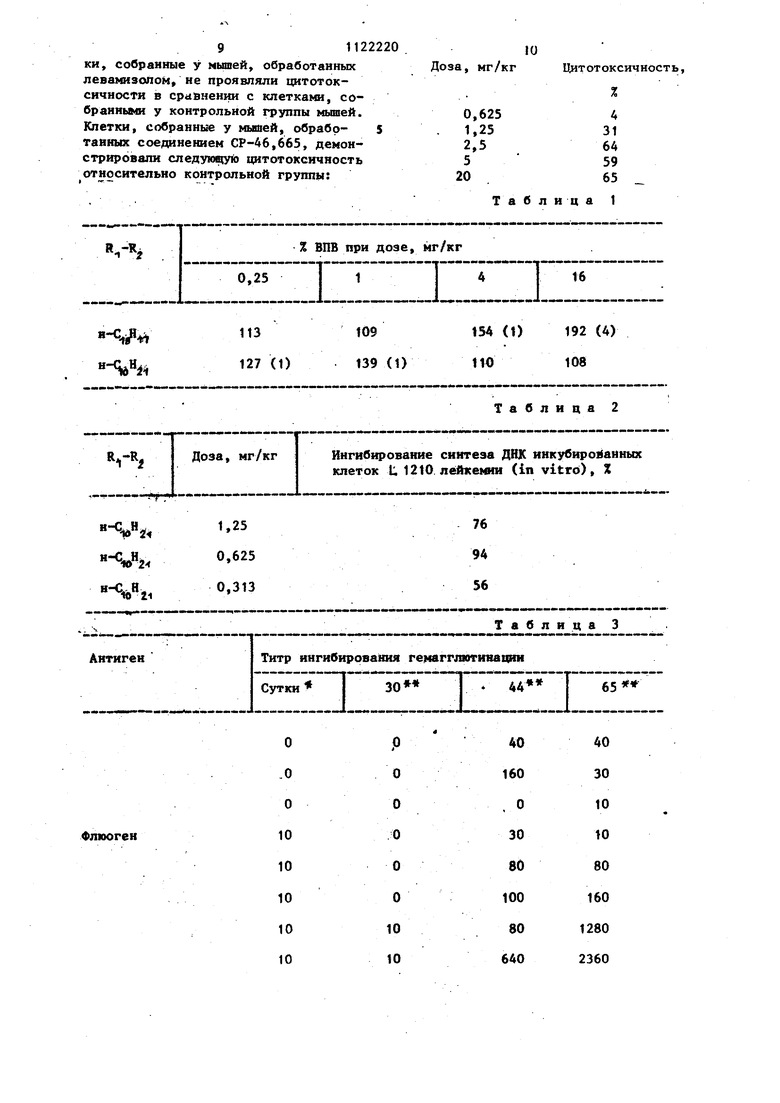

СПОСОБ ПОЛУЧЕНИЯ даГИДРОХЛОРИДОВ ПРОИЗВОДНЫХ ДИ-0-Н-АПКШ1ГЛИЦЕРИНОВ. формулы CHg-v сн-т CHg-OR где один, из Y и Y означает h «О СНгННг a другой ОК, R,, и R каждый означает Cg- или C.jj-алкил, отличающийся тем, что соединение формулы паз - 7 , CH-Z iCHf OR где один из Z и Z означает СО h СХ CN a другой OC, где R -.имеет указанные значения, подвергают каталитической гидрогенизации в присутствии bo ю ю to никеля Ренея с последующим переводом полученного основания в дигидрохлорид.
Сутки после первичнбй сенсибилизации (анафилаксии). Повторное измерение через 30, 44, 65 дней после первичной сенсибилизации
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| G | |||
| Renoux et al | |||
| J | |||
| Immunol, 109, 1972, p | |||
| Реактивный турбо-пропеллер и устройство для его использования | 1924 |
|
SU761A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Прибор для периодического прерывания электрической цепи в случае ее перегрузки | 1921 |
|
SU260A1 |
| Приспособление для строгания деревянных полов, устраняющее работу на коленях | 1925 |
|
SU1956A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Органические синтезы, ч | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| М., Мир, 1973, с | |||
| КАТОК ДЛЯ ФОРМОВКИ КИРПИЧЕЙ ПРЯМОУГОЛЬНОГО СЕЧЕНИЯ ИЗ РАЗЛИТОЙ ПО ПОЛЮ СУШКИ ТОРФЯНОЙ МАССЫ | 1923 |
|
SU477A1 |
Авторы
Даты
1984-10-30—Публикация
1979-05-14—Подача