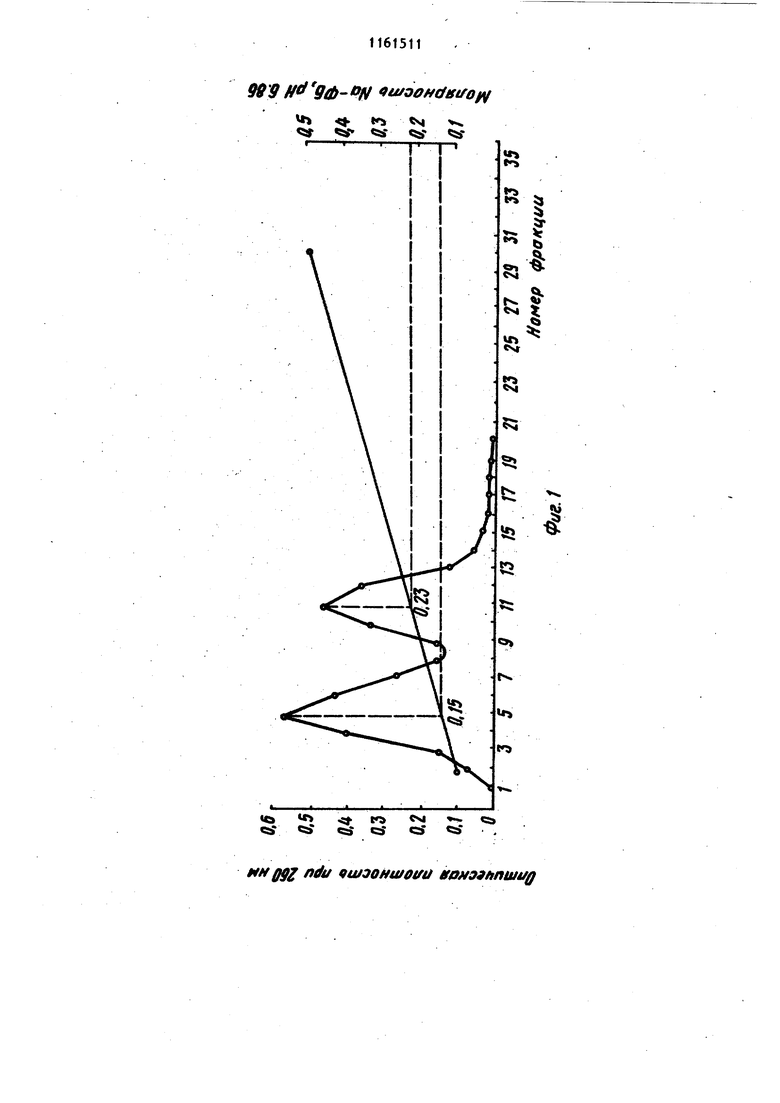
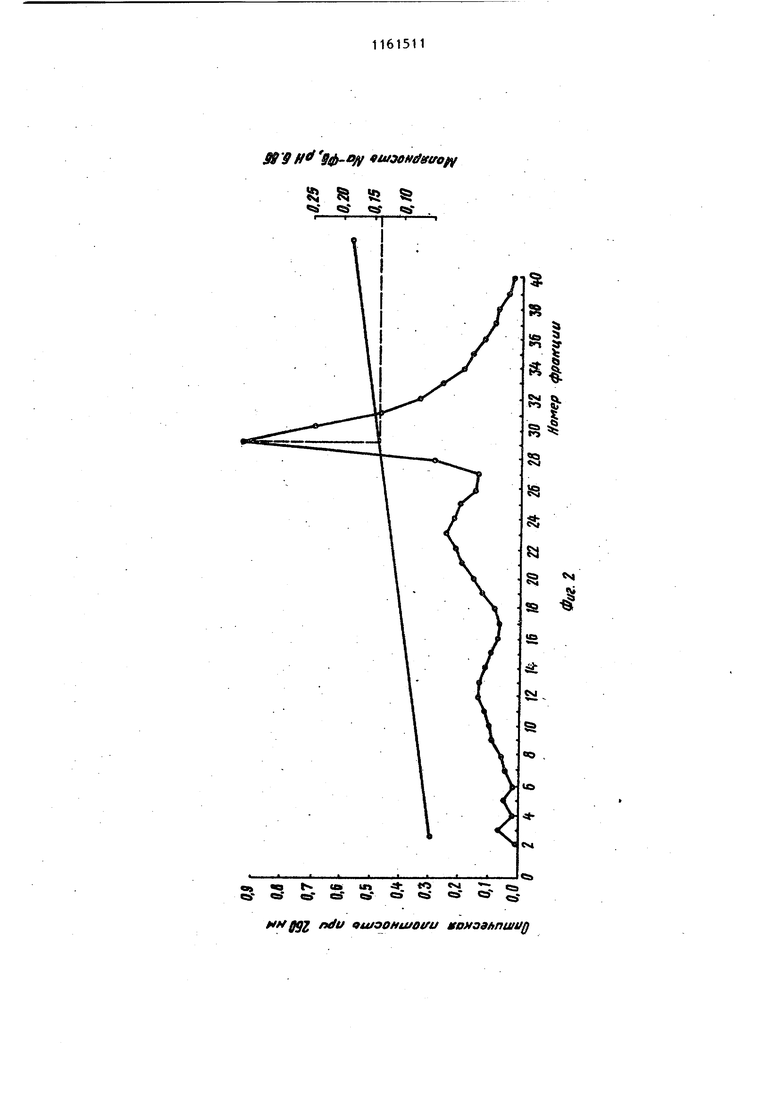
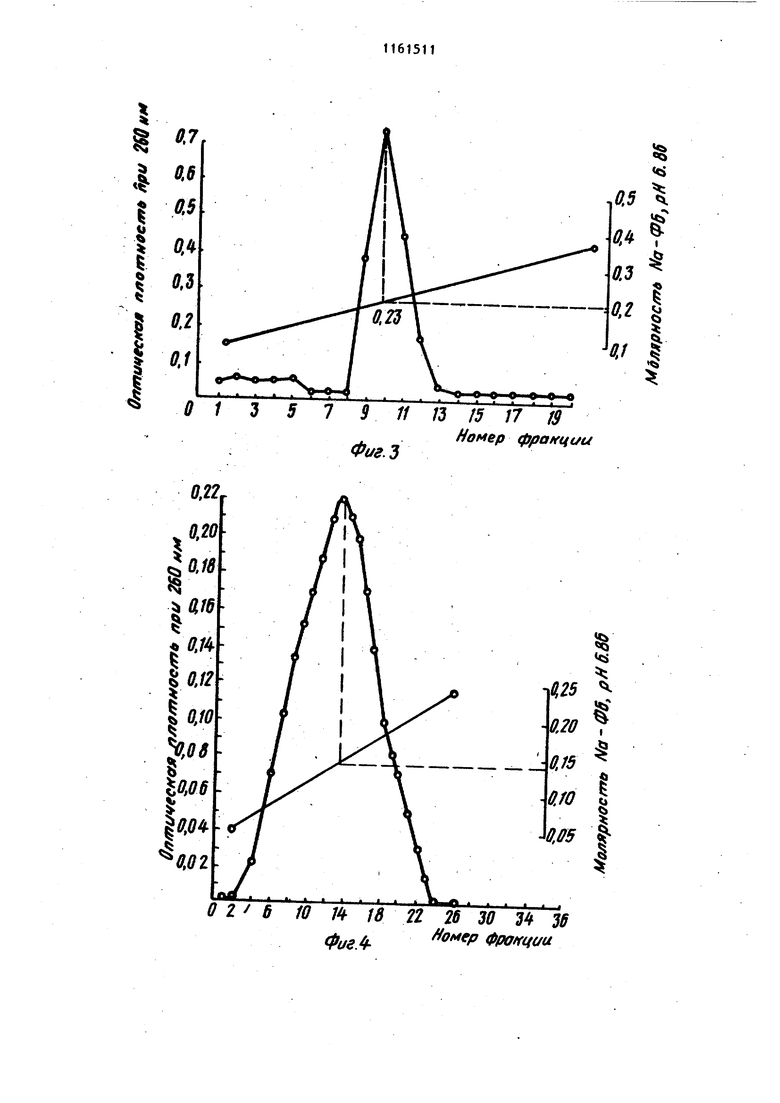
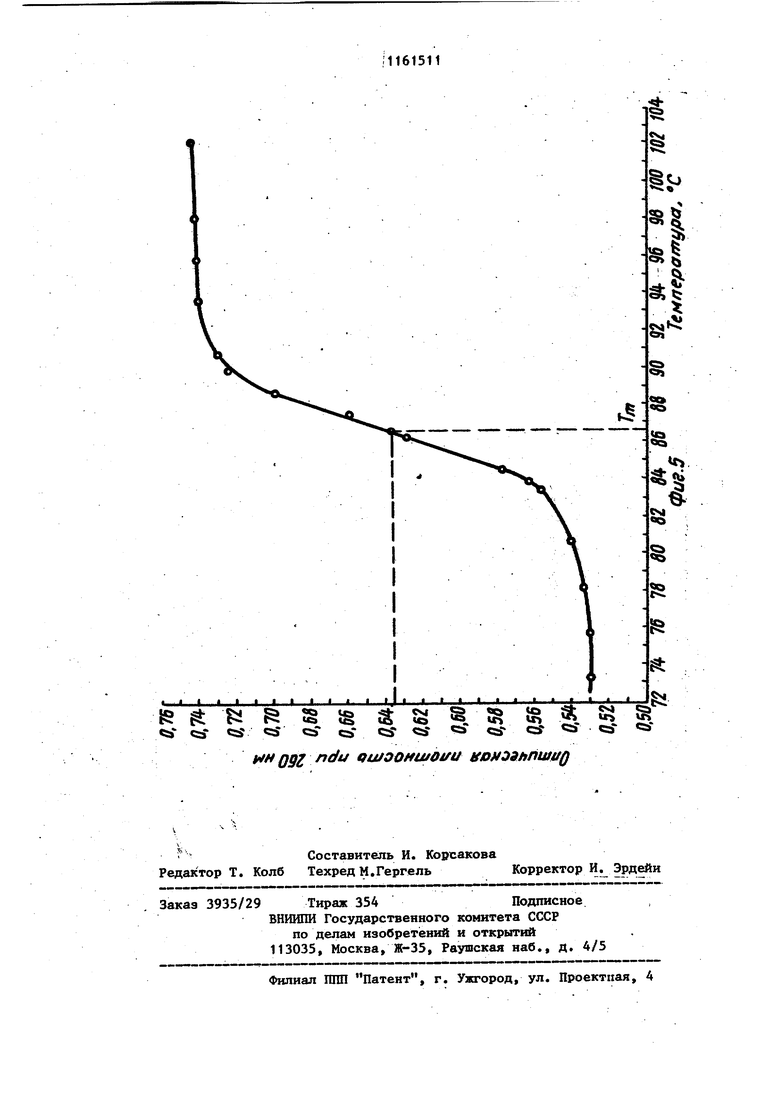
Изобретение относится к усовершенствованному способу вьзделения нуклеиновых кислот, а именно к способу осаждения спиртом дезоксирибонуклбиновой (ДНК), и рибонуклеиновой (РНК) кислот из растворов в присутствии фосфатного буфера, который представляет собой водный раствор со лей NaH2.P04. и ., и КНа.РОф. Спирты, такие как этанол и изопропанол,.широко используются для прямого осаждения биополимеров и их компонентов DI частности нуклеотидов, олигонуклеотидов и нуклеиновы5с кислот, из их водных растворов. Это наиболее распространенный и прос той метод, который применяют при про мьшшенном производстве нуклеиновых кислот. Однако если в растворе присутствуют соли фосфатного буфера,то вслед ствие их нерастворимости в 50-70%-но этаноле получение осадка нуклеиновой кислоты без примеси солей невозможно Известен способспиртового осажде ния нуклеиновых кислот, который заключается в предварительном диализе раствора нуклеиновых кислот для удаления солей фосфатного буфера с nor следующим осаждением этанолом /jZ . Недостатками способа являются его длительность (ТВ-часовой диализ), а также то, что при диализе происходит частичная потеря биополимеров, связанная с их сорбцией на диализной мембране. Известен также способ осаждения нуклеиновых кислот из растворов в присутствии фосфатного буфера, заключаюпцйся в добавлении бромистого центилтриметиламмония (цетавлона) .в количестве 4 мГ на 1 мг ДНК. Выход составляет 95% 3. Однако необходимость проводить в дальнейшем очистку полученного продукта от цетавлона, включающую растворение осадка, центрифугирование и двухкратное пере осаждение этанолом, приводит к умень шению выхода продукта. Наиболее близким к изобретению по технической сущности является способ осаждения нуклеиновых кислот, в част ности ДНК, из растворов, содержащих фосфатный буфере концентрацией солей приблизительно 0,24 М, путем обработки 1 мл исходного раствора 0,1 мл 0,5 М раствора хлорида кальция и 1 мл этанола, отделения образовавшегося осадка, представляющего собой смесь фосфата кальция и ДНК, центрифугированием, обработки его этилендиамином для растворения солей кальция и диализа растворенных солей. ДНК осаждают этанолом после добавления хлорида натрия до концентрации NaCl в смеси 0,2 М. Для получения растворов ДНК, содержащих фосфатный буфер с концентрацией солей 0,24 М, исходный раствор обычно разбавляют водой. Выход полученной ДНК не указан 4 . Основными недостатками этого метода являются длительность стадии диализа и трудоемкость стадий перерастворения и центрифугирования. Цель изобретения - сокращение длительности и упрощение процесса. Поставленная цель достигается тем, что согласно способу осаждения нуклеиновых кислот из растворов, содержащих фосфатный буфер с концентрацией солей 0,3 М, раствор перед обработкой этиловым или изопропиловым спиртом титруют 16М формиатным буфером, имеющим рН 2,9-3,0 до значения рН раствора 3,5-3,6. При этом для осаждения ДНК обрабатывают раствор одним объемом спирта, а для осаждения РНК - двумя объемами спирта. Обычно снижение концентрации солей натрий-Лосфатного буфера осуществляют путем разбавления исходного или охлаждения его до О С с последующим сливом надосадочной жидкости. Снижение концентрации солей калийфасфатного буфера достигается разбавлением исходного раствора, поскольку гидроортофосфат и дигидроортофосфат калия обладают больдией растворимостью, чем фосфорнокислые соли натрия, и при охлаждении не выпадают в осадок. При исходных значениях концентрации солей ниже0,3М первую стадию вообще опускают. Для осаждения ДНК обычно используют один объем спирта, а при осаждении РНК два объема. Известно, что при комнатной температуре 50%-ная денатурация ДНК имеет место при рН 2,9 4Д. Кроме того, согласно 5 наличие в растворе 50-70% этанола понижает темпеРУтуру плавления ДНК, что эквивалентно повышению кислотности денатурации на 0,125-0,35 ед., т.е. до значения рН 3,15-3,25. Поэтому титрование растворов ДНК или РНК, содержащих фосфатный буфер, заканчивают, когда рН раствора достигает 3,5-3,6, что выше значения денатурации. Значение рН более высокие, чем 3,6, использовать нецелесообразно, так как это приводит к снижению растворимости солей Ьосфатного буфера в водноспиртовой смеси и затрудняет процес осаждения. Для титрования используют формиатный буфер, имеющий рН 2,9-3,0. Нижняя граница рН буфера 2,9 подобрана с таким расчетом, чтобы при подкислении, которое осуществляется путем добавления формиатного буфера к раствору нуклеиновой кислоты при одновременном перемешивании с. помощью магнитной мешалки, не произош ла денатурация биополимера. При зна чении рН, которое имеет используемы для титрования буфер, денатурация дезоксирибонуклеиновой кислоты, например, протекает за десятки секунд Но поскольку перемешивание раствора и выравнивание рН происходит за период времени, который меньше на целый порядок, то биополимер после такой обработки остается в нативном состоянии. Однако значение рН можно снизить Так, согласно }титрование раствора ДНК проводят с помощью концентрированной соляной кислоты (т.е. рН титрующего агента ниже 2,9). Титрование растворами, рН которых ниже критического значения 2,9, при котором начинается денатурация ДНК, осложняет проведение процесса. Для предотвращения длительного локальног понижения рН титрующий агент добавляют в микроколичествах (капилляром) при крайне интенсивном перемешивании на магнитной мешалке. Это увеличивае трудоемкость метода и делает его неприемлемым для работы с. большими объемами нуклеиновых кислот, так как объем добавляемого титрующего агента и скорость перемешивания становятся критическими моментами. Верхний предел значений рН формиатного буфера выбран с таким расчетом, чтобы максимально снизить раз бавление раствора нуклеиновой кислот при титровании, а следовательно, уменьшить потери целевых продуктов ,при спиртовом осаждении. Установлено, что при использовании формиатного буфера со значением рН 3,1-3,2 возрастает необходимый для титрования объем этого буфера, а выход ДНК и РНК при последующем осаждении спиртом снижается. Буфер со значением рН 3,5 нельзя использовать, поскольку при этом не удается осадить нуклеиновые кислоты спиртом в присутствии фосфатного буфера. Выбор для осаждения формиатиого буфера, а не глицин-НС1 или фталатНС1 буферов, у которых диапазон значений рН включает 2,9-3,0 OQ обусловлен тем, что растворимость в воде глицина йфталевой кислоты значительно ниже, чем муравьиной кислоты. (Максимальная концентрация глицин-НС1 буфера не превышает 3 М, концентрация фталат-НС1 буфера ниже. При подкислении раствори нуклеиновых кислот, содержащего фосфатный буфер необходимо добавлять большой объем подкисляющего агента, что ведет к разбавлению растворов ДНК и РНК, в результате чего снижается выход нуклеиновых кислот при спиртовом осаждении и возрастает расход этилового (или изопропилового) спирта. Для титрования растворов необходимо использовать наиболее концентрированный формиатный буфер, максимальная концентрация которого 16М. Уменьшение концентрации буфера нецелесообразно, так как при этом возрастает разбавление титруьмого раствора нуклеиновой кислоты и, как результат этого, Ьнижается выход целевых продуктов, а расход используемого Для осаждения спирта возрастает. Таким образом, существенным отличием предлагаемого способа является . титрование растворов, содержащих фос-фатный буфер, перед обработкой спиртом 16 М формиатным буфером, имеющим рН 2,9-3,0, до значения рН раствора 3,5-3,6. Качество получаемых согласно предлагаемому способу препаратов ДНК и РНК проверяли хроматографическими и спектроскопическими методами. На фиг. 1 прелставлены результаты анализа хроматографической очистки на гидроксиапатите исходного препарата ДНК печени крысы в присутстии примесей РНК; на фиг.2 - то же. исходного препарата дрожжевой РНК; на фиг.З то же, ДНК печени крысы после спиртового осаждения из фосфатного буфера с предварительным подкислением; на фиг.4 - то же, дрож жевой РНК после спиртового осаждения из фосфатного буфера с предварительным подкислением; на фиг.З - кривая плавления ДНК печени крысы после спиртового осаждения из фосфатного буфера с предварительным подкислением. Препараты ДНК и РНК, получаемые согласно предлагаемому способу проверяли на нативность и степень чистоты. Нативность указанных биополимеров устанавливали по концентрации элюции с гидроксиапатита, а также по гиперхромному эффекту и температуре плавления. Известно, что при элюции с гидроксиапатита линейным градиентом концентрации Na-фосфатного буфера (NaФБ) нативная ДНК элюируется при концентрации последнего, превьшающей . 0,2 М, в то время как РНК и денатурированная ДНК элюируются при белее низкой концентрации Na-ФБ (0,130,15 М). Следует отметить, что лри наличии смеси нативной и денатурированной ДНК соответствующие им пики полностью разделяются. Показано, что концентрация элюци ДНК составляет 0,23 М, а РНК - 0,14 0,15 М На-ФБ рН 6,86 (фиг. 1 и 2). После спиртового осаждения ДНК и РН из фосфатного буфера .с предваритель ным подкислением 16 М формиатным бу фером полученные осадки биополимеро растворяли и проводили их повторную хроматографию. Как видно из фиг. 3 и 4, концентрация элюции как ДНК, так и РНК не изменяется после осажд ния предложенным способом. ДНК и РНК элюируются одиночными пиками соответственно в области 0,23 М и 0,14 М Na-ФБ, что говорит о нативно ти и гомогенности этих препаратов. Спектрофотометрическое определение гиперхромизма получаемых соглас предложенному способу образцов ДНК при нагревании последних до 100° С с последующим добавлением формальде гида и охлаждением дало значение гиперхромного эффекта от 39,4 до 40 что характерно для нативных ДНК. Та кое же значение гиперхромного эффек получено при плавлении препаратов ДНК, полученных после спиртового осаждения из фосфатного буфера с предварительным подкислением, на спектрофотометре СФ-4. Температура плавления Т составила 86,б С, что также характерно только для нативных ДНК С. Кривая плавления ДНК печени крысы . в растйоре, содержащем 0,15 М NaCl и 0,015 М цитрата Na (рН 7,3), изображена на фиг.5. Чистота препаратов ДНК и РНК определялась их спектральными характеристиками. Препарат нуклеиновой кислоты считается чистым, если для его спектра выполняются соотношения Еаео/Ег50 1,8; Еа.ео/Е„о 2 (Е - оптическая плотность при длине волны, равной 7 И . В таблице приведены спектральные характеристики препаратов ДНК печени крысы и дрожжевой РНК д0 и после осаждения. Как видно из таблицы, обработка формиатным буфером перед осуждением не загрязняет препаратов нуклеиновых кислот. Наоборот, спектральные характеристики ДНК и РНК после спиртового осаждения из фосфатного буфера с предварительным подкислением по сравнению со спектральными характеристиками исходных препаратов несколько улучшаются. Пример Т. Осаждение ДНК из растворов, содержащих 0,5 М фосфатный буфер (рН 6,9). 15 мл раствора ДНК печени крысы (0,18 мг/мл; 3,6 о.с.) мл; 2,7-10-з г), Содержащего Na-фосфатный буфер в концентрации 0,5 М охлаждают в химическом стакане до 0°С и выдерживают при этой температуре в течение 10 мин. При этом выпадают кристаллы солей фосфорной кислоты, после чего надосадочную жидкость осторожно сливают в чистый химический стакан. Концентрация буфера при этом снижается доО,3 М. ; Слитый раствор титруют 16 М формиатным буфером рН 3,0 при перемешивании с помощью магнитной мешалки. Перемешивание прекращают, когда рН титруемого раствора достигает значения 3,5. После окончания титрования к раствору ДНК добавляют 17,5 мл этанола. Выпадает осадок ДНК, его собирают. Получают 2,45 10-3 г (94%) ДНК. Пример 2. Осаждение ДНК из растворов, содержащих 0,25 М Na-фосфатный буфер (рН 7,0).
14,8 мл раствора печени крысы (0,045 мг/мл; 0,9 о.с./мл; 0,6710 г), содержащего 0,25 М Na-фосфатный буфер, титруют в химическом стакане формиа:тным буфером (16 М, рН 2,9), перемешивая раствор при помощи магнитной мешалки, до значения рН 3,5. .Затем к раствору добавляют 16 мл изопропанола, собирают выпавший осадок. Получают 0,54-10 г (80%) ДНК.
Пример 3. Осаждение РНК из растворов, содержащих 0,15 М Na-фЬсфатный буфер (рН 7,0).
Сзгммарный пул фракций, содержащих РНК дрожжей и собранных после хроматографии на оксиапатите, представляет собой раствор РНК (10,0115 мг/м 2,3 о.с./мл; 1,49510- г) вО,15М Na-фосфатном буфере, рН 7,0. 13 мл этого раствора подкисляют 16 М формиатным буфером на рН-метре -до значения рН 3,5 при перемепшвании на магнитной мешалке. Затем приливают к раствору РНК 27 мл этанола и выдер живают при в течение 1 ч. Выпавший осадок РНК собирают центрифугированием (18 тыс. об./мин) в течение 10 мин. Выход РНК составляе 1,230-10- г (82,5%).
Пример 4. Осаждение -ДНК из растворов, содержащих 0,5 М К-фосфатный буфер (рН 7,2).
15 мл раствора ДНК печени свиньи (10,10 мг/мл; 2 о.с./мл; 1,5«10- г) содержащего 0,5 М К-фосфатный буфер (рН 7,2), предварительно разбавляют дистиллированной водой в 2 раза.
После подкисления формиатным буфером на рН-метре до рН 3,56 с одновременным перемешиванием раствора магнитной мешалкой добавляют 32,4мл этанола.
Осадок отделяют, выход ДНК -10- г (84,5%).
Таким образом, предлагаемый способ осаждения нуклеиновых кислот позволяет быстро и с высоким выходом вьщелять ДНК или РНК из растворов, содержащих фосфатный буфер, осуществляется при любом объеме раствора и не требует длительного и трудоемкого диализа.



| название | год | авторы | номер документа |
|---|---|---|---|
| Способ выделения дезоксирибонуклеиновой кислоты | 1982 |
|
SU1081171A1 |
| СПОСОБ ПОЛУЧЕНИЯ ХОЛЕСТЕРОЛЭСТЕРАЗЫ, ТРИПСИНА, ДЕЗОКСИРИБОНУКЛЕАЗЫ И РИБОНУКЛЕАЗЫ ИЗ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ КРУПНОГО РОГАТОГО СКОТА | 2005 |
|
RU2311455C2 |
| Способ получения аффинного сорбента для фракционирования нуклеиновых кислот | 1989 |
|
SU1655534A1 |
| Способ фракционирования нуклеиновых кислот | 1989 |
|
SU1692986A1 |
| СПОСОБ ВЫДЕЛЕНИЯ ДНК | 1991 |
|
RU2026864C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИПОПОЛИСАХАРИДА ВОЗБУДИТЕЛЯ ЧУМЫ | 2012 |
|
RU2483112C1 |
| Способ получения кислой дезоксирибонуклеазы | 1982 |
|
SU1100308A1 |
| Способ получения нуклеината натрия из микроводоросли Chlorella vulgaris Beijerink | 2020 |
|
RU2742056C1 |
| Способ получения нуклеината натрия из сухой биомассы микроводоросли Chlorella vulgaris Beijerink | 2020 |
|
RU2747120C1 |
| Способ получения нуклеината натрия из биомассы микроводоросли Chlorella vulgaris Beijerink | 2020 |
|
RU2742053C1 |
1. СПОСОБ ОСАВДЕНИЯ НУКЛЕ(Л ИНОВЫХ КИрЛОТ ИЗ РАСТВОРОВ, СОДЕРЖАс ЩИХ ФОСФАТНЫЙ БУФЕР с концентрацией солей 0,3 М, путем обработки раствора этиловым или изопропиловым спиртом, отличающийся тем, что, с целью сокращения длительности и упрощения процесса, раста вор перед обработкой спиртом титруют 16 М формиатным буфером, имеющим ел рН 2,9-3,0, до значения рН раствора ,3,5-3,6. 2. Способ по п. 1,отличающий с я тем, что для осаждения дезсксирибонуклеиновой кислоты обрабатывают раствор одним объемом спирта, а для осаждения рибонуклеиновой кислоты - двумя объемами спирта. j
Препарат
ДНК печени
крысы до
осаждения
ДНК печени крысы после осаждения предлагаемым способом
РНК дрожжей до осаждения
РНК дрожжей после осаждения предлагаемымспособом
Спектральные характеристики
/Е,
acf - 8.V5
2,2
2,3
2,17
2,2
999 f/ff iXf-f/ u/ooft€tifi/o
НЪ CM Ч S «Sf Ъ- «Ъ
«О to CM Cb
c ctf cs C5 a ,
Htf09Z 9W3QHUfei/a У13М9911ПШид
9 Н «f yoftfsttfo
1 « ,
Г«. U tn 4- to м tf- е ъ с аГ
ffffggZ ndu 9u/9Offtuoift/ ttoMaahnuuf)
I
0.7
0.6 0.5
I
ОЛ O.S
о
0.2 0.1
О 1 Ъ 5 1 9
11 /3 5 17 19
Номер
Фиг.Ъ
0.22 0.20
UW J
I «74 I O.f2
|a/ .os
0.06 §:
ff.04I
ff.02
4S
7
I
10 т 18 22 26 30 J« 3ff Фиг. F:i 2§ i§ § Cs - - o es «a ggi ndu «twootfwoi/u teotfMhnuit/Q cs- af 2 Jg 5 ci . r СГ . e f
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Кау E.R.M., Simmons N.S., Donee A.L | |||
| An Improved Preparation of Sodium Dezoxyribonucleate | |||
| - J | |||
| Am | |||
| Chem | |||
| Soc., 1952, 74, 1724 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Hydroxyapatite Column Chromatography in Procedures for Isolation of Purified DMA | |||
| - AnalyticalBiochemistry, 1974, 59, 554 (прототип) | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Выделение и очистка ДНК из высших растений с помощью бромистого цетилтриметиламмония в сочетании с хроматографией на оксиапатите | |||
| Биоорганическая химия, 1976, т | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Устройство для одновременной передачи двух сообщений по радиотелеграфу | 1924 |
|
SU1182A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Влияние лигандов с избирательным характером взаимодействия на переход спираль - клубок ДНК IV | |||
| Тепловая денатурация ДНК в кислой среде | |||
| - Молекулярная биология, 1981, т | |||
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
| МЕТАЛЛИЧЕСКАЯ НАБИВКА ДЛЯ САЛЬНИКОВ | 1925 |
|
SU1093A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| On the structure and stability of DNA-Photometric and DNA-Polypeptide complexes | |||
| Mol | |||
| Biolog., 1968, V | |||
| Способ сопряжения брусьев в срубах | 1921 |
|
SU33A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Справочник по биохимии | |||
| Киев, Наукова думка, 1971, с | |||
| Спускная труба при плотине | 0 |
|
SU77A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Под ред | |||
| акад | |||
| А.И | |||
| Белозерского | |||
| М,, Мир, 1970, с | |||
| 0 |
|
SU183191A1 | |
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| Щадящий метод выделения ДНК из ядер клеток насекомых | |||
| - Укр | |||
| биох | |||
| ж., 1982, 54, с | |||
| Способ амидирования жидких сульфохлоридов ароматического ряда | 1921 |
|
SU316A1 |
Авторы
Даты
1985-06-15—Публикация
1983-07-01—Подача