1
Изобретение относится к способам получения новых производных тиазолй- дина, которые обладают фармакологической активностью, и могут найти применение в медицине.
Цель изобретения - создание новых производных тиазолидина, обладающих . противоязвенной активностью без побочного действия на организм.
П р и мер 1. 3-Бензш1-2-циан- ими ютиазолидин (соединение А).
К кипящей смеси из 1,27 г (10 ммоль) 2-цианиминотиазолина, 2 мл ацетона fi 1,52 г прокаленного ка1рвоната .-прикапьшают 1,3 мл (11 ммоль) бензилбромида. После кипячения (4 ч) вьшавшую в осадок соль отфильтровывают и филйтрат выпаривают. Кристаллический остаток растирают с эфиром и отфильтровывают. Получают 2,03 г З-бензил-2-цианимино- тиазолудина (93,5% от теории), мол.м. 217,29, т.пл. 102-104 С. После перекристаллизации температура плавления остается неизменной.
Найдено, %; С 60,98} Н 5,02; N 19,57j S 14,96.
С 41( 3
Вычислено,%: С 60,80; Н 5,10i N 19,34J S 14,76.
ИК-спектр (KBr), см1 2190,
1570, - (широкая).
ЯМР (CDClj), М.Д.: 3,38, мульти- ппет (2), -S-CHj-: 3,85 мультиплет
2) ,N-CHj - гетероциклич.); 4,65 синглет (2), Н-СНг - .(фенил)i 7,38
синглет (5), -Аг-Н.
Аналогично описанному способу поучают следующие соединения. ; . 3-Бензил-2-(карбамош1имино)-тиазо- лидин, мол.м. 235,31, т.пл., 143- . , после перекристаллизации из этанола т.пл. повьшается до 148°С.
Найдено, %: С 56,10 Н 5,46, N18,10.
.
Вычислено, %: С 56,15J Н 5,97; N 17,86.
ИК-спектр (КВг), 3320, 3260, 1645, , 1540; C N-,
ЯМР (CDClj + DHCO - dg),м. Г,05 триплет (2), - S-CHj-; 3,5 триплет (2), N-CHj - (ретероциклич.); 4,75 синглет (2), N-CHj - (фенил); 5,6 ; 7,32 синглет (5), Аг-Н.
3562 . : ;
З-Бензил-2-нитрометилентиазоли- дин, Т.Ш1. 136-138°С, после перекристаллизации из 140 мл этанола получают 4,08 г чистого продукта, мол.м. 236,30, т.пл. 139°С. Найдено, %: С 55,81, Н,4,99; N 11,89.
Вычислено, %: С 55,91{ Н 5,12 N 11,86.
ИК-спектр (КВг), , 1633, С-С-, 1535, 1354,Л-NOj.
ЯМР (CDClj), м.дi: 3,1 триплет -S-CHj; 3,8 м.д. триплет, :;N-CHj- (гетероциклич.-) 4,43 синглет, N-CH2-(); 6,97 синглет, 7,0-7,3 муль Типлет, -Аг-Н.
2-Циан№1ино-3-(4-метоксибензил)- -тиазолидин, мол.м. 247j31,тTпл. 99- 102 С .
Найдено. %: С 58,35,- Н 5,17.
; с,2Н,,Нз08 . :
Вычислено, %: С 58,28, Н 5,30. ИК-спектр (КВг), : 2840, -O-CHji 2185; . 1570, 1608, 814, -Ar.
ЯМР (CDClj), м.д.;3,3 мультиплет, -S-CHj-; 3,7 мультиппет, rN-CH -; 3,75 синглет, -О-СН, 4,43 синглет, N-CH2-(CgH,j); 6,9 квадруплет, -Аг-Н.
2-Цианимино-3-(2-фурилметил)- -тиазолидин, мол.м. 207,25, т.пл. 124-125 С..
Найдено, %: N 20,38, -S 15,44.
Вычислено, %: N 20,28; S 15,47. HK-cneKTpjr(KBr), . : 2185j
1750, 1238,- С-О-СГ,
795- -Ar-H. ЯМР (CDCIj), М.Д.: 3,3 мультиплет,
-S-CHj -; .3,7. мультиплет, -N-CH (гетероциклич.); 4,57 синглет,
-N-CH,,-Arv 6,3 дублет, -Ar- (3,4) H;
7,3 мультиплетj-Ar- (5) H. 2-Цианимино-3-(4-метилбензил)-тиазолидин, мол.м. 231,31 т.пл. 102104°С.
Найдено, %: С 62,16ГН 5,52; S 13,96. .
С„.Н,,Нз8
Вычислено,%: С 62,26; Н 5,66; S 13,85.
ЙК-спектр (КВг), CM S 2190, -CsN; 1590, 1260, -S-CH,-; 792 -Ar.
ЯМР (CDClj), м.д.;2,31 синглет, -СНз, 3,3 мультиплет, -S-CH -; 3,7 мультиплет, (гетероциклич.)J
3.. 1
,54 синглет, N-CH,,. (фени- ен); 7,10 синглет, -Аг-Н.
3-(2-Фурилметил)-2-нитрометилен- иазолидин, т.пл..190-192°С. После перекристаллизации из нитрометана температура плавления остается неизменной. ИК-спектр (КВг), см : 1543, 1340, -NOj; 1640, 3130, 757 фуран, 5C-HJ 1243, : С-0-С.
ЯМР (трифторуксусная кислота), М.Д.: 3,7 триплет, -S-CH -; 6 триплет , li N-CH -; 5,07 синглет, 5N-CH2 - (С Нз 0), 6,3 дублет, -CH-NO ; 6,5 мультиплет, фуран (3,4) Н; 7,5 мультиплет, фуран 5Н. .2-Цианимино-3-(4-оксибензил)- -тиазолидин, т.пл. 175-177 С.
ИК-спектр (КВг), : 2190, -CrN, 1570, 3210,. -ОН; 1610, 840, -Ar. . . ЯМР (CDClg), м.д., 3,4 мультиплет, -S-CHj;3,7 мультиплет,N-CH2-; 4,5 синглет, -Аг-СН,,-; 6,9 квадру- . плет -Аг-Н; 9,47 синглет, - ОН.
Пример 2. 2-Цианимино-З- . -(4-хлорбензш1)-тиазолидин.
3,82 г (30 ммоль) 2-цианимино- тиазолидина, 4,9 г (30 ммоль) 4-зшор беизилхлорида и 4,3 г прокаленного карбоната калия кипятят в 100 мл . ацетона в течение 5 ч. По окончании реакции неорганическз о соль отделяют путем отфильтрования и ацетоновый раствор выпаривают. Остаток кристаллиз уют из 40 мл изопропанола. Получают 6,26 г 2-цианимино-3-(4- -хлорбензил)-тиаз олидина (83% от теории), мол.м. 251,74 т.пл. 131- 133°С
Найдено, %: С 52,72; Н4,18, N 16,49.
С„Н,оСШзЗ
Вычислено, %: С 52,48; Н 4,00, N 16,69.
ИК-спектр (КВг), см : 2185, -CrN; 1560, , 1092, -Ar-Cl.
ЯМР (СОС1з + DMCO - dg), м.д.: 3,3 мультиплет (2), -S-CH -; 3,8 мультиплет (2), -Nj-CH - (гетеро- циклич.){ 4,50 синглет (2), ::N-CH2 (); 7,12 синглет (4), -Аг-Н.
П р и м е р 3. 2-Цианимчно-З- -(3,4-дихлорбензил)-тиазолидин.
Аналогично примеру 2 3,82 ,г (30 ммоль) 2-цианиминотиазолина и 6 г (31 ммоль) 3,4-дихлорбензш1хло-;
15
20
5
0
40356-4.
рида вводят во взаимодействие, остаток после выпаривания перекристаллизуют из 50 мл этанола. Получают 6,8 г 2-цианимино-3-(3,4-ди- 5 хлорбензил)-тиазолидина, мол.м. 286,18, т.пл. 130-1.32°С.
Найдено, %: С 46,12; Н 3,18i S 11,22.
С„
10 Вычисленсг, %: С 46,16i Н 3,17{ S 11,21.;
ИК-спектр (КВг), см : 2190, , 1570, 1060, -Ar-Cl.
- . . , -
ЯМР (СВС1з), м.д.,4 мультиплет (2), -S-CHj-; 3,7 мультиплет (2),. Ы-СНз- (геТероциклич.){ 4,56 синглет (2),N-CH2- (3,4-дихлорфенил) 6,9-7,5 мультиплет (3) -Аг-Н.
Пример 4. 2-Щ1анимино-3- - -(4-нитробензил)-тиазолидин.
2,54 г (20 ммоль) 2-цианимино- тиазолидина, 3,43 г 4-нитробензил- хлорида и 2,85 г безводного Карбоната калия кипятят в течение 6 ч в 80 мл ацетона. Выпавшую в осадок соль отфильтровывают, раствор выпаривают и остаток кристаллизуют из 30 мл ацетонитрила. Получают 3,66 г (70% по теории) 2-цианимино-3-(4- . -нитробензил)-тиазолидина, мол.м. 262,29, т.пл. 171°С. . . ,Найдено,%: С 50,36; Н 3,94 ; : N 21,46. ..
C,;H,oN 0,3 .
5 Вычислено, %: С 50,37| Н 3,84; N 21,36. .
ИК-спектр (КВг), 2190} , 1575, 1505, 1343, -NQj.
ЯМР (С1)С1з + DMCO-dg), М.Д.: 3,4 0 мультиплет (2), -S-CH -; 3,8 мультиплет (2), ;;;N-CHj-; 4,65 синглет (2), ::: N-CHj - ( -irrNOj ) f 7,35 дублет (9 Н) (2) -Аг-Н (2,6), 8,U5 дублет (9 Н., ) (2), -Аг-Н (3,5). 5 Пример 5. 2-Цианимино-З- -(2-окСи-5-нитробензил)-тиазотздин.
3,82 г (30 ммоль) 2-цианимин,о- - тиазолидина, 5,63 г (30 ммоль) 2-ок- си-5-нитробензилхлорида и 4, 3 ;г 0 безводного карбоната калия в 100 мл ацетона кипятят в течение 6ч. После Охлаждения реакционной .смеси оса док отделяют путем отфильтровывания (9,85 г) и растворяют в 600 мл 5 горячей воды. Раствор отфильтровывают, прозрачный фильтрат подкисляют до рН 3 и охлаждают, осадок от- деляют путем фильтрования и высушивают. Получают 5,1 г 2-цианимино- -3-(2-окси-5-нитрЬбензнл)-тиазолиди- на, перекристаллизованный из пиридина продукт плавится при 253-255°С, мол.м. 278,29.
Найдено,%: С 47,78, Н 3,71, N 20,01.
С„Н,рЫ40,8 , Вычислено,%: С 47,47; Н 3,62; N20,13. . J .
ик-спектр (КВг), : 31.00, (ши- рокая)-ОН} 2190, 1575, , l522, 1338, VNOj. ,
ЯМР (СВС1з + DMCO - dg), м.д.: j 3,4 мультиплет (2), -S-CHj-; 3,8 мультиплет (2), (гетероцик- лич.), 4,54 синглет (2), -CHj-(2-OH, S-Oj-CjHj); 6,88- триплет (I), -Ar-H (3); 8,00 мультиплет (2), -Ar-H (4,6), 3,9 дублет (1), -ОН.
П р И м е р 6. 2-Цианимино-З- -(З-оксибензил)-тиазолидин.
Смесь 3,82 г (30 ) 2-циан- :иминотиазолидина, 6,10 г (30 ммоль) -крезилбр|омидацетата и 4 30 г безводного карбоната калия в 100 мл тона кипятят с обратным холодильником в течение 6 ч. После отфильтро- вывания осадка фильтрат выпаривают досуха, маслянистый остаток (8,75 г) для отщепления сложноэфирной фениль- ной группы гидролизуют с помощью 50 мл 2 н. раствора гидроксида натрия при комнатной температуре. Реакционную смесь подкисляют, выделившееся масло отделяют, кристаллизуют КЗ ацетонитрила и перекристаллизуют из 50%-ного ацетона. Получают 1,98 г 2-цианимино-3-(3-оксибензил)-тиазо- лидина-, мол.м. 233,29, т.пл. 126- 128 С.
Найдено,%: С 56,70i Н 5,07; S 13,75| N 17,83. С„Н,, NjOS
Вычислено, %: С 56,63/ Н 4,75, S 13,75i N 18,02.
Ж-спектр (КВг), : 3260, . 1230, -ОН; 2190, -СгН; 1570, - ЯМР СВС1з + DMCO-dg), м.д.{3,3 мультиплет (2), -S-CHj-; 3,7 мультиплет (2), N-CH - (гетероциклич.); 4,48 синглет (2), rN-CH - (океифе- нил), 6,5-7,4 мультиплет (А) Аг-Н; 8,6 дублет (1), - ОН. - И р им е р 7. 2-Цианимино З- -(1-нафтилметил)тиазолидин.
Шесь 3,82 г (30 ммоль) 2-циан- иминотиазолидина, 5,56 г (30 ммол)
1-хлОрметилнафталина и 4,3 г карбоната калия в 100 мл ацетона кипятят с обратным холодильником в течение 56 ч. Осадок удаляют из еще горячей реакционной смеси путем отфильтро- вывания, продукт начинает осаждаться уже во время фильтрации. После концентрирования и вьщерживания в холо- 10 дильнике получают в целом 6,5 г 2-ци- анимино-3-(1-нафтилмётил)-тиазолидина (81,15% от теории), перекристаллизо- ванный из ацетонитрила продукт плавится при 167°С, мол.м. 267,34. 15 Найдено,%: С 67,32; Н 4,80 N 15,78i S 11,06. CjjH NjSВычислено,%: С 67,39; Н 4,90 N 15,72; S 12,00.
20 ик-спектр (КВг), : 2190, , 1580, .
ЯМР (CDClj + DMCO-dg), М.Д.: мультиплет (2), -S-CHj-; 3,6 мультиплет (2), -N-CH,j- (гетероциклич.Of 25 4,92 синглет (2), -N-CH - (нафтил), 7,0-7,9 мультиплет (7), -Ar-H.
Пример 8. 3,3-(1,4-Kcили- лeн)-5ttC - (2-цианиминотиазолидин) . ,Q Смесь из 4,5 г (26 ммоль) 1,4- -ксилилендихлорида, 6,36 г (50 ммоль) 2-цианиминотиазолидина и 7,17 г безводного карбоната калия в 150 мл ацетона кипятят с обратным холодильником в течение 7ч, охлажденную в холодильнике реакционную смесь отфильтровывают . Из. отдельного осадка (15,48 г) экстрагируют неорганическую часть с помощью холодной воды,в. .виде остатка получают 8,1 г 3,з - - (1,4-ксилил ен) - 5t/c-(2-цИанимино- тиазолидина) (91,0% от теории), перекристаллизованный из. 70 мл диметил- формамида продукт плавится при 275- 278 С, мол.м. 356,47. Найдено, %: С 53,70/ Н 4,78 S 17,85J N 23,37.-
Вычислело, %: С 53,91; Н. 4,52; S 17,99; N 23,58. ик-спектр (КВг), : 2180;
1570, ::;c-N-..
ЯМР (DMCO-dg), м.д.i3,4 мультиплет (4), .-S-CHj-i 3,7 мультиплет (4), -N-CHj- (гетероциклич.), 4,50 син- 5 глет (4), -N-CHj- (фенилен), 7,18 синглет (4), -Аг-Н.
Пример 9. 2-Цианимино-3-(6- -метил-2-пиридилметил)-тиазолидин.
5
5
/
Смесь из 3,3 г (26 ммоль) 2-циан- иминотиазолидина,4,03 г (28,5 ммоль) 2-хлорметил- 6-метилпиридина и 3,9 г безводного карбоната калия в 60 мл ацетона кипятят с обратным холодильником вплоть до полного расхода исходного тиазолинового соединения (примерно 6 ч).. После отфильтровы вания выделившейся соли растворитель отгоняют и остаток кристаллизуют путем до.бавки 40 мЛ диэтилового эфира
Получают 5,43 г 2-цианимино-З -(6-метил-2-пиридш1метил)-тиазолиди- на (89,9% от теории), перекристаллизованный из этилацетата продукт плавится при 114°С, мол.м. 232,30.
Найдено,%: С 56,77, Н 5,12, N 24,18.
C,,H,
Вычислено, %: С 56,67; Н 5,20, N 24,12.
ИК-спектр (КВг), см : 2190, , -teN; 1570, .
ЯМР (CDClj), м.д.: 2,48 синглет (3), -пиридил-СН,i 3,3 мультиплет (2), -S-CHg-, 3,9 мультиплет (2), N-CHj-; 4,60 синглет (2),:;N-CH2-Pyj 6,9 дублет (2), -Ру-2,5 Н; 7,4 (1), -Ру 4-Н.
Пример 10. 2-Цианимино-З- -(6-дйхлорметил-2-пиридш1метил)- -тиазолидин. 6,6 г (52 ммоль) 2-цианиминртиазо лидина, 12 г (57 ммоль) 2-дихлор- метил-6-хлорметилпиридина .и 7,9 г, безводного карбоната калия в 240 мл ацетона вводят во взаимодействие аналогично приведенным примерам. После отфильтровывания вьщелившейся соли и отгонки растворителя остаток растирают с зфиром и кристаллизуют из ацетонитрила. Получают 5,2 г 2-цианимино-З-(6-дихлорметил-2-пи- ридилметилУ-тиазолидина (33% от теории), мол.м. 301,19, т.пл. 122°С.
Найдено,%: С 43,91 Н 3,46, S 10,80.
,oCl2N S
Вычислено, %: С 43,86,, Н 3,34 S 10,64.
ШС-спектр (КВг), : 2180, 1560, (широкая) 718 -CH-CJ.
ЯМР (CDCl,), м.д.3,34 триплет (2), -S-CHj-; 3,97 триплет.(2), N-CHj-; 4,62 синглет (2), ::N-CH.j(фенил); 6,50 синглет (1), -Py-CHj-J 7,0-7,8 мультиплет (3),, -Ру-Н.
Согласно предлагаемому изрбрете- 5 кию среди получаемых соединений общей формулы (I) особенно 3-бензил- . -2-цианиминотиазолидин (соединение А) обладает предпочтительными свой-. ствами. Остальные полученные соеди- 0 нения общей формулы (I) также в более или менее низкой степени оказались в.значительной мере активными.
Для фармакологического исследова- ния предлагаемых соединений исполь- 5 описанные методы.
Язва Shay.
Самок крыс H-Wistar весом по 120- 15Q г вьздерживают без пищи в Тече0 ние 24 часов в решетчатых клетках и снабжают их только питьевой водой. Затем привратник желудка животных подвергают мягкому эфирному наркоэу и одновременно обрабатывают.интрапе5 ритонеально исследуемым подавляющим язву соединением. Спустя 4ч животных умерщв ляют путем эфирного нарко- за. Желудок животных вынимают, измеряют объем и рН - значение содерQ жимого желудка, в части случаев определяют образование соляной кислоты путем титрования.
35
Язва за счет аспирина. Известно, что нестероидные про- тивовоспалительные средства в различ
НОЙ мере могут вызывать образование желудочных и кишечных язв. На основании этого действия для теста, подавляющих язвы средств, с успехом используется аспириновая модель. Самок крыс H-Wistar весом по 12в- 150 г в течение 24 часов без пищи снабжают только водо й, затем путем орального введения с помощью приготовленной с твином ВО суспензии с 100 мг/кг ацетилсалициловой кислоты вызывают обр1азонание язв в железистой части желудка животных. Одновременно с ацетилсалициловой кислотой животным вводят исследуемое соединение также оральным путем. Спустя 4 ч животных умерщвляют и подсчитывают находящиеся на железистой части желудка коричнево-красные эрозии. При оценке результатов указывается среднее число находяощхся в желудке язв, соответственно количество животных без язв.
.Язва за счет индометацина..
Нестероидное противовоспалительно средство индометацин (1-(-хлорбен- зол)-5-метокси-2-метилиндол-3-уксус- ная кислота) обладает не только вызывающим образование язвы желудка побочным дбйстрием, но и также приводи к чрезвычайно сильному образованию язв в тонком кишечнике. Это образование в тонком кишечнике в зависимости от дозы может быть также фатальньм, так как наступающее за счет перфорации кишечника воспаление брюшины смертельно.
dhi Вызываемая индометацином фатальная модель кишечной язвы.
Для этих опытов используют самок крыс H-Wistar весом по 120-150 г,которых кормят нормально. Путем оральных доз 15 мг/кг индометацина (в приготовленной с твином 80 суспензии вызывают фатальное образование язв кишечника. Исследуемые соединения вводят также орально животным после обработки индометацином. Для развития кишечных язв в противоположность желудочным язвам требуется более продолжительное вр.емя (примерно 48- 72 ч).
Для оценки язвообразования применяется так называемый метод вздутия, благодаря зтому методу возможно количественное прослеживание процесса язвообразования. Прочность в момент разрыва стенок ки1Ц(,ечника, которая указана в мм Hg, постепенно падает с возрастанием интенсивности язвооб- разовання.
:. ff- Индуцированная индометацином не- .фатальная модель кишечной язвы.
Нормально питающихся крыс H-Wista весом по 120-150 г обрабатывают перо рально с по;4ощью 7,5 мг/кг индометацина для индуцирования нефатальных кишечных язв. Спустя 4 ч также орально животным вводят желательные дозы исследуемого соединения и эту обработку повторяют спустя 24 и 48 ч. Спустя 24 ч после последней обработки, т.е. 72 ч после вызывающей образование язв индукций с помощью индометацина, животных умерщвляют, для оценки язвообразования используют также так называемый метод вздутия.
Индуцированная с помощью абсолютного спирта модель некроза желудка.
Самок крыс H-Wistar весом по 120- 150 г выдерживают 24ч без пищи и
снабжают только питьев.ой водой. Затем животных орально обрабатывают исследуемым соединением.и спустя с 30 мин дают им по 0,5 мл на 100 г веса тела -абсолютного спирта через зонд. Спустя 2 ч после дачи спирта - животных умершрляют, извлекают желудок, разрезают вдоль большой выпук0 лости, слегка промывают и растягивают. Видимые на железистой части продольные невротические полосы измеряют в миллиметрах и оценивают сог- .ласно Derelanko и Long. Указывают
5 среднюю длину поражений на желудок, меру желудочной цитозащиты выражают в процентах fi расчете на контрольных животных.
0 Осуществленные в процессе описанных методов фармакологические исследования показали, что рассматриваемый как особенно предпочтительный представитель соединений общей формулы
5 (I) 3-бензил-2-цианиминотиазолин
(соединение А) во всех тестах оказался очень активным подавляющим язвы средством. Это соединение ингибирует выделение кислоты желудочного сока
0 Shay-крыс уже в низних дозах (ЭД 5,3 мг/кг интраперитонеально). Индуцированные аспирином (ацетилсалициловой кислотой) язвы желудка при одновременном оральном введении по5 давляются -(ЭДуд 2,1 мг/кг перораль- но). Во введенном недавно Robert тесте с некрозом за счет абсолютного спирта это соединение также активно. Соединение А прд одновременном вве0 дении подавляет индуцированное индометадином язвообразование тонкого кишечника, так как рассматриваемое как наилучшее подавляющее язвы известное средство диметидин-Ы-циано5 -N -метил-н -(2-) (5-метил-1Н-имида- зол-4-ил)метил(-тиo)-эти Л-гyaнидин не может подавлять индуцированное индометацином язвообразование в кишечнике . Это наблюдение подтвержде0 но клиническими опытами: у страдаю- :щих язвами и ревматизмом пациентов при одновременном лечении с помощью циметидина и индометацина появляются перфораций. Вызываемое индометацй5 ном язвообразование кишечника такжЙГ не может подавляться с помощью используемых в, терапии людей антихо- линергическйх средств.
В табл. 1-6 используют сокращения: п - число животных, в.т. - вес тела.
В табл.1 указано подавляющее вьще- ленив кислоты желудочного сока, действие соединения А в случае. Shay-крыс (связывание привратника желудка в течение 4 ч) в табл.2 - подавляющее выделение кислоты желудочного сока, действие соединения А при различных обработках Shay-крысы спустя 4 ч в табл.3 - подавление индукционной / ацетилсалициловой кислотой желудочных язв благодаря одновременному лечению соединением .А в табл.4 - за.висящее от дозы подавляющее действие соединения А против индуцированного индоме- тацином кишечного язвообразования при одновременном лечении|f в табл.5 - влияние на индуцируемое с помощью 7,5 мг/кг перорально доз индометаци- на,нефатальное кишечное язвообразова- .ние благодаря дополнительной обработке циметидином и соответственйо сое- динением Af в табл.6 - цитозащитное действие соединения А против индуцируемого абсолютным спиртом некроза желудка.
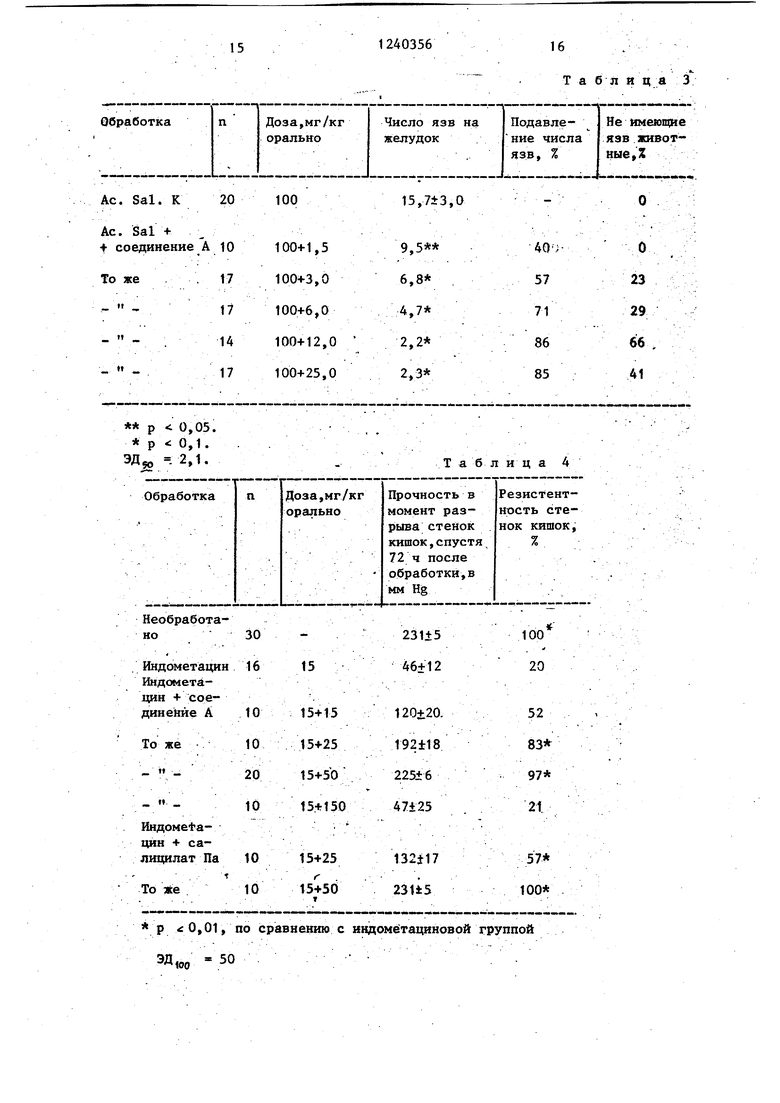
Из представленньк в табл.1 данных видно, что соединение в зависимости от дозы уменьшает выделение кислоты желудочного сока. Соединение А активно подавляет у крыс Shay также при оральном применении вьщеление кисло ты желудочного сока, как это следует из данных табл.2.
Индуцированное ацетилсалициловой кислотой язвообразование в желудке подавляется в зависимости от дозы од новременной обработкой с помощью соединения А также, как и индуцированные дозами по 20 мг/кг индометацина перорально язвы желудка. Подавляющее действие соединения А по отношению к индуцированному ацетилсалициловой кислотой язвообразованию представле- но в табл.3.
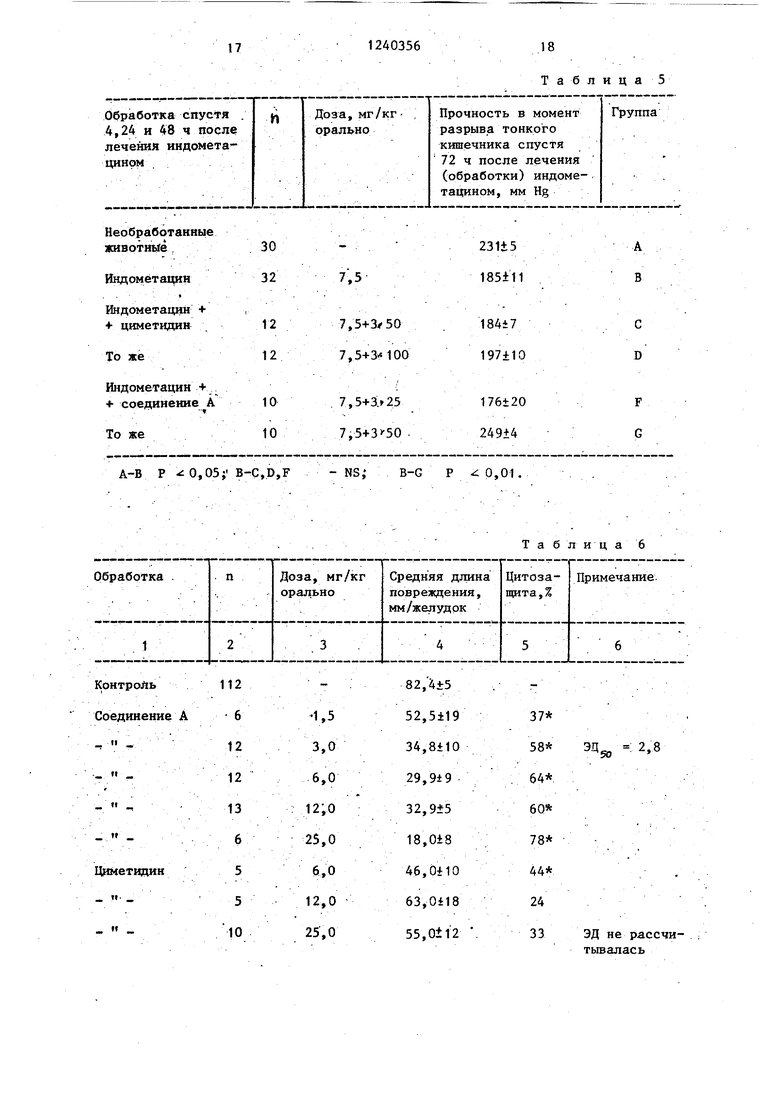
Данные табл.4 показывают подавляющее действие против индуцированных с помощью 15 мг/кг перорально доз индометацина язв тонкого кишечника. Здесь подавляющее действие зависит от дозы соединения А. .
Важными являются результаты,полу- ченные в опытах с нефатальной мо- делью кишечной язвы. Обработка с, помо1цью соединения А начинается
.-
t
5 Ю15 20 25
55
35
«
лишь тогда, когда язвообразование у животных индуцировано уже на 4 ч раньше за счет 7,5 мг/кг пе1р6рально индометацина. В этом случае речь идет о дополнительной обработке, а именно спустя 4,24 и 48 ч после .. введения индрметацинд. Из данных табл.5 видно, что циметидин в таких условиях неактивен, в то время как соединение А может нормализовать в зависимости от дозы прочность в момент разрыва кишки (кишечника).
. Соединение А активно против индуцированного абсолютным спиртом некроза желудка. Как показывают данные табл.6, эта цитозащита зависит от дозы. .
На основании результатов соединение А мояшо рассматривать как активное подавляющее язвы средство, спектр действия .которого по ширине превосходит получаемые лучшие продукты в этой области. Комплексный механизм действия соединения А указывает на то, что это соединение активно в трех моделях язв с разлиЧ- ными механизмами: в модели с индуцированной ацетилсалициловой кислотой -ЯЗВЫ желудка, в модели с индутдарован- ной индометацином язвы тонкого кишечника, в модели с индуцированньм абсолютным спиртом некрозом -желудка.
Сравнение полученных при оральном, интраперитонеальном и подкожном введении результатов действия показывает, что соединение А при рральном применении хорошо абсорбируется,
На основании результатов токсико логических наблюдений соединение А обладает высоким терапевтическим индексом.
Так как соединение А нерастворим. в воде при токсикологических исследованиях использовали приготовленную с твином 80 суспензию для орального и соответственно интраперито- . неального применения биологически активного вещества. Для внутривенного введения биологически активное вещество растворяли в диметилформа- миде. Сделаны следующие наблюдения; 100 мг/кг внутривенно: животные чувствуют себя плохо, ни одно животное не погибает в течение 3 дней, 250 мг/кг интраперитонеапь- но: в течение 2 недель ни одного по гибшего, 1500 мг/кг интраперитонеально: животные погибают в течение 30 мин, 1500 мг/кг перорально: из десяти животных три в течение 24 часов погибают, остальные остаются живыми также спустя неделю, их поведение и прием ими пищи нормальные. Пример 11. Лекарственный препарат. .
Для приготовления таблетироваи- ного лекарственного препарата (1000 таблеток) используют следующие вещества, содержащие г: З-Бензил-2-цианимино- тиазолидин (биологически активное вещество)50 Крахмал75
Приме ч а кие. ,3
Молочный-сахар 55 Тальк10
ПоливинилпирроЛИДОН 6
Стеарат аммония 3 Коллоидальную кремниевую кислоту1 Тонко размолотое биологически активное вещество смешивают с молочным сахаром и тальком, порошковую смесь смешивают с раствором поли- винилпирролидона до получения пасты
и гранулируют через сито. Высушен- ные зерна смешивают со стеаратом магния и коллоидальной кремневой кислотой и 3fTy смесь прессуют в -1000 таблеток весом по 0,2 г.
Таблица 1
Таблица2
р 4:0,01, по сравнению с индомётациновой группой
ЭД
100
50
Т а б л и ц а 3
Контроль
Соединение А
- -
-, .., II
Циметидин I.
Таблица 5
Т а блиц а 6
тьгоалась
|
II
:i5
12
50,0 100,0
р 0,01 по сравнению с контролем.
Продолжение табл.б
34,0t10 47,0116
59 43







| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных тиазолидина | 1984 |
|
SU1240355A3 |
| Способ получения производных 2-пиридин-тиола или их кислотно-аддитивных солей (его варианты) | 1985 |
|
SU1346042A3 |
| Способ получения амидов 1,2,3,4,6,7,12,12 @ -октагидроиндоло(2,3- @ )-хинолизин-1-ил-алканкарбоновых кислот или их физиологически совместимых солей присоединения кислот | 1985 |
|
SU1470193A3 |
| Способ получения 2-галоген-никэрголинов | 1986 |
|
SU1445557A3 |
| Способ получения производных 2-тиазолидинона | 1988 |
|
SU1657062A3 |
| Способ получения N-сульфамил-3-(2-гуанидинотиазол-4-илметилтио)-пропионамидина | 1986 |
|
SU1450743A3 |
| Способ получения производных 3-азабицикло 3,3,1 нонана,или их изомеров,или их фармацевтически приемлемых солей присоединения кислот (его варианты) | 1984 |
|
SU1395141A3 |
| Способ получения трипептидов | 1980 |
|
SU1085505A3 |
| Способ получения сложных эфиров алкоксивинкаминовой кислоты и/или сложных эфиров алкоксиаповинкаминовой кислоты или их эпимеров,рацематов,оптически активных изомеров или их кислотных физиологически приемлемых солей | 1982 |
|
SU1189348A3 |
| Способ получения оптически активных 9-или 11-замещенных производных аповинкаминовой кислоты или их солей | 1985 |
|
SU1398775A3 |

| Патент США № 4143148, кл | |||
| Способ приготовления хлебного вина | 1925 |
|
SU424A1 |
| Дверной замок, автоматически запирающийся на ригель, удерживаемый в крайних своих положениях помощью серии парных, симметрично расположенных цугальт | 1914 |
|
SU1979A1 |
Авторы
Даты
1986-06-23—Публикация
1984-10-17—Подача