Изобретение относится к способу 11олуче и1я новых биологически активных химических соединений, а именно к способу получения спирогетероазо- лидиндионов, спирооксазолидиндионов или спиромидазолидиндионов или их фармацевтически приемлемых солей, которые обладают способностью инги- бировать активность альдозоредуктазы и могут быть использованы для лечени некоторых хронических диабетических осложнений, включающих осложнения зрительных органов.
Цель изобретения - получение но- вых производных ряда спирогетероазо- лидиндионов, обладающих повышенной ингибирующей активностью против фер- мента альдозоредуктазы.
Пример 1, СпироСимидазоли дин-4,1 -индан-3 -он)2,5-дион.
2,5-Диоксо-4-фенил-А-имидазолидин уксусную кислоту суспендируют в 15 м полифосфорной кислоты при 150°С. Пос тепенно происходит растворение, и после 2 ч выдерживания при реакционную смесь охлаждают до и разбавляют 15 мл воды. Медленно образуется твердое вещество, которое со- бирают фильтрованием, промывают водой, сушат и це-рекристаллизовывают из поды, получая 0,210 г (А0% выход) целевого соединения, т.пл. 268-270 С
Вычислено, %: С 61,11, Н 3,73,
N 12,96.
С,,НеМ,0,.
Найдено, %: С 60,89, Н 3,87, N 12,98.
Пример. Спиро(имидазолидин- -4,1 -3 Н-1 , 2 -д1 гидронафтален-4 - -он)2,5-дион.
2,5-Диоксо-А-фенил-4-имидазоли- динпропио 1оную кислоту (2,48 г, 10 ммоль) нагревают в 25 мл концентрированной серной кис1готы сначала пр в течение 1 ч, а затем при 120 С в течение 45 мин и выливают в 200 г льда. Получающееся в результа- те твердое вещество собирают фильтрованием и сушат в вакууме при 100°С в течение 60 ч, получая 1,85 г неочищенного продукта, т.пл. 144-149 С Вещество обесцвечивают в растворе изопропянола активированным углем и перекристалличовывают из изопропано- ла, получая 1,11 г (487 выход) целевого соединения, т.пл. 261-263 С.
2
%: С 62,60, Н 4,38,
С,, Н ,„ N7О,
Найдено, %: С 62,34, Н 4,51, N 12,16.
Пример 3. Спиро(имидазо- лидин-4,Г-3 Н-1 ,2 -дигидронафтален- -4 -он)2,5-дион.
2,5-Диоксо-4-фенил-4-имидазолидин- пропионовую кислоту (2,43 г,10 ммоль) суспендируют в 25 мл полифосфорной кислоты при 150°С. Постепенно происходит растворение и через 135 мин реакционную смесь охлаждают до 25 С. Добавляют воду (75 мл), получающееся в результате неочищенное твердое вещество отделяют фильтрованием. Данный твердьш материал обеспечивают активированным углем в виде раствора в изо- пропаноле и перекристаллизовывают из
изопропанола, получая 450 мг (17% выход) целевого соединения, т.пл. 262- 263 С.
ЯМР (DMCO-dt), млн.дол.: 10,98 (ш.с., 1Н), 8,65 (ш.с., 1Н), 8,03- 7,30 (м., 4Н) и 3,07-2,23 (м., 4Н).
Пример 4.7 -Фтор-спиро(ими- дазолидин-4,1 -З Н-1 ,2 -дигидронаф- тален-4 он)-2,5-дион.
2,5-Диокси-4-м-фторфенил-4-имида- золидинпропионовую кислоту (1,33- г, 5 ммоль) с 15 мл полифосфорной кислоты нагревают при 150°С в течение
1.5ч. Реакционную смесь охлаждают до 0°С и разбавляют водой. Темное твердое вещество собирают фильтрованием и распределяют между этилацета- том и разбавленной водной гидроокисью натрия (рН 8). Этилацетатный слой экстрагируют водной 10% гидроокисью натрия, а объединенные водные слои обесцвечивают активированным углем
и доводят до рН 3 концентрированной соляной кислотой. Воду упаривают в вакууме, а получающееся в результате белое твердое вещество растирают с кипящим изопропаном для удаления хлористого натрия. Изопропанольный раствор фильтруют и концентрируют в вакууме, получая 115 мг целевого соединения в виде белой пены. ЯМР (DMCO-dj), млн.дол.: 8,55 (щ.с., 1Н) 8,02 (кв., 1Н), 7,37 (м., 1Н), 7,17 (кв., 1Н), 3,15-2,96 (м., 1Н), 2,752.6(м., 1Н) и 2,45-2,3 (м., 2Н). Пример 5. 7-Фтор-спиро(имидазолидин-4, 1 -З Н-1 , 2 -дигидронаф- тален-4 -он)-2 , 5-дион .
2,5-Диоксо-А-м-фторфенил-4-имида- золидинпропионовую кислоту (68,55 г, 0,26 ммоль) с 500 мл концентрированной серной кислоты нагревают при 75- 77°С и выливают в лед для осаждения твердого вещества, которое отделяют фильтрованием. Твердое вещество растворяют в 800 мл метанола и обесцвечивают активированным углем. Метанол удаляют в вакууме, получая твердое вещество, которое растирают с 75 мл метанола, затем собирают фильтрованием. После промывки 30 мл воды твердое вещество сушат в вакууме при 80° в течение 20 ч, получая 52,07 г (81% выход) целевого соединения, т.пл. 229-231 с.
Вычислено, %: С 58,07, Н 3,65, N 11,29.
СцН g FN-jO 3.
Найдено, %: С 57,86, Н 3,59, N 11,39.
Пример 6. 7 -Метил-спиро (имидазолидин-)А,1 (-З Н-1 ,2 -ди- гидронафтален-4 -он)2,5-дион.
2,5-Диоксо-4-м-толил-4-имидазолидинпропионовую кислоту d, г, 5,3 ммоль) объединяют с 25 мл концентрированной серной кислоты и наг- ревают при в течение 30 мин. Реакционную смесь выпивают на лед и полученное в результате твердое вещество собирают фильтрованием и обесцвечивают с помощью активированного угля в горячей воде и кристаллизуют из воды, получая 420 мг (32% выход) целевого соединения, т.пл. .
Вычислено, %: С 63,93, Н 4,95, N 11,47.
C,iH,,N,03.
Найдено, %: С 63,57, Н 4,91, N 11,45.
Отработанную черную сажу сушат и экстрагируют метанолом при нагрева- НИИ с обратным холодильником, получая дополнительно 110 мг (8,5% выход целевого продукта, т.пл, 202 С.
Пример 7. 5,7 -Диметил- -спиро(имидазолидии-4,1 -3 Н -1 ,2 - -дигидронафтален-4 -он)2,5-дион.
2,5-Диоксо-4-м-ксилил-4-имидазо- лидинпропионовую кислоту (1,0 г, 3,7 ммоль) смешивают с 20 мл концентрированной серной кислоты и нагревают при 85°С в течение 45 мин, охлаждают до и выливают на лед. Полученный в результате рыжий осадок собирают фильтрованием, сушат, раство
5
0
5
Q
с
5
0
0
ряют в 200 мл метанола при нагревании с обратным холодильником и обесцвечивают активированным углем. Метаноль- ный раствор концентрируют в вакууме, а остаток растирают с 10 мл воды. Полученное в результате твердое вещество собирают фильтрованием и су- шэт, получая 630 мг (70% выход) целевого соединения, т.пл, 260-261 С.
Вычислено, %: С 65,11, Н 5,46, N 10,85.
С,,Н,,К,Оз,
Найдено, %: С 64,80, Н 5,48, N 10,73.
Пример В, 6 -Хлор-спиро( дазолидин-4,1 -3 Н-1 ,2 -дигидронафтален-4 -он)-2,5-дион.
2,5-Диоксо-4-п-хлорфенил-4-имида- золидинпропионовую кислоту (5,0 г, 18 ммоль) смешивают с 90 мл концентрированной серной кислоты и нагревают при 1 в течение 16 ч. Реакционную смесь охлаждают до 25 С и выливают на 800 J льда и перемешивают в течение 2 ч. Добавляют активированный уголь, и перемешивание продолжают в течение 1,5 ч. Реакционную смесь фильтруют через диатомовую землю, и фильтрат промывают 400 мл воды, а затем отфильтрованное твердое вещество, активированный уголь и диатомовую землю перемешивают с 500 мл метанола при нагревании с обратным холодильником. После 30-минутного перемешивания шлам (или суспензию) снова фильтруют через диатомовую землю, чистое вещество концентрируют в вакууме, получая 1,1 г материала, который согласно данным ЯМР, представляет смесь 1:1 исходного вещества и целевого соединения, 1,1 г вещества суспендируют в метаноле и фильтруют, получая 0,31 г (6%) целевого соединения, т.пл, 258- 261°С. Аналитический образец пере- кристаллизовываЮт из воды, получая целевое соединение, т.пл. 265-266 С.
Вычислено, %: С 54,46, Н 3,43, N 10,58.
C,H,,C1,
Найдено, %: С 54,21, Н 3,41, N 10,40.
Пример 9, (17 -Хлор-3 ,3- димeтил-cпиpo(имидaзoлидин-4 ,1 -1 , -дигидронафтален-4-он)2,5-дион.
2,5-Диоксо-З,3-диметил-4-(м-хлор- фенил)-4-имидазолидинпропионовую кислоту (0,62 г, 2 ммоль) смешивают с 4 мл концентрированной серной кисло
513
ты и нагревают при 70°С в течение 4 ч Реакционную смесь выливают на лед, и твердое вещество, которое образуется, собирают фильтрованием, промывают водой и сушат, получая 412 мл твердого вещества. Данное твердое вещество добавляют в горячий ацетонит- рил, обеспечивают активированным углем с примешанной к нему инфузорной землей, и более твердое вещество, которое образуется при охлаждении, собирают с помощью фильтрования и сушат, получая 140 иг целевого соединения, т.пл. 264-26б с.
Вычислено, %: С 57,44, Н 4,48, N 9,57.
C,,H,,0,N,F.
Найдено, %: С 57,26, Н 4,51, N 9,63.
Пример 10. (1)3, З -Диме- тил-спиро(имидазолидин-4,1 -1 ,2 - -дигидронафтален-4 он)2,5-дион,
2,5-Диоксо-З,З-диметил-4-фенил- -4-имидазолидинпропионовую кислоту (26,94 г, 0,1 моль) объединяют с 135 мл концентрированной серной кислоты и нагревают при 70°С в течение 5 ч, а затем выливают на лед. Образуется твердое вещество, которое соби- рают с помощью фильтрования и сушат, получая 21,04 г неочищенного продукта. Неочищенный продукт (19,35 г) растворяют в 150 мл 1 и.гидроокиси натрия и обесцвечивают активированным углем с примесью диатомовой земли. Основной раствор доводят до рН 7 с помощью соляной кислоты, и полученное в результате твердое вещество собирают с помощью фильтрования и промывают дважды водой. Данную процедуру повторяют снова, и полученное Б результате твердое вещество распределяют между 75 мл разбавленной соляной кислоты и 400 мл этилацетата. Этилацетатньш слой промывают солевым раствором, сушат над безводным сульфатом натрия и концент
рируют, получая 12,54 г целевого соединения, т.пл. 229-231 с.
N
Вычислено, %: С 65,10, Н 5,46, 10,85.
5
Q
0
5 п
5
0
5
0
2,5-Диоксо-3-метил-4-(м-хлорфе- нил)-4-имидазолидинпропионовую кислоту (10,72 г, 36,1 ммоль) соединяют с 55 мл концентрированной серной кислоты и нагревают при 70°С в течение 5 ч. Реакционную смесь выливают в ледяную воду, и полученное в результате твердое вещество собирают с помощью фильтрования, промывают водой и сушат, получая 7,96 г неочищенного продукта. Неочищенный продукт (7,76 г) растворяют в 400 мл кипящего ацетонитрила и обесцвечивают активированным углем, фильтруют и оставляют охлаждаться до 25°С. Получающееся твердое вещество собирают с помощью фильтрования и сушат, получая 4,48 г целевого соединения, т.пл. 232-234 С (частичное плавление), 255-257 С (разложение).
Вычислено, %: С 56,02, Н 3,98, N 10,05.
..
Найдено, %: С 56,17, Н 4,08, N 10, 13.
Пример 12. Спиро(имидазолидин-4, 1 -индан-3 -он)2,5-дион.
Температура плавления 253-256 С.
ЯМР (DMCO-dj), млн.дол.: 11,13 (т.е., 1Н), 8,50 (ш.с., 1Н), 7,97- 7,43 (м., 4Н) и 3,0 (д., 2Н).
Вычислено, %: С 61,11, Н 3,73, N12,96.
С ,iHgNiOj
Найдено, %: N 13,09.
П р и м -е р 13. 6 -Фтор-спиро (имидазолидин-4,1 -индан-3 -он)2,5- дион.
Температура плавления , с разложением.
С 56,42, Н 3,01,
С 60,54, Н 4,02,
С 55,85, Н 3,22,
Вычислено, N 11,96.
C,,H,FN,Oj.
Найдено, %: N 12,06.
Пример 14. Спиро(имидазолидин-4, 1 -З Н-1 ,2 -дигидронафтален- 4 -он)2,5-дион.
Температура плавления 256-258 с.
Вычислено, %: С 62,60, Н 4,38, N 12,17.










Изобретение касается гетероциклических веществ, в частности получения спирогетероазолидиндионов общей формулы -NH Ю CHiln х о где а) U-NH; п О или 1; Х-Н, Вг, бензил, С -алкил или диметил при условии, когда X - диметил, то Y-H, галоид, N0,, С -алкокси или С -алкил; Z-H, галоид, С . -алкил при условии, когда Y N07, то Z - Н; б) и - кислород; п 1, X - С -алкил; Y - галоид; Z - Н, или их фармацевтически приемлеь ых солен, которые способны ингибировать активность альдозоредуктазы и могут быть использованы для лечения осложнений диабета, включающих осложнения зрительных органов. Цель - создание новых более активных веществ указанного класса. Их синтез ведут циклизацией, например, 2,5-диоксо-4-фенил- -4-имидазолидинуксусной кислоты под действием полифосфорной кислоты или конц. при 70-150°С. Степень ингибирования указанного фермента У новых веществ составляет 81-91% без признаков токсичности. 3 табл. СУ) со 00 о О) см
C,,,N,.
Найдено, %: С 54,74, Н 5,53, N 10,74.
Пример 11. (t) 7 -Хлор-3 - -метил-спиро(имидазолидин-4,1 -З Н- -1 ,2 -дигидронафтален-4-он) 2 ,5-дион .
П
Найдено, %:
12,15.
Пример
С 62,84, Н 4,75,
Температура плавления 221-224 С.
Вычислено, %: С 46,63, Н 2,93, N 9,06.
С„Н,ВгЫ,0,.
Найдено, %: С 46,42, Н 3,10, N 9,12.
Пример 16. 7 -Метокси-спи- ро(имидазолидин-4,1 -З Н-1 ,2 -ди- гидронафталин-4 -он)-2,5-дион.
2,5-Диоксо-4-м-метоксифенил-4- -имидазолидинпропионовую кислоту (8,35 г, 30 ммоль) подвергают взаимодействию с 60 мл полифосфорной кислоты при в течение 1 ч. Реакционную смесь охлаждают до 25°С и разбавляют водой. Получающееся в результате твердое вещество собирают фильтрованием и обесцвечивают активированным углем в водном растворе и кристаллизуют из воды, получая 2,9 г. (37% выход) целевого соединения; температура плавления 250-251°С
Вычислено, %: С 60,00, Н 4,65, N 10,76.
,0,.
Найдено, %: С 59,83, Н 4,71, N 10,79.
Пример 17. 7 -Нитро-спиро (имидазолидин-4,1 -3 Н-1 ,2 -дигидро нафтален-4 -он)2,5-дион.
Процедуру примера 5 применяют для получения целевого соединения с использованием 2,5-диоксо-4-м-нитрофе- нил-4-имидазолидинпропионовой кислоты в качестве исходного материала вместо м-фторфенильного соединения.
Пример 18. 7 -Хлор-б -метил -спиро(имидазолидин-4,1 -З Н-1 ,2 - -дигидронафтален-4 -он)2,5-дион.
4-(м-Хлор-п-метилфенил)-2,5-ди- оксо-4-имидазолидинпропионовую кислоту (10,0 г, 34 ммоль) смешивают с 150 мл концентрированной серной кислоты и нагревают при 80 С в течение 2 ч. Реакционную смесь охлаждают до и выпивают на лед. Получающееся в результате белое твердое вещество собирают и промьшают водой и сушат, получая 8,78 г (94% выход) неочищенного продукта; т.пл. 260-265°С. Не- очищенный продукт перекристаллизовы- вают из смеси изопропанол-вода, получая 5,80 г целевого соединения; т.пл. 277-278 С.
Вычислено, %: С 56,03, Н 3,98, N 10,05.
,0,Cl.
5
0
5
0
5
0
5
5
Найдено, %: С 55,63, Н 4,01, N 9,96.
Пример 19. 6 -Метил-спиро (имидазолидин-4,1-3 Н-1 ,2 -дигидронафтален-4 -он)2,5-дион.
2,5-Диоксо-4-п-толил-4-имидазоли- динпропионовую кислоту (2,85 г, 10,9 ммоль) смешивают с 25 мл концентрированной серной кислоты и нагревают при 95°С в течение 1,5 ч. Реакционную смесь выливают на лед, и получающееся в результате твердое вещество собирают фильтрованием, промывают водой и сушат, получая 1,88 г (71% выход) неочищенного продукта, т.пл. 206-214 с. Неочищенный материал (1,76 г) перекристаллизовывают из изопропанола, получая 1,12 г целевого соединения, т.пл. 245-248 С.
Вычислено, %: С 63,93, Н 4,95, N 11,47.
С,Н„К,Оз.
Найдено, %: С 63,56, Н 5,15, N 11,24.
Пример 20. 7 -Хлор-спиро (имидазолидин-4,1 -3 Н-1 ,2 -дигидронафтален-4 -он)2,5-дион.
2,5-Диоксо-4-(м-хлорфенил)-4-ими- дазолидинпропионовую кислоту (5,42 г, 20,0 ммоль) смешивают с 40 мл концентрированной серной кислоты, нагревают при 90 С в течение 3 ч, а затем охлаждают до 25 С и выливают на лед. Полученное в результате твердое вещество собирают, сушат и перекрис- таллизовьшают из воды, получая 2,61 г вещества, т.пл. 202-230 С. Анализ ЯМР показьгоает, что данное вещество представляет собой смесь исходной пропионовой кислоты и требуемого продукта. Соответственно 2,4 г данного вещества объединяют с 25 мл концентрированной серной кислоты и нагревают при 120 С в течение 3 ч. Реакционную смесь охлаждают до 25 С, выливают на лед, и полученное в результате твердое вещество собирают фильтрованием и перекристаллизовывают из воды, получая 700 мг (14% выход) целевого соединения, т.пл. 279- 280°С.
Вычислено, %: С 54,58, Н 3,41, N 10,60.
С iHgNlOjCl.
Найдено, %: С 54,42, Н 3,60, N 10,42.
Пример 21. Используя описанные методики, получают 3 -метил913
- -фтор-спиро(имидазолидин-А, 1 - -3 Н-1 ,2 -дигидронафтален-4 -он) 2,5-дион.
Температура плавления 224-225 С.
Вычислено, %: С 59,5А, Н 4,23, N 10,68.
GI, H,,FNjOj.
Найдено, %: С 59,41, Н 4,32, N 10,68.
ЯМР (DMCO-dfe, 250 МГц) показывает диастереомерную пару в соотношении 94ГБ; основной компонент, млн,дол.: 11,07 (т.е., 1Н), 8,60 (с., 1Н), 8,05 (м., 1Н), 7,39 (м., 1Н), 7,24 (м., 1Н), 3,34 (м., 1Н), 2,5 (т.,1Н), 2,18 (т., 1Н) и 1,15 (д., ЗН), компонент в меньшем количестве, млн.дол: а,94 (с., 1Н), 3,0 (м., 1Н) и 1,18 (д., ЗН).
Пример 22. Соль (+)7 -фтор- -спиро(имидазолидин-4,1 -З Н-1 ,2- -дигидронафтален-4-он(2,5-диона.
(t)7 -Фтор-спиро(имидазолидин- -4,1 -3 Н-Г ,2 -дигидронафтален-4 - -он)2,5-дион (24,62 г, 0,099 моль) растворяют в 700 мл кипящего с обратным холодильником ацетонитрила. К данному раствору добавляют 42,96 г (,0,0998 моль) дигидрата бруцина. Ацетонитрильную смесь фильтруют в горячем состоянии для удаления следов нерастворимого вещества и фильтрат оставляют охлаждаться до 25°С. Полученное в результате твердое вещество собирают фильтрованием и сушат, получая 26,83 г соли, т.пл. 229-230 С с разложением: fo J j) +30,7 (метанол). Данную соль перекристаплизовывают из ацетонитрила, получая 18,8 г очищен- ной соли, т.пл. 230°С с разложением, д +32,0 (метанол).
Очищенную соль (17,8 г) разлагают при перемешивании с 500 мл хлороформа. Сначала большая часть, если растворялась, а затем образуется новое твердое вещество. Данное твердое новое вещество собирают фильтрованием и сущат, получая 6,32 г целевого соединения, т.пл. 263-264 С; Го +203,5 (метанол).
Абсолютной конфигурации при 4,l центре приписывается S на основании рентгеновского анализа единичного кристалла.
Пример 23. З -Бром-7 -фтор- спиро(имидазолидин-4,1 -З Н-1 , гидронафтален-4-он)2,5-дион. Температура плавления 223-224 С.
10
10
Вычислено, %: С 44,06, Н 2,47, N 8,56.
С,, HjNjOjBrF.
Найдено, %: С 43,61, Н 2,61, N 8,31.
Пример 24. (+)7-Фтор-3 - -метил-спиро(имидазолидин-4,1 -3 Н-1 ,2 -дигидронафтален-4 -он)2,5- -дион.
Температура плавления 250-25I C; Ul +231, Г (метанол, ).
Вычислено, %: С 59,54, Н 4,23, N 10,68.
С„Н„М,0,Г.
Найдено, %: С 59,36, Н 4,38, N 10,70.
Абсолютные конфигурации при 4,1 и 3 центрах определены как S и R соответственно на основании ренгеновского анализа единичного кристалла.
Пример 25. (-)7 -Фтор-З - -метил-спиро(имидазолидин-4,1 -З Н- -1 ,2 -дигидронафтален-4-он)2,5-дио
Температура плавления 149-150,З с разложением; , -223,4 (метанол, С
1).
Пример 26. (1)7 -Фтор-З - -метил-спиро(имидазолидин-4,1 -з Н- -1 ,2 -дигидронафтален-4-он)2,5-диоН.
Температура Плавления 196-199 с.
Вычислено, %: С 59,54, Н 4,23, N 10,68,
С 1,Н ,,.
Найдено, %: С 59,22, Н 4,29, N 10,53.
И р и м-е р 27. (+) 7 -Фтор-З - -бензил-спиро(имидазолидин-4,1 -3 Н- -1 ,2 -дигидронафтален-4 -он)2,5- дион.
Температура плавления 225-226 С. loiT 120 (метанол, С 1).
Масс-спектр высокой разрешающей способности. Вычислено для C,,H«Nj05F: 338, 1067. Найдено: 338, 1067.
Основной диастереомер вьщеляют следующим образом. При использовании 672 мг (2 ммоль) ( + )7 -фтор-3 - -бензилиден-спиро(имидазолидин-4 - . -1 ,2 -дигидронафтален-4 -он)2,5-диона и описанных условий гидрирования вьзделяют неочищенный продукт, состоящий преимущественно из одного диасте- реомера. Перекристаллизация из изо- пропанола дает 460 мг основного ди- астереомера; т.пл. 238-240 С, д -31 (метанол, С 1).(
1113
Пример 28. (f)7-Фтop-3-мe- тилcпиpo(3, А-дигидронафтален-1 )2Н (5 -оксазолидин)2,А -трион.
Целевое соединение получают в виде коричневого смолообразного твердого вещества, которое, когда его подвергают действию глубокого вакуума, превращается в пену целевого соединения.
Macc-cneifTp высокой разрешающей способности.Вычислено для С Н ,jN04F: 263,0594. Найдено: 263, 0572.
Инфракрасный спектр хлороформного раствора пены имеет поглощение при 1820, 1750 и 1690 см- .
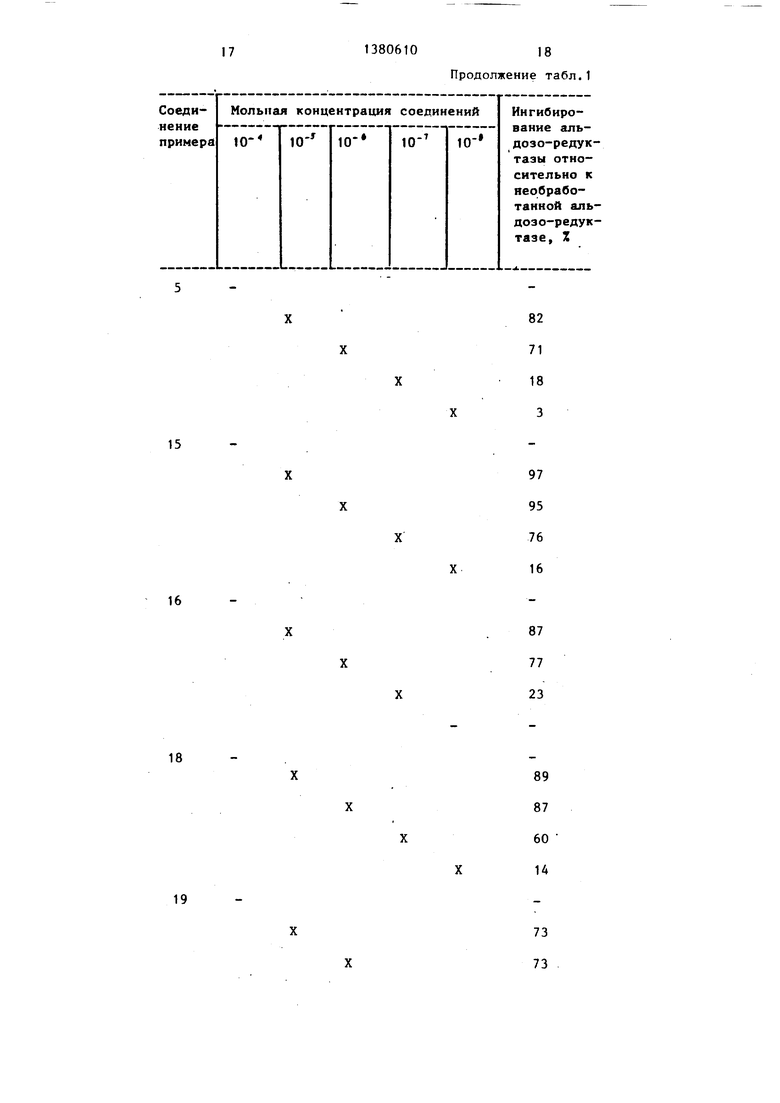
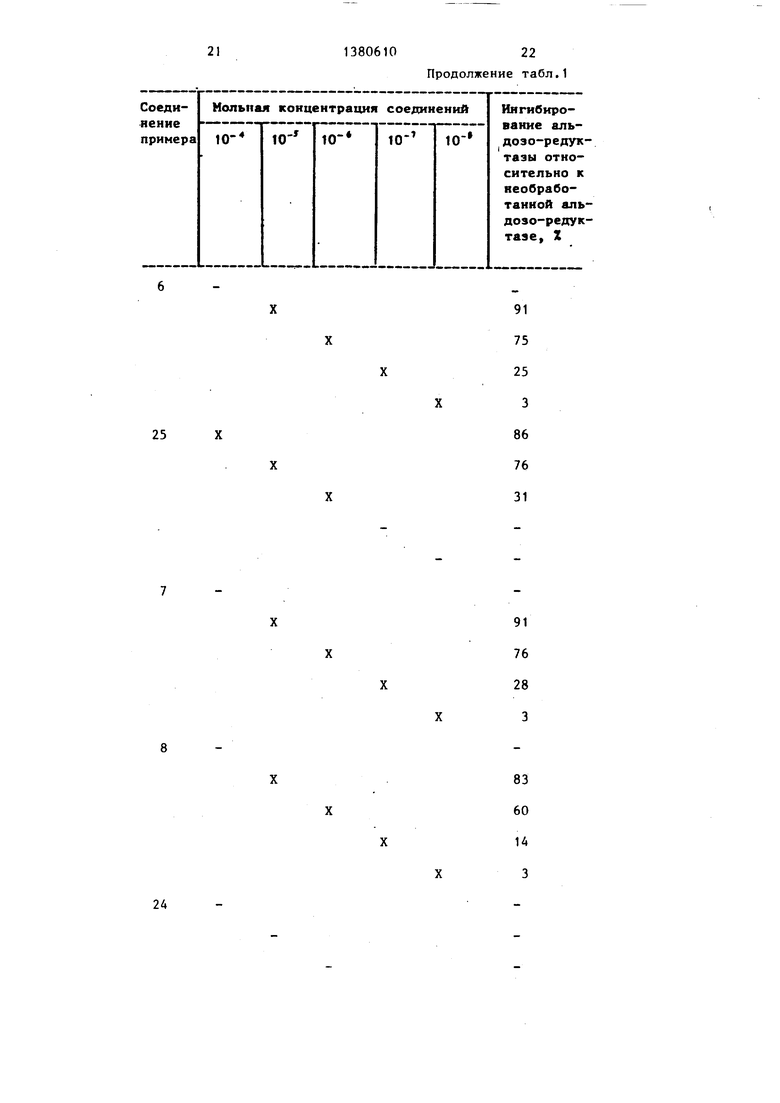
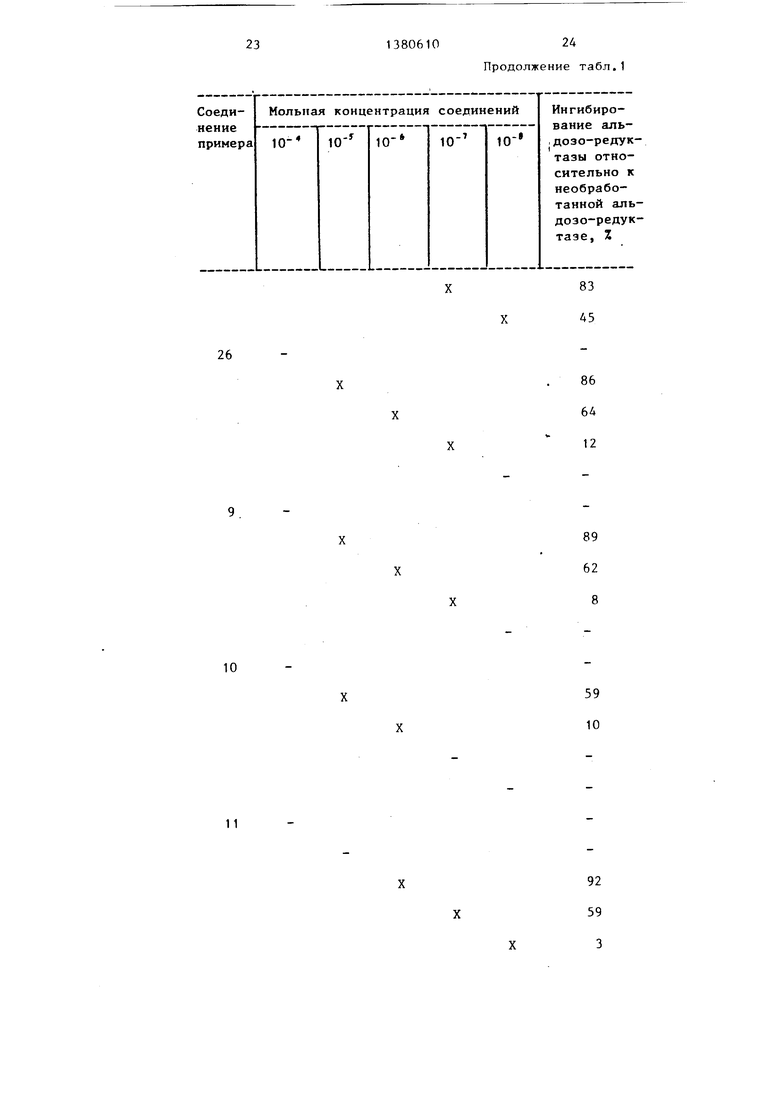
Пример 29. Соединения примеров 1-28 испытьшают на их способность ингибировать активность фермента альдозоредуктазы, используя процедуру.
Соединения испытывают против аль- дозо-редуктазы, .выделенной из плаценты человека.
Ингибирование альдозо-редуктазы, выделенной из плаценты человека при-. ведено в табл.1.
В качестве сравнительных соедине- НИИ испытывают:
A.Спиро- инуан(1,5)оксазолидин
21 I I ,4 -дион.
B.1 ,2 ,3 ,4 -тeтpaгидpo-cпиpo- - oкcaзoлидин(5, 1)нафтален 2,4-дион.
C.Rel 1,5,ЗP-7-фтop-3-мeтилcпи- ,4-дигидpoнaфтaлeн-1 (2Н),5 -окса- золидин 2 ,4 -дион.
(концентрация онгроль ° - 25Р5бо1ка
(концентрация сорбитола)
Результаты по ингибированию сорби- тола приведены в табл.3.
Результаты показывают, что только соединение D обладает достаточной ин гибирующей активностью в седалищном нерве.
Предлагаемые соединения в испытуемых дозах не проявляют признаков токсичности и их можно отнести к категории малотоксичных соединений.
Формула изобретения
Способ получения спирогетероазоли- диндионов формулы
10
12
D. Пе1 1,3 ,3,7-фтор-З-метилспиро 3 ,4-дигидронафтален-1(2Н),5 -оксазо- лидин 2 ,4 -дион.
Соединения А и В испытывают против альдозо-редуктазы, выделенной из хрусталика глаза теленка, а С и D против альдозоредуктазы, вьщеленной из плаценты человека. Эти два энзима дают одинаковые значения процента ингиби- рования и, если они и различаются, то только тем, что плаценты человека труднее ингибиронать по методике Choristopher А, Lipinski and Nancy I.
Данные испытаний приведены в табл.2.
Результаты табл.2 для соединений A-D показывают, что D наиболее активно.
Соединения испытывают также на их способность ингибировать сорбитол, аккумулированный в седалищном нерве и хрусталике диабетической крысы. Следуя ранее приведенной методике, m.I. Peterson единичная доза стрептозото- цина внутривенно вводят крысам (85 мг/кг). Испытуемое соединение вскармливают крысам через 4, 7 и 24 ч после введения стрептозотоцина. Через 27 ч после введения стрептозотоцина, животные умерщвлены и хрусталики глаз и седалищные нервы удалены для сор- битольного испытания. Контрольным животным ВВО/1ЯТ только стрептозотоцин, без введения испытуемых соединений.
Процент ингибирования сорбитола вычисляют по следующей формуле:
контроль
где, когда U - NH-группа, п О или 1; X - водород или бром, бензил, С,-С 4 алкил или диметил при условии X - диметил, п 1; Y - водород, галоид, нитрогруппа, С 1-С -алкокси или С,-С4-алкил; Z - водород, галоид или С,-Сд-алкил при условии Y - нитрогруппа, Z - водород;
когда и - кислород, п 1; X - С,-алкил, Y - галоид; Z - водород, или их фармацевтически приемлемых лей, отличающийся тем что соединение формулы
tO
X
о
г де п, и, Y, Z и X указаны, подвергают взаимодействию с полифосфорной или концентрированной серной кислотой при 70-150°С.
Таблица 1
79 61 11
79 61 11
81
54 5
91 91
Продолжение табл.
87 86
5
87
66
5
87
66
5
82
71
18
3
17
15
16
19
138061018
Продолжение табл.1
82
71
18
3
97 95 76 16
87 77 23
89 87 60 14
73 73
19
23
1380610
20 Продолжение табл.1
90 77 48
88 77 21
81 53 16
9А 97 77 49
25
91
75
25
3
86 76 31
91
76
28
3
83
60
U
3
23
26
138061024
Продолжение табл.1
X
83 45
86 64 12
89
62
8
59 10
92
59
3
25
Основной ди- астере- омер
138061026
Продолжение табл.1
64 27
95 91 72 18
271380610
Таблица 2
28
Продолжение табл.2
| Патент США № 4226875, кл | |||
| Способ приготовления хлебного вина | 1925 |
|
SU424A1 |
| Приспособление для изготовления в грунте бетонных свай с употреблением обсадных труб | 1915 |
|
SU1981A1 |
| , К.Бюлер, Д.Пирсон, Органические синтезы | |||
| М.: Мир, 1972, ч | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| с | |||
| Устройство для разметки подлежащих сортированию и резанию лесных материалов | 1922 |
|
SU123A1 |
Авторы
Даты
1988-03-07—Публикация
1983-12-05—Подача