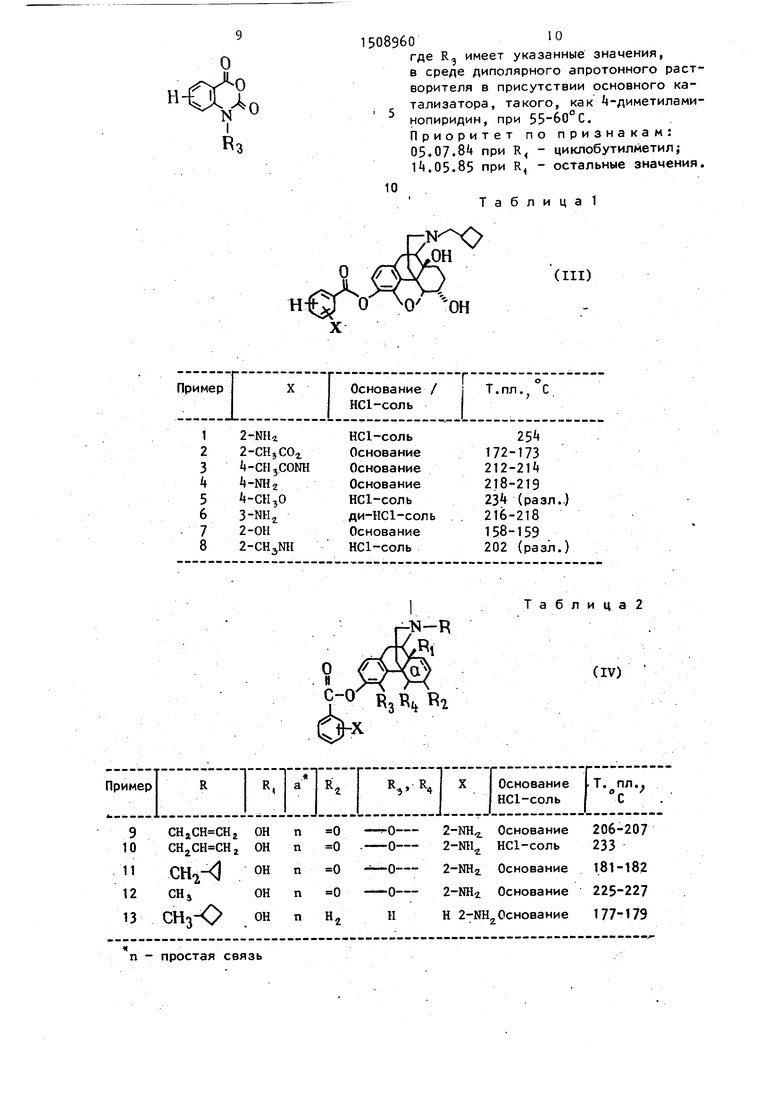
Изобретение касается способа получения производных бензоатных эфи- ров общей формулы I:.
-N-Rl .ОН
где R - аллил, циклопропилметил,
циклобутилметил или метил;
RI - ОН или кетогруппа;
R 3 - И или СИ э,
обладающих болеутоляющими свойствами или приемлемых а качестве антагонистов наркотиков.
Используемые далее обозначения представляют собой следующие соединения :
ы
3150
.налбуфин (-)-(17)-(циклобутилме- тил)-,5 /-эпоксиморфинан-3 ,., Й-три- ол или его соль ,
налтрексон: (-) -1 /- (циклопропил- метил) -, 5о6-эпокси-3,1 -диоксиморфи- нан-6-он или его соль-,
налоксон: (-)-1 У-аллил-,5« эпок- си-3,1 диоксиморфинан-6-он или его соль;
буто рфанол: (-)-17-(циклобутилме- тил)морфинан-3,1 i-диол или его соль;
бупренорфин: (-)-17(циклопропил- метил)(1,1-диметил-этил)- ,5-эпок- си-18,19 дигидро-3 окси-6-метокси- -oi-метил-б, 1 -этеноморфинан-7-мета- нол или его соль. .
В соответствии с изобретением 3-oкcимopфинaV растворяют в диполяр- ном апротонном растворителе, например Н,Ы-диметилформамиде, диметилсульфок- сиде, N-иетилпирролидоне, Ы,Н-диме- тилацетамиде или трипирролидинфос- финоксиде, добавляют к полученному раствору ангидрид изатиновой кислоты, затем катализатор, например А-диме- тиламинопиридин, 4-пирролидинпиридин, или -пиперидинпиридин, и выдерживают реакционную смесь в течение 1-5 ч при в атмосфере азота.
35
Пример 1. Налбуфин-3-антра- нилат гидрохлорид.
В.круглодонную колбу объемом 50 мл добавляют г (0,01 моль) налбу- фина, 1,96 г (0,012 моль) ангидрида изатиновой кислоты, 0,12 г (0,001 моль) А-диметиламинопиридин и 25 мл М,К-ди- метилформамида. Реакционную смесь нагревают на масляной бане в атмосфе-40 ре азота в течение В ч при- , затем колбу снимают с байи и добавляют .в нее 25 мл воды. При этом образующийся продукт выпадает в осадок в виде компактных кристаллов. После 45 выдержки при комнатной температуре.в течение часа продукт собирают, промывают водой и высушивают на воздухе. Выход: А,2 г, т.пл. 199-202 С. По данным тонкослойной хроматографии 50 (силикагель, смесь этилацетата с гек- саном в соотношении 3:1), полученный продукт с R( 0,6 содержит примеси с RI 0,1б. Продукт растворяют в хлорисРаствор 7, г (0,02 моль) налбу- фина, 5,38 г (0,03 моль) ангидрида N-метилизатиновой кислоты, 600 мг (0,005 моль) «-диметиламинопиридина в 35 мл диметилформамида нагревают на масляной бане при 55-60°С в течение А ч. После добавления к смеси 35 мл воды выпадает кристаллический осадок, который отфильтровывают, про мывают водой и высушивают. В результате получают 8,0 г продукта, которы растирают с 30 мл эфира и дважды пе- рекристаллизовывают из 1-пропанола, получая в результате 3f65 г продукта с т.пл. . Полученное соединение переводят в моногидрохлорид, растворяя его в тетрагидрофуране и добавляя один эквивалент газообразно го НС1 в эфире. Целевое соединение, выпавшее в осадок, отфильтровывают, промывают водой и высушивают. Выход 3, г, т.пл. 202°С (пенится).
В табл. 1 приведены соединения в соответствии с примерами 1 и 8, а также другие соединения, полученные указанным образом.
П р и м е р ы 9 и 10. -3-антранилат (формула
Налоксон- IV, в которо
R
связь, R
X 2-NHi)
R
0; R,
ОН; и R.
а простая « О;
По примеру 1 смесь 6,62 г (0,02 моль) налоксана, ,Э г (0,03 моль) ангидрида изатиновой кис
том метилене и обрабатывают древеснымдз лоты, 0,6 г (0,005 моль) А-диметилуглем для обесцвечивания. После отгонки хлористого метилена остаются белые кристаллы. В результате перекристаллизации из этилацетата полуаминопиридина в 20 мл диметилформами да нагревают в течение Л ч при 60°С, получая в результате 8,0 г сырого продукта с т.пл. (основа0
5
0
5
0 5 0
чают ,0 г налбуфин-3-антранилата с т.пл. 205-20б С. По данным тонкослойной хроматографии, полученнь1й продукт 5 имеет R 0,6. По данным аналитичес кой высокопроизводительной жидкостной хроматографии, степень чистоты его выше 99. Полученное основание переводят в моногидрохлорид путем растворения в 10 мл тетрагидрофураИа и добавления по каплям 2,0 г 20%-ного раствора НС1 в этаноле. Образующийся моногидрохлорид выпадает в осадок в виде белых кристаллов. Их отфильтровывают и высушивают на воздухе. Выход k, г, т.пл. .
Примеры 2-7 даны в табл. 1.
При мер 8. Налбуфин-3-(Н-ме- тилантранилат).
Раствор 7, г (0,02 моль) налбу- фина, 5,38 г (0,03 моль) ангидрида N-метилизатиновой кислоты, 600 мг (0,005 моль) «-диметиламинопиридина в 35 мл диметилформамида нагревают на масляной бане при 55-60°С в течение А ч. После добавления к смеси 35 мл воды выпадает кристаллический осадок, который отфильтровывают, промывают водой и высушивают. В результате получают 8,0 г продукта, который растирают с 30 мл эфира и дважды пе- рекристаллизовывают из 1-пропанола, получая в результате 3f65 г продукта с т.пл. . Полученное соединение переводят в моногидрохлорид, растворяя его в тетрагидрофуране и добавляя один эквивалент газообразного НС1 в эфире. Целевое соединение, выпавшее в осадок, отфильтровывают, промывают водой и высушивают. Выход 3, г, т.пл. 202°С (пенится).
В табл. 1 приведены соединения в соответствии с примерами 1 и 8, а также другие соединения, полученные указанным образом.
П р и м е р ы 9 и 10. -3-антранилат (формула
5
30
Налоксон- IV, в которой
язь, R
2-NHi)
R
0; R,
ОН; и R.
а простая « О;
По примеру 1 смесь 6,62 г (0,02 моль) налоксана, ,Э г (0,03 моль) ангидрида изатиновой кислоты, 0,6 г (0,005 моль) А-диметиллоты, 0,6 г (0,005 моль) А-диметиламинопиридина в 20 мл диметилформамида нагревают в течение Л ч при 60°С, получая в результате 8,0 г сырого продукта с т.пл. (основание). После перекристаллизации из этилацетата (выход 6,9 г; т.пл. 200- ), а затем из метоксиэтанола получают 5, г налоксон-3-антранилата с т.пл. 206-207 С. При тонкослойной хроматографии продукта (силикагель, этилацетат) образуется одно пятно с Rf 0,65. После перевода.основания в моногидрохлорид и последующей перекристаллизации из этанола получают 5, г соли с т.пл. 233°С (вспенивание) .
Пример 11. Налтрексон-3-ан- транилат (формула IV, в которой RСН- ч R ОН; а простая связьи R
О; X 2-mi ).
R 0; R
Проводя процесс по примеру 1 из 3,5 г (0,01 моль) налтрексона, 1,63 г (0,01 моль) ангидрида изатино- вой кис лоты, 0,25 г (0,002 моль) -диметиламинопиридина, растворенных в 50 мл диметилформамида, получают
179°С. При тонкослойной хроматографии (смесь ацетона и гексана в соотношении 35:65) полученного продукта образуется одно пятно с R.J. 0,5.
В табл. 2 приведены характеристики соединений согласно примерам .
Фармакологические исследования.
Результаты проведенных испытаний свидетельствуют о том, что новые соединения формулы I в соответствии с изобретением повышают биоусвояемость 3-оксиморфинанов при оральном введеНИИ композиции и обладают средней токсичностью.
Для оценки эффективности предле- карств 3 оксиморфинанов в соответствии с изобретением проводят опыты
по определению скорости их гидролиза в человеческой плазме и плазме крыс, а также биоусвояемкости 3 оксиморфи- нанов у собак и крыс при оральном введении им предлекарства. Концентра



Изобретение касается гетероциклических соединений , в частности, получения производных бензоатных эфиров 3-оксиморфинанов общей формулы 1: R3-NH-Y-C(O)-OX, где Y - группа формулы п
X - группа общей формулы Ш: @ при R1 - аллил, циклопропилметил, циклобутилметил или метил
R2 - OH или кетогруппа
R3 - H или метил, обладающих болеутоляющими свойствами или приемлемых в качестве антагонистов наркотиков, что может быть использовано в медицине. Цель - создание веществ с активностью не характерной для данного класса. Синтез ведут взаимодействием 3-оксиморфинана общей формулы 1у: XO-X, где X - см. выше, с ангидридом изатиновой кислоты общей формулы V: Y-C(O)-O-C(O)-NR3, ГДЕ Y И R3 - СМ. ВЫШЕ, В СРЕДЕ ДИПОЛЯРНОГО АПРОТОННОГО РАСТВОРИТЕЛЯ В ПРИСУТСТВИИ ОСНОВНОГО КАТАЛИЗАТОРА, ТАКОГО КАК 4-ДИМЕТИЛАМИНОПИРИДИН, ПРИ 55-60°С. НОВЫЕ СОЕДИНЕНИЯ ПОВЫШАЮТ БИОУСВОЯЕМОСТЬ 3-ОКСИМОРФИНАНОВ ПРИ ОРАЛЬНОМ ВВЕДЕНИИ И ОБЛАДАЮТ СРЕДНЕЙ ТОКСИЧНОСТЬЮ. 5 ТАБЛ.
1,5 г налтрексон-3-антранилата, имею- 25 цию 3 оксиморфинана определяют с по- щего после очистки путем перекристал- мощью аналитической высокоразрешающей лизации(дважды) из 1-пропанола т.пл. хроматографии. Детектирование осуществляют с помощью электрохимическое го датчика, реагирующего на. фенольиую 30 гидроксильную группу (п 3-положении) и, следовательно, не реагирующего на
.181-182°C.
П р и м е р 12. Оксиморфон-З-ант ранилат (формула IV, в которой R CHj; R ОН; а простая связь;
R/, 0; R
и Rq.
-О; Х.2-Шр.
Процесс проводят аналогично примеру 1, нагревая смесь 10,0 г (0,033 моль) оксиморфона, 7,01 г 5 (0,043 моль) ангидрида изатиновой
кислоты, 1,2 г (О,-01 моль) if-диметил- аминопиридина в 50 мл диметилформамида в течение 5 ч при 60°С. Образую- . щийся сырой продукт (8,1 г) дважды перекристаллизов,ывают из этилацетата, получая в результате 7,05 г оксимор- фон-3-антранилата с т.пл. 225-227°С. Пример 13. Буторфанол-3-ант- ранилат (формула IV, в которой R
предлекарства с защищенной группой в этом положении. Концентрации в плазме определяют после экстракции растворителем.
Гидролиз плазмы. Предлекарство добавляют к свежей плазме (не позже, чем через 24 ч после изъятия) в таком количестве, чтобы концентрация его составляла 0,28 мкмоль, выдерживают плазму при 37°С и определяют скорость появления в ней лекарства.
Биоусвояемость 3 оксиморфинанов
д5 при оральном введении.
Крысам и собакам вводят внутривенно и орально 3-оксиморфинаны и орально предлекарства формулы I. Как правило предлекарства вводят в виде водСН2-О
; R, ОН; а простая
связь; R 2 Н; R, и R Н; X ) .
Процесс проводят по примеру 1, нагревая 1,3 г (3,97 моль) буторфа- нола, 0,71 г (, ммоль) ангидрида изатиновой кислоты, 0,5 г (4,37 ммоль) 4-диметиламинопиридина в 10 мл диметилформамида в течение 5 ч при 55 С, определения концентрации 3-оксиморфи- Сырой продукт (1,6 г; т.пл. 1б7-171°С) нана. Для каждого животного определя- перекристаллизовывают из 5 мл 1-пропанола, получая в результате 1,3 г буторфанол-3-антранилата с т.пл. 177ют площадь под кривой зависимости концентрации 3-оксиморфинана в плазме от времени (AUC). Биоусвояемость
предлекарства с защищенной группой в этом положении. Концентрации в плазме определяют после экстракции растворителем.
Гидролиз плазмы. Предлекарство добавляют к свежей плазме (не позже, чем через 24 ч после изъятия) в таком количестве, чтобы концентрация его составляла 0,28 мкмоль, выдерживают плазму при 37°С и определяют скорость появления в ней лекарства.
Биоусвояемость 3 оксиморфинанов
д5 при оральном введении.
Крысам и собакам вводят внутривенно и орально 3-оксиморфинаны и орально предлекарства формулы I. Как правило предлекарства вводят в виде вод50 ных растворов, приготовленных непосредственно перед введением. Однако отдельные собаки получают лекарства или предлекарства в твердой форме. Отбирают плазму и замораживают ее до
определения концентрации 3-оксиморфи- нана. Для каждого животного определя-
ют площадь под кривой зависимости концентрации 3-оксиморфинана в плазме от времени (AUC). Биоусвояемость
3-оксиморфинана (F) рассчитывают по формуле:
F
AUC ° X Dose
АиС Г5о;ё ° F - количество (%) лекарства, перешедшего в плазму.
Относительную биоусвояемость (RB) определяют путем сравнения биоусвояемости З оксиморфинана при оральном введении предлекарства (Fp ) с биоусвояемостью орально введенного лекарства (Fjry ) :
Fpro
RB
Fd
.
Результаты опытов с налбуфином. Как показали опыты по биоусвояемости налбуфина, при оральном введении и скорости гидролиза предлекарства в плазме in vitro собаки оказались ближе к человеку, чем крысы и обезьяны..
Ниже приведены результаты по биоусвояемости налбуфина при оральном введении у различных млекопитающих. По биоусвояемости налбуфина при оральном введении собаки (5,) ближе всех других подопытных животных к человеку ().
Биоусвояемость налбуфина при ораль ном введении, % от введённой дозы ± SE:
Крысы 2,7 ± 0,4 (20 мг налбуфи-
на/кг)
Собаки 5,4 ± 0,9.(4 мг налбуфина/кг)
Обезьяны 0,9, 1 ,6- (4 мг налбуфина/кг)
Человек 14 (45 мг в виде таблетки или раствора)
Ниже приведены периоды полураспада при гидролизе налбуфин-антранилата в качестве предлекарства налбуфина в плазме различных млекопитающих. Период полураспада в плазме собак ближе всех по величине к периоду полураспада в плазме человека.
Период полураспада предлекарства налбуфина в плазме, t 1/2 ч:
Крысы 1,5
Собаки . 14,6
Обезьяны 3,3
Человек 45,0
С учетом приведенных результатов можно сделать вывод, что наиболее характерным критерием при доклинической оценке предлекарств является биоусвояемость их при оральном введении у соба к.
Ниже приведены значения относительной биоусвояемости (КВ) у собак различных предлекарств 3 оксиморфи- нанов в соответствии с изобретением: Пример RB (биоусвояемость симорфинана при оральном введении 1)
19,5
23,9 42,7
61,7
Биоусвояемость предлекарства в соответствии с примером 10 54,2 (+6,3) При оральном введении гидрохлорида налоксона (10 мг налоксона/кг) концентрация налоксона в плазме близка к пределу чувствительности определения и плохо воспроизводима, поэтому его относительную биоусвояемость нельзя рассчитать.
Ф о рмула изобретения
, Способ получения производных бен- зоатных эфиров 3-оксиморфинанов обще формулы
-N-Rl
.ОН
О V-0 0 Я
где R, - аллил, циклопропилметил, циклобутилметил или метил; R гидроксильная группа или кетогруппа;
R - водород или метил, отличающийся тем, что 3-оксиморфинан общей формулыгде R(, R и Rj имеют указанные значения,
подвергают взаимодействию с ангидридом изатиновой кислоты общей формулы
.Ri
508960
где R
10
10
имеет указанные значения, в среде диполярного апротонного растворителя в присутствии основного катализатора, такого, как «-диметилами- нопиридин, при 55-60°С. Приоритет по признакам: ОБ,07.8 при R - циклобутилметил,- И.05.85 при R, - остальные значения.
Таблица 1
(IV) 
| Патент США N , кл | |||
| Прибор для периодического прерывания электрической цепи в случае ее перегрузки | 1921 |
|
SU260A1 |
| СЛОИСТАЯ СТРУКТУРА ИЗ ПЛАСТИЧНОГО МАТЕРИАЛА ДЛЯ ПОЛУЧЕНИЯ КЕРАМИЧЕСКОЙ ОБЛИЦОВОЧНОЙ ПЛИТКИ | 2006 |
|
RU2323192C1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| (Sk СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ БЕНЗОАТНЫХ ЭФИРОВ З-ОКСИМОРФИНАНОВ | |||
Авторы
Даты
1989-09-15—Публикация
1987-07-03—Подача