Изобретение относится к способу получения новых производных пиримидо b,4-b l ,4 |оксазина или их кислотно- аддитивных солей, которые оказывают действие на сердечно-сосудистую систему и могут найти применение я медицине для поныыения деятельности сердечных мышц и для улучшения коронарного кровообращения.
Целью изобретения является получение новых пиримидооксазинов, обладающих новым видом биологической активности в этом ряду соединений.
с
II Р и м е р 1 . 4- (2-Оксиэтил)-ами- но-2-ме тил-8-(2-оксопропил)-6,7-ди-
гидро-8Н-пиримидо 5 , 4-b J , 4J оксазин- 7-он.5
Раствор 0,32 г хлорацетона в 5 мл бутанона прибавляют по каплям к суспензии, приготовленной из 0,68 г 4- (2-оксиэтил)-амино-2-метил-6,7-ди- гидро-8Н-пиримидо 5 ,4-b 1,Г окса- Ю зин-7-она, 0,5 г безводного углекислого калия и 15 мл бутанона, затем смесь при перемешивании нагревают в течение 8 ч при температуре ее кипения, после чего смесь фильтруют еще J5 в нагретом состоянии..Фильтрат упаривают до 12 мл и выдерживают остаток в течение ночи при температуре 0-4°С. Образовавшийся осадок отделяют фильтрованием, промывают диэтиловым эфи- 20 ром и сушат. В результате получают 0,70 г (83%) продукта, температура
150мида и 25 мл бутанона при перемешивании нагревают в течение 8 ч при
плавления которого составляет
152 С. Гидрохлорид имеет температуру
25
30
40
плавления 185-187 С.
П р и м е р 2. 8 Цианометил-2-ме- тил-4- 2-(4-морфолинил)-этил -амино- 6,7- дигидро- 8Н- пиримидо 5,4-b 1 , 4 J оксазин-7-он.
Раствор 0,25 г хлорацетонитрила в 50 мл бутанола прибавляют в течение 15 мин по каплям при перемешивании и температуре кипения смеси к суспензии, приготовленной из 0,88 г 2-метил-4- 2-(4-морфолинил)-этшт}- амино-6,7-дигидро-8Н-пиримидо 5,4-bJ Ј1,4 оксазин- 7-она в виде основания, 0,5 г безводного углекислого калия и 15 мл бутанола. Затем смесь в течение 8 ч нагревают при перемешивании и при температуре кипения, непосредственно после этого осадок отделяют фильтрованием еще в горячем состоянии и промывают бутанолом. Затем фильтрат упаривают, а остаток основа- 4j тате получают 0,59 г (68%) продукта, тельно перемешивают с диизопропило- вым эфиром и сушат.
В результате получают 0,91 г (91%) продукта с температурой плавления 126-128°С.
II р и м е р 3. 8-Аминокарбонилме- тил-4-(4-этоксикарбонил 1-пиперази- нил)-2-метил 6,7-дигидро-8Н-пиримидо 5,4-b I ,4joKCH3HH-7-on.
Суспензию, приготовленную из 0,96 г 4-(4-этоксикарбонил-1-пипера- зинил)-2-метил-6,7-дигидро-8П 5,4-bJ l,4joKca3HH-7-она. 0,5 г безводного углекислого калия, 0,31 г хлорацетатемпературе кипения смеси, еще в горячем состоянии реакционную смесь фильтруют, осадок промывают бутано- ном, а полученный здесь фильтрат отставляют. Осадок промывают сначала водой, а затем диэтиловым эфиром и сушат. В результате получают 0,65 г продукта, температура плавления которого составляет 225-227°С.
Отставленный фильтрат упаривают до 10 мл и остаток выдерживают в течени ночи при температуре 0-4°С. Кристаллический продукт отфильтровывают, промывают и сушат. В результате дополнительно получают 0,20 г продукта температура плавления которого составляет 225-227 С. Общий выход составлял 75%.
П р и м е р 4. 4-Хлор-8-зтокси- карбонилметил-2-метил-6,7-дигидро-8Н- пиримидо- 5,4-b 1 , 4 -оксазин-7-он.
Раствор 0,41 г этилхлорацетата в 5 мл бутанона при перемешивании прибавляют в течение 15 мин по каплям при температуре кипения реакционной смеси к суспензии, приготовленной из 0,6 г 4-хлор-2-метил-5,7-дигидро-8Н- пиримидо- 5,4-Ъ j ,4j-oKca3HH-7-она, 0,5 г безводного углекислого калия и 15 мл бутанона, затем реакционную смесь в течение 8 ч нагревают при перемешивании и температуре ее кипения фильтруют еще в горячем состоянии, после чего осадок промывают бутаноном Фильтрат упаривают до 10 мл, остаток охлаждают, после чего отфильтровывают выделившееся в осадок неизменное исходное вещество. Маточный раствор упаривают, остаток растирают с н-гек- саном, продукт отфильтровывают, промывают н-гексаном и сушат. В резуль-
50
55
температура правления которого составляет 69-70°С.
Приведенные в табл. 1 соединения получают аналогично описанным примерам.
Биологические свойства важнейших представителей сердечных веществ, отличающихся от сердечных глнкочидов, указывают на то, что существует постоянная потребность в нахождении новых, пригодных для применения продолжительное время и не обладающих побочным действием биологически ак-
и-
15671234
мида и 25 мл бутанона при перемешивании нагревают в течение 8 ч при
5 0
5
0
0
j тате получают 0,59 г (68%) продукта,
температуре кипения смеси, еще в горячем состоянии реакционную смесь фильтруют, осадок промывают бутано- ном, а полученный здесь фильтрат отставляют. Осадок промывают сначала водой, а затем диэтиловым эфиром и сушат. В результате получают 0,65 г продукта, температура плавления которого составляет 225-227°С.
Отставленный фильтрат упаривают до 10 мл и остаток выдерживают в течение ночи при температуре 0-4°С. Кристаллический продукт отфильтровывают, промывают и сушат. В результате дополнительно получают 0,20 г продукта, температура плавления которого составляет 225-227 С. Общий выход составлял 75%.
П р и м е р 4. 4-Хлор-8-зтокси- карбонилметил-2-метил-6,7-дигидро-8Н- пиримидо- 5,4-b 1 , 4 -оксазин-7-он.
Раствор 0,41 г этилхлорацетата в 5 мл бутанона при перемешивании прибавляют в течение 15 мин по каплям при температуре кипения реакционной смеси к суспензии, приготовленной из 0,6 г 4-хлор-2-метил-5,7-дигидро-8Н- пиримидо- 5,4-Ъ j ,4j-oKca3HH-7-она, 0,5 г безводного углекислого калия и 15 мл бутанона, затем реакционную смесь в течение 8 ч нагревают при перемешивании и температуре ее кипения, фильтруют еще в горячем состоянии, после чего осадок промывают бутаноном. Фильтрат упаривают до 10 мл, остаток охлаждают, после чего отфильтровывают выделившееся в осадок неизменное исходное вещество. Маточный раствор упаривают, остаток растирают с н-гек- саном, продукт отфильтровывают, промывают н-гексаном и сушат. В резуль-
тате получают 0,59 г (68%) продукта,
температура правления которого составляет 69-70°С.
Приведенные в табл. 1 соединения получают аналогично описанным примерам.
Биологические свойства важнейших представителей сердечных веществ, отличающихся от сердечных глнкочидов, указывают на то, что существует постоянная потребность в нахождении новых, пригодных для применения продолжительное время и не обладающих побочным действием биологически ак-
тивных веществ, которые в сравнении с известными веществами могут быть применены с большей безопасностью.
Новые производные пиримидо L5,4-b j ,4 оксазина, получаемые по предлагаемому способу, в значительной степени соответствуют упомянутым фармакологическим требованиям.
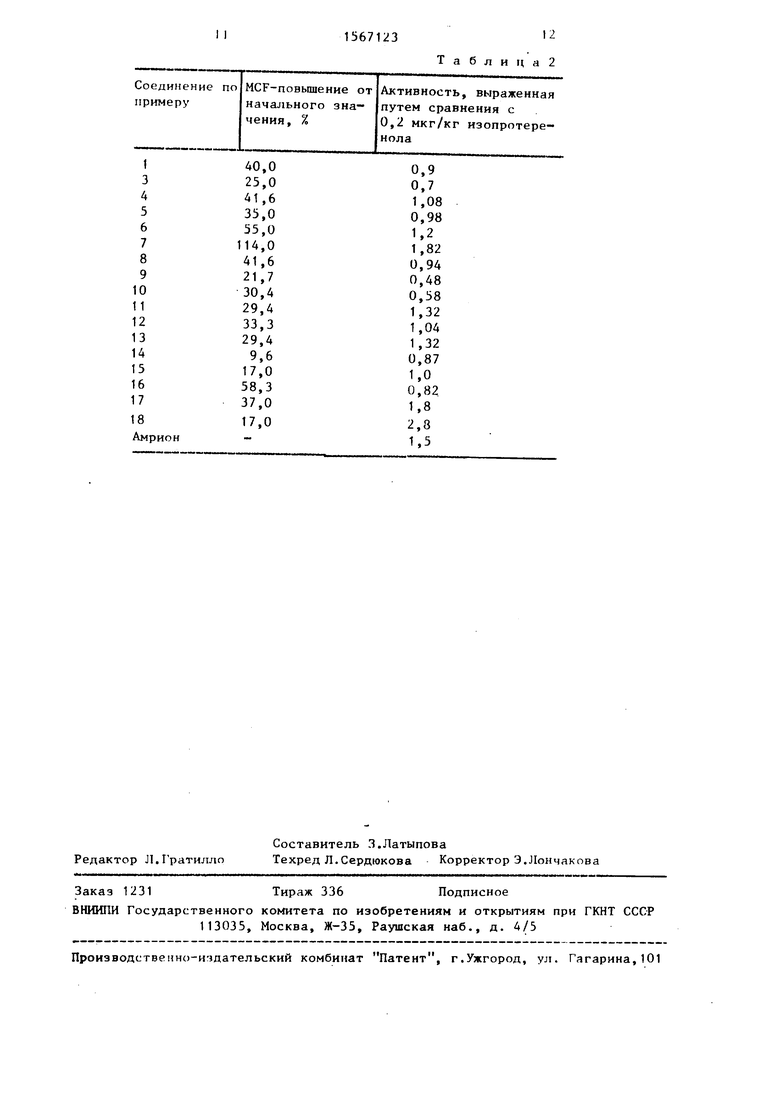
Повышающий сократительную силу сердца эффект (Myocardial Contractil Force далее сокращенно: MCF) определяли в проведенных на живых организмах опытах по приводимым ниже методикам.
Испытание на подвергнутых наркозу кошках.
Животных наркотизировали внутривенным (i.v.) введением 30 мг/кг натриевой соли пентобарбитала, после чего при искусственном дыхании раскрывали их грудные клетки. После раскрытия перикарда прикрепляли прибор для измерения давления к эпикардиальной поверхности левого желудочка сердца. Кровяное давление измеряли посредством того, что катетер, соединенный с передатчиком давления и электроманометром, вводили в бедренную артерию. Биологически активное вещество вводили либо внутривенно через введенную в бедренную вену канюлю, либо интрадуоденально (i.d.) через i.d. канюлю. В начале опыта вводили 0,2 мкг/кг изопротеренола (сокращенно: IS) в качестве внутреннего стандарта для того, чтобы проконтролировать миокардиальную реактивность, а именно: наибольший MCF-ответ мог изменяться при всех положительных ино- тропных средствах в соответствии с личностью животного. Таким образом, изопротеренол применяли не в качестве эталона, а в качестве внутреннего стандарта.
МСК-ответ выражали в процентном изменении начального значения: действие 5 мг/кг исследуемого вещества, введенного внутривенно, сравнивали с действием U,2 мкг/кг изопротеренола, введенного внутривенно, и выражали отношением. Полученные результаты представлены в табл. 2.
В качестве эталона использовали амрион.
Амрион: 3-амино-5-(4-пиридил)- 2(1Н)-пиридннон, значительно повышает минутный объем сердца больных, страдающих хронической недостаточ0
5
5
ностью сердца, после орального введения и даже уменьшает сопротивление периферических кровеносных сосудов, но возможности его применения для терапевтических целей значительно ограничиваются действием, определяющимся плохой картиной крови.
По сравнению с предлагаемым изо- протеренолом соединения проявляют аналогичное или более сильное действие, проявляющееся в повышении сократительной силы сердца. В качестве более сильного /3-адреноцептор-аго- нис.та изопротеренол вызывает измеримое MCF-ловышение уже при вводимой внутривенно дозе 0,2 мкг/кг, но этот эффект краткосрочен, полностью обратим и не оказывает влияния на пара- 0 метры кровообращения. При действии соединений, указанных в табл. 1, частота пульса повышается незначительно или совершенно не повышается.
Действие некоторых соединений также исследовали после интрадеуденаль- ного введения. Соединение примера 4 обладает сильным положительным изотропным действием в дозе 20 мг/кг или даже после Ь мг/кг.
Испытания соединения примера 6 на подвергнутых наркозу собаках.
Соединение вводили находящимся под наркозом собакам со вскрытой грудной клеткой внутривенно в количестве 0,5 и 1,0 мг/кг или интрадуоденально в 5 количестве Ь мг/кг. При внутривенном введении в количестве 0,5 мг/кг величина MCF возрастала на 56%, коронарная циркуляция - на 34%. При этом пульс возрастал на 6-7%, а систематическое артериальное кровяное давление уменьшалось на 10-15%.
При внутривенном введении в количестве 1,0 мг/кг максимальное возрастание MCF составляло 46% и установившаяся величина оставалась неизменной в течение 10 мин. Пульс повышался примерно на 13% (в течение 5 мин), а коронарная цир ляция в течение 10 мин увеличивалась на 20%. Систематическое артериальное кровяное давление уменьшалось на 20%.
0
0
5
0
При интрадуоденальном введении в количестве 5,0 мг/кг величина MCF возрастала примерно на 30% и оставалась неизменной в течение 60 мин.
В соответствии с результатами фармакологических испытаний предлагаемые соединения могут быть применены для
лечения заболеваний, связанных с нарушением кровообращения, прежде всего для повышения деятельности недостаточно действующих сердечных мышц, т.е. для лечения хронической недостаточности сердца и для улучшения коронарного кровообращения. Установлено, что соединения отличаются также низкой токсичностью. Все эти свойства говорят о том, что соединения имеют весьма ценный спектр действия и безопасны при применении для терапевтических целен.
Для терапевтических целей получае- мые по предлагаемому способу новые пиримидо 5,4-b 1 ,4)оксазины, принимая во внимание условия резорбции, в большинстве случаев применяют в суточных дозах между 0,2 мг/кг веса те- ла и 250 мг/кг, предпочтительно между 0,2 мг/кг и 50 мг/кг, причем в некоторых случаях суточную дозу разделяют на несколько частей.
Для терапевтического применения новые соединения наиболее целесообразно перерабатывать в фармацевтические препараты, причем препараты получают посредством того, что биологически активное вещество смешивают с применяемыми для получения лекарственных препаратов, пригодными для эн- терального или парентерального введения нетоксичными инертными твердыми или жидкими носителями и/или вспомогательными веществами. Подходящими веществами-носителями являются, например вода, желатин лактоза, крахмал пектин, стеарат магния, стеариновая кислота, тальк и растительные масла. В качестве вспомогательных веществ применение могут находить, например, консервирующее средство и смачиватель (поверхностно-активное вещество), а также эмульгаторы, буфер ные вещества и вещества, придающие аромат.
С помощью указанных веществ-носителей и вспомфгательных веществ пред- лагаемые биологически активные вещества могут быть превращены в обычные фармацевтические препараты, среди которых могут быть указаны твердые лекарственные формы, например таблетки,
капсулы, пилюли, суппозитории и т.п., или жидкие формы, например растворы в воде или масле, суспензии, эмульсии или сиропы, а также пригодные для
с 0
5 о Q с
5
инъекций растворы, суспензии и эмульсии.
Пример 19. Получение таблеток.
Состав (в расчете на 1001) таблеток) , г:
Фумарат основания по примеру 610
Лактоза185
Микрокристаллическая целлюлоза25
Тальк5
Кукурузный крахмал /3 Стеарат магния2
Компоненты смешивали друг с другом,1 смесь гомогенизировали, после чего из смеси отпрессовывали таблетки, которые содержали по 10 мг биологически активного вещества.
Пример 20. Получение раствора для инъекций.
Состав (в расчете на 2 л раствора) :
Фумарат основания по примеру 6, г2
Хлористый натрий, г 20 Вода для инъекционных целей g,S, мл До 2000 Из указанных компонентов приготавливали раствор, который помещали в ампулы и стерилизовали. Одна ампула содержала 2 мл раствора.
Формула изобретения
Способ получения производных пири- мидо 5,4-b 1 .оксазинл общей формулы
2
llJyOyE
ч
где R. - С ,-С -алкил;
К.г - галоген или группа -NU5U6,
где К-5 водород, U« - С -С -алкил, замещенный гидроксилом, 4-хлорфенилом или морболини- лом, или К С -С -алкил или бензил, К6 - С -С -гид- роксиалкил, или группа - NKj-Ug означает морЛолинил, или пиперачинил, замещенный (С2-С4-алкил)оксикарбонилом; К - атом водород или С,-С4-ал- кил;
R4 - С -С -алкил, монозамещенный оксогруппой, цианогруппой, аминокарбонилом, С, килоксикарбонилом или морфо- линилкарбонилом,
их кислотно-аддитивных солей, личающийся тем, что инение обпей формулы
Ч2
т, /Ц-Цк О
н
567123Ю
fvje R - K имеют укатанные значения, подвергают взаимодействию с соединением формулы
К4Х, где R$ имеет указанные значения;
X - галоген,
и выделяют целевой продукт в виде свободного основания или его переводят в кислотно-аддитивную соль.
10




| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных пиримидо (5-4 @ )-(1,4)оксазина или их аддитивных солей с кислотами | 1986 |
|
SU1567122A3 |
| 6,7-Диэтокси-1-(4-этокси-3-оксибензил)-3,4-дигидроизохинолин,обладающий действием на сердечно-сосудистую систему | 1982 |
|
SU1097621A1 |
| Способ получения вещества, обладающего гормональным действием | 1972 |
|
SU624562A3 |
| Способ получения 3-замещенных тетрагидропирроло/1,2- @ / пиримидинов,их кислотно-аддитивных или четвертичных солей | 1980 |
|
SU1048986A3 |
| Способ получения производных мочевины | 1981 |
|
SU1176834A3 |
| Способ получения производных @ -(3,3-дифенилпропил)-пропилендиамина или их солей | 1973 |
|
SU1014468A3 |
| Способ получения производных пиридазона | 1973 |
|
SU533337A3 |
| Способ получения замещенных ксилита или гексита | 1980 |
|
SU1075975A3 |
| Способ получения алкилтиобензимидазолов | 1980 |
|
SU1126208A3 |
| Способ получения оптически активных солей щелочных металлов или лактона цис-2-окси-циклопент-4-ен-1-ил-уксусной кислоты | 1979 |
|
SU1271370A3 |
Изобретение относится к гетероциклическим соединениям, в частности к получению производных пиримидо [5,4-B][1,4] оксазина ф-лы 1 N=C(R1)-N=C(R2)-C=C-N(R4)-C(O)-C(R3)-O, где R1 - C1-C4-алкил
R2 - атом галогена или группа - NR5R6, а R5 - H и R6 - C1-C4-алкил, замещенный гидроксилом, 4- хлорфенилом или морфолинилом, или R5-C1-C4-алкил или бензил и R6 - C1-C4-гидроксиалкил или группа- NR5R6 означает морфолинил, или пиперазинил, замещенный (C2-C4-алкил)оксикарбонилом, R3 - Н или C1-C4-алкил
R4-C1-C4-алкил, монозамещенный оксогруппой, цианогруппой аминокарбонилом, (C1 - C4) алкилоксикарбонилом или морфолинилкарбонилом, или их кислотно- аддитивных солей, которые оказывают действие на сердечно- сосудистую систему и могут найти применение в медицине. Цель разработка способа получения соединений, обладающих указанным действием. Получение ведут реакцией соединения ф-лы 1, где R1, R2, R3 - указано выше, R4 - Н с соединением ф-лы R4X, где R4 - указано выше (кроме Н) и X- атом галогена, и выделяют целевой продукт в виде свободного основания или его переводят в кислотно-аддитивную соль. 2 табл.
Т а б л и Ц а 1 Структура и характеристики пиримидо b,4-b fl ,4 оксазина формулы
Пример
5 6 7 8
9
10 11
12
N-(2-оксиэтил) амино
Н-(2-оксиэтил) амино
(4-Хлорбензил) амино
нил-1-этил
4-Морфолинил- карбонил
н-Нутоксикарбо- нилметил
1Э Этоксикарбонил- метил
Соединения получают и идентифицируют в виде гидрохлорида,
80-82 162-165 142-145 101-104
ион
40,0 25,0 41,6 35,0 55,0 114,0 41,6 21,7 30,4 29,4 33,3 29,4 9,6 17,0 58,3 37,0 17,0
Таблиц а2
0,9 0,7 1,08 0,98
1,2
1,82
0,94
0,48
0,58
1,32
1,04
1 ,32
0,87
1,0
0,82
1,8
2,8
1,5
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 8Н-ПИРИМИДО- [5,4-&] [1,4]-ОКСАЗИНОНА-7 | 1971 |
|
SU418036A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1990-05-23—Публикация
1988-06-14—Подача