Изобретение относится к новым биологически активным соединениям класса кумаринов, конкретно к ариламидам 2-ацетилиминокумарин-3-карбоновой кислоты, общей формулы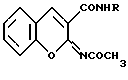
где Ia) R=2,4-(CH3)2C6H3; Iб) R=м-C2H5OC6H4,
проявляющих антикоагулянтную активность.
Ближайшим аналогом по структуре соединений I является п-толуидид 2-ацетилиминокумарин-3-карбоновой кислоты (SU 1575536, 1988) формулы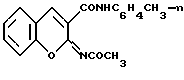
В качестве эталона сравнения взят антикоагулянт непрямого действия - неодикумарин (Машковский М.Д. Лекарственные средства. М.: Медицина, 1988, т. 2, с. 76-78), широко применяемый в лечебной практике.
Целью изобретения является изыскание новых производных кумаринового ряда, обладающих антикоагулянтной активностью.
Поставленная цель достигается 2,4-ксилидидом (Ia) и м-фенетидидом 2-ацетилиминокумарин-3-карбоновой кислоты (Iб), которые получают взаимодействием салицилового альдегида с 2,4-ксилидидом или м-фенетидидом циануксусной кислоты, образовавшиеся при этом, соответственно, 2,4-ксилидид 2-иминокумарин-3-карбоновой кислоты (IIа) и м-фенетидид 2-иминокумарин-3-карбоновой кислоты (IIб), ацетилируют уксусным ангидридом.
Изобретение иллюстрируется следующими примерами.
Пример 1. 2,4-Ксилидид 2-иминокумарин-3-карбоновой кислоты IIа. Смесь 1,22 г (0,01 моль) салицилового альдегида, 1,88 (0,01 моль) 2,4-ксилидида циануксусной кислоты 5 кап пиперидина кипятят в 15 мл этанола в течение 1,5 ч. Выпавший после охлаждения реакционной массы осадок отделяют, промывают эфиром, кристаллизуют из диоксана. Получают 2,74 г (94%) IIа. Т.пл. 203-204oС. Найдено, %: С 73,8; Н 5,6; N 9,7. С18H16N2O2. Вычислено, %: С 74,0; Н 5,5; N 9,6.
Пример 2. м-Фенетидид 2-иминокумарин-3-карбоновой кислоты IIб. Смесь 1,22 г (0,01 моль) салицилового альдегида, 2,04 (0,01 моль) м-фенетидида циануксусной кислоты 5 кап пиперидина кипятят в 15 мл этанола в течение 1,5 ч. Выпавший после охлаждения реакционной массы осадок отделяют, промывают эфиром, кристаллизуют из диоксана. Получают 2,12 г (69%) IIб. Т.пл. 164-166oС. Найдено, %: С 70,3; Н 5,3; N 9,1. С18Н16N2O3. Вычислено, %: С 70,1; Н 5,2; N 9,1.
Пример 3. 2,4-Ксилидид 2-ацетилиминокумарин-3-карбоновой кислоты Iа. Растворяют при слабом нагревании (40-50oC) 2,92 г (0,01 моль) 2,4-ксилидида 2-иминокумарин-3-карбоновой кислоты в 40 мл уксусного ангидрида. Оставляют при комнатной температуре, через несколько минут выпадает обильный осадок. Реакционную массу выдерживают при 20oС в течение 12 ч, разбавляют водой, осадок отфильтровывают, кристаллизуют из диоксана. Получают 2,96 г (92%) соединения Iа. Т.пл. 223-225oС. Найдено, %: С 74,3; Н 6,4; N 8,3, C20H22N2O3. Вычислено, %: С 71,0; Н 6,5; N 8,3.
Пример 4. м-Фенетидид 2-ацетилиминокумарин-3-карбоновой кислоты Iб. Растворяют при слабом нагревании (40-50oC) 3,08 г (0,01 моль) м-фенетидида 2-иминокумарин-3-карбоновой кислоты в 40 мл уксусного ангидрида. Оставляют при комнатной температуре, через несколько минут выпадает осадок. Реакционную массу выдерживают при 20oС в течение 12 ч, разбавляют водой, осадок отфильтровывают, кристаллизуют из диоксана. Поучают 3,25 г (93%) соединения Iб. Т. пл. 207-209oС. Найдено, %: С 68,6; Н 5,3; N 8,2, С20Н18N2O4. Вычислено, %: С 68,6; Н 5,1; N 8,0.
Строение соединений Iа, б и IIа, б подтверждено данными ИК, ПМР спектроскопии. В ИК-спектрах соединений Iа, б имеются полосы при 1680, 1710 см-1 (СО), 3230 см-1 (NH). В спектрах ПМР соединений Iа, б присутствуют: синглет при 2,33 м.д. (3HСН3), мультиплет с центром при 7,5 м.д. (Н аром. кольца) и уширенный сигнал при 10,7 м.д. (IН NН).
В ИК-спектрах IIа, б наблюдаются полосы при 1680-1690 см-1 (СО) 3330-3400 см-1(=NН), 3420 см-1 (NН).
Заявляемые соединения были исследованы на наличие у них антикоагулянтной активности. В качестве эталона сравнения использован неодикумарин. Опыты проведены на крысах обоего пола массой 180-200 г. Все вещества вводили через рот в желудок с помощью зонда в виде взвеси в 2% крахмальной слизи. Каждую дозу вводили в течение 2 дней с интервалами в 24 ч. Антикоагулянты непрямого действия, к которым относится неодикумарин, уменьшают содержание протромбина в крови. Показателем антикоагулянтной активности является изменение протромбинового индекса и увеличение времени образования сгустка крови. В начале эксперимента и после окончания введения соединений определяли у каждого животного протромбиновое время и протромбиновый индекс с помощью метода Квика в модификации Кудряшова (Козловская Л.В., Николаев А.Ю. Пособие по клиническим лабораторным методам исследования. М.: Медицина, 1985, с. 86; Фармакол. и токсикол. 1954, 3, с. 34-40). Для этого часовое стекло нагревали на водяной бане до +37oС, в лунку стекла вводили 0,1 мл суспензии тромбопластина и 0,1 мл 0,277% раствора хлорида кальция. В микропипетку на 0,1 мл набирали 0,01 мл 1,34% раствора оксалата натрия и до 0,1 мл крови, полученной из хвостовой вены крысы. Смесь выдували на часовое стекло и включали секундомер, через определенное время появлялись нити фибрина и образовывался сгусток крови. Для определения протромбинового индекса контрольное время образования сгустка до введения антикоагулянта делили на время, полученное после применения антикоагулянтов. Результаты выражали в процентах.
Для получения взвеси 50 мг сухого тромбопластина из кадаверного мозга (Кировский НИИГДК) тщательно растирали с 5 мл дистиллированной воды. После центрифугирования надосадочную жидкость использовали для определения протромбинового времени.
Исследовали по 4 дозы каждого соединения. С использованием пробитного метода Литчфильда и Уилкоксона (Беленький М.Л. Элементы количественной оценки фармакологического эффекта, Л. 1963, с. 152) находили среднюю эффективную дозу ЕД50 соединения в мг/кг, вызывающую снижение содержания протромбина в крови животных на 50%.
Острую токсичность заявляемых соединений и неодикумарина изучали в опытах на белых мышах обоего пола массой 16-20 г по Г.Н.Першину (Першин Г.Н. Методы экспериментальной химиотерапии. М.: Медицина, 1959, с. 456-462). Каждую дозу вводили внутрибрюшинно в виде взвеси в 2% крахмальной слизи, а также с помощью зонда в желудок животных. По Литчфильду и Уилкоксону вычисляли ЛД50 в мг/кг.
Результаты исследований представлены в таблице.
Из таблицы видно, что заявляемые соединения значительно менее токсичны по сравнению с неодикумарином и имеют практически одинаковую токсичность по сравнению с п-толуидидом 2-ацетилиминокумарин-3-карбоновой кислоты.
Оба соединения вызывают снижение концентрации протромбина в крови на 50% в дозах меньших, чем эталон сравнения. Индекс антикоагулянтного действия, характеризуемый отношением показателей ЛД50 и ЕД50 их в 5 и 5,8 раза больше, чем у неодикумарина. Широта терапевтического действия у заявляемых соединений больше, чем у неодикумарина.
Заявляемые соединения перспективны как антикоагулянты непрямого действия, превосходящие эталон по активности и обладающие меньшей токсичностью, и могут найти применение в медицине в качестве антикоагулянтов непрямого действия.

Изобретение относится к новым соединениям - 2,4-ксилидиду и м-фенетидиду 2-ацетилиминокумарин-3-карбоновой кислоты общей формулы 1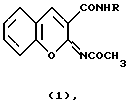 ,
,
где Iа) R=2,4-(СН3)2С6Н3; Iб) R=м-С2Н5ОС6Н4, которые обладают антикоагулянтной активностью и могут быть использованы в медицине. Технический результат - индекс антикоагулянтного действия их в 5 и 5,6 раза больше, чем у некодикумарина - известного препарата. Соединения менее токсичны по сравнению с неодикумарином в 3,4 и 3,16 раза соответственно. 1 табл.
2,4-Ксилидид и м-фенетидид 2-ацетилиминокумарин-3-карбоновой кислоты общей формулы 1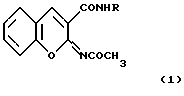
где Iа) R= 2,4-(СН3)2С6Н3; Iб) R= м-С2Н5OС6Н4,
обладающие антикоагулянтной активностью.
| US 4782083 А, 01.11.1988 | |||
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ АДДИТИВНЫЕ СОЛИ КИСЛОТЫ, ИЛИ N-ОКСИД ГЕТЕРОЦИКЛИЧЕСКОГО СОЕДИНЕНИЯ, ИЛИ ЕГО АДДИТИВНАЯ СОЛЬ КИСЛОТЫ | 1992 |
|
RU2047614C1 |
| ПРОИЗВОДНЫЕ ХРОМАНА ИЛИ ТИОХРОМАНА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ) | 1990 |
|
RU2092483C1 |
Авторы
Даты
2002-11-27—Публикация
2001-05-16—Подача