Изобретение относится к методам аналитического определения кислот, кислых солей, других веществ, имеющих кислую реакцию и реагирующих со щелочами, а именно к методу титрования, используемого как в учебном процессе, так и на производстве.
Наиболее близким аналогом по достигаемому эффекту является способ определения кислотности (ГОСТ 5898-87 Изделия кондитерские. Методы определения кислотности и щелочности), заключающийся в следующем.
Навеску исследуемого продукта помещают в сухую коническую колбу определенного объема. Приливают дистиллированную воду (при необходимости нагретую до температуры 60-70°С) перемешивают, охлаждают до температуры 20 (±5)°С, при необходимости выдерживают определенное время и фильтруют.
Определенный объем фильтрата или растворенного продукта титруют (NaOH или КОН) при добавлении 2-3 капель фенолфталеина до слаборозового окрашивания.
При потенциометрическом определении кислотности в подготовленную пробу исследуемого продукта опускают электроды потенциометра и проводят титрование, определяя величину рН. При этом за точку окончания титрования принимают величину рН 7,0-7,2.
Недостатки данного метода:
1. Достаточно большой расход щелочей (гидрооксида натрия или калия) и, как следствие, повышение стоимости проведения анализа.
2. При определении кислотности титруют 0.1 н. раствором щелочи до показания потенциометра рН 8,5 (точка перехода индикатора фенолфталеина), при этом происходит перетитровывание исследуемого раствора и необходима последующая нейтрализация отходов, которые ухудшают экологию окружающей среды при их утилизации.
3. При приготовлении и использовании щелочей возникает необходимость точного соблюдения техники безопасности, что не всегда осуществляется в учебном и производственном процессах.
Технической задачей изобретения является удешевление проведения анализа, улучшение экологии окружающей среды, повышение безопасности условий труда.
Поставленная задача достигается тем, что в методе определения кислотных чисел пищевых и непищевых веществ, включающем взвешивание, растворение в дистиллированной воде навески вещества или отмеривание определенного объема жидкого вещества, его титрование с использованием щелочных титрантов, определение точки эквивалентности с помощью рН-метра, новым является то, что в качестве титранта используют электрохимически активированную щелочную воду с рН 11,9-12,1, в которую перед активацией добавляют 0,1% NaCl.
Технический результат заключается в том, что предлагаемый метод определения кислотности позволит решить проблемы экологии окружающей среды, устранить постоянные затраты на использование и приготовление растворов щелочи, повысить условия безопасности труда.
Способ реализуется следующим образом:
В 1 литр водопроводной воды добавляли 1 г NaCl. Далее проводили активацию 0.1% раствора NaCl в электрохимическом активаторе в катодной зоне в течение 5 мин при токе 3,8 А и напряжении от 60 до 80 В. Электрохимически активированную щелочную воду получали в установке периодического действия. В качестве электродов использовали окисно-рутениевый титановый анод (ОРТА).
В полученной электрохимически активированной щелочной воде определяли показатели рН и окислительно-восстановительного потенциала (Е).
Полученную электрохимически активированную щелочную воду с различными рН и окислительно-восстановительным потенциалом титровали 0,1 н. раствором НСl до нейтрального значения рН.
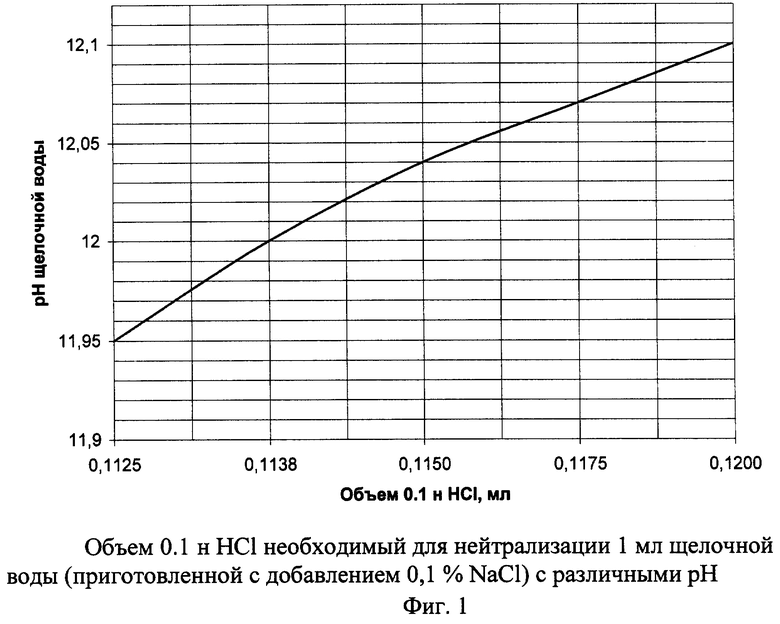
По результатам титрования рассчитали объем 0,1 н раствора НСl, необходимого для нейтрализации 1 мл электрохимически активированной щелочной воды (приготовленной с добавлением 0,1% NaCl) с различными рН. Результаты титрования представлены на графике (фиг.1).
Исходя из того, что на титрование 1мл 0,1 н. раствора NaOH (приготовленного из фиксанала) идет 1 мл 0,1 н. раствора НСl, по графику (фиг.1) определяем эквивалентность между щелочной водой и 0,1 н. раствором NaOH.
При рН щелочной воды меньше 11,9 значительно увеличивается соотношение щелочная вода / 0.1 н раствор NaOH
Величину рН больше 12,1 можно получить только увеличением концентрации NaCl в растворе, что экономически нецелесообразно.
Следовательно, приведенные выше параметры являются наиболее рациональными.
Метод подтверждается примерами:
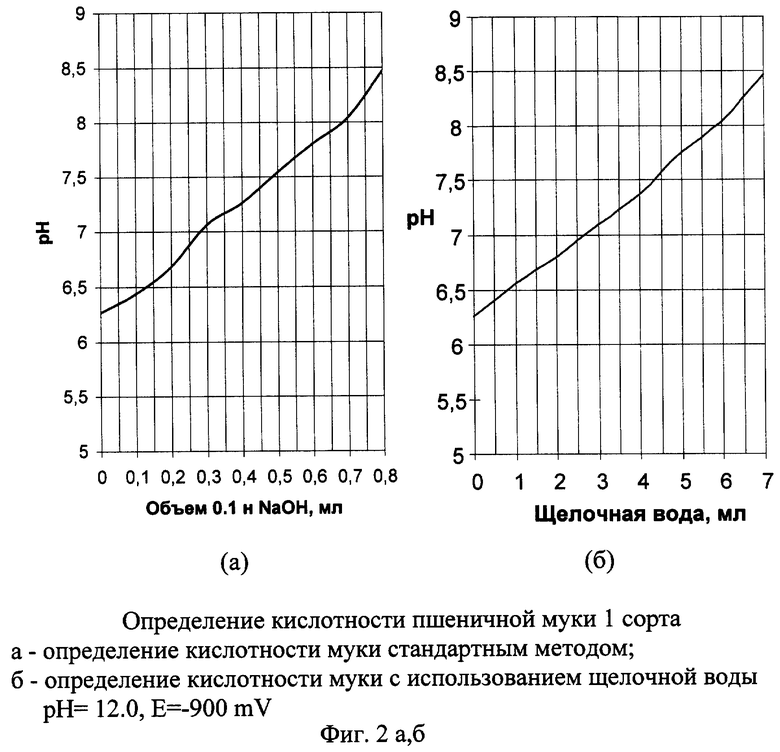
Пример 1а. Определение кислотности муки стандартным методом.
Взвешивают на технических весах 5 г муки с точностью ±0,01 г и количественно переносят ее в сухую коническую колбу вместимостью 100-150 см3, в которую затем наливают 50 см3 дистиллированной воды. Содержимое колбы немедленно перемешивают, взбалтывая до исчезновения комочков муки. Приставшие к стенкам частички муки смывают из промывалки. Затем добавляют 5 капель 1% раствора фенолфталеина и титруют 0,1 н. раствором NaOH до получения слабо-розового окрашивания, не исчезающего в течение 1 мин. При титровании параллельно производят измерение рН на рН-метре и по результатам титрования строят зависимость рН от количества добавляемого 0,1 н. раствора NaOH (фиг 2.а).
Кислотность муки (град) вычисляем по формуле:
K=2*V
где К - кислотность град.;
V - объем 0.1 н. NaOH, израсходованной на титрование. При трех параллельных опытах получили следующие значения кислотности:
K1=1,6 град; К2=1,5 град; К3=1,6 град
Расхождение между параллельными опытами не превышает 0,2 град, что соответствует требованиям стандарта.
Пример 1б. Определение кислотности муки с использованием электрохимически активированной щелочной воды
Титрование производим аналогично примеру 1а, заменяя 0,1 н. раствор NaOH электрохимически активированной щелочной водой с рН 12.0, Е=-900 mV. Получаем аналогичную графическую зависимость (фиг 2б).
Кислотность муки (град) вычисляем по формуле:
K=0,11375·2·V
где К - кислотность град.;
V - объем электрохимически активированной щелочной воды, израсходованной на титрование;
0,11375 - коэффициент эквивалентности (коэффициент соотношения
щелочная вода / 0,1 н. раствор NaOH).
При трех параллельных опытах получили следующие значения кислотности:
K1=1,6 град; К2=1,7 град; К3=1,6 град
Расхождение между параллельными опытами не превышает 0,2 град.
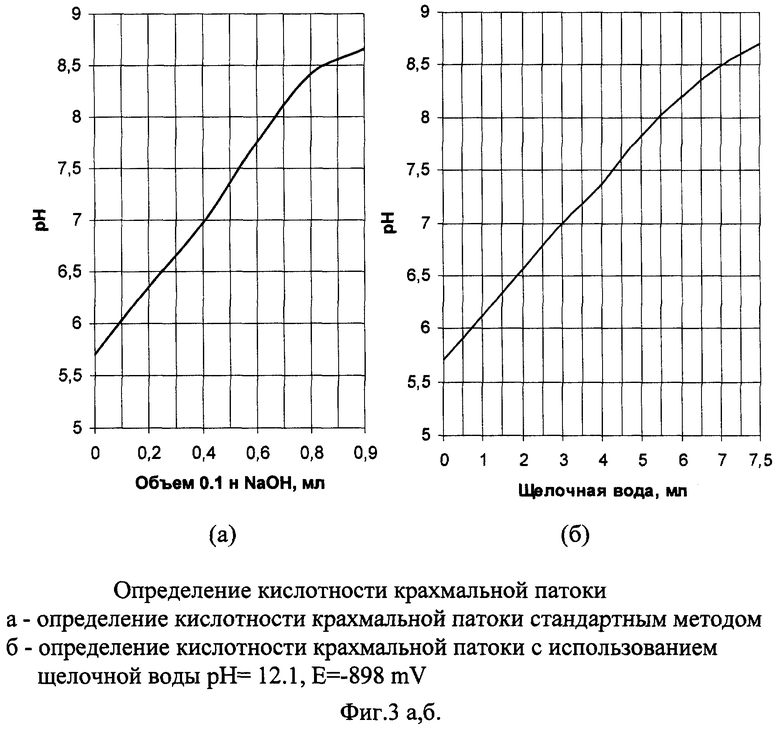
Пример 2а.
Кислотность крахмальной патоки стандартным методом
Для проведения анализа готовим основной раствор патоки. Навеску патоки массой 50 г с точностью ±0,01 г количественно переносят с помощью горячей дистиллированной воды в мерную колбу 250 см3. Раствор в колбе охлаждают, доливают дистиллированной водой до метки и тщательно перемешивают.
Для определения кислотности отмеривают пипеткой в коническую колбу 100 см3 основного раствора, вводят 3-5 капель фенолфталеина и титруют 0.1 н. раствором NaOH до заметной слабо-розовой окраски. При титровании параллельно производят измерение рН на рН-метре и по результатам титрования строят зависимость рН от количества добавляемого 0,1 н. раствора NaOH (фиг 3а)
Результат анализа пересчитывают на 100 г. сухого вещества патоки.
Кислотность (град) вычисляем по формуле:
K=500·V/CB
где К - кислотность град.;
V - объем 0.1 н. NaOH, израсходованной на титрование;
СВ - сухие вещества патоки, %.
При трех параллельных опытах получили следующие значения кислотности:
K1=5,8 град; К2=6,1 град; К3=5,8 град
Расхождение между параллельными опытами не превышает 0,3 град, что соответствует требованиям стандарта.
Пример 2б.
Кислотность крахмальной патоки с использованием электрохимически активированной щелочной воды.
Титрование производим аналогично примеру 2а, заменяя 0,1 н. раствор NaOH электрохимически активированной щелочной водой с рН 12.1, Е=-898 mV. Получаем аналогичную графическую зависимость (фиг. 3б).
Кислотность (град.)вычисляем по формуле:
K=0,1200·500·VCB
где К - кислотность град.;
V - объем электрохимически активированной щелочной воды, израсходованной на титрование;
0,1200 - коэффициент эквивалентности (коэффициент соотношения
щелочная вода / 0.1 н. раствор NaOH).
При трех параллельных опытах получили следующие значения кислотности:
K1=6,1 град; К2=5,8 град; К3=5,8 град.
Расхождение между параллельными опытами не превышает 0,3 град.
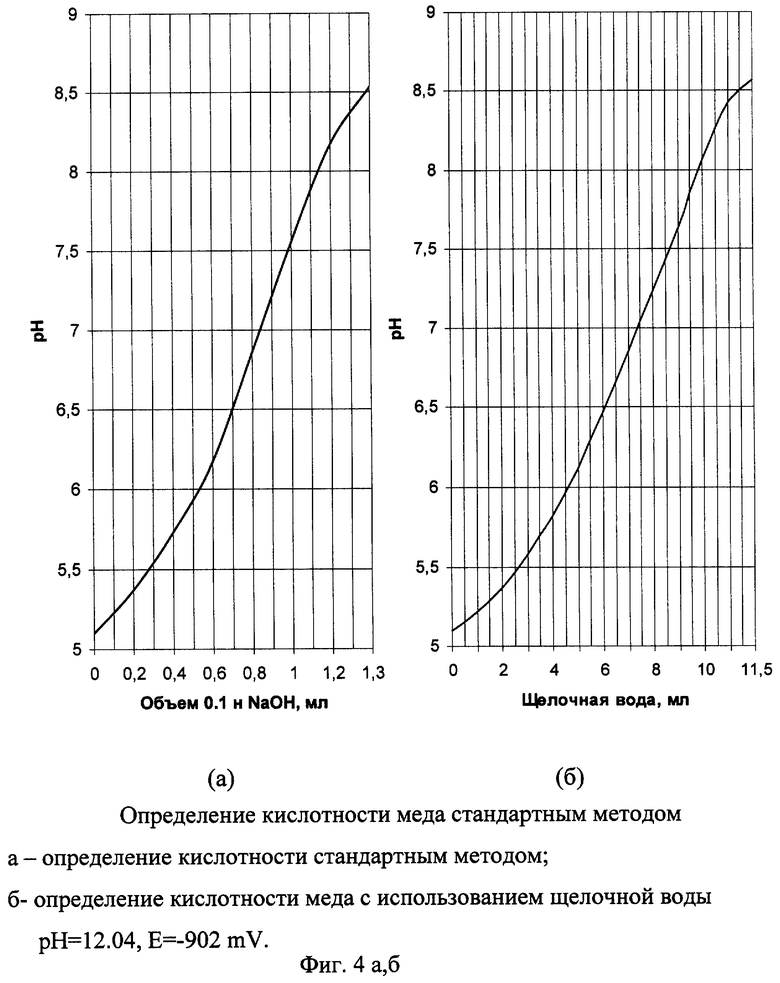
Пример 3а. Определение кислотности меда стандартным методом. Навеску меда массой 5 г взятую с точностью до ±0.01 г, растворяют в дистиллированной воде. Вносят 2-3 капли раствора фенолфталеина и титруют 0,1 н. раствором NaOH до розового окрашивания, не исчезающего в течение 1 мин. При титровании параллельно производят измерение рН на рН-метре и по результатам титрования строят зависимость рН от количества добавляемого 0,1 н. раствора NaOH (фиг 4а). Кислотность (град) вычисляем по формуле:
K=2·V
где К - кислотность град.;
V - объем 0.1 н. NaOH, израсходованной на титрование;
При трех параллельных опытах получили следующие значения кислотности:
K1=2,6 град.; K2=2,7 град.; К3=2,6 град.
Расхождение между параллельными опытами не превышает 0,2 град, что соответствует требованиям стандарта.
Пример 3б.
Кислотность меда с использованием электрохимически активированной щелочной воды
Титрование производим аналогично примеру 1а, заменяя 0,1 н. раствор NaOH электрохимически активированной щелочной водой с рН 12.04, Е=-902 mV. Получаем аналогичную графическую зависимость (фиг 4б).
Кислотность (град) вычисляем по формуле:
K=0,1150·2·V
где К - кислотность град.;
V - объем электрохимически активированной щелочной воды, израсходованной на титрование;
0,1150 - коэффициент эквивалентности (коэффициент соотношения щелочная вода / 0.1 н. раствор NaOH).
При трех параллельных опытах получили следующие значения кислотности:
K1=2,64 град; К2=2,76 град; К3=2,64 град
Расхождение между параллельными опытами не превышает 0,2 град.
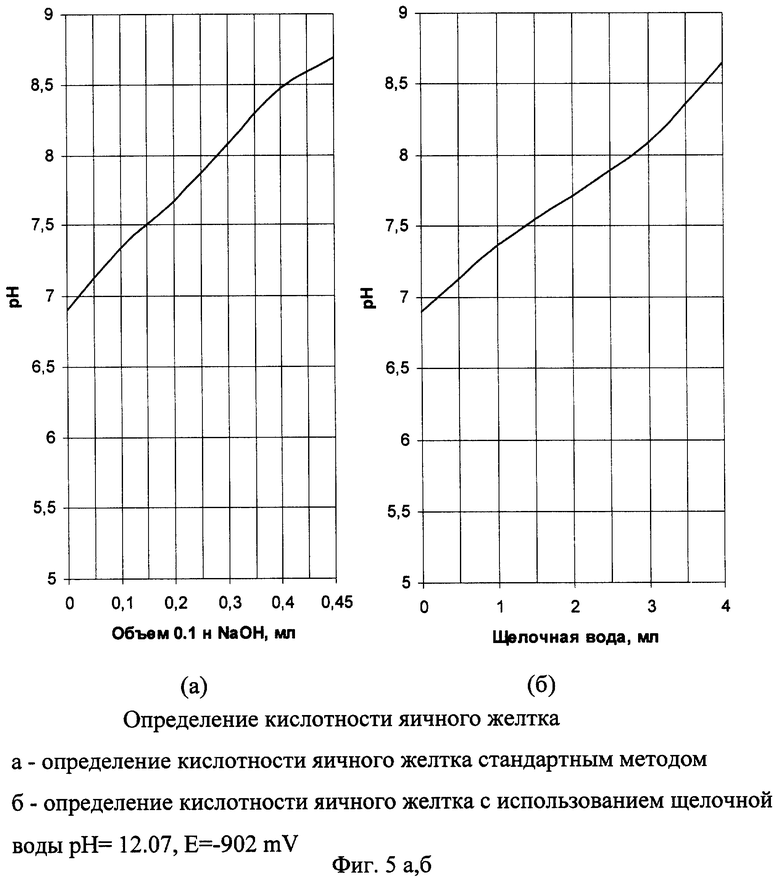
Пример 4а. Определение кислотности яичного желтка стандартным методом.
Навеску яичного желтка массой 20 г при помощи дистиллированной воды переносят в мерную колбу вместимостью 250 см3, доводят объем жидкости в колбе до метки и взбалтывают. Отмеривают пипеткой 25 см3 раствора в колбу для титрования и титруют в присутствии фенолфталеина 0,1 н. раствором NaOH до слабо-розового окрашивания. При титровании параллельно производят измерение рН на рН-метре и по результатам титрования строят зависимость рН от количества добавляемого 0,1 н. раствора NaOH (фиг 5а).
Кислотность (град) вычисляем по формуле:
K=0,5·V
где К - кислотность град.;
V - объем 0.1 н. NaOH, израсходованной на титрование;
При трех параллельных опытах получили следующие значения кислотности:
K1=0,22 град.; К2=0,20 град.; К3=0,22 град.
Расхождение между параллельными опытами не превышает 0,02 град., что соответствует требованиям стандарта.
Пример 4б.
Кислотность яичного желтка с использованием электрохимически активированной щелочной воды.
Титрование производим аналогично примеру 1а, заменяя 0,1 н. раствор NaOH электрохимически активированной щелочной водой с рН 12.07, Е=-902 mV. Получаем аналогичную графическую зависимость (фиг 5б).
Кислотность (град) вычисляем по формуле:
K=0,1175·0,5·V
где К – кислотность град.;
V - объем электрохимически активированной щелочной воды, израсходованной на титрование;
0,1175 - коэффициент эквивалентности (коэффициент соотношения щелочная вода / 0.1 н. раствор NaOH).
При трех параллельных опытах получили следующие значения кислотности:
K1=0,235 град.; К2=0,235 град.; К3=0,235 град.
Расхождения между параллельными опытами не наблюдалось.
Пример 5а.
Определение кислотности молока стандартным методом.
В коническую колбу отмеривают 10 см3 молока и 20 см3 дистиллированной воды (свежепрокипяченной для удаления CO2 и охлаждают до комнатной температуры). Тщательно перемешивают, вводят 2-3 капли фенолфталеина и титруют 0,1 н. раствором NaOH до появления слабо-розового окрашивания, соответствующего контрольному эталону окраски и не исчезающего в течение 1 мин. При титровании параллельно производят измерение рН на рН-метре и по результатам титрования строят зависимость рН от количества добавляемого 0,1 н. раствора NaOH (фиг. 6а).
Кислотность (град.) вычисляем по формуле:
K=10·V
где К - кислотность град.;
V - объем 0.1. н NaOH, израсходованной на титрование;
При трех параллельных опытах получили следующие значения кислотности:
K1=13,5 град.; К2=13 град.; К3=13,5 град.
Расхождение между параллельными опытами не превышает 1 град, что соответствует требованиям стандарта.
Пример 5б.
Кислотность молока с использованием электрохимически активированной щелочной воды
Титрование производим аналогично примеру 1а, заменяя 0,1 н. раствор NaOH электрохимически активированной щелочной водой с рН 11.95, Е=-892 mV. Получаем аналогичную графическую зависимость (фиг 6б).
Кислотность (град.) вычисляем по формуле:
K=0,1125·2·V
где К - кислотность град.;
V - объем электрохимически активированной щелочной воды, израсходованной на титрование;
0,1125 - коэффициент эквивалентности (коэффициент соотношения щелочная вода / 0.1 н. раствор NaOH).
При трех параллельных опытах получили следующие значения кислотности:
K1=14 град.; К2=14 град.; К3=14 град.
Расхождения между параллельными опытами не наблюдалось.
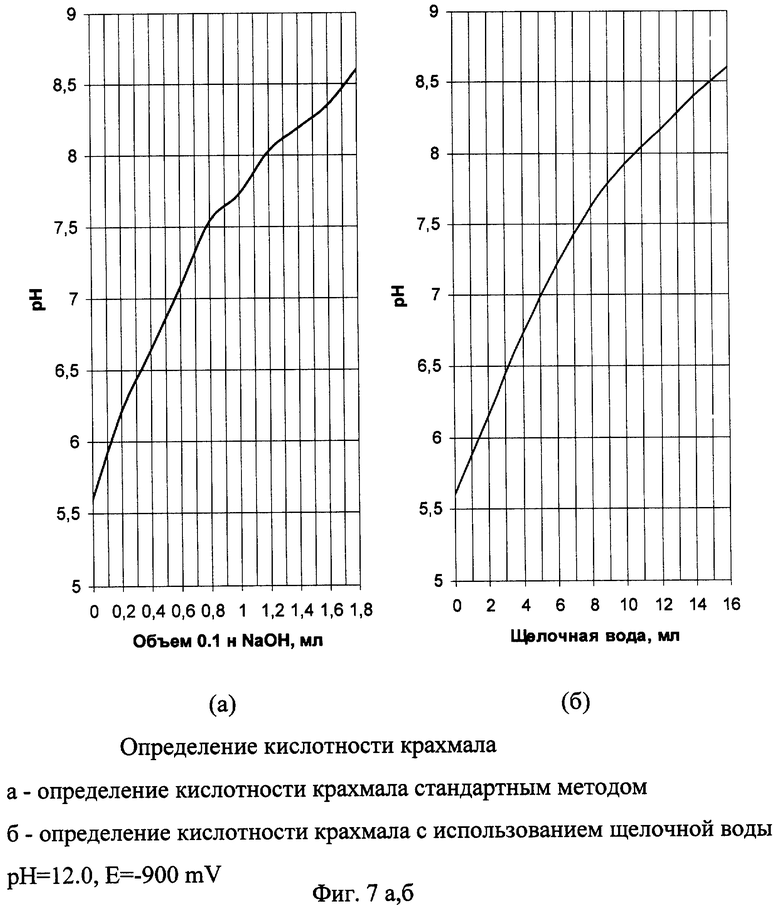
Пример 6а.
Кислотность крахмала стандартным методом
В коническую колбу взвешивают навеску крахмала массой 20 г с точностью до 0,01 г, отмеривают цилиндром 100 см3 дистиллированной воды, прибавляют 5-8 капель фенолфталеина и титруют 0.1 н. раствором до розовой окраски, не исчезающей в течение 1 мин. Так как крахмал адсорбирует фенолфталеин, то перед концом титрования добавляют еще 5-6 капель фенолфталеина. При титровании параллельно производят измерение рН на рН-метре и по результатам титрования строят зависимость рН от количества добавляемого 0,1 н. раствора NaOH (фиг 7а).
Кислотность(град) 0.1 н раствора в 100 г сухого вещества крахмала вычисляем по формуле:
K=100*100*V/(m*CB)
где К - кислотность град.;
V - объем 0.1 н. NaOH, израсходованной на титрование;
m - масса навески крахмала, г;
СВ - содержание сухих веществ, %.
При трех параллельных опытах получили следующие значения кислотности:
K1=10,7 град.; К2=10,7 град; К3=10,7 град.
Расхождения между параллельными опытами не наблюдалось.
Пример 6б.
Кислотность крахмала с использованием электрохимически активированной щелочной воды.
Титрование производим аналогично примеру 1а, заменяя 0,1 н. раствор NaOH щелочной водой с рН 12.0, Е=-900 mV. Получаем аналогичную графическую зависимость (фиг. 7б).
Кислотность (град) вычисляем по формуле:
K=0,1137*2*V
где К - кислотность град.;
V - объем электрохимически активированной щелочной воды, израсходованной на титрование;
0,1137 - коэффициент эквивалентности (коэффициент соотношения щелочная вода / 0.1 н. раствор NaOH).
При трех параллельных опытах получили следующие значения кислотности:
K1=10,8 град.; К2=11,2 град.; К3=10,8 град.
Расхождение между параллельными опытами не превышает 0,3 град.
Анализируя полученные закономерности, можно сделать вывод о том, что расхождения между значениями кислотности полученными стандартными методами и методами с использованием электрохимически активированной щелочной воды не превышают требуемых стандартов. Коэффициент эквивалентности (коэффициент соотношения щелочная вода / 0.1 н. раствор NaOH) варьируется в небольшом интервале значений (0,1125-0,1200), следовательно, если не требуется высокая точность анализа, то коэффициент эквивалентности можно брать усредненный (0,1162). В случае необходимости более точного значения кислотности коэффициент эквивалентности подбирается по кривой на фиг. 1.
Как видно из вышеперечисленных примеров, использование данного метода позволяет снизить стоимость проведения анализа, улучшить экологию окружающей среды, повысить безопасность условий труда.
| название | год | авторы | номер документа |
|---|---|---|---|
| МЕТОД ОПРЕДЕЛЕНИЯ ЩЕЛОЧНОСТИ ПИЩЕВЫХ И НЕПИЩЕВЫХ ВЕЩЕСТВ | 2003 |
|
RU2234698C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ МАССОВОЙ ДОЛИ ОСНОВНОГО ВЕЩЕСТВА МЕТИЛФОСФОНОВОЙ КИСЛОТЫ ТИТРИМЕТРИЧЕСКИМ МЕТОДОМ | 2007 |
|
RU2365914C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АЛЮМИНАТА, ГИДРОКСИДА И КАРБОНАТА НАТРИЯ В РАСТВОРАХ АЛЮМИНАТА НАТРИЯ | 1992 |
|
RU2043627C1 |
| Кислотно-основные индикаторы | 1990 |
|
SU1760445A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АЗОТА В БИОЛОГИЧЕСКИХ ОБРАЗЦАХ | 1999 |
|
RU2156458C1 |
| Способ комплексного анализа материальных образцов | 1991 |
|
SU1786428A1 |
| Способ количественного определения концевых групп полиамидов | 1978 |
|
SU763788A1 |
| Способ контроля натуральности мандариновых соков | 1990 |
|
SU1793372A1 |
| Способ количественного определения концевых групп полиамидов | 1978 |
|
SU777571A1 |
| 3,3'-ЗАМЕЩЕННЫЕ ТРИФЕНИЛМЕТАНОВЫЕ КРАСИТЕЛИ В КАЧЕСТВЕ КИСЛОТНО-ОСНОВНЫХ ИНДИКАТОРОВ | 2000 |
|
RU2176654C1 |

Изобретение относится к методам аналитического определения кислот, кислых солей, других веществ, имеющих кислую реакцию и реагирующих со щелочами, а именно к методу титрования, используемого как в учебном процессе, так и на производстве. В методе определения кислотных чисел пищевых и непищевых веществ, включающем взвешивание, растворение в дистиллированной воде навески вещества или отмеривание определенного объема вещества, его титрование с использованием щелочных титрантов, определение точки эквивалентности с помощью рН-метра, в качестве титранта используют электрохимически активированную щелочную воду с рН 11,9-12,1 в которую перед активацией добавляют 0,1% NaCl. Предлагаемый метод определения кислотности позволит решить проблемы экологии окружающей среды, устранить постоянные затраты на использование и приготовление растворов щелочи, повысить условия безопасности труда. 7 ил.
Метод определения кислотных чисел пищевых и непищевых веществ, включающий взвешивание, растворение в дистиллированной воде навески вещества или отмеривание определенного объема жидкого вещества, его титрование с использованием щелочных титрантов, определение точки эквивалентности с помощью рН-метра, отличающийся тем, что в качестве титранта используют электрохимически активированную щелочную воду с рН 11,9-12,1, в которую перед активацией добавляют 0,1% NaCl.
| Ускоритель торможения | 1926 |
|
SU5898A1 |
| Методы определения кислотности и щелочности | |||
| Способ определения кислотного числа масла семян масличных культур | 1979 |
|
SU909632A1 |
| Способ подготовки раствора реагента для рН-метрического анализа кислотных чисел жиров | 1987 |
|
SU1688158A1 |
| Способ определения кислотного числа масел и жиров | 1991 |
|
SU1825423A3 |
| Способ определения кислотного числа масла в маслосодержащем материале | 1978 |
|
SU749886A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КИСЛОТНОГО ЧИСЛА РАСТИТЕЛЬНЫХ МАСЕЛ | 1997 |
|
RU2119162C1 |
| СПОСОБ ПОТЕНЦИОМЕТРИЧЕСКОГО ОПРЕДЕЛЕНИЯ КИСЛОТНОГО ЧИСЛА РАСТИТЕЛЬНОГО МАСЛА | 1997 |
|
RU2119161C1 |
| Устройство автоматического определения кислотного числа масла в масличных семенах | 1983 |
|
SU1201768A1 |
| Шпонка для закрепления шкива на валу | 1928 |
|
SU10858A1 |
| Методы испытаний | |||
| СТРОИТЕЛЬНАЯ ПЛИТА | 1926 |
|
SU5476A1 |
| Методы определения кислотного числа. | |||
Авторы
Даты
2005-01-10—Публикация
2003-05-20—Подача