Область техники
Данное изобретение относится к усовершенствованному способу получения гидрохлорида пирлиндола.
Предпосылки к созданию изобретения
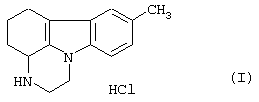
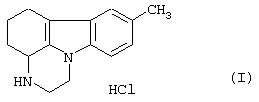
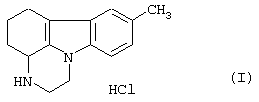
Гидрохлорид пирлиндола (1,10-триметилен-8-метил-1,2,3,4-тетрагидропиразин[1,2-а]индола) формулы (I)
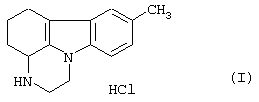
является антидепрессантом, который действует и на возвращение к норме норадреналина, и в качестве ингибитора МАО (моноаминоксидазы) ("Drug of the future". Vol. V, No. 1, pp.39-41, 1980).
Описаны различные способы синтеза этой молекулы, и большинство из них исходны из 6-метил-1,2,3,4-тетрагидрокарбазол-1-она формулы (II)
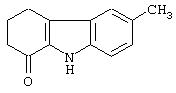
Например, патент Франции 2132514 (на имя Всероссийского научно-исследовательского химико-фармацевтического института имени Серго Орджоникидзе) иллюстрирует способ, исходящий непосредственно из соединения формулы (II), которое, когда его подвергают реакции с щелочным агентом, таким как метоксид или этоксид натрия, и затем с хлор-ацетонитрилом, дает 9-цианометил-6-метил-1,2,3,4-тетрагидрокарбазол-1-он, который путем каталитического гидрирования предпочтительно с никелем Реннея или катализатором Адамса (оксид платины) и последующего осаждения из спиртового или эфирного раствора хлороводородной кислоты приводит к желательному продукту. Очевидно, что указанный способ как по причинам безопасности (хлор-ацетонитрил является чрезвычайно токсичным веществом; никель Реннея является легковзрывчатым веществом), так и по экономическим причинам (катализатор Адамса является исключительно дорогим) не является легким для применения в промышленном масштабе.
Иванов П.Ю. и др., Хим.-Фарм. Ж. (1987), 21(1), стр.71-75 (здесь далее "Иванов и др.") описывает способ, в котором нет этих недостатков. Он также исходит из 6-метил-1,2,3,4-тетрагидрокарбазол-1-она формулы (II), который, когда его подвергают реакции с этаноламином, дает 6-метил-1-(2-гидрокси-имино)-1,2,3,4-тетрагидрокарбазол формулы (III)
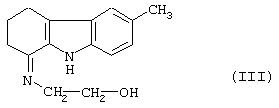
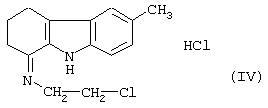
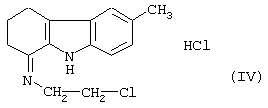
Его вначале превращают в соль с помощью раствора хлороводородной кислоты в этаноле, затем обрабатывают ионилхлоридом, чтобы получить гидрохлорид 6-метил-1-(2-хлорэтил-имино)-1,2,3,4-тетрагидрокарбазола формулы (IV)
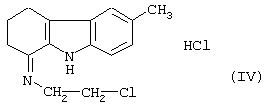
который при восстановлении боргидридом натрия дает гидрохлорид 6-метил-1-(2-хлорэтил-амино)-1,2,3,4-тетрагидрокарбазола формулы (V)
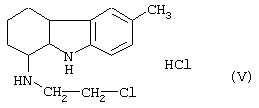
Данное промежуточное соединение подвергают реакции внутримолекулярной циклизации, чтобы получить желаемое соединение. Указанную циклизацию проводят с помощью щелочного агента в водном растворе, например гидроксида натрия, в присутствии катализатора переноса фаз, используя бензол в качестве растворителя для реакции.
Щелочной агент используют в большом избытке: в примере, приведенном в этой статье, сообщается об использовании 50%-ного водного раствора, полученного, исходя из 15 г гидроксида натрия (2,8 моль) по отношению к 9,07 г производного формулы (V) (30 ммоль).
Тот же пример дает количество катализатора фазового переноса 10 мас.% по отношению к тому же производному формулы (V).
Выход конечного продукта этого способа равен 68,4% в расчете на то же промежуточное соединение формулы (IV).
Краткое описание изобретения
В настоящее время найден способ синтеза гидрохлорида пирлиндола, который не только представляет собой промышленно применимую альтернативу известным ранее способам, но также имеет преимущества по отношению к способу, предложенному Ивановым и др., в том, что в нем используют меньшие количества реагентов, все еще достигая того же выхода.
Подробное описание изобретения
Следовательно, данное изобретение относится к процессу синтеза гидрохлорида пирлиндола формулы (I)
характеризующемуся тем, что гидрохлорид 6-метил-1-(2-хлорэтилимино)-1,2,3,4-тетрагидрокарбазола формулы (IV)
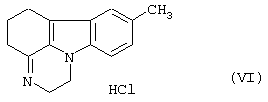
циклизуется, давая 1,2,5,6-тетрагидро-8-метил-пиразин[3,2,1-j,k]-4Н-карбазола формулы (VI)
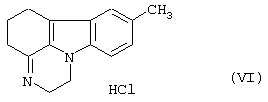
который подвергают восстановлению.
Более конкретно данное изобретение относится к способу, по которому соединение формулы (IV) циклизуют путем обработки щелочным агентом в молярном отношении от 1,5:1 до 3:1 в присутствии катализатора фазового переноса в количестве 3 мас.%, получая соединение формулы (VI), которое затем восстанавливают с получением соединения формулы (1).
Щелочным агентом является карбонат щелочного металла, такой как карбонат натрия или калия, предпочтительно карбонат калия.
Предпочтительно молярное отношение между щелочным агентом и соединением формулы (IV) составляет 2,4:1,1.
Катализатор переноса фаз выбирают из группы, включающей бромид тетрабутиламмония и гидрофосфат тетрабутиламмония. По чисто практическим причинам предпочтительно применение бромида тетрабутиламмония.
Реакция циклизации происходит при температуре между 80 и 140°С, предпочтительно при 120°С, в течение периода приблизительно 3 часов.
Реакция восстановления происходит при температуре между 80 и 120°С, предпочтительно при 100°С, в течение периода приблизительно 5 часов.
Соединение формулы (VI) восстанавливают боргидридом натрия.
Весь процесс изобретения проводят в диметилформамиде, диметилацетамиде или простом монометиловом эфире этиленгликоля, причем предпочитается диметилформамид.
Выход в способ, который составляет предмет данного изобретения, эквивалентен выходу способа Иванова и др., а именно около 70% по отношению к соединению формулы (IV). Конечный продукт получают со степенью чистоты выше, чем 99%.
Как уже было сказано выше, способ данного изобретения предоставляет преимущество, касающееся использования очень уменьшенных количеств и щелочного агента и катализатора переноса фаз реакции внутримолекулярной циклизации, достигая, тем не менее, того же выхода конечного продукта. Более конкретно, количество катализатора переноса фаз составляет более чем вдвое меньше, чем количество, используемое Ивановым и др., в то время как количество щелочного агента, по меньшей мере, в три раза ниже, чем в указанном способе.
Факт уменьшения количества реагентов представляет выгоду не только с экономической точки зрения, но также в отношении условий работы, которые становятся более удобными за счет уменьшения реакционных объемов.
Дальнейшее преимущество данного способа по отношению к способу Иванова и др. заключается в факте замены бензола, растворителя, который является сильно канцерогенным и поэтому проблематичным для применения помимо всего в фармацевтической области по сравнению с диметилформамидом или одним из других растворителей, перечисленных выше. Переход от бензола к диметилформамиду, диметилацетамиду или монометиловому эфиру этиленгликоля не является общепринятым. Обычно наиболее общеизвестной альтернативой бензолу является толуол, поскольку оба растворителя являются высокоаполярными, чего нет в случае с растворителями, которые могут применяться в способе данного изобретения.
Чтобы лучше проиллюстрировать изобретение, ниже даны следующие примеры.
Пример 1
Синтез 1,2,5,6-тетрагидро-8-метил-пиразин[3,2,1-j,k]-4H-карбазола
Гидрохлорид 6-метил-1-(2-хлорэтил-имино)-1,2,3,4-тетрагидрокарбазола (29,7 г, 0,1 моль) растворяют в диметилформамиде (59,4 г), затем добавляют карбонат калия (29,7 г, 0,21 моль) и бромид тетрабутиламмония (0,9 г). Реакционную смесь нагревают до 120-125°С в течение приблизительно 2 часов до тех пор, пока не исчезнет исходный продукт (определение посредством ТСХ). Соли, образовавшиеся в реакционной смеси, отделяют путем фильтрования и полученный раствор используют таким, как он есть в последующей стадии.
Пример 2
Синтез гидрохлорида пирлиндола
К раствору, полученному в примере 1, добавляют боргидрид натрия (3,8 г, 0,1 моль) при 25-30°С и позволяют температуре подняться вплоть до 90-100°С, затем выдерживают при этих величинах до тех пор, пока не исчезнет исходный продукт. При добавлении хлороводородной кислоты образуются кристаллы, которые отделяют путем фильтрования и охлаждают. Полученное твердое вещество подвергают перекристаллизации из смеси вода/втор.-бутанол, получая 18,1 г указанного в заголовке соединения (выход, рассчитанный на гидрохлорид 6-метил-1-(2-хлорэтил-имино)-1,2,3,4-тетрагидрокарбазола: 69,1%). Чистота >99,8% (ЖХВР).
Изобретение относится к усовершенствованному способу синтеза гидрохлорида пирлиндола формулы (I)
характеризующийся тем, что гидрохлорид 6-метил-1-(2-хлорэтил-имино)-1,2,3,4-тетрагидрокарбазола формулы (IV)
циклизуют при температуре 80-140°С с помощью щелочного агента в присутствии катализатора переноса фаз с получением 1,2,5,6-тетрагидро-8-метил-пиразин [3,2,1-j,k]-4Н-карбазола формулы (VI)
который подвергают восстановлению при температуре 80-120°С. Способ обеспечивает получение соединения I с выходом около 70% и со степенью чистоты выше 99% при уменьшенных количествах щелочного агента и катализатора переноса фаз реакции внутри молекулярной циклизации. 6 з.п. ф-лы.
с использованием гидрохлорида 6-метил-1-(2-хлорэтил-имино)-1,2,3,4-тетрагидрокарбазола, отличающийся тем, что гидрохлорид 6-метил-1-(2-хлорэтил-имино)-1,2,3,4-тетрагидрокарбазола формулы (IV)
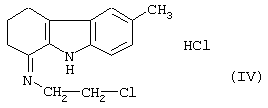
циклизуют при температуре 80-140°C с помощью щелочного агента в присутствии катализатора переноса фаз с получением 1,2,5,6-тетрагидро-8-метил-пиразин[3,2,1-j,k]-4Н-карбазола формулы (VI)
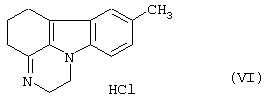
который подвергают восстановлению при температуре 80-120°С.
| Кузнечная нефтяная печь с форсункой | 1917 |
|
SU1987A1 |
| Пуговица для прикрепления ее к материи без пришивки | 1921 |
|
SU1992A1 |
| ПРИБОР ДЛЯ ЗАПИСИ И ВОСПРОИЗВЕДЕНИЯ ЗВУКОВ | 1923 |
|
SU1974A1 |
| Способ получения 1,10-триметилен-8-метил 1,2,3,4-тетрагидропиразино-(1,2- @ )-индола (пиразидола) | 1969 |
|
SU276060A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 5,6-ТРИМЕТИЛЕН-у-ИЗОКАРБОЛИНОВ | 0 |
|
SU192819A1 |
| СПОСОБ ПОЛУЧЕНИЯ ХЛОРГИДРАТА 5,6-ТРИМЕТИЛЕН-2,3,4,5- | 0 |
|
SU194827A1 |
| ЭНЕРГОУСТАНОВКА С КОМБИНИРОВАННЫМ ЦИКЛОМ, ОСНАЩЕННАЯ РЕАКТОРОМ С ЦИРКУЛИРУЮЩИМ ПСЕВДООЖИЖЕННЫМ СЛОЕМ | 1996 |
|
RU2132514C1 |
Авторы
Даты
2005-04-10—Публикация
2000-04-14—Подача