Изобретение относится к микробиологии и может быть использовано в микробиологических лабораториях различного профиля.
К роду микобактерий относится более 100 видов, но в диагностическом материале, выделяемом от больных, обычно определяют 10-12 видов. Основным этиологическим фактором в возникновении туберкулеза являются микобактерии туберкулеза человеческого вида, хотя в ряде случаев имеет место выделение микобактерий бычьего вида и нетуберкулезных, являющихся причиной микобактериозов. Установление видовой принадлежности микобактерий, выделенных из диагностического материала, необходимо для исключения диагноза микобактериоза, а также для установления возможного источника инфицирования [Методические рекомендации МЗ РФ «Современные методы лабораторной диагностики туберкулеза», М. - 1992]. Поэтому идентификация микобактерий вирулентных видов является одним из обязательных этапов диагностики. В настоящее время для видовой диагностики микобактерий применяют комплексные исследования, состоящие из микробиологических, биохимических, биологических и иммунологических методов. Отсутствие простого и точного метода определения видовой принадлежности микобактерий приводит иногда к ошибочным заключениям. Поэтому для дифференциации микобактерий и определения видов в пределах этого обширного рода необходимо применение специальных методик [Методические рекомендации «Бактериологическая и биохимическая идентификация микобактерий». Ленинград - 1980].
Известен способ определения видовой принадлежности микобактерий хроматографическим методом, основанным на обнаружении липидов, присущих только данному виду микобактерий [Методические рекомендации МЗ РФ «Современные методы лабораторной диагностики туберкулеза». М. - 1992, стр.18-20]. В этом способе производят получение и очистку липидного экстракта исследуемой культуры, затем получение хроматограмм в различных системах растворителей и видовую идентификацию исследуемой культуры путем сравнения с «банком» хроматограмм различных видов микобактерий. Недостатком данного метода является необходимость использования специального дорогостоящего оборудования, а также токсичных реактивов.
Наиболее близким решением технической задачи данного назначения к заявляемому изобретению является способ определения видовой принадлежности микобактерий, включающий культуральные и биохимические исследования по культуральным характеристикам путем посева материала, культивирования и учета результата [Приказ МЗ РФ от 21.03.2003 №109 «О совершенствовании противотуберкулезных мероприятий в Российской Федерации». М., стр.275]. При данном способе производится посев взвеси микобактерий на питательные среды, культивирование и учет результатов. При этом взвесь микобактерий засевают на питательные среды без препаратов либо содержащие различные препараты (салициловокислый натрий, пиразинамид, мочевину и т.д.), а также к взвеси микобактерий добавляют различные реактивы (ниациновый тест, тест на нитратредуктазу и т.д.). Учет результатов проводят по отсутствию (наличию) роста на питательных средах с препаратами или по изменению цвета окраски растворов. Этот способ является трудоемким, так как включает в себя множество различных тестов, при этом результаты биохимических исследований зачастую оказываются противоречивыми.
В основу изобретения положена задача повышения точности и достоверности исследований по определению видовой принадлежности микобактерий путем определения циклов роста культур.
Поставленная задача решается тем, что при определении видовой принадлежности микобактерий путем приготовления взвеси микобактерий, последующего посева на питательную среду, культивирования и учета результатов посев осуществляют отдельными равными порциями взвеси, взятыми через определенный интервал времени, а учет результатов осуществляют одновременно во всех посевах путем сопоставления полученных данных со стандартными номограммами роста лабораторных штаммов микобактерий. При этом взвесь микобактерий готовят в дистиллированной воде, разводят ее до концентрации 10×10-5 по стандарту мутности ГИСК, посев порций взвеси микобактерий осуществляют на среду «Новая» в течение 6 часов с интервалом между посевами 12±3 мин. Для учета результатов строят номограммы цикличности роста лабораторных штаммов микобактерий и сопоставляют данные по выходу микробной массы исследуемой культуры с данными номограмм в соответствующие интервалы времени.
Посев отдельными равными порциями микробной взвеси через определенный интервал времени с последующим одновременным учетом результатов позволяет за счет разности величин микробной массы определить степень интенсивности роста каждой порции микобактерий, что повышает точность исследований.
Приготовление взвеси микобактерий на дистиллированной воде уменьшает влияние остаточных питательных веществ и продуктов жизнедеятельности микобактерий, что повышает достоверность исследований. В то же время в инертной среде (дистиллированной воде) сохраняется способность микобактерий к цикличному размножению. Приготовление взвеси микобактерий в разведении 10×10-5 по стандарту мутности ГИСК позволяет получить рост изолированных колоний, что обеспечивает точность при подсчете количества выросших на питательной среде микобактерий.
Посев порций взвеси микобактерий на среду «Новая» в силу ее высоких питательных свойств позволяет учитывать результат в более короткие сроки. Посев порций взвеси микобактерий производится в течение 6 часов, так как в течение этого времени происходят основные изменения цикличности роста микобактерий. Посев порций взвеси микобактерий с интервалом между посевами 12±3 мин позволяет выявить характеристические точки в графике динамики изменения цикличности роста микобактерий. Циклы роста туберкулезных микобактерий различных видов различаются между собой, а также значительно отличаются от таковых у нетуберкулезных микобактерий. Сопоставление данных, полученных при исследовании культуры микобактерий, с данными номограмм лабораторных штаммов позволяет точно определить вид микобактерий исследуемой культуры, что повышает точность и достоверность исследований.
Пример изобретения
1. Для построения номограммы взвесь микобактерий туберкулеза человеческого вида (лабораторный штамм H37Rv) готовили в концентрации 10×10-5 по стандарту мутности ГИСК на дистиллированной воде. Взвесь наносили на поверхность питательной среды "Новая" в количестве 0,1 мл через каждые 12 минут в течение 6 часов. Пробирки помещали в горизонтальном положении на 24 часа в термостат при 37°С. По истечении срока инкубации одновременно проводили учет результатов всех посевов путем подсчета количества колоний микобактерий, выросших на поверхности питательной среды. На основании полученных данных строили стандартную номограмму цикличности роста микобактерий туберкулеза.
2. Аналогичным образом строили номограммы цикличности роста лабораторных штаммов микобактерий туберкулеза H32v, M.Bovis, М.avium; быстрорастущих микобактерий - M.Smegmatis. Номограммы цикличности роста микобактерий туберкулеза Н37Rv и Н32v представлены на чертеже.
3. Для определения видовой принадлежности штамма микобактерий, выделенных от больного туберкулезом, готовили взвесь микобактерий этого штамма, производили посев, инкубацию и учет данных аналогично описанию в п.1 данного примера. Полученные результаты сопоставляли с данными номограмм лабораторных штаммов следующим образом: количество колоний микобактерий культуры больного, выросших при посеве взвеси через 12 мин после ее приготовления, сравнивали с массивностью роста микобактерий лабораторных штаммов, посеянных в этом же временном интервале и т.д. по каждому временному интервалу. Данные представлены в таблице.
Путем проведенного сравнения установлено, что показатели массивности роста микобактерий, выделенных из материала больного туберкулезом, практически совпадали с таковыми у лабораторного штамма Н37Rv. Имеющиеся различия не были статистически достоверными. На основании результатов проведенного сравнения культура, выделенная от больного, была идентифицирована как Mycobacterium tuberculosis человеческого вида.
Таким образом, предложенный способ позволяет определить видовую принадлежность микобактерий, что повышает точность и достоверность бактериологических исследований.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫДЕЛЕНИЯ МИКОБАКТЕРИЙ | 2005 |
|
RU2300571C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЛЕКАРСТВЕННОЙ ЧУВСТВИТЕЛЬНОСТИ МИКОБАКТЕРИЙ | 1999 |
|
RU2157849C1 |
| СПОСОБ ВЫЯВЛЕНИЯ МИКОБАКТЕРИЙ С ПОВЕРХНОСТЕЙ | 1999 |
|
RU2180690C2 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ПИТАТЕЛЬНОЙ СРЕДЫ ДЛЯ ВЫРАЩИВАНИЯ МИКОБАКТЕРИЙ | 2008 |
|
RU2403281C2 |
| СПОСОБ ВЫЯВЛЕНИЯ МИКОБАКТЕРИЙ ТУБЕРКУЛЕЗА ИЗ ВОЗДУШНОЙ СРЕДЫ | 2011 |
|
RU2490328C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЛЕКАРСТВЕННОЙ ЧУВСТВИТЕЛЬНОСТИ МИКОБАКТЕРИЙ ТУБЕРКУЛЕЗА | 2003 |
|
RU2255977C1 |
| СПОСОБ ВЫЯВЛЕНИЯ МИКОБАКТЕРИЙ | 2001 |
|
RU2203957C2 |
| СПОСОБ ВИДОВОЙ ДИФФЕРЕНЦИАЦИИ МИКОБАКТЕРИЙ ТУБЕРКУЛЕЗА | 2009 |
|
RU2428484C2 |
| СПОСОБ ВЫЯВЛЕНИЯ МИКОБАКТЕРИЙ С ПОВЕРХНОСТЕЙ | 2008 |
|
RU2415945C2 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ РЕЗИСТЕНТНОСТИ ПОПУЛЯЦИОННОГО СОСТАВА ШТАММОВ BACILLUS ANTHRACIS К СИБИРЕЯЗВЕННОМУ БАКТЕРИОФАГУ | 2004 |
|
RU2266963C1 |
Для определения видовой принадлежности готовят взвесь микобактерий в дистиллированной воде и разводят ее до концентрации 10×10-5 по стандарту мутности ГИСК. Посев порций взвеси микобактерий осуществляют на среду «Новая» в течение 6 ч с интервалом между посевами 9-15 мин. Для учета результатов строят номограммы цикличности роста лабораторных штаммов микобактерий и сопоставляют данные по выходу микробной массы исследуемой культуры с данными номограмм в соответствующие интервалы времени. Изобретение обеспечивает повышение точности и достоверности исследований по определению видовой принадлежности микобактерий за счет определения циклов роста культур. 3 з.п. ф-лы, 1 ил., 1 табл.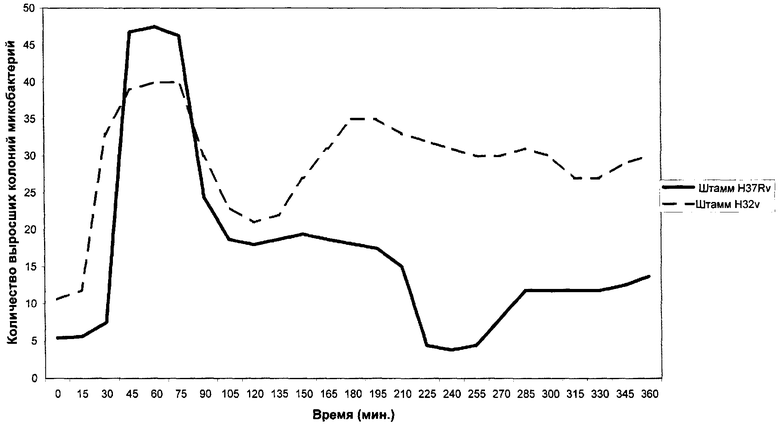
| Шкив для канатной передачи | 1920 |
|
SU109A1 |
| Способ определения микобактерий М. воVIS, М. тUвеRсULаSIS | 1990 |
|
SU1735778A1 |
| СПОСОБ ИДЕНТИФИКАЦИИ МИКОБАКТЕРИЙ | 2000 |
|
RU2177507C1 |
| Справочник по микробиологическим и вирусологическим методам исследования под ред БИРГЕРА М.О | |||
| - М.: Высшая школа, 1982, с.271-273. | |||
Авторы
Даты
2008-12-10—Публикация
2006-07-07—Подача