Область настоящего изобретения
Изобретение, главным образом, относится к низкомолекулярным иммунопотенциаторам (SMIP), таким как новые имидазохинолиновые соединения, способные стимулировать или модулировать у субъекта иммунный ответ. Изобретение также относится к новым сочетаниям антигенов с иммунопотенциаторами, которые могут быть использованы в вакцинотерапии. В некоторых вариантах выполнения соединения могут быть использованы в качестве иммунотерапевтических средств при пролиферативных заболеваниях, инфекционных заболеваниях, аутоиммунных заболеваниях, аллергиях и/или астме.
Предшествующий уровень техники настоящего изобретения
При быстром росте количества и разнообразия заболеваний и небольшом количестве соответствующих терапевтических методов существует потребность в новом терапевтическом подходе. Такой подход должен быть меньше направлен на конкретные субстраты болезненного состояния и больше на усиление иммунного ответа на заболевание. Со времени открытия пенициллина, нацеленного на специфичные для бактерий клеточные стенки, не характерные для человека, модель современной медицины состояла в уничтожении субстратов болезненного состояния без воздействия на систему-хозяина. К сожалению, немногие терапевтические средства позволяли достигнуть этой задачи и еще более немногие остаются эффективными из-за обусловливающих резистентность мутаций. Применительно к злокачественным опухолям целями терапевтических разработок были положительно регулированные киназы. К сожалению, единственным недавно разработанным лекарственным средством, достигшим цели, является Gleevec, и, вероятно, не только благодаря своей ингибирующей киназы активности. Borg et al. J. Clin. Invest. 114:379-388 (2004).
Многие преимущества достигаются потенциированием иммунного ответа вместо или помимо ингибирования субстрата заболевания (или в противном случае, вызывается значительный ущерб). Одно преимущество является следствием того, что субстраты заболевания и хозяина обычно одинаковы, хотя, возможно, и положительно регулированы в болезненном состоянии. Например, противораковые средства, нацеленные на киназы, могут быть цитотоксичны и могут нарушать клеточные механизмы хозяина наряду с клеточными механизмами злокачественных клеток. Далее, максимальные переносимые дозы (MTD), необходимые для обеспечения эффективности лечения, могут вызывать нежелательные побочные эффекты и даже ослаблять иммунный ответ у пациента. Такие побочные эффекты могут обусловить необходимость прекращения лечения. Наоборот, что касается Gleevec, двойное действие, заключающееся в ингибировании bcr-abl при стимуляции иммунного ответа, вероятно, способствует его эффективности и переносимости, в особенности поскольку NК-клетки, стимулируемые введением Gleevec, независимо участвуют в регрессии опухоли. Такой синергический подход к регрессии злокачественных опухолей крайне эффективен. Альтернативно, цитотоксические средства, подавляющие иммунную систему, могут независимо способствовать болезненному состоянию, поскольку они могут ингибировать отдельные пути, которые могут быть вовлечены в процесс выздоровления.
Другим преимуществом иммунопотенциации является то, что оно создает платформу, не так легко обходимую обусловливающими резистентность мутациями. Если терапевтические цели, такие как конкретный субстрат в вирусном репликоне или киназа злокачественной клеточной линии, настолько поляризованы и специфичны (что может быть необходимо во избежание воздействия на клетки хозяина), одна точечная мутация в субстрате болезненного состояния может придать ему невосприимчивость к лекарственному средству, приводящую к появлению еще более стойких штаммов патогена в следующих поколениях.
Существует потребность в новых способах и механизмах лечения пациентов, страдающих заболеваниями, резистентными к либо не поддающимися должным образом лечению в соответствии со стандартными подходами, использующими средства, нацеленные на механизмы специфичного иммунного ответа в организме.
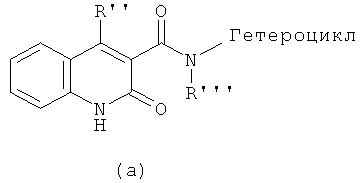
В патентах США №№4,547,511 и 4,738,971 раскрыты соединения для лечения заболеваний, восприимчивых к средствам, усиливающим клеточный иммунитет. Соединения, раскрытые в этих патентах, характеризуются общей формулой (а):
 .
.
Однако, ни в одном из этих патентов не содержится сведений об использовании соединений формулы(а) в сочетании с антигенами.
В WO 98/55495 и WO 98/16247 описаны иммуностимулирующие олигонуклеотиды и полинуклеотиды. В опубликованной заявке на выдачу патента США №2002/0164341 описаны адъюванты, содержащие неметилированный динуклеотид CpG (CpG ODN) и отличный от нуклеиновой кислоты адъювант. В заявке на выдачу патента США №2002/0197269 описаны композиции, содержащие антиген, антигенный CpG-ODN, и поликатионный полимер. Каждая из этих ссылок включена сюда во всей полноте посредством ссылки и для любых целей считается полностью изложенной в настоящем описании.
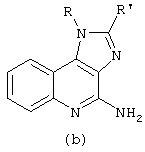
В выданных патентах США №№4,689,338, 5,389,640, 5,268,376, 4,929,624, 5,266,575, 5,352,784, 5,494,916, 5,482,936, 5,346,905, 5,395,937, 5,238,944, 5,525,612, 6,083,505 и 6,110,929 и WO 99/29693 раскрыты имидазохинолиновые соединения общей структурной формулы (b) для использования в качестве "модификаторов иммунного ответа":
 .
.
Каждая из этих ссылок включена сюда во всей полноте посредством ссылки и для любых целей считается полностью изложенной в настоящем описании.
В WO 03/097641 раскрыто применение определенных имидазохинолинов и их солей для лечения определенных зависимых от протеинкиназ заболеваний и для производства фармацевтических препаратов для лечения заболеваний.
Иммунный ответ на некоторые антигены, которые иначе слабо антигенны, может быть усилен использованием иммунопотенциаторов, известных как вакцинные адъюванты. Такие адъюванты усиливают иммунный ответ на специфичные антигены и, таким образом, представляют значительный интерес и составляют предмет исследований медицинского сообщества.
Исследования привели к созданию вакцин, содержащих антигенные эпитопы, получить которые ранее не представлялось возможным. Например, доступные в настоящее время вакцины-кандидаты содержат синтетические пептиды, являющиеся миметиками стрептококковых, гонококковых и малярийных антигенов. Эти очищенные антигены, как правило, являются слабыми антигенами, требующими адъювантов для индукции защитного иммунитета. К сожалению, стандартные вакцинные адъюванты обладают рядом недостатков, ограничивающих их общее применение и эффективность. Например, известно, что минеральное масло вызывает раздражение тканей и является потенциально онкогенным. Квасцы, единственный одобренный в Соединенных Штатах адъювант, также вызывают образование гранулем в месте прививки и, кроме того, не индуцируют эффективно клеточный иммунитет. Более того, многие доступные в настоящее время адъюванты имеют ограниченную применимость, поскольку содержат компоненты, не метаболизируемые в организме человека. Кроме того, приготовление большинства адъювантов сложно и может потребовать проведения времязатратных процедур, а в некоторых случаях - использования сложного и дорогостоящего оборудования для приготовления системы вакцины и адъюванта.
Иммунные адъюванты описаны в "Current Status of Immunological Adjuvants", Ann. Rev. Immunol., 1986, 4, pp.369-388, и "Recent Advances in Vaccine Adjuvants and Delivery Systems" Derek T.O'Hagan и Nicholas M.Valiante. См. также патенты США №№4,806,352; 5,026,543 и 5,026,546 для ознакомления с описанием различных вакцинных адъювантов, встречающимся в патентной литературе. Каждая из этих ссылок включена сюда во всей полноте посредством ссылки и для любых целей считается полностью изложенной в настоящем описании.
Были приложены усилия для идентификации новых иммуномодуляторов для использования в качестве адъювантов для вакцин и иммунотерапевтических средств, которые позволили бы преодолеть недостатки и изъяны стандартных иммуномодуляторов. В частности, был бы чрезвычайно желателен адъювантный состав, индуцирующий у человека и домашних животных мощные клеточные и гуморальные иммунные ответы на широкий спектр антигенов, но не вызывающий побочных эффектов, характерных для стандартных адъювантов и других иммуномодуляторов. Эта потребность может быть удовлетворена низкомолекулярными иммунопотенциаторами (SMIP), поскольку ставка на низкомолекулярные соединения позволяет использовать разнообразные соединения для селективного манипулирования иммунным ответом, необходимого для повышения терапевтического индекса иммуномодуляторов.
Существует потребность в новых средствах узкого действия с варьирующими способностями изменения уровней содержания и/или профилей продукции цитокинов иммунокомпетентными клетками человека. Соединения различной структуры зачастую индуцируют желаемый ответ посредством различных механизмов действия или с большей специфичностью к мишени, такой как дендритная клетка, модулируя силу ответа и снижая побочные эффекты после введения пациенту.
Иммуносупрессорный эффект цитостатических веществ сделал их применимыми для терапии аутоиммунных заболеваний, таких как рассеянный склероз, псориаз и некоторые ревматические заболевания. К сожалению, их благоприятный эффект должен перевешивать серьезные побочные эффекты, которые вынуждают использовать слишком низкие дозы. Кроме того, может потребоваться прекращение лечения.
Существует потребность в средствах и/или сочетаниях активных веществ, оказывающих значительно улучшенные цитостатические или цитотоксические эффекты по сравнению со стандартными цитостатическими средствами, например, винкристином, метотрексатом, цисплатином и т.д. При наличии таких средств и сочетаний могут стать доступны такие химиотерапевтические методы, в которых сочетаются повышенная эффективность со значительным ослаблением побочных эффектов и снижением терапевтических доз. Таким образом, такие средства и сочетанные терапевтические схемы способны обеспечить повышение терапевтической эффективности известных цитостатических лекарственных средств. В некоторых вариантах выполнения соединения согласно изобретению используют в сочетании с соединениями, оказывающими значительно улучшенный цитостатический или цитотоксический эффект по сравнению со стандартными цитостатическими средствами, вводимыми отдельно. Кроме того, клеточные линии, невосприимчивые к стандартному химиотерапевтическому лечению, также могут оказаться восприимчивыми к химиотерапии с использованием сочетаний активных веществ.
Настоящее изобретение относится к отдельным терапевтическим и профилактическим средствам для лечения болезненных состояний, характеризующихся другими иммунодефицитами, аномалиями или инфекциями, включая аутоиммунные заболевания и вирусные и бактериальные инфекции, восприимчивые к соединениям, обладающим способностью модулировать цитокины и/или TNF-α, такие как, помимо прочих, рассеянный склероз, болезнь Крона, HIV, HSV и HCV.
Существует потребность в терапевтических средствах с пониженной цитотоксичностью, которые служат для усиления естественных защитных механизмов хозяина от вирусных и бактериальных инфекций или от образования и прогрессирования опухолей. Настоящее изобретение относится к таким терапевтическим средствам и дополнительно обеспечивает другие родственные преимущества.
Краткое изложение сущности настоящего изобретения
Настоящее изобретение относится к новым иммунопотенциаторам, иммуногенным композициям, новым соединениям и фармацевтическим композициям и новым способам введения вакцины путем введения низкомолекулярных иммунопотенциаторов отдельно или в сочетании с антигенами и/или другими агентами. Изобретение дополнительно относится к новым соединениям и фармацевтическим композициям для использования в лечении злокачественных опухолей, предраковых состояний, аутоиммунных заболеваний, инфекционных заболеваний, аллергий и астмы. Изобретение дополнительно относится к применению соединений согласно изобретению в производстве лекарственных препаратов для использования в лечении злокачественных опухолей, предраковых состояний, аутоиммунных заболеваний, аллергий и астмы.
Имидазохинолиновые соединения, применимые в соответствии со способами и в композициях согласно изобретению, недороги в получении и просты для введения. Они обладают потенциалом для более высокой специфичности по сравнению с существующими иммуностимуляторами, обеспечивая таким образом повышенную эффективность и улучшенные профили безопасности.
Как адъюванты имидазохинолиновые соединения могут быть объединены с многочисленными антигенами и системами доставки с получением конечного вакцинного продукта.
Как иммунотерапевтические средства имидазохинолиновые соединения могут быть использованы отдельно или в сочетании с другими лекарственными средствами (например, противовирусными средствами, антибактериальными средствами, другими иммуномодуляторами или, в составе терапевтических вакцин, антигенами) для лечения хронических инфекций, таких как инфекции, вызванные вирусом иммунодефицита человека (HIV), вирусом гепатита С (HCV), вирусом гепатита В (HBV), вирусом простого герпеса (HSV) и Н.pylori, равно как и с лекарственными препаратами для замедления опухолевого роста или модуляции аномальной клеточной пролиферации, связанной с такими заболеваниями, как старческий кератоз, атипические и диспластические невусы или предраковые лентиго.
Имидазохинолиновые соединения согласно настоящему изобретению также нацелены на субстраты болезненного состояния, такие как, например, конкретные киназы, включая, помимо прочих, EGFr, c-Kit, bFGF, Kdr, CHK1, CDK, cdc-2, Akt, PDGF, PI3K, VEGF, PKA, PKB, src, c-Met, Аbl, Ras, RAF и МЕК.
Как иммунотерапевтические средства имидазохинолиновые соединения также могут быть использованы для лечения злокачественных опухолей либо отдельно, либо в сочетании с другими противораковыми терапевтическими средствами (например, химиотерапевтическими средствами, моноклональными антителами (mAb) или другими иммунопотенциаторами). Кроме того, некоторые имидазохинолины, обладающие способностью индуцировать выработку цитокинов типа 1 (например, IL-12, TNF-α и IFN), могут быть использованы для лечения аллергий и/или астмы благодаря их способности направлять иммунный ответ в более доброкачественные исходы. Имидазохинолиновые соединения могут быть использованы, например, для лечения инфекции бациллы Кальметта-Герена (BCG), холеры, чумы, брюшного тифа, инфекции вируса гепатита В, гриппа, инфекции инактивированного полиовируса, инфекции вируса бешенства, кори, эпидемического паротита, краснухи, пероральной инфекции полиовируса, желтой лихорадки, столбняка, дифтерии, инфекции Haemophilus influenzae типа b, менингококковой инфекции и пневмококковой инфекции. Имидазохинолиновые соединения могут быть использованы в количестве, эффективно подавляющем клеточную пролиферацию, для лечения злокачественных опухолей. Имидазохинолиновые соединения также могут быть использованы в количестве, эффективно подавляющем выработку цитокинов Тh2/типа 2, для коррекции аллергических/астматических иммунных ответов.
Некоторые варианты выполнения относятся к способам лечения злокачественных опухолей и/или предраковых состояний. В таких вариантах выполнения одно или несколько противораковых средств объединяют с одним или несколькими имидазохинолиновыми соединениями для замедления опухолевого роста у субъекта. Ряд подходящих противораковых средств предполагается использовать в способах согласно настоящему изобретению, и они более подробно описаны в следующем подробном раскрытии.
Другой вариант выполнения относится к способу ингибирования роста опухолевых клеток у субъекта. Способ предусматривает введение субъекту эффективной дозы сочетания, содержащего, по меньшей мере, один SMIP и моноклональное антитело (mAb). Сочетание более эффективно ингибирует рост таких клеток, чем отдельно вводимое mAb. В некоторых вариантах выполнения способов лечения злокачественных опухолей сочетанием субъекту вводят дополнительное SMIP соединение и/или mAb.
В некоторых вариантах выполнения способов и композиций согласно изобретению имидазохинолиновое соединение выбирают из одного или нескольких соединений из следующего перечня:
N2-метил-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
N2,N2-диметил-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
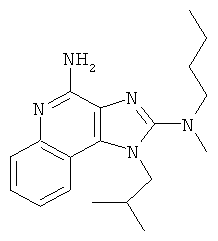
N2-этил-N2-метил-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
N2-метил-1-(2-метилпропил)-N2-пропил-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
1-(2-метилпропил)-N2-пропил-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
N2-бутил-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
N2-бутил-N2-метил-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
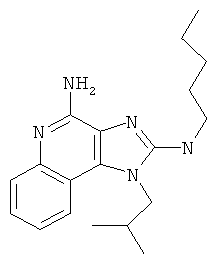
N2-метил-1-(2-метилпропил)-N2-пентил-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
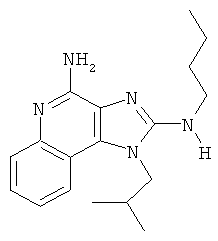
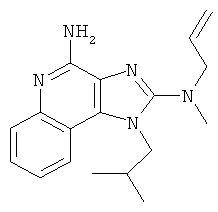
N2-метил-1-(2-метилпропил)-N2-проп-2-енил-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
1-(2-метилпропил)-2-[(фенилметил)тио]-1Н-имидазо[4,5-с]хинолин-4-амин;
1-(2-метилпропил)-2-(пропилтио)-1Н-имидазо[4,5-с]хинолин-4-амин;
2-[[4-амино-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2-ил](метил)амино]этанол;
2-[[4-амино-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2-ил](метил)амино]этилацетат;
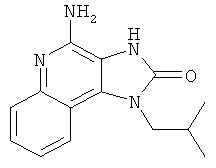
4-амино-1-(2-метилпропил)-1,3-дигидро-2Н-имидазо[4,5-с]хинолин-2-он;
N2-бутил-1-(2-метилпропил)-N4,N4-бис(фенилметил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
N2-бутил-N2-метил-1-(2-метилпропил)-N4,N4-бис(фенилметил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
N2-метил-1-(2-метилпропил)-N4,N4-бис(фенилметил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
N2,N2-диметил-1-(2-метилпропил)-N4,N4-бис(фенилметил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
1-{4-амино-2-[метил(пропил)амино]-1Н-имидазо[4,5-с]хинолин-1-ил}-2-метилпропан-2-ол;
1-[4-амино-2-(пропиламино)-1Н-имидазо[4,5-с]хинолин-1-ил]-2-метилпропан-2-ол;
N4,N4-дибензил-1-(2-метокси-2-метмлпропил)-N2-пропил-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
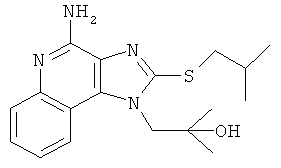
1-(4-амино-2-пропилсульфанилимидазо[4,5-с]хинолин-1-ил)-2-метилпропан-2-ол;
1-(4-амино-2-азетидин-1-илимидазо[4,5-с]хинолин-1-ил)-2-метилпропан-2-ол;
1-(4-амино-2-пирролидин-1-илимидазо[4,5-с]хинолин-1-ил)-2-метилпропан-2-ол;
1-(4-амино-2-циклопропилсульфанилимидазо[4,5-с]хинолин-1-ил)-2-метилпропан-2-ол или
1-(4-амино-2-изобутилсульфанилимидазо[4,5-с]хинолин-1-ил)-2-метилпропан-2-ол.
Дополнительные варианты выполнения, способы и композиции, предположительно, применимые в соответствии с настоящим изобретением, раскрыты в заявках на выдачу патента США №10/814,480, 10/762,873, 60/582,654, 10/405,495 и 10/748,071, каждая из которых включена сюда во всей полноте посредством ссылки и для любых целей считается полностью изложенной в настоящем описании.
Раскрыты способы производства соединений и композиций, описанные в настоящем описании, а также применение имидазохинолинов в способах производства лекарственных препаратов для использования в способах согласно изобретению, и предполагается, что они подпадают под объем изобретения.
В каждом варианте выполнения настоящего изобретения соединения, такие как соединения формулы I, могут быть использованы для производства лекарственного препарата для усиления иммунного ответа на антиген.
Другие варианты выполнения относятся к применению соединений согласно изобретению в производстве лекарственного препарата для иммуностимуляции и другого агента, такого как антиген, для одновременного, раздельного или последовательного введения. Другой более конкретный вариант выполнения относится к применению для лечения или профилактики бактериальной или вирусной инфекции. Другой вариант выполнения относится к применению для лечения злокачественных опухолей. Другой вариант выполнения относится к применению для профилактики инфекции вируса гриппа, а антиген представляет собой поверхностный(ые) белок(ки) гемагглютинин и/или нейраминидазу.
Другие варианты выполнения относятся к фармацевтическим препарату или системе, содержащим (а) соединение (такое как соединение формулы I) согласно любому из аспектов/вариантов выполнения, раскрытых в настоящем описании; и (b) антиген, причем первый и второй агенты либо находятся в смеси, либо представляют собой отдельные композиции. В более конкретном варианте выполнения второй агент представляет собой поверхностный(ые) белок(ки) гемагглютинин и/или нейраминидазу. Более конкретно, агенты предназначены для одновременного, раздельного или последовательного введения. Другой более конкретный вариант выполнения относится к применению для профилактики инфекции. Другой вариант выполнения относится к применению для лечения злокачественных опухолей.
Другие варианты выполнения изобретения включают в себя варианты, описанные в следующем подробном раскрытии.
Краткое описание чертежей
На фиг.1 показана зависимость SMIP согласно настоящему изобретению TLR7 (фиг.1А) и TLR8 (фиг.1В).
На фиг.2А показаны результаты мультицитокиновых анализов эффективности SMIP на миеломоноцитарных клетках, ТНР-1.
На фиг.2В показаны результаты мультицитокиновых анализов эффективности SMIP на человеческих РВМС.
На фиг.2С показаны результаты мультицитокиновых анализов эффективности SMIP на мышиных спленоцитах.
На фиг.3 показана относительная расстановка активности SMIP на различных клеточных линиях.
На фиг.4 показана in vivo адъювантная активность соединений из примера 11 и примера 19, а именно, среднее геометрическое титров IgG2a специфичной против gp120 сыворотки через 2 недели после вторичной иммунизации мышей BALB/c, дважды иммунизированных gp120 HIV, введенным в MF59 +/- указанные SMIP (фиг.4А); среднее геометрическое титров IgG1 через 2 недели после вторичной иммунизации (фиг.4В) и ех vivo специфичные против gp120 Т-клеточные ответы селезенок, иссеченных из иммунизированных мышей (фиг.4С).
Подробное раскрытие изобретения
Заявители раскрыли способы стимуляции цитокиновой активности в клетках и иммунотерапевтические средства и/или вакцинные адъюванты, обеспечивающие эффективное лечение заболеваний, таких как заболевания, указанные в настоящем описании и очевидные специалисту в данной области техники.
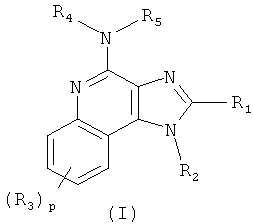
В одном варианте выполнения изобретение относится к соединению формулы (I):
где
R1 представляет собой -NR6R7, -C(O)R8, -C(O)OR8, -C(O)NR6R7, -(CH2)mCH=CH(CH2)nR9, -(CH2)mC≡C(CH2)nR9 или -S(O)qR10;
R2 представляет собой Н, C1-6алкил, замещенный C1-6алкил, -(CH2)mCH=CH(CH2)nR9, -(CH2)mC≡C(CH2)nR9, -C(O)R8, -C(O)OR8, -C(O)NR6R7 или -S(O)qR10;
каждый R3 независимо представляет собой Н, C1-6алкил, замещенный C1-6алкил, C1-6алкокси, галоген, тригалогенметил, -NR6R7, -C(O)R8, -C(O)OR8 или -C(O)NR6R7;
каждый из R4 и R5 независимо представляет собой Н, C1-6алкил, С6-10арил-C1-6алкил или защитную группу;
каждый из R6 и R7 независимо представляет собой Н, C1-6алкил, замещенный C1-6алкил, C1-6алкокси, C1-6алкокси-C1-6алкил, С6-10арил, С6-10арил-С1-6алкил, С6-10арилокси-С1-6алкил, -(CH2)mCH=CH(CH2)nR9 или -(CH2)mC≡C(CH2)nR9; или
R6 и R7 вместе взятые образуют замещенную или незамещенную гетероциклильную группу;
каждый R8 независимо представляет собой Н, C1-6алкил или замещенный С1-6алкил;
каждый R9 независимо представляет собой Н, С1-6алкил, замещенный C1-6алкил, С2-6алкенил, С6-10арил, -СO2Н, -C(O)O-C1-6алкил или галоген;
каждый R10 независимо представляет собой C1-6алкил, замещенный C1-6алкил, С2-6алкенил, С6-10арил, С6-10арил-C1-6алкил, тригалогенметил или -NR6R7;
каждое из m и n независимо равно 0, 1, 2 или 3;
p равно 0, 1, 2 или 3; и
каждое q независимо равно 0, 1 или 2; или
его фармацевтически приемлемой соли, его таутомеру или фармацевтически приемлемой соли таутомера.
В некоторых вариантах выполнения, если q в составе R1 равно 0, a R10 в составе R1 представляет собой метил, так что если R1 представляет собой -S-Ме, то R2 не является изобутилом.
В другом варианте выполнения каждый из R4 и R5 представляет собой Н. В других вариантах выполнения каждый из R4 и R5 представляет собой Н, а p равно 0.
В другом варианте выполнения каждый из R4 и R5 представляет собой Н, а R1 представляет собой -NR6R7, -S(O)qR10, -C(O)NR6R7, -(CH2)mCH=CH(CH2)nR9 или -(CH2)mC≡C(CH2)nR9.
В другом варианте выполнения каждый из R4 и R5 представляет собой Н, а R1 представляет собой -NR6R7, где R6 и R7 независимо представляют собой Н, незамещенный C1-6алкил или -(СН2)mСН=СН(СН2)nR9.
В другом варианте выполнения R1 представляет собой -NR6R7. В некоторых таких вариантах его выполнения, R6 и R7 в составе R1 независимо выбраны из Н, C1-6алкила или -(СН2)mСН=СН(СН2)nR9. В других вариантах его выполнения C1-6алкил(ы) групп R6 и/или R7 из R1 -NR6R7 независимо выбран(ы) из метила, этила, пропила, н-бутила или н-пентила. В некоторых таких вариантах выполнения R6 и R7 представляют собой соответственно пропил и метил. В других вариантах выполнения R6 представляет собой метил, a R7 представляет собой -(CH2)mCH=CH(CH2)nR9, где m равно 1, n равно 0, a R9 представляет собой Н.
В другом варианте выполнения R1 представляет собой -S(O)qR10. В некоторых таких вариантах его выполнения q и R10 в составе R1 представляют собой соответственно 0 и С1-6алкил, так что R1 представляет собой -SR10, где R10 из -SR10 представляет собой C1-6алкил, так что R1 представляет собой -S-C1-6алкил. В другом варианте выполнения C1-6алкил представляет собой этил, так что R1 представляет собой -S-этил. В другом варианте выполнения С1-6алкил представляет собой -CH2СН2СН3, так что R1 представляет собой -SСН2СH2СН3. В другом варианте выполнения C1-6алкил представляет собой -СН(СН3)2, так что R1 представляет собой -S-СН(СН3)2. В другом варианте выполнения q и R10 в составе R1 представляют собой соответственно 0 и С6-10арил-C1-6алкил, так что R1 представляет собой -S-(С6-10арил-C1-6алкил). В некоторых таких вариантах выполнения R10 представляет собой бензил, так что R1 представляет собой -S-CH2Ph.
В других вариантах выполнения R1 представляет собой -C(O)NR6R7.
В других вариантах выполнения R1 представляет собой -(CH2)mCH=CH(CH2)nR9.
В других вариантах выполнения R1 представляет собой -(CH2)mC≡C(CH2)nR9.
В другом варианте выполнения R2 представляет собой C1-6алкил. В некоторых таких вариантах выполнения R2 представляет собой изобутил.
В других вариантах выполнения m равно 1, n равно 0, a R9 представляет собой Н.
В других вариантах выполнения p равно 0.
В других вариантах выполнения R2 представляет собой замещенный C1-6алкил. В некоторых таких вариантах его выполнения R2 представляет собой -СН2С(СН3)2(ОН). В другом варианте выполнения R2 представляет собой -СН2С(СН3)2NН-SO2СН3.
В других вариантах выполнения R1 представляет собой -S-циклопропил, -S-СН2СН(СН3)2, или -S-СН2СН2СН3.
В других вариантах выполнения R1 представляет собой -S-С3-6циклоалкил.
В других вариантах выполнения R6 и R7 вместе взятые образуют замещенную или незамещенную гетероциклильную группу. Если R6 и R7 вместе взятые образуют замещенную или незамещенную гетероциклильную группу, гетероциклильная группа присоединена к ядру через атом азота.
В других вариантах выполнения указанная гетероциклильная группа выбрана из пиперидинила, пирролидинила, азетидинила или азиридинила. В других вариантах выполнения указанная гетероциклильная группа (образованная R6 и R7) представляет собой морфолинил, тиоморфолинил, пиперазинил, N-метилпиперазинил или полициклический гетероцикл, такой как хинуклидин.
В других вариантах выполнения R6 и R7 вместе взятые образуют замещенную или незамещенную гетероарильную группу, такую как пиррольная, пиразольная, триазольная и пиридоновая группы.
В других вариантах выполнения R1 представляет собой -N(СН3)СН2СН2СН3.
В других вариантах выполнения соединение выбирают из следующего перечня:
1-(4-амино-2-пропилсульфанилимидазо[4,5-с]хинолин-1-ил)-2-метилпропан-2-ол;
1-(4-амино-2-азетидин-1-илимидазо[4,5-с]хинолин-1-ил)-2-метилпропан-2-ол;
1-(4-амино-2-пирролидин-1-илимидазо[4,5-с]хинолин-1-ил)-2-метилпропан-2-ол;
1-(4-амино-2-циклопропилсульфанилимидазо[4,5-с]хинолин-1-ил)-2-метилпропан-2-ол или
1-(4-амино-2-изобутилсульфанилимидазо[4,5-с]хинолин-1-ил)-2-метилпропан-2-ол.
В других вариантах выполнения соединение формулы I выбирают из группы, состоящей из:
N2-метил-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2,4-диамина;
N2,N2-диметил-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2,4-диамина;
N2-этил-N2-метил-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2,4-диамина;
N2-метил-1-(2-метилпропил)-N2-пропил-1Н-имидазо[4,5-с]хинолин-2,4-диамина;
1-(2-метилпропил)-N2-пропил-1Н-имидазо[4,5-с]хинолин-2,4-диамина;
N2-бутил-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2,4-диамина;
N2-бутил-N2-метил-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2,4-диамина;
N2-метил-1-(2-метилпропил)-N2-пентил-1Н-имидазо[4,5-с]хинолин-2,4-диамина;
N2-метил-1-(2-метилпропил)-N2-проп-2-енил-1Н-имидазо[4,5-с]хинолин-2,4-диамина;
1-(2-метилпропил)-2-[(фенилметил)тио]-1Н-имидазо[4,5-с]хинолин-4-амина;
1-(2-метилпропил)-2-(пропилтио)-1Н-имидазо[4,5-с]хинолин-4-амина;
2-[[4-амино-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2-ил](метил)амино]этанола;
2-[[4-амино-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2-ил](метил)амино]этилацетата;
4-амино-1-(2-метилпропил)-1,3-дигидро-2Н-имидазо[4,5-с]хинолин-2-она;
N2-бутил-1-(2-метилпропил)-N4,N4-бис(фенилметил)-1Н-имидазо[4,5-с]хинолин-2,4-диамина;
N2-бутил-N2-метил-1-(2-метилпропил)-N4,N4-бис(фенилметил)-1Н-имидазо[4,5-с]хинолин-2,4-диамина;
N2-метил-1-(2-метилпропил)-N4,N4-бис(фенилметил)-1Н-имидазо[4,5-с]хинолин-2,4-диамина;
N2,N2-диметил-1-(2-метилпропил)-N4,N4-бис(фенилметил)-1Н-имидазо[4,5-с]хинолин-2,4-диамина;
1-{4-амино-2-[метил(пропил)амино]-1Н-имидазо[4,5-с]хинолин-1-ил}-2-метилпропан-2-ола;
1-[4-амино-2-(пропиламино)-1Н-имидазо[4,5-с]хинолин-1-ил]-2-метилпропан-2-ола; и
N4,N4-дибензил-1-(2-метокси-2-метилпропил)-N2-пропил-1Н-имидазо[4,5-с]хинолин-2,4-диамина.
В некоторых вариантах выполнения соединение выбирают из одного из следующих соединений:
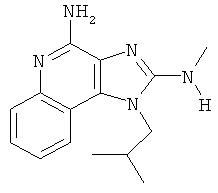 ,
, 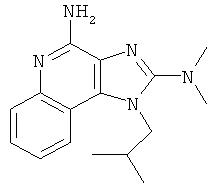 ,
, 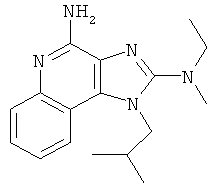 ,
, 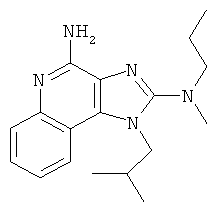 ,
, 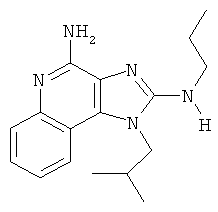 ,
,  ,
,  ,
,  ,
,  ,
, 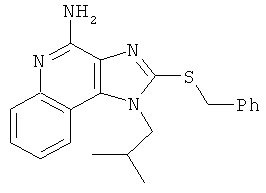 ,
, 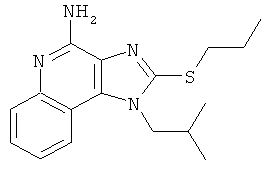 ,
, 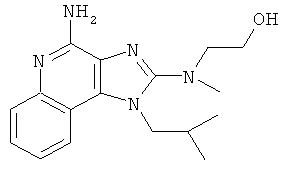 ,
, 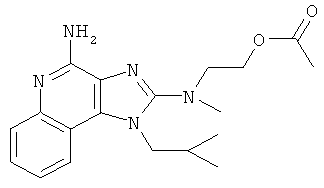 ,
,  ,
,  ,
,  ,
,  ,
, 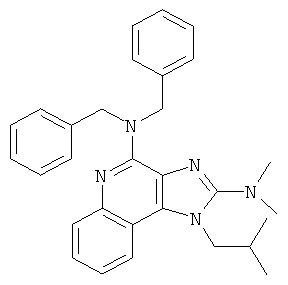 ,
, 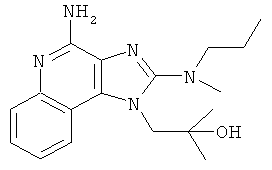 ,
, 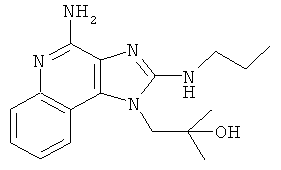 или
или 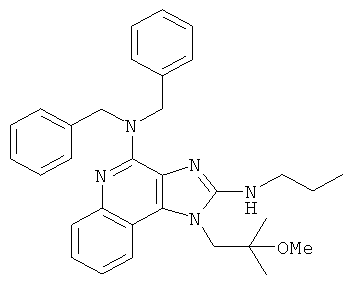 ;
;
или их фармацевтически приемлемых солей, его таутомеров или фармацевтически приемлемых солей таутомеров.
В некоторых других вариантах выполнения соединение выбирают из одного из следующих соединений:
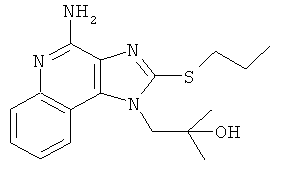 ,
, 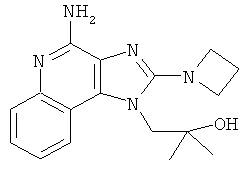 ,
, 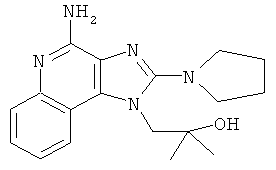 ,
, 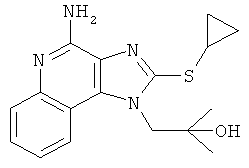 ,
,  ;
;
или их фармацевтически приемлемых солей, его таутомеров или фармацевтически приемлемых солей таутомеров.
В другом варианте выполнения изобретение относится к способу синтеза соединения формулы (II)
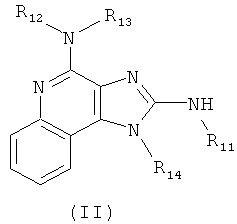
где каждый из R11 и R14 представляет собой C1-6алкил или замещенный C1-6алкил, и каждый из R12 и R13 представляет собой защитную группу, предусматривающему:
(а) взаимодействие соединения формулы (III):
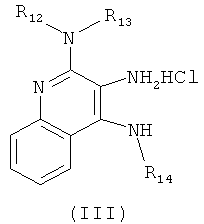
с изотиоцианатом формулы R11NCS, где R11 определен выше, с получением таким образом соединения формулы (IV):
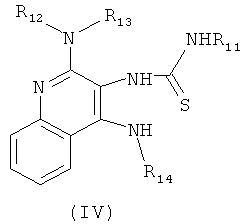
(b) необязательную очистку соединения формулы (IV);
(c) взаимодействие соединения формулы (IV) со сшивающим агентом с получением таким образом соединения формулы (II); и
(d) необязательное удаление защитной группы с соединения формулы (II).
В некоторых вариантах выполнения способа синтеза соединения формулы (II) сшивающий агент представляет собой 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорид.
В других вариантах выполнения способа синтеза соединения любой из формул (II-XIV) R12 представляет собой защитную группу, такую как трет-бутоксикарбонил (ВОС), a R13 представляет собой -Н.
В другом варианте выполнения изобретение относится к способу синтеза соединения формулы (V)
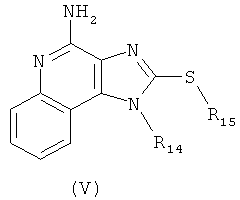
где R14 представляет собой C1-6алкил или замещенный C1-6алкил, a R15 представляет собой С6-10арил-C1-6алкил, предусматривающему:
(а) взаимодействие соединения формулы (III):

где каждый из R12 и R13 представляет собой защитную группу, с дисульфидом углерода с получением таким образом соединения формулы (VI):
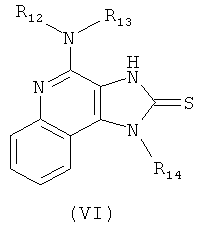
(b) необязательную очистку соединения формулы (VI);
(c) взаимодействие соединения формулы (VI) с активированной группой R15 с получением соединения формулы (VIa);
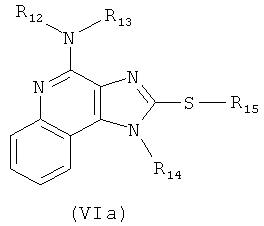
(d) удаление защитной группы с соединения формулы (VIa) с получением таким образом соединения формулы (V).
В другом варианте выполнения изобретение относится к способу синтеза соединения формулы (VII)
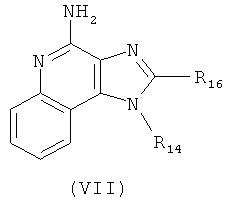
где R14 представляет собой C1-6алкил или замещенный C1-6алкил, a R16 представляет собой -C(O)C1-6алкил или -C(O)O-C1-6алкил, предусматривающему:
(а) взаимодействие соединения формулы (VIII):
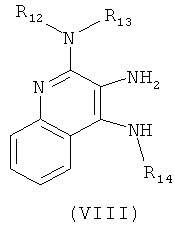
где каждый из R12 и R13 представляет собой защитную группу, с соединением формулы (IX):
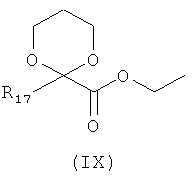
где R17 представляет собой Н или C1-6алкил, с получением таким образом соединения формулы (X):
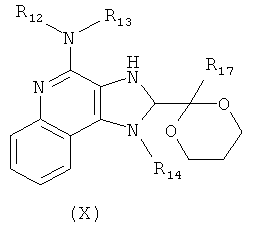
(b) необязательную очистку соединения формулы (X); и
(c) взаимодействие соединения формулы (X) с катализатором Перлмана, когда R17 представляет собой C1-6алкил, и последующий гидролиз полученного соединения в кислых условиях с получением соединения формулы (VII); или
(d) гидролиз и последующее окисление соединения формулы (X), когда R17 представляет собой Н, и последующее взаимодействие полученного гидролизованного и окисленного соединения с реагентом с получением соединения формулы (VIIa):
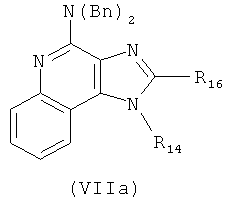
где Вn представляет собой бензил, и причем дополнительно соединение формулы (VIIa) затем взаимодействует с бромоводородом с получением соединения формулы (VII).
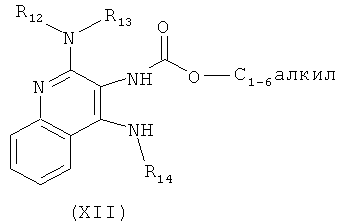
В другом варианте выполнения изобретение относится к способу синтеза соединения формулы (XI)
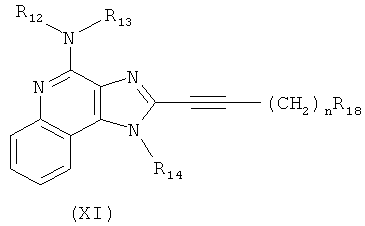
где каждый из R12 и R13 представляет собой защитную группу, R14 представляет собой C1-6алкил или замещенный C1-6алкил, n выбрано из 0, 1, 2 или 3, a R18 представляет собой Н, C1-6алкил или С6-10арил, предусматривающему:
(а) взаимодействие соединения формулы (III):

с хлорформиатом формулы ClC(O)O-C1-6алкил с получением таким образом соединения формулы (XII):
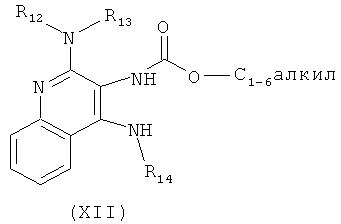
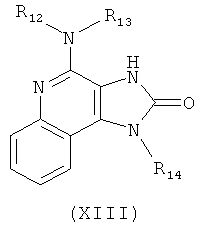
(b) необязательную очистку соединения формулы (XII);
(c) взаимодействие соединения формулы (XII) с алкоксидным основанием с получением таким образом соединения формулы (XIII);
(d) взаимодействие соединения формулы (XIII) с ангидридом трифторметансульфоновой кислоты с получением таким образом трифлата формулы (XIV):
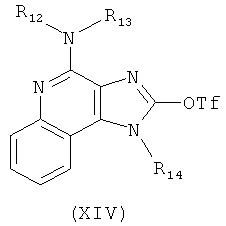
(e) взаимодействие соединения формулы (XIV) с ацетилидом лития формулы Li-C≡C(CH2)nR18, где n и R18 определены выше, с получением таким образом соединения формулы (XI); и
(f) необязательное удаление защитной группы с соединения формулы (XI).
В некоторых вариантах выполнения каждого из раскрытых в настоящем описании способов синтеза защитные группы R12 или R13 или как R12, так и R13 представляют собой бензильные группы.
В другом варианте выполнения изобретение относится к способу синтеза соединения формулы (XIV)

где каждый из R12 и R13 представляет собой защитную группу или Н, a R14 представляет собой C1-6алкил или замещенный C1-6алкил, предусматривающему:
(а) взаимодействие соединения формулы (III):

с хлорформиатом формулы ClC(O)O-C1-6алкил с получением таким образом соединения формулы (XII):
(b) необязательную очистку соединения формулы (XII);
(c) взаимодействие соединения формулы (XII) с алкоксидным основанием с получением таким образом соединения формулы (XIII);

(d) взаимодействие соединения формулы (XIII) с ангидридом трифторметансульфоновой кислоты с получением таким образом трифлата формулы (XIV):
 ; и
; и
(е) необязательное удаление защитной группы с соединения формулы (XIV).
В некоторых вариантах выполнения соединение формулы I окисляют по хинолиновому атому N, таким образом, чтобы соединение становилось N-оксидом, но в остальном характеризовалось всеми признаками соединения формулы I.
Также раскрыты соединения формулы I и их смеси, в которых любой(ые) асимметричный(ые) атом(ы) углерода может(могут) характеризоваться либо R-, либо S-конфигурацией. Заместители по двойной связи или кольцу соединений формулы I могут присутствовать либо в цис-(-Z-), либо в транс-(-Е-) конфигурациях. Таким образом, соединения могут находиться в форме смесей изомеров, диастереомеров и энантиомеров или могут находиться в форме чистых изомеров. В некоторых вариантах выполнения соединения являются энантиомерно чистыми, если присутствует только один энантиомер. В других вариантах выполнения соединение может представлять собой смесь энантиомеров, содержащую большее количество одного энантиомера, чем другого.
Как правило, SMIP или композиция, содержащая SMIP, считаются эффективно индуцирующими иммунный ответ в концентрации 300 мкМ или менее в некоторых вариантах выполнения, 200 мкМ или менее в некоторых вариантах выполнения, 100 мкМ или менее в некоторых вариантах выполнения, 20 мкМ или менее в некоторых вариантах выполнения, если SMIP соединение вызывает (а) продукцию TNF-α в in vitro клеточном анализе мононуклеарных клеток периферической крови человека и (b) концентрация мононуклеарных клеток периферической крови человека (РВМС) составляет около 500000/мл, когда соединение воздействует на клетки в течение периода, составляющего около 18-24 часов, предпочтительно, около 24 часов.
Упомянутый выше способ стимуляции местного иммунного ответа, например, в выбранных клетках и тканях пациента, предусматривает стимуляцию местного иммунного ответа, причем выбранные клетки и ткани являются инфицированными или злокачественными. В некоторых вариантах выполнения выбранные клетки и ткани инфицированы грибом или бактерией. В некоторых вариантах выполнения выбранные ткани воспалены в результате воздействия аллергена, например, при астматическом состоянии. В других вариантах выполнения выбранные клетки инфицированы вирусом или бактериями. В других вариантах выполнения инфекционным агентом является HCV, HIV, HBV, HSV, H.pylori, HSV типа 1 или 2 или вирус папилломы человека.
В другом варианте выполнения раскрыт способ индукции биосинтеза интерферона у субъекта. Такие способы предусматривают введение соединения формулы I субъекту в количестве, достаточном для индукции биосинтеза интерферона. В соответствии с некоторыми такими способами вакцинный адъювант формулы I вводят субъекту в количестве, достаточном для индукции биосинтеза интерферона.
В другом варианте выполнения раскрыто соединение формулы I, причем соединение вводят нуждающемуся в этом пациенту совместно с другим агентом. В некоторых таких вариантах выполнения агент представляет собой антиген или вакцину. В вариантах выполнения, в которых соединение формулы I вводят пациенту или субъекту совместно с другим агентом, соединение формулы I может быть введено субъекту до, во время или после введения субъекту другого агента. Таким образом, в некоторых вариантах выполнения соединение формулы I вводят субъекту одновременно с введением субъекту другого агента.
В другом варианте выполнения раскрыт способ модулирования иммунного ответа у субъекта. Такие способы предусматривают введение субъекту соединения формулы I.
В другом варианте выполнения раскрыт способ индукции продукции TNF-α у субъекта. Такие способы предусматривают введение субъекту соединения формулы I в количестве, достаточном для индукции продукции TNF-α. В некоторых таких вариантах выполнения соединение характеризуется средней равновесной концентрацией лекарственного средства в крови, составляющей менее 20 мкМ.
В другом варианте выполнения раскрыт способ индукции иммунного ответа у субъекта. Вариант выполнения предусматривает введение субъекту соединения формулы I в количестве, достаточном для индукции иммунного ответа. В некоторых таких вариантах выполнения иммунный ответ включает в себя продукцию цитокинов или усиленную продукцию TNF-α.
В другом варианте выполнения раскрыт способ индукции иммунного ответа у субъекта, страдающего микробной инфекцией. Способ предусматривает введение субъекту соединения формулы I в количестве, достаточном для индукции иммунного ответа.
В другом варианте выполнения раскрыт способ индукции иммунного ответа у субъекта, страдающего вирусной инфекцией или вызванным вирусом болезненным состоянием. Способ предусматривает введение субъекту соединения формулы I в количестве, достаточном для индукции у субъекта иммунного ответа. В некоторых таких вариантах выполнения субъект страдает вирусной инфекцией или болезненным состоянием, вызванным вирусом гепатита С (HCV). В других вариантах выполнения субъект страдает вирусной инфекцией или болезненным состоянием, вызванным вирусом иммунодефицита человека (HIV). В другом варианте выполнения способа соединение формулы I местно вводят субъекту.
В другом варианте выполнения раскрыт способ индукции иммунного ответа у субъекта для профилактики вирусной инфекции или вызванного вирусом болезненного состояния. Способ предусматривает введение субъекту соединения формулы I в количестве, достаточном для индукции у субъекта иммунного ответа. В некоторых таких вариантах выполнения у субъекта проводят профилактику вирусных инфекции или болезненного состояния. В других вариантах выполнения субъекта защищают от инфекции микробов или других патогенов, такой как указана в настоящем описании.
В другом варианте выполнения раскрыт способ индукции иммунного ответа у субъекта, страдающего аномальной клеточной пролиферацией или злокачественной опухолью. Способ предусматривает введение субъекту соединения формулы I в количестве, достаточном для индукции у субъекта иммунного ответа. В некоторых вариантах выполнения соединение вводят субъекту, страдающему заболеванием, связанным с аномальной клеточной пролиферацией. В некоторых таких вариантах выполнения заболевание выбрано из нейрофиброматоза, атеросклероза, пневмосклероза, артрита, псориаза, гломерулонефрита, рестеноза, пролиферативной диабетической ретинопатии (PDR), образования гипертрофических рубцов, воспалительного заболевания кишечника, отторжения трансплантата, ангиогенеза или эндотоксического шока.
В других вариантах выполнения раскрыты способы индукции иммунного ответа у субъекта, страдающего аллергическим заболеванием. Такие способы предусматривают введение субъекту соединения формулы I в количестве, достаточном для индукции иммунного ответа.
В другом варианте выполнения раскрыт способ индукции иммунного ответа у субъекта, страдающего астмой. Способ предусматривает введение субъекту соединения формулы I в количестве, достаточном для индукции иммунного ответа. В некоторых вариантах выполнения астму могут лечить путем перенаправления иммунного ответа от секреции и эффекторного механизма цитокинов типа 2 (например, от продукции IgЕ и/или активации тучных клеток/базофилов).
В другом варианте выполнения раскрыт способ индукции иммунного ответа у субъекта, страдающего предраковыми состояниями. Способ предусматривает введение субъекту соединения формулы I в количестве, достаточном для индукции иммунного ответа. В некоторых таких вариантах выполнения предраковое состояние представляет собой старческий кератоз. В других вариантах выполнения предраковые состояния выбраны из старческого кератоза, атипических или диспластических невусах или предраковых лентиго. В другом варианте выполнения способа соединение формулы I местно вводят субъекту.
В других вариантах выполнения раскрыт способ ингибирования киназы у субъекта. Такие способы предусматривают введение субъекту соединения формулы I.
В другом варианте выполнения раскрыт способ модулирования иммунного ответа у субъекта. Способ предусматривает введение субъекту соединения формулы I в количестве, достаточном для ингибирования киназы у субъекта. В некоторых таких вариантах выполнения киназу выбирают из EGFr, c-Kit, bFGF, Kdr, CHK1, CDK, cdc-2, Akt, PDGF, PI3K, VEGF, PKA, PKB, src, c-Met, Аbl, Ras, RAF, MEK или их сочетаний. В другом варианте выполнения способа соединение формулы I местно вводят субъекту.
В другом варианте выполнения раскрыт способ индукции иммунного ответа у субъекта, предусматривающий введение субъекту соединения формулы I и антигена, причем соединение индуцирует и усиливает иммунный ответ субъекта на антиген. Более конкретно, антиген представляет собой антиген вируса гриппа или любой другой антиген, указанный в настоящем описании.
В другом варианте выполнения раскрыта композиция, содержащая соединение формулы I и другой агент. В некоторых вариантах выполнения другим агентом является иммуногенная композиция. В других вариантах выполнения агент представляет собой антиген. В других вариантах выполнения агент представляет собой вакцину, а соединение представляет собой вакцинный адъювант. В другом варианте выполнения композиция дополнительно содержит поли(лактидсогликолид) (PIG). В другом варианте выполнения композиция дополнительно содержит MF59 или другой адъювант.
В другом варианте выполнения способа соединение формулы I местно вводят субъекту.
В другом варианте выполнения раскрыта фармацевтическая композиция, содержащая соединение формулы I и фармацевтически приемлемый наполнитель.
В другом варианте выполнения способа соединение формулы I вводят местно. Более конкретно, соединение вводят местно в очаг повреждения, вызванного вирусной инфекцией. Более конкретно, вирусная инфекция представляет собой инфекцию вируса простого герпеса (HSV), еще более конкретно, инфекцию вируса простого герпеса II типа. В другом варианте выполнения вирус представляет собой вирус папилломы человека (HPV). Альтернативно, соединение формулы I вводят местно в очаг повреждения, вызванного старческим кератозом.
В другом варианте выполнения настоящего изобретения раскрыт способ стимулирования продукции TLR-7, предусматривающий введение соединения формулы I. В другом варианте выполнения раскрыт способ стимулирования продукции TLR-8, предусматривающий введение соединения формулы I. В другом варианте выполнения раскрыт способ стимулирования продукции TLR-7 и TLR-8, предусматривающий введение соединения формулы I.
Соединения согласно настоящему изобретению вызывают иммунопотенциирование и стимуляцию продукции TLR-7 и TLR-8. Такие соединения могут быть использованы в качестве поликлональных активаторов для продукции антигенов. Более конкретно, изобретение относится к способу получения моноклональных антител с желаемой антигенной специфичностью, предусматривающему взаимодействие соединений согласно настоящему изобретению (таких как соединения формулы I) с иммортализованными В-клетками памяти.
Продуцированные ими моноклональные антитела или их фрагменты могут быть использованы для лечения заболевания, для профилактики заболевания или для диагностики заболевания. Диагностические способы могут предусматривать взаимодействие антитела или фрагмента антитела с образцом. Диагностические способы также могут предусматривать обнаружение комплекса антиген/антитело.
Подлежащие трансформации В-клетки памяти могут происходить из различных источников (например, из цельной крови, из мононуклеарных клеток периферической крови (РВМС), из культуры клеток крови, из костного мозга, из органов и т.д.), и подходящие способы получения В-клеток человека хорошо известны из предшествующего уровня техники. Образцы могут содержать клетки, которые не являются В-клетками памяти или другими клетками крови.
Субпопуляция специфичных человеческих В-лимфоцитов памяти, характеризующаяся желаемой антигенной специфичностью, может быть отобрана перед стадией трансформации в соответствии с методиками, известными в данной области техники. В одном варианте выполнения субпопуляция человеческих В-лимфоцитов памяти характеризуется специфичностью в отношении вируса, например, В-клетки берут у пациента, страдающего или выздоровевшего от вирусной инфекции. В другом варианте выполнения В-клетки берут у субъектов, страдающих болезнью Альцгеймера, и они содержат В-клетки, специфичные в отношении β-амилоида (например, Mattson & Chan (2003) Science 301:1 847-9; и т.д.).
В другом варианте выполнения раскрыт способ получения иммортализованных В-лимфоцитов памяти, предусматривающий стадию трансформации В-лимфоцитов памяти с помощью вируса Эпштейна-Барр в присутствии соединения согласно настоящему изобретению, такого как соединение формулы I. См. WO 04/76677.
Изобретение также относится к фармацевтическим композициям, содержащим любое из указанных выше соединений или вариантов выполнения формулы I. Такие композиции могут содержать другие фармацевтически приемлемые ингредиенты, такие как один или несколько наполнителей, носителей и тому подобных веществ, хорошо известных специалистам в данной области техники.
Подразумевается, что изобретение охватывает все возможные сочетания описанных выше вариантов выполнения. В некоторых вариантах выполнения каждого из описанных в настоящем описании соединения и способов каждый из R4 и R5 соединений формулы (I) представляет собой Н.
Имидазохинолиновые соединения могут быть использованы с антигеном или без него в терапевтических приложениях, например, для лечения злокачественных опухолей или инфекционных заболеваний. Имидазохинолиновые соединения также могут быть использованы в сочетании с другими терапевтическими средствами, такими как противовирусные средства и моноклональные антитела, в различных терапевтических приложениях.
Один вариант выполнения способа индукции иммуностимулирующего эффекта у пациента предусматривает введение иммуногенной композиции, содержащей вакцину в количестве, эффективно стимулирующем иммунный ответ, такой как клеточный иммунный ответ, и имидазохинолиновое соединение в качестве вакцинного адъюванта в количестве, эффективно потенциирующем иммунный ответ на вакцину, такой как клеточный иммунный ответ.
Средства, сочетаемые с имидазохинолиновыми соединениями, предположительно, применимые для лечения указанных выше заболеваний, включают в себя средства, хорошо известные из уровня техники, такие как без ограничения анестетики, снотворные седативные средства, анксиолитики, противоэпилептические средства, жаропонижающие противовоспалительные средства, стимуляторы, амины бодрствования, средства против болезни Паркинсона, антипсихоневротические средства, средства для лечения нарушений центральной нервной системы, релаксанты скелетной мускулатуры, средства для лечения нарушений вегетативной нервной системы, спазмолитики, цитотоксические средства, моноклональные антитела, глазные лекарственные средства, лекарственные средства для лечения нарушений носа и уха, средства против вертиго, кардиотоники, антиаритмические средства, диуретики, антигипертонические средства, сосудосуживающие средства, коронарные сосудорасширяющие средства, периферические сосудорасширяющие средства, антигиперлипидемические средства, стимуляторы дыхания, средства против кашля и отхаркивающие средства, бронходилятаторы, антиаллергические средства, средства против диареи, средства против кишечных нарушений, средства против пептических язв, способствующие желудочному пищеварению средства, антациды, желчегонные средства, связанные с гормонами гипофиза средства, связанные со слюнными железами гормоны, связанные с тиреоидным гормоном средства, антитиреоидные средства, анаболические стероиды, кортикостероиды, андрогенные средства, эстрогенные средства, связанные с гормонами желтого тела средства, смешанные гормоны, средства для лечения нарушений органов мочеполовой системы, средства для лечения нарушений ануса, средства для хирургической стерилизации/антисептики, раневые протекторы, наружные средства для лечения гнойных заболеваний, анальгетики, средства против зуда, вяжущие средства, противовоспалительные средства, наружные средства для лечения паразитарных заболеваний кожи, смягчающие кожу средства, прижигающие средства, средства для лечения нарушений зубов/ротовой полости, витамины, неорганические препараты, вспомогательные жидкости, кровоостанавливающие средства, антикоагуляционные средства, средства для лечения заболеваний печени, антидоты, средства против привычной интоксикации, средства для лечения подагры, ферментные препараты, антидиабетические средства, антионкотические средства, антигистаминные средства, антибиотики (такие как кетолиды, аминогликозиды, сульфонамиды и/или бета-лактамы), химиотерапевтические средства, биологические препараты, противоглистные средства, антипротозойные средства, средства для препаратов, рентгеноконтрастные среды и диагностические средства.
Раскрыты дополнительные способы согласно изобретению, в соответствии с которыми описанные в настоящем описании композиции используют для лечения злокачественных опухолей и замедления опухолевого роста. В одном варианте выполнения имидазохинолиновое соединение согласно изобретению объединяют с известным mAb для лечения злокачественных опухолей. В одном таком варианте выполнения антитело и имидазохинолиновое соединение вводят нуждающемуся в этом субъекту. В некоторых таких вариантах выполнения антитело отдельно оказывает ингибирующий эффект на рост опухолевых клеток, а имидазохинолиновое соединение индуцирует продукцию цитокинов.
В соответствии с другим вариантом выполнения настоящего изобретения раскрыта терапевтическая композиция для ингибирования роста опухолевых клеток у субъекта. Такие композиции содержат эффективное количество сочетания, по меньшей мере, одного имидазохинолинового соединения, по меньшей мере, одного mAb, и, по меньшей мере, одного фармацевтически приемлемого носителя. В таких вариантах выполнения сочетание более эффективно ингибирует рост определенных опухолевых клеток млекопитающих, чем любые отдельно вводимые средства.
В другом варианте выполнения раскрыты способы лечения злокачественных опухолей, в соответствии с которыми известные противораковые средства объединяют с имидазохинолиновыми соединениями для замедления опухолевого роста у субъекта. Ряд подходящих противораковых средств предполагается использовать в таких способах. Действительно, в соответствии с настоящим изобретением предполагается без ограничения вводить многочисленные противораковые средства, включая без ограничения фенретинид, ваталаниб, SU-11248, SU 5416, SU 6668, оксалиплатин, бортезомиб, R 115777, СЕР-701, ZD-6474, MLN-518, лапатиниб, гефитиниб (Iressa), эрлотиниб (Tarceva), перифозин, CYC-202, LY-317615, скваламин, UCN-01, мидостаурин, ирофульвен, стауроспорин, алвоцидиб, генистеин, DA-9601, авицин, доцетаксел, IM 862, SU 101 и тетратиомолибдат, а также другие средства, индуцирующие апоптоз, такие как без ограничения полинуклеотиды (например, рибозимы); полипептиды (например, ферменты); лекарственные средства; биологические миметики; 25 алкалоидов; алкилирующие агенты; противоопухолевые антибиотики; антиметаболиты; гормоны; соединения платины; моноклональные антитела, конъюгированные с противораковыми средствами, токсинами и/или радионуклидами; модификаторы биологического ответа (например, интерфероны [например, α-IFN и т.д.] и интерлейкины [например, IL-2 и т.д.] и т.д.); средства для адоптивной иммунотерапии; кроветворные факторы роста; средства, индуцирующие дифференцировку опухолевых клеток (например, полностью транс-ретиноевая кислота и т.д.); реагенты для генной терапии; реагенты и нуклеотиды для антисмысловой терапии; противоопухолевые вакцины; и ингибиторы ангиогенеза и т.п. Известно и очевидно специалистам в данной области техники множество других примеров химиотерапевтических соединений и противораковых терапевтических средств, подходящих для совместного введения с раскрытыми имидазохинолиновыми соединениями.
В некоторых вариантах выполнения противораковые средства включают в себя средства, индуцирующие или стимулирующие апоптоз. Средства, индуцирующие апоптоз, включают в себя без ограничения излучение (например, W); ингибиторы киназ (например, ингибитор киназы рецептора эпидермального фактора роста, ингибитор киназы рецептора сосудистого фактора роста, ингибитор киназы рецептора фибробластного фактора роста-5, ингибитор киназы рецептора I тромбоцитарного фактора роста, ингибиторы киназ EGFr и Bcr-Abl, такие как Gleevec, Iressa и Tarceva); антисмысловые молекулы; антитела [например, Herceptin и Rituxan], антиэстрогенные средства [например, ралоксифен и тамоксифен]; антиандрогенные средства [например, флутамид, бикалутамид, финастерид, аминоглутетамид, кетоконазол и кортикостероиды]; ингибиторы циклооксигеназы-2 (СОХ-2) [например, Celecoxib, мелоксикам, NS-398 и нестероидные противоспалительные средства I (НСПВС)]; и противораковые химиотерапевтические средства [например, СРТ-11, флударабин (Fludara), декарбазин (DTIC), дексаметазон, митоксантрон, Mylotarg, цисплатин, 5-FU, Doxrubicin, Taxotere или таксол]; молекулы передачи клеточного сигнала; церамиды и цитокины; и т.п. также могут быть введены субъектам в сочетании с имидазохинолинами формулы I.
В других вариантах выполнения раскрыты способы лечения аллергий. Такие способы предусматривают введение имидазохинолинового соединения отдельно или в сочетании с другим средством, достоверно эффективным против аллергий. В таких вариантах выполнения сочетание более эффективно для лечения аллергического состояния, чем известное(ые) средство(а) без добавления имидазохинолинового соединения. В некоторых таких вариантах выполнения известное средство представляет собой антигистаминное средство и/или ингибитор лейкотриенов. В других вариантах выполнения аллергическое состояние представляет собой астму. В других вариантах выполнения аллергическое состояние выбирают из аллергического ринита, дерматоза или крапивница. В некоторых таких вариантах выполнения сочетание вводят субъекту энтерально, парентерально, интраназально, подкожно или внутриартериально.
Вакцинные композиции, подпадающие под объем настоящего изобретения, могут содержать дополнительный(ые) адъювант(ы). В некоторых вариантах выполнения адъюванты для повышения эффективности композиции включают в себя без ограничения (1) соли алюминия (квасцы), такие как гидроксид алюминия, фосфат алюминия, сульфат алюминия и т.д.; (2) эмульсионные составы "масло-в-воде" (со специфичными иммуностимуляторами, такими как мурамилпептиды или компоненты бактериальной клеточной стенки, или без них), такие как, например, (a) MF59TM (WO 90/14837), содержащий 5% сквален, 0,5% Tween 80 и 0,5% Span 85 (необязательно содержащий МТР-РЕ), приготовленный в виде субмикронных частиц с помощью микрофлуидайзера, (b) SAF, содержащий 5% сквален, 0,5% Tween 80, 5% Pluronic-блоксополимер L121 и thr-MDP либо микрофлуидизированный в субмикронную эмульсию, либо полученный в виде эмульсии с частицами большего размера путем встряхивания, и (с) адъювантная система RibiTM (RAS), (Ribi Immunochem, Hamilton, MT), содержащая 2% сквален, 0,2% Tween 80 и один или несколько компонентов бактериальной клеточной стенки из группы, состоящей из монофосфориллипида A (MPL), трегалозодимиколата (TDM) и скелета клеточной стенки (CWS), предпочтительно, MPL+CWS (DetoxTM); (3) могут быть использованы сапонинсодержащие адъюванты, такие как QS21 или StimulonTM (Cambridge Bioscience, Worcester, MA) или полученные из них частицы, такие как ISCOM (иммуностимулирующие комплексы), причем указанные ISCOM могут не содержать дополнительное поверхностно-активное вещество, как описано, например, в WO 00/07621; (4) полный адъювант Фройнда (CFA) и неполный адъювант Фройнда (IFA); (5) цитокины, такие как интерлейкины (например, IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-12 (WO 99/44636) и т.д.), интерфероны (например, интерферон-гамма), макрофагальный колониестимулирующий фактор (M-CSF), фактор некроза опухоли (TNF) и т.д.; (6) монофосфориллипид А (MPL) или 3-O-дезацилированный MPL (3dMPL), необязательно по существу не содержащие квасцы при использовании с пневмококковыми сахаридами, например, WO 00/56358; и RC529 (7) сочетания 3dMPL, например, с QS21 и/или с эмульсиями "масло-в-воде", например, ЕР-А-0835318; (8) олигонуклеотиды, содержащие мотивы CpG, т.е. содержащие, по меньшей мере, один динуклеотид CG, с 5-метилцитозином, необязательно используемым вместо цитозина; (9) полиоксиэтиленовый эфир или сложный полиоксиэтиленовый эфир, например, WO 99/52549; (10) поверхностно-активный сложный полиоксиэтиленсорбитановый эфир в сочетании с октоксинолом (WO 0121207) или поверхностно-активный полиоксиэтиленалкильный эфир или сложный полиоксиэтиленалкильный эфир в сочетании, по меньшей мере, с одним дополнительным неионогенным поверхностно-активным веществом, таким как октоксинол (WO 01/21152); (11) сапонин и иммуностимулирующий олигонуклеотид (например, олигонуклеотид CpG) (WO 00/62800); (12) иммуностимулятор и частицы соли металла, например, WO 00/23105; (13) сапонин и эмульсия "масло-в-воде", например, WO 99/11241; (14) сапонин (например, QS21)+3dMPL+IL-12 (необязательно+стерин), например, WO 98/57659; (14) другие вещества, действующие как иммуностимуляторы, для повышения эффективности композиции. В некоторых вариантах выполнения квасцы (особенно фосфат и/или гидроксид алюминия) и MF59 используют с сахаридными антигенами.
Изобретение также относится к способам введения вакцинных композиций. В некоторых вариантах выполнения вакцину вводят субъекту в количестве, эффективно стимулирующем иммунный ответ. Количество, составляющее эффективное количество, зависит, помимо прочего, от конкретной используемой вакцины, конкретного вводимого адъювантного соединения и его количества, вида желаемого индуцируемого иммунного ответа (гуморальный или клеточный), состояния иммунной системы (например, супрессированного, ослабленного, стимулированного) и желаемого терапевтического результата. Соответственно, нецелесообразно указывать определенное количество, составляющее эффективное количество вакцины. Однако средние специалисты в данной области техники могут легко определить подходящее количество, уделив надлежащее внимание таким факторам.
Вакцинные композиции согласно изобретению могут быть введены различным животным субъектам, включая млекопитающих, таких как человек и отличные от человека субъекты, включая, например, карманных питомцев, птицу и т.п., в соответствии со стандартными способами, хорошо известными специалистам в данной области техники (например, перорально, подкожно, назально, местно).
Подходящие вакцины включают в себя без ограничения любое вещество, индуцирующее либо гуморальный, либо клеточный, либо оба типа иммунного ответа. Подходящие вакцины содержат антигены живых вирусов и бактерий и инактивированные вирусные, опухолевые, протозойные, микробные, грибковые и бактериальные антигены, анатоксины, токсины, полисахариды, белки, гликопротеиды, пептиды и т.п. Также могут быть использованы традиционные вакцины, такие как вакцины, используемые против BCG (живые бактерии), холеры, чумы и брюшного тифа (убитые бактерии), гепатита В, гриппа, полиомиелита (инактивированный вирус) и бешенства (инактивированный вирус), кори, эпидемического паротита, краснухи, полиомиелита (пероральная вакцина), SARS и желтой лихорадки (живой вирус), столбняка и дифтерии (анатоксины), Haemophilus influenzae типа b, менингококков и пневмококков (бактериальные полисахариды). В соответствии с настоящим изобретением может быть использован любой антиген, известный из предшествующего уровня техники или раскрытый в настоящем описании.
Кроме того, предполагается, что некоторые экспериментальные в настоящее время вакцины, особенно такие вещества, как рекомбинантные белки, гликопротеиды и пептиды, не вызывающие сильного иммунного ответа, также найдут применение в сочетании с имидазохинолиновыми соединениями согласно изобретению. Показательные экспериментальные субъединичные антигены включают в себя без ограничения антигены, связанные с такими вирусными заболеваниями, как аденовирусная инфекция, синдром приобретенного иммунодефицита человека (СПИД), ветряная оспа, цитомегаловирусная инфекция, лихорадка денге, лейкоз кошек, чума птиц, гепатит А, гепатит В, гепатит С, HSV-1, HSV-2, холера свиней, грипп А, грипп В, японский энцефалит, корь, парагрипп, бешенство, респираторно-синцитиальная вирусная инфекция, SARS, ротавирусная инфекция, бородавки и желтая лихорадка.
Конкретные антигены, применимые в соответствии с изобретением, включают в себя без ограничения антигены, указанные ниже. Число(а) в скобках отсылает(ют) к источнику(ам), содержащему(им) сведения об антигене. Перечень источников приведен после перечня антигенов, и каждый источник включен сюда во всей полноте посредством ссылки и для любых целей считается полностью изложенным в настоящем описании.
Конкретные антигены включают в себя белковый антиген N.meningitidis серогруппы В (1-7); препарат везикул внешней мембраны (OMV) N.meningitidis серогруппы В (8, 9, 10, 11); сахаридный антиген N.meningitidis серогрупп А, С, W135 и/или Y, такой как олигосахарид (12) серогруппы С (13); сахаридный антиген Streptococcus pneumoniae (14, 15, 16); антиген N.gonorrhoeae (1, 2, 3); антиген Chlamydia pneumoniae (17, 18, 19, 20, 21, 22, 23); антиген Chlamydia trachomatis (24); антиген вируса гепатита А, такой как инактивированный вирус (25, 26); антиген вируса гепатита В, такой как поверхностный и/или коровый антигены (например, 26, 27); антиген вируса гепатита С (28); антиген Bordetella pertussis, такой как коклюшный голотоксин (РТ) и волокнистый гемагглютинин (FHA) В.pertussis, необязательно также в сочетании с пертактином и/или агглютиногенами 2 и 3 (29, 30); дифтерийный антиген, такой как дифтерийный анатоксин (31: глава 3) например, мутант CRM197 (32); столбнячный антиген, такой как столбнячный анатоксин (31: глава 4); белковый антиген Helicobacter pylori, такой как СаgА (33), VacA (33), NAP (34), HopX (5), HopY (35) и/или уреаза; сахаридный антиген Haemophilus influenzae В (13); антиген Porphyromonas gingivalis (36); антиген(ы) полиовируса (37, 38), такие как IPV или OPV; антиген(ы) вируса бешенства (39), такие как лиофилизированный инактивированный вирус (40, RabAvertTM); антигены возбудителей кори, эпидемического паротита и/или краснухи (31: главы 9, 10 и 11); антиген(ы) вируса гриппа (31: глава 19), такие как поверхностные белки гемагглютинин и/или нейраминидаза; антиген Moraxelta catarrhalis (41); антиген Streptococcus agalactiae (стрептококка группы В) (42, 43); антиген Streptococcus pyogenes (стрептококка группы А) (43, 44, 45) и антиген Staphylococcus aureus (46). Композиции согласно изобретению могут содержать один или несколько из указанных выше антигенов.
В некоторых вариантах выполнения низкомолекулярные иммунопотенциирующие соединения согласно изобретению применяют в адъювантных системах, в композициях для введения вакцин против гриппа. В некоторых таких вариантах выполнения применяют одно или несколько низкомолекулярных иммунопотенциирующих соединений согласно изобретению, необязательно в сочетании с другим адъювантом, таким как адъювант MF59, и одним или несколькими антигенами вируса гриппа (31: глава 19), такими как поверхностные белки гемагглютинин и/или нейраминидаза.
В вариантах выполнения, в которых используют сахаридный или углеводный антиген, сахаридный или углеводный антиген могут быть конъюгированы с белком-носителем для повышения антигенности (47-56). В некоторых вариантах выполнения белками-носителями являются бактериальные токсины или анатоксины, такие как дифтерийный или столбнячный анатоксины. Одним примером такого анатоксина является дифтерийный анатоксин CRM197. Другие подходящие белки-носители включают в себя белок внешней мембраны N.meningitidis (57), синтетические пептиды (58, 59), белки теплового шока (60), белки возбудителя коклюша (61, 62), белок D H.influenzae (63), токсин А или В С.difficile (64) и т.д. В вариантах выполнения, в которых смесь содержит капсульные сахариды менингококков как серогруппы А, так и серогруппы С, массовое отношение сахарид МеnА:сахарид МеnС может быть больше 1 (например, 2:1, 3:1, 4:4, 5:1, 10:1 или более). Сахариды N.meningitidis различных серогрупп могут быть конъюгированы с одинаковыми или различными белками-носителями.
Может быть использована любая подходящая реакция конъюгирования с использованием при необходимости любого подходящего линкера. Токсичные белковые антигены могут быть при необходимости обезврежены (например, детоксификация коклюшного токсина химическими и/или генетическими средствами (30)). Если в состав композиции включен дифтерийный антиген, также предпочтительным является включение в состав столбнячного антигена и коклюшных антигенов. Аналогично, если присутствует столбнячный антиген, также предпочтительным является включение в состав дифтерийных и коклюшных антигенов. Аналогично, если присутствует коклюшный антиген, также предпочтительным является включение в состав дифтерийных и столбнячных антигенов.
Адъюванты:
Вакцины согласно изобретению могут быть введены в сочетании с другими иммунорегуляторными агентами. В частности, композиции обычно содержат адъювант. Адъюванты, применимые в соответствии с изобретением, включают в себя без ограничения один или несколько из следующего приведенного ниже перечня:
А. Минералсодержащие композиции
Минералсодержащие композиции, пригодные для использования в качестве адъювантов в соответствии с изобретением, содержат минеральные соли, такие как соли алюминия и соли кальция. Изобретение предусматривает использование минеральных солей, таких как гидроксиды (например, оксигидроксиды), фосфаты (например, гидроксифосфаты, ортофосфаты), сульфаты и т.д. [см., например, главы 8 и 9 Vaccine Design… (1995) eds. Powell & Newman. ISBN: 030644867X. Plenum.), или смесей различных минеральных соединений (например, смеси адъюванта на основе фосфата или гидроксида), причем указанные соединения принимают любую подходящую форму (например, геля, кристаллического вещества, аморфного вещества и т.д.), причем предпочтительной является адсорбция. Минералсодержащие композиции также могут быть приготовлены в форме частиц солей металлов (WO 00/23105).
Соли алюминия могут быть включены в состав вакцин согласно изобретению таким образом, что доза Al3+ составляет от 0,2 до 1,0 мг на дозу.
В одном варианте выполнения адъювант на основе алюминия, применимый в соответствии с настоящим изобретением, представляет собой квасцы (сульфат алюминия-калия (AIK(SO4)2)) или производные квасцов, такие как производные, получаемые in situ путем смешивания антигена в фосфатном буфере с квасцами с последующим титрованием и осаждением основанием, таким как гидроксид аммония или гидроксид натрия.
Другой адъювант на основе алюминия, применимый в соответствии с настоящим изобретением, представляет собой адъювант на основе гидроксида алюминия (Аl(ОН)3) или кристаллический оксигидроксид алюминия (AIOOH), являющийся превосходным адсорбентом, характеризующимся площадью поверхности, составляющей около 500 м2/г. Альтернативно, используют адъювант на основе фосфата алюминия (АlРO4) или гидроксифосфат алюминия, содержащий фосфатные группы вместо некоторых или всех гидроксигрупп адъюванта на основе гидроксида алюминия. Предпочтительные адъюванты на основе фосфата алюминия, применимые в соответствии с настоящим изобретением, являются аморфными и растворимыми в кислой, основной и нейтральной средах.
В другом варианте выполнения адъювант согласно изобретению содержит как фосфат алюминия, так и гидроксид алюминия. В его более конкретном варианте выполнения адъювант содержит большее количество фосфата алюминия, чем гидроксида алюминия, например, с отношением 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1 или более 9:1 по массе фосфата алюминия к массе гидроксида алюминия. Еще более конкретно, соли алюминия в вакцине находятся в количестве от 0,4 до 1,0 мг на дозу вакцины или от 0,4 до 0,8 мг на дозу вакцины или от 0,5 до 0,7 мг на дозу вакцины или около 0,6 мг на дозу вакцины.
Вообще, предпочтительный(ые) адъювант(ы) на основе алюминия или отношение множественных адъювантов на основе алюминия, такое как отношение фосфата алюминия к гидроксиду алюминия, выбирают путем оптимизации электростатического притяжения между молекулами таким образом, чтобы при желаемом значении рН антиген характеризовался зарядом, противоположным таковому адъюванта. Например, при значении рН 7,4 фосфат на основе фосфата алюминия (ИЭТ=4) адсорбирует лизоцим, но не альбумин. Если мишенью является альбумин, должен быть выбран адъювант на основе гидроксида алюминия (ИЭТ=11,4). Альтернативно, предварительная обработка гидроксида алюминия фосфатом снижает его изоэлектрическую точку, что делает его предпочтительным адъювантом для более основных антигенов.
В. Масляные эмульсии
Композиции в форме масляной эмульсии, пригодные для использования в качестве адъювантов в соответствии с изобретением, включают в себя эмульсии сквалена-воды, такие как MF59 (5% сквалена, 0,5% Tween 80 и 0,5% Span 85, приготовленные в виде субмикронных частиц с помощью микрофлуидайзера). См. WO 90/14837. См. также Podda, "The adjuvanted influenza vaccines with novel adjuvants: experience with the MF59-adjuvanted vaccine", Vaccine (2001) 19: 2673-2680; Frey et al., "Comparison of the safety, tolerability, and immunogenicity of a MF59-adjuvanted influenza vaccine and a non-adjuvanted influenza vaccine in non-elderly adults", Vaccine (2003) 21:4234-4237. MF59 используют в качестве адъюванта в трехвалентной субъединичной вакцине против вируса гриппа FLUADTM.
Особенно предпочтительными адъювантами, применимыми в составе композиций, являются субмикронные эмульсии "масло-в-воде". Предпочтительными субмикронными эмульсиями "масло-в-воде", применимыми в составе композиций, являются эмульсии сквалена/воды, необязательно содержащие варьирующие количества МТР-РЕ, такие как субмикронная эмульсия "масло-в-воде", содержащая 4-5% (мас./об.) сквалена, 0,25-1,0% (мас./об.) Tween 80TM (полиоксиэтиленсорбитанмоноолеата) и/или 0,25-1,0% Span 85TM (сорбитантриолеата) и, необязательно, N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1',2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)этиламин (МТР-РЕ), например, субмикронная эмульсия "масло-в-воде", известная как "MF59" (международная публикация № WO 90/14837; патенты США №6,299,884 и 6,451,325, и Ott et al., "MF59 - Design and Evaluation of a Safe и Potent Adjuvant for Human Vaccines" в Vaccine Design: The Subunit and Adjuvant Approach (Powell, M.F. and Newman, M.J. eds.) Plenum Press, New York, 1995, pp.277-296). MF59 содержит 4-5% (мас./об.) сквалена (например, 4,3%), 0,25-0,5% (мас./об.) Tween 80TM и 0,5% (мас./об.) Span 85TM и необязательно содержит варьирующие количества МТР-РЕ, приготовленные в виде субмикронных частиц с помощью микрофлуидайзера, такого как микрофлуидайзер модели 110Y (Microfluidics, Newton, MA). Например, МТР-РЕ может содержаться в количестве, составляющем около 0-500 мкг на дозу, более предпочтительно, 0-250 мкг на дозу и, наиболее предпочтительно, 0-100 мкг на дозу. Используемый здесь термин "MF59-0" относится к указанной выше субмикронной эмульсии "масло-в-воде", не содержащей МТР-РЕ, тогда как термин "MF59-MTP" означает состав, содержащий МТР-РЕ. Например, "MF59-100" содержит 100 мкг МТР-РЕ на дозу и т.д. MF69, другая применимая в составе композиций согласно изобретению субмикронная эмульсия "масло-в-воде", содержит 4,3% (мас./об.) сквалена, 0,25% (мас./об.) Tween 80TM и 0,75% (мас./об.) Span 85TM и необязательно МТР-РЕ. Еще одной субмикронной эмульсией "масло-в-воде" является MF75, также известная как SAF, содержащая 10% сквалена, 0,4% Tween 80TM, 5% Pluronic-блоксополимера L121 и thr-MDP, также микрофлуидизированная в субмикронную эмульсию. "MF75-МТР" означает состав MF75, содержащий МТР, например, 100-400 мкг МТР-РЕ на дозу.
Субмикронные эмульсии "масло-в-воде", способы их приготовления и иммуностимуляторы, такие как мурамилпептиды, применимые в составе композиций, подробно описаны в международной публикации № WO 90/14837 и патентах США №№6,299,884 и 6,451,325.
Также в качестве адъювантов согласно изобретению могут быть использованы полный адъювант Фройнда (CFA) и неполный адъювант Фройнда (IFA).
С. Сапонинсодержащие составы
В качестве адъювантов в соответствии с изобретением также могут быть использованы сапонинсодержащие составы. Сапонины представляют собой разнородную группу стероидных гликозидов и тритерпеноидных гликозидов, которые содержатся в коре, листьях, стеблях, корнях и даже цветках широкого круга видов растений. В качестве адъюванта был хорошо исследован сапонин из коры мыльного дерева Quillaia saponaria Molina. Сапонины также могут быть промышленно получены из Smilax ornata (сарсапарели), Gypsophilla paniculata (гипсофилы ползучей) и Saponaria officinalis (мыльного корня). Сапонинсодержащие адъювантные составы включают в себя очищенные составы, такие как QS21, равно как и липидные составы, такие как ISCOM.
Сапонинсодержащие композиции очищали по методу высокоэффективной тонкослойной хроматографии (ВЭ-ТСХ) и обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ). С помощью этих методов были выделены конкретные очищенные фракции, включая QS7, QS17, QS18, QS21, QH-A, QH-B и QH-C. Предпочтительно, сапонин представляет собой QS21. Методика получения QS21 описана в патенте США №5,057,540. Сапонинсодержащие составы также могут содержать стерин, такой как холестерин (см. WO 96/33739).
Сочетания сапонинов и холестеринов могут быть использованы для формирования уникальных частиц, называемых иммуностимулирующими комплексами (ISCOM). ISCOM, как правило, также содержат фосфолипид, такой как фосфатидилэтаноламин или фосфатидилхолин. Для получения ISCOM может быть использован любой известный сапонин. Предпочтительно, ISCOM содержит один или несколько из QuilA, QHA и QHC. ISCOM более подробно описаны в ЕР 0109942, WO 96/11711 и WO 96/33739. ISCOM необязательно могут не содержать дополнительного(ых) поверхностно-активного(ых) вещества(веществ). См. WO 00/07621.
С обзором разработки адъювантов на основе сапонинов можно ознакомиться в Barr, et al., "ISCOMs and other saponin based adjuvants", Advanced Drug Delivery Reviews (1998) 32:247-271. См. также Sjolander, et al., "Uptake and adjuvant activity of orally delivered saponin and ISCOM vaccines", Advanced Drug Delivery Reviews (1998) 32:321-338.
D. Виросомы и вирусоподобные частицы (VLP)
Виросомы и вирусоподобные частицы (VLP) также могут быть использованы в качестве адъювантов в соответствии с изобретением. Эти структуры, как правило, содержат один или несколько вирусных белков, необязательно объединенных или включенных в композицию с фосфолипидом. Как правило, они не патогенны, не способны к репликации и не содержат каких-либо частей нативного вирусного генома. Вирусные белки могут быть получены в соответствии с рекомбинантными методиками или выделены из цельных вирусов. Такие вирусные белки, пригодные для использования в получении виросом или VLP, включают в себя белки, полученные из вируса гриппа (такие как НА или NA), вируса гепатита В (такие как коровые или капсидные белки), вируса гепатита Е, вируса кори, вируса Синдбис, ротавируса, вируса ящура, ретровируса, вируса Норуолк, вируса папилломы человека, ВИЧ, РНК-фагов, Qβ-фага (такие как белки оболочки), GA-фага, fr-фага, фага АР205 и Ту (такие как белок р1 ретротранспозона Ту). VLP более подробно обсуждаются в WO 03/024480, WO 03/024481 и Niikura et al., "Chimeric Recombinant Hepatitis E Virus-Like Particles as an Oral Vaccine Vehicle Presenting Foreign Epitopes", Virology (2002) 293:273-280; Lenz et al., "Papillomavirus-Like Particles Induce Acute Activation of Dendritic Cells", Journal of Immunology (2001) 5246-5355; Pinto, et al., "Cellular Immune Responses to Human Papillomavirus (HPV)-16 L1 Healthy Volunteers Immunized with Recombinant HPV-16 L1 Virus-Like Particles", Journal of Infectious Diseases (2003) 188:327-338; и Gerber et al., "Human Papillomavirus Virus-Like Particles Are Efficient Oral Immunogens when Coadministered with Escherichia coli Heat-Labile Entertoxin Mutant R192G или CpG", Journal of Virology (2001) 75(10):4752-4760. Виросомы более подробно обсуждаются, например, в Gluck et al., "New Technology Platforms in the Development of Vaccines for the Future", Vaccine (2002) 20:B10-B16. Иммунопотенциирующие восстановленные виросомы на основе вируса гриппа (IRIV) используют в качестве системы доставки субъединичного антигена в интраназальном трехвалентном продукте INFLEXALTM {Mischler & Metcalfe (2002) Vaccine 20 Suppl 5:B17-23} и продукте INFLUVAC PLUSTM.
Е. Бактериальные или микробные производные
Адъюванты, пригодные для использования в соответствии с изобретением, включают в себя бактериальные или микробные производные, такие как:
(1) Нетоксичные производные энтеробактериального липополисахарида (LPS)
Такие производные включают в себя монофосфориллипид A (MPL) и 3-O-дезацилированный MPL (3dMPL). 3dMPL представляет собой смесь 3-дез-O-ацилированного монофосфориллипида А с 4, 5 или 6 ацилированными цепями. Предпочтительная форма 3-дез-O-ацилированного монофосфориллипида А в виде "мелких частиц" описана в ЕР 0689454. Такие "мелкие частицы" 3dMPL достаточно малы для того, чтобы стерильно фильтроваться через мембрану с размером ячеи 0,22 микрона (см. ЕР 0689454). Другие нетоксичные производные LPS включают в себя миметики монофосфориллипида А, такие как производные аминоалкилглюкозаминидфосфата, например, RC-529. См. Johnson et al. (1999) Bioorg. Med. Chem. Lett. 9:2273-2278.
(2) Производные липида А
Производные липида А включают в себя производные липида А из Escherichia coli, такие как ОМ-174. ОМ-174 описан, например, в Meraldi et al., "ОМ-174, а New Adjuvant with a Potential for Human Use, Induces a Protective Response with Administered with the Synthetic C-Terminal Fragment 242-310 from the circumsporozoite protein of Plasmodium berghei", Vaccine (2003) 21:2485-2491; и Pajak, et al., "The Adjuvant OM-174 induces both the migration and maturation of murine dendritic cells in vivo", Vaccine (2003) 21:836-842.
(3) Иммуностимулирующие олигонуклеотиды
Иммуностимулирующие олигонуклеотиды, пригодные для использования в качестве адъювантов в соответствии с изобретением, включают в себя нуклеотидные последовательности, содержащие мотив CpG (последовательность, состоящую из неметилированного цитозина, связанного фосфатной связью с гуанозином). Также был продемонстрирован иммуностимулирующий эффект бактериальных двухцепочечных РНК и олигонуклеотидов, содержащих палиндромные или поли(dG) последовательности.
CpG могут содержать нуклеотидные модификации/аналоги, такие как фосфоротиоатные модификации, и могут быть двухцепочечными или одноцепочечными. Необязательно, гуанозин может быть заменен аналогом, таким как 2'-дезокси-7-дезазагуанозин. Для ознакомления с возможными аналогичными заменами см. Kandimalla, et al., "Divergent synthetic nucleotide motif recognition pattern: design and development of potent immunomodulatory oligodeoxyribonucleotide agents with distinct cytokine induction profiles", Nucleic Acids Research (2003) 31(9): 2393-2400; WO 02/26757 и WO 99/62923. Адъювантный эффект олигонуклеотидов CpG более подробно обсуждается в Krieg, "CpG motifs: the active ingredient in bacterial extracts?", Nature Medicine (2003) 9(7): 831-835; McCluskie, et al., "Parenteral and mucosal prime-boost immunization strategies in mice with hepatitis В surface antigen и CpG DNA", FEMS Immunology и Medical Microbiology (2002) 32:179-185; WO 98/40100; патент США №6,207,646; патент США №6,239,116 и патент США №6,429,199.
Последовательность CpG, такая как мотив GTCGTT или TTCGTT, может быть направлена на TLR9. См. Kandimalla, et al., "Toll-like receptor 9: modulation of recognition and cytokine induction by novel synthetic CpG DNAs", Biochemical Society Transactions (2003) 31. (part 3); 654-658. Последовательность CpG, такая как CpG-A ODN, может специфично индуцировать Thl-зависимый иммунный ответ, или последовательность CpG, такая как CpG-B ODN, может более специфично индуцировать В-клеточный ответ. CpG-A и CpG-B ODN обсуждаются в Blackwell, et al., "CpG-A-Induced Monocyte IFN-gamma-Inducible Protein-10 Production is Regulated by Plasmacytoid Dendritic Cell Derived IFN-alpha", J. Immunol. (2003) 170(8):4061-4068; Krieg, "From A to Z on CpG", TRENDS in Immunology (2002) 23(2):64-65 и WO 01/95935. Предпочтительно, CpG представляет собой CpG-A ODN.
Предпочтительно, олигонуклеотид CpG предпочтительно конструируют таким образом, что 5'-конец доступен для распознавания рецептора. Необязательно, две олигонуклеотидные последовательности CpG могут быть соединены своими 3'-концами с образованием "иммуномеров". См., например, Kandimalla, et al., "Secondary structures in CpG oligonucleotides affect immunostimulatory activity", BBRC (2003) 306:948-953; Kandimalla, et al., "Toll-like receptor 9: modulation of recognition and cytokine induction by novel synthetic GpG DNAs", Biochemical Society Transactions (2003) 31 (part 3): 664-658; Bhagat et al., "CpG penta- and hexadeoxyribonucleotides as potent immunomodulatory agents" BBRC (2003) 300:853-861 и WO 03/035836.
(4) АДФ-рибозилирующие токсины и их обезвреженные производные
В качестве адъювантов в соответствии с изобретением могут быть использованы бактериальные АДФ-рибозилирующие токсины и их детоксифицированные производные. Белок предпочтительно происходит из Е.соli (из термолабильного энтеротоксина Е.соli "LT"), возбудителя холеры ("СТ") или возбудителя коклюша ("РТ"). Использование детоксифицированных АДФ-рибозилирующих токсинов в качестве мукозальных адъювантов описано в WO 95/17211, а в качестве парентеральных адъювантов - в WO 98/42375. Предпочтительно, адъювант представляет собой детоксифицированный мутант LT, такой как LT-K63, LT-R72 и LTR192G. Использование АДФ-рибозилирующих токсинов и их детоксифицированных производных, в частности, LT-K63 и LT-R72, в качестве адъювантов описан в следующих ссылках: Beignon, et al., "The LTR72 Mutant of Heat-Labile Enterotoxin of Escherichia coli Enahnces the Ability of Peptide Antigens to Elicit CD4+ Т Cells and Secrete Gamma Interferon after Coapplication onto Bare Skin", Infection and Immunity (2002) 70(6):3012-3019; Pizza, et al., "Mucosal vaccines: non toxic derivatives of LT и СТ as mucosal adjuvants", Vaccine (2001) 19:2534-2541; Pizza, et al., "LTK63 and LTR72, two mucosal adjuvants ready for clinical trials" Int. J. Med. Microbiol. (2000) 290(4-5):455-461; Scharton-Kersten et al., "Transcutaneous Immunization with Bacterial ADP-Ribosylating Exotoxins, Subunits and Unrelated Adjuvants", Infection and Immunity (2000) 68(9):5306-5313; Ryan et al., "Mutants of Escherichia coli Heat-Labile Toxin Act as Effective Mucosal Adjuvants for Nasal Delivery of an Acellular Pertussis Vaccine: Differential Effects of the NontoxicAB Complex and Enzyme Activity on Th1 and Th2 Cells" Infection and Immunity (1999) 67(12):6270-6280; Partidos et al., "Heat-labile enterotoxin of Escherichia coli and its site-directed mutant LTK63 enhance the proliferative and cytotoxic T-cell responses to intranasally co-immunized synthetic peptides", Immunol. Lett. (1999) 67(3):209-216; Peppoloni et al., "Mutants of the Escherichia coli heat-labile enterotoxin as safe and strong adjuvants for intranasal delivery of vaccines", Vaccines (2003) 2(2):285-293; и Pine et al., (2002) "Intranasal immunization with influenza vaccine and a detoxified mutant of heat labile enterotoxin from Escherichia coli (LTK63)" J. Control. Release (2002) 85(1-3):263-270. Численные обозначения аминокислотных замен предпочтительно основаны на результатах выравнивания субъединиц А и В АДФ-рибозилирующих токсинов, приведенных в Domenighini et al., Mol. Microbiol. (1995) 15(6): 1165-1167.
F. Биоадгезивные и мукоадгезивные вещества
Биоадгезивные и мукоадгезивные вещества также могут быть использованы в качестве адъювантов в соответствии с изобретением. Подходящие биоадгезивные вещества включают в себя микросферы этерифицированной гиалуроновой кислоты (Singh et al. (2001) J. Cont. Rele. 70:267-276) или мукоадгезивные вещества, такие как сшитые производные полиакриловой кислоты, поливиниловый спирт, поливинилпирролидон, полисахариды и карбоксиметилцеллюлоза. В качестве адъювантов в соответствии с изобретением также могут быть использованы хитозан и его производные. Например, WO 99/27960.
G. Микрочастицы
В качестве адъювантов в соответствии с изобретением также могут быть использованы микрочастицы. Предпочтительными являются микрочастицы (т.е. частица ~100 нм - ~150 мкм в диаметре, более предпочтительно ~200 нм - ~30 мкм в диаметре и наиболее предпочтительно ~500 нм - ~10 мкм в диаметре), образованные биоразлагаемыми и нетоксичными веществами (например, поли(α-гидроксикислотой), полигидроксимасляной кислотой, сложным полиортоэфиром, полиангидридом, поликапролактоном и т.д.), причем предпочтительным является поли(лактидсогликолид), необязательно обработанный с образованием отрицательно заряженной поверхности (например, SDS) или положительно заряженной поверхности (например, катионным поверхностно-активным веществом, таким как СТАВ).
Н. Липосомы
Примеры липосомных составов, пригодных для использования в качестве адъювантов, описаны в патенте США №6,090,406, патенте США №5,916,588 и ЕР 0626169.
I. Составы на основе полиоксиэтиленовых эфиров и сложных полиоксиэтиленовых эфиров
Адъюванты, пригодные для использования в соответствии с изобретением, включают в себя полиоксиэтиленовые эфиры и сложные полиоксиэтиленовые эфиры. WO 99/52549. Такие составы дополнительно включают в себя поверхностно-активные полиоксиэтиленсорбитановые сложные эфиры в сочетании с октоксинолом (WO 01/21207), равно как и поверхностно-активные полиоксиэтиленалкильные эфиры или сложные эфиры в сочетании, по меньшей мере, с одним дополнительным неионогенным поверхностно-активным веществом, таким как октоксинол (WO 01/21152).
Предпочтительные полиоксиэтиленовые эфиры выбирают из следующей группы: полиоксиэтилен-9-лауриловый эфир (лаурет-9), полиоксиэтилен-9-стеариловый эфир, полиоксиэтилен-8-стеариловый эфир, полиоксиэтилен-4-лауриловый эфир, полиоксиэтилен-35-лауриловый эфир и полиоксиэтилен-23-лауриловый эфир.
J. Полифосфазен (РСРР)
РСРР составы описаны, например, в Andrianov et al., "Preparation of hydrogel microspheres by coacervation of aqueous polyphosphazene solutions", Biomaterials (1998) 19(1-3):109-115 и Payne et al., "Protein Release from Polyphosphazene Matrices", Adv. Drug. Delivery Review (1998) 31(3):185-196.
К. Мурамилпептиды
Примеры мурамилпептидов, пригодных для использования в качестве адъювантов в соответствии с изобретением, включают в себя N-ацетилмурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетилнормурамил-L-аланил-D-изоглутамин (нор-MDP) и N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1',2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)этиламин МТР-РЕ).
L. 2-Н- и 2-алкилимидазохинолиновые соединения
Примеры 2-Н- и 2-алкилимидазохинолиновых соединений, применимых для использования в качестве адъювантов в соответствии с изобретением, включают в себя Imiquimod и его аналоги, более подробно описанные в Stanley, "Imiquimod and the imidazoquinolines: mechanism of action and therapeutic potential." Clin. Exp. Dermatol. (2002) 27(7):571-577; Jones, "Resiquimod 3M", Curr. Opin. Investig. Drugs (2003) 4(2):214-218; и патенты США №№4,689,338, 5,389,640, 5,268,376, 4,929,624, 5,266,575, 5,352,784, 5,494,916, 5,482,936, 5,346,905, 5,395,937, 5,238,944, 6,083,505 и 5,525,612.
М. Тиосемикарбазоновые соединения
Примеры тиосемикарбазоновых соединений, равно как и способы приготовления, производства и скрининга соединений, подходящих для использования в качестве адъювантов в соответствии с изобретением, включают в себя таковые, раскрытые в WO 04/60308. Тиосемикарбазоны особенно эффективно стимулируют продукцию цитокинов, таких как TNF-α, мононуклеарными клетками периферической крови человека.
N. Триптантриновые соединения
Примеры триптантриновых соединений, равно как и способы приготовления, производства и скрининга соединений, подходящих для использования в качестве адъювантов в соответствии с изобретением, включают в себя таковые, раскрытые в WO 04/64759. Триптантриновые соединения особенно эффективно стимулируют продукцию цитокинов, таких как TNF-α, мононуклеарными клетками периферической крови человека.
Изобретение также может предусматривать сочетания аспектов одного или нескольких определенных в настоящем описании адъювантов. Например, в соответствии с изобретением могут быть использованы следующие адъювантные композиции:
(1) сапонин и эмульсия "масло-в-воде" (WO 99/11241);
(2) сапонин (например, QS21) + нетоксичное производное LPS (например, 3dMPL)(cм. WO 94/00153);
(3) сапонин (например, QS21) + нетоксичное производное LPS (например, 3dMPL) + холестерин;
(4) сапонин (например, QS21) + 3dMPL + IL-12 (необязательно + стерин) (WO 98/57659);
(5) сочетания 3dMPL, например, с QS21 и/или эмульсиями "масло-в-воде" (См. заявки на выдачу Европейского патента №№0835318, 0735898 и 0761231);
(6) SAF, содержащий 10% сквалан, 0,4% Tween 80TM, 5% Pluronic-блоксополимер L121 и thr-MDP, либо микрофлуидизированный в субмикронную эмульсию, либо встряхиваемый до образования эмульсии с большим размером частиц;
(7) адъювантная система RibiTM (RAS) (Ribi Immunochem), содержащая 2% сквален, 0,2% Tween 80 и один или несколько компонентов бактериальной клеточной стенки, выбранных из группы, состоящей из монофосфориллипида А (MPL), димиколата трегалозы (TDM) и скелета клеточной стенки (CWS), предпочтительно, MPL+CWS (DetoxTM); и
(8) одна или несколько минеральных солей (таких как соль алюминия) + нетоксичное производное LPS (такое как 3dMPL);
(9) одна или несколько минеральных солей (таких как соль алюминия) + иммуностимулирующий олигонуклеотид (такой как нуклеотидная последовательность, содержащая мотив CpG).
О. Иммуномодуляторы человека
Иммуномодуляторы человека, пригодные для использования в качестве адъювантов в соответствии с изобретением, включают в себя цитокины, такие как интерлейкины (например, IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-12 и т.д.), интерфероны (например, γ-интерферон), макрофагальный колониестимулирующий фактор и фактор некроза опухоли.
Соли алюминия и MF59 являются предпочтительными адъювантами для использования в составе инъецируемых вакцин против гриппа. Бактериальные токсины и биоадгезивные вещества являются предпочтительными адъювантами для использования в составе мукозально доставляемых вакцин, таких как назальных вакцин.
Антигены:
Композиции согласно изобретению могут быть введены в сочетании с одним или несколькими антигенами для использования в соответствии с терапевтическими, профилактическими или диагностическими способами согласно настоящему изобретению. Предпочтительные антигены включают в себя антигены, указанные ниже. Кроме того, композиции согласно изобретению могут быть использованы для лечения или профилактики инфекций, вызываемых любым из указанных ниже возбудителей. Помимо сочетания с указанными ниже антигенами, композиции согласно изобретению также могут быть объединены с адъювантом, описанным в настоящем описании.
Антигены, применимые в соответствии с изобретением, включают в себя без ограничения один или несколько из следующих указанных ниже антигенов или антигенов, происходящих от одного или нескольких указанных ниже патогенов:
А. Бактериальные антигены
Бактериальные антигены, подходящие для использования в соответствии с изобретением, включают в себя белки, полисахариды, липополисахариды и везикулы внешней мембраны, которые могут быть выделены, очищены или получены из бактерий. Кроме того, бактериальные антигены могут включать в себя бактериальные лизаты и составы на основе инактивированных бактерий. Бактериальные антигены могут быть получены путем рекомбинантной экспрессии. Бактериальные антигены предпочтительно содержат эпитопы, экспрессируемые на поверхности бактерий в течение, по меньшей мере, одной стадии их жизненного цикла. Бактериальные антигены предпочтительно консервативны во множестве серотипов. Бактериальные антигены включают в себя антигены, полученные из одной или нескольких бактерий, указанных ниже, равно как и конкретные примеры антигенов, приведенные ниже.
Neisseria meningitidis: Антигены Neisseria meningitidis могут включать в себя белки (такие как белки, описанные в ссылках 1-7), сахариды (включая полисахарид, олигосахарид или липополисахарид) или везикулы внешней мембраны (ссылки 8, 9, 10, 11), выделенные или полученные из N.meningitidis таких серогрупп, как А, С, W135, Y и/или В. Белковые антигены Neisseria meningitidis могут быть выбраны из белков адгезии, аутотранспортеров, токсинов, Fe-связывающих белков и мембраноассоциированных белков (предпочтительно, интегрального белка внешней мембраны).
Streptococcus pneumoniae: Антигены Streptococcus pneumoniae могут включать в себя сахарид (включая полисахарид или олигосахарид) и/или белок Streptococcus pneumoniae. Сахаридные антигены могут быть выбраны из серотипов 1, 2, 3, 4, 5, 6 В, 7F, 8, 9N, 9V, 10А, 11А, 12F, 14, 15В, 17F, 18С, 19А, 19F, 20, 22F, 23F и 33F. Белковые антигены могут быть выбраны из белков, описанных в WO 98/18931, WO 98/18930, патенте США №6,699,703, патенте США №6,800,744, WO 97/43303 и WO 97/37026. Белки Streptococcus pneumoniae могут быть выбраны из семейства полигистидиновой триады (PhtX), семейства холинсвязывающих белков (СbpХ), усеченных белков СbрХ, семейства LytX, усеченных белков LytX, химерных белков усеченный белок СbрХ - усеченный белок LytX, пневмолизина (Ply), PspA, PsaA, Sp128, Sp101, Sp130, Sp125 или Sp133.
Streptococcus pyogenes (стрептококк группы А): Антигены стрептококка группы А могут включать в себя белок, описанный в WO 02/34771 или WO 2005/032582 (включая GAS 40), гибриды из фрагментов белков GAS M (включая гибриды, описанные в WO 02/094851 и Dale, Vaccine (1999) 17:193-200 и Dale, Vaccine 14(10):944-948), фибронектинсвязывающий белок (Sfb1), стрептококковый гемассоциированный белок (Shp) и стрептолизин S (SagA).
Moraxella catarrhalis: Антигены Moraxella catarrhalis включают в себя антигены, описанные в WO 02/18595 и WO 99/58562, белковые антигены внешней мембраны (HMW-OMP), С-антиген и/или LPS.
Bordetella pertussis: Коклюшные антигены включают в себя коклюшный голотоксин (РТ) и волокнистый гемагглютинин (FHA) В.pertussis, необязательно также в сочетании с антигенами пертактина и/или агглютиногенов 2 и 3.
Staphylococcus aureus: Антигены Staphylococcus aureus включают в себя капсульные полисахариды S.aureus типов 5 и 8, необязательно конъюгированные с нетоксичным рекомбинантным экзотоксином А Pseudomonas aeruginosa, такие как StaphVAXTM, или антигены, полученные из поверхностных белков, инвазинов (лейкоцидина, киназ, гиалуронидазы), поверхностных факторов, ингибирующих фагоцитарное поглощение (капсула, белок А), каротиноидов, белков продукции каталазы, белка А, коагулазы, фактора свертывания и/или повреждающих мембрану токсинов (необязательно детоксифицированных), лизирующих мембраны эукариотических клеток (гемолизинов, лейкотоксина, лейкоцидина).
Staphylococcus epidermidis: Антигены S.epidermidis включают в себя ассоциированный со slime антиген (SAA).
Clostridium tetani (возбудитель столбняка): Столбнячные антигены включают в себя столбнячный анатоксин (ТТ), предпочтительно используемый в качестве белка-носителя в сочетании или конъюгате с композициями согласно настоящему изобретению.
Corynebacterium diphtheriae (возбудитель дифтерии): Дифтерийные антигены включают в себя дифтерийный токсин, предпочтительно детоксифицированный, такой как CRM197. Кроме того, предполагается, что для сочетания, совместного введения или конъюгирования с композициями согласно настоящему изобретению пригодны антигены, способные модулировать, ингибировать АДФ-рибозилирование или связанные с ним. В качестве белков-носителей могут быть использованы дифтерийные анатоксины.
Haemophilus influenzae В (Hib): Антигены Hib включают в себя сахаридный антиген Hib.
Pseudomonas aeruginosa: Антигены Pseudomonas aeruginosa включают в себя эндотоксин А, белок Wzz, LPS P.aeruginosa, более конкретно, LPS, выделенный из РАO1 (серотип O5), и/или белки внешней мембраны, включая белки внешней мембраны F (OprF) (Infect. Immun. 2001 May; 69(5):3510-3515).
Legionella pneumophila: Бактериальные антигены могут быть получены из Legionella pneumophila.
Streptococcus agalactiae (стрептококк группы В): Антигены стрептококка группы В включают в себя белковые или сахаридные антигены, описанные в WO 02/34771, WO 03/093306, WO 04/041157 или WO 2005/002619 (включая белки GBS 80, GBS 104, GBS 276 и GBS 322 и включая сахаридные антигены, полученные из стрептококков серотипов Ia, Ib, Ia/c, II, III, IV, V, VI, VII и VIII).
Neisseria gonorrhoeae: Гонорейные антигены включают в себя белок Por (или порин), такой как PorВ (см. Zhu et al., Vaccine (2004) 22:660-669), трансферринсвязывающий белок, такой как ТbpА и ТbpВ (см. Price et al., Infection and Immunity (2004) 71(1):277-283), обусловливающий мутность белок (такой как Ора), модифицируемый восстановлением белок (Rmp), и препараты везикул внешней мембраны (OMV) (см. Plante et al., J. Infectious Disease (2000) 182:848-855), см. также, например, WO 99/24578, WO 99/36544, WO 99/57280, WO 02/079243).
Chlamydia trachomatis: Антигены Chlamydia trachomatis включают в себя антигены, полученные из хламидий серотипов А, В, Ва и С (агентов, вызывающих трахому, причину слепоты), серотипов L1, L2 и L3 (связанных с венерической лимфогранулемой) и серотипов D-K. Антигены Chlamydia trachomatis также могут включать в себя антиген, описанный в WO 00/37494, WO 03/049762, WO 03/068811 или WO 05/002619, включая РерА (СТ045), LcrE (СТ089), ArtJ (CT381), DnaK (CT396), CT398, OmpH-подобный антиген (СТ242), L7/L12 (CT316), OmcA (CT444), AtosS (CT467), CT547, Eno (CT587), HrtA (CT823) и MurG (СТ761).
Treponema pallidum (возбудитель сифилиса): Сифилитические антигены включают в себя антиген TmpA.
Haemophilus ducreyi (возбудитель мягкого шанкра); Антигены Haemophilus ducreyi включают белок внешней мембраны (DsrA).
Enterococcus faecalis или Enterococcus faecium: Антигены включают в себя трисахаридный повтор или другие антигены Enterococcus, описанные в патенте США №6,756,361.
Helicobacter pylori: Антигены Н.pylori включают в себя Cag, Vac, Nap, HopX, HopY и/или уреазный антиген.
Staphylococcus saprophyticus: Антигены включают в себя гемагглютинин массой 160 кДа антигена S.saprophyticus.
Yersinia enterocolitica: Антигены включают в себя LPS (Infect. Immun. 2002 August; 70(8):4414).
E.соli: Антигены E.coli могут быть получены из энтеротоксигенной Е.соli (ЕТЕС), энтероагрегативной E.coli (EAggEC), диффузно прикрепляющейся Е.соli (DAEC), энтеропатогенной Е.соli (ЕРЕС) и/или энтерогеморрагической Е.соli (ЕНЕС).
Bacillus anthracis (возбудитель сибирской язвы); Антигены B.anthracis необязательно детоксифицированы и могут быть выбраны из А-компонентов (летальный фактор (LF) и фактор отека (EF)), каждый из которых может содержать общий В-компонент, известный как протективный антиген (РА).
Yersinia pestis (возбудитель чумы): Чумные антигены включают в себя капсульный антиген F1 (Infect. Immun. 2003 Jan; 71(1)):374-383, LPS (Infect. Immun. 1999 Oct; 67(10):5395), антиген V Yersinia pestis (Infect. Immun. 1997 Nov; 65(11):4476-4482).
Mycobacterium tuberculosis: Туберкулезные антигены включают в себя липопротеиды, LPS, антигены BCG, гибридный белок антигена 85В (Аg85В) и/или ESAT-6, необязательно включенные в состав катионных липидных везикул (Infect. Immun. 2004 October; 72(10):6148), связанные с изоцитратдегидрогеназой Mycobacterium tuberculosis (Mtb) антигены (Proc. Natl. Acad. Sci. USA. 2004 Aug 24; 101(34):12652) и/или антигены МРТ51 (Infect. Immun. 2004 July; 72(7):3829).
Rickettsia: Антигены включают в себя белки внешней мембраны, включая белки внешней мембраны А и/или В (OmpB) (Biochim. Biophys. Acta. 2004 Nov 1; 1702(2):145), LPS и поверхностный белковый антиген (SPA) (J. Autoimmun. 1989 Jun; 2 Suppl:81).
Listeria monocytogenes: Бактериальные антигены могут быть получены из Listeria monocytogenes.
Chlamydia pneumoniae: Антигены включают в себя таковые, описанные в WO 02/02606.
Vibrio cholerae: Антигены включают в себя протеиназные антигены, LPS, особенно липополисахариды Vibrio cholerae II, O1 Inaba O-специфичные полисахариды, O139 V.cholera, антигены вакцины IЕМ108 (Infect. Immun. 2003 Oct; 71(10):5498-504) и/или токсин zonula occludens (Zot).
Salmonella typhi (возбудитель брюшного тифа): Антигены включают в себя капсульные полисахариды, предпочтительно, конъюгаты (Vi, т.е. vax-TyVi).
Borrelia burgdorferi (возбудитель болезни Лайма): Антигены включают в себя липопротеиды (такие как OspA, OspB, OspC и OspD), другие поверхностные белки, такие как OspE-связанные белки (Erps), декоринсвязывающие белки (такие как DbpA) и антигенно вариабельные белки VI, такие как антигены, связанные с Р39 и Р13 (интегральным мембранным белком, Infect. Immun. 2001 May; 69(5):3323-3334), антигенный вариационный белок VIsE (J. Clin. Microbiol. 1999 Dec; 37(12):3997).
Porphyromonas gingivalis: Антигены включают в себя белок внешней мембраны (ОМР) Р.gingivalis.
Klebsiella: Антигены включают в себя ОМР, включая ОМР А, или полисахарид, необязательно конъюгированный со столбнячным анатоксином.
Другие бактериальные антигены согласно изобретению могут представлять собой капсульные антигены, полисахаридные антигены или белковые антигены любой из указанных выше бактерий. Другие бактериальные антигены могут также включать в себя препарат везикул внешней мембраны (OMV). Кроме того, антигены включают в себя живые, ослабленные и/или очищенные варианты любой из указанных выше бактерий. Антигены согласно настоящему изобретению могут быть получены из грамотрицательных и грамположительных бактерий. Антигены согласно настоящему изобретению могут быть получены из аэробных или анаэробных бактерий.
Кроме того, любой из указанных выше бактериальных сахаридов (полисахаридов, LPS, LOS или олигосахаридов) может быть конъюгирован с другим агентом или антигеном, таким как белок-носитель (например, CRM197). Такое конъюгирование может представлять собой непосредственное конъюгирование, проводимое путем восстановительного аминирования карбонильных фрагментов сахарида аминогруппами белка, как описано в патенте США №5,360,897 и Can. J. Biochem. Cell Biol. 1984 May; 62(5):270-5. Альтернативно, сахариды могут быть конъюгированы посредством линкера, такого как сукцинамид или другие линкеры, описанные в Bioconjugate Techniques, 1996 и CRC, Chemistry of Protein Conjugation и Cross-Linking, 1993.
В. Вирусные антигены
Вирусные антигены, подходящие для использования в соответствии с изобретением, включают в себя инактивированный (или убитый) вирус, ослабленный вирус, составы на основе расщепленного вируса, составы очищенных субъединиц, вирусные белки, которые могут быть выделены, очищены или получены из вируса, и вирусоподобные частицы (VLP). Вирусные антигены могут быть получены из вирусов, культивируемых на клеточной культуре или другом субстрате. Альтернативно, вирусные антигены могут быть рекомбинантно экспрессированы. Вирусные антигены предпочтительно содержат эпитопы, экспрессируемые на поверхности вируса в течение, по меньшей мере, одной стадии его жизненного цикла. Вирусные антигены предпочтительно консервативны во множестве серотипов или изолятов. Вирусные антигены включают в себя антигены, полученные из одного или нескольких вирусов, указанных ниже, равно как и примеры конкретных антигенов, указанные ниже.
Ортомиксовирус: Вирусные антигены могут быть получены из ортомиксовируса, такого как вирус гриппа А, В и С. Ортомиксовирусные антигены могут быть выбраны из одного или нескольких вирусных белков, включая гемагглютинин (НА), нейраминидазу (NA), нуклеопротеид (NP), матриксный белок (М1), мембранный белок (М2), один или несколько компонентов транскриптазы (РВ1, РВ2 и РА). Предпочтительные антигены включают в себя НА и NA.
Антигены вируса гриппа могут быть получены из межпандемических (ежегодных) штаммов вируса гриппа. Альтернативно, антигены вируса гриппа могут быть получены из штаммов, обладающих потенциалом для вызывания пандемической вспышки (т.е. штаммов вируса гриппа с новым гемагглютинином по сравнению с гемагглютинином в штаммах, циркулирующих в настоящее время, или штаммов вируса гриппа, патогенных у субъектов-птиц и обладающих потенциалом для горизонтальной передачи в человеческой популяции, или штаммов вируса гриппа, патогенных у человека).
Вирусы семейства Paramyxoviridae: Вирусные антигены могут быть получены из вирусов семейства Paramyxoviridae, таких как пневмовирусы (RSV), парамиксовирусы (PIV) и морбилливирусы (корь).
Пневмовирус: Вирусные антигены могут быть получены из пневмовируса, такого как респираторно-синцитиальный вирус (RSV), респираторно-синцитиальный вирус крупного рогатого скота, вирус мышиной пневмонии и вирус ринотрахеита индеек. Предпочтительно, пневмовирус представляет собой RSV. Пневмовирусные антигены могут быть выбраны из одного или нескольких следующих белков, включая гибридные поверхностные белки (F), гликопротеид (G) и малый гидрофобный белок (SH), матриксные белки М и М2, нуклеокапсидные белки N, Р и L и неструктурные белки NS1 и NS2. Предпочтительные пневмовирусные антигены включают в себя F, G и М. См., например, J. Gen. Virol. 2004 Nov; 85(Pt 11):3229). Пневмовирусные белки также могут быть включены в состав или получены из химерных вирусов. Например, химерные вирусы RSV/PIV могут содержать компоненты как RSV, так и PIV.
Парамиксовирус: Вирусные антигены могут быть получены из парамиксовируса, такого как вирус парагриппа типов 1-4 (PIV), вирус эпидемического паротита, вирусы Сендаи, обезьяний вирус-5, вирус парагриппа крупного рогатого скота и вирус ньюкаслской болезни. Предпочтительно, парамиксовирус представляет собой PIV или вирус эпидемического паротита. Парамиксовирусные антигены могут быть выбраны из одного или нескольких следующих белков: гемагглютинина - нейраминидазы (HN), гибридных белков F1 и F2, нуклеопротеида (NP), фосфопротеида (Р), большого белка (L) и матриксного белка (М). Предпочтительные парамиксовирусные белки включают в себя HN, F1 и F2. Парамиксовирусные антигены также могут быть включены в состав или получены из химерных вирусов. Например, химерные вирусы RSV/PIV могут содержать компоненты как RSV, так и PIV. Коммерчески доступные вакцины против эпидемического паротита содержат живой ослабленный вирус эпидемического паротита либо в моновалентной форме, либо в сочетании с вакцинами против кори и краснухи (MMR).
Морбилливирус: Вирусные антигены могут быть получены из морбилливируса, такого как вирус кори. Морбилливирусные антигены могут быть выбраны из одного или нескольких следующих белков: гемагглютинина (Н), гликопротеида (G), фактора слияния (F), большого белка (L), нуклеопротеида (NP), полимеразного фосфопротеида (Р) и матриксного белка (М). Коммерчески доступные вакцины против кори содержат живой ослабленный вирус кори, как правило, в сочетании с вакцинами против эпидемического паротита и краснухи (MMR).
Пикорнавирус: Вирусные антигены могут быть получены из пикорнавирусов, таких как энтеровирусы, риновирусы, гепарнавирусы, кардиовирусы и афтовирусы. Предпочтительными являются антигены, полученные из энтеровирусов, таких как полиовирус.
Энтеровирус: Вирусные антигены могут быть получены из энтеровируса, такого как полиовирус типов 1, 2 или 3, вирус Коксаки А типов 1-22 и 24, вирус Коксаки В типов 1-6, эховирус (ЕСНО-вирус) типов 1-9, 11-27 и 29-34 и энтеровирус 68-71. Предпочтительно, энтеровирус представляет собой полиовирус. Энтеровирусные антигены предпочтительно выбраны из одного или нескольких следующих капсидных белков VP1, VP2, VP3 и VP4. Коммерчески доступные полиовакцины включают в себя вакцину на основе инактивированного полиовируса (IPV) и пероральную вакцину против полиовируса (OPV).
Гепарнавирус: Вирусные антигены могут быть получены из гепарнавируса, такого как вирус гепатита A (HAV). Коммерчески доступные вакцины против HAV включают в себя вакцину на основе инактивированного HAV.
Тогавирус: Вирусные антигены могут быть получены из тогавируса, такого как рубивирус, альфавирус или артеривирус. Предпочтительными являются антигены, полученные из рубивируса, такого как вирус краснухи. Тогавирусные антигены могут быть выбраны из Е1, Е2, Е3, С, NSP-1, NSPO-2, NSP-3 или NSP-4. Тогавирусные антигены предпочтительно выбраны из Е1, Е2 или Е3. Коммерчески доступные вакцины против краснухи содержат живой прошедший холодовую адаптацию вирус, как правило, в сочетании с вакцинами против эпидемического паротита и кори (MMR).
Флавивирус: Вирусные антигены могут быть получены из флавивируса, такого как вирус клещевого энцефалита (ТВЕ), вирус Денге (типов 1, 2, 3 или 4), вирус желтой лихорадки, вирус японского энцефалита, вирус энцефалита Западного Нила, вирус сент-луисского энцефалита, вирус русского весенне-летнего энцефалита, клещевого энцефалита Повассан. Флавивирусные антигены могут быть выбраны из РrМ, М, С, Е, NS-1, NS-2a, NS2b, NS3, NS4a, NS4b и NS5. Флавивирусные антигены предпочтительно выбраны из РrМ, М и Е. Коммерчески доступные вакцины против ТВЕ включают в себя вакцины на основе инактивированного вируса.
Пестивирус: Вирусные антигены могут быть получены из пестивируса, такого как вирус диареи крупного рогатого скота (BVDV), вирус классической лихорадки свиней (CSFV) или вирус пограничной болезни (BDV).
Гепаднавирус: Вирусные антигены могут быть получены из гепаднавируса, такого как вирус гепатита В. Гепаднавирусные антигены могут быть выбраны из поверхностных антигенов (L, М и S), коровых антигенов (НВс, НВе). Коммерчески доступные вакцины против HBV включают в себя субъединичные вакцины, содержащие поверхностный антиген S-белок.
Вирус гепатита С: Вирусные антигены могут быть получены из вируса гепатита С (HCV). Антигены HCV могут быть выбраны из одного или нескольких из Е1, Е2, Е1/Е2, полипротеина NS345, корового полипротеина NS 345, корового белка и/или пептидов из неструктурных областей (Houghton et al., Hepatology (1991) 14:381).
Рабдовирус: Вирусные антигены могут быть получены из рабдовируса, такого как лиссавирус (вирус бешенства) и везикуловирус (VSV). Рабдовирусные антигены могут быть выбраны из гликопротеида (G), нуклеопротеида (N), большого белка (L), неструктурных белков (NS). Коммерчески доступная вакцина против вируса бешенства содержит убитый вирус, выращенный на диплоидных клетках человека или клетках легкого плода макака-резуса.
Caliciviridae: Вирусные антигены могут быть получены из Calciviridae, таких как вирус Норуолк, и Норуолк-подобные вирусы, такие как гавайский вирус и вирус Снежных гор.
Коронавирус: Вирусные антигены могут быть получены из коронавируса, вируса SARS, респираторного коронавируса человека, вируса инфекционного бронхита птиц (IBV), вируса гепатита мышей (MHV) и вируса инфекционного гастроэнтерита свиней (TGEV). Коронавирусные антигены могут быть выбраны из антигена шипов (S), антигена оболочки (Е), матриксного антигена (М), нуклеокапсидного антигена (N) и гемагглютининэстеразного гликопротеида (НЕ). Предпочтительно, коронавирусный антиген получают из вируса SARS. Вирусные антигены SARS описаны в WO 04/92360.
Ретровирус: Вирусные антигены могут быть получены из ретровируса, такого как онковирус, лентивирус или спумавирус. Онковирусные антигены могут быть получены из HTLV-1, HTLV-2 или HTLV-5. Лентивирусные антигены могут быть получены из HIV-1 или HIV-2. Ретровирусные антигены могут быть выбраны из gag, pol, env, tax, tat, rex, rev, net, vif, vpu и vpr. Антигены HIV могут быть выбраны из gag (p24gag и p55gag), env (gp160 и gp41), pol, tat, net, rev, vpu, минибелков, (предпочтительно, p55gag и gp140v делетированы). Антигены HIV могут быть получены из одного или нескольких следующих штаммов: HIVIIIb, HIVSF2, HIVLAV, HIVLAI, HIVMN, HIV-1CM235, HIV-1US4.
Реовирус: Вирусные антигены могут быть получены из реовируса, такого как ортореовирус, ротавирус, орбивирус или колтивирус. Реовирусные антигены могут быть выбраны из структурных белков λ1, λ2, λ3, µ1, µ2, σ1, σ2 или σ3 или неструктурных белков σNS, µNS или σ1s. Предпочтительные реовирусные антигены могут быть получены из ротавируса. Ротавирусные антигены могут быть выбраны из VP1, VP2, VP3, VP4 (или расщепленного продукта VP5 и VP8), NSP1, VP6, NSP3, NSP2, VP7, NSP4 или NSP5. Предпочтительные ротавирусные антигены включают в себя VP4 (или расщепленный продукт VP5 и VP8) и VP7.
Парвовирус: Вирусные антигены могут быть получены из парвовируса, такого как парвовирус В19. Парвовирусные антигены могут быть выбраны из VP-1, VP-2, VP-3, NS-1 и NS-2. Предпочтительно, парвовирусный антиген представляет собой капсидный белок VP-2.
Вирус гепатита дельта (HDV): Вирусные антигены могут быть получены из HDV, особенно δ-антиген HDV (см., например, патент США №5,378,814).
Вирус гепатита Е (HEV): Вирусные антигены могут быть получены из HEV.
Вирус гепатита G (HGV): Вирусные антигены могут быть получены из HGV.
Герпесвирус человека: Вирусные антигены могут быть получены из герпесвируса человека, такого как вирусы простого герпеса (HSV), вирус опоясывающего лишая (VZV), вирус Эпштейна-Барр (EBV), цитомегаловирус (CMV), герпесвирус-6 человека (HHV6), герпесвирус-7 человека (HHV7) и герпесвирус-8 человека (HHV8). Антигены герпесвируса человека могут быть выбраны из немедленно-ранних белков (α), ранних белков (β) и поздних белков (γ). Антигены HSV могут быть получены из штаммов HSV-1 или HSV-2. Антигены HSV могут быть выбраны из гликопротеидов gВ, gС, gD и gН, гибридного белка (gВ) или белков иммунного избегания (gС, gЕ или gI). Антигены VZV могут быть выбраны из корового белка, нуклеокапсидного белка, белка внутренней оболочки или белка внешней оболочки. Коммерчески доступна вакцина на основе живого ослабленного VZV. Антигены EBV могут быть выбраны из белков раннего антигена (ЕА), вирусного капсидного антигена (VCA) и гликопротеидов мембранного антигена (МА). Антигены CMV могут быть выбраны из капсидных белков, гликопротеидов внешней оболочки (таких как gВ и gН) и белков внутренней оболочки.
Паповавирусы: Антигены могут быть получены из паповавирусов, таких как вирусы папилломы и вирусы полиомы. Вирусы папилломы включают в себя НРV серотипов 1, 2, 4, 5, 6, 8, 11, 13, 16, 18, 31, 33, 35, 39, 41, 42, 47, 51, 57, 58, 63 и 65. Предпочтительно, антигены HPV получают из HPV серотипов 6, 11, 16 или 18. Антигены HPV могут быть выбраны из капсидных белков (L1) и (L2) или Е1-Е7 или их гибридов. Антигены HPV предпочтительно включают в состав вирусоподобных частиц (VLP). Вирусы полиомы включают в себя вирус ВК и вирус JK. Антигены вирусов полиомы могут быть выбраны из VP1, VP2 или VP3.
Далее раскрыты антигены, композиции, способы и микробы, описанные в Vaccines, 4th Edition (Plotkin and Orenstein ed. 2004); Medical Microbiology 4th Edition (Murray et al. ed. 2002); Virology, 3rd Edition (W.K.Joklik ed. 1988); Fundamental Virology, 2nd Edition (B.N.Fields and D.M.Knipe, eds. 1991), связь которых с композициями согласно настоящему изобретению предполагается.
С. Грибковые антигены
Грибковые антигены, применимые в соответствии с изобретением, могут быть получены из одного или нескольких указанных ниже грибов.
Грибковые антигены могут быть получены из Dermatophytres, включая Epidermophyton floccusum, Microsporum audouini, Microsporum canis, Microsporum distortum, Microsporum equinum, Microsporum gypsum, Microsporum nanum, Trichophyton concentricum, Trichophyton equinum, Trichophyton gallinae, Trichophyton gypseum, Trichophyton megnini, Trichophyton mentagrophytes, Trichophyton quinckeanum, Trichophyton rubrum, Trichophyton schoenleini, Trichophyton tonsurans, Trichophyton verrucosum, T.verrucosum var. album, var. discoides, var. ochraceum, Trichophyton violaceum и/или Trichophyton faviforme.
Грибковые антигены могут быть получены из Aspergillus fumigatus, Aspergillus flavus, Aspergillus niger, Aspergillus nidulans, Aspergillus ferrous, Aspergillus sydowi, Aspergillus flavatus, Aspergillus glaucus, Blastoschizomyces capitatus, Candida albicans, Candida enolase, Candida tropicalis, Candida glabrata, Candida krusei, Candida parapsilosis, Candida stellatoidea, Candida kusei, Candida parakwsei, Candida lusitaniae, Candida pseudotropicalis, Candida guilliermondi, Cladosporium carrionii, Coccidioides immitis, Blastomyces dermatidis, Cryptococcus neoformans, Geotrichum clavatum, Histoplasma capsulatum, Klebsiella pneumoniae, Paracoccidioides brasiliensis, Pneumocystis cannii, Pythiumn insidiosum, Pityrosporum ovale, Sacharomyces cerevisae, Saccharomyces boulardii, Saccharomyces pombe, Scedosporium apiosperum, Sporothrix schenckii, Trichosporon beigelii, Toxoplasma gondii, Penicillium mameffei, Malassezia spp., Fonsecaea spp., Wangiella spp., Sporothrix spp., Basidiobolus spp., Conidiobolus spp., Rhizopus spp., Mucor spp., Absidia spp., Mortierella spp., Cunninghamella spp., Saksenaea spp., Alternaria spp., Curvularia spp., Helminthosporium spp., Fusarium spp., Aspergillus spp., Penicillium spp., Monolinia spp., Rhizoctonia spp., Paecilomyces spp., Pithomyces spp. и Cladosporium spp.
Способы получения грибковых антигенов хорошо известны из предшествующего уровня техники (см. патент США №6,333,164). В соответствии с предпочтительным способом растворимую фракцию экстрагируют и отделяют от нерастворимой фракции, полученной из грибковых клеток, клеточная стенка которых по существу была удалена или, по меньшей мере, частично удалена, причем способ предусматривает стадии получения живых грибковых клеток; получения грибковых клеток, клеточная стенка которых по существу была удалена или, по меньшей мере, частично удалена; разрушения грибковых клеток, клеточная стенка которых по существу была удалена или, по меньшей мере, частично удалена; получения нерастворимой фракции; и экстрагирования и отделения растворимой фракции от нерастворимой фракции.
D. Антигены возбудителей ЗППП
Композиции согласно изобретению могут содержать один или несколько антигенов, полученных из возбудителей заболеваний, передающихся половым путем (ЗППП). Такие антигены могут быть использованы для профилактики или терапии ЗППП, таких как хламидиоз, генитальный герпес, гепатит (такие как гепатит С), генитальные бородавки, гонорея, сифилис и/или мягкий шанкр (См. WO 00/15255). Антигены могут быть получены из одного или нескольких вирусных или бактериальных возбудителей ЗППП. Антигены вирусных возбудителей ЗППП, применимые в соответствии с изобретением, могут быть получены, например, из HIV, вируса простого герпеса (HSV-1 и HSV-2), папилломавируса человека (HPV) и вируса гепатита (HCV). Антигены бактериальных возбудителей ЗППП, применимые в соответствии с изобретением, могут быть получены, например, из Neiserria gonorrhoeae, Chlamydia trachomatis, Treponema pallidum, Haemophilus ducreyi, E.coli и Streptococcus agalactiae. Примеры конкретных антигенов, полученных из этих возбудителей, описаны выше.
Е. Респираторные антигены
Композиции согласно изобретению могут содержать один или несколько антигенов, полученных из возбудителей респираторных заболеваний. Например, респираторные антигены могут быть получены из респираторного вируса, такого как ортомиксовирусы (вирус гриппа), пневмовирус (RSV), парамиксовирус (PIV), морбилливирус (вирус кори), тогавирус (вирус краснухи), VZV и коронавирус (SARS). Респираторные антигены могут быть получены из бактерий, вызывающих респираторные заболевания, таких как Streptococcus pneumoniae, Pseudomonas aeruginosa, Bordetella pertussis, Mycobacterium tuberculosis, Mycoplasma pneumoniae, Chlamydia pneumoniae, Bacillus anthracis и Moraxella catarrhalis. Примеры конкретных антигенов, полученных из этих возбудителей, описаны выше.
F. Антигены педиатрических вакцин
Композиции согласно изобретению могут содержать один или несколько антигенов, подходящих для использования в педиатрии. Педиатрические субъекты, как правило, находятся в возрасте менее около 3 лет или менее около 2 лет или менее около 1 года. Педиатрически значимые антигены могут быть введены много раз в течение 6 месяцев, 1, 2 или 3 лет. Педиатрически значимые антигены могут быть получены из вируса, поражающего популяции детей, и/или вируса, инфекции которого подвержены популяции детей. Педиатрически значимые вирусные антигены включают в себя антигены, полученные из одного или нескольких из ортомиксовируса (вируса гриппа), пневмовируса (RSV), парамиксовируса (PIV и вируса эпидемического паротита), морбилливируса (вируса кори), тогавируса (вируса краснухи), энтеровируса (вируса полиомиелита), HBV, коронавируса (SARS), вируса опоясывающего лишая (VZV) и вируса Эпштейна-Барр (EBV). Педиатрически значимые бактериальные антигены включают в себя антигены, полученные из одного или нескольких из Streptococcus pneumoniae, Neisseria meningitidis, Streptococcus pyogenes (стрептококка группы A), Moraxella catarrhalis, Bordetella pertussis, Staphylococcus aureus, Clostridium tetani (возбудителя столбняка), Corynebacterium diphtheriae (возбудителя дифтерии), Haemophilus influenzae В (Hib), Pseudomonas aeruginosa, Streptococcus agalactiae (стрептококка группы В) и Е.соli. Примеры конкретных антигенов, полученных из этих возбудителей, описаны выше.
G. Антигены, применимые для использования у пожилых субъектов или субъектов с иммунными нарушениями
Композиции согласно изобретению могут содержать один или несколько антигенов, подходящих для использования у пожилых субъектов или субъектов с иммунными нарушениями. Такие субъекты могут нуждаться в более частой вакцинации, вакцинации более высокими дозами или вакцинации составами с адъювантом для усиления их иммунного ответа на антигены-мишени. Антигены, которые могут являться мишенями, применимыми у пожилых субъектов или субъектов с иммунными нарушениями, включают в себя антигены, полученные из одного или нескольких из следующих возбудителей: Neisseria meningitidis, Streptococcus pneumoniae, Streptococcus pyogenes (стрептококка группы А), Moraxella catarrhalis, Bordetella pertussis, Staphylococcus aureus, Staphylococcus epidermis, Clostridium tetani (возбудителя столбняка), Corynebacterium diphtheriae (возбудителя дифтерии), Haemophilus influenzae В (Hib), Pseudomonas aeruginosa, Legionella pneumophila, Streptococcus agalactiae (стрептококка группы В), Enterococcus faecalis, Helicobacter pylori, Clamydia pneumoniae, ортомиксовируса (вируса гриппа), пневмовируса (RSV), парамиксовируса (PIV и вируса эпидемического паротита), морбилливируса (вируса кори), тогавируса (вируса краснухи), энтеровируса (вируса полиомиелита), HBV, коронавируса (SARS), вируса опоясывающего лишая (VZV), вируса Эпштейна-Барр (EBV), цитомегаловируса (CMV). Примеры конкретных антигенов, полученных из этих возбудителей, описаны выше.
Н. Антигены, применимые для использования в вакцинах для подростков
Композиции согласно изобретению могут содержать один или несколько антигенов, подходящих для использования у подростков. Подростки могут нуждаться в повторной иммунизации введенным ранее педиатрически значимым антигеном. Педиатрически значимые антигены, которые могут быть использованы у подростков, описаны выше. Кроме того, подросткам могут быть введены антигены, полученные из возбудителей ЗППП, для формирования протективного или терапевтического иммунитета перед началом половой жизни. Антигены возбудителей ЗППП, которые могут быть использованы у подростков, описаны выше.
I. Опухолевые антигены
Один вариант выполнения настоящего изобретения относится к сочетанию опухолевого антигена или антигена злокачественной опухоли с композициями согласно настоящему изобретению. Опухолевые антигены могут представлять собой, например, пептидсодержащие опухолевые антигены, такие как полипептидные опухолевые антигены или гликопротеидные опухолевые антигены. Опухолевый антиген также может представлять собой, например, сахаридсодержащий опухолевый антиген, такой как гликолипидный опухолевый антиген или ганглиозидный опухолевый антиген. Опухолевый антиген также может представлять собой, например, полинуклеотидсодержащий опухолевый антиген, экспрессирующий полипептидсодержащий опухолевый антиген, например, РНК-векторную конструкцию или ДНК-векторную конструкцию, такую как плазмидная ДНК.
Опухолевые антигены, применимые в соответствии с настоящим изобретением, включают в себя большое множество молекул, таких как (а) полипептидсодержащие опухолевые антигены, включающие в себя полипептиды (находящиеся в диапазоне длины 8-20 аминокислот, хотя длина полипептида за пределами этого диапазона также распространена), липополипептиды и гликопротеиды, (b) сахаридсодержащие опухолевые антигены, включающие в себя полисахариды, муцины, ганглиозиды, гликолипиды и гликопротеиды, и (с) полинуклеотиды, экспрессирующие антигенные полипептиды.
Опухолевые антигены могут представлять собой, например, (а) полноразмерные молекулы, связанные со злокачественными клетками, (b) их гомологи и модифицированные формы, включая молекулы с делетированными, добавленными и/или замененными фрагментами, и (с) их фрагменты. Опухолевые антигены могут являться рекомбинантными. Опухолевые антигены включают в себя, например, антигены класса I, распознаваемые лимфоцитами CD8+, или антигены класса II, распознаваемые лимфоцитами CD4+.
Из предшествующего уровня техники известны многочисленные опухолевые антигены, включая (а) антигены рака яичка, такие как NY-ESO-1, SSX2, SCP1, равно как и полипептиды семейств RAGE, BAGE, GAGE и MAGE, например, GAGE-1, GAGE-2, MAGE-1, MAGE-2, MAGE-3, MAGE-4, MAGE-5, MAGE-6 и MAGE-12 (которые могут быть использованы, например, для вакцинации против меланомы, опухолей легкого, головы и шеи, NSCLC, опухолей молочной железы, желудочно-кишечного тракта и мочевого пузыря), (b) мутантные антигены, например, р53 (ассоциированный с многими солидными опухолями, например, со злокачественными опухолями толстой и прямой кишок, легкого, головы и шеи), p21/Ras (ассоциированный, например, с меланомой, раком поджелудочной железы и колоректальным раком), CDK4 (ассоциированный, например, с меланомой), MUM1 (ассоциированный, например, с меланомой), каспаза-8 (ассоциированная, например, со злокачественными опухолями головы и шеи), CIA 0205 (ассоциированный, например, с раком мочевого пузыря), HLA-A2-R1701, бета-катенин (ассоциированный, например, с меланомой), TCR (ассоциированный, например, с Т-клеточной неходжкинской лимфомой), BCR-аbl (ассоциированный, например, с хроническим миелолейкозом), триозофосфатизомераза, KIA 0205, CDC-27 и LDLR-FUT, (с) усиленно экспрессируемые антигены, например, галектин-4 (ассоциированный, например, с колоректальным раком), галектин-9 (ассоциированный, например, с болезнью Ходжкина), протеиназа-3 (ассоциированный, например, с хроническим миелолейкозом), WT 1 (ассоциированный, например, с различными лейкозами), карбоангидраза (ассоциированная, например, со злокачественной опухолью почки), альдолаза А (ассоциированная, например, с раком легкого), PRAME (ассоциированный, например, с меланомой), HER-2/neu (ассоциированный, например, с раком молочной железы, толстой кишки, легкого и яичника), альфа-фетопротеин (ассоциированный, например, с гепатомой), KSA (ассоциированный, например, с колоректальным раком), гастрин (ассоциированный, например, с раком поджелудочной железы и желудка), теломеразный каталитический белок, MUC-1 (ассоциированный, например, с раком молочной железы и яичника), G-250 (ассоциированный, например, с почечноклеточной карциномой), р53 (ассоциированный, например, с раком молочной железы и толстой кишки) и карциноэмбриональный антиген (ассоциированный, например, с раком молочной железы, раком легкого и злокачественными опухолями желудочно-кишечного тракта, такими как колоректальный рак), (d) общие антигены, например, антигены меланомы-дифференцировки меланоцитов, такие как MART-1/Melan А, gp100, MC1R, рецептор меланоцитстимулирующего гормона, тирозиназа, связанный с тирозиназой белок-1/TRP1 и связанный с тирозиназой белок-2/ТРР2 (ассоциированные, например, с меланомой), (е) ассоциированные с предстательной железой антигены, такие как PAP, PSA, PSMA, PSH-P1, PSM-Р1, PSM-P2, ассоциированные, например, с раком предстательной железы, (f) иммуноглобулиновые идиотипы (ассоциированные, например, с миеломой и В-клеточными лимфомами), и (g) другие опухолевые антигены, такие как полипептид- и сахаридсодержащие антигены, включая (i) гликопротеиды, такие как сиалил-Tn и сиалил-Lex (ассоциированные, например, с раком молочной железы и колоректальным раком), а также различные муцины; гликопротеиды могут быть связаны с белком-носителем (например, MUC-1 может быть связан с KLH); (ii) липополипептиды (например, MUC-1, связанный с липидным фрагментом); (iii) полисахариды (например, синтетический гексасахарид Globo Н), которые могут быть связаны с белком-носителем (например, с KLH), (iv) ганглиозиды, такие как GM2, GM12, GD2, GD3 (ассоциированные, например, со злокачественными опухолями головного мозга, легкого, меланомой), которые также могут быть связаны с белком-носителем (например, с KLH). Дополнительные опухолевые антигены, известные из предшествующего уровня техники, включают в себя р15, Hom/Mel-40, H-Ras, E2A-PRL, H4-RET, IGH-IGK, MYL-RAR, антигены вируса Эпштейна-Барр, EBNA, антигены вируса папилломы человека (HPV), включая Е6 и Е7, антигены вирусов гепатита В и С, антигены лимфотропного вируса Т-клеток человека, TSP-180, p185erbB2, p180erbB-3, с-met, mn-23H1, TAG-72-4, CA 19-9, СА 72-4, САМ 17.1, NuMa, K-ras, p16, TAGE, PSCA, CT7, 43-9F, 5T4, 791 Tgp72, beta-HCG, BCA225, BTAA, CA 125, CA 15-3 (CA 27.29\BCAA), CA 195, CA 242, CA-50, CAM43, CD68/KP1, CO-029, FGF-5, Ga733 (EpCAM), HTgp-175, M344, MA-50, MG7-Ag, MOV18, NB/70K, NY-CO-1, RCAS1, SDCCAG16, TA-90 (Мас-2-связывающий белок/циклофилин С-ассоциированный белок), TAAL6, TAG72, TLP, TPS и т.п. Эти, равно как и другие, клеточные компоненты описаны, например, в заявке на выдачу патента США №20020007173 и процитированных в ней ссылках.
Полинуклеотидсодержащие антигены согласно настоящему изобретению, как правило, содержат полинуклеотиды, кодирующие полипептидные антигены злокачественных опухолей, такие как указанные выше антигены. Предпочтительные полинуклеотидсодержащие антигены включают в себя ДНК- или РНК-векторные конструкции, такие как плазмидные векторы (например, pCMV), способные экспрессировать полипептидные антигены злокачественных опухолей in vivo.
Опухолевые антигены могут быть получены, например, из мутантных или измененных клеточных компонентов. После внесения изменений клеточные компоненты больше не выполняют своих регуляторных функций, и, следовательно, клетка может неконтролируемо расти. Показательные примеры измененных клеточных компонентов включают в себя ras, p53, Rb, измененный белок, кодируемый геном опухоли Вилмса, убиквитин, муцин, белок, кодируемый генами DCC, АРС и МСС, а также рецепторы или рецептороподобные структуры, такие как neu, рецептор тиреоидного гормона, рецептор тромбоцитарного фактора роста (PDGF), рецептор инсулина, рецептор эпидермального фактора роста (EGF) и рецептор колониестимулирующего фактора (CSF). Эти, равно как и другие, клеточные компоненты описаны, например, в патенте США №5,693,522 и процитированных в нем ссылках.
Кроме того, для лечения злокачественных опухолей могут быть использованы бактериальные и вирусные антигены в сочетании с композициями согласно настоящему изобретению. В частности, для лечения злокачественных опухолей в сочетании или конъюгате с соединениями согласно настоящему изобретению могут быть использованы такие белки-носители, как CRM197, столбнячный анатоксин или антиген Salmonella typhimurium. Сочетанные терапевтические средства на основе антигенов злокачественных опухолей демонстрируют повышенную эффективность и биологическую доступность по сравнению с существующими терапевтическими средствами.

J. Антигенные составы
В соответствии с другими аспектами изобретения раскрыты способы получения микрочастиц, содержащих адсорбированные антигены. Способы предусматривают (а) приготовление эмульсии путем диспергирования смеси, содержащей (i) воду, (ii) поверхностно-активное вещество, (iii) органический растворитель и (iv) биологически разлагаемый полимер, выбранный из группы, состоящей из поли(α-гидроксикислоты), полигидроксимасляной кислоты, поликапролактона, сложного полиортоэфира, полиангидрида и полицианоакрилата. Полимер, как правило, содержится в смеси в концентрации, составляющей от около 1% до около 30% относительно органического растворителя, тогда как поверхностно-активное вещество, как правило, содержится в смеси в массовом отношении "поверхностно-активное вещество к полимеру", составляющем от около 0,00001:1 до около 0,1:1 (более типично, от около 0,0001:1 до около 0,1:1, от около 0,001:1 до около 0,1:1 или от около 0,005:1 до около 0,1:1); (b) удаление органического растворителя из эмульсии; и (с) адсорбцию антигена на поверхность микрочастиц. В некоторых вариантах выполнения биологически разлагаемый полимер содержится в концентрации, составляющей от около 3% до около 10% относительно органического растворителя.
Микрочастицы, применимые в соответствии с изобретением, образуются из стерилизуемых нетоксичных и биологически разлагаемых веществ. Такие вещества включают в себя без ограничения поли(α-гидроксикислоту), полигидроксимасляную кислоту, поликапролактон, сложный полиортоэфир, полиангидрид, РАСА и полицианоакрилат. Предпочтительно, микрочастицы, применимые в соответствии с настоящим изобретением, получают из поли(α-гидроксикислоты), в частности, из поли(лактида) ("PLA") или сополимера D,L-лактида и гликолида или гликолевой кислоты, такого как поли(D,L-лактидсогликолид) ("PIG" или "PIGA"), или сополимера D,L-лактида и капролактона. Микрочастицы могут быть получены из любых из множества полимерных исходных веществ, характеризующихся различными молекулярными массами, и для сополимеров, таких как PIG, различными значениями отношения лактид:ликолид, выбор которых в большой степени является свободным, частично зависящим от совместно вводимой макромолекулы. Эти параметры более подробно обсуждаются ниже.
Дополнительные антигены также могут включать в себя препарат везикул внешней мембраны (OMV).
Дополнительные сведения о способах приготовления составов и входящих в них антигенах (особенно опухолевых антигенах) содержатся в патенте США №09/581,772.
К. Ссылки, содержащие сведения об антигенах
Следующие ссылки содержат сведения об антигенах, применимых в сочетании с композициями согласно настоящему изобретению:
Ссылки, содержащие сведения об антигенах, указаны ниже:
международная патентная заявка WO 99/24578
международная патентная заявка WO 99/36544.
международная патентная заявка WO 99/57280.
международная патентная заявка WO 00/22430.
Tettelin et al. (2000) Science 287:1809-1815.
международная патентная заявка WO 96/29412.
Pizza et al. (2000) Science 287:1816-1820.
международная патентная заявка WO 01/52885.
Bjune et al. (1991) Lancet 338(8775).
Fuskasawa et al. (1999) Vaccine 17:2951-2958.
Rosenqistet al. (1998) Dev. Biol. Strand 92:323-333.
Constantino et al. (1992) Vaccine 10:691-698.
Constantino et al. (1999) Vaccine 17:1251-1263.
Watson (2000) Pediatr. Infect. Dis. J 19:331-332.
Rubin (20000) Pediatr. Clin. North Am. 47:269-285, v.
Jedrzejas (2001) Microbiol. Mol. Biol. Rev. 65:187-207.
международная патентная заявка, поданная 3 июля 2001 года, в соответствии с которой испрашивается приоритет по GB-0016363.4; WO 02/02606; PCT IB/01/00166.
Kalman et al. (1999) Nature Genetics 21:385-389.
Read et al. (2000) Nucleic Acids Res. 28:1397-406.
Shirai et al. (2000) J. Infect. Dis. 181 (Suppl 3):S524-S527.
международная патентная заявка WO 99/27105.
международная патентная заявка WO 00/27994.
международная патентная заявка WO 00/37494.
международная патентная заявка WO 99/28475.
Bell (2000) Pediatr. Infect. Dis. J. 19:1187-1188.
Iwarson (1995) APMIS 103:321 -326.
Gerlich et al. (1990) Vaccine 8 Suppl:S63-68 & 79-80.
Hsu et al. (1999) Clin. Liver Dis. 3:901-915.
Gastofsson et al. (1996) N. Engl. J. Med. 334-:349-355.
Rappuoli et al. (1991) TIBTECH 9:232-238.
Vaccines (1988) eds. Plotkin & Mortimer. ISBN 0-7216-1946-0.
Del Guidiceetal. (1998) Molecular Aspects of Medicine 19:1-70.
международная патентная заявка WO 93/018150.
международная патентная заявка WO 99/53310.
международная патентная заявка WO 98/04702.
Ross et al. (2001) Vaccine 19:135-142.
Sutler et al. (2000) Pediatr. Clin. North Am. 47:287-308.
Zimmerman & Spann (1999) Am. Fan. Physician 59:113-118, 125-126.
Dreensen (1997) Vaccine 15 Suppl"S2-6.
MMWR Morb. Mortal. Wkly rep. 1998 Jan 16:47(1):12, 9.
McMichael (2000) Vaccine 19 Suppl 1:8101-107.
Schuchat (1999) Lancet 353(9146):51-6.
заявки на выдачу патента GB №№0026333.5, 0028727.6 & 0105640.7.
Dale (1999) Infect. Disclin. North Am. 13:227-43, viii.
Ferretti et al. (2001) PNAS USA 98: 4658-4663.
Kuroda et al. (2001) Lancet 357(9264): 1225-1240; см. также стр.1218-1219.
Ramsay et al. (2001) Lancet 357(9251):195-196.
Lindberg (1999) Vaccine 17 Suppl 2:828-36.
Buttery & Moxon (2000) J.R.Coil. Physicians Long. 34:163-168.
Ahmad & Chapnick (1999) Infect. Dis. Clin. North Am. 13:113-133, vii.
Goldblatt (1998) J. Med. Microbiol. 47:663-567.
Европейский патент №0477508.
патент США №5,306,492.
международная патентная заявка WO 98/42721.
Conjugate Vaccines (eds. Cruse et al.) ISBN 3805549326, особенно том 10:48-114.
Hermanson (1996) Bioconjugate Techniques ISBN: 012323368 & 012342335X.
заявка на выдачу Европейского патента №0372501.
заявка на выдачу Европейского патента №0378881.
заявка на выдачу Европейского патента №0427347.
международная патентная заявка WO 93/17712.
международная патентная заявка WO 98/58668.
заявка на выдачу Европейского патента №0471177.
международная патентная заявка WO 00/56360.
международная патентная заявка WO 00/67161.
Фармацевтические композиции, содержащие раскрытые в настоящем описании соединения, могут содержать добавки, такие как наполнители. Подходящие фармацевтически приемлемые наполнители включают в себя облегчающие обработку агенты и модификаторы и усилители доставки лекарственного средства, такие как, например, фосфат кальция, стеарат магния, тальк, моносахариды, дисахариды, крахмал, желатин, целлюлоза, метилцеллюлоза, натрий-карбоксиметилцеллюлоза, декстроза, гидроксипропил-β-циклодекстрин, поливинилпирролидон, воски с низкой точкой плавления, ионообменные смолы и т.п., равно как и сочетания любых двух или более из них. Другие подходящие фармацевтически приемлемые наполнители описаны в "Remington's Pharmaceutical Sciences," Mack Pub. Co., New Jersey (1991), включенной сюда во всей полноте посредством ссылки и для любых целей считающейся полностью изложенной в настоящем описании.
Фармацевтические композиции, содержащие соединения согласно изобретению, могут находиться в любой форме, подходящей для желаемого способа введения, включая, например, формы раствора, суспензии или эмульсии. Для приготовления растворов, суспензий и эмульсий, как правило, используют жидкие носители. Жидкие носители, использование которых предполагается в соответствии с настоящим изобретением, включают в себя, например, воду, солевой раствор, фармацевтически приемлемый(ые) органический(ие) растворитель(и), фармацевтически приемлемые масла или жиры и т.п., равно как и смеси двух или более из них. Жидкий носитель может включать в себя другие подходящие фармацевтически приемлемые добавки, такие как растворители, эмульгаторы, питательные вещества, буферы, консерванты, суспендирующие агенты, загустители, регуляторы вязкости, стабилизаторы и т.п. Подходящие органические растворители включают в себя, например, одноатомные спирты, такие как этанол, и многоатомные спирты, такие как гликоли. Подходящие масла включают в себя без ограничения соевое масло, кокосовое масло, оливковое масло, сафлоровое масло, хлопковое масло и т.п. Для парентерального введения носителем может являться нелетучий сложный эфир, такой как этилолеат, изопропилмиристат и т.п. Композиции согласно настоящему изобретению также могут находиться в форме микрочастиц, микрокапсул и т.п., равно как и сочетания любых двух или более из них.
Соединения и сочетания согласно настоящему изобретению также могут быть введены в форме липосом. Как известно из предшествующего уровня техники, липосомы, как правило, получают из фосфолипидов или других липидных веществ. Липосомы образуются из моно- и мультиламеллярных гидратированных жидких кристаллов, диспергированных в водной среде. Может быть использован любой нетоксичный физиологически приемлемый и метаболизируемый липид, способный образовывать липосомы. Композиции согласно настоящему изобретению в форме липосом, помимо соединения согласно настоящему изобретению, могут содержать стабилизаторы, консерванты, наполнители и т.п. Предпочтительные липиды включают в себя как природные, так и синтетические фосфолипиды и фосфатидилхолины (лецитины). Способы получения липосом известны из предшествующего уровня техники. См., например, Prescott, Ed., Methods in Cell Biology, Volume XIV, Academic Press, New York, N.W., p.33 et seq (1976).
Другие добавки в композиции согласно изобретению могут включать в себя иммуностимуляторы, известные из предшествующего уровня техники или перечисленные в настоящем описании. Иммуностимулирующие олигонуклеотиды и полинуклеотиды описаны в РСТ WO 98/55495 и РСТ WO 98/16247. В заявке на выдачу патента США №2002/0164341 описаны адъюванты, содержащие неметилированный динуклеотид CpG (CpG ODN) и отличный от нуклеиновой кислоты адъювант. В заявке на выдачу патента США №2002/0197269 описаны композиции, содержащие антиген, антигенный CpG-ODN и поликатионный полимер. Также могут быть использованы и другие иммуностимулирующие добавки, описанные в предшествующем уровне техники, например, описанные в патенте США №5,026,546; патенте США №4,806,352 и патенте США №5,026,543. Кроме того, предполагается, что SMIP соединения, описанные в заявках на выдачу патента США №№10/814480 и 60/582654, являются эффективными агентами для совместного введения или могут быть использованы в сочетании с композициями согласно настоящему изобретению.
Также могут быть использованы системы доставки контролируемого высвобождения, такие как диффузионная контролируемая матриксная система или размываемая система, описанные, например, в Lee, "Diffusion-Controlled Matrix Systems", pp.155-198 и Ron and Langer, "Erodible Systems", pp.199-224, в "Treatise on Controlled Drug Delivery", A.Kydonieus Ed., Marcel Dekker, Inc., New York 1992. Матрикс может состоять, например, из биологически разрушаемого вещества, которое может подвергаться спонтанному разрушению in situ и in vivo, например, путем гидролиза или ферментативного расщепления, например, протеазами. Система доставки может состоять, например, из природного или синтетического полимера или сополимера, например, в форме гидрогеля. Показательные полимеры с расщепляемыми связями включают в себя сложные полиэфиры, сложные полиортоэфиры, полиангидриды, полисахариды, сложные поли(фосфоэфиры), полиамиды, полиуретаны, поли(имидокарбонаты) и поли(фосфазены).
Соединения согласно изобретению могут быть введены энтерально, перорально, парентерально, подъязычно, путем ингаляции спрея, ректально или местно в дозированных однократных составах, содержащих при желании стандартные нетоксичные фармацевтически приемлемые носители, адъюванты и наполнители. Например, подходящие способы введения включают в себя пероральный, подкожный, чрескожный, чресслизистый, ионофоретический, внутривенный, внутримышечный, внутрибрюшинный, интраназальный, субдермальный, ректальный и т.п. Местное введение также может предусматривать использование чрескожного введения, такого как введение с помощью пластырей для чрескожного введения или ионофоретических устройств. Используемый здесь термин "парентеральный" относится к подкожным инъекциям, внутривенным, внутримышечным, интрастернальным инъекциям или инфузионным методикам.
Препараты для инъекций, например, стерильные водные или масляные суспензии для инъекций, могут быть приготовлены в соответствии с методиками, известными из предшествующего уровня техники с использованием подходящих диспергирующих или увлажняющих агентов и суспендирующих агентов. Стерильный препарат для инъекций также может представлять собой стерильные раствор или суспензию для инъекций в нетоксичном приемлемом для парентерального введения разбавителе или растворителе, например, в виде раствора в 1,3-пропандиоле. Приемлемые носители и растворители, которые могут быть использованы, включают в себя воду, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды стандартно используют стерильные нелетучие масла. Для этой цели может быть использовано любое безвкусное нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, в приготовлении препаратов для инъекций находят применение жирные кислоты, такие как олеиновая кислота.
Суппозитории для ректального введения лекарственного средства могут быть приготовлены путем смешивания лекарственного средства с подходящим нераздражающим наполнителем, таким как масло какао и полиэтиленгликоли, который находится в твердом состоянии при обычных температурах, но в жидком при ректальной температуре и, таким образом, тает в прямой кишке с высвобождением лекарственного средства.
Твердые дозированные формы для перорального введения могут включать в себя капсулы, таблетки, драже, порошки и гранулы. В таких твердых дозированных формах активное соединение может быть смешано, по меньшей мере, с одним инертным разбавителем, таким как сахароза, лактоза или крахмал. Такие дозированные формы также могут содержать, как и в стандартной практике, дополнительные вещества, отличные от инертных разбавителей, например, смазывающие вещества, такие как стеарат магния. Что касается капсул, таблеток и драже, дозированные формы также могут содержать забуферивающие агенты. Кроме того, таблетки и драже могут быть приготовлены с энтеросолюбильными покрытиями.
Жидкие дозированные формы для перорального введения могут включать в себя фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры, содержащие инертные разбавители, стандартно используемые в данной области техники, такие как вода. Такие композиции также могут содержать адъюванты, такие как увлажняющие агенты, эмульгаторы и суспендирующие агенты, циклодекстрины и подсластители, корригенты и отдушки.
Эффективные количества соединений согласно изобретению, как правило, включают в себя любое количество, достаточное для достижения ощутимого результата в лечении описанных здесь нарушений.
Успех лечения субъекта в соответствии с изобретением может заключаться в ослаблении или облегчении симптомов у субъекта, страдающего медицинским или биологическим нарушением. Например, лечение может купировать дальнейшее прогрессирование нарушения или может предотвратить или замедлить развитие нарушения.
Количество активного ингредиента, который может быть объединен с веществами-носителями с получением однократной дозированной формы, варьирует в зависимости от получающего лечение хозяина и конкретного способа введения. Однако следует понимать, что определенный уровень дозировки для каждого конкретного пациента будет зависеть от множества факторов, включая активность конкретного используемого соединения, возраста, массы тела, общего состояния здоровья, пола, рациона, времени введения, пути введения, скорости выведения, сочетания лекарственных средств и тяжести конкретного подвергаемого лечению заболевания. Терапевтически эффективное количество для данной ситуации может быть с легкостью определено в соответствии с рутинными экспериментами, исходя из квалификации и суждения среднего лечащего врача.
Определения
Следующие использованные выше и по всему настоящему описанию термины и сокращения имеют значения, определенные ниже:
Термин "SMIP" относится к низкомолекулярным иммунопотенциирующим соединениям, включающим в себя низкомолекулярные соединения с м.м., составляющей, как правило, менее около 800 г/моль, способные стимулировать или модулировать провоспалительный ответ у пациента. В некоторых вариантах выполнения SMIP соединения способны стимулировать продукцию цитокинов мононуклеарными клетками периферической крови человека. Более конкретно, предпочтительные SMIP включают в себя имидазохинолины и соединения, характеризующиеся формулой I, приведенной в настоящем описании или содержащейся в любой процитированной в настоящем описании ссылке.
Термин "SMIS" относится к низкомолекулярным иммуносупрессирующим соединениям, включающим в себя низкомолекулярные соединения с м.м., составляющей, как правило, менее около 800 г/моль, способные подавлять или модулировать иммунный ответ у пациента. В некоторых вариантах выполнения SMIS соединения способны ингибировать продукцию цитокинов, хемокинов и/или факторов роста мононуклеарными клетками периферической крови человека. В других вариантах выполнения SMIS соединения способны индуцировать продукцию TGF-бета, тем самым подавляя иммунный ответ.
Ссылка на "имидазохинолины" (применительно к имидазохинолинам согласно настоящему изобретению) означает соединения, характеризующиеся приведенной в настоящем описании общей структурной формулой I. В некоторых вариантах выполнения имидазохинолины выбирают из следующего перечня:
N2-метил-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
N2,N2-диметил-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
N2-этил-N2-метил-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
N2-метил-1-(2-метилпропил)-N2-пропил-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
1-(2-метилпропил)-N2-пропил-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
N2-бутил-1-(2-мeтилпpoпил)-1H-имидaзo[4,5-c]xинoлин-2,4-диaмин;
N2-бутил-N2-метил-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
N2-метил-1-(2-метилпропил)-N2-пентил-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
N2-метил-1-(2-метилпропил)-N2-проп-2-енил-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
1-(2-метилпропил)-2-[(фенилметил)тио]-1Н-имидазо[4,5-с]хинолин-4-амин;
1-(2-метилпропил)-2-(пропилтио)-1Н-имидазо[4,5-с]хинолин-4-амин;
2-[[4-амино-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2-ил](метил)амино]этанол;
2-[[4-амино-1-(2-метилпропил)-1Н-имидазо[4,5-с]хинолин-2-ил](метил)амино]этилацетат;
4-амино-1-(2-метилпропил)-1,3-дигидро-2Н-имидазо[4,5-с]хинолин-2-он;
N2-бутил-1-(2-метилпропил)-N4,N4-бис(фенилметил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
N2-бутил-N2-метил-1-(2-метилпропил)-N4,N4-бис(фенилметил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
N2-метил-1-(2-метилпропил)-N4,N4-бис(фенилметил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
N2,N2-диметил-1-(2-метилпропил)-N4,N4-бис(фенилметил)-1Н-имидазо[4,5-с]хинолин-2,4-диамин;
1-{4-амино-2-[метил(пропил)амино]-1Н-имидазо[4,5-с]хинолин-1-ил}-2-метилпропан-2-ол;
1-[4-амино-2-(пропиламино)-1Н-имидазо[4,5-с]хинолин-1-ил]-2-метилпропан-2-ол; или
N4,N4-дибензил-1-(2-метокси-2-метилпропил)-N2-пропил-1Н-имидазо[4,5-с]хинолин-2,4-диамин.
Термин "рефрактерные злокачественные клетки" относится к линиям злокачественных клеток, резистентных к предсуществующим терапевтическим средствам или схемам лечения, включая прописанные схемы дозирования.
Способы согласно изобретению применимы для лечения "аллергических заболеваний", которое может быть проведено так же, как и прочие описанные в настоящем описании иммунотерапевтические способы.
Термин "аллерген" относится к веществу (антигену), способному индуцировать аллергический или астматический ответ у предрасположенного субъекта. Перечень аллергенов огромен и может включать в себя пыльцу, яды насекомых, перхоть животных, пыль, споры грибов и лекарственные средства (например, пенициллин).
Термин "астма" относится к нарушению дыхательной системы, характеризующемуся воспалением, сужением дыхательных путей и повышенной реактивности дыхательных путей на вдыхаемые агенты. Астма зачастую, хотя и не исключительно, ассоциирована с атопическими или аллергическими симптомами.
Термин "ингибитор лейкотриенов" относится к любому агенту или соединению, ингибирующим, подавляющим, замедляющим или иным образом влияющим на действие или активность лейкотриенов, таким как без ограничения ингибиторы 5-липоксигеназы ("5-LO"), антагонисты активирующего 5-липоксигеназу белка ("FLAP") и антагонисты лейкотриена D4 ("LTD4").
Термин "модулирование" относится к индуцированию или подавлению.
Термины "иммуностимуляция" или "иммунопотенциирование" относятся к активации иммунной системы, включая активацию гуморального или клеточного звеньев, например, активацию клетки, такой как киллер (Т или NK) или дендритная клетка иммунной системы, например, вызывающую усиление продукции цитокинов дендритной клеткой, приводящее к общему усилению защиты хозяина (иммунного ответа).
Термин "модулирование иммунного ответа" относится либо к иммунопотенциированию, либо к иммуносупрессии, определенным в настоящем описании.
Термин "иммуногенная композиция" относится к композиции, способной стимулировать иммунный ответ. В некоторых вариантах выполнения "иммуногенные композиции" представляют собой композиции, способные стимулировать иммунный ответ у субъекта. В некоторых вариантах выполнения иммуногенная композиция способна модулировать продукцию цитокинов у субъекта, тем самым осуществляя иммунопотенциирование у указанного субъекта.
Термины "иммунная супрессия" или "иммуносупрессия" относятся к дезактивации иммунной системы, например, к предотвращению или ослаблению продукции цитокинов дендритной клеткой, приводящим к общему ослаблению защиты хозяина (иммунного ответа).
Термин "иммуностимулирующее эффективное количество" относится к количеству, эффективно активирующему иммунную систему, например, вызывающему усиление продукции цитокинов дендритной клеткой, приводящее к общему усилению защиты хозяина (иммунного ответа).
Термин "усиление иммунного ответа на антиген соединением" означает усиление иммунного ответа по сравнению с таковым в отсутствие соединения. Индуцирующая усиленный иммунный ответ композиция представляет собой композицию, как правило, содержащую антиген и низкомолекулярное иммунопотенциирующее соединение, индуцирующее более сильный иммунный ответ, чем композиция, содержащая антиген и не содержащая одно или несколько низкомолекулярных иммунопотенциирующих соединений. В таких вариантах выполнения соединение действует как адъювант, например, применимый в вакцинных композициях и способах.
Термин "заболевание, ассоциированное с клеточной пролиферацией" включает в себя без ограничения нейрофиброматоз, атеросклероз, пневмосклероз, артрит, псориаз, гломерулонефрит, рестеноз, пролиферативную диабетическую ретинопатию (PDR), образование гипертрофических рубцов, воспалительное заболевание кишечника, отторжение трансплантата, ангиогенез или эндотоксический шок.
Термин "эффективное количество" означает количество, необходимое или достаточное для осуществления желаемого биологического эффекта. Например, количество соединения, эффективное для лечения инфекционного нарушения, может представлять собой количество, необходимое для индукции антигенспецифичного иммунного ответа при контакте с инфекционным агентом. Эффективное количество может варьировать, например, в зависимости от подвергающегося лечению состояния, массы тела субъекта и тяжести заболевания. Специалист в данной области техники способен легко определить эффективное количество эмпирически без проведения излишних экспериментов.
Используемый в настоящем описании термин "эффективное для лечения количество" относится к количеству, достаточному для облегчения, смягчения, стабилизации, обращения, замедления или задержки прогрессирования состояния, такого как болезненное состояние.
Термины "метрономическое введение" или "введенный метрономически" относятся к схемам дозирования с возрастающей частотой при использовании более низких концентраций лекарственного средства по сравнению с известными схемами дозирования для существующего терапевтического средства. Метрономическое введение отличается от обычного дозирования цитотоксических средств, представляющего собой эпизодическое (менее частое) введение в максимально переносимых дозах (MTD).
Термины "субъект" или "пациент" относятся к человеку или позвоночному животному, включая собаку, кошку, карманного питомца, игрунку, лошадь, корову, свинью, овцу, козу, слона, жирафа, курицу, льва, обезьяну, сову, крысу, белку, тонкого лори и мышь.
Термин "карманный питомец" относится к группе позвоночных животных, способных поместиться в просторном кармане плаща, таких как, например, хомяки, шиншиллы, хорьки, крысы, морские свинки, песчанки, кролики и карликовые сумчатые летяги. С более подробным описанием можно ознакомиться в Mackay, В., Pocket Pets, Animal Issues, 32(1) 2001.
Используемый в настоящем описании термин "фармацевтически приемлемый сложный эфир" относится к сложным эфирам, гидролизующимся in vivo, и включает в себя сложные эфиры, которые легко разлагаются в организме человека с образованием исходного соединения или его соли. Подходящие сложноэфирные группы включают в себя, например, группы фармацевтически приемлемых алифатических карбоновых кислот, особенно алкановых, алкеновых, циклоалкановых и алкандиовых кислот, в которых каждый алкильный или алкенильный фрагмент предпочтительно содержит не более 6 атомов углерода. Показательные примеры конкретных сложных эфиров включают в себя без ограничения формиаты, ацетаты, пропионаты, бутираты, акрилаты и этилсукцинаты.
Соединения согласно настоящему изобретению могут быть использованы в форме солей, таких как "фармацевтически приемлемых солей" неорганических или органических кислот. Эти соли включают в себя без ограничения следующие соли: ацетат, адипат, альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфорсульфонат, диглюконат, циклопентанпропионат, додецилсульфат, этансульфонат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, фумарат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат, лактат, малеат, метансульфонат, никотинат, 2-нафталинсульфонат, оксалат, памоат, пектинат, сульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, п-толуолсульфонат и ундеканоат. Кроме того, основные азотсодержащие группы могут быть кватернизованы с помощью таких агентов, как низшие алкилгалогениды, такие как метил-, этил-, пропил- и бутил- -хлориды, -бромиды и -йодиды; диалкилсульфаты, такие как диметил-, диэтил- и дибутил- -сульфат и диамилсульфаты; длинноцепочечные галогениды, такие как децил-, лаурил-, миристил- и стеарил- -хлориды, -бромиды и -йодиды; аралкилгалогениды, такие как бензил- и фенэтил- -бромиды и др. Таким образом могут быть получены растворимые или диспергируемые в воде или масле продукты.
Используемый в настоящем описании термин "фармацевтически приемлемое пролекарство" относится к таким пролекарствам соединений согласно настоящему изобретению, которые в соответствии с обоснованным медицинским суждением подходят для использования в контакте с тканями человека и низших животных без неприемлемых токсичности, раздражения, аллергической реакции и т.п., характеризуются разумным соотношением выгода/риск и эффективны для предполагаемого применения, равно как и по возможности к цвиттерионным формам соединений согласно изобретению. Термин "пролекарство" относится к соединениям, которые быстро преобразуются in vivo с образованием исходного соединения указанной выше формулы, например, с помощью гидролиза в крови. С обсуждением можно ознакомиться в Т.Higuchi and V.Stella, Pro-drugs as Novel Delivery Systems, Vol.14 of the A.C.S. Symposium Series и в Edward В. Roche, ed., Bioreversible Carriers in Drug Design, American Pharmaceutical Association and Pergamon Press, 1987. Могут быть использованы пролекарства, описанные в патенте США №6,284,772.
Символ  означает точку прикрепления группы.
означает точку прикрепления группы.
Термин "галоген" относится к атомам F, Cl, Вr или I, особенно F, Cl и Вr.
Ссылка на "активированный" или "активирующий" применительно к группе R, такой как R15, предполагает наличие электрофильного фрагмента, связанного с группой R, который может быть заменен нуклеофилом. Примерами предпочтительных активирующих групп являются галогены, такие как Cl, Вr, I и F; трифлаты; сложные эфиры; альдегиды; кетоны; эпоксиды и т.п. Примером активированной группы R является йодпропан, который легко разрушается нуклеофилом, таким как тиол, с образованием тиопропановой функциональной группы.
Термин "сшивающий агент" относится к агенту, действующему как граница раздела между двумя заместителями, необязательно образующая химический мостик между ними для облегчения проведения реакции. Одним предпочтительным сшивающим агентом является EDC.
Термин "удаление защиты" относится к удалению защитной группы, такому как удаление бензильной группы, связанной с амином. Удаление защитной группы может быть осуществлено путем нагревания и/или добавления реагентов, способных удалять защитные группы. Одним предпочтительным способом удаления бензильных групп с аминогрупп является добавление НВr и уксусной кислоты при нагревании. Многие реакции удаления защитных групп хорошо известны из предшествующего уровня техники и описаны в Protective Groups in Organic Synthesis, Greene, T.W., John Wiley & Sons, New York, NY, (1st Edition, 1981).
Термин "необязательная очистка" относится к необязательному удалению компонентов смеси, отличных от желаемого продукта. Такие компоненты могут представлять собой побочные продукты, остатки исходных веществ или молекулы, попавшие в смесь на какой-либо стадии способа, такие как молекулы воды. Таким образом, термин "очистка" охватывает хроматографию, перегонку, перекристаллизацию и фильтрование, равно как и экстрагирование, сушку или азеотропную перегонку с такими веществами, как сульфат натрия или толуол.
Термин "окисление" относится к образованию связи атома с более электроотрицательным атомом. Добавление в органическую молекулу водорода почти всегда считается восстановлением. Окисление может быть проведено с помощью различных окислителей, хорошо известных специалистам в данной области техники. Восстановление может быть проведено с помощью большого множества восстановителей, также хорошо известных из предшествующего уровня техники.
Термин "проведение взаимодействия" относится к такому модифицированию условий в реакционном сосуде, при котором нереакционноспособная молекула становится реакционноспособной. Это может предусматривать, помимо прочего, добавление растворителя(ей), катализатора, реагентов, сшивающих агентов и/или нагревание.
Термин "катализатор Перлмана" означает гидроксид палладия на активированном угле.
Термин "алкил" относится к замещенным и незамещенным алкильным группам, таким как метил, этил, пропил, бутил, пентил, гексил, гептил, октил, нонил, децил, ундецил, додецил и т.п. Термин "C1-6алкил" имеет то же значение, что и "алкил" за исключением того, что он ограничен алкильными группами, содержащими шесть или менее атомов углерода. Термин "C1-6алкил" также относится к разветвленным изомерам неразветвленных алкильных групп, включая без ограничения следующие группы, приведенные в качестве примера: -СН(СН3)2, -СН(СН3)(СН2СН3), -СН(СН2СН3)2, -С(СН3)3, -СН2СН(СН3)2, -СН2СН(СН3)(СН2СН3), -СН2СН(СН2СН3)2, -СН2С(СН3)3, -СН(СН3)СН(СН3)(СН2СН3), -СН2СН2СН(СН3)2, -СН2СН2СН(СН3)(СН2СН3), -СН2СН2С(СН3)3, -СН(СН3)СН2СН(СН3)2, -СН(СН3)СН(СН3)СН(СН3) и др. Кроме того, термин "C1-6алкил" относится к циклическим алкильным или С3-6циклоалкильным группам, таким как циклопропил, циклобутил, циклопентил, циклогексил, и таким циклам, замещенным неразветвленными или разветвленными алкильными группами, определенными выше. Термин "алкил" также относится к полициклическим алкильным группам, таким как без ограничения адамантил, норборнил и бицикло[2.2.2]октил, и таким циклам, замещенным неразветвленными или разветвленными алкильными группами, определенными выше.
Термин "арил" относится к замещенным и незамещенным арильным группам, не содержащим гетероатомы. Термин "С6-10арил" имеет то же значение, что и "арил" за исключением того, что он ограничен арильными группами, содержащими от шести до десяти атомов углерода. Термин "арил" относится без ограничения к таким группам, как, например, фенил, бифенил и нафтил. Арильные группы также включают в себя группы, в которых один из ароматических атомов углерода связан с алкильной, алкенильной или алкинильной группами, определенными в настоящем описании. Термин включает в себя такие взаимные геометрические расположения связей, при которых два атома углерода углерода арильной группы связаны с двумя атомами углерода алкильной, алкенильной или алкинильной групп с образованием конденсированной системы колец (например, дигидронафтил или тетрагидронафтил). Таким образом, термин "арил" относится без ограничения, помимо прочего, к толилу и гидроксифенилу.
Термин "алкенил" относится к неразветвленным, разветвленным и циклическим группам, таким как группы, описанные применительно к алкильным группам, определенным выше, за исключением того, что в них содержится, по меньшей мере, одна двойная связь между двумя атомами углерода. Термин "C2-6алкенил" имеет то же значение, что и "алкенил" за исключением того, что он ограничен алкенильными группами, содержащими от двух до шести атомов углерода. Примеры включают в себя без ограничения винил, -СН=С(Н)(СН3), -СН=С(СН3)2, -С(СН3)=С(Н)2, -С(СН3)=С(Н)(СН3), -С(СН2СН3)=СН2, циклогексенил, циклопентенил, циклогексадиенил, бутадиенил, пентадиенил, гексадиенил и т.п.
Термин "алкокси" относится к группам, характеризующимся формулой -O-алкил, где точкой прикрепления является оксигруппа, а алкильная группа определена выше. Термин "C1-6алкокси" имеет то же значение, что и "алкокси" за исключением того, что он ограничен алкоксигруппами, содержащими от одного до шести атомов углерода.
Термин "арилокси" относится к группам, характеризующимся формулой -O-арил, где точкой прикрепления является оксигруппа, а арильная группа определена выше. Термин "С6-10арилокси" имеет то же значение, что и "арилокси" за исключением того, что он ограничен арилоксигруппами, содержащими от шести до десяти атомов углерода.
Термин "C1-6алкокси-С1-6алкил" относится к эфирным группам с количеством атомов углерода до 12. Одним примером C1-6алкокси-C1-6алкильной группы является -СН2-O-СН2СН3.
Термин "С6-10арилокси-С1-6алкил" относится к арилэфирным группам с количеством атомов углерода 16 или менее, особенно 10 или менее атомов углерода, связанным с C1-6алкильной группой. Одним примером С6-10арилокси-C1-6алкильной группы является пропоксибензол.
Термин "С6-10арил-С1-6алкил" относится к арилалкильным группам с количеством атомов углерода 16 или менее, особенно 10 или менее атомов углерода, связанным с C1-6алкильной группой. Одним примером С6-10арил-С1-6алкильной группы является толуол.
Термин "алкинил" относится к неразветвленным и разветвленным группам, таким как группы, описанные применительно к алкильным группам, определенным выше, за исключением того, что в них содержится, по меньшей мере, одна тройная связь между двумя атомами углерода. Термин "С2-6алкинил" имеет то же значение, что и "алкинил" за исключением того, что он ограничен алкинильными группами, содержащими от двух до шести атомов углерода. Примеры включают в себя без ограничения -С≡С(Н), -С≡С(СН3), -С≡С(СН2СН3), -С(Н2)С≡С(Н), -С(Н)2С≡С(СН3), -С(Н)2С≡С(СН2СН3) и т.п.
Термин "тригалогенметил" относится к метильной группе, в которой три атома Н метильной группы замещены тремя атомами галогена, которые могут быть одинаковыми или различными. Одним примером такой группы является группа -СF3, в которой все три атома Н метильной группы замещены атомами F.
Для целей разъяснения формула -СН2С(СН3)2(ОН) соответствует 2-метилпропан-2-олу или трет-бутанолу.
Термин "гетероциклил" относится как к ароматическим, так и к неароматическим циклическим соединениям, включающим в себя моноциклические, бициклические и полициклические кольцевые соединения, такие как без ограничения хинуклидил, содержащий 3 или более членов кольца, из которых один или несколько представляют собой гетероатом, такой как без ограничения N, О и S. Примеры гетероциклильных групп включают в себя без ограничения ненасыщенные 3-8-членные кольца, содержащие 1-4 атома азота, такие как без ограничения пирролил, пирролинил, имидазолил, пиразолил, пиридил, дигидропиридил, пиримидил, пиразинил, пиридазинил, триазолил (например, 4Н-1,2,4-триазолил, 1Н-1,2,3-триазолил, 2Н-1,2,3-триазолил и т.д.), тетразолил (например, 1Н-тетразолил, 2Н тетразолил и т.д.); насыщенные 3-8-членные кольца, содержащие 1-4 атома азота, такие как без ограничения пирролидинил, имидазолидинил, пиперидинил, пиперазинил; конденсированные ненасыщенные гетероциклические группы, содержащие 1-4 атома азота, такие как без ограничения индолил, изоиндолил, индолинил, индолизинил, бензимидазолил, хинолил, изохинолил, индазолил, бензотриазолил; ненасыщенные 3-8-членные кольца, содержащие 1-2 атома кислорода, такие как без ограничения фуранил; ненасыщенные 3-8-членные кольца, содержащие 1-2 атома кислорода и 1-3 атома азота, такие как без ограничения оксазолил, изоксазолил, оксадиазолил (например, 1,2,4-оксадиазолил, 1,3,4-оксадиазолил, 1,2,5-оксадиазолил и т.д.); насыщенные 3-8-членные кольца, содержащие 1-2 атома кислорода и 1-3 атома азота, такие как без ограничения морфолинил; ненасыщенные конденсированные гетероциклические группы, содержащие 1-2 атома кислорода и 1-3 атома азота, например, бензоксазолил, бензоксадиазолил, бензоксазинил (например, 2H-1,4-бензоксазинил и т.д.); ненасыщенные 3-8-членные кольца, содержащие 1-3 атома серы и 1-3 атома азота, такие как без ограничения тиазолил, изотиазолил, тиадиазолил (например, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,3,4-тиадиазолил, 1,2,5-тиадиазолил и т.д.); насыщенные 3-8-членные кольца, содержащие 1-2 атома серы и 1-3 атома азота, такие как без ограничения тиазолодинил; насыщенные и ненасыщенные 3-8-членные кольца, содержащие 1-2 атома серы, такие как без ограничения тиенил, дигидродитиинил, дигидродитионил, тетрагидротиофен, тетрагидротиопиран; ненасыщенные конденсированные гетероциклические кольца, содержащие 1-2 атома серы и 1-3 атома азота, такие как без ограничения бензотиазолил, бензотиадиазолил, бензотиазинил (например, 2Н-1,4-бензотиазинил и т.д.), дигидробензотиазинил (например, 2Н-3,4-дигидробензотиазинил и т.д.), ненасыщенные конденсированные гетероциклические кольца, содержащие 1-2 атома кислорода, такие как бензодиоксолил (например, 1,3-бензодиоксолил и т.д.); ненасыщенные 3-8-членные кольца, содержащие атом кислорода и 1-2 атома серы, такие как без ограничения дигидрооксатиинил; насыщенные 3-8-членные кольца, содержащие 1-2 атома кислорода и 1-2 атома серы, такие как 1,4-оксатиан; ненасыщенные конденсированные кольца, содержащие 1-2 атома серы, такие как бензотиенил, бензодитиинил; и ненасыщенные конденсированные гетероциклические кольца, содержащие атом кислорода и 1-2 атома кислорода, такие как бензоксатиинил. Гетероциклильные группы также включают в себя описанные выше группы, в которых один или несколько атомов S в кольце связан двойной связью с одним или двумя атомами кислорода (сульфоксиды и сульфоны). Например, гетероциклильные группы включают в себя тетрагидротиофен, тетрагидротиофеноксид и тетрагидротиофен-1,1-диоксид. Предпочтительные гетероциклильные группы содержат в кольце 5 или 6 членов. Более предпочтительные гетероциклильные группы включают в себя морфолин, пиперазин, пиперидин, пирролидин, имидазол, пиразол, 1,2,3-триазол, 1,2,4-триазол, тетразол, тиоморфолин, тиоморфолин, в котором атом S тиоморфолина связан с одним или более атомами О, пиррол, гомопиперазин, оксазолидин-2-он, пирролидин-2-он, оксазол, хинуклидин, тиазол, изоксазол, фуран и тетрагидрофуран. Термин "гетероциклил" также относится к таким определенным выше группам, в которых один из членов кольца связан с отличным от атома водорода атомом, таким как описанные выше применительно к замещенным алкильным группам и замещенным арильным группам. Примеры включают в себя без ограничения, помимо прочего, 2-метилбензимидазолил, 5-метилбензимидазолил, 5-хлорбензтиазолил, 1-метилпиперазинил и 2-хлорпиридил. Гетероциклильные группы включают в себя группы, содержащие от 2 до 15 атомов углерода и до 6 дополнительных гетероатомов, описанных выше. Более предпочтительные гетероциклильные группы содержат от 3 до 5 атомов углерода и до 2 гетероатомов. Наиболее предпочтительные гетероциклильные группы включают в себя пиперидинильную, пирролидинильную, азетидинильную и азиридинильную группы.
Термин "замещенный" подразумевает замену одного или нескольких атомов водорода одновалентным или двухвалентным радикалом. Подходящие замещающие группы включают в себя, например, гидроксил, нитро, амино, имино, циано, галоген, тио, тиоамидо, амидино, имидино, оксо, оксамидино, метоксамидино, имидино, гуанидино, сульфонамидо, карбоксил, формил, алкил, гетероциклил, арил, галогеналкил, алкокси, алкоксиалкил, алкилкарбонил, арилкарбонил, аралкилкарбонил, алкилтио, аминоалкил, алкиламино, цианоалкил и т.п. Например, одним предпочтительным "замещенным C1-6алкилом" является трет-бутанол. Другим предпочтительным замещенным C1-6алкилом является -CH2C(CH3)2NH-SO2CH3.
Замещающая группа может сама быть однажды замещена. Например, алкоксизаместитель алкильной группы может быть замещен галогеном, оксогруппой, арильной группой и т.п. Группой, замещающей другую замещающую группу, может являться карбоксил, галоген, нитро, оксо, амино, циано, гидроксил, C1-6алкил, C1-6алкокси, С6-10арил, аминокарбонил, -SR, тиоамидо, -SO3Н, -SO2R или циклоалкил, где R, как правило, представляет собой водород, гидроксил или C1-6алкил.
Если замещенный заместитель содержит неразветвленную группу, замещение может иметь место либо в середине цепи (например, 2-гидроксипропил, 2-аминобутил и т.п.), либо на конце цепи (например, 2-гидроксиэтил, 3-цианопропил и т.п.). Замещенные заместители могут характеризоваться неразветвленными, разветвленными или циклическими взаимными геометрическими расположениями ковалентно связанных атомов углерода или гетероатомов.
Термины "защищенный" или "защитная группа" применительно к гидроксигруппам, аминогруппам и сульфгидрильным группам относятся к формам этих функциональных групп, которые защищены от нежелательной реакции защитной группой, известной специалистам в данной области техники, такой как группы, указанные в Protective Groups in Organic Synthesis, Greene, T.W., John Wiley & Sons, New York, NY, (1st Edition, 1981), которые могут быть введены или удалены в соответствии с методиками, изложенными в указанной ссылке. Примеры замещенных гидроксигрупп включают в себя без ограничения силиловые эфиры, такие как силиловые эфиры, полученные в соответствии с реакцией гидроксигруппы с таким реагентом, как без ограничения трет-бутилдиметилхлорсилан, триметилхлорсилан, триизопропилхлорсилан, триэтилхлорсилан; замещенные метиловые и этиловые эфиры, такие как без ограничения метоксиметиловый эфир, метилтиометиловый эфир, бензилоксиметиловый эфир, трет-бутоксиметиловый эфир, 2-метоксиэтоксиметиловый эфир, тетрагидропираниловые эфиры, 1-этоксиэтиловый эфир, аллиловый эфир, бензиловый эфир; сложные эфиры, такие как без ограничения бензоилформиат, формиат, ацетат, трихлорацетат и трифторацетат. Примеры защищенных аминогрупп включают в себя без ограничения бензиловые или дибензиловые амиды, такие как формамид, ацетамид, трифторацетамид и бензамид; имиды, такие как фталимид и дитиосукцинимид; и др. В некоторых вариантах выполнения защитная группа аминов представляет собой бензиловую группу. Примеры защищенных сульфгидрильных групп включают в себя без ограничения тиоэфиры, такие как S-бензиловый тиоэфир и S-4-пиколиловый тиоэфир; замещенные S-метиловые производные, такие как гемитио-, дитио- и аминотиоацетали; и др.
Имидазохинолиновые соединения формулы I могут характеризоваться явлением таутомерии, и графические формулы в настоящем описании могут соответствовать лишь одной из возможных таутомерных форм. Следует понимать, что изобретение охватывает все таутомерные формы, обладающие иммуномодулирующей активностью, и не может быть ограничено лишь любой одной таутомерией формой, использованной в графических формулах.
Имидазохинолины формулы I также могут находиться в сольватированной, равно как и в несольватированной формах, таких как, например, гидратированных формах. Изобретение относится как к сольватированным, так и к несольватированным формам, обладающим иммуномодулирующей активностью.
Изобретение также относится к меченым изотопами имидазохинолиновым соединениям, структурно идентичным соединениям, раскрытым выше, за исключением того, что один или несколько атомов заменены атомом, характеризующимся атомной массой, или массовым числом, отличным от атомной массы, или массового числа, обычно встречающегося в природе. Примеры изотопов, которые могут быть введены в соединения согласно изобретению, включают в себя изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора и хлора, такие как соответственно 2H, 3H, 13С, 14С, 15N, 18О, 17О, 31P, 32P, 35S, 18F и 36Cl. Соединения согласно настоящему изобретению, их таутомеры, их пролекарства и фармацевтически приемлемые соли соединений и пролекарств, содержащие указанные выше изотопы и/или другие изотопы других атомов, подпадают под объем настоящего изобретения. Некоторые меченные изотопами соединения согласно настоящему изобретению, например, соединения, в которые введены радиоактивные изотопы, такие как 3H и 14С, применимы в анализах тканевого распределения лекарственных средств и/или субстратов. Изотопы трития, т.е. 3Н, и углерода-14, т.е. 14С, особенно применимы благодаря простоте их получения и обнаружения. Кроме того, замена более тяжелыми изотопами, такими как дейтерий, т.е. 2H, может приводить к определенным терапевтическим преимуществам за счет большей метаболической стабильности, например, увеличенного времени полужизни in vivo или пониженной требуемой дозы, и, следовательно, может быть предпочтительной в некоторых обстоятельствах. Меченные изотопами соединения согласно настоящему изобретению и их пролекарства, как правило, могут быть получены путем осуществления известных или описанных методик и путем замены не меченного изотопами реагента на легкодоступный меченный изотопами реагент.
Изложенные выше сведения могут быть лучше поняты благодаря ознакомлению со следующими примерами, которые приведены в иллюстративных целях и не ограничивают объем изобретательского замысла. Соединения, указанные в примерах, и их аналоги могут быть легко синтезированы специалистом в данной области техники в соответствии с методиками, раскрытыми в настоящем описании, равно как и в указанных здесь патентах и заявках на выдачу патента, каждый(ая) из которых включен(а) сюда во всей полноте посредством ссылки и для любых целей считается полностью изложенным(ой) в настоящем описании.
Примеры
Схема 1
На реакционной схеме 1 проиллюстрировано получение универсального промежуточного продукта для соединений согласно изобретению. Схема дополнительно описана в патенте США №5,48,293, включенном в настоящее описание посредством ссылки. Незамещенное соединение формулы I является известным коммерчески доступным соединением, а другие соединения формулы I, включая соединения, замещенные по R3, как описано в настоящем описании, могут быть получены в соответствии с методиками, известными специалистам в данной области техники и описанными, например, в Сhem. Ber. 1927, 60, 1108 (Kohler) и J. Heterocyclic Chem. 1988, 25, 857 (Kappe).
На стадии (i) сначала получали 3-нитрохинолин-2,4-дисульфонат путем взаимодействия 2,4-дигидрокси-3-нитрохинолина с сульфонилгалогенидом или, предпочтительно, сульфоновым ангидридом. Подходящие сульфонилгалогениды включают в себя алкилсульфонилгалогениды, такие как метансульфонилхлорид и трифторметансульфонилхлорид, и арилсульфонилгалогениды, такие как бензолсульфонилхлорид, п-бромбензолсульфонилхлорид и п-толуолсульфонилхлорид. Подходящие сульфоновые ангидриды включают в себя ангидриды, соответствующие указанным выше сульфонилгалогенидам. Особенно предпочтительным сульфоновым ангидридом является трифторметансульфоновый ангидрид.
Условия реакции предпочтительно предусматривали сначала объединение соединения 1 с основанием, предпочтительно, с избытком третичноаминового основания (например, триалкиламинового основания, такого как триэтиламин) и, предпочтительно, в подходящем растворителе, таком как дихлорметан, с последующим добавлением сульфонилгалогенида или сульфонового ангидрида. Добавление предпочтительно проводили контролируемо (например, по каплям) и при пониженной температуре (например, при температуре около 0°С).
Затем проводили взаимодействие с трет-бутиламином, предпочтительно, в присутствии избытка третичноаминового основания в растворителе, таком как дихлорметан, с получением соединения 2. Реакция может быть проведена путем добавления третичноаминового основания в реакционную смесь, полученную в результате первой части стадии (i), охлаждения до пониженной температуры (например, до 0°С) и контролируемого добавления трет-бутиламина (например, по каплям). Реакция также может быть проведена путем добавления трет-бутиламина в раствор дисульфоната и третичноаминового основания в таком растворителе, как дихлорметан. Реакция может быть проведена при относительно низких температурах, например, около 0°С, с целью снижения количества нежелательных 2-аминированных и 2,4-диаминированных побочных продуктов. Иногда необходимо и желательно нагреть реакционную смесь после добавления для того, чтобы завершить реакцию.
На стадии (ii) проводили взаимодействие соединения 2 с дибензиламином. Реакция может быть проведена путем внесения исходного вещества и дибензиламина в инертный растворитель, такой как бензол, толуол или ксилол, и нагревания при температуре и в течение времени, достаточных для того, чтобы вызвать замену сульфонатной группы дибензиламином, причем такие температура и время легко определяются специалистами в данной области техники. Затем трет-бутильную группу удаляли путем нагревания в полярном растворителе, таком как метанол, в присутствии кислоты, такой как соляная кислота.
Нитрогруппу затем восстанавливали до аминогруппы. Способы проведения такого восстановления хорошо известны специалистам в данной области техники: предпочтительный способ предусматривает in situ получение Ni2B из боргидрида натрия и NiCl2 в метаноле с получением раствора восстановителя. Нитросоединение добавляли к раствору восстановителя с проведением восстановления нитрогруппы. Продукт представляет собой соединение 3. Последующее добавление НСl в форме газа, барботируемого через метанол, или растворение в водном НСl с последующей лиофилизацией позволяли получить полезный промежуточный продукт НСl, используемый во многих следующих схемах.
Схема 2
Стадия I
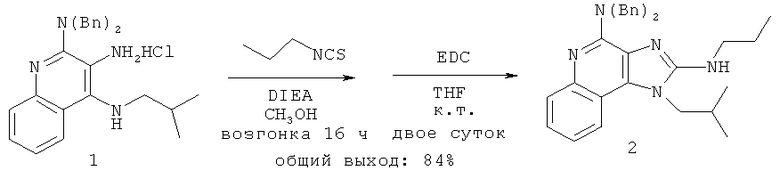
Соединение 1 синтезировали, как показано на схеме 1, используя 2-метил-1-пропиламин вместо трет-бутиламина на стадии (i) схемы 1. Соединение 1 (2,235 г, 5 ммоль, 1,0 экв.) растворяли в сухом метаноле (40 мл), добавляли N,N-диизопропилэтиламин (0,96 мл, 5,5 ммоль, 1,1 экв.). Раствор перемешивали в течение 0,5 часа и затем добавляли пропилизотиоцианат (0,52 мл, 5 ммоль, 1,0 экв.). После нагревания с обратным холодильником в течение 16 часов раствор концентрировали и остаток вносили в THF (50 мл) и добавляли 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорид (EDC) (1,438 г, 7,5 ммоль, 1,5 экв.). Реакционный раствор перемешивали при комнатной температуре в течение двух суток. Смесь концентрировали и остаток распределяли между этилацетатом и водой. Органический слой промывали насыщенным раствором хлорида натрия, затем сушили и концентрировали. Неочищенный остаток подвергали хроматографии на колонке с силикагелем. Колонку элюировали смесью 10:1 (по объему) гексана и этилацетата. Концентрирование объединенных фракций позволяло получить продукт в виде желтого масла (2,0 г, 84%).
1H ЯМР (300 МГц, CDCl3) 0,87 (т, J=7,2 Гц, 3Н), 1,04 (д, J=6,6 Гц, 6Н), 1,57 (м, 2Н), 2,38 (м, 1Н), 3,32 (м, 2Н), 3,86 (т, J=5,4 Гц, 1Н), 3,96 (д, J=7,5 Гц, 2Н), 5,38 (с, 4Н), 7,17-7,81 (м, 14Н); 13С ЯМР (300 МГц, СDСl3) 12,2, 20,8, 23,6, 29,9, 46,3, 51,1, 52,4, 115,6, 119,1, 121,8, 126,1, 126,6, 127,2, 128,5, 128,9, 129,0, 133,8, 141,0, 144,6, 150,9, 152,2; HRMS (EI) набл. 477,2888 (М+), расч. 477,2889 (М+) (C31H35N5).
Стадия II
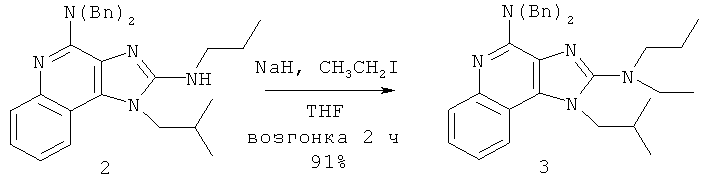
К раствору 2 (1,887 г, 3,95 ммоль, 1,0 экв.) в THF (30 мл) добавляли 60% гидрид натрия (0,316 г, 7,9 ммоль, 2,0 экв.) с последующим добавлением йодэтана (0,48 мл, 5,93 ммоль, 1,5 экв.). Смесь нагревали с обратным холодильником на масляной бане в течение 2 часов. Смесь затем концентрировали и остаток распределяли между этилацетатом и водой. Органический слой промывали насыщенным солевым раствором и сушили. Концентрирование позволяло получить масляный остаток, который подвергали хроматографии на колонке с силикагелем. Колонку элюировали смесью 10:1 (по объему) гексана и этилацетата. Концентрирование объединенных фракций позволяло получить продукт в виде желтого твердого вещества (1,83 г, 92%).
т.пл. 115,4-116,0°С; 1H ЯМР (300 МГц, СDСl3) 0,798 (т, J=7,2 Гц, 3Н), 0,80 (д, J=6,6 Гц, 6Н), 1,01 (т, J=7,2 Гц, 3Н), 1,45 (м, 2Н), 2,30 (м, 1Н), 3,00 (т, J=7,5 Гц, 2Н), 3,10 (кв, J=7,2 Гц, 2Н), 4,16 (д, J=7,2 Гц, 2Н), 5,38 (с, 4Н), 7,17-7,81 (м, 14Н); 13С ЯМР (300 МГц, CDCl3) 11,7, 12,4, 19,7, 20,5, 28,3, 47,5, 50,4, 52,7, 54,5, 115,3, 119,5, 121,0, 126,0, 126,5, 127,6, 128,1, 128,2, 133,7, 140,1, 144,3, 150,5, 155,5; HRMS (EI) набл. 505,3198 (М+), расч. 505,3200 (М+) (С33Н39N5).
Стадия III

Раствор 3 (152 мг, 0,3 ммоль, 1,0 экв.) в растворе бромоводорода (10 мл, 47% в воде) и уксусной кислоты (10 мл) нагревали с обратным холодильником в течение ночи. Реакционный раствор затем разбавляли CH2Cl2 (100 мл) и значение рН доводили до 7 1М раствором NaOH и насыщенным раствором NаНСО3. Органический слой отделяли, сушили и концентрировали. Неочищенный продукт очищали по методу хроматографии с помощью 5% метанола в СН2Сl2 с получением 66% (4).
т.пл. 139,2-142,8°С; 1H ЯМР (300 МГц, CDCl3) 0,82 (д, J=6,6 Гц, 6Н), 0,92 (т, J=7,2 Гц, 3Н), 1,15 (т, J=7,2 Гц, 3Н), 1,60 (м, 2Н), 2,29 (м, 1Н), 3,14 (т, J=7,5 Гц, 2Н), 3,24 (кв, J=7,2 Гц, 2Н), 4,16 (д, J=7,2 Гц, 2Н), 5,67(с, 2Н), 7,27-7,84 (м, 4Н); 13С ЯМР (300 МГц, CDCl3) 12,4, 13,4, 20,4, 21,4, 29,2, 48,1, 53,5, 55,1, 116,4, 120,6, 122,6, 126,2, 127,0, 127,6, 133,0, 144,7, 151,6, 158,1; HRMS (EI) набл. 325,2262 (М+), расч. 325,2261 (M+) (C19H27N5).
Схема 3
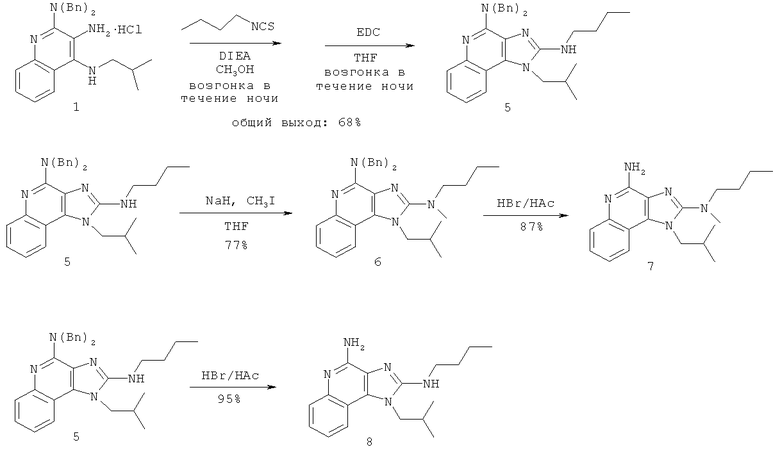
Стадия I
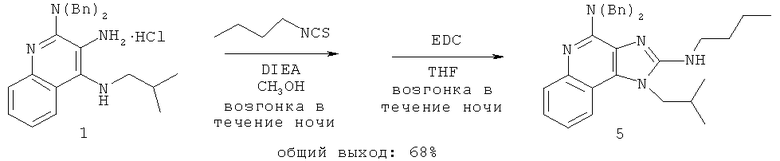
Соединение 1 (536,4 мг, 1,2 ммоль, 1,0 экв.) растворяли в сухом метаноле (20 мл) и добавляли N,N-диизопропилэтиламин (0,23 мл, 13,2 ммоль, 1,1 экв.). Раствор перемешивали в течение 0,5 часа и затем добавляли н-бутилизотиоцианат (0,15 мл, 1,2 ммоль, 1,0 экв.). После нагревания с обратным холодильником в течение ночи раствор концентрировали и вносили в THF (30 мл) и добавляли 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорид (EDC) (460 мг, 2,4 ммоль, 2,0 экв.). Реакционный раствор нагревали с обратным холодильником в течение ночи. Смесь концентрировали и остаток распределяли между этилацетатом и водой. Органический слой промывали насыщенным раствором хлорида натрия, затем сушили и концентрировали. Неочищенный остаток подвергали хроматографии на колонке с силикагелем. Колонку элюировали смесью 10:1 (по объему) гексана и этилацетата. Концентрирование объединенных фракций позволяло получить продукт в виде желтого масла (0,4 г, 68%).
1H ЯМР (300 МГц, CDCl3) 0,86 (т, J=7,2 Гц, 3Н), 1,05 (д, J=6,6 Гц, 6Н), 1,30 (м, 2Н), 1,54 (м, 2Н), 2,28 (м, 1Н), 3,36 (м, 2Н), 3,84 (т, J=5,4 Гц, 1Н), 3,98 (д, J=7,5 Гц, 2Н), 5,39 (с, 4Н), 7,20-7,81 (м, 14Н); 13С ЯМР (300 МГц, CDCl3) 14,5, 20,8, 29,9, 32,6, 44,3, 51,2, 52,3, 115,5, 119,2, 121,9, 126,2, 126,6, 127,2, 128,2, 128,9, 129,0, 133,8, 140,8, 150,7, 152,3; HRMS (EI) набл. 491,3028 (М+), расч. 491,3043 (М+) (C32H37N5).
Стадия II
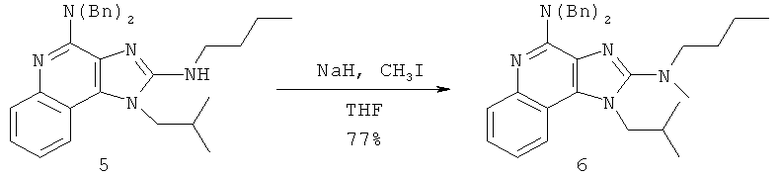
К раствору 5 (208 мг, 0,42 ммоль, 1,0 экв.) в THF (30 мл) добавляли 60% гидрид натрия (50 мг, 1,26 ммоль, 3,0 экв.) с последующим добавлением йодметана (0,039 мл, 0,63 ммоль, 1,5 экв.). Смесь нагревали с обратным холодильником в течение ночи в атмосфере N2. Смесь концентрировали и остаток распределяли между этилацетатом и водой. Органический слой промывали насыщенным солевым раствором и сушили сульфатом натрия. Концентрирование позволяло получить масляный остаток, который подвергали хроматографии на колонке с силикагелем. Колонку элюировали смесью 10:1 (по объему) гексана и этилацетата. Концентрирование объединенных фракций позволяло получить продукт в виде масла (165 мг, 77%).
1H ЯМР (300 МГц, CDCl3) 0,80 (д, J=6,6 Гц, 6Н), 0,84 (т, J=7,2 Гц, 3Н), 1,25 (м, 2Н), 1,47 (м, 2Н), 2,29 (м, 1Н), 3,01 (с, 3Н), 3,03 (т, J=7,5 Гц, 2Н), 4,17 (д, J=7,5 Гц, 2Н), 5,38 (с, 4Н), 7,20-7,85 (м, 14Н); 13С ЯМР (300 МГц, CDCl3) 14,7, 20,4, 21,1, 29,1, 30,1, 41,7, 51,1, 53,6, 56,1, 116,1, 120,2, 121,9, 126,9, 127,3, 128,4, 128,9, 129,1, 134,6, 140,9, 145,1, 151,3, 157,6; HRMS (EI) набл. 505,3187 (М+), расч. 505,3200 (М+) (С33Н39N5).
Стадия III
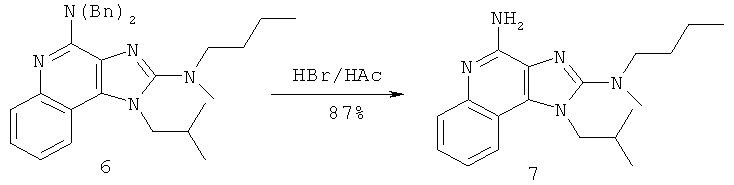
Раствор 6 (140 мг, 0,28 ммоль, 1,0 экв.) в растворе бромоводорода (10 мл, 47% в воде) и уксусной кислоты (10 мл) нагревали с обратным холодильником в течение ночи. Реакционный раствор разбавляли CH2Cl2 (100 мл) и значение рН доводили до 7 1М раствором NaOH и насыщенным раствором NаНСО3. Органический слой отделяли, сушили и концентрировали. Неочищенный продукт очищали по методу хроматографии с помощью 5% метанола в дихлорметане с получением выхода 87% (7).
т.пл. 112,7-114,8°С; 1H ЯМР (300 МГц, CDCl3) 0,82 (д, J=6,6 Гц, 6Н), 0,95 (т, J=7,5 Гц, 3Н), 1,39 (м, 2Н), 1,62 (м, 2Н), 2,26 (м, 1Н), 2,89 (с, 3Н), 3,16 (т, J=7,8 Гц, 2Н), 4,18 (д, J=7,5 Гц, 2Н), 5,50 (с, 2Н), 7,26-7,85 (м, 4Н); 13С ЯМР (300 МГц, СDСl3) 14,0, 19,6, 20,2, 28,5, 29,5, 40,5, 52,9, 55,4, 115,7, 119,8, 122,0, 125,3, 126,4, 126,9, 132,4, 143,9, 150,7, 158,8; HRMS (EI) набл. 325,2262 (М+), расч. 325,2261 (M+) (C19H27N5)
Стадия IV (получения неметилированного аналога):
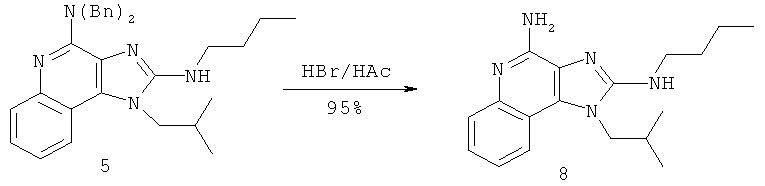
Раствор 5 (100 мг, 0,20 ммоль, 1,0 экв.) в растворе бромоводорода (10 мл, 47% в воде) и уксусной кислоты (10 мл) нагревали с обратным холодильником в течение ночи. Реакционный раствор разбавляли СН2Сl2 (100 мл) и значение рН доводили до 7 1М раствором NaOH и насыщенным раствором NаНСО3. Органический слой отделяли, сушили и концентрировали. Неочищенный продукт очищали по методу хроматографии с помощью 10% метанола в дихлорметане с получением (8) с выходом 95%.
1H ЯМР (300 МГц, CDCl3) 0,99 (т, J=7,3 Гц, 3Н), 1,03 (д, J=6,9 Гц, 6Н), 1,46 (м, 2Н), 1,71 (м, 2Н), 2,27 (м, 1Н), 3,50 (м, 2Н), 3,99 (д, J=7,8 Гц, 2Н), 4,47 (т, 1Н), 6,70 (с, 2Н), 7,25-7,68 (м, 4Н); 13С ЯМР (300 МГц, СDСl3) 13,8, 19,8, 20,1, 29,0, 31,6, 43,4, 51,6, 113,6, 119,2, 122,9, 123,1, 124,0, 126,7, 132,3, 137,9, 148,7, 154,2; HRMS (EI) набл. 311,2106 (М+), расч. 325,2104 (M+) (C18H25N5)
Схема 4
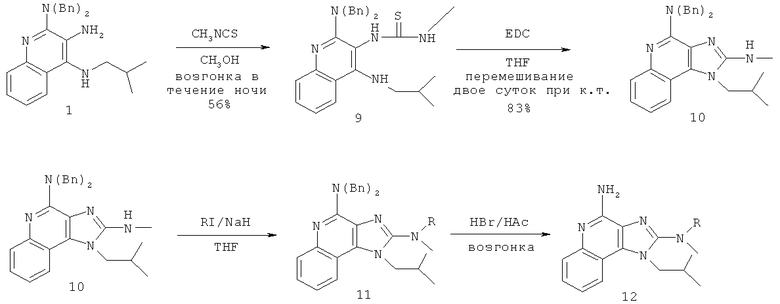
Стадия I
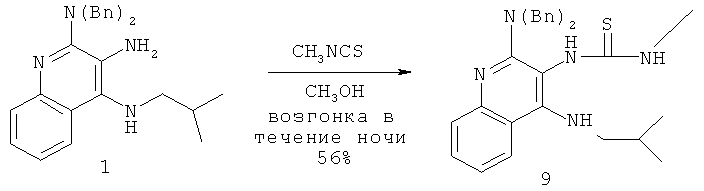
Соединение 1 (2,23 г, 5,4 ммоль, 1,0 экв.) растворяли в сухом метаноле (60 мл) и добавляли метилизотиоцианат (0,4 г, 5,4 ммоль, 1,0 экв.). После нагревания с обратным холодильником в течение ночи раствор концентрировали и остаток подвергали хроматографии на колонке с силикагелем. Колонку элюировали смесью 10:1 (по объему) гексана и этилацетата. Концентрирование объединенных фракций позволяло получить продукт 9 (1,46 г, 56%).
1H ЯМР (300 МГц, CDCl3) 0,88 (д, J=6,6 Гц, 6Н), 1,60 (м, 1Н), 2,97 (д, J=4,5 Гц, 3Н), 3,24 (м, 2Н), 4,73 (с, 5Н), 5,54 (кв, 1Н), 6,92 (т, 1Н), 7,17-7,78 (м, 14Н); HRMS (EI) набл. 483,2455 (М+), расч. 483,2451 (М+) (C33H33N5S1)
Стадия II

Соединение 9 (416 мг, 0,86 ммоль, 1,0 экв.) растворяли в THF (30 мл) и добавляли 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорид (EDC) (249 мг, 1,3 ммоль, 1,5 экв.). Реакционный раствор перемешивали при комнатной температуре в течение двух суток. Смесь концентрировали и остаток распределяли между этилацетатом и водой. Органический слой промывали насыщенным раствором хлорида натрия, сушили и концентрировали. Неочищенный остаток подвергали хроматографии на колонке с силикагелем. Колонку элюировали смесью 10:1 (по объему) гексана и этилацетата. Концентрирование объединенных фракций позволяло получить продукт в виде белого твердого вещества (320 мг, 83%).
т.пл. 178,5-179,4°С; 1H ЯМР (300 МГц, CDCl2) 1,04 (д, J=6,6 Гц, 6Н), 2,39 (м, 1Н), 2,99 (д, J=4,8 Гц, 3Н), 3,83 (кв, J=5,1 Гц, 1Н), 3,98 (д, J=7,5 Гц, 2Н), 5,40 (с, 4Н), 7,18-7,82 (м, 14Н); 13С ЯМР (300 МГц, CDCl3) 20,7, 29,7, 31,2, 50,9, 52,2, 115,4, 119,0, 121,7, 126,1, 126,5, 127,1, 128,3, 128,8, 128,9, 133,9, 140,8, 144,5, 150,8, 152,8; HRMS (EI) набл. 449,2575 (М+), расч. 449,2574 (М+) (C29Н31N5)
Стадия III

К раствору 10 (135 мг, 0,3 ммоль, 1,0 экв.) в THF (30 мл) добавляли 60% гидрид натрия (36 мг, 0,9 ммоль, 3,0 экв.) с последующим добавлением алкилйодида (0,45 ммоль, 1,5 экв.). Смесь перемешивали при комнатной температуре (или нагревали с обратным холодильником в течение 8 часов в случае 11е). Смесь концентрировали и остаток распределяли между этилацетатом и водой. Органический слой промывали насыщенным солевым раствором и сушили сульфатом натрия. Концентрирование позволяло получить масляный остаток, который подвергали хроматографии на колонке с силикагелем. Концентрирование объединенных фракций позволяло получить продукт в виде масла.
11а
1H ЯМР (300 МГц, СDСl3) 0,79 (д, J=6,6 Гц, 6Н), 2,28 (м, 1Н), 2,80 (с, 6Н), 4,19 (д, J=7,5 Гц, 2Н), 5,38 (с, 4Н), 7,21-7,85 (м, 14Н); 13С ЯМР (300 МГц, СDCl3) 20,1, 28,9, 43,8, 50,9, 53,6, 115,9, 120,0, 121,8, 126,7, 127,1, 128,2, 128,7, 128,9, 140,7, 145,0; HRMS (EI) набл. 463,2726 (М+), расч. 463,2730 (М+) (С30Н33N5)
11b
1H ЯМР (300 МГц, CDCl3) 0,80 (д, J=6,6 Гц, 6Н), 1,08 (т, J=7,2 Гц, 3Н), 2,28 (м, 1Н), 2,76 (с, 3Н), 3,10 (кв, J=7,2 Гц, 2Н), 4,18 (д, J=7,5 Гц, 2Н), 5,38 (с, 4Н), 7,20-7,85 (м, 14Н); 13С ЯМР (300 МГц, CDCl3) 13,1, 20,2, 29,0, 41,0, 50,5, 51,0, 53,4, 115,9, 120,0, 121,7, 126,7, 127,1, 128,2, 128,8, 128,9, 134,4, 140,7, 145,0, 151,2, 157,1; HRMS (EI) набл. 477,2882 (М+), расч. 477,2887 (М+) (С31H35N5)
11с
1H ЯМР (300 МГц, CDCl3) 0,80 (д, J=6,6 Гц, 6Н), 0,85 (т, J=7,2 Гц, 3Н), 1,23 (м, 4Н), 1,49 (м, 2Н), 2,28 (м, 1Н), 2,77 (с, 3Н), 3,02 (т, J=7,5 Гц, 2Н), 4,17 (д, J=7,5 Гц, 2Н), 5,38 (с, 4Н), 7,20-7,82 (м, 14Н); 13С ЯМР (300 МГц, СDСl3) 14,6, 20,2, 23,1, 27,5, 28,9, 29,9, 41,5, 51,0, 53,4, 56,2, 116,0, 120,0, 121,7, 126,7, 127,1, 128,2, 128,7, 128,9, 134,4, 140,7, 145,0, 151,1, 157,5; HRMS (EI) набл. 519,3353 (М+), расч. 519,3356 (М+) (С34Н41N5)
11d
1H ЯМР (300 МГц, СDСl3) 0,80 (д, J=6,6 Гц, 6Н), 2,25 (м, 1Н), 2,76 (с, 3Н), 3,64 (д, J=6,0 Гц, 2Н), 4,18 (д, J=7,2 Гц, 2Н), 5,15 (дд, J=10,2, 1,5 Гц, 1Н), 5,25 (дд, J=17,1, 1,5 Гц, 1Н), 5,38 (с, 4Н), 5,83 (м, 1Н), 7,21-7,82 (м, 14Н); 13С ЯМР (300 МГц, СDСl3) 20,2, 29,1, 40,7, 51,0, 53,4, 59,0, 116,0, 118,4, 120,0, 121,8, 126,7, 126,8, 127,2, 128,3, 128,8, 128,9, 134,5, 134,7, 140,7, 145,1, 151,2, 157,2; HRMS (EI) набл. 489,2886 (М+), расч. 489,2887 (М+) (C32Н35N5)
11е
1H ЯМР (300 МГц, CDCl3) 0,81 (д, J=6,6 Гц, 6Н), 2,27 (м, 1Н), 2,86 (с, 3Н), 3,23 (с, 3Н), 3,28 (т, J=5,4 Гц, 2Н), 3,41 (т, J=5,4 Гц, 2Н), 4,26 (д, J=7,2 Гц, 2Н), 5,40 (с, 4Н), 7,20-7,88 (м, 14Н); 13С ЯМР (300 МГц, CDCl3) 20,1, 28,9, 42,6, 51,2, 53,3, 55,5, 59,3, 70,6, 115,9, 120,1, 121,9, 126,5, 126,9, 127,2, 128,1, 128,8, 140,6, 145,0, 151,0, 157,0; HRMS (EI) набл. 507,3000 (М+), расч. 507,2993 (М+) (С32Н37N5O1)
Стадия IV
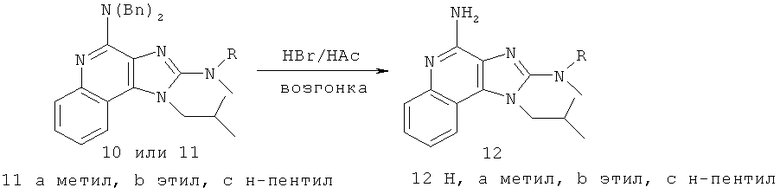
Раствор 10 или 11 (0,20 ммоль, 1,0 экв.) в растворе бромоводорода (10 мл, 47% в воде) и уксусной кислоты (10 мл) нагревали с обратным холодильником в течение ночи (или 2 суток в случае 12а). Реакционный раствор разбавляли CH2Cl2 (100 мл) и значение рН доводили до 7 1М раствором NaOH и насыщенным раствором NаНСО3. Органический слой отделяли, сушили и концентрировали. Неочищенный продукт очищали по методу хроматографии с помощью 5% метанола в дихлорметане.
12
разлагается при 188,6°С; 1H ЯМР (300 МГц, CDCl3) 1,01 (д, J=6,6 Гц, 6Н), 2,28 (м, 1Н), 3,13 (д, J=4,8 Гц, 3Н), 3,97 (д, J=7,5 Гц, 2Н), 4,51 (кв, J=3,9 Гц, 1Н); 6,70 (с, 2Н), 7,25-7,86 (м, 4Н); HRMS (EI) набл. 269,1637 (M+), расч. 269,1635 (М+) (C15H19N5)
12а
разлагается при 154,6°С; 1H ЯМР (300 МГц, СDCl3) 0,82 (д, J=6,6 Гц, 6Н), 2,18 (м, 1Н), 2,93 (с, 6Н), 4,19 (д, J=7,5 Гц, 2Н), 7,28-7,94 (м, 4Н); 13С ЯМР (300 МГц, CDCl3) 20,0, 24,5, 29,2, 43,6, 53,9, 114,1, 120,8, 121,7, 124,4, 124,8, 128,8, 134,2, 137,2, 150,7, 160,7; HRMS (EI) набл. 283,1791 (М+), расч. 283,1791 (М+) (C16H21N5)
12b
т.пл. 183,6-186,8°С; 1H ЯМР (300 МГц, СDCl3) 0,83 (д, J=6,6 Гц, 6Н), 1,22 (т, J=7,2 Гц, 3Н), 2,26 (м, 1Н), 2,89 (с, 3Н), 3,22 (кв, J=7,2 Гц, 2Н), 4,18 (д, J=7,2 Гц, 2Н), 5,62 (с, 2Н), 7,29-7,85 (м, 4Н); 13С ЯМР (300 МГц, CDCl3) 13,3, 20,2, 29,2, 40,6, 50,6, 53,6, 116,1, 120,5, 122,9, 127,0, 127,3, 133,2, 143,8, 151,1, 159,1; HRMS (EI) набл. 297,1945 (М+), расч. 297,1948 (M+) (C17H23N5)
12с
т.пл. 97,6-103,0°С; 1H ЯМР (300 МГц, СDCl3) 0,80 (д, J=6,6 Гц, 6Н), 0,90 (т, J=6,9 Гц, 3Н), 1,32 (м, 4Н), 1,61 (м, 2Н), 2,24 (м, 1Н), 2,87 (с, 3Н), 3,13 (т, J=7,5 Гц, 2Н), 4,16 (д, J=7,2 Гц, 2Н), 5,64 (с, 2Н), 7,25-7,83 (м, 4Н); 13С ЯМР (300 МГц, CDCl3) 14,6, 20,2, 23,1, 27,6, 29,1, 29,8, 41,0, 53,5, 56,3, 116,1, 120,5, 122,8, 125,8, 127,0, 127,2, 133,1, 143,9, 151,1, 159,5; HRMS (EI) набл. 339,2417 (М+), расч. 339,2417 (M+) (C20H29N5)
Стадия V
Раствор 11d (108 мг, 0,22 ммоль, 1,0 экв.) в растворе бромоводорода (10 мл, 47% в воде) нагревали с обратным холодильником в течение 0,5 часа. Реакционный раствор разбавляли СН2Сl2 (100 мл) и значение рН доводили до 7 1М раствором NaOH и насыщенным раствором NаНСО3. Органический слой отделяли, сушили и концентрировали. Очистка по методу хроматографии (последовательно 2,5%, 5% и 20% метанола в дихлорметане) позволяла получить продукты 13 (5%), 12d (44%) и 12 (17%), соответственно.
13
1H ЯМР (300 МГц, СDCl3) 0,82 (д, J=6,6 Гц, 6Н), 2,62 (м, 1Н), 2,84 (с, 3Н), 3,71 (д, J=6,0 Гц, 2Н), 4,15 (д, J=7,5 Гц, 2Н), 4,95 (д, J=5,7 Гц, 2Н), 5,25 (дд, J=10,2, 1,2 Гц, 1Н), 5,38 (дд, J=17,1, 1,5 Гц, 1Н), 5,94 (м, 1Н), 6,99-7,87 (м, 9Н); HRMS (EI) набл. 399,2419 (М+), расч. 399,2417 (M+) (C25H29N5)
12d
1H ЯМР (300 МГц, СDCl3) 0,83 (д, J=6,6 Гц, 6Н), 2,24 (м, 1Н), 2,89 (с, 3Н), 3,76 (д, J=6,0 Гц, 2Н), 4,18 (д, J=7,5 Гц, 2Н), 5,28 (дд, J=10,2, 1,5 Гц, 1Н), 5,38 (дд, J=17,1, 1,5 Гц, 1Н), 5,95 (м, 1Н), 7,30-7,85 (м, 4Н); HRMS (EI) набл. 309,1946 (М+), расч. 309,1948 (М+) (C18H23N5)
Стадия VI
Раствор 11е (508 мг, 1 ммоль, 1,0 экв.) в растворе бромоводорода (15 мл, 47% в воде) и уксусной кислоты (15 мл) нагревали с обратным холодильником в течение 10 часов. Реакционный раствор разбавляли CH2Cl2 (100 мл) и значение рН доводили до 7 1М раствором NaOH и насыщенным раствором NаНСО3. Органический слой отделяли, сушили и концентрировали. Неочищенный продукт очищали по методу хроматографии (последовательно 4% и 8% метанола в CH2Cl2) с получением продуктов 12f (8%) и 14 (12%), соответственно.
12f
1H ЯМР (300 МГц, CDCl3) 0,83 (д, J=6,3 Гц, 6Н), 2,22 (м, 1Н), 3,01 (с, 3Н), 3,47 (т, J=4,8 Гц, 2Н), 3,94 (т, J=4,8 Гц, 2Н), 4,24 (д, J=7,5 Гц, 2Н), 6,54 (с, 2Н), 7,27-7,85 (м, 4Н); HRMS (EI) набл. 313,1893 (М+), расч. 313,1897 (М+) (C17H23N5O1)
14
1H ЯМР (300 МГц, CDCl3) 0,83 (д, J=6,6 Гц, 6Н), 2,02 (с, 3Н), 2,29 (м, 1Н), 2,96 (с, 3Н), 3,59 (т, J=5,7 Гц, 2Н), 4,22 (д, J=7,5 Гц, 2Н), 4,33 (т, J=5,7 Гц, 2Н), 5,43 (с, 2Н), 7,31-7,85 (м, 4Н); HRMS (EI) набл. 355,2006 (М+), расч. 355,2003 (М+) (C19H25N5O2)
Стадия 5
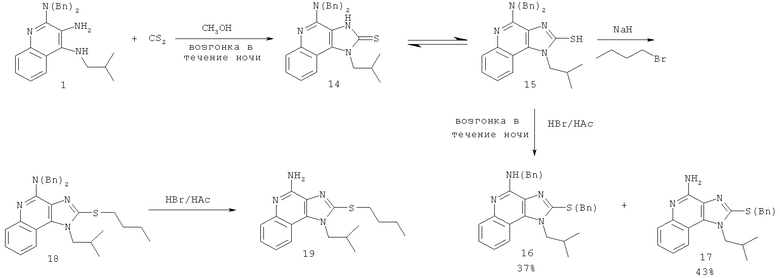
Стадия I
Соединение 1 (205 мг, 0,5 ммоль, 1,0 экв.) растворяли в сухом метаноле (20 мл) с последующим добавлением дисульфида углерода (0,03 мл, 0,5 ммоль, 1,0 экв.). После нагревания с обратным холодильником в течение ночи раствор концентрировали и остаток вносили в уксусную кислоту (10 мл) и бромоводород (10 мл, 47% в воде). Реакционный раствор затем нагревали с обратным холодильником в течение ночи. Смесь разбавляли CH2Cl2 (100 мл) и значение рН доводили до 7 1М раствором NaOH и насыщенным раствором NаНСО3. Органический слой отделяли, сушили и концентрировали. Неочищенный продукт очищали по методу хроматографии с помощью последовательной элюции 2,5% и 5% метанола в дихлорметане с получением продуктов 16 (37%) и 17 (43%), соответственно.
16
1H ЯМР (300 МГц, СDCl3) 0,93 (д, J=6,6 Гц, 6Н), 2,27 (м, 1Н), 4,12 (д, J=7,5 Гц, 2Н), 4,48 (с, 2Н), 4,97 (д, J=5,7 Гц, 2Н), 6,07 (т, J=5,4 Гц, 1Н), 7,23-7,82 (м, 14Н); 13С ЯМР (300 МГц, СDCl3) 20,4, 29,8, 39,2, 45,4, 53,8, 115,7, 120,3, 122,4, 127,5, 127,8, 128,3, 128,4, 128,8, 129,0, 129,2, 129,3, 129,6, 134,4, 137,4, 140,4, 145,8, 149,5, 150,5; MS (EI) 452 (M+).
17
1H ЯМР (300 МГц, CDCl3) 0,94 (д, J=6,9 Гц, 6Н), 2,30 (м, 1Н), 4,14 (д, J=7,8 Гц, 2Н), 4,54 (с, 2Н), 5,69 (с, 2Н), 7,26-7,85 (м, 9Н); 13С ЯМР (300 МГц, СDCl3) 20,4, 29,7, 39,0, 53,8, 115,7, 120,4, 122,9, 127,6, 127,7, 128,3, 128,6, 129,3, 129,6, 135,1, 137,3, 145,0, 150,2, 151,2; MS (EI) 362 (M+).
Стадия II
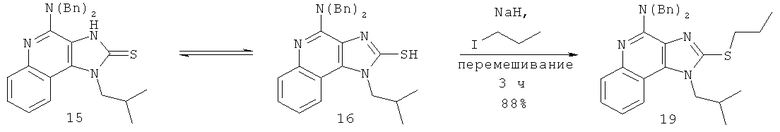
Альтернативно, соединение 1 (205 мг, 0,5 ммоль, 1,0 экв.) растворяли в сухом метаноле (20 мл) с последующим добавлением дисульфида углерода (0,03 мл, 0,5 ммоль, 1,0 экв.). После нагревания с обратным холодильником в течение ночи раствор концентрировали и затем вносили в CH2Cl2. Смесь промывали водой, насыщенным раствором NaHCO3 и сушили над сульфатом натрия. К раствору 15 (16) (226,3 мг, 0,5 ммоль, 1,0 экв.) в THF (20 мл) добавляли 60% гидрид натрия (100 мг, 2,5 ммоль, 5,0 экв.) с последующим добавлением йодпропана (0,098 мл, 1,0 ммоль, 2,0 экв.). Смесь перемешивали в атмосфере N2 при комнатной температуре в течение 3 часов. Раствор концентрировали и остаток распределяли между этилацетатом и водой. Органический слой промывали насыщенным солевым раствором и сушили. Концентрирование позволяло получить масляный остаток, который подвергали хроматографии на колонке с силикагелем. Колонку элюировали смесью 20:1 (по объему) гексана и этилацетата. Концентрирование объединенных фракций позволяло получить продукт в виде твердого вещества (224 мг, 88%).
19
1H ЯМР (300 МГц, СDCl3) 0,89 (т, J=7,2 Гц, 3Н), 1,10 (д, J=6,6 Гц, 6Н), 1,67 (м, 2Н), 2,50 (м, 1Н), 3,13 (т, J=7,2 Гц, 2Н), 4,30 (д, J=7,5 Гц, 2Н), 5,51 (с, 4Н), 7,28-7,97 (м, 14Н); 13С ЯМР (300 МГц, CDCl3) 13,9, 20,6, 23,6, 29,8, 35,8, 51,3, 53,9, 115,4, 120,0, 122,0, 127,3, 127,4, 128,5, 128,7, 128,9, 129,3, 136,8, 140,6, 145,3, 149,4, 150,8; HRMS (EI) набл. 494,2501 (М+), расч. (М+) 494,2499 (C31H34N4S1)
Стадия III
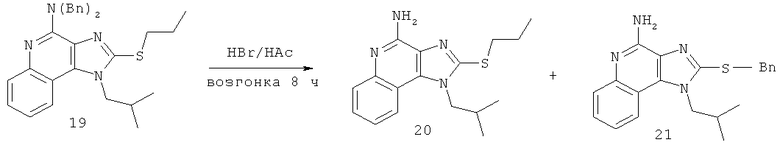
Раствор 19 (1 экв.) в растворе бромоводорода (10 мл, 47% в воде) и уксусной кислоте (10 мл) нагревали с обратным холодильником в течение 8 часов. Реакционный раствор разбавляли СH2Сl2 (100 мл) и значение рН доводили до 7 1М раствором NaOH и насыщенным раствором NаНСО3. Органический слой отделяли, сушили и концентрировали. Неочищенный продукт очищали по методу хроматографии с помощью последовательной элюции 5% метанола в дихлорметане с получением продуктов 20 и 21 в виде смеси, мольное отношение которой по данным 1H-ЯМР составляло 2,0:2,8.
20
1H ЯМР (300 МГц, CDCl3) 1,00 (д, J=6,6 Гц, 6Н), 1,05 (т, J=7,5 Гц, 3Н), 1,80 (м, 2Н), 2,27 (м, 1Н), 3,32 (т, J=7,5 Гц, 2Н), 4,25 (д, J=7,5 Гц, 2Н), 5,65 (с, 2Н), 7,24-7,84 (м, 4Н); HRMS (EI) набл. 314,1556 (М+), расч. 314,1560 (М+) (C17H22N4S1)
21
1Н ЯМР (300 МГц, CDCl3) 0,93 (д, J=6,6 Гц, 6Н), 2,28 (м, 1Н),4,13 (д, J=7,8 Гц, 2Н), 4,53 (с, 2Н), 5,71 (с, 2Н), 7,24-7,84 (м, 9Н)
Схема 6
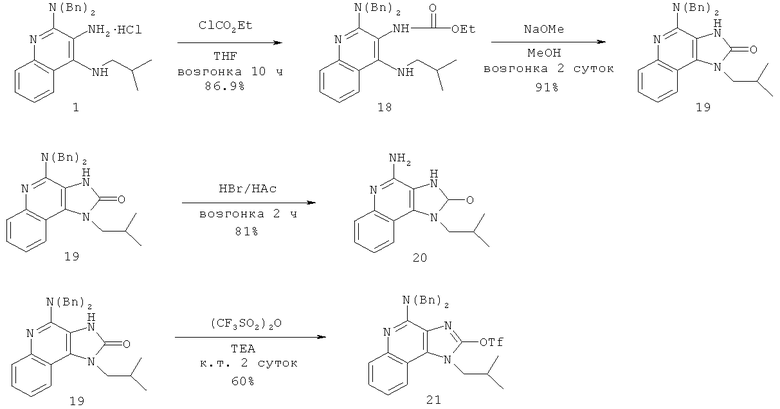
Стадия I

К раствору 1 (134 мг, 0,3 ммоль, 1,0 экв.) в THF (20 мл) добавляли этилхлорформиат (0,15 мл, 1,4 ммоль, 5,0 экв.). Смесь нагревали с обратным холодильником в атмосфере N2 в течение 10 часов. Раствор концентрировали и остаток распределяли между дихлорметаном и водой. Органический слой сушили и концентрировали. Неочищенный остаток подвергали хроматографии на колонке с силикагелем. Колонку элюировали смесью 8:1 (по объему) гексана и этилацетата. Концентрирование объединенных фракций позволяло получить продукт 18 в виде твердого вещества (0,126 г, 86,9%).
18
т.пл. 99,7-101,2°С; 1H ЯМР (300 МГц, CDCl3) 0,91 (д, J=6,6 Гц, 6Н), 1,15 (т, J=7,2 Гц, 3Н), 1,74 (м, 1Н), 3,24 (м, 2Н), 4,10 (кв, J=7,2 Гц, 2Н), 4,41 (с, 4Н), 4,71 (с, 1Н), 6,47 (1Н), 7,20-7,94 (м, 14Н); HRMS (EI) набл. 482,2679 (М+), расч. 482,2676 (М+) (С30Н34N4O2)
Стадия II
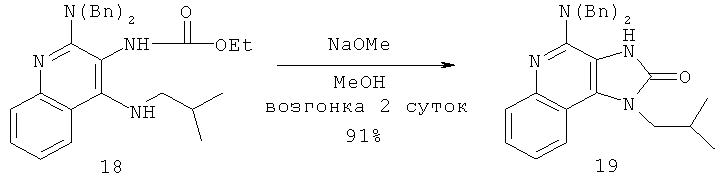
К раствору 18 (483 мг, 1,0 ммоль, 1,0 экв.) в сухом метаноле (50 мл) добавляли NaOMe (108 мг, 2,0 ммоль, 2,0 экв.). Смесь нагревали с обратным холодильником в атмосфере N2 в течение 2 суток. Раствор концентрировали и остаток распределяли между дихлорметаном и водой. Органический слой сушили и концентрировали. Остаток наносили в сухом виде на силикагель (1 г) и затем подвергали хроматографии на колонке с силикагелем. Колонку элюировали смесью 5:1 (по объему) гексана и этилацетата. Концентрирование объединенных фракций позволяло получить продукт в виде белого твердого вещества (396 мг, 91%).
19
т.пл. 210,1-211,9°С; 1H ЯМР (300 МГц, CDCl3) 1,01 (д, J=6,6 Гц, 6Н), 2,28 (м, 1Н), 4,05 (д, J=7,5 Гц, 2Н), 4,86 (с, 4Н), 7,25-7,86 (м, 14Н), 7,89 (с, 1Н); 13С ЯМР (300 МГц, CDCl3) 19,8, 28,8, 49,5, 51,6, 111,3, 113,6, 119,8, 123,0, 126,8, 127,1 128,0, 128,4, 130,8, 138,2, 143,9, 146,5, 155,3; HRMS (EI) набл. 436,2258 (M+), расч. 436,2258 (M+) (C28H28N4O1)
Стадия III
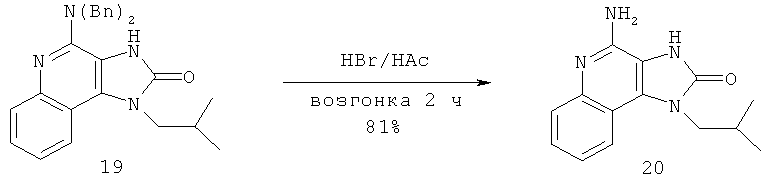
Раствор 19 (87,3 мг, 0,2 ммоль, 1,0 экв.) в растворе бромоводорода (10 мл, 47% в воде) и уксусной кислоты (10 мл) нагревали с обратным холодильником в течение 2 часов. Реакционный раствор разбавляли СН2Сl2 (100 мл) и значение рН доводили до 7 1М раствором NaOH и насыщенным раствором NаНСО3. Органический слой отделяли, сушили и концентрировали. Неочищенный продукт очищали по методу хроматографии с помощью 10% метанола в дихлорметане. Выход: 81%
20
1H ЯMP (300 MГц, MeOD) 1,00 (д, J=6,6 Гц, 6Н), 2,22 (м, 1Н), 4,11 (д, J=7,5 Гц, 2Н), 7,31-7,98 (м, 4Н); MS (EI) 256.
Стадия IV
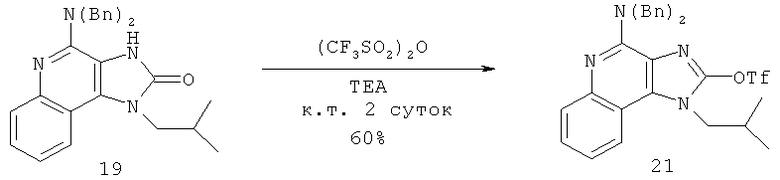
К раствору 19 (1,757 г, 4,0 ммоль, 1,0 экв.) в сухом дихлорметане (50 мл) последовательно добавляли триэтиламин (0,67 мл, 4,8 ммоль, 1,2 экв.) и трифторметансульфоновый ангидрид (0,81 мл, 4,8 ммоль, 1,2 экв.). Смесь перемешивали в атмосфере N2 в течение 2 суток. Раствор распределяли между CH2Cl2 и водой. Органический слой сушили и концентрировали. Остаток подвергали хроматографии на колонке с силикагелем. Колонку элюировали 5% этилацетатом в гексане. Концентрирование объединенных фракций позволяло получить продукт в виде белого твердого вещества (1,36 г, 60%).
21
т.пл. 108,2-109,6°С; 1H ЯМР (300 МГц, CDCl3) 1,06 (д, J=6,6 Гц, 6Н), 2,40 (м, 1Н), 4,25 (д, J=7,5 Гц, 2Н), 5,29 (с, 4Н), 7,21-7,84 (м, 14Н); 13С ЯМР (300 МГц, CDCl3) 20,4, 29,5, 51,2, 53,3, 114,5, 119,9, 122,7, 123,9, 127,5, 128,6, 128,7, 128,8, 129,0, 134,5, 139,9, 143,4, 146,1, 150,9; 19F ЯМР (400 МГц, CDCl3) - 13,42; HRMS (EI) набл. 568,1756 (М+), расч. 568,1750 (М+) (С29Н27F3N4O3S1); анал. расч. для С29Н27F3N4O3S1: С, 61,26; Н, 4,79; N, 9,85; экспер. получ.: С, 61,36; Н, 4,78, N: 9,85.
Специалисту в данной области техники очевидно, что соединение 21 является весьма полезным промежуточным соединением, которое может быть легко функционализировано путем замены трифлата множеством заместителей, включая, помимо прочего, замещенные аминогруппы, тиогруппы, карбонильные группы, оксогруппы и алкоксигруппы и алкенильные и алкинильные фрагменты.
Схема 7
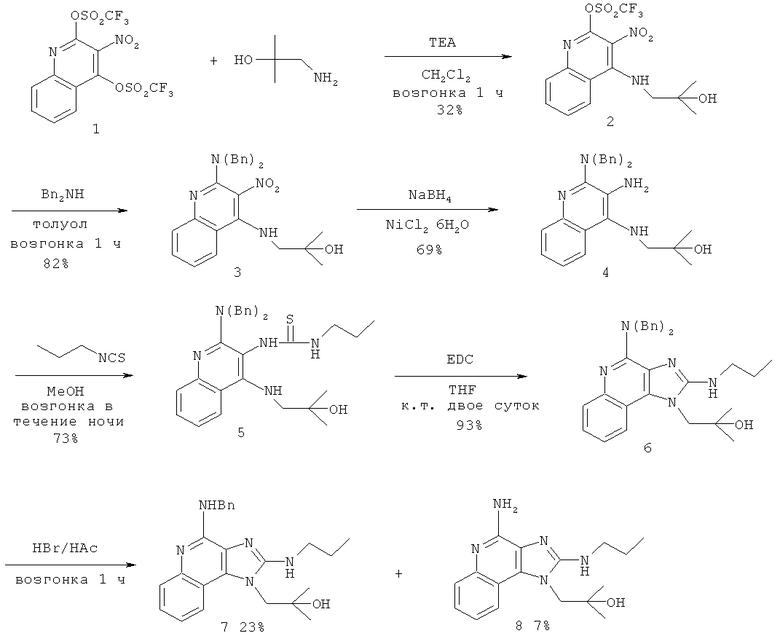
Стадия I
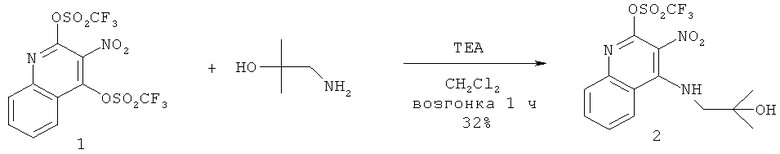
К раствору 1 (470 мг, 1 ммоль, 1,0 экв.) в сухом CH2Cl2 (30 мл) добавляли триэтиламин (0,14 мл, 1 ммоль, 1,0 экв.) с последующим добавлением 1-амино-2-метил-2-пропанола (89 мг, 1 ммоль, 1,0 экв.). Смесь нагревали с обратным холодильником в течение 1 часа в атмосфере N2. Реакционный раствор распределяли между дихлорметаном и водой. Органический слой сушили и концентрировали с получением масляного остатка, который подвергали хроматографии на колонке с силикагелем. Колонку элюировали смесью 5:4 (по объему) гексана и этилацетата. Концентрирование желтых фракций позволяло получить продукт в виде твердого вещества (132 мг, 32%).
2
т.пл. 139,6-139,8 С; 1Н ЯМР (300 МГц, СDCl3) 1,34 (с, 6Н), 3,50 (д, J=5,1 Гц, 2Н), 7,57-8,08 (м, 4Н), 7,89 (с, 1Н); HRMS (EI) набл. 409,0553 (М+), расч. 409,0550 (М+) (C14H14F3N3O6S1)
Стадия II
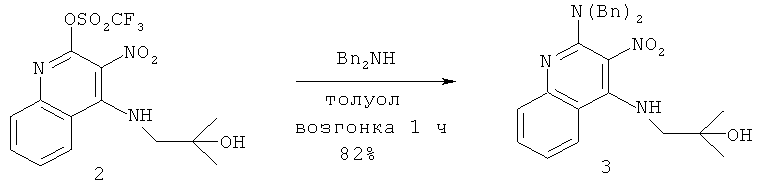
К раствору 2 (8,066 г, 0,020 моль, 1,0 экв.) в сухом толуоле (250 мл) добавляли дибензиламин (5,8 мл, 0,03 моль, 1,5 экв.). Смесь нагревали с обратным холодильником в течение 1 часа в атмосфере N2. Смесь концентрировали и остаток подвергали хроматографии на колонке с силикагелем. Колонку элюировали смесью 5:1 (по объему) гексана и этилацетата. Концентрирование красных фракций позволяло получить продукт в виде твердого вещества (7,4 г, 82%).
3
1H ЯМР (300 МГц, CDCl3) 1,24 (с, 6Н), 3,63 (д, J=5,1 Гц, 2Н), 4,53 (с, 4Н), 7,17-7,97 (м, 15Н); 13С ЯМР (300 МГц, CDCl3) 28,0, 53,2, 60,0, 71,2, 116,9, 122,2, 126,7, 127,7, 128,4, 128,8, 129,0, 129,1, 132,6, 128,1, 149,3, 151,2, 153,3; HRMS (EI) набл. 456,2156 (М+), расч. 456,2156 (М+) (С27Н28N4O3)
Стадия III
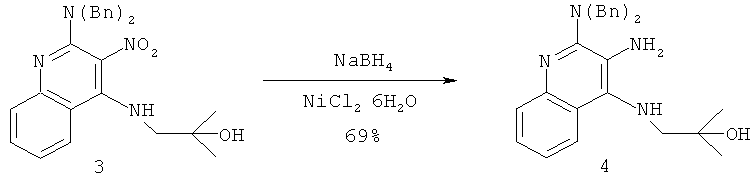
В трехгорлую круглодонную колбу емкостью 100 мл, оборудованную поглотительной трубкой, добавляли метанол (10 мл) и хлорид никеля (89,2 мг, 0,375 ммоль, 0,75 экв.). Затем малыми порциями добавляли NaBH4 (28,4 мг, 0,75 ммоль, 1,5 экв.), поддерживая температуру на уровне 25°С. Раствор перемешивали в течение 30 минут и затем добавляли 3 (228 мг, 0,5 ммоль, 1,0 экв.) в DCM (10 мл) и метаноле (10 мл). Малыми порциями добавляли NaBH4 (75,6 мг, 2,0 ммоль, 4,0 экв.), поддерживая температуру на уровне 35°С. Наблюдали бесцветный раствор с черным осадком. Реакционный раствор фильтровали через целитовый фильтр и фильтрат концентрировали и наносили на колонку с силикагелем и подвергали хроматографии. Колонку элюировали смесью 10:3 (по объему) гексана и этилацетата. Концентрирование фракций позволяло получить продукт в виде масла (146 мг, 69%).
4
1H ЯМР (300 МГц, CDCl3) 1,23 (с, 6Н), 3,05 (с, 2Н), 4,14 (с, 2Н), 4,41 (с, 4Н), 7,10-7,71 (м, 14Н); 13С ЯМР (300 МГц, CDCl3) 28,1, 54,0, 57,5, 71,9, 119,7, 122,9, 124,7, 126,0, 127,2, 127,5, 128,9, 129,1, 135,2, 139,6, 142,3, 153,9; HRMS (EI) набл. 426,2421 (М+), расч. 426,2414 (M+) (C27H30N4O1)
Стадия IV
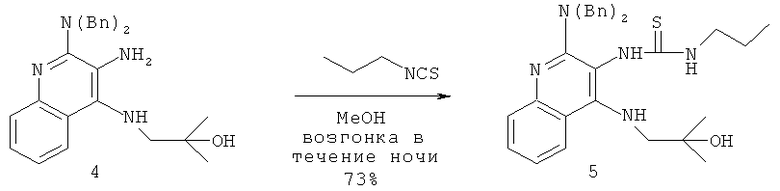
Соединение 4 (146 мг, 0,34 ммоль, 1,0 экв.) растворяли в сухом метаноле (15 мл) и добавляли пропилизотиоцианат (0,042 мл, 0,41 ммоль, 1,2 экв.). После нагревания с обратным холодильником в течение ночи в атмосфере N2 раствор концентрировали и остаток распределяли между CH2Cl2 и водой. Органический слой сушили и концентрировали. Неочищенный остаток подвергали хроматографии на колонке с силикагелем. Колонку элюировали смесью 10:3 (по объему) гексана и этилацетата. Концентрирование объединенных фракций позволяло получить продукт в виде масла (131 мг, 73%).
5
1H ЯМР (300 МГц, CDCl3) 0,67 (т, J=7,5 Гц, 3Н), 1,13 (с, 6Н), 1,27 (м, 2Н), 2,27 (с, 1Н), 3,31 (м, 4Н), 4,58 (с, 4Н), 5,14 (1Н), 5,65 (1Н), 7,07-7,75 (м, 15Н); HRMS (EI) набл. 527,2719 (M+), расч. 527,2713. (M+) (С31H37N5O1S1)
Стадия V
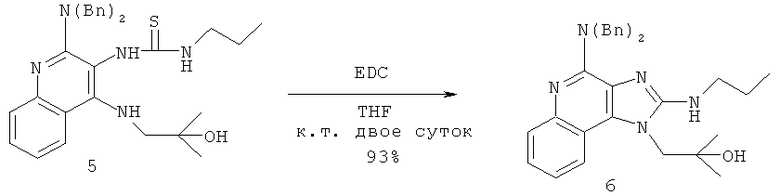
К раствору 5 (131 мг, 0,25 ммоль, 1,0 экв.) в сухом THF (15 мл) добавляли EDC (95 мг, 0,5 ммоль, 2,0 экв.). Реакционный раствор перемешивали в течение двух суток в атмосфере N2. Смесь затем концентрировали и остаток распределяли между CH2Cl2 и водой. Органический слой промывали насыщенным раствором хлорида натрия, сушили и концентрировали. Неочищенный остаток подвергали хроматографии на колонке с силикагелем. Колонку элюировали смесью 5:1 (по объему) гексана и этилацетата. Концентрирование объединенных фракций позволяло получить продукт в виде масла (115 мг, 84%).
6
1H ЯМР (300 МГц, CDCl3) 0,79 (т, J=7,5 Гц, 3Н), 1,31 (с, 6Н), 1,51 (м, 2Н), 1,93 (1Н), 3,16 (м, 2Н), 4,25 (с, 2Н), 5,31 (с, 4Н), 5,83 (1Н), 7,04-7,74 (м, 14Н); 13С ЯМР (300 МГц, CDCl3) 11,5, 22,7, 27,7, 45,1, 50,3, 54,3, 73,8, 114,7, 117,8, 120,7, 125,2, 126,1, 126,4, 127,9, 128,1, 128,2, 133,5, 140,2, 143,8, 150,1, 153,7; HRMS (EI) набл. 493,2832 (M+), расч. 493,2836 (M+) (C31H35N5O1)
Стадия VI
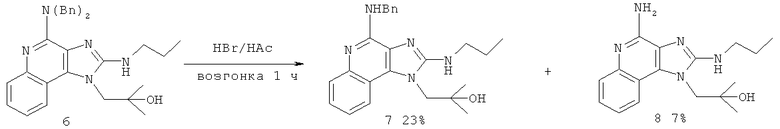
Раствор 6 (115 мг, 0,23 ммоль, 1,0 экв.) в растворе бромоводорода (10 мл, 47% в воде) и уксусной кислоте (10 мл) нагревали с обратным холодильником в течение 1 часа. Реакционный раствор разбавляли СН2Сl2 (100 мл) и значение рН доводили до 7 1М раствором NaOH и насыщенным раствором NаНСО3. Органический слой отделяли, сушили и концентрировали. ТСХ позволяла выделить четыре продукта. Продукты 7 и 8 очищали по методу хроматографии с использованием соответственно 2,5%, 10% метанола в CH2Cl2.
7
1H ЯМР (300 МГц, CDCl3) 0,90 (т, J=7,5 Гц, 3Н), 1,34 (с, 6Н), 1,58 (м, 2Н), 3,28 (м, 2Н), 4,25 (с, 2Н), 4,88 (д, J=5,7 Гц, 2Н), 5,91 (1Н), 5,99 (1Н), 7,11-7,82 (м, 9Н); HRMS (EI) набл. 403,2355 (М+), расч. 403,2367 (М+) (C24H29N5O1)
8
1H ЯМР (300 МГц, CDCl3) 0,94 (т, J=7,5 Гц, 3Н), 1,40 (с, 6Н), 1,65 (м, 2Н), 3,35 (м, 2Н), 4,31 (с, 2Н), 5,42 (с, 2Н), 6,09 (т, 1Н), 7,14-7,78 (м, 4Н); HRMS (EI) набл. 313,1889 (М+), расч. 313,1897 (М+) (C17H23N5O1)
Стадия VII
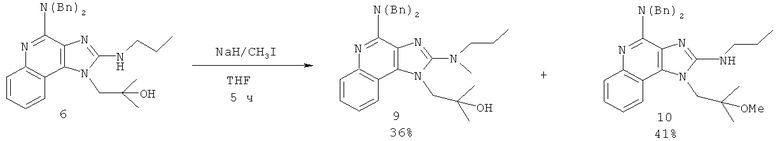
К раствору 6 (2,014 г, 4,1 ммоль, 1,0 экв.) в THF (40 мл) добавляли 60% гидрид натрия (163 мг, 4,1 ммоль, 1,0 экв.) с последующим добавлением йодметана (0,25 мл, 4,1 ммоль, 1,0 экв.). Смесь перемешивали в атмосфере N2 в течение 5 часов. Реакционный раствор концентрировали и остаток распределяли между этилацетатом и водой. Органический слой промывали насыщенным солевым раствором и сушили. Концентрирование позволяло получить масляный остаток, который подвергали хроматографии на колонке с силикагелем. Колонку элюировали смесью 15:1 (по объему) гексана и этилацетата. Концентрирование объединенных фракций позволяло получить продукт 10 в виде твердого вещества (41%) и продукт 9 в виде масла (36%).
9
1H ЯМР (300 МГц, CDCl3) 0,85 (т, J=7,2 Гц, 3Н), 1,20 (с, 6Н), 1,53 (м, 2Н), 2,78 (с, 3Н), 2,98 (т, J=7,8 Гц, 2Н), 4,59 (с, 1Н), 4,66 (с, 2Н), 5,38 (с, 4Н), 7,22-8,04 (м, 14Н); 13С ЯМР (300 МГц, CDCl3) 12,2, 20,8, 28,2, 41,5, 51,2, 56,3, 58,6, 73,1, 115,6, 119,7, 121,8, 126,0, 127,2, 128,6, 128,7, 128,8, 135,0, 140,5, 145,6, 151,1, 156,0; HRMS (EI) набл. 507,2988 (М+), расч. 507,2993 (M+) (C32H37N5O1)
10
1H ЯМР (300 МГц, CDCl3) 0,92 (т, J=7,5 Гц, 3Н), 1,37 (с, 6Н), 1,63 (м, 2Н), 3,26 (с, 3Н), 3,30 (м, 2Н), 4,40 (с, 2Н), 5,41 (с, 4Н), 6,08 (т, J=5,4 Гц, 1Н), 7,18-7,86 (м, 14Н); 13С ЯМР (300 МГц, СDCl3) 11,5, 21,3, 22,7, 44,9, 49,1, 50,3, 55,2, 77,9, 114,8, 117,7, 120,7, 125,1, 126,2, 126,4, 128,1, 128,3, 133,5, 140,3, 143,8, 150,1, 153,9; HRMS (EI) набл. 507,2990 (M+), расч. 507,2993 (M+) (C32H37N5O1)
Стадия VIII
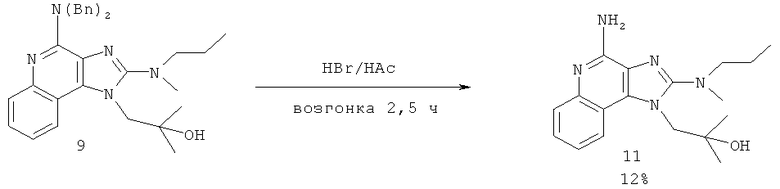
Раствор 9 (203 мг, 0,4 ммоль, 1,0 экв.) в растворе бромоводорода (10 мл, 47% в воде) и уксусной кислоты (10 мл) нагревали с обратным холодильником в течение 2,5 часов. Реакционный раствор разбавляли CH2Cl2 (100 мл) и значение рН доводили до 7 1М раствором NaOH и насыщенным раствором NаНСО3. Органический слой отделяли, сушили и концентрировали. Продукт (11) очищали по методу хроматографии с использованием 4% метанола в дихлорметане.
11
1H ЯМР (300 МГц, СDCl3) 0,96 (т, J=7,5 Гц, 3Н), 1,20 (с, 6Н), 1,67 (м, 2Н), 2,87 (с, 3Н), 3,07 (т, J=7,8 Гц, 2Н), 4,09 (с, 1Н), 4,58 (с, 2Н), 5,92 (с, 2Н), 7,25-8,10 (м, 4Н); HRMS (EI) набл. 327,2054 (М+), расч. 327,2054 (М+) (C18H25N5O1)
Стадия VIIa (альтернативный способ)
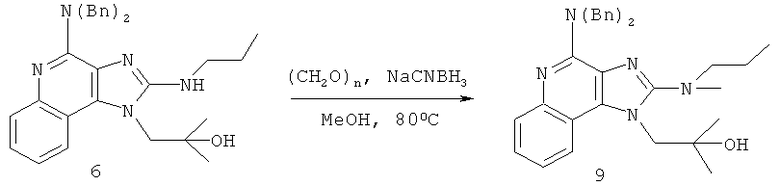
Смесь 6 (1 экв.) и параформальдегида (5 экв.) растворяли в растворе МеОН и АсОН (5:1) на молекулярных ситах. К суспензии добавляли NaСNВН3 (4 экв.) при 25°С. Взвесь затем нагревали до 80°С. Через 10 часов смесь охлаждали, фильтровали и концентрировали. Остаток растворяли в СН2Сl2 и промывали насыщенным раствором NaHCO3. Органический раствор сушили (Na2SO4) и концентрировали с получением 9. Последующее дебензилирование в соответствии со стадией VIII позволяло получить конечный продукт (11).
В следующих схемах описаны способы получения предпочтительных 2-алкенильных или 2-алкинильных производных имидазо[4,5-с]хинолин-4-амина. Специалисту в данной области техники очевидно, что реагенты и/или заместители могут быть изменены или заменены для оптимизации и дополнительной функционализации указанных ниже соединений.
Схема 8
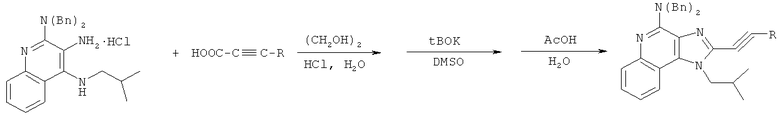
где группа R может представлять собой Н, алкил или арил, предпочтительно, фенил.
Схема 9
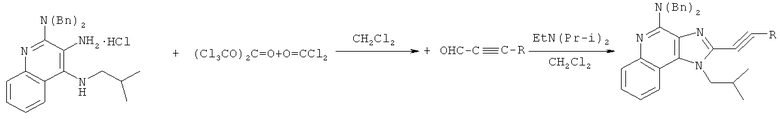
где группа R может представлять собой Н, алкил или арил, предпочтительно, фенил.
Схема 10
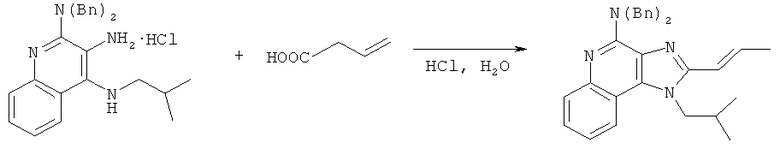
Схема 11
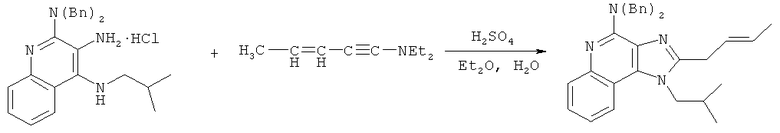
Альтернативно, вместо H2SO4 может быть использована трифторметансульфоновая кислота.
Схема 12
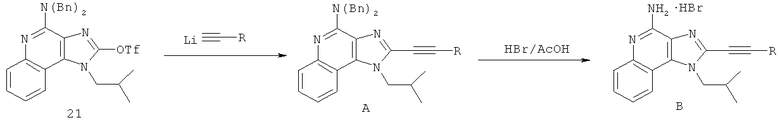
Схема 13
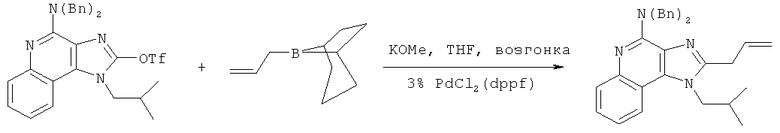
Также предполагается, что замена трифлатного заместителя в реагенте в галоген, такой как бром, и последующее связывание алкенильного или алкинильного фрагмента, содержащего, по меньшей мере, три атома углерода в Et3N, с CuI, Рh3Р и Pd(OAc)2 позволит получить многие продукты, указанные в схемах 8-13.
Если реакция любой из схем 8-13 не протекает до конца, для завершения реакции может быть использовано нагревание.
Последующее дебензилирование продуктов, указанных в схемах 8-13, для получения свободного амина в 4-положении проводят в кипящем MeCN с использованием NaI и TMSCI с получением TMSI in situ. Удаление полученной функциональной группы TMS проводят в THF с Bu4N+F-. Альтернативно, в зависимости от стабильности алкенильного или алкинильного заместителя, связанного в положении 2 N-ТМS-имидазо[4,5-с]хинолин-4-аминовых производных для отщепления полученной группы TMS могут быть использованы К2СО3, лимонная кислота, HF или полистиролсульфоновая кислота в МеОН. Альтернативно, дебензилирование может быть проведено, как описано ранее, в присутствии НВr и уксусной кислоты (как показано в схеме 11).
Схема 14
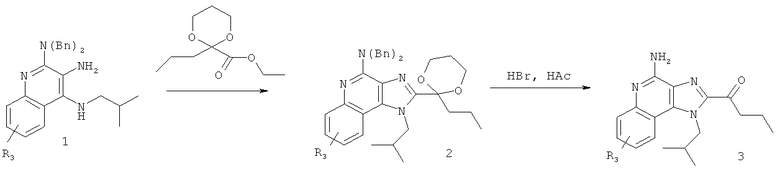
Циклизацию 1 с образованием имидазохинолинового аналога 2 проводили путем добавления кеталя и нагревания в THF. По окончании реакции реакционную смесь конденсировали, промывали водой и экстрагировали добавлением СНСl3. Смесь затем сушили над сульфатом натрия и очищали по методу хроматографии на силикагеле. Затем проводили дебензилирование бромоводородом и уксусной кислотой, как описано ранее (при нагревании), что также приводило к гидролизу кеталя с получением желаемого кетона. Проведение хроматографии на силикагеле позволяло получить продукт (3).
Схема 15
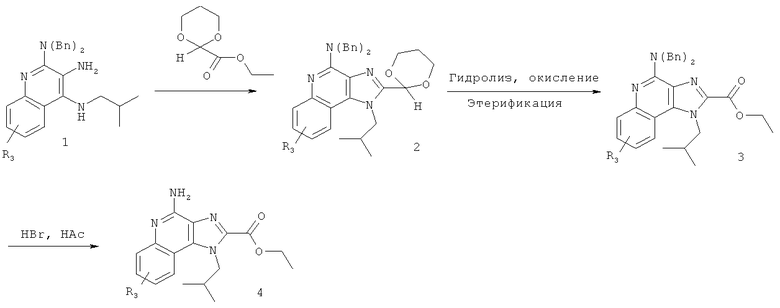
Циклизацию 1 с образованием имидазохинолинового аналога 2 проводили путем добавления ацеталя и нагревания в THF. По окончании реакции реакционную смесь конденсировали, промывали водой и экстрагировали добавлением СНСl3. После гидролиза ацеталя водным НСl проводили окисление Сверна с получением карбоновой кислоты. Наконец, проводили этерификацию в присутствии НСl и спирта, такого как этанол. Затем проводили дебензилирование бромоводородом, как описано ранее, с получением конечного продукта (4). Альтернативно, дебензилирование может быть проведено, как описано в схемах 8-13 выше.
Имидазохинолиновые соединения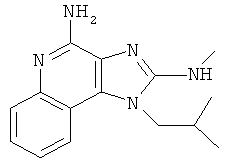
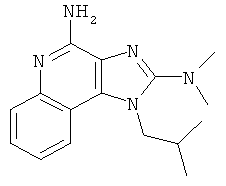
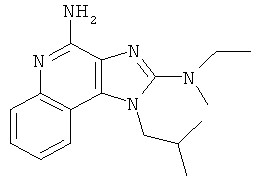
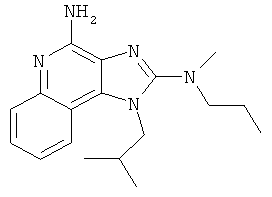
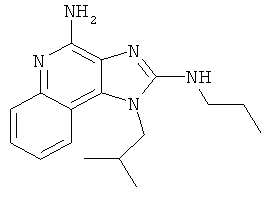
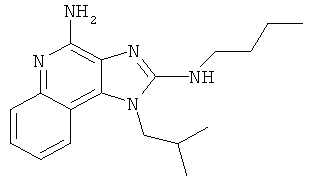
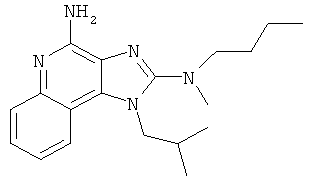
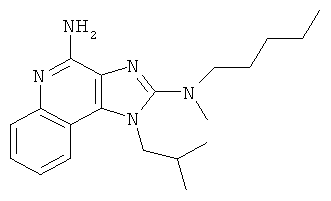
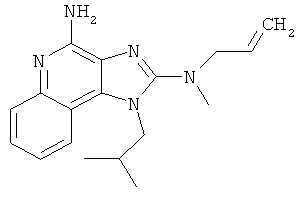
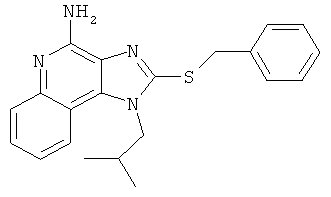
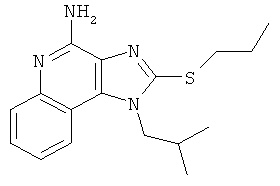
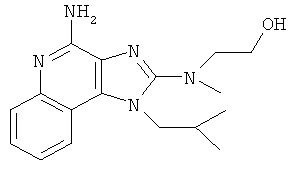
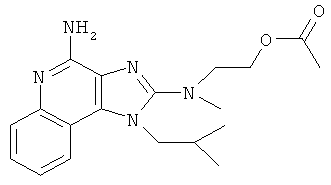
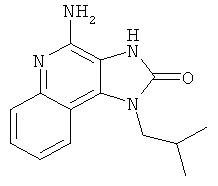
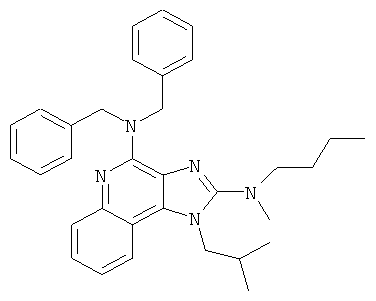
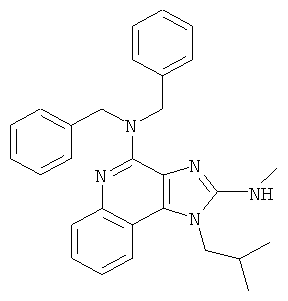
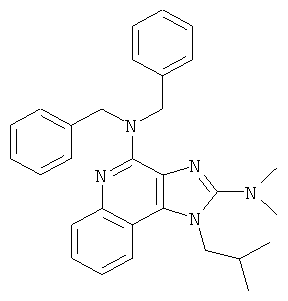
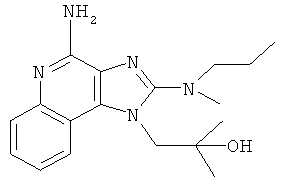
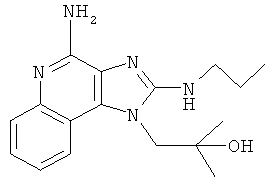
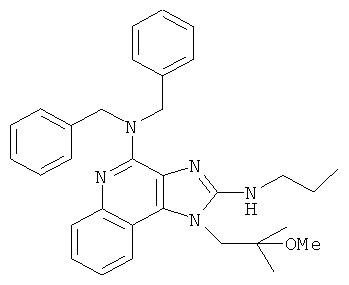
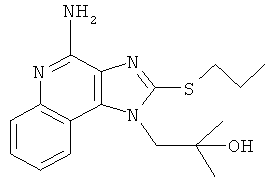
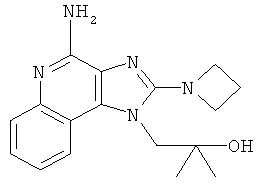
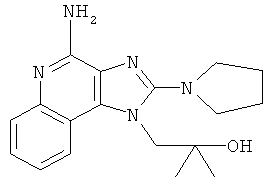
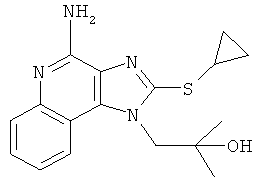
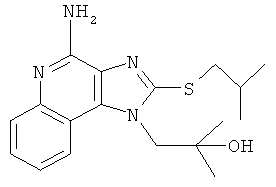
Каждое из указанных в примерах соединений 1-21, приведенных в таблице 1, синтезировали в соответствии с приведенными выше схемами. Многие указанные в примерах соединения подвергали скринингу в соответствии с аналитическим методом, описанным ниже, на предмет их способности индуцировать продукцию цитокинов. Многие их этих соединений проявляли активность в отношении продукции TNF-α в концентрации менее 5 мкМ. Некоторые их этих соединений проявляли активность в отношении продукции TNF-α в концентрации менее 1,5 мкМ. Кроме того, некоторые их этих соединений проявляли активность в отношении продукции TLR-7 и/или TLR-8. По этой причине каждая из групп R любого соединения, указанного в таблице 1, является предпочтительной. Кроме того, благодаря превосходной активности соединений каждое из них является предпочтительным индивидуально и является предпочтительным как член группы, содержащей любое или все остальные соединения, и каждое соединение является предпочтительным для использования в соответствии со способами модулирования иммунного ответа и со способами лечения ассоциированных с ним биологических состояний, например, для использования в качестве вакцинного адъюванта. Каждое из соединений также является предпочтительным для использования в приготовлении лекарственных препаратов для иммунопотенциирования, замедления опухолевого роста, лечения микробных и вирусных инфекций, особенно HCV и HSV, и в лечении опосредуемых ими биологических состояний.
Некоторые указанные в примерах соединения подвергали скринингу в соответствии с аналитическим методом, описанным ниже, и обнаруживали их неэффективность в концентрации 20 мкМ или менее, большинство таких соединений представляли собой защищенные промежуточные продукты конечных соединений. Эти соединения также применимы в соответствии с изобретением, поскольку подразумевается, что изобретение не ограничено соединениями, которые применимы в концентрации 20 мкМ или менее. Соединения могут быть применимы в качестве промежуточных продуктов или в качестве конечных продуктов, вызывающих продукцию TNF-α в более высоких концентрациях, таких как 100 мкМ, 200 мкМ или 300 мкМ, в описанных здесь аналитических методах. Например, Loxoribine вызывает продукцию TNF-α в концентрации 300 мкМ (см. Pope et al. Cellular Immunology 162: 333-339 (1995)).
Биологические анализы
Низкомолекулярные иммунопотенциаторы-кандидаты могут быть идентифицированы in vitro. Соединения подвергали скринингу in vitro на предмет их способности активировать иммунокомпетентные клетки. Одним маркером такой активации является индукция продукции цитокинов, например, продукции TNF-α. Индуцирующие апоптоз малые молекулы могут быть идентифицированы как обладающие этой активностью. Эти низкомолекулярные иммунопотенциаторы потенциально применимы в качестве адъювантов и иммунотерапевтических средств.
В соответствии с методикой анализа (высокопроизводительном скрининге (HTS)) имидазохинолиновых низкомолекулярных иммунопотенциаторов (SMIP) мононуклеарные клетки периферической крови человека (РВМС) в концентрации 500000 на мл в среде RPMI 1640 с 10% FCS наносили на 96-луночные планшеты (100000 на лунку), уже содержащие 5 мкМ соединения в DMSO. РВМС инкубировали в течение 18 часов при 37°С в 5% CO2. Их способность продуцировать цитокины в ответ на низкомолекулярные соединения определяли в соответствии с модифицированным сэндвич-ELISA.
Вкратце, супернатанты культур РВМС анализировали на предмет секретированного TNF с использованием первичного связанного с планшетом антитела для улавливания с последующим добавлением вторичного биотинилированного антитела против TNF с образованием сэндвича. Биотинилированное вторичное антитело затем обнаруживали с помощью меченного европием стрептавидина и количество связанного европия определяли по флуоресценции с разрешением по времени. Имидазохинолиновые соединения подтверждали по их индуцирующей продукцию TNF активности, измерявшейся в соответствии с аналитическим методом как большее число импульсов атомов европия по сравнению с таковым на клетках, инкубированных только в среде RPMI. "Положительные результаты" выбирали по их индуцирующей продукцию TNF активности относительно таковой оптимальной дозы липополисахарида LPS (1 мкг/мл), сильного индуктора продукции TNF. Ошибкоустойчивость анализа и низкий фон позволяли рутинно отбирать результаты, соответствующие ~10% активности LPS, что, как правило, соответствует 5-10-кратным фоновым значениям (полученным на одних клетках). Отобранные положительные результаты затем подвергали процедуре подтверждения их способности индуцировать продукцию цитокинов в образцах от многих доноров при понижающихся концентрациях. Соединения с согласующейся активностью при концентрации 5 мкМ или менее считали подтверждено применимыми для целей этого анализа. Анализ легко модифицировали для скрининга соединений, эффективных при более высоких или более низких концентрациях.
Помимо описанной выше методики, способы измерения продукции других цитокинов (например, IL1-бета, IL-12, IL-6, IFN-гамма, IL-10 и т.д.) хорошо известны из предшествующего уровня техники и могут быть использованы для обнаружения активных имидазохинолиновых соединений согласно настоящему изобретению.
Качественное или количественное измерение иммунного ответа на SMIP или содержащую SMIP композицию согласно предпочтительным вариантам выполнения настоящего изобретения может быть осуществлено в соответствии с методиками, известными из предшествующего уровня техники, такими как измерение продукции антигенспецифичных антител, активации отдельных популяций лимфоцитов, таких как CD4+, CD8+ Т-клетки или NK-клетки, и/или содержания цитокинов, таких как IFN, IL-2, IL-4 или IL-12. Способы измерения специфичных гуморальных ответов включают в себя твердофазный иммуноферментный анализ (ELISA), известный из предшествующего уровня техники. Измерение количества лимфоцитов отдельных типов, таких как CD4+ Т-клетки, может быть проведено, например, с помощью клеточного сортинга с возбуждением флуоресценции (FACS). Анализы цитотоксичности также могут быть проведены в соответствии с методиками, известными из предшествующего уровня техники, например, описанными в Raz et al., (1994) Proc. Natl. Acad. Sci. USA 91:9519-9523. Сывороточные концентрации цитокинов могут быть измерены, например, в соответствии с ELISA. Такие аналитические методы описаны, например, в Selected Methods in Cellular Immunology (1980) Mishell and Shiigi, eds., W.H.Freeman and Co.
Дополнительные биологические методы
I. Приготовление образцов
Получение РВМС человека
Человеческую кровь от одного или множества доноров-людей собирали в СРТ-пробирку BD VacutainerTM с цитратом натрия (BD, Franklin Lakes, NJ) и центрифугировали в течение 20 минут при 1600 g. После центрифугирования мононуклеарные клетки в верхнем слое содержимого пробирок собирали и затем трижды промывали буфером PBS. Промытые клетки затем восстанавливали в требуемой концентрации клеток полной RPMI, содержащей 10% FBS и 100 Ед./мл пенициллина и 100 мкг/ил стрептомицина.
Получение мышиных спленоцитов
Селезенки иссекали из мышей BALB/c и измельчали для отделения спленоцитов из тканей. После того как измельченные образцы обрабатывали солью аммония для разрушения эритроцитов, оставшиеся спленоциты промывали и восстанавливали в требуемой концентрации клеток полной RPMI.
Линия клеток ТНР-1 человека
Линия человеческих миеломоноцитарных трансформированных клеток восприимчива к агонистам TLR8 и слабо восприимчива к агонистам TLR7. Клеточную линию культивировали в среде RPMI, дополненной 10% FBS.
II. Измерение активности
Измерение стимуляции соединениями и содержания множества цитокинов
РВМС человека (hРВМС) (в концентрации 1 миллион клеток на мл) или мышиные спленоциты (в концентрации 5 миллионов клеток на мл) или моноцитарные клетки ТНР-1 человека (в концентрации 1 миллион клеток на мл) смешивали с испытуемыми соединениями, такими как имидазохинолины, в оттитрованных концентрациях соединения в полной среде RPMI. После того как культуры клеток инкубировали в течение 24 часов при 37°С, 5% СО2, культуральный супернатант собирали и анализировали на предмет содержания секретированных цитокинов в присутствии соединений. Для измерения количества следующих цитокинов: TNF-α, IL-6, IL-1β, IL-8 и IL-12p40 использовали наборы для измерения содержания множества цитокинов человека или мыши Beadlyte (Upstate, Lake Placid, NY) в соответствии с инструкциями производителя.
На фиг.2А-С показаны результаты оценки способности миеломоноцитарной клеточной линии ТНР-1 (фиг.2А), РВМС человека (фиг.2В) и мышиных спленоцитов (фиг.2С) продуцировать цитокины в ответ на понижающиеся дозы соединений согласно примерам 4, 20, 19, 13, 10, 12 и 11. Для каждой клеточной популяции анализировали содержание множества цитокинов (например, IL-12, IFN-γ, IL-1β, IL-10, TNF-α и т.д.), и показаны содержания IL-8 человека (А); IL-6 человека (В) и IL-6 мыши (С).
Передача сигнала TLR
Клетки НЕК293 (АТСС, CRL-1573) высевали во флакон Т75 при 3×106 20 мл DMEM, дополненной 0,1 мМ заменимых аминокислот, 1 мМ пирувата натрия, 2 мМ L-глутамина, пенициллином-стрептомицином и 10% FCS. После культивирования в течение ночи клетки трансфицировали 1) репортером pNFkB-TA-люцифераза (0,4 мкг) (BD Clontech, Palo Alto, CA) и 2) pGL4.74 (0,01 мкг), несущей промотор ТК, не восприимчивый к стимуляции NF-kB, и несущей ген люциферазы Renilla, используемый в качестве внутреннего контроля (Promega, WI), и 3) отдельно следующей конструкцией TLR (10 мкг): puno конструкции TLR7 человека (hTLR), hTLR8, TLR7 мыши (mTLR7) (Invivogene, CA), с помощью агента для трансфекции Fugene 6 (Roche). После трансфекции в течение 24 часов трансфицированные клетки собирали и высевали на 96-луночный плоскодонный планшет (1×104 клеток на лунку) и стимулировали испытуемыми соединениями в следующих концентрациях: 30, 10, 3, 1, 0,3, 0,1, 0,03 мкМ. После стимуляции соединениями в течение ночи клетки анализировали на предмет экспрессии люцифераз мухи и Renilla с помощью Dual-Luciferase Reporter Assay System (Promega, WI). Активация NF-kb прямо пропорциональна относительным единицам люциферазы мухи, которые измеряли против внутреннего контроля единиц люциферазы Renilla.
На фиг.1 показаны результаты зависимости TLR7 (фиг.1А) и зависимости TLR8 (фиг.1В), соответствующих SMIP из примеров 19, 4, 20 и 11 при использовании дозы 20 мкМ. Отрицательными контролями служили TLR7- или 8-трансфицированные клетки HEK293-NFkB-люцифepaзa в одной среде, и эти результаты были сходны с таковыми, полученными при использовании нетрансфицированных (TLR7 или 8) экспрессирующих клеток HEK293-NFkB-люцифераза.
Стандартизация продукции цитокинов
Благодаря агонистической природе испытуемых соединений оценка соединений основывалась на силе индукции продукции цитокинов в ходе клеточных скрининговых исследований. Вкратце, значение EC50 каждого соединения для данного цитокина рассчитывали относительно контрольной композиции (т.е. содержащей LPS). Эту оценку затем использовали в аналитическом методе в качестве делителя максимального содержания продуцированного цитокина (пг/мл). На фиг.3 показана оценка уровня активности SMIP на различных клеточных линиях. Для расчета значения EC50 использовали пятипараметрический подбор кривой для кривых зависимости "доза-ответ" содержания цитокинов с использованием различных SMIP для указанных клеточных популяций. Вычисление оценки активности SMIP проводили путем деления значения максимальной концентрации продуцированного цитокина на относительное значение EC50. определенное для каждого указанного соединения. Для расчета для клеток ТНР-1 человека использовали индукцию продукции IL-8, для расчета для РВМС человека - IL-6, а для расчета для мышиных спленоцитов - IL-6.
In Vivo исследования адъювантов
В фосфатно-буферном растворе (PBS) 25 микрограмм антигена gp120dV2EnvSF162 (рекомбинантного белка gp120, полученного из последовательности штамма HIV-1 SF162 - домен V2 делетирован; Pharm Res. 2004 Dec 21(12):2148-52) смешивали с 50 микролитрами адъюванта MF59 с последующим добавлением 0, 1, 5 или 25 микрограмм низкомолекулярного иммунопотенциатора (SMIP) и доводили PBS до 100 микролитров. 50 микролитров раствора были последовательно введены как в левую, так и в правую передние большеберцовые мышцы самок мышей BALB/c (0 сутки) в общем объеме 100 микролитров на мышь. Через четыре недели (28 сутки) 50 микролитров раствора вновь были введены как в левую, так и в правую передние большеберцовые мышцы мышей. Через семь суток после второй иммунизации (34 сутки) собирали образцы сыворотки, а днем позже (35 сутки) селезенки иссекали. Образцы сыворотки анализировали по методу ELISA на предмет содержания Env-специфичного сывороточного IgG2a и ELISA на предмет содержания Env-специфичного сывороточного IgG1. Образцы селезенок анализировали на предмет содержания Env-специфичных продуцирующих цитокины CD4 и CD8 Т-клеток селезенки. Результаты показаны в таблице 2.
На фиг.4 проиллюстрирована in vivo адъювантная активность соединений из примера 19 и примера 11. Мышей BALB/c дважды иммунизировали gp120 HIV в составе MF59 +/- указанные SMIP (25 мкг/мл). В качестве положительного контроля использовали CpG 1826 (25 мкг/мл). Через 2 недели после вторичной иммунизации собирали сыворотку от иммунизированных мышей и определяли среднегеометрические титры (GMT) анти-gp120-специфичных IgG2a (фиг.4А) и IgG1 (фиг.4В) в сыворотке. Кроме того, у иммунизированных мышей также иссекали селезенки и с помощью внутриклеточного окрашивания цитокинов IL-2 и IFN-γ измеряли ех vivo анти-gp120-специфичные Т-клеточные ответы (фиг.4С). Результаты выражали как процент антигенспецифичных Т-клеток, экспрессирующих указанный цитокин.
По настоящей заявке испрашивается приоритет в соответствии с предварительной заявкой на выдачу патента США №60/609,586, поданной 14 сентября 2004 года, и предварительной заявкой на выдачу патента США №60/637,107, поданной 16 декабря 2004 года, описания каждой из которых во всей полноте включены в настоящее описание посредством ссылки.
Содержание всех патентов, заявок на выдачу патента и журнальных статей, процитированных выше, включено сюда посредством ссылки и для любых целей считается полностью изложенным в настоящем описании.
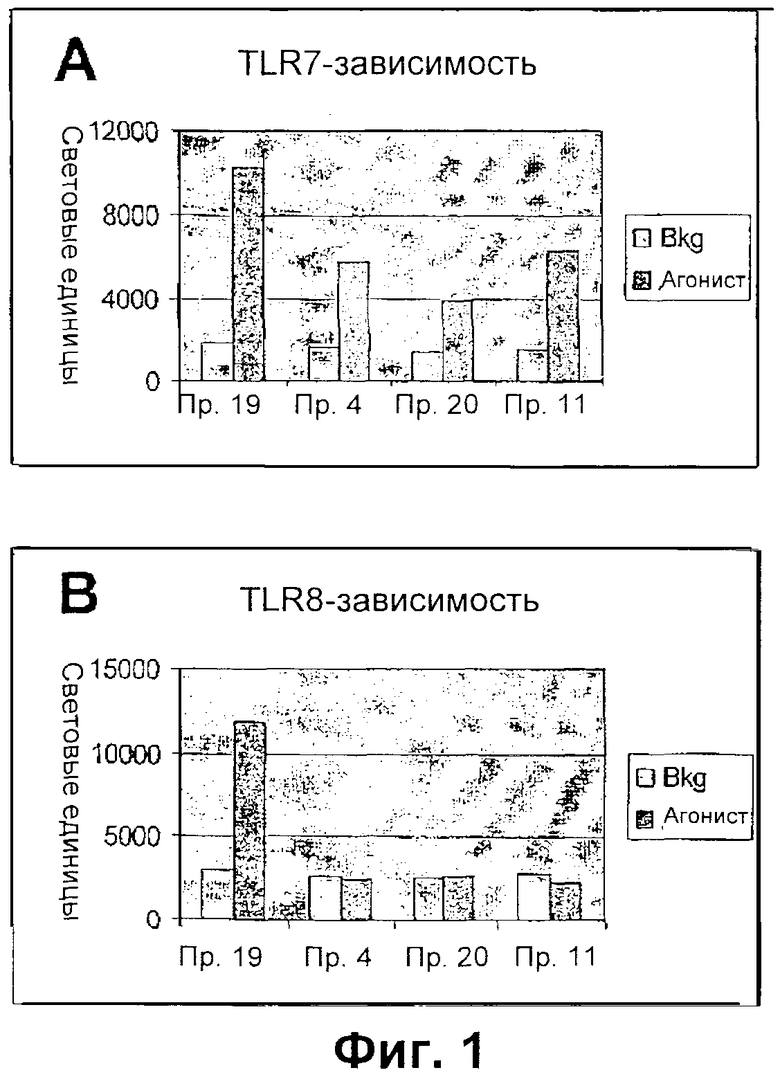
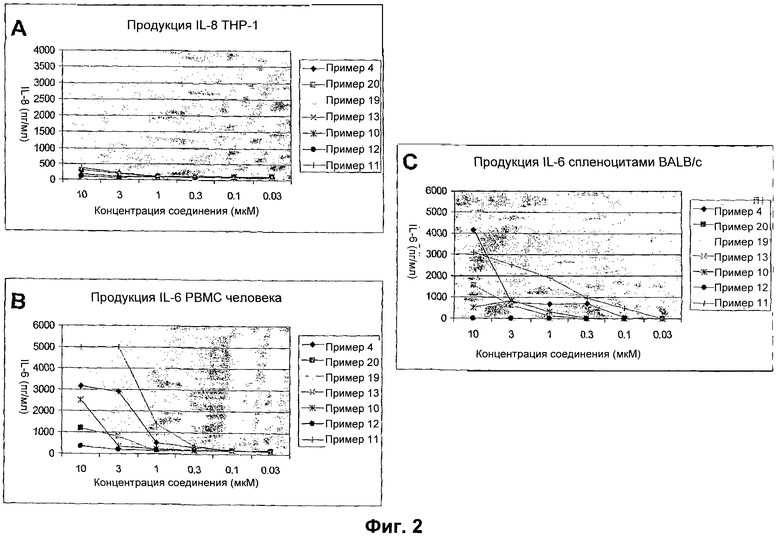

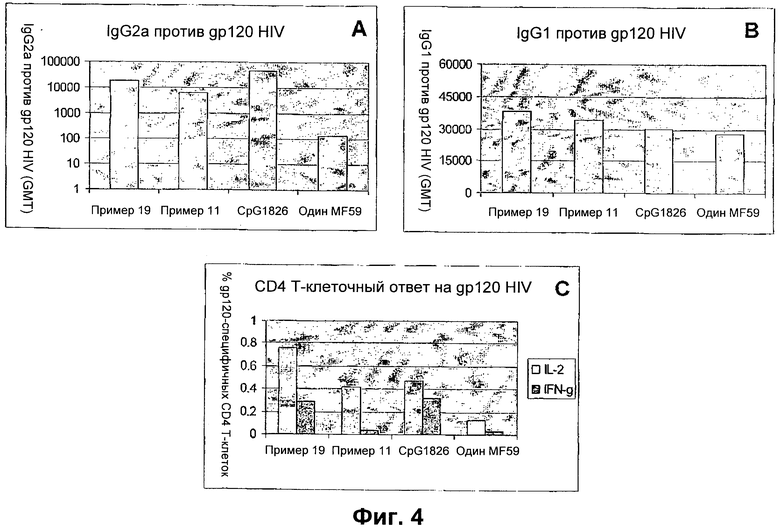
Изобретение относится к новым производным имидазохинолина или к их фармацевтически приемлемым солям, их таутомерам или фармацевтически приемлемым солям таутомеров, общей формулы I, где R1 представляет собой -NR6R7, -(CH2)mCH=CH(CH2)nR9, -(СН2)mС≡С(СН2)nR9 или -S(O)qR10; R2 представляет собой C1-6алкил или C1-6алкил, замещенный одной группой, выбранной из -ОН и -ОМе; каждый из R4 и R5 независимо представляет собой Н, С6арил-С1алкил или защитную группу; каждый из R6 и R7 независимо представляет собой Н, C1-6алкил, C1-6алкил, замещенный одной группой, выбранной из -ОН и -ОМе, C1-6алкокси-С1-2алкил или -(CH2)mCH=CH(CH2)nR9; каждый R9 независимо представляет собой Н, C1-6алкил, или С6-10арил; каждый R10 независимо представляет собой C1-3алкил или С6-10арил-С1-6алкил; каждое из m и n независимо равно 0 или 1; и каждое q независимо равно 0; при условии, что если R1 представляет собой -S-Me, то R2 не является изобутилом. Также изобретение относится к конкретным соединениям, к способам синтеза соединений формул II, V и XI, которые являются вариантами формулы I, к фармацевтической композиции на основе соединения формулы I и к композиции на основе соединения формулы I и дополнительной иммуногенной композиции или антигена. Технический результат: получены новые производные имидазохинолина, пригодные для модулирования иммунного ответа у субъекта. 7 н. и 30 з.п. ф-лы, 4 ил., 2 табл.
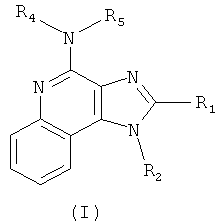
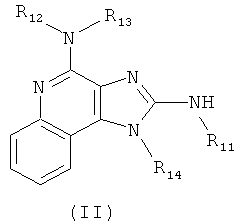


1. Соединение формулы (I):
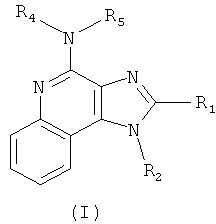
где R1 представляет собой -NR6R7, -(CH2)mCH=CH(CH2)nR9, -(СН2)mС≡С(СН2)nR9 или -S(O)qR10;
R2 представляет собой C1-6алкил или C1-6алкил, замещенный одной группой, выбранной из -ОН и -ОМе;
каждый из R4 и R5 независимо представляет собой Н, С6арил-С1алкил или защитную группу;
каждый из R6 и R7 независимо представляет собой Н, C1-6алкил, C1-6алкил, замещенный одной группой, выбранной из -ОН и -ОМе, С1-6алкокси-С1-2алкил или
-(СН2)mСН=СН(СН2)nR9;
каждый R9 независимо представляет собой Н, C1-6алкил, или С6-10арил;
каждый R10 независимо представляет собой С1-3алкил или С6-10арил-C1-6алкил;
каждое из m и n независимо равно 0 или 1; и
каждое q независимо равно 0; или
его фармацевтически приемлемая соль, его таутомер или фармацевтически приемлемая соль таутомера;
при условии, что, если R1 представляет собой -S-Me, то R2 не является изобутилом.
2. Соединение по п.1, в котором каждый из R4 и R5 представляет собой Н.
3. Соединение по п.2, в котором R1 представляет собой -NR6R7.
4. Соединение по п.2, в котором R1 представляет собой -S(O)qR10.
5. Соединение по п.2, в котором R1 представляет собой -(CH2), CH=CH(CH2)nR9.
6. Соединение по п.2, в котором R1 представляет собой -(СН2)mС≡С(СН2)nR9.
7. Соединение по любому из пп.1-6, в котором R2 представляет собой C1-6алкил.
8. Соединение по п.3, в котором R6 и R7 в R1 независимо представляют собой Н, С1-6алкил или -(СН2)mСН=СH(СН2)nR9.
9. Соединение по п.4, в котором R1 представляет собой -SR10, a R10 в -SR10 представляет собой С1-3алкил.
10. Соединение по п.7, в котором R2 представляет собой изобутил.
11. Соединение по п.9, в котором C1-3алкил в R10 выбран из метила, этила или пропила.
12. Соединение по п.8, в котором m равно 1, n равно 0, a R9 представляет собой Н.
13. Соединение по п.2, в котором R1 представляет собой -N(СН3)СН2СН2СН3.
14. Соединение по любому из пп.1-6, в котором R2 представляет собой C1-6алкил, замещенный одной группой, выбранной из -ОН и -ОМе.
15. Соединение по п.14, в котором R2 представляет собой -СН2С(СН3)2(ОН).
16. Соединение по п.2, в котором R1 представляет собой -S-СН2СН2СН3.
17. Соединение структурной формулы, выбранное из группы, состоящей из:
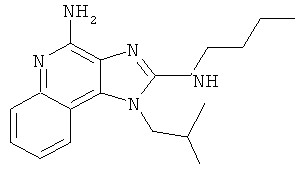 ,
, 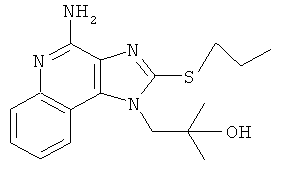 ,
,  ,
,
 ,
, 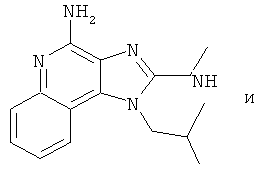

или его фармацевтически приемлемая соль, его таутомер или фармацевтически приемлемая соль таутомера.
18. Способ синтеза соединения формулы (II)
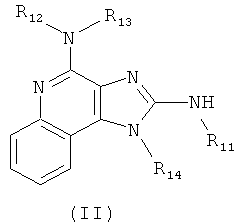
где каждый из R11 и R14 представляет собой C1-6алкил или С1-6алкил, замещенный одной группой, выбранной из -ОН и -ОМе, и каждый из R12 и R13 представляет собой защитную группу, предусматривающий:
(а) взаимодействие соединения формулы (III):

с изотиоцианатом формулы R11NCS, где R11 определен выше, с получением таким образом соединения формулы (IV):
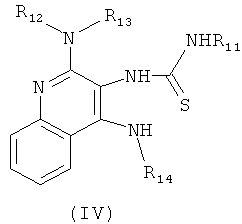
(b) необязательную очистку соединения формулы (IV);
(c) взаимодействие соединения формулы (IV) со сшивающим агентом с получением таким образом соединения формулы (II); и
(d) необязательное удаление защитной группы с соединения формулы (II).
19. Способ по п.18, в котором сшивающий агент представляет собой 1-(3-диметиламинопропил)3-этилкарбодиимидгидрохлорид.
20. Способ по п.18, в котором защитная группа представляет собой бензильную группу.
21. Способ синтеза соединения формулы (V)

где R14 представляет собой C1-6алкил или C1-6алкил, замещенный одной группой, выбранной из -ОН и -ОМе, a R15 представляет собой С6-10арил-С1-6алкил, предусматривающий:
(а) взаимодействие соединения формулы (III):

где каждый из R12 и R13 представляет собой защитную группу, с дисульфидом углерода с получением таким образом соединения формулы (VI):

(b) необязательную очистку соединения формулы (VI);
(c) взаимодействие соединения формулы (VI) с активированной группой R15 с получением соединения формулы (VIa); и

(d) удаление защитной группы с соединения формулы (VIa) с получением таким образом соединения формулы (V).
22. Способ по п.21, в котором защитная группа представляет собой бензильную группу.
23. Способ синтеза соединения формулы (XI)

где каждый из R12 и R13 представляет собой защитную группу, R14 представляет собой C1-6алкил или C1-6алкил, замещенный одной группой, выбранной из -ОН и
-ОМе, n равно 0, 1, 2 или 3, a R18 представляет собой Н, C1-6алкил или С6-10арил, предусматривающий:
(а) взаимодействие соединения формулы (III):

с хлорформиатом формулы СlС(O)O-С1-6алкил с получением таким образом соединения формулы (XII):
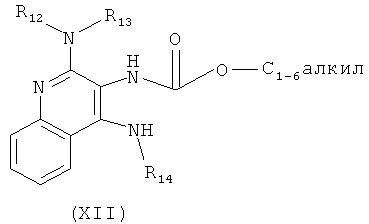
(b) необязательную очистку соединения формулы (XII);
(c) взаимодействие соединения формулы (XII) с алкоксидным основанием с получением таким образом соединения формулы (XIII);

(d) взаимодействие соединения формулы (XIII) с ангидридом трифторметансульфоновой кислоты с получением таким образом трифлата формулы (XIV):

(e) взаимодействие соединения формулы (XIV) с ацетилидом лития формулы Li-C≡(CH2)nR18, где n и R18 определены выше, с получением таким образом соединения формулы (XI); и
(f) необязательное удаление защитной группы с соединения формулы (XI).
24. Способ по п.23, в котором защитная группа представляет собой бензильную группу.
25. Фармацевтическая композиция, содержащая соединение по любому из пп.2-17 и фармацевтически приемлемый наполнитель для модулирования иммунного ответа у субъекта.
26. Композиция, содержащая соединение по любому из пп.2-17 и дополнительную иммуногенную композицию или антиген.
27. Композиция по п.26, в которой дополнительная иммуногенная композиция содержит антиген.
28. Композиция по п.26, дополнительно содержащая дополнительный адъювант.
29. Композиция по п.28, в которой адъювант представляет собой MF59.
30. Композиция по любому из пп.26-28, дополнительно содержащая поли(лактидсогликолид) (PLG).
31. Композиция по п.27, в которой антиген представляет собой бактериальный антиген или вирусный антиген.
32. Композиция по п.31, в которой антиген представляет собой вирусный антиген из вируса, выбранного из группы, состоящей из вируса гепатита С, вируса иммунодефицита человека, вируса гепатита В, вируса папилломы человека и вируса гриппа.
33. Композиция по п.32, в которой антиген представляет собой антиген вируса гриппа.
34. Композиция по п.33, в которой антиген вируса гриппа включает в себя поверхностные белки гемагглютинин и/или нейраминидазу.
35. Композиция по п.31, дополнительно содержащая дополнительный адъювант.
36. Композиция по п.35, в которой адъювант представляет собой MF59.
37. Композиция по любому из пп.31-36, дополнительно содержащая поли(лактидсогликолид) (PLG).
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| ПРОИЗВОДНОЕ 1,3-ДИГИДРО-2H-ИМИДАЗО/4,5-B/ХИНОЛИН-2-ОНА В КАЧЕСТВЕ ИНГИБИТОРА ФОСФОДИЭСТЕРАЗЫ, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ПРОМЕЖУТОЧНЫЕ ДЛЯ НЕГО, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1992 |
|
RU2127273C1 |
| Способ получения производных 1,3-дигидро-2Н-имидазо/4,5-в/хинолин-2-онов или их фармацевтически приемлемых солей | 1986 |
|
SU1450746A3 |
Авторы
Даты
2011-04-10—Публикация
2005-09-14—Подача