ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к векторам на основе нуклеиновых кислот, содержащим гены, необходимые для продуцирования ретровирусов, и их применению. Также предоставлены способы создания линий клеток, пакующих/продуцирующих ретровирусы, содержащих векторы на основе нуклеиновых кислот, как описано в настоящем документе.
ПРЕДШЕСТВУЮЩИЙ ИЗОБРЕТЕНИЮ УРОВЕНЬ ТЕХНИКИ
При генотерапии генетический материал доставляется в эндогенные клетки индивидуума, нуждающегося в лечении. Генетический материал может вносить новые гены индивидууму или вносить дополнительные копии предсуществующих генов, или вносить различные аллели или варианты генов, которые присутствуют у индивидуума. Системы вирусных векторов были предложены в качестве эффективного способа доставки генов для применения в генотерапии (Verma и Somia (1997) Nature 389: 239-242).
Конкретно, основой этих вирусных векторов являются члены семейства ретровирусов вследствие их способности интегрировать свой генетический груз в геном хозяина. Ретровирусные векторы сконструированы для содержания важнейших белков, необходимых для упаковки и доставки ретровирусного генома, но любые несущественные добавочные белки, включая те, которые ответственны за их профиль заболевания, удалены. Примеры ретровирусных векторов включают лентивирусные векторы, такие как основанные на вирусе иммунодефицита человека тип 1 (ВИЧ-1), который широко используют, поскольку они способны интегрироваться в непролиферирующие клетки.
В настоящее время большинство вирусных векторов получают посредством временной сотрансфекции вирусных генов внутрь линии клеток-хозяев. Вирусные гены вносятся с использованием бактериальных плазмид, которые существуют в клетке-хозяине в течение лишь ограниченного периода времени, потому что вирусные гены остаются на плазмидах и не интегрируются в геном. В связи с этим, временно трансфицированный генетический материал не передается последующим поколениям во время клеточного деления.
Существует несколько недостатков, связанных с временной трансфекцией, такие как вариабельность от партии к партии, высокая стоимость реагентов для трансфекции и трудность поддержания контроля качества (см. Segura et al. (2013) Expert Opin. Biol. Ther. 13(7): 987-1011). Процесс трансфекции сам по себе также является трудоемким и представляющим сложность при увеличении масштабов производства. Также существует сложная задача удаления загрязнения плазмидами, которые переносятся во время получения вектора (см. Pichlmair et al. (2007) J. Virol. 81(2): 539-47).
Обращаясь к проблемам, связанным с временной трансфекцией, присутствует желание разработать линии клеток, пакующие и продуцирующие ретровирусы, с целью упростить продуцирование ретровирусных векторов.
Пакующие линии клеток были произведены посредством трансфекции линии клеток, способной паковать ретровирусные векторы, с применением плазмид, где индивидуальные плазмиды несут ретровирусные гены упаковки и уникальные эукариотические селективные маркеры. Гены упаковки интегрированы в геном пакующей линии клеток и описываются как стабильно трансфицированные. За последние 20 лет были сделаны различные попытки произвести стабильные пакующие и продуцирующие линии клеток для ретровирусных векторов.
Сообщалось о многочисленных проблемах в отношении пакующих и продуцирующих линий клеток, полученных посредством интеграции компонентов ретровирусного вектора в геном клетки-хозяин. В первую очередь, последовательное введение компонентов ретровирусного вектора может быть трудоемким и ненастраиваемым. Также были проблемы с генетической и/или транскрипционной нестабильностью компонентов ретровирусного вектора при их интеграции в геном клетки-хозяина, поскольку участок интеграции является непредсказуемым (Ni et al. (2005) J. Gene Med. 7: 818-834.). Значительный спад продуктивности вирусного вектора также сообщался во время суспензионной адаптации и повышении масштаба производства продуцирующих линий клеток (Farson et al. (2001) Hum. Gene Ther. 12: 981-997; Guy et al. (2013) Hum. Gene Ther. Methods. 24(2): 125-39).
Таким образом, целью настоящего изобретения является предоставить способ создания стабильных линий клеток, пакующих и продуцирующих ретровирусы, посредством которого преодолевается один или несколько из неблагоприятных факторов, связанных с существующими способами.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения разработали новый способ создания пакующих и продуцирующих линий клеток, который включает применение векторов на основе нуклеиновых кислот, содержащих участок начала репликации, не присущий млекопитающим, и способность удерживать, по меньшей мере, 25 тысяч пар нуклеотидов (т.п.н.) ДНК, таких как бактериальные искусственные хромосомы, содержащие гены ретровирусов, обязательные для продуцирования ретровирусного вектора. Это обеспечивает экспрессию ретровирусных генов, необходимых для продуцирования ретровирусных векторных частиц с дефектом репликации для устранения проблем, связанных со способами временной трансфекции.
Применение вектора на основе нуклеиновой кислоты, содержащего не присущий млекопитающим участок начала репликации и который обладает способностью удерживать, по меньшей мере, 25 т.п.н. ДНК (т.е. крупную конструкцию ДНК), имеет несколько преимуществ. В первую очередь, векторы могут быть сначала обработаны в клетках немлекопитающих (например, микробных клетках, таких как бактериальные клетки), вместо клеток млекопитающего, что делает их применение гораздо более легким (например, бактериальные искусственные хромосомы могут быть сначала обработаны в E. coli). Как только вектор на основе нуклеиновой кислоты был получен, он может быть введен в клетку млекопитающего, и можно выбирать любые клетки млекопитающего, которые имеют вектор на основе нуклеиновой кислоты, интегрированный в эндогенные хромосомы, с целью выделить стабильную линию клеток.
Введение нуклеиновых кислот ретровирусов в клетку млекопитающего также может происходить в один этап, что помогает уменьшить давление отбора и период сайленсинга. Это позволяет провести более быстрый скрининг потенциальных упаковывающих клеток и снижает стоимость материалов, так как используется только единичный вектор, в отличие от предыдущих способов, в которых используется множество плазмидных векторов. Конкретно, применение данной системы снижает стоимость производства посредством экономии на стоимости плазмиды, реагентов, необходимых для трансфекции (например, полиэтиленимина [PEI]), снижения количества необходимой обработки бензоназой (при этом способе снижено количество ДНК при сборе лентивируса, таким образом, меньше бензоназы необходимо для удаления избытка при переработке для выделения и очистки конечного продукта) и сниженной стоимости тестирования (нет необходимости в тестировании на предмет остаточной плазмиды в лентивирусном продукте).
Кроме того, в векторе на основе нуклеиновой кислоты присутствуют гены ретровирусов, обязательные для продуцирования ретровирусов (с или без вектора для переноса), таким образом, что при введении вектора в клетку млекопитающего, все гены ретровирусов, встроенные в вектор на основе нуклеиновой кислоты, будут интегрированы в одном локусе в составе эндогенного генома клетки млекопитающего. Это может устранить такие проблемы, как сайленсинг генов, который происходит, когда гены ретровирусов интегрированы случайным образом и в различные локусы внутри генома клетки-хозяина.
Применение векторов на основе нуклеиновой кислоты по изобретению, таким образом, предоставляет преимущества при создании линий клеток, пакующих и продуцирующих ретровирусы.
Таким образом, по первому аспекту изобретения, представлена клетка, продуцирующая ретровирусы, содержащая последовательности нуклеиновых кислот, кодирующие:
gag и pol белки;
env белок или его функциональный заменитель; и
РНК геном ретровирусной векторной частицы,
где указанные последовательности нуклеиновых кислот все расположены в едином локусе внутри генома клетки, продуцирующей ретровирус.
По дополнительному аспекту изобретения, предоставлен вектор на основе нуклеиновой кислоты, содержащий не присущий млекопитающим участок начала репликации и способность удерживать, по меньшей мере, 25 тысяч пар нуклеотидов (т.п.н.) ДНК, характеризующийся тем, что указанный вектор на основе нуклеиновой кислоты содержит ретровирусные последовательности нуклеиновых кислот, кодирующие:
gag и pol белки, и
env белок или его функциональный заменитель,
где каждая из ретровирусных последовательностей нуклеиновой кислоты расположена в виде индивидуальных экспрессирующих конструкций в составе вектора на основе нуклеиновой кислоты.
По дополнительному аспекту изобретения, предоставлен способ получения стабильной ретровирусной пакующей линии клеток, содержащий:
(a) введение вектора на основе нуклеиновой кислоты, как определено в настоящем документе, в культуру клеток млекопитающего; и
(b) отбор в культуре клеток млекопитающего, которые содержат последовательности нуклеиновых кислот, кодируемые на векторе, интегрированном в эндогенную хромосому клетки млекопитающего.
По дополнительному аспекту изобретения, предоставлена ретровирусная упаковывающая клетка, полученная посредством способа, как определено в настоящем документе.
По дополнительному аспекту изобретения, предоставлен способ получения репликативно-дефектной ретровирусной векторной частицы, содержащий:
(a) введение вектора на основе нуклеиновой кислоты, как определено в настоящем документе, в культуру клеток млекопитающего;
(b) отбор в культуре клеток млекопитающего, которые содержат последовательности нуклеиновых кислот, кодируемые на векторе, интегрированном в эндогенную хромосому клетки млекопитающего; и
(c) дополнительное культивирование клетки млекопитающего в условиях, при которых получают репликативно-дефектную ретровирусную векторную частицу.
По дополнительному аспекту изобретения, предоставлена репликативно-дефектная ретровирусная векторная частица, полученная посредством способа, как определено в настоящем документе.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
ФИГУРА 1: Пошаговое руководство для конструирования BACpack-WTGP-277delU5 и BACpack-SYNGP-277delU5.
ФИГУРА 2: Отбор стабильного поликлонального пула
Адгезивные клетки HEK293T трансфицировали с применением BACpackWTGagPol-переноса с использованием фосфата кальция. Стабильные пулы получали после 2 недель отбора с помощью зеоцина. Чтобы увидеть, способны ли стабильные трансфектанты вырабатывать вирус, стабильные поли-пулы индуцировали с применением доксициклина в течение 48 часов. Вирусный супернатант собирали 48 часов после индукции, фильтровали через 0,22 мкм фильтр и титровали посредством трансдукции HEK293T клеток. GFP позитивные трансдуцированные клетки использовали для расчета трансдуцирующих единиц/мл (TU/мл).
ФИГУРА 3: Создание стабильных трансфекционных суспензионных клонов. HEK293 6E клетки трансфицировали с применением BACpackWTGagPol-переноса с использованием реагента 293fectin. Стабильные пулы получали после 2 недель отбора с применением зеоцина. Стабильные пулы клонировали посредством лимитирующего разведения в 96-луночных планшетах для получения клонов единичных клеток, которые затем размножали. GFP детектировали посредством флуоресцентной микроскопии лучших клонов 1, 14, 15 и 16, полученных с применением среды для адгезивных клеток (DMEM+FBS) с последующей адаптацией к суспензионных условиям культивирования (среда FreeStyle).
ФИГУРА 4: Индукция лентивируса в суспензионных клонах. Чтобы увидеть, способны ли стабильные HEK6E трансфектанты вырабатывать вирус, 20 мл стабильных суспензионных клонов индуцировали с применением доксициклина (2 мкг/мл) в течение 48 часов. Вирусный супернатант собирали 48 часов после индукции, фильтровали через 0,45μm фильтр и титровали посредством трансдуцирования HEK293T клеток. GFP позитивные трансдуцированные клетки использовали для расчета трансдуцирующих единиц/мл (TU/мл).
ФИГУРА 5: Векторные титры клонов, продуцированные в соответствии с примером 4. Результаты демонстрируют векторные титры от клонов 1 и 16, незначительно повышенные между пассажем 5 и пассажем 21.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ОПРЕДЕЛЕНИЯ
Если не определено иначе, все технические и научные термины, применяемые в настоящем документе, имеют то же значение, какое обычно понятно специалисту в данной области, к которой принадлежит данное изобретение. Все патенты и публикации, упоминаемые в настоящем документе, полностью включены в качестве ссылки.
Термин «содержащий» охватывает «включающий» или «состоящий из», например, композиция, «содержащая» X, может состоять исключительно из X или может включать что-то дополнительное, например, X+Y.
Термин «состоящий по существу из» ограничивает объем признака до указанных материалов или этапов и таких, которые не оказывают существенного влияния на основную(ые) характеристику(и) заявленного свойства.
Термин «состоящий из» исключает наличие любого дополнительного(ых) компонента(ов).
Термин «приблизительно» по отношению к числовому значению x означает, например, x ± 10%, 5%, 2% или 1%.
Термин «вектор» или «вектор на основе нуклеиновой кислоты» относится к переносчику, который способен искусственным образом переносить чужеродный (т.е. экзогенный) генетический материал в другую клетку, где он может реплицироваться и/или экспрессироваться. Примеры векторов включают не присущие млекопитающим векторы на основе нуклеиновых кислот, такие как искусственные хромосомы бактерий (BACs), искусственные хромосомы дрожжей (YACs), P1-полученные искусственные хромосомы (PACs), космиды или фосмиды.
Другие примеры векторов включают вирусные векторы, такие как ретровирусные и лентивирусные векторы, которые представляют особый интерес в настоящей заявке. Лентивирусные векторы, так как те, которые основаны на вирусе иммунодефицита человека тип 1 (ВИЧ-1) широко используют, поскольку они способны интегрироваться в непролиферирующие клетки. Вирусные векторы могут быть сделаны репликативно-дефектными посредством расщепления вирусного генома на отдельные части, например, посредством помещения на отдельные плазмиды. Например, так называемое первое поколение лентивирусных векторов, разработанное в Salk Institute for Biological Studies, было сконструировано в виде трехплазмидной экспрессирующей системы, состоящей из пакующей экспрессирующей кассеты, оболочечной экспрессирующей кассеты и векторной экспрессирующей кассеты. «Пакующая плазмида» содержит полностью gag-pol последовательности, регуляторные (tat и rev) и добавочные (vif, vpr, vpu, nef) последовательности. «Оболочечная плазмида» содержит гликопротеин вируса везикулярного стоматита (VSVg) взамен нативного оболочечного белка ВИЧ-1, под контролем промотора цитомегаловируса (CMV). Третья плазмида («трансферная плазмида») несет длинные концевые повторы (LTRs), последовательность инкапсуляции (ψ), последовательность элемента ответа Rev (RRE) и CMV промотор для экспрессии трансгена внутри клетки-хозяина.
Второе поколение лентивирусных векторов характеризовалось делецией вирулентных последовательностей vpr, vif, vpu и nef. Пакующий вектор был сокращен до генов gag, pol, tat и rev, таким образом, повышая безопасность системы.
С целью улучшения лентивирусной системы были сконструированы векторы третьего поколения посредством удаления гена tat из пакующей конструкции и инактивации LTR из векторной кассета, таким образом, уменьшая проблемы, связанные с эффектами инсерционного мутагенеза.
Различные поколения лентивирусов описаны в следующих ссылочных источниках: первое поколение: Naldini et al. (1996) Science 272(5259): 263-7; второе поколение: Zufferey et al. (1997) Nat. Biotechnol. 15(9): 871-5; третье поколение: Dull et al. (1998) J. Virol. 72(11): 8463-7, все из которых включены в настоящий документ в качестве ссылки полностью. Обзор на предмет разработки лентивирусных векторов можно найти в Sakuma et al. (2012) Biochem. J. 443(3): 603-18 и Picanço-Castro et al. (2008) Exp. Opin. Therap. Patents 18(5):525-539.
Термин «не присущий млекопитающим участок начала репликации» относится к последовательности нуклеиновой кислоты, где инициируется репликация, и которую получают из не присущего млекопитающим источника. Это позволяет векторам на основе нуклеиновых кислот по изобретению стабильно реплицировать и в то же время сегрегировать эндогенные хромосомы в подходящей клетке-хозяине (например, микробной клетке, такой как бактериальная или дрожжевая клетка), таким образом, что она является годной к передаче потомству клетки-хозяина, кроме случая, когда клетка-хозяин представляет собой присущую млекопитающему клетку-хозяин. В клетках млекопитающего векторы на основе нуклеиновых кислот с не присущими млекопитающим участками начала репликации будут либо интегрироваться в эндогенные хромосомы клетки млекопитающего или будут утеряны при репликации клетки млекопитающего. Например, векторы на основе нуклеиновых кислот с не присущими млекопитающим участками начала репликации, такие как бактериальные искусственные хромосомы (BAC), P1-полученная искусственная хромосома (PAC), космиды или фосмиды, способны стабильно реплицировать и в то же время сегрегировать эндогенные хромосомы в бактериальных клетках (таких как E. coli), однако если они вносятся в клетки млекопитающего, BAC, PAC, космида или фосмида будут либо интегрироваться или или будут утеряны при репликации клетки млекопитающего. Искусственные хромосомы дрожжей (YAC) способны стабильно реплицировать и в то же время сегрегировать эндогенные хромосомы в клетках дрожжей, однако если они вносятся в клетки млекопитающего, YAC будут либо интегрироваться, либо будут утеряны при репликации клетки млекопитающего. Таким образом, в этом контексте, векторы на основе нуклеиновых кислот по изобретению действуют в качестве резервуаров ДНК (т.е. для генов, обязательных для продуцирования ретровирусов), которые могут быть с легкостью перенесены в клетки млекопитающего для создания стабильных линий клеток для продуцирования ретровирусов. Примеры не присущих млекопитающим участков начала репликации включают бактериальные участки начала репликации, такие как oriC, oriV или oriS, или дрожжевые участки начала репликации, также известные как автономно повторяющиеся последовательности (ARS элементы).
Векторы на основе нуклеиновых кислот по настоящему изобретению содержат не присущий млекопитающим участок начала репликации и способны удерживать, по меньшей мере, 25 тысяч пар нуклеотидов (т.п.н.) ДНК. В одном из вариантов осуществления вектор на основе нуклеиновой кислоты обладает способностью удерживать, по меньшей мере, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290, 300, 310, 320, 330, 340 или 350 т.п.н. ДНК. Следует понимать, что указания на «способность удерживать» имеют свое обычное значение и подразумевают, что верхний предел размера вставки для вектора на основе нуклеиновой кислоты составляет не менее, чем заявленный размер (т.е. не менее чем 25 т.п.н. ДНК).
Целью настоящего изобретения является включить гены, обязательные для ретровирусной упаковки, в единую конструкцию (т.е. вектор на основе нуклеиновой кислоты). Таким образом, векторы на основе нуклеиновых кислот по изобретению, должны быть способны удерживать большие вставки ДНК. Во избежание неопределенности, следует понимать, что указания на «векторы на основе нуклеиновых кислот» или «искусственные хромосомы» не относятся к природным бактериальным плазмидам (например, таким как плазмиды, применяемые в настоящее время в способах временной трансфекции), потому что они не способны удерживать, по меньшей мере, 25 т.п.н. ДНК. Максимальный размер вставки, которую может содержать плазмида, составляет приблизительно 15 т.п.н. Такие векторы на основе нуклеиновых кислот также не относятся к бактериофагам, которые, как правило, удерживают вставки максимум только 5-11 т.п.н. Таким образом, в одном из вариантов осуществления вектор на основе нуклеиновой кислоты по изобретению не является плазмидой, бактериофагом или эписомой.
Термин «эндогенные хромосомы» относится к геномным хромосомам, обнаруживаемым в клетке-хозяине перед созданием или введением экзогенного вектора на основе нуклеиновой кислоты, такого как бактериальная искусственная хромосома.
Термины «трансфекция», «трансформация» и «трансдукция» как используют в настоящем документе, можно использовать для описания вставки не присущего млекопитающим или вирусного вектора в клетку-мишень. Вставку вектора, как правило, называют трансформацией для бактериальных клеток и трансфекцией для эукариотических клеток, хотя вставка вирусного вектора также могут называть трансдукцией. Специалист обычно осведомлен о различных широко используемых способах невирусной трансфекции, которые в качестве неограничивающих примеров включают применение физических способов (например, электропорация, сжимание клетки, сонопорация, оптическая трансфекция, слияние протопластов, импалефекция, магнитофекция, генная пушка или бомбардировка частицами), химические реагенты (например, фосфат кальция, сильно разветвленные органические соединения или катионные полимеры) или катионные липиды (например, липофекция). При многих способах трансфекции необходим контакт растворов плазмиды ДНК с клетками, которые затем выращивают и отбирают с помощью маркера экспрессии гена.
Термин «промотор» относится к последовательности, которая запускает экспрессию гена. Чтобы запустить высокий уровень экспрессии, предпочтительным может являться использование высоко эффективного промотора, такого как неретровирусный, высокоэффективный промотор. Примеры подходящих промоторов могут включать такой промотор, как немедленно-ранний промотор цитомегаловируса человека (CMV), промотор вируса бляшкообразования в селезенке (SFFV), промотор вируса саркомы Рауса (RSV) или промотор фактора элонгации 1-альфа человека (pEF).
Tet оперон (тетрациклин-контролируемая транскрипционная активация) можно использовать в способе индуцируемой экспрессии гена, где транскрипцию обратимым образом включают или выключают в присутствии антибиотика тетрациклина или одного из его производных (например, доксициклина). В природе, Ptet промотор экспрессирует TetR, репрессор, и TetA, белок, который откачивает антибиотик тетрациклин из клетки. В настоящем изобретении, Tet оперон может присутствовать или отсутствовать, например, в одном из вариантов осуществления Tet оперон может присутствовать в промоторе.
Термин «селективный маркер» относится к гену, который помогает выбрать клетки, активно экспрессирующие вставленный ген (например, трансген). Примеры подходящих селективных маркеров включают ферменты, кодирующие устойчивость к антибиотику (т.е. ген устойчивости к антибиотикам), например, канамицин, неомицин, пуромицин, гигромицин, бластицидин или зеоцин. Другим примером подходящих селективных маркеров являются флуоресцентные белки, например, зеленый флуоресцентный белок (GFP), красный флуоресцентный белок (RFP) или голубой флуоресцентный белок (BFP).
Термин «полиA сигнал» относится к последовательности сигнала полиаденилирования, например, размещенной на 3' трансгена, которая позволяет факторам организма-хозяина добавить полиаденозиновый (полиA) хвост к концу растущей иРНК во время транскрипции. ПолиA хвост это удлинение до 300 аденозиновых рибонуклеотидов, которое защищает иРНК от ферментативного расщепления и также способствует трансляции. Таким образом, векторы на основе нуклеиновых кислот по настоящему изобретению могут включать сигнальную последовательность полиA, такую как полиA сигналы бета глобина человека или бета глобина кролика, ранние или поздние полиA сигналы вируса обезьяны 40 (SV40), полиA сигнал инсулина человека или полиA сигнал гормона роста быка. В одном из вариантов осуществления сигнальной последовательностью полиA является полиA сигнал бета глобина человека.
Термин «интронная последовательность» относится к нуклеотидной последовательности, которая удалена из финального продукта гена посредством РНК сплайсинга. Было показано, что применение нисходящего интрона энхансерной/промоторной области и восходящего интрона вставки кДНК повышает уровень экспрессии гена. Повышение экспрессии зависит от конкретной кДНК вставки. Таким образом, вектор на основе нуклеиновой кислоты по настоящему изобретению может включать интроны, такие как интрон бета глобина человек, интрон II бета глобина кролика или химерный интрон бета глобина-иммуноглобулина человека. В одном из вариантов осуществления интроном является интрон бета глобина человек и/или интрон II бета глобина кролика.
Термин «пакующий линия клеток» относится к линии клеток со стабильно вставленными генами gag и pol белка и оболочечного гликопротеина. Альтернативно, термин «продуцирующая линия клеток» относится к пакующей линии клеток со стабильно вставленным вектором для переноса, содержащим трансген, представляющим интерес. Специалисту в данной области следует понимать, что векторы на основе нуклеиновых кислот, описываемые в настоящем документе, можно использовать для создания пакующих линий клеток (т.е. когда, по меньшей мере, gag, pol и env гены присутствуют на векторе на основе нуклеиновой кислоты и встроены в клетку-хозяин) или продуцирующих линий клеток (т.е. когда вектор на основе нуклеиновой кислоты дополнительно содержит вектор для переноса компонентов, предназначенных для встраивания в клетку-хозяин наряду с gag, pol и env генами).
Термин «стабильно трансфицированный» относится к линиям клеток, которые способны передавать введенные ретровирусные гены своему потомству (т.е. дочерним клеткам), или потому что трансфицированная ДНК была встроена в эндогенные хромосомы, или за счет стабильного наследования экзогенных хромосом.
ВЕКТОРЫ НА ОСНОВЕ НУКЛЕИНОВЫХ КИСЛОТ
В соответствии с одним из аспектов изобретения, предоставлен вектор на основе нуклеиновой кислоты, содержащий не присущий млекопитающим участок начала репликации и способность удерживать, по меньшей мере, 25 тысяч пар нуклеотидов (т.п.н.) ДНК, характеризующийся тем, что указанный вектор на основе нуклеиновой кислоты содержит ретровирусные последовательности нуклеиновых кислот, кодирующие:
gag и pol белки, и
env белок или его функциональный заменитель.
Конкретно, каждая из ретровирусных последовательностей нуклеиновых кислот может быть организована как индивидуальные экспрессирующие конструкции внутри вектора на основе нуклеиновой кислоты.
Существующие способы создания ретровирусных векторов предполагают временную трансфекцию ретровирусных генов в клетку-хозяин. Однако с этим способом связано много недостатков, поскольку он дорогостоящий, трудоемкий и сложный в промышленном масштабе. Одним из возможных решений является конструирование пакующей линии клеток, которая стабильно встраивает ретровирусные гены упаковки во избежание проблем, связанных с временной трансфекцией и для снижения выхода вариабельных ретровирусных векторов.
Авторы настоящего изобретения обнаружили, что векторы на основе нуклеиновых кислот, описываемые в настоящем документе, можно использовать для создания ретровирусной пакующей линии клеток, которая устранит предшествующие трудности, связанные со способами продуцирования ретровирусных векторов. Например, известные способы продуцирования ретровирусных пакующих линий клеток предполагают множество раундов селекции, после того, как введен каждый ретровирусный ген. Этот процесс может занять до шести месяцев и требует огромных трудозатрат. Посредством включения всех ретровирусных генов в вектор на основе нуклеиновой кислоты, гены ретровирусов могут затем быть вставлены в эндогенные хромосомы клетки млекопитающего в один единственный этап. Таким образом, применение вектора на основе нуклеиновой кислоты, как предполагается в настоящем документе, должно уменьшить давление отбора, уменьшить временной период сайленсинга и обеспечить более быстрый скрининг потенциальных упаковывающих клеток. Кроме того, гены ретровирусов, включенные в вектор на основе нуклеиновой кислоты все будут интегрированы в эндогенные хромосомы клетки млекопитающего в единичном локусе, что снизит риск того, что отдельные ретровирусные гены подвергнутся сайленсингу, и гарантирует, что все гены ретровирусов будут равномерно экспрессироваться.
В одном из вариантов осуществления вектор на основе нуклеиновой кислоты дополнительно содержит последовательности нуклеиновых кислот, которые кодируют РНК геном ретровирусных векторных частиц. Следует понимать, что РНК геном ретровирусных векторных частиц, как правило, включен в «вектор для переноса», применяемый в способах временной трансфекции. Плазмидный вектор для переноса, как правило, содержит промотор (такой как CMV), 3' LTR (который может быть или может не быть самостоятельно инактивирующим (т.е. SIN) 3'-LTR), 5' LTR (который может содержать или может не содержать U5 область), последовательность инкапсулирования (ψ) и потенциально трансген, связанный с промотором.
В одном из вариантов осуществления множественные копии РНК генома ретровирусных векторных частиц (т.е. вектора для переноса) включены в вектор на основе нуклеиновой кислоты. Ожидается, что множественные копии вектора для переноса приведут к более высокому титру вирусного вектора. Например, вектор на основе нуклеиновой кислоты может включать две или более, например, три, четыре, пять, шесть, семь, восемь, девять или десять или более копий РНК генома ретровирусных векторных частиц (т.е. вектора для переноса).
В одном из вариантов осуществления вектор на основе нуклеиновой кислоты содержит один или множество сайтов рекомбинации. Это позволяет нацелиться на последовательности, которые надо интегрировать в эндогенные хромосомы клетки млекопитающего сайт-специфичным образом в присутствии фермента рекомбиназы. Фермент рекомбиназа катализирует реакцию рекомбинации между двумя сайтами рекомбинации.
Много типов систем сайт-специфичной рекомбинации известно в данной области, и в настоящем изобретении можно использовать любую подходящую систему рекомбинации. Например, в одном из вариантов осуществления сайт(ы) рекомбинации выбран(ы) или получен(ы) из int/att системы фага лямбда, Cre/lox системы бактериофага P1, FLP/FRT системы дрожжей, Gin/gix рекомбиназной системы фага Mu, Cin рекомбиназной системы, Pin рекомбиназной системы E. coli и R/RS системы плазмиды pSR1 или любого их сочетания. В дополнительном варианте осуществления сайтом рекомбинации является att сайт (например, из фага лямбда), где att сайт позволяет произвести сайт-направленную интеграцию в присутствии лямбда-интегразы. Следует понимать, что указание на «лямбда-интегразу» включает указания на мутантные интегразы, которые тем не менее совместимы с int/att системой, например, модифицированные лямбда-интегразы, описанные в WO 2002/097059.
В одном из вариантов осуществления вектор на основе нуклеиновой кислоты выбран из: бактериальной искусственной хромосомы (BAC), искусственной дрожжевой хромосомы (YAC), P1-полученной искусственной хромосомы (PAC), фосмиды или космиды. В дополнительном варианте осуществления вектором на основе нуклеиновой кислоты является бактериальная искусственная хромосома (BAC).
Бактериальные искусственные хромосомы
Термин «бактериальная искусственная хромосома» или «BAC» относится к ДНК конструкции, полученной из бактериальной плазмиды, которая способна удерживать большую вставку экзогенной ДНК. Они могут, как правило, удерживать ДНК вставку максимум из приблизительно 350 т.п.н. BACs были разработаны на основе хорошо охарактеризованной бактериальной функциональной плазмиды фертильности (F-плазмида), которая содержит разделенные гены, которые способствуют равномерному распределению плазмид после деления бактериальной клетки. Это позволяет BACs быть стабильно реплицированной и сегрегированной наряду с эндогенными бактериальными геномами (такими как E. coli). BAC, как правило, содержит, по меньшей мере, одну копию участка начала репликации (такого как oriS или oriV ген), ген repE (для репликации и регуляции числа копий плазмиды) и разделяющие гены (такие как sopA, sopB, parA, parB и/или parC), которые обеспечивают стабильное поддержание BAC в бактериальных клетках. BACs в природе являются кольцевыми и сверхспиральными, что делает их восстановление более легким, чем для линейных искусственных хромосом, таких как YACs. Они также могут быть введены в бактериальные клетки-хозяева относительно легко, с применением простых способов, таких как электропорация.
В одном из вариантов осуществления бактериальная искусственная хромосома содержит oriS ген. В одном из вариантов осуществления бактериальная искусственная хромосома содержит repE ген. В одном из вариантов осуществления бактериальная искусственная хромосома содержит разделяющие гены. В дополнительном варианте осуществления разделяющие гены выбраны из sopA, sopB, parA, parB и/или parC. В еще одном дополнительном варианте осуществления бактериальная искусственная хромосома содержит sopA и sopB ген.
BAC для применения в настоящем изобретении можно получать из коммерческих источников, например, pSMART BAC из LUCIGEN™ (см. номер доступа генома EU101022.1 для полной последовательности нуклеотидного остова). Этот BAC содержит L-арабинозную «переписывающую» систему, которая также содержит oriV средне-копийный участок начала репликации, который является активным только в присутствии белка репликации TrfA. Ген для TrfA может быть встроен в геном бактериальных клеток-хозяев под контролем L арабинозного индуцибельного промотора araC-PBAD (см. Wild et al. (2002) Genome Res. 12(9): 1434-1444). Добавление L-арабинозы индуцирует экспрессию TrfA, которая активирует oriV, вызывая репликацию плазмиды до 50 копий на клетку.
Искусственные хромосомы дрожжей
Термин «искусственная дрожжевая хромосома» или «YAC» относится к хромосомам, в которых ДНК дрожжей встроена в бактериальные плазмиды. Они содержат автономно реплицирующуюся последовательность (ARS) (т.е. участок начала репликации), центромеру и теломеры. В отличие от BACs, YAC является линейной и, таким образом, содержит теломеры дрожжей на каждом конце хромосомы для защиты концов от деградации по мере перехода к потомству клетки-хозяина. YACs могут удерживать целый ряд размеров ДНК вставок; какой-либо из диапозона 100-2000 т.п.н.
P1-полученные искусственные хромосомы
Термин «P1-полученная искусственная хромосома» или «PAC» относится к конструкции ДНК, полученной из ДНК P1-бактериофага и бактериальной F-плазмиды. Они могут, как правило, удерживать ДНК вставку максимум из приблизительно 100-300 т.п.н. и используются в качестве клонирующих векторов в E. coli. PACs обладают преимуществами подобно, как у BACs, такие как легкость в очищении и введении в бактериальные клетки-хозяева.
Космиды и фосмиды
Термин «космида» относится к конструкциям ДНК, полученной из бактериальных плазмид, которые дополнительно содержат cos сайты, полученные из бактериофага лямбда. Космиды, как правило, содержат бактериальный участок начала репликации (такой как oriV), селективный маркер, клонирующий сайт и, по меньшей мере, один cos сайт. Космиды могут, как правило, принять ДНК вставку максимум 40-45 т.п.н. Было показано, что космиды являются более эффективными при инфицировании клеток E. coli, чем стандартные бактериальные плазмиды. Термин «фосмиды» относится к не присущим млекопитающим векторам на основе нуклеиновых кислот, которые являются подобными космидам, за исключением того, что они основаны на бактериальной F-плазмиде. Конкретно, в них используется участок начала репликации и распределительные механизмы F-плазмиды, чтобы обеспечить возможность клонирования больших фрагментов ДНК. Фосмиды могут, как правило, принимать ДНК вставку максимум 40 т.п.н.
РЕТРОВИРУСЫ
Ретровирусы являются семейством вирусов, которые содержат псевдодиплоидный одноцепочечный РНК геном. Они кодируют обратную транскриптазу, которая продуцирует ДНК из РНК генома, которая затем может быть вставлена в ДНК клетки-хозяина. Изобретение, описываемое в настоящем документе, можно использовать для продуцирования репликативно-дефектных ретровирусных векторных частиц. Ретровирусную векторную частицу по настоящему изобретению можно выбрать из или получить из любого подходящего ретровируса.
В одном из вариантов осуществления ретровирусную векторную частицу получают или выбирают из лентивируса, альфа-ретровируса, гамма-ретровируса или пенящего ретровируса, такого как лентивирус или гамма-ретровирус, конкретно, лентивируса. В дополнительном варианте осуществления ретровирусной векторной частицей является лентивирус, выбранный из группы, состоящей из ВИЧ-1, ВИЧ-2, SIV, FIV, EIAV и Visna. Лентивирусы способны инфицировать неделящиеся (т.е. покоящиеся) клетки, что делает их привлекательными ретровирусными векторами для генотерапии. В еще одном дополнительном варианте осуществления ретровирусная векторная частица представляет собой ВИЧ-1 или получена из ВИЧ 1. Геномную структуру некоторых ретровирусов можно найти в данной области. Например, подробности о ВИЧ-1 можно найти в NCBI Genbank (номер доступа генома AF033819). ВИЧ-1 является одним из наиболее изученных ретровирусов и, таким образом, часто используется в качестве ретровирусного вектора.
Ретровирусные гены
Последовательности нуклеиновых кислот, общие для всех ретровирусов, могут быть объяснены более подробно, как следует далее:
Длинные концевые повторы (LTRs): Основная структура ретровирусного генома содержит 5'-LTR и 3'-LTR, между или внутри которых расположены гены, требуемые для продуцирования ретровирусов. LTRs необходимы для интеграции и транскрипции ретровируса. Они также могут действовать как промотор последовательности для контроля экспрессии ретровирусных генов (т.е. они являются cis-действующими генами). LTRs состоят из трех субобластей, обозначенных U3, R, U5: U3 происходит из последовательности, уникальной для 3' конца РНК; R происходит из последовательности, повторяющейся на обоих концах РНК; и U5 происходит из последовательности, уникальной для 5' конца РНК. Таким образом, в одном из вариантов осуществления вектор на основе нуклеиновой кислоты дополнительно содержит 5'- и 3'-LTR. В дополнительном варианте осуществления U5 область 5' LTR может быть удалена и замещена не-ВИЧ-1 полиA хвостом (см. Hanawa et al. (2002) Mol. Ther. 5(3): 242-51).
С целью решения вопросов безопасности, относящихся к созданию репликационно-компетентного вируса, был разработан самоинактивирующийся (SIN) вектор посредством удаления участка в U3 области 3′ LTR, которая включает TATA бокс и участки связывания для факторов транскрипции Sp1 и NF-κB (см. Miyoshi et al. (1998) J. Virol. 72(10):8150-7). Делецию переносят к 5′ LTR после обратной транскрипции и интеграции в инфицированных клетках, что приводит к транскрипционной инактивации LTR. Это известно как самоинактивирующаяся векторная система на основе лентивируса, которая может быть включена в настоящее изобретение.
ψ: Инкапсулирование ретровирусной РНК происходит посредством ψ (psi) последовательности, расположенной на 5' конце ретровирусного генома. Также хорошо известно в данной области, что последовательности ниже psi последовательности и распространяющиеся на gag кодирующую область вовлечены в эффективное продуцирование ретровирусного вектора (см. Cui et al. (1999) J. Virol. 73(7): 6171-6176). В одном из вариантов осуществления вектор на основе нуклеиновой кислоты дополнительно содержит ψ (psi) последовательность.
Участок связывания праймера (PBS): Ретровирусный геном содержит PBS, который находится после U5 области 5'-LTR. Этот сайт связывается с тРНК праймером, необходимым для инициации обратной транскрипции. В одном из вариантов осуществления вектор на основе нуклеиновой кислоты дополнительно содержит PBS последовательность.
PPT: Ретровирусные геномы содержат короткие фрагменты пуринов, называемые полипуриновые тракты (PPTs), рядом с 3' концом ретровирусного генома. Эти PPTs функционируют как РНК праймеры для синтеза плюс-цепи ДНК во время обратной транскрипции. Сложные ретровирусы (такие как ВИЧ-1) содержат второй, более центрально расположенный PPT (т.е. центральный полипуриновый тракт (cPPT)), который предоставляет второй сайт для инициации синтеза ДНК. Было показано, что ретровирусные векторы, кодирующие cPPT демонстрируют усиленную трансдукцию и экспрессию трансгена (см. Barry et al. (2001) Hum. Gene Ther. 12(9):1103-8). В одном из вариантов осуществления вектор на основе нуклеиновой кислоты дополнительно содержит 3'-PPT последовательность и/или cPPT последовательность.
Геномная структура некодирующих областей, описанных выше, хорошо известна специалисту в данной области. Например, подробности о геномной структуре некодирующих областей в ВИЧ-1 можно найти в NCBI Genbank с номером доступа генома AF033819, или для ВИЧ-1 HXB2 (широко используемый ВИЧ-1 референтный штамм) с номером доступа генома K03455. В одном из вариантов осуществления некодирующие области получают из последовательностей, доступных по номеру доступа генома K03455, например, из пар оснований 454-1126 (для R-U5-PBS-Gag), 7622-8479 (для RRE) или 7769-8146 (для RRE), 4781-4898 (для cPPT), 9015-9120 & 9521-9719 (для dNEF-PPT-sinU3-R-U5).
Gag/pol: Экспрессия генов gag и pol основана на сдвиге рамки считывания между gag и gagpol. Они оба являются полипротеинами, которые расщепляются во время созревания. Белки основного структурного матрикса, капсида и нуклеокапсида ретровирусного вектора кодируются gag. Ген pol кодирует ретровирусные ферменты: i) обратная транскриптаза, обязательная для обратной транскрипции ретровирусного РНК генома до двухцепочечной ДНК, ii) интеграза, которая обеспечивает интеграцию ретровирусного ДНК генома в хромосому клетки-хозяин, и iii) протеаза, которая расщепляет синтезированный полипротеин, чтобы продуцировать зрелые и функциональные белки ретровируса. В одном из вариантов осуществления последовательность ретровирусной нуклеиновой кислоты, кодирующую gag и pol белки, получают из последовательности ВИЧ-1 HXB2, которая доступна по номеру доступа генома K03455, например, из пар оснований 790-5105.
Env: Ген env («оболочка») кодирует поверхностные и трансмембранные компоненты оболочки ретровируса (например, гликопротеины gp120 и gp41 ВИЧ-1) и вовлечен в слияние мембраны ретровируса и клетки. С целью расширения тканевого тропизма ретровирусного вектора, ретровирусные векторы, описываемые в настоящем документе, могут быть псевдотипированы с применением оболочечного белка от другого вируса. Псевдотипирование относится к процессу при котором диапазон ретровирусных векторов клетки-хозяина, включая лентивирусные векторы, может быть расширен или изменен посредством замены гликопротеинов (GPs) на ретровирусные векторные частицы (например, посредством применения GPs, полученных или извлеченных из других оболочечных вирусов или применения синтетических/искусственных GPs). Наиболее широко используемым гликопротеином для псевдотипирования ретровирусных векторов является вирус везикулярного стоматита GP (VSVg), вследствие его широкого тропизма и высокой стабильности векторных частиц. Однако специалисту следует понимать, что другие гликопротеины можно использовать для псевдотипирования (см. Cronin et al. (2005) Curr. Gene Ther. 5(4):387-398, полностью включенный в настоящий документ в качестве ссылки). Выбор вируса, применяемого для псевдотипирование может также зависеть от типа клеток и/или органов, выбранных в качестве мишени, потому что было показано, что некоторые псевдотипы имеют предпочтения в типе ткани.
В одном из вариантов осуществления env белок или его функциональный заменитель получают из или извлекают из вируса, выбранного из везикуловируса (например, вирус везикулярного стоматита), лиссавируса (например, вирус бешенства, вирус Mokola), аренавируса (например, вирус лимфоцитарного хориоменингита (LCMV)), альфавируса (например, вирус реки Росс (RRV), вирус Синдбис, вирус леса Семлики (SFV), вирус венесуэльского энцефалита лошадей), филовируса (например, вирус Эбола Рестон, вирус Эбола Заир, вирус Ласса), альфаретровирус (например, вирус лейкоза птиц (ALV)), бетаретровирус (например, ретровирус овец Jaagsiekte (JSRV)), гаммаретровирус (например, вирус лейкоза мышей Молони (MLV), вирус лейкоза гиббонов (GALV), эндогенный ретровирус кошачьих (RD114)), дельтаретровирус (например, T-лимфотропный вирус человека 1 (HTLV-1)), спумавирус (например, пенящий вирус человека), лентивирус (например, вирус Мэди-Висна (MVV)), коронавирус (например, SARS-CoV), респировирус (например, вирус Сендай, респираторно-синциатиальный вирус (RSV)), гепацивирус (например, вирус гепатита C (HCV)), вирус гриппа (например, вирус гриппа A) и вирус ядерного полиэдроза (например, вирус множественного ядерного полиэдроза совки калифорнийской люцерновой (AcMNPV)). В дополнительном варианте осуществления env белок или его функциональный заменитель получают из или извлекают из вируса везикулярного стоматита. В этом варианте осуществления можно использовать белок гликопротеин вируса везикулярного стоматита (VSVg), который позволяет ретровирусным частицам инфицировать более широкий диапазон клеток-хозяев и уменьшает вероятность того, что в ходе рекомбинации будут продуцироваться оболочечные белки дикого типа. В дополнительном варианте осуществления последовательность ретровирусной нуклеиновой кислоты, кодирующую env белок или его функциональный заменитель, получают из последовательности, доступной по номеру доступа генома J02428.1, например, из пар оснований от 3071 до 4720.
Структурные гены, описываемые в настоящем документе, являются общими для всех ретровирусов. Дополнительные вспомогательные гены можно найти в различных типах ретровирусов. Например, лентивирусы, такие как ВИЧ-1, содержат шесть дополнительных вспомогательных генов, известных как rev, vif, vpu, vpr, nef и tat. Другие ретровирусы могут иметь вспомогательные гены, которые аналогичны генам, описываемым в настоящем документе, однако они могут не всегда давать те же имена, что и в литературе. Ссылки, такие как Tomonaga и Mikami (1996) J. Gen. Virol. 77(Pt 8):1611-1621 описывают различные вспомогательные гены ретровирусов.
Rev: Вспомогательный ген rev («регулятор вириона») кодирует акцессорный белок, который связывается с элементом ответа Rev (RRE) и облегчает экспорт ретровирусных транскриптов. Белковый продукт гена позволяет фрагментам ретровирусной иРНК, которые содержат элемент ответа Rev (RRE) экспортироваться из ядра в цитоплазму. Спрогнозировано, что RRE последовательность должна образовывать сложную складчатую структуру. Эта конкретная роль rev отражает жесткую связь этапов сплайсинга и ядерного экспорта. В одном из вариантов осуществления вектор на основе нуклеиновой кислоты содержит RRE последовательность. В дополнительном варианте осуществления RRE последовательность получают из ВИЧ-1 HXB2 последовательности, которая доступна по номеру доступа генома K03455, например, из пар оснований от 7622 до 8479 или от 7769 до 8146, конкретно, пар оснований от 7622 до 8479.
Rev связывается с RRE и облегчает экспорт однократно сплайсированных (env, vif, vpr и vpu) или несплайсированных (gag, pol и геномная РНК) вирусных транскриптов, таким образом приводя к нижестоящим событиям, например, генной трансляции и упаковке (см. Suhasini и Reddy (2009) Curr. HIV Res. 7(1): 91-100). В одном из вариантов осуществления вектор на основе нуклеиновой кислоты дополнительно содержит вспомогательный ген rev или аналогичный ему ген (т.е. от других ретровирусов или функционально аналогичной системы). Включение гена rev обеспечивает эффективный экспорт РНК транскриптов генома ретровирусного вектора из ядра в цитоплазму, особенно если RRE элемент также включен в транскрипт, предназначенный для транспортировки. В дополнительном варианте осуществления ген rev содержит, по меньшей мере, 60% идентичность последовательностей, например, по меньшей мере, 70% идентичность последовательностей для пар оснований от 970 до 1320 номера доступа генома M11840 (т.е. ВИЧ-1 клон 12 кДНК, локус HIVPCV12). В альтернативном варианте осуществления ген rev содержит, по меньшей мере, 60% идентичность последовательностей, например, по меньшей мере, 70%, 80%, 90% или 100% идентичность последовательностей для пар оснований от 5970 до 6040 и от 8379 до 8653 номера доступа генома K03455.1 (т.е. вирус иммунодефицита человека тип 1, HXB2).
Считается, что вспомогательные гены играют роль в ретровирусной репликации и патогенезе, таким образом, многие существующие системы продуцирования вирусных векторов не включают некоторые из этих генов. Исключением является rev, который обычно присутствует, или система, аналогичная rev/RRE системе, потенциально используется. Таким образом, в одном из вариантов осуществления последовательности нуклеиновых кислот, кодирующие один или несколько вспомогательных генов vpr, vif, vpu, tat и nef, или аналогичные вспомогательные гены, разорваны таким образом, что указанные вспомогательные гены удалены из РНК генома ретровирусных векторных частиц или неспособны кодировать функциональные вспомогательные белки. В дополнительном варианте осуществления, по меньшей мере, два или более, три или более, четыре или более, или все из вспомогательных генов vpr, vif, vpu, tat и nef, или аналогичные вспомогательные гены, разорваны таким образом, что указанные вспомогательные гены удалены из РНК генома ретровирусных векторных частиц или неспособны кодировать функциональные вспомогательные белки. Удаление функционального вспомогательного гена может не требовать удаления гена целиком; удаления части гена или разрыва гена будет достаточно.
Следует понимать, что последовательности нуклеиновых кислот, кодирующие репликативно-дефектную ретровирусную векторную частицу могут быть такими же, или получены из, генов дикого типа ретровируса, на котором ретровирусная векторная частица основана, т.е. последовательности могут быть генетически или другим образом измененными версиями последовательностей, содержащихся в вирусе дикого типа. Таким образом, гены ретровирусов, встроенные в векторы на основе нуклеиновых кислот или геномы клеток-хозяев, могут также относиться к кодон-оптимизированным версиям генов дикого типа.
ДОПОЛНИТЕЛЬНЫЕ КОМПОНЕНТЫ
Векторы на основе нуклеиновых кислот по изобретению могут содержать также дополнительные компоненты. Эти дополнительные качества можно использовать, например, чтобы помочь стабилизировать транскрипты для трансляции, повысить уровень экспрессии гена, и запустить/прекратить транскрипцию гена.
Ретровирусные векторные частицы, полученные по изобретению, можно использовать в способах генотерапии. Таким образом, в одном из вариантов осуществления вектор на основе нуклеиновой кислоты дополнительно содержит один или несколько трансгенов. Этот трансген может быть терапевтически активным геном, который кодирует продукт гена, который можно использовать для лечения или улучшения состояния заболевания, являющегося целью. Трансген может кодировать, например, антисмысловую РНК, рибозим, белок (например, белок-супрессор опухолевого роста), токсин, антиген (который можно использовать для индуцирования антител или хелперных T-клеток или цитотоксических T-клеток) или антитело (такое как одноцепочечное антитело). В одном из вариантов осуществления трансген кодирует бета глобин.
Множественные копии вектора для переноса, содержащего трансген, как ожидается, приведут к более высокому титру ретровирусного вектора, таким образом, в одном из вариантов осуществления вектор на основе нуклеиновой кислоты содержит множественные копии трансгена, например, две или более, конкретно, три или более копии трансгена. В некоторых случаях более чем один продукт гена необходим для лечения заболевания, таким образом, в дополнительном варианте осуществления вектор на основе нуклеиновой кислоты дополнительно содержит два или более, например, три или более, или четыре или более различных трансгенов.
Указания в настоящем документе на «трансген» относятся к гетерологичной или чужеродной ДНК, которая не присутствует или не достаточно экспрессируется в клетке млекопитающего, в которую ее вводят. Это может включать, например, случаи, когда целевой ген не экспрессируется должным образом в клетке млекопитающего, таким образом, корректная версия гена-мишени вводится в качестве трансгена. Таким образом, трансген может быть геном, представляющим потенциальный терапевтический интерес. Трансген может быть получен из другого типа клеток или от другого вида, или получен синтетически. Альтернативно, трансген может быть получен из клетки-хозяина, но функционально связан с регуляторными областями, которые отличаются от тех, которые присутствуют в нативном гене. Альтернативно, трансген может быть отличающейся аллелью или вариантом гена, присутствующего в клетке-хозяине.
Целью генотерапии является модифицировать генетический материал живых клеток для терапевтических целей, и она заключается во вставке функционального гена в клетку для достижения терапевтического эффекта. Ретровирусный вектор, полученный с использованием векторов на основе нуклеиновых кислот, и клетки-хозяева, описываемые в настоящем документе, можно использовать для трансфекции клеток-мишеней и индуцирования экспрессии гена, представляющего потенциальный терапевтический интерес. Ретровирусный вектор может, таким образом, быть использован для лечения млекопитающего индивидуума, такого как человеческий индивидуум, страдающий от состояния, включая в качестве неограничивающих примеров, наследственные нарушения, злокачественную опухоль и определенные вирусные инфекции.
В одном из вариантов осуществления вектор на основе нуклеиновой кислоты дополнительно содержит элемент регуляции транскрипции. Например, любой из элементов, описываемых в настоящем документе, может быть функционально связан с промотором, таким образом, что экспрессия может контролироваться. Промоторы, упоминаемые в настоящем документе, могут включать известные промоторы, полностью или частично, которые могут действовать конститутивно или индуцибельно, например, в присутствии регуляторного белка. В одном из вариантов осуществления вектор на основе нуклеиновой кислоты дополнительно содержит высоко эффективный промотор, такой как CMV промотор. Этот промотор обладает преимуществом, заключающимся в стимуляции высокого уровня экспрессии элементов, закодированных на не присущем млекопитающим векторе на основе нуклеиновой кислоты. В дополнительном варианте осуществления CMV промотор содержит последовательность, полученную из цитомегаловируса человека штамм AD169. Эта последовательность доступна по номеру доступа генома X17403, например, из пар оснований от 173731 до 174404.
В одном из вариантов осуществления промотор (такой как CMV промотор) дополнительно содержит, по меньшей мере, один Tet оперон. Систему Tet оперона можно использовать для контроля экспрессии ретровирусных последовательностей, содержащихся внутри вектора на основе нуклеиновой кислоты. В кратком изложении, Tet репрессорный белок блокирует экспрессию посредством связывания с сайтом Tet оперона, который введен в промотор. Таким образом, когда Tet репрессор связывается с Tet опероном, экспрессия гена не осуществляется. При добавлении тетрациклина или доксициклина, Tet репрессор секвестируется, делая возможной промоторную активность, таким образом, экспрессия гена запускается. Системы Tet оперона являются широко доступными, например, Tet оперон, применяемый в pcDNA™4/TO экспрессирующем векторе млекопитающих, доступен в Invitrogen.
В одном из вариантов осуществления вектор на основе нуклеиновой кислоты дополнительно содержит репрессорный белок для оперона устойчивости к тетрациклину («Tet репрессор» или «TetR»). В дополнительном варианте осуществления Tet репрессор является кодон-оптимизированным.
В одном из вариантов осуществления вектор на основе нуклеиновой кислоты дополнительно содержит инсулятор, такой как инсулятор хроматина. Термин «инсулятор» относится к генетической последовательности, которая блокирует взаимодействие между промоторами и энхансерами. В дополнительном варианте осуществления инсулятор (такой как инсулятор хроматина) находится между каждой из ретровирусных последовательностей нуклеиновых кислот. Это помогает предотвратить промоторную интерференцию (т.е. когда промотор для одной единицы транскрипции мешает экспрессии соседней единицы транскрипции) между соседними ретровирусными последовательностями нуклеиновых кислот. Следует понимать, что если инсуляторы присутствуют в векторе на основе нуклеиновой кислоты между каждой из ретровирусных последовательностей нуклеиновых кислот, тогда они могут быть располагаться как индивидуальные экспрессирующие конструкции внутри вектора на основе нуклеиновой кислоты. Например, каждая последовательность, кодирующая ретровирусные последовательности нуклеиновых кислот, имеет свой собственный промотор и/или интрон и/или полиA сигнал. В одном из вариантов осуществления хроматиновый инсулятор имеет, по меньшей мере, 90% идентичность последовательностей, например, по меньшей мере, 95% идентичность последовательностей, с последовательностью инсулятора курицы (Gallus gallus) HS4 (например, см. номер доступа генома U78775.2, пары оснований от 1 до 1205).
В одном из вариантов осуществления вектор на основе нуклеиновой кислоты дополнительно содержит селективный маркер. Это позволяет отбирать клетки, в которые встроены последовательности нуклеиновых кислот, кодирующие репликативно-дефектную ретровирусную векторную частицу. В дополнительном варианте осуществления селективным маркером является ген устойчивости к антибиотикам, такой как ген устойчивости к зеоцину, канамицину или пуромицину, конкретно, ген устойчивости к зеоцину (ZeoR). В еще одном дополнительном варианте осуществления ген устойчивости к зеоцину получают из гена Streptoalloteichus hindustans ble, например, см. номер доступа генома X52869.1 из пар оснований от 3 до 377.
В одном из вариантов осуществления вектор на основе нуклеиновой кислоты дополнительно содержит полиA сигнал. Применение полиA сигнала имеет преимущество, заключающееся в способности защищать иРНК от ферментативной деградации и помощи при трансляции. В дополнительном варианте осуществления полиA сигнал получают из или извлекают из SV40, бычьего гормона роста и/или бета глобина человека. В одном из вариантов осуществления полиA сигнал получают из SV40 ранний полиA сигнал (например, см. номер доступа генома EF579804.1, пары оснований от 2668 до 2538 из минус цепи). В одном из вариантов осуществления полиA сигнал получают из полиA сигнала бета глобина человека (например, см. номер доступа генома GU324922.1, пары оснований от 3394 до 4162).
В одном из вариантов осуществления вектор на основе нуклеиновой кислоты дополнительно содержит интронную последовательность. Известно, что применение интрона ниже энхансерной/промоторной области и выше кДНК вставки (т.е. трансгена) повышает уровень экспрессии вставки. В дополнительном варианте осуществления интронной последовательностью является последовательность интрона бета глобина человека или интрона бета глобина кролика II. В одном из вариантов осуществления интрон бета глобина человека получают из последовательности, доступной по номеру доступа генома KM504957.1 (например, из пар оснований от 476 до 1393). В одном из вариантов осуществления интрон бета глобина кролика II получают из последовательности доступной по номеру доступа генома V00882.1 (например, из пар оснований от 718 до 1290).
В одном из вариантов осуществления вектор на основе нуклеиновой кислоты дополнительно содержит посттранскрипционный регуляторный элемент вируса гепатита сурков (WPRE). Было показано, что наличие WPRE усиливает экспрессию и по этой причине вероятно полезен для достижения высоких уровней экспрессии. В дополнительном варианте осуществления WPRE получают из последовательности, доступной по номеру доступа генома J04514.1 (например, из пар оснований от 1093 до 1684).
В одном из вариантов осуществления вектор на основе нуклеиновой кислоты дополнительно содержит внутренний участок связывания рибосомы (IRES). IRES является структурированным РНК элементом, который, как правило, обнаруживается в 5'-нетранслируемой области ниже 5'-кэпа (который необходим для сборки инициирующего комплекса). IRES распознается посредством факторов инициации трансляции, и обеспечивает кэп-независимую трансляцию. В дополнительном варианте осуществления IRES получают из генома вируса энцефаломиокрадита (EMCV) (например, см. номер доступа генома KF836387.1, пары оснований от 151 до 724).
В одном из вариантов осуществления вектор на основе нуклеиновой кислоты дополнительно содержит участок множественного клонирования (MCS). MCS является коротким сегментом ДНК внутри вектора на основе нуклеиновой кислоты, который содержит множественные участки рестрикции (например, 10, 15 или 20 сайтов). Эти сайты, как правило, встречаются только один раз внутри вектора на основе нуклеиновой кислоты, чтобы с целью обеспечения того, чтобы эндонуклеаза резала только в одном сайте. Это дает возможность генам ретровирусов с легкостью быть вставленными с применением соответствующих эндонуклеаз (т.е. рестрикционных ферментов).
Специалисту в данной области следует понимать, что конструкции могут располагаться в любом порядке внутри вектора на основе нуклеиновой кислоты. В иллюстративном варианте осуществления вектор на основе нуклеиновой кислоты содержит следующую вставку: последовательность ретровирусной нуклеиновой кислоты, кодирующая gag и pol белки, последовательность ретровирусной нуклеиновой кислоты, кодирующая env белок или его функциональный заменитель (такой как VSVg), последовательность ретровирусной нуклеиновой кислоты, кодирующая вспомогательный ген rev (такая как кодон-оптимизированная rev последовательность) или аналогичный ему ген или функционально аналогичную систему, репрессорный белок оперона устойчивости к тетрациклину (TetR), внутренний участок связывания рибосомы и селективный маркер (такой как селективный маркер устойчивости к зеоцину) (т.е. GagPol-Env-Rev-TetRepressor-IRES-маркер устойчивости к антибиотикам-остающаяся BAC последовательность («BAC остов»); например: GagPol-(дикого типа)VSVg-(кодон-оптимизированный)Rev-TetRepressor-IRES-устойчивость к зеоцину-pSMARTBAC). В дополнительном варианте осуществления инсулятор (такой как хроматиновый инсулятор) присутствует между каждой из gagpol, env и rev последовательностей. В дополнительном варианте осуществления промотор присутствует до каждой из gagpol, env и rev последовательностей. В еще одном дополнительном варианте осуществления, по меньшей мере, одна копия последовательности вектора для переноса (т.е. содержащая последовательности нуклеиновых кислот, которые кодируют РНК генома ретровирусных векторных частиц) присутствует до gagpol последовательности.
В одном из вариантов осуществления вектор на основе нуклеиновой кислоты содержит следующую вставку: инсулятор (такой как хроматиновый инсулятор), промотор (такой как CMV промотор, необязательно содержащий последовательность Tet оперона), интрон (такой как интрон бета глобина человека), последовательность ретровирусной нуклеиновой кислоты, кодирующую gag и pol белки, ретровирусная нуклеиновая кислота, кодирующая RRE, полиA сигнал (такой как полиA сигнал бета глобина человека), инсулятор (такой как хроматиновый инсулятор), промотор (такой как CMV промотор, необязательно содержащий последовательность Tet оперона), интрон (такой как интрон бета глобина человека), последовательность ретровирусной нуклеиновой кислоты, кодирующая env белок или его функциональный заменитель (такой как VSVg), полиA сигнал (такой как полиA сигнал бета глобина человека), инсулятор (такой как хроматиновый инсулятор), промотор (такой как CMV промотор, необязательно содержащий последовательность Tet оперона), последовательность ретровирусной нуклеиновой кислоты, кодирующая вспомогательный ген rev или аналогичный ему ген или функционально аналогичную систему, полиA сигнал (такой как полиA сигнал бета глобина человека), инсулятор (такой как хроматиновый инсулятор), промотор (такой как CMV промотор), интрон (такой как интрон бета глобина кролика), репрессорный белок оперона устойчивости к тетрациклину (TetR), внутренний участок связывания рибосомы, селективный маркер (такой как селективный маркер устойчивости к зеоцину), полиA сигнал и участок множественного клонирования.
Последовательности нуклеиновых кислот могут быть введены в вектор на основе нуклеиновой кислоты последовательно. Это делает возможной селекцию после каждой интеграции для того, чтобы убедиться, что все требуемые последовательности нуклеиновых кислот успешно интегрированы в вектор на основе нуклеиновой кислоты. Альтернативно, по меньшей мере, две или более последовательностей нуклеиновых кислот вносятся в вектор на основе нуклеиновой кислоты одновременно.
Следует понимать, что дополнительные гены, описываемые в настоящем документе, могут быть введены в вектор на основе нуклеиновой кислоты посредством стандартных методов молекулярного клонирования, известных в данной области, например, с применением рестрикционных эндонуклеаз и методов лигирования. Кроме того, вектор на основе нуклеиновой кислоты, конкретно, BACs, PACs, фосмиды и/или космиды, может быть введен в бактериальные клетки-хозяева (такие как E. coli клетки, конкретно, E. coli штамм DH10B) стандартными способами, такими как электропорация.
USES
По дополнительному аспекту изобретения, предоставлен вектор на основе нуклеиновой кислоты, как определено в настоящем документе для применения при получении ретровирусной пакующей или продуцирующей линии клеток.
Векторы на основе нуклеиновых кислот, описываемые в настоящем документе, можно использовать для создания ретровирусной пакующей линии клеток, которая существенным образом упрощает продуцирование ретровирусного вектора. Следует понимать, что, если трансген включен в вектор на основе нуклеиновой кислоты, тогда это будет использовано для создания продуцирующей линии клеток.
Как описано в настоящем документе, будет полезным разработать стабильную ретровирусную пакующую (или продуцирующую) линию клеток с целью преодоления трудностей, связанных с временной трансфекцией. Векторы на основе нуклеиновых кислот, описываемые в настоящем документе, можно использовать для получения указанных пакующих линий клеток, поскольку они способны удерживать крупные ДНК вставки, содержащие обязательные гены, требуемые для ретровирусной упаковки, которые затем могут быть интегрированы в эндогенный геном клеток млекопитающего в один этап.
КЛЕТКИ-ХОЗЯЕВА
По дополнительному аспекту изобретения, предоставлена ретровирусная упаковывающая клетка, содержащая последовательности нуклеиновых кислот, кодирующие:
gag и pol белки; и
env белок или его функциональный заменитель,
где указанные последовательности нуклеиновых кислот все расположены в едином локусе внутри генома ретровирусной упаковывающей клетки.
Преимуществом включения всех генов ретровирусов в крупный вектор на основе нуклеиновой кислоты является то, что их сначала можно получать в микробных клетках (таких как бактериальные или дрожжевые клетки), которые гораздо легче поддерживать и обрабатывать, до интеграции в клетки млекопитающего в один этап. Это облегчает давление отбора и сокращает временной период сайленсинга, как только гены ретровирусов были интегрированы в клетку млекопитающего. Характерной чертой этого способа является то, что все гены ретровирусов, требуемые для создания пакующей линии клеток присутствуют в едином локусе в эндогенном геноме, а не рассеяны случайным образом на всем протяжении эндогенного генома. Преимуществом этого является продуцирование ретровирусной упаковывающей клетки, которая экспрессирует все гены ретровирусов на одном и том же уровне, поскольку они расположены в едином локусе, по сравнению с предшествующими способами, при которых гены ретровирусов интегрированы случайным образом на всем протяжении эндогенного генома, что может привести к неравномерным уровням экспрессии.
В одном из вариантов осуществления ретровирусная упаковывающая клетка дополнительно содержит последовательности нуклеиновых кислот, которые кодируют РНК геном ретровирусных векторных частиц. Она также может быть расположена в едином локусе с последовательностями нуклеиновых кислот, кодирующими gag и pol белки и env белок или его функциональный заменитель.
Таким образом, по дополнительному аспекту изобретения, предоставлена ретровирусная продуцирующая клетка, содержащая последовательности нуклеиновых кислот, кодирующие:
gag и pol белки;
env белок или его функциональный заменитель; и
РНК геном ретровирусных векторных частиц,
где указанные последовательности нуклеиновых кислот все расположены в едином локусе внутри генома ретровирусной продуцирующей клетки.
В одном из вариантов осуществления ретровирусная упаковывающая клетка является клеткой млекопитающего. В дополнительном варианте осуществления клетка млекопитающего выбрана из HEK 293 клетки, CHO клетки, Jurkat клетки, KS62 клетки, PerC6 клетки, HeLa клетки или их производного или функционального эквивалента. В еще одном дополнительном варианте осуществления клеткой млекопитающего является HEK 293 клетка, или полученная из HEK 293 клетка. Такие клетки могут быть адгезивными линиями клеток (т.е. они растут в один слой, прикрепленный к поверхности) или суспензионно адаптированными/неадгезивными линиями клеток (т.е. они растут в суспензии в среде для культивирования). В еще одном дополнительном варианте осуществления HEK 293 клеткой является HEK 293T клетка. Термин «HEK 293 клетка» относится к линии клеток эмбриональной почки человека 293, которая широко используется в биотехнологии. Конкретно, HEK 293T клетки широко используются для получения различных ретровирусных векторов. Другие примеры подходящих коммерчески доступных линий клеток включают линии клеток T REX™ (Life Technologies).
Следует понимать, что все варианты осуществления, описываемые для вектора на основе нуклеиновой кислоты в настоящем документе ранее, также могут быть применены к ретровирусным пакующим/продуцирующим клеткам по изобретению.
СПОСОБЫ
По дополнительному аспекту изобретения, предоставлен способ получения стабильной ретровирусной пакующей линии клеток, содержащий:
(a) введение вектора на основе нуклеиновой кислоты, как описано в настоящем документе в культуру клеток млекопитающего; и
(b) отбор в культуре клеток млекопитающего, которые содержат последовательности нуклеиновых кислот, кодируемые на векторе, интегрированном в эндогенную хромосому клетки млекопитающего.
В одном из вариантов осуществления клетка млекопитающего выбрана из HEK 293 клетки, HEK 6E клетки, CHO клетки, Jurkat клетки, KS62 клетки, PerC6 клетки, HeLa клетки или их производного или функционального эквивалента. В дополнительном варианте осуществления клеткой млекопитающего является HEK 293 клетка, или полученная из HEK 293 клетка. Такие клетки могут быть адгезивными линиями клеток (т.е. они растут в один слой, прикрепленный к поверхности) или суспензионно адаптированными/неадгезивными линиями клеток (т.е. они растут в суспензии в среде для культивирования). В еще одном дополнительном варианте осуществления HEK 293 клеткой является HEK 293T клетка или HEK 6E клетка. Другие примеры подходящих коммерчески доступных линий клеток включают линии клеток T REX™ (Life Technologies).
Специалист должен осознавать, что введение вектора на основе нуклеиновой кислоты в клетку-хозяин можно проводить с применением подходящих известных в данной области способов, например, липид-опосредованная трансфекция, микроинъекция, слияние клеток (таких как микроклетки), электропорация или бомбардировка микрочастицами. В одном из вариантов осуществления вектор на основе нуклеиновой кислоты введен в клетку-хозяин посредством электропорации. Следует понимать, что выбор способа, применяемого для введения вектора на основе нуклеиновой кислоты, может быть сделан в зависимости от используемого типа клетки млекопитающего.
Оказавшись внутри клетки млекопитающего, вектор на основе нуклеиновой кислоты случайным образом интегрируется в эндогенный геном клетки млекопитающего. Таким образом, способ дополнительно содержит отбор клетки млекопитающего, в которую интегрировались нуклеиновые кислоты, кодируемые на векторе на основе нуклеиновой кислоты (например, с использованием селективного маркера устойчивости к антибиотикам, такого как маркер устойчивости к зеоцину).
Специалист обычно осведомлен о способах, содействующих интеграции вектора нуклеиновой кислоты, например, линеаризация вектора на основе нуклеиновой кислоты, если он в природных условиях является кольцевым (например, BACs, PACs, космиды или фосмиды). Вектор на основе нуклеиновой кислоты может дополнительно содержать области совместной гомологии с эндогенными хромосомами клетки млекопитающего для направления интеграции в выбранный сайт внутри эндогенного генома. Кроме того, если на векторе на основе нуклеиновой кислоты присутствуют сайты рекомбинации, тогда их можно использовать для целенаправленной рекомбинации. Например, вектор на основе нуклеиновой кислоты может содержать loxP сайт, который обеспечивает целенаправленную интеграцию при комбинации с Cre рекомбиназой (т.е. с применением Cre/lox системы, полученной из P1 бактериофага). Альтернативно (или дополнительно), сайтом рекомбинации является att сайт (например, из фага лямбда), где att сайт позволяет произвести сайт-направленную интеграцию в присутствии лямбда-интегразы. Это обеспечит возможность генам ретровирусов быть направленными в локус внутри эндогенного генома, что обеспечит высокую и/или стабильную экспрессию.
Другие способы направленной интеграции хорошо известны в данной области. Например, способы индуцирования целенаправленного расщепления геномной ДНК можно использовать для содействия целенаправленной рекомбинации в выбранном хромосомном локусе. Эти способы часто предполагают применение сконструированных систем расщепления для индуцирования двухцепочечной поломки (DSB) или проникновение в эндогенный геном для индуцирования репарации поломки посредством естественных процессов, таких как негомологичное соединение концов (NHEJ) или репарация с использованием матрицы репарации (т.е. направляемая гомологией репарация или HDR).
Расщепление может происходить посредством использования специфических нуклеаз, таких как сконструированные нуклеазы «цинковые пальцы» (ZFN), эффекторные нуклеазы, подобные активаторам транскрипции (TALENs), с применением CRISPR/Cas9 системы со сконструированной cрРНК/tracr РНК (однонаправленная РНК') для направления специфического расщепления, и/или с применением нуклеаз на основе системы Аргонавт (например, из T. thermophilus, известной как 'TtAgo', см. Swarts et al. (2014) Nature 507(7491): 258-261). Целенаправленное расщепление с применением одной из этих нуклеазных систем может быть использовано для вставки нуклеиновой кислоты в специфическое целевое положение с использованием или HDR, или NHEJ-опосредованных процессов. Таким образом, в одном из вариантов осуществления способ дополнительно содержит интеграцию последовательностей нуклеиновых кислот, кодируемых на векторе на основе нуклеиновой кислоты в геном (т.е. эндогенную хромосому) клетки млекопитающего с использованием, по меньшей мере, одной нуклеазы, где, по меньшей мере, одна нуклеаза расщепляет геном клетки млекопитающего, таким образом, что последовательности нуклеиновых кислот интегрируются в геном клетки. В дополнительном варианте осуществления, по меньшей мере, одна нуклеаза выбрана из группы, состоящей из нуклеазы «цинковые пальцы» (ZFN), TALE нуклеазы (TALEN), CRISPR/Cas нуклеазной системы и их сочетания.
По дополнительному аспекту изобретения, предоставлена ретровирусная упаковывающая клетка, полученная посредством способа, определенного в настоящем документе.
Линию клеток, полученную с использованием способов, определенных в настоящем документе, можно использовать для продуцирования высокого титра ретровирусного вектора.
Указания в настоящем документе на термин «высокий титр» относятся к эффективному количеству ретровирусного вектора или частиц, которое способно трансдуцировать клетку-мишень, такую как клетка пациента. В одном из вариантов осуществления высоким титром является более 106 TU/мл без концентрирования (TU=трансдуцирующие единицы).
По дополнительному аспекту изобретения, предоставлен способ получения репликативно-дефектной ретровирусной векторной частицы, содержащий:
(a) введение вектора на основе нуклеиновой кислоты, как определено в настоящем документе, в культуру клеток млекопитающего;
(b) отбор в культуре клеток млекопитающего, которые содержат последовательности нуклеиновых кислот, кодируемые на векторе, интегрированном в эндогенную хромосому клетки млекопитающего; и
(c) дополнительное культивирование клетки млекопитающего в условиях, при которых получают репликативно-дефектную ретровирусную векторную частицу.
Как описано в настоящем документе ранее, в одном из вариантов осуществления клетка млекопитающего выбрана из HEK 293 клетки, CHO клетки, Jurkat клетки, KS62 клетки, PerC6 клетки, HeLa клетки или их производного или функционального эквивалента. В дополнительном варианте осуществления клеткой млекопитающего является HEK 293 клетка, или полученная из HEK 293 клетка. Такие клетки могут быть адгезивными линиями клеток (т.е. они растут в один слой, прикрепленный к поверхности) или суспензионно адаптированными/неадгезивными линиями клеток (т.е. они растут в суспензии в среде для культивирования). В еще одном дополнительном варианте осуществления HEK 293 клеткой является HEK 293T клетка. Другие примеры подходящих коммерчески доступных линий клеток включают линии клеток T REX™ (Life Technologies).
Специалисту следует понимать, что условия, применяемые в способе, описываемом в настоящем документе, будут применяться в зависимости от клетки-хозяина. Типичные условия, например, предназначенная среда для культивирования или температура, хорошо известны в данной области. В одном из вариантов осуществления культивирование проводят посредством инкубации клетки млекопитающего в условиях увлажнения воздуха. В дополнительном варианте осуществления условия увлажнения воздуха включают инкубацию трансфицированных клеток при 37°C, при 5% CO2. В одном из вариантов осуществления культивирование проводят с использованием среды для культивирования, выбранной из: модифицированной Дульбекко среды Игла (DMEM), содержащей 10% (vol/vol) эмбриональной телячьей сыворотки (FBS), бессывороточной среды UltraCULTURETM (Lonza, каталожн. № 12-725F), или среды FreeStyleTM Expression (Thermo fisher, каталожн. № 12338 018).
В одном из вариантов осуществления способ дополнительно содержит выделение репликативно-дефектной ретровирусной векторной частицы. Например, в одном из вариантов осуществления выделение проводят посредством использования фильтра. В дополнительном варианте осуществления фильтром является мембрана с низким связыванием белков (например, 0,22 мкм мембрана с низким связыванием белков или 0,45 мкм мембрана с низким связыванием белков), например, искусственные мембраны на основе поливинилиден фторида (PVDF) или простого полиэфирсульфона (PES).
Оказавшись внутри клетки млекопитающего, нуклеиновые кислоты ретровирусов, присутствующие на векторе на основе нуклеиновой кислоты, могут интегрироваться в случайный, один локус внутри эндогенного генома. Этапу интеграции можно способствовать, как описано в настоящем документе ранее, например, с применением линеаризации и/или областей совместной гомологии. Сайты рекомбинации также можно использовать для целенаправленной рекомбинации.
Если целевые гены интегрированы в эндогенные хромосомы с селективным маркером, таким как ген устойчивости к антибиотикам, тогда способ может дополнительно содержать отбор клеток млекопитающего, в которые нуклеиновые кислоты ретровирусов успешно интегрировались.
Будучи изолированными, ретровирусные векторные частицы могут быть сконцентрированы с целью in vivo применения. Способы концентрации включают, например, ультрацентрифугирование, осаждение или анионообменную хроматографию. Ультрацентрифугирование пригодно в качестве быстрого способа концентрации ретровирусного вектора в небольшом объеме. Альтернативно, анионообменная хроматография (например, с использованием анионобменных мембранных картриджей Mustang Q) или осаждение (например, с использованием PEG 6000) особенно пригодны для обработки крупных объемов супернатантов с лентивирусным вектором.
По дополнительному аспекту изобретения, предоставлена репликативно-дефектная ретровирусная векторная частица, полученная посредством способа, определенного в настоящем документе.
Изобретение будет описано ниже в подробностях с ссылкой на следующие неограничивающие примеры.
ПРИМЕРЫ
ПРИМЕР 1: Руководство по конструированию
На фигуре 1 представлена пошаговое руководство по конструированию BACpack-WTGP-277delU5 и BACpack-SYNGP-277delU5. Благодаря совместимым концам XbaI и NheI лизата, лентивирусные гены упаковки постепенно были загружены в pSmart BAC вектор. В момент добавления GagPol, были сделаны 2 конструкции, содержащие или GagPol дикого типа (WTGP), или кодон-оптимизированный GagPol, SYNGP. Им были даны обозначения BACpack-WTGP и BACpack-SYNGP, соответственно. Кассета переноса затем была загружена на обе эти конструкции и, таким образом, образовывая BACpackWTGP-277delU5 и BACpackSYNGP-277delU5.
ПРИМЕР 2: Отбор стабильного поликлонального пула
Поликлональные пулы стабильных трансфектантов получали посредством трансфицирования адгезивной линии клеток, HEK293T, с применением BACpackSYNGP-277delU5 или BACpackWTGP-277delU5. Успешные случаи интеграции были затем отобраны с применением зеоцина.
Чтобы оценить способность этих поликлональных пулов образовывать лентивирусный вектор, клетки индуцировали с применением доксициклина (I) или оставляли неиндуцированными (UI) и сравнивали с нетрансфицированными HEK293T клетками.
Результаты демонстрируют титр в трансдуцирующих единицах (TU)/мл супернатанта лентивирусного вектора, собранного при каждом трансфекционном состоянии. Из результатов титрования можно увидеть на фигуре 2, что стабильные поликлональные пулы, образованные с применением BACpackSYNGP-277delU5 или BACpackWTGP-277delU5 способны к продуцированию лентивирусного вектора при концентрациях в области 10e7 TU/мл, которая сравнима с существующей системой временной трансфекции.
Результаты подтверждают, что единый BAC вектор, содержащий все гены упаковки, необходимые для лентивирусного продуцирования, могут образовывать линии клеток, способные продуцировать лентивирусный вектор при подходящем титре.
ПРИМЕР 3: Создание стабильной трансфекции суспензионных клонов
Первичной целью создания линий клеток, продуцирующих лентивирусный вектор с использованием BAC технологии, является быстрое приложение новых достижений к платформе. Эти достижения вероятно включают модификацию специализированных линий клеток. Например, стандартной для данной отрасли практикой является повысить выход посредством продуцирования биологических продуктов в суспензии клеток, поскольку они растут до большей плотности, чем адгезивные клетки. Однако существующая система продуцирования лентивирусного вектора основана на высоких скоростях трансфекции, которые являются более трудными для достижения в суспензии клеток, чем в адгезивных HEK293T клетках. Поскольку эффективность трансфекции является менее проблематичной при образовании стабильной линии клеток вследствие отбора успешных интегрантов, BAC конструкция является идеальным решением для создания суспензионных линий клеток, продуцирующих лентивирусный вектор.
Как было продемонстрировано ранее, BAC конструкция способна создавать линии клеток, продуцирующие лентивирусный вектор, из адгезивных HEK293T клеток. Чтобы доказать гибкость BAC конструкций, стабильно трансфицированные линии клеток получали из суспензионной линии клеток HEK293 6E. HEK293 6E клетки трансфицировали с применением BAC конструкции BACpackWTGP-277delU5, затем отбираемой с применением зеоцина. За этим следовало клонирование для создания клональных линий клеток. Результаты на фигуре 3 демонстрируют GFP сигнал, созданный стабильными линиями клеток. Это указывает как на наличие устойчивости к зеоцину, так и функциональной GFP экспрессирующей кассеты в сегменте вектора для переноса.
Эти результаты позволяют предположить, что BAC конструкция способна образовывать стабильные клоны из множества линий клеток.
ПРИМЕР 4: Индукция лентивируса в суспензионных клонах
С целью подтверждения способности стабильных суспензионных клонов продуцировать лентивирусный вектор, клоны 1, 14, 15 и 16, были индуцированы с применением 2 мкг/мл доксициклина, и супернатант оценивали на предмет вирусного титра посредством трансдукции HEK293T клеток.
Результаты на фигуре 4 демонстрируют титр в трансдуцирующих единицах (TU)/мл супернатанта лентивирусного вектора, собранного от каждого клона. Результаты ясно показывают, что линии клеток, созданные посредством стабильной трансфекции суспензионной линии клеток HEK293 6E с применением BACpackWTGP-277delU5, способны к продуцированию лентивирусного вектора с выходом, сравнимым с существующей системой временной трансфекции.
ПРИМЕР 5: Титр вектора в клонах
Клоны 1 и 16, как описано на фигуре 4, пассировали в культуре и индуцировали и титровали в более поздние временные точки, чтобы определить является ли продуцирование вектора стабильным от этих высоко продуктивных клонов. Как показано на фигурах 5A и 5B, титры вектора от этих клонов действительно немного повышались между пассажем 5 и пассажем 21, возможно, вследствие повышения концентрации натрия бутирата, введенного в способ индукции.
Следует понимать, что варианты осуществления, описываемые в настоящем документе, могут быть применены ко всем аспектам изобретения. Кроме того, все публикации, включая в качестве неограничивающих примеров патенты и патентные заявки, цитированные в этом описании изобретения, включены в настоящий документ в качестве ссылки, как если бы полностью были изложены.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВРЕМЕННОЙ ТРАНСФЕКЦИИ ДЛЯ ПРОДУЦИРОВАНИЯ РЕТРОВИРУСА | 2016 |
|
RU2749717C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ МУЛЬТИПОТЕНТНЫХ КЛЕТОЧНЫХ ПОПУЛЯЦИЙ | 2008 |
|
RU2535365C2 |
| УСОВЕРШЕНСТВОВАНИЕ ГЕНЕТИЧЕСКИХ КОНСТРУКЦИЙ ДЛЯ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ АНТИВИЧ ТЕРАПИИ | 2013 |
|
RU2533817C1 |
| ВЕКТОРЫ ДЛЯ ПРОИЗВОДСТВА БЕЛКОВ | 2019 |
|
RU2820218C2 |
| ВЕКТОРНАЯ СИСТЕМА НА ОСНОВЕ ASLV | 2010 |
|
RU2566563C2 |
| ВИРУСНЫЕ ВЕКТОРЫ С ЗАВИСИМОЙ ОТ УСЛОВИЙ РЕПЛИКАЦИЕЙ И ИХ ПРИМЕНЕНИЕ | 2001 |
|
RU2301260C2 |
| КОМПОЗИЦИИ ПРОМОТОРОВ | 2014 |
|
RU2742435C2 |
| ДВОЙНОЙ ВЕКТОР ДЛЯ ПОДАВЛЕНИЯ ВИРУСА ИММУНОДЕФИЦИТА ЧЕЛОВЕКА | 2010 |
|
RU2562868C2 |
| ПРИМЕНЕНИЕ АДАПТИРОВАННЫХ РЕКОМБИНАЗ ДЛЯ ЛЕЧЕНИЯ РЕТРОВИРУСНЫХ ИНФЕКЦИЙ | 2008 |
|
RU2501860C2 |
| КОМПОЗИЦИИ, ПОВЫШАЮЩИЕ ЧИСЛО КОПИЙ ВЕКТОРА (ЧКВ), И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2744603C2 |
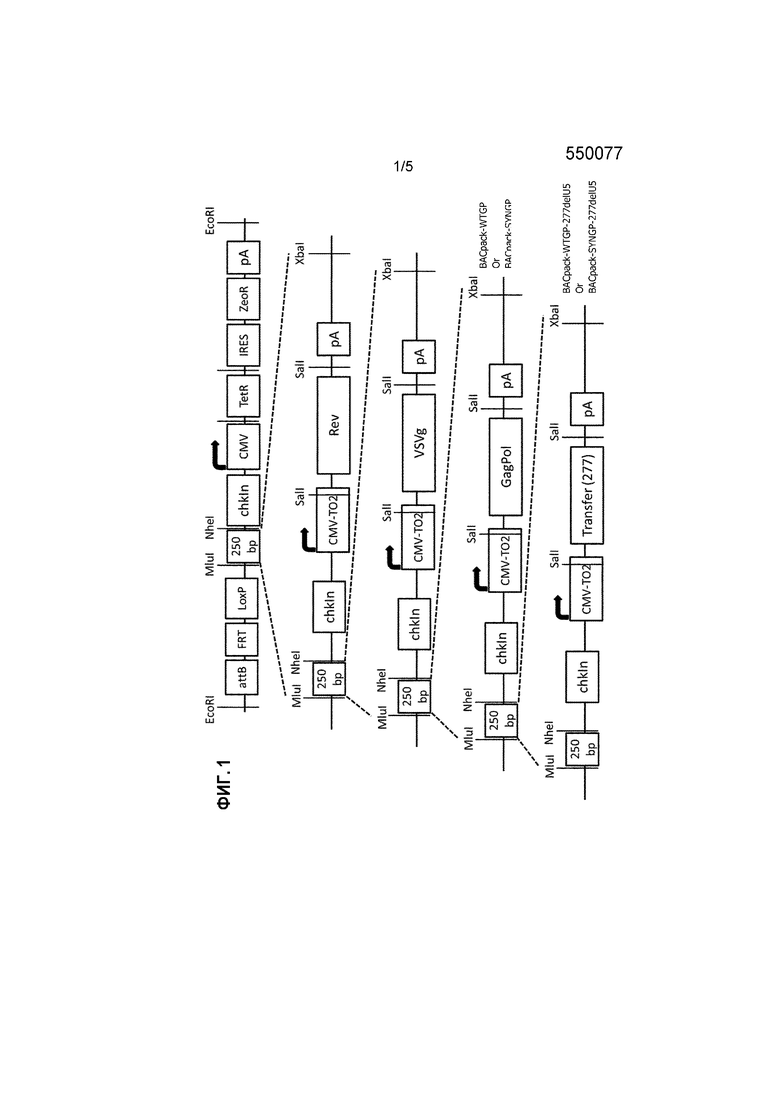
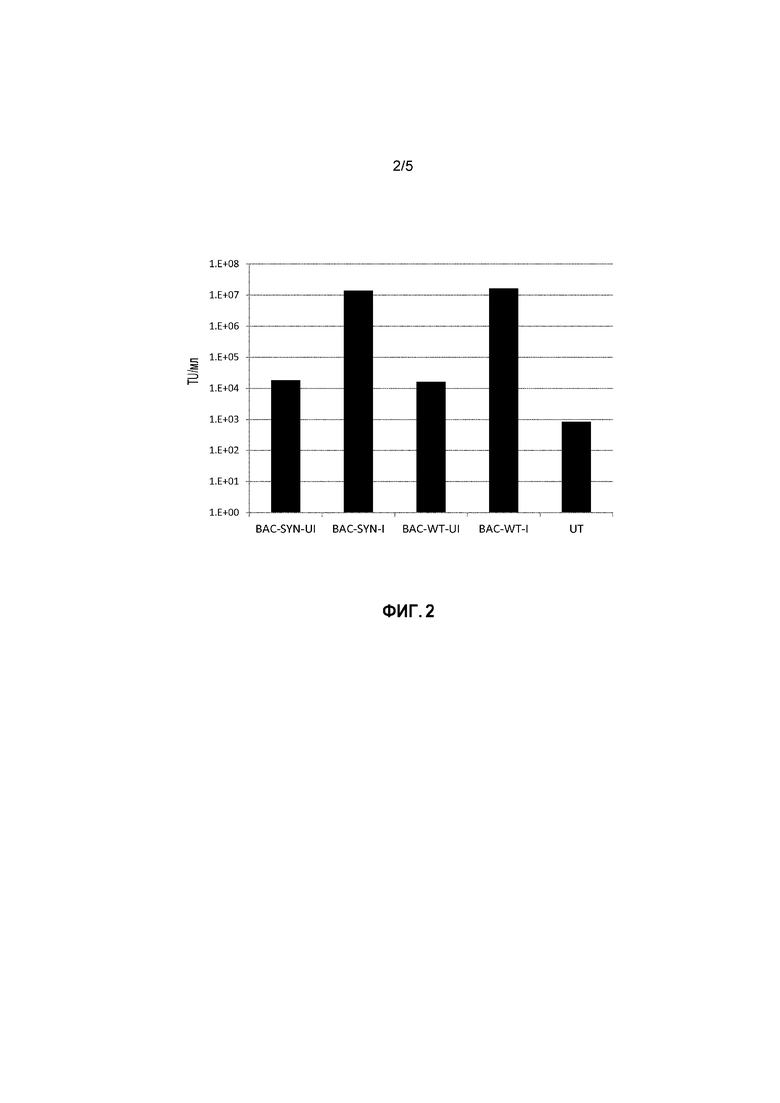


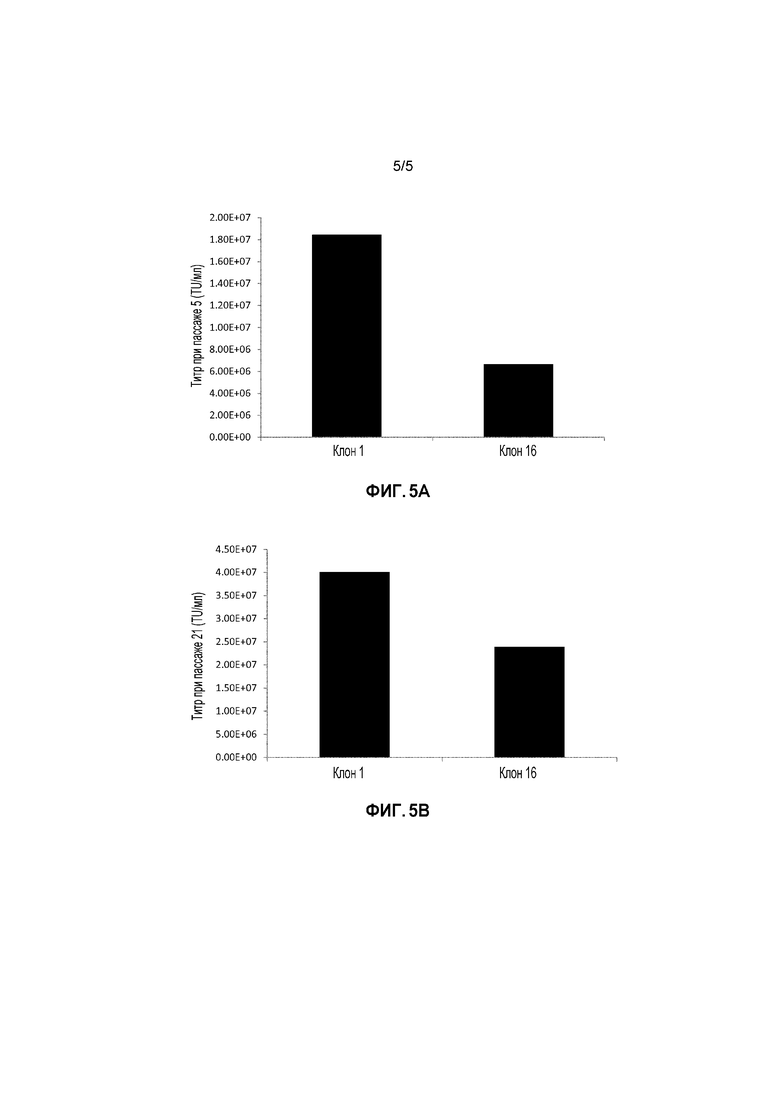
Изобретение относится к биотехнологии. Описан вектор на основе нуклеиновых кислот для получения стабильной пакующей ретровирус клеточной линии, где вектор на основе нуклеиновых кислот содержит не присущий млекопитающим участок начала репликации и способность удерживать по меньшей мере 25 тысяч пар нуклеотидов (т.п.н.) ДНК, и характеризуется тем, что указанный вектор на основе нуклеиновых кислот выбирают из искусственной хромосомы бактерий (BAC), искусственной хромосомы дрожжей (YAC), P1-полученной искусственной хромосомы, фосмиды или космиды, и содержит ретровирусные последовательности нуклеиновых кислот, кодирующие: gag и pol белки, и env белок, где каждая из ретровирусных последовательностей нуклеиновых кислот имеет свой собственный промотор внутри вектора на основе нуклеиновых кислот и один или множество сайтов рекомбинации для интеграции указанных последовательностей нуклеиновых кислот в эндогенную хромосому клетки-хозяина млекопитающего сайт-специфичным образом. Изобретение также относится к применениям и способам, в которых используется указанный вектор на основе нуклеиновой кислоты с целью продуцировать стабильные линии клеток, пакующие и продуцирующие ретровирусы. Изобретение расширяет арсенал средств для продуцирования ретровирусных векторов. 4 н. и 13 з.п. ф-лы, 5 ил., 5 пр.
1. Вектор на основе нуклеиновых кислот для получения стабильной пакующей ретровирус клеточной линии, где вектор на основе нуклеиновых кислот содержит не присущий млекопитающим участок начала репликации и способность удерживать по меньшей мере 25 тысяч пар нуклеотидов (т.п.н.) ДНК и характеризуется тем, что указанный вектор на основе нуклеиновых кислот выбирают из искусственной хромосомы бактерий (BAC), искусственной хромосомы дрожжей (YAC), P1-полученной искусственной хромосомы, фосмиды или космиды, и содержит ретровирусные последовательности нуклеиновых кислот, кодирующие:
gag и pol белки, и
env белок,
где каждая из ретровирусных последовательностей нуклеиновых кислот имеет свой собственный промотор внутри вектора на основе нуклеиновых кислот и один или множество сайтов рекомбинации для интеграции указанных последовательностей нуклеиновых кислот в эндогенную хромосому клетки-хозяина млекопитающего сайт-специфичным образом.
2. Вектор на основе нуклеиновых кислот по п. 1, который дополнительно содержит последовательности нуклеиновых кислот, которые кодируют РНК геном ретровирусной векторной частицы.
3. Вектор на основе нуклеиновых кислот по п. 1 или 2, который дополнительно содержит вспомогательный ген rev или аналогичный ему ген.
4. Вектор на основе нуклеиновых кислот по любому из пп. 1-3, где вектором является бактериальная искусственная хромосома.
5. Способ получения стабильной пакующей ретровирус клеточной линии, содержащий:
(a) введение вектора на основе нуклеиновых кислот по любому из пп. 1-4 в культуру клеток-хозяев млекопитающего; и
(b) отбор внутри культуры клетки-хозяина млекопитающего, которая имеет последовательности нуклеиновых кислот, кодируемые на векторе, интегрированном внутрь эндогенной хромосомы клетки-хозяина млекопитающего.
6. Способ по п. 5, где вектор на основе нуклеиновых кислот дополнительно содержит последовательности нуклеиновых кислот, которые кодируют РНК геном ретровирусной векторной частицы.
7. Способ по п. 5 или 6, где вектор на основе нуклеиновых кислот дополнительно содержит вспомогательный ген rev или аналогичный ему ген.
8. Способ по любому из пп. 5-7, где вектор на основе нуклеиновых кислот представляет собой BAC.
9. Способ по любому из пп. 5-8, где клетка млекопитающего представляет собой HEK 293 клетку.
10. Способ по любому из пп. 5-9, где клетка млекопитающего представляет собой суспензионно адаптированную/неадгезивную клетку.
11. Пакующая ретровирус клетка, полученная посредством способа по любому из пп. 6-10, где все указанные последовательности нуклеиновых кислот расположены в одном локусе в пределах генома пакующей ретровирус клетки.
12. Способ получения репликативно-дефектной ретровирусной векторной частицы, содержащий:
(a) введение вектора на основе нуклеиновых кислот по любому из пп. 1-4 в культуру клеток-хозяев млекопитающего;
(b) отбор внутри культуры клетки-хозяина млекопитающего, которая имеет последовательности нуклеиновых кислот, кодируемые на векторе, интегрированном внутрь эндогенной хромосомы клетки-хозяина млекопитающего; и
(c) дополнительное культивирование клетки-хозяина млекопитающего в условиях, при которых получают репликативно-дефектную ретровирусную векторную частицу.
13. Способ по п. 12, дополнительно содержащий выделение репликативно-дефектной ретровирусной векторной частицы.
14. Способ по любому из пп. 5-13, где ретровирусные последовательности нуклеиновых кислот выделяют из ретровируса, выбранного из лентивируса, альфа-ретровируса, гамма-ретровируса или пенящего ретровируса.
15. Способ по п. 14, где ретровирусные последовательности нуклеиновых кислот выделяют из лентивируса, выбранного из группы, состоящей из ВИЧ-1, ВИЧ-2, SIV, FIV, EIAV и висна.
16. Способ по п. 15, где ретровирусные последовательности нуклеиновых кислот выделяют из ВИЧ-1.
17. Способ по любому из пп. 5-13, где env белок выделяют из вируса везикулярного стоматита.
| КОМПОЗИЦИИ И СПОСОБЫ ДОСТАВКИ ГЕНЕТИЧЕСКОГО МАТЕРИАЛА | 1994 |
|
RU2174845C2 |
| WO 2012028681 A1, 08.03.2012 | |||
| Замочный механизм висячего замка | 1929 |
|
SU18124A1 |
| ФОРМУЛА КОШАЧЬЕЙ ВАКЦИНЫ | 2002 |
|
RU2312676C2 |
| СПОСОБ ГЕНЕТИЧЕСКОЙ МОДИФИКАЦИИ ИНТЕРЕСУЮЩЕГО ЭНДОГЕННОГО ГЕНА ИЛИ ХРОМОСОМНОГО ЛОКУСА (ВАРИАНТЫ) И ЕГО ИСПОЛЬЗОВАНИЕ | 2001 |
|
RU2290441C2 |
| Способ нагрева прессующего полотна непрерывно работающего пресса и устройство для его осуществления | 1990 |
|
SU1829963A3 |
| Приспособление для записи прогибов железнодорожного пути | 1927 |
|
SU12723A1 |
| ПОЛИВАЛЕНТНЫЕ ВИРУСНЫЕ ВЕКТОРЫ И СИСТЕМА ДЛЯ ИХ ПОЛУЧЕНИЯ | 2005 |
|
RU2416646C2 |
| КАПСУЛА ДЛЯ КЛЕТОК, ПРОДУЦИРУЮЩИХ ВИРУСНЫЕ ЧАСТИЦЫ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ИСПОЛЬЗОВАНИЯ | 1996 |
|
RU2187301C2 |
Авторы
Даты
2021-07-28—Публикация
2016-11-21—Подача