Изобретение относится к области ветеринарной вирусологии и биотехнологии, может быть использовано для разработки и изготовления средств диагностики и специфической профилактики инфекционного ринотрахеита кошек и контроля антигенной и иммуногенной активности вакцин против данного заболевания.
Инфекционный ринотрахеит кошек - контагиозное вирусное заболевание, характеризующееся поражением верхних дыхательных путей, конъюнктивитами и кератитами [1, 2]. Возбудителем инфекционного ринотрахеита кошек является вирус, принадлежащий к семейству Herpesviridae, роду Varicellovirus, виду Alphaherpesvirus 1 (FHV-1 - Felid alphaherpesvirus-1) [3]. FHV-1 был впервые выделен в США в 1957 году от кошки с симптомами заболевания верхних дыхательных путей [4]. Инфекционный ринотрахеит был зарегистрирован у многих представителей семейства кошачьих, таких как европейских дикие кошки (Felis silvestris silvestris), песчаные кошки (Felis margarita), леопардовые кошки (Felis bengalensis), гепарды (Acinonyx jubatus), горные львы (Puma concolor), оцелоты (Leopardus pardalis) и др. [2]. К инфекции восприимчивы как взрослые кошки всех пород, так и котята, но у молодых животных, зараженных FHV-1, нередок летальный исход в результате осложнения пневмонией [5]. Также в литературе описаны случаи развития менингоэнцефалита в результате заражения FHV-1 [2, 6] После острой фазы заболевание часто переходит в латентную форму с пожизненным вирусоносительством [7]. Исследователи из Австралии определили серопревалентность FHV-1 на уровне 11-17% у диких представителей семейства кошачьих и 37% у домашних кошек, однако, по другим оценкам около 90% кошек считаются серопозитивными по отношению к FHV-1, из них 45% выделяют вирус в течение всей жизни [4, 8].
В настоящее время известны следующие штаммы вируса инфекционного ринотрахеита кошек, которые применяются для диагностики FHV-1, а также производства вакцин против данного заболевания: штамм «F-2», штамм «G 2620А», штамм «FVRm», штамм «Гранд» [9-12].
Штаммы «F-2», «G 2620А», «FVRm» входят в состав импортных ассоциированных вакцин против инфекционных болезней кошек, однако, на территории РФ данные импортные препараты имеют высокую стоимость.
Наиболее близким предполагаемому изобретению по совокупности существенных признаков является штамм «Гранд» вируса инфекционного ринотрахеита кошек, используемый для изготовления отечественной ассоциированной вакцины «Мультифел», однако, молекулярно-генетические свойства данного штамма в литературе не представлены [12].
Все штаммы FHV-1 принадлежат к одной серогруппе, хотя для некоторых штаммов были зафиксированы незначительные генетические изменения [1, 4, 13]. Генетически и антигенно FHV-1 имеет сходство с герпесвирусом собак 1-го типа (CHV-1), а также герпесвирусом тюленей 1-го типа (PhHV-1). Есть сообщения о перекрестной защите между FHV-1 и PhHV-1 [1].
Задача, на решение которой направлено настоящее изобретение, заключается в расширении арсенала производственных штаммов вируса инфекционного ринотрахеита кошек, обладающих новыми биологическими и генетическими характеристиками, и пригодных для изготовления средств диагностики и специфической профилактики данного заболевания. Указанная задача решена в результате депонирования нового штамма «Лавр» вируса инфекционного ринотрахеита кошек, который может быть использован для проведения лабораторных исследований и изготовления средств вакцинопрофилактики.
Изолят вируса инфекционного ринотрахеита кошек, послуживший источником для получения штамма «Лавр» был выделен из патологического материала, полученного от кота, поступившего на лечение в ветеринарную клинику ВООО Центра животных «Валента» г. Владимир, в 2021 г.
Штамм «Лавр» депонирован во Всероссийской государственной коллекции экзотических типов вируса ящура и других патогенов животных (ГКШМ) ФГБУ «ВНИИЗЖ» под регистрационным номером: №457-деп/23-7 ГКШМ ФГБУ «ВНИИЗЖ».
Экспериментально подтверждена возможность использования штамма «Лавр» вируса инфекционного ринотрахеита кошек для изготовления средств диагностики и специфической профилактики данного заболевания.
Для получения штамма «Лавр» вируса Alphaherpesvirus 1 инфекционного ринотрахеита кошек, обладающего оптимальными биотехнологическими свойствами, использовали первично-трипсинизированную и субкультуру клеток почки котенка (ПК). В результате проведения серии последовательных пассажей на данной культуре клеток и перевиваемой культуре клеток почки кошки (CRFK) из ранее выделенного изолята был получен штамм «Лавр» вируса Alphaherpesvirus 1 инфекционного ринотрахеита кошек, имеющий необходимые биотехнологические свойства и пригодный для изготовления диагностических препаратов и препаратов специфической профилактики данного заболевания. Штамм адаптирован к перевиваемой культуре клеток почки кошки (CRFK), что позволяет в промышленных масштабах получать вирусный материал штамма «Лавр» вируса инфекционного ринотрахеита кошек с титрами инфекционной активности не менее 6,5 lg ТЦД50/см3.
Генетическую идентификацию полученного вируса и сравнительный анализ последовательности ДНК проводят с помощью полимеразной цепной реакции. Для идентификации и филогенетического анализа осуществлено секвенирование.
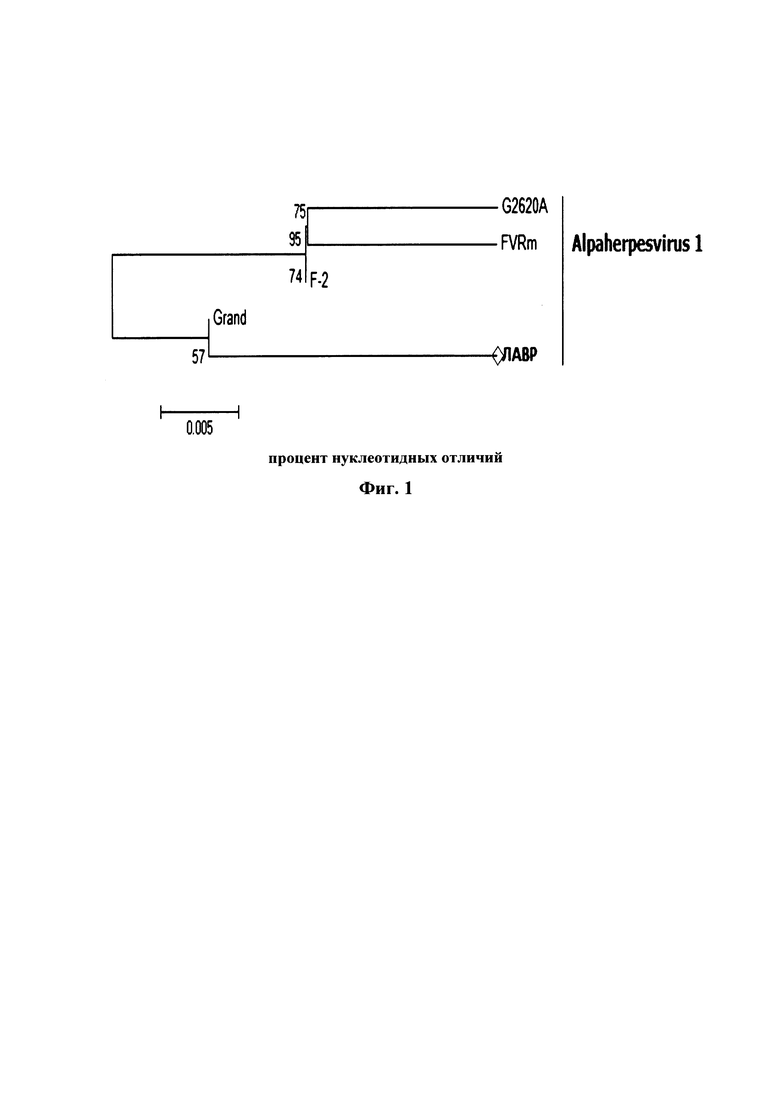
Редактор выравнивания последовательностей BioEdit использовался для анализа необработанных последовательностей. Выравнивания, содержащие полногеномные последовательности, были построены с использованием программы Clustal_W. Эволюционная история была выведена с использованием критерия максимального правдоподобия, основанного на 3 параметрах классической модели Tamura. Дерево было нарисовано в масштабе, с длиной ветвей, измеренной в количестве замен на сайт. Эволюционный анализ был проведен в MEGA7. Выравнивание аминокислотных последовательностей проводили с использованием Clustal X (Фиг. 1).
Дендрограмма на фиг. 1 основана на сравнении нуклеотидных последовательностей гена FeHV-1, который кодирует мембранный белок VP1 (позиции в геноме: 1477…1911 п.н.) ДНК вируса Alphaherpesvirus 1 инфекционного ринотрахеита кошек (FHV). Штамм «Лавр» имеет большое количество нуклеотидных отличий от других заявленных штаммов (степень сходства не более 57%), при этом относится к геногруппе 1 (Felid alphaherpesvirus 1).
Сущность изобретения отражена на графических изображениях:
Фиг. 1 - Филогенетическое древо для вируса инфекционного ринотрахеита кошек штамма «Лавр».
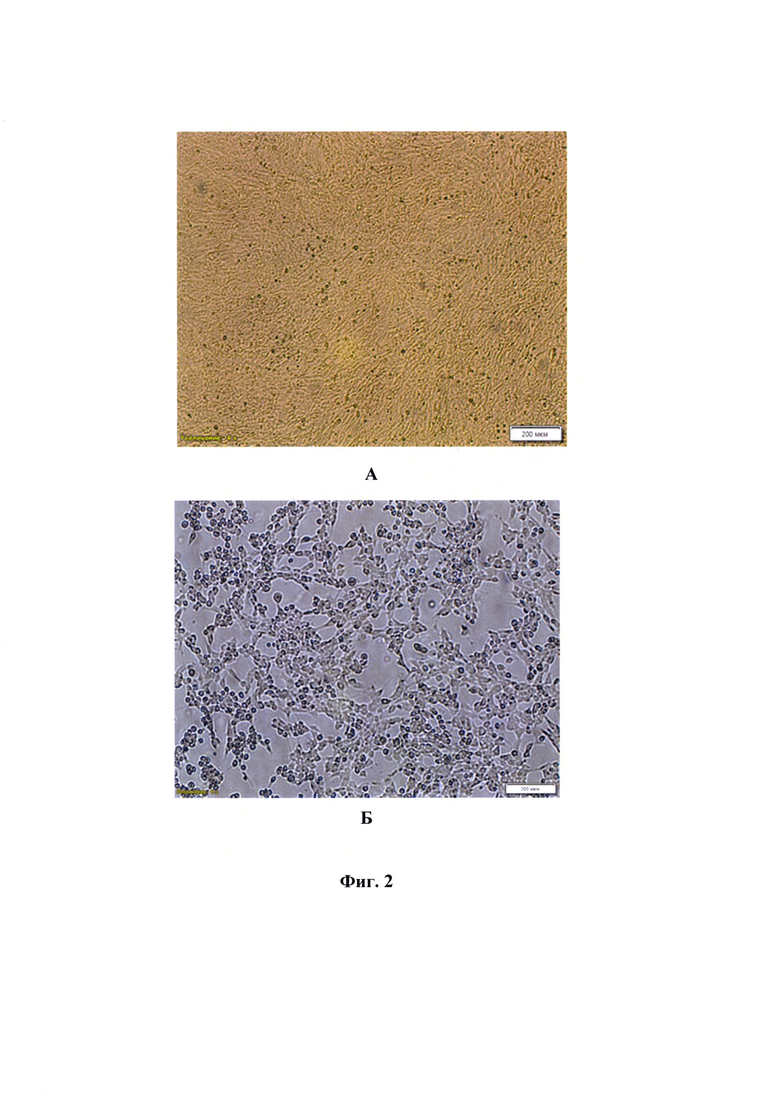
Фиг. 2 - Состояние монослоя клеточной линии CRFK до (А) и после (Б) репродукции вируса Alphaherpesvirus 1 инфекционного ринотрахеита кошек штамма «Лавр».
Сущность изобретения пояснена в перечне последовательностей, в котором:
SEQ ID NO: 1 представляет последовательность нуклеотидов участка ТК ДНК вируса Alphaherpesvirus 1 инфекционного ринотрахеита кошек штамма «Лавр»;
SEQ ID NO: 2 представляет последовательность аминокислот белков для генного участка ТК ДНК вируса Alphaherpesvirus 1 инфекционного ринотрахеита кошек штамма «Лавр».
Штамм «Лавр» вируса Alphaherpesvirus 1 инфекционного ринотрахеита кошек характеризуется следующими признаками и свойствами.
Морфологические признаки
Штамм «Лавр» вируса инфекционного ринотрахеита кошек относится к семейству Herpesviridae, роду Varicellovirus, виду Alphaherpesvirus 1 и обладает морфологическими признаками, характерными для представителей герпесвирусов: размер вирионов от 120 до 180 нм, они состоят из ядра, содержащего двухцепочечную ДНК, икосаэдрического капсида, слоя оболочки, окружающего капсид, и липидного бислоя, из которого выступают шипы гликопротеина.
Антигенные свойства
Все циркулирующие штаммы представляют собой единый серотип. У переболевших кошек в сыворотках крови образуются антитела, выявляемые в реакции нейтрализации (РН). Вирус стабильно нейтрализуется гомологичной антисывороткой в РН в культуре клеток CRFK. Инокуляция в организм животного штамма «Лавр» вируса инфекционного ринотрахеита кошек сопровождается образованием вируснейтрализующих антител в крови в титре 6,40±0,58 log2 SN50 у кроликов.
Биотехнологические характеристики
Штамм «Лавр» вируса Alphaherpesvirus 1 инфекционного ринотрахеита кошек репродуцируется в перевиваемой культуре клеток почки кошки (CRFK). Репродукция вируса в культуре клеток CRFK сопровождается специфическим цитопатическим действием (Фиг. 2), приводящим к округлению клеток и деструкции монослоя через 48-72 ч культивирования. Биологические свойства характеризовали путем определения инфекционной активности вируса каждого пассажа в перевиваемой культуре клеток CRFK. При культивировании вирус штамма «Лавр» накапливается в титре не менее 6,5±0,25 lg ТЦД50/см3 и сохраняет исходные характеристики при пассировании в течение не менее 5 пассажей (срок наблюдения).
Гено- и хемотаксономические характеристики
Геном вируса имеет размер приблизительно 135 800 п.н., который состоит из уникальных длинных (UL) и уникальных коротких (US) последовательностей, обрамленных областями инвертированных повторов, известными как терминальный и инвертированный длинный повтор (TRL, IRL) и инвертированный и терминальный короткий повтор (IRL, TRS), соответственно [6, 7]. Рекомбинация является распространенным механизмом эволюции FHV. Большинство зарегистрированных событий рекомбинации в геноме FHV происходят в различных участках. Для штаммовой дифференциации в мировом научном сообществе принято использовать участок ДНК вируса инфекционного ринотрахеита кошек, который кодирует мембранный белок VP1 (ген FeHV-1 - 435 п.н.) [7].
Устойчивость к внешним факторам
Вирус довольно устойчив во внешней среде. Чувствителен к сильнокислым и слабощелочным значениям рН, при температуре 56°С инактивируется за 3-4 минуты, при температуре 37°С - за 36 часов, медленно инактивируется в формалине, устойчив к этиловому спирту. Разрушают оболочку вируса стандартные дезинфектанты (гипохлорит, четвертичные аммонийные соединения). Переносит двукратное размораживание и оттаивание.
Дополнительные признаки и свойства:
Патогенность - патогенен для естественно-восприимчивых животных.
Вирулентность - вирулентен для естественно-восприимчивых животных при интраназальном заражении.
Безвреден для кроликов, морских свинок и белых мышей при внутримышечном и подкожном заражении.
Стабильность - сохраняет исходные биологические свойства при пассировании в чувствительных биологических системах в течение 5 пассажей (срок наблюдения) на перевиваемой культуре клеток CRFK.
Контаминация бактериями, грибами, микоплазмами и посторонними вирусами - штамм «Лавр» не контаминирован бактериями, грибами, микоплазмами и посторонними вирусами.
Условия хранения
При хранении штамма в нативном состоянии при температуре -70±5°С допустимая длительность хранения без освежения составляет 12 мес., а при хранении в лиофилизированном состоянии при той же температуре - 10 лет.
Сущность предлагаемого изобретения пояснена примерами его использования, которые не ограничивают объем изобретения.
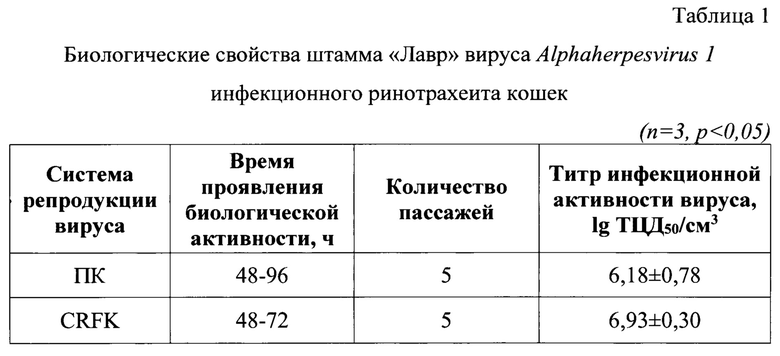
Пример 1. Биологические и вирусологические исследования штамма «Лавр» вируса Alphaherpesvirus 1 инфекционного ринотрахеита кошек
Биологические и вирусологические методы включали адаптацию вируса, выделенного из патологического материала, к культурам клеток ПК, CRFK. Для выделения вируса, вирусную суспензию вносили на освобожденный от ростовой среды монослой первично-трипсинизированной культуры клеток почки котенка (ПК) и экспонировали в течение 60 мин. при температуре (37,0±0,5)°С.Затем вносили поддерживающую среду ПСС (или аналог) с добавлением 2% фетальной сыворотки крови КРС и антибиотиков (стрептомицин 100 мкг/см3 и пенициллин 100 ЕД/см3). Инфицированную культуру инкубировали при температуре (37,0±0,5)°С в течение 72-96 ч, затем замораживали при минус (45,0±5,0)°С. Полученный вируссодержащий материал использовали для последующих пассажей. После проведения трех «слепых» пассажей в первично-трипсинизированной и субкультуре клеток ПК, вируссодержащий материал вносили на освобожденный от ростовой среды монослой перевиваемой культуры клеток почки кошки (CRFK) и инкубировали в течение 60 мин. при температуре (37,0±0,5)°С.Затем вносили поддерживающую среду ПСС (или аналог) с добавлением 2% фетальной сыворотки крови КРС и антибиотиков (стрептомицин 100 мкг/см3 и пенициллин 100 ЕД/см3). Инфицированную культуру инкубировали при температуре (37,0±0,5)°С в течение 48-72 ч. После каждого пассажа определяли инфекционную активность вируса. По истечении 3 суток культуральные флаконы с вирусным материалом замораживали в низкотемпературном холодильнике при температуре минус (45,0±5,0) С. После цикла заморозки и разморозки вирусного материала при комнатной температуре производили его сбор с последующим отбором проб для исключения микробной контаминации и повторным определением инфекционной активности вируса. Результаты адаптации вируса к перевиваемой линии клеток почки кошки CRFK представлены в таблице 1. Инфекционная активность вируса при репродукции в первично-трипсинизированной и субкультуре клеток ПК в течение 5 пассажей составила 6,18±0,78 lg ТЦД50/см3. При репродукции в течение 5 пассажей в перевиваемой культуре клеток CRFK инфекционная активность вируса составила 6,93±0,30 lg ТЦД50/см3. Данные, приведенные в таблице 1, свидетельствовали о хорошей адаптационной активности штамма «Лавр» вируса Alphaherpesvirus 1 инфекционного ринотрахеита кошек к данным клеточным культурам.
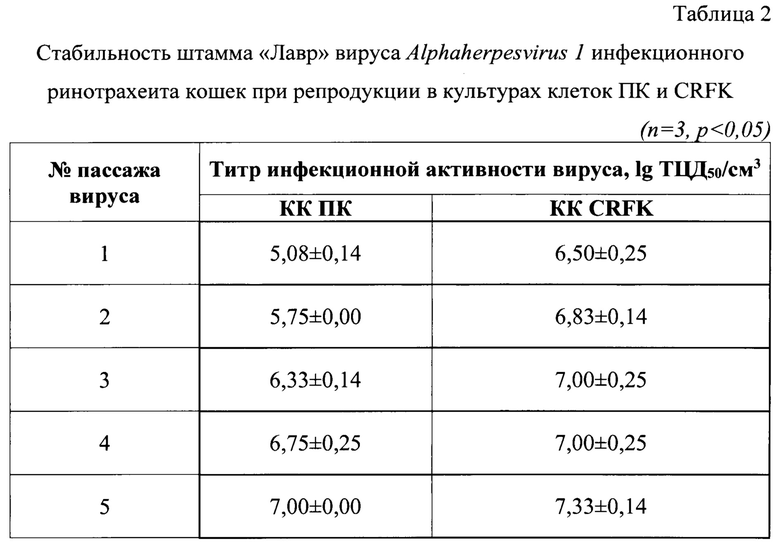
Пример 2. Контроль стабильности биологической активности штамма «Лавр» вируса инфекционного ринотрахеита кошек
Контроль стабильности биологической активности штамма определяли в течение 5 последовательных пассажей в культурах клеток ПК и CRFK. Результаты изучения стабильности штамма по его биологической активности в течение 5 пассажей представлены в таблице 2. В ходе проведенных исследований установлено, что штамм «Лавр» вируса инфекционного ринотрахеита кошек в течение 5 последовательных пассажей в культурах клеток ПК и CRFK проявлял стабильную биологическую активность, которая находилась в пределах от 5,08±0,14 lg ТДЦ50/см3 до 7,00±0,00 lg ТДЦ50/см3 и от 6,50±0,25 lg ТДЦ50/см3 до 7,33±0,14 lg ТДЦ50/см3 соответственно.
Пример 3. Получение антигена штамма «Лавр» вируса инфекционного ринотрахеита кошек.
Для приготовления антигена в культуру клеток CRFK, выращенную в культуральных флаконах с площадью рабочей поверхности 300 см2, предварительно слив с них ростовую среду, вносили вируссодержащий материал в дозе 0,001 ТЦД50/кл. Флаконы помещали на один час в термостат при температуре (37,0±0,5)°С для контакта клеток культуры с вирусом. После этого вносили поддерживающую среду ПСС (или аналог) с добавлением 2% сыворотки крови КРС. Инфицированную культуру инкубировали при (37,0±0,5)°С до появления ЦПД вируса. При поражении площади монослоя не менее 80% культуральные флаконы подвергали замораживанию при температуре минус (45,0±0,5)°С. Стерильный инфицированный монослой дезагрегировали с рабочей поверхности флаконов путем его разморозки при температуре (20±2)°С и периодического встряхивания. По окончании разморозки интенсивным встряхиванием остатки монослоя удаляли с рабочей поверхности, затем, соблюдая условия асептики, инфицированную суспензию собирали в общую емкость. Из собранного материала отбирали пробу для контроля. Контроль посевного материала штамма «Лавр» вируса инфекционного ринотрахеита кошек перед лиофилизацией осуществляли по показателю отсутствия контаминации грибами, бактериями и микоплазмами. Контроль контаминации грибами и бактериями посевного материала штамма «Лавр» вируса инфекционного ринотрахеита кошек проводили по ГОСТ 28085 [14]. Контроль контаминации микоплазмами осуществляли в соответствии с требованиями ГФ XIV, том II, с. 2997-3008 (ОФС.1.7.2.0031.15) [15]. Вируссодержащий материал с активностью не ниже 6,5 lg ТЦД50/см3 хранили при температуре не выше минус (20±2)°С и использовали для изготовления вакцинных и диагностических препаратов.
Пример 4. Получение гипериммунной сыворотки против антигена вируса инфекционного ринотрахеита кошек штамма «Лавр»
Штамм «Лавр» вируса Alphaherpesvirus 1 инфекционного ринотрахеита кошек используют для получения высокоактивной гипериммунной сыворотки, предназначенной для оценки иммунобиологических свойств вируса инфекционного ринотрахеита кошек. Для гипериммунизации животных применяли антиген вируса инфекционного ринотрахеита кошек штамма «Лавр», полученный по методике, указанной в примере 3. Кроликов иммунизировали в дозе 1,0 см3 внутримышечно по следующей схеме: 1) однократно, с обескровливанием через 35 дней после иммунизации; 2) двукратно, отбор крови на 21 сутки после последней иммунизации. Полученную сыворотку крови исследования на наличие антител против антигена вируса инфекционного ринотрахеита кошек штамма «Лавр». Титр антител определяли в реакции микронейтрализации (РМН). Данные, представленные в таблице 3, свидетельствуют, что способом, описанным в примере 4, получены диагностические сыворотки со специфической активностью 4,75-7,5 log2 SN50 в РМН.
Пример 5. Изучение антигенной активности штамма «Лавр» вируса инфекционного ринотрахеита кошек на кроликах
Для изучения антигенной активности штамма «Лавр» вируса Alphaherpesvirus 1 инфекционного ринотрахеита кошек использовали вируссодержащий материал с биологической активностью равной 7,0 lg ТЦЦ50/см3, определенной до инактивации. Инактивацию проводили с помощью водного раствора аминоэтилэтиленимина (АЭЭИ). Подопытным кроликам в количестве 5 голов вводили инактивированный материал в среднюю часть бедра в дозе 1,0 см3 двукратно с интервалом 21 сутки. Кроликов в количестве 5 голов оставили в качестве контроля. Титр антител к антигену вируса инфекционного ринотрахеита кошек в сыворотках крови кроликов определяли через 14 суток после второй иммунизации в РМН по общепринятой методике.
Результаты исследований антигенной активности штамма «Лавр» вируса Alphaherpesvirus 1 инфекционного ринотрахеита кошек представлены в таблице 4, из которой следует, что титр антител у иммунизированных кроликов составил 6,40±0,58 log2 SN50.
Пример 6. Изучение биологических свойств штамма «Лавр» вируса инфекционного ринотрахеита кошек (определение патогенности для кошек)
Патогенность штамма «Лавр» вируса инфекционного ринотрахеита кошек изучали на естественно восприимчивых животных (беспородные котята в возрасте 2-3 мес). Животных разделили на две группы по 4 головы в каждой - подопытную и контрольную. Подопытным котятам инокулировали интраназально вируссодержащую культуральную жидкость в объеме 1,0 см3 с титром инфекционной активности 7,0 lg ТЦД50/см3. Животным контрольной группы инокулировали интраназально 0,9% раствор хлорида натрия в объеме 1,0 см3. На 4-5 сутки после заражения у всех животных подопытной группы наблюдали характерные клинические признаки инфекционного ринотрахеита кошек: снижение активности, отказ от корма, катаральный ринит, гнойный конъюнктивит, повышение температуры тела. Через 7 сут. после появления клинических признаков болезни два котенка пали. Специфичность заболевания и падежа животных подтверждена исследованиями биоматериала от котят методом ПЦР.
Таким образом, штамм «Лавр» вируса Alphaherpesvirus 1 инфекционного ринотрахеита кошек, полученный в соответствии с предлагаемым изобретением, обладает высокой биологической, антигенной активностью, пригоден для изготовления инактивированных вакцин, определения их иммуногенной активности, а также диагностических целей, и расширяет арсенал новых отечественных производственных штаммов вируса инфекционного ринотрахеита кошек.
Источники информации, принятые во внимание при составлении описания изобретения к заявке на выдачу патента Российской Федерации на изобретение «Штамм «Лавр» вируса Alphaherpesvirus 1 инфекционного ринотрахеита кошек для изготовления биопрепаратов для диагностики и специфической профилактики инфекционного ринотрахеита кошек».
1. Алипер Т.И., Непоклонов Е.А., Мухин А.Н. и др. Диагностика и профилактика инфекционных болезней кошек и кошек: руководство для практикующих ветеринарных врачей. Под ред. Т.И. Алипера. М.: ЗооВетКнига; 2017. 300 с.
2. Wu Q, Wu Н., Не S., Liu Y., Chen Y., Qi X., Gu X., Wen Y., Jin X., Jin Y., Tian K. Feline herpesvirus infection and pathology in captive snow leopard. Sci Rep.2022 Apr 28;12(1):4989.
3. Sun H., Li Y., Jiao W., Liu C, Liu X., Wang H., Hua F., Dong J., Fan S., Yu Z., Gao Y., Xia X.. Isolation and identification of feline herpesvirus type 1 from a South China tiger in China. Viruses. 2014 Feb 28;6(3): 1004-14.
4. Magouz A., Lokman M.S., Albrakati A., Elmahallawy E.K. First Report of Isolation and Molecular Characterization of Felid Herpesvirus-1 from Symptomatic Domestic Cats in Egypt. Vet Sci. 2022 Feb 15;9(2):81.
5. Povey R.C. A review of feline viral rhinotracheitis (feline herpesvirus I infection). Comp Immunol Microbiol Infect Dis. 1979;2(2-3):373-87.
6. Hora A.S., Tonietti P.O., Guerra J.M., Leme M.C., Pena H.F., Maiorka P.C., Brandao P.E. Felid herpesvirus 1 as a causative agent of severe nonsuppurative meningoencephalitis in a domestic cat. J Clin Microbiol. 2013 Feb;51(2):676-9.
7. Maes R. Felid herpesvirus type 1 infection in cats: a natural host model for alphaherpesvirus pathogenesis. ISRN Vet Sci. 2012 Nov 14;2012:495830.
8. Cottingham E., Johnstone Т., Hartley C.A., Devlin J.M. Update on feline alphaherpesvirus-1 seroprevalence in Victorian feral and owned cats. Aust Vet J. 2022 May;100(5):187-189. doi: 10.111l/avj.13147. Epub 2022 Jan 25. Erratum in: Aust Vet J. 2022 Aug;100(8):414.
9. Purevax RCPCh. - URL: https://www.vetlek.ru/directions/?id=448 (дата обращения 05.04.23 г.).
10. Нобивак Tricat Trio. - URL: https://vetsnab.info/vetpreparaty/nobivak-tricat-trio-s-rastvoritelem-nobivak-diluent/(flaTa обращения 05.04.23 г.).
11. Фелоцел CVR. - URL: https://www.vetlek.ru/articles/?id=250 (дата обращения 05.04.23 г.).
12. Пат.2 215 031 Российская Федерация, МПК A61K 39/245 (2006.01), C12N 7/00(2006.01). Штамм Feline herpesvirus-1, используемый для контроля иммуногенной активности вакцин, изготовления специфических лечебно-профилактических и диагностических биопрепаратов / Элизбарашвили Э.И., Рахманина М.М., Уласов В.И.; заявитель и патентообладатель ФГБУ «ВГНКИ». - №2002107022/13; заявл. 2002.03.20; опубл. 2003.10.27.
13. Vaz P.K., Job N., Horsington J, Ficorilli N., Studdert M.J., Hartley C.A., Gilkerson J.R., Browning G.F., Devlin J.M. Low genetic diversity among historical and contemporary clinical isolates of felid herpesvirus 1. BMC Genomics. 2016 Sep 2;17(1):704.
14. ГОСТ 28085-13 «Средства лекарственные биологические для ветеринарного применения. Метод бактериологического контроля стерильности».
15. ГФ XIV, т. 2, с. 2997-3008 Испытания на присутствие микоплазм (ОФС.1.7.2.0031.15).

--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing dtdVersion="V1_3" fileName="FHV Lavr.xml"
softwareName="WIPO Sequence" softwareVersion="2.1.2"
productionDate="2023-06-05">
<ApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>0</ApplicationNumberText>
<FilingDate>2023-04-24</FilingDate>
</ApplicationIdentification>
<ApplicantFileReference>500</ApplicantFileReference>
<EarliestPriorityApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>0</ApplicationNumberText>
<FilingDate>2023-04-24</FilingDate>
</EarliestPriorityApplicationIdentification>
<ApplicantName languageCode="ru">ФГБУ
"ВНИИЗЖ"</ApplicantName>
<ApplicantNameLatin>Doronin Maksim Igorevich </ApplicantNameLatin>
<InventorName languageCode="ru">Галкина Татьяна
Сергеевна</InventorName>
<InventorNameLatin>Galkina Tatiana Sergeevna</InventorNameLatin>
<InventionTitle languageCode="ru">Штамм «Лавр» вируса инфекционного
ринотрахеита кошек для изготовления биопрепаратов для диагностики и
специфической профилактики инфекционного ринотрахеита
кошек</InventionTitle>
<SequenceTotalQuantity>2</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>435</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..435</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>genomic DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q1">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>FHV</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>aaaattcttatcctttattacatgaatttcccccatgatatacgatgac
aataagtaatgcgataaataataggagagtgagtcccatattgagaagcataagtctacacatacaattc
ttgggtccgtaggtccttccacctgaaaatggagatgggctgatataagatggtatctcagacataccac
gtggttgatgccaggtacgattagacgactttaatggttgaggggttagtgggatctccacagtgctatc
tgagaaatcccgtttcatcattaagattttctcgtctggatgcccaaattttacacgtccctgtggggtt
gaatgtagataaggagatcccagttcatctgtataccactgtgtagaggatcggggtaatttcatagttg
tagagtcgagccatgggttagtgtggacattaggtt</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>145</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..145</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>FHV</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>KILILYYMNFPHDIQSQVFMRIIGEVPYEAVYTYNSRRFSWVRRSFHLK
MERMGYKMVSQTYHVVDARYDTRTLMVREGLVGSPQCYLRNPRVSSLRFSRLDAQILHVPVGLNRVDKEI
PVHLYTTVRIGVISRLSRAMGCGHYV</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---
Изобретение относится к области биотехнологии и касается нового штамма «Лавр» вируса инфекционного ринотрахеита кошек семейства Herpesviridae, рода Varicellovirus, вида Alphaherpesvirus 7, депонированный во Всероссийской государственной коллекции экзотических типов вируса ящура и других патогенов животных (ГКШМ) ФГБУ «ВНИИЗЖ» под регистрационным номером: №457-деп/23-7 - ГКШМ ФГБУ «ВНИИЗЖ». Представленный штамм репродуцируется в перевиваемой культуре клеток почки кошки (CRFK). В перевиваемой культуре клеток почки кошки CRFK в течение 48-72 часов инкубирования титр инфекционной активности вируса достигает значений 6,93±0,30 lg ТЦД50/см3, сохраняя исходные характеристики при пассировании в клеточной культуре на протяжении 5 пассажей. Представленный штамм может быть использован для изготовления биопрепаратов для диагностики и специфической профилактики инфекционного ринотрахеита кошек и для контроля антигенной активности вакцин против данного заболевания. 2 ил., 4 табл., 6 пр.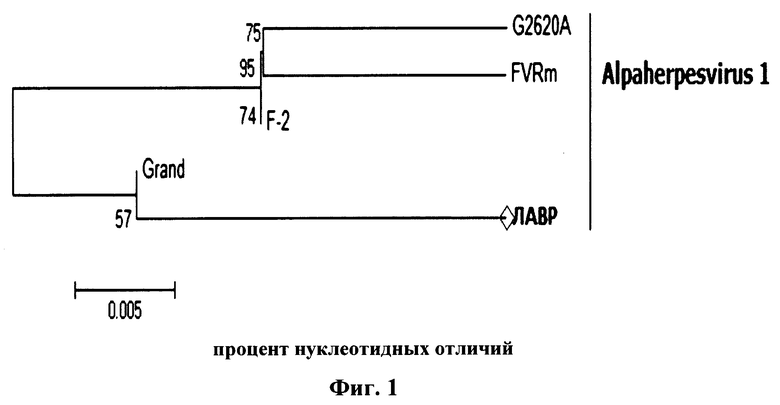
Штамм «Лавр» вируса инфекционного ринотрахеита кошек Alpaherpesvirus 1, депонированный во Всероссийской государственной коллекции экзотических типов вируса ящура и других патогенов животных (ГКШМ) ФГБУ «ВНИИЗЖ» под регистрационным номером: №457-деп/23-7 - ГКШМ ФГБУ «ВНИИЗЖ» для изготовления биопрепаратов для диагностики и специфической профилактики инфекционного ринотрахеита кошек.
| 2002 |
|
RU2215031C1 | |
| АЛИПЕР Т.И., и др | |||
| Диагностика и профилактика инфекционных болезней кошек и кошек: руководство для практикующих ветеринарных врачей | |||
| Под ред | |||
| Т.И | |||
| Алипера | |||
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| ТКАЦКИЙ СТАНОК | 1920 |
|
SU300A1 |
| SUN H., Isolation and identification of feline herpesvirus type 1 from a South China tiger in China | |||
| Viruses | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
Авторы
Даты
2023-11-01—Публикация
2023-06-27—Подача