Изобретение относится к области ветеринарной вирусологии и биотехнологии, может быть использовано для разработки и изготовления средств диагностики и специфической профилактики панлейкопении кошек и контроля антигенной и иммуногенной активности вакцин против данного заболевания.
Панлейкопения кошек - высококонтагиозное заболевание вирусной этиологии, характеризующееся лихорадкой, острым геморрагическим энтеритом, лейкопенией, обезвоживанием организма и высокой летальностью (до 90%) [1]. Возбудителем панлейкопении кошек является безоболочечный вирус с одноцепочечной ДНК и икосаэдрическим капсидом, принадлежащий к семейству Parvoviridae, роду Protoparvovirus, виду Carnivore protoparvovirus 1 (FPV - Feline Panleukopenia Virus) [2]. Наиболее благоприятны для репродукции возбудителя панлейкопении митотически активные клетки костного мозга, лимфатической ткани и эпителиальные клетки крипт тонкого кишечника [3]. Вирус выделяется со всеми секретами и экскретами животного во время активной стадии инфекции, но максимальная концентрация возбудителя достигается в фекалиях [1]. Обычно вирусовыделение происходит около двух дней после проявления клинических признаков, однако FPV способен выделяться с фекалиями и мочой до 6 месяцев после выздоровления [4]. Вирус панлейкопении кошек устойчив к неблагоприятным условиям внешней среды и действию органических растворителей (эфиру и хлороформу) [1]. Факторами передачи возбудителя могут являться контаминированные предметы, обувь, одежда, поэтому риск заражения домашних невакцинированных кошек, не имеющих свободного доступа на улицу, остается высоким.
Вирус панлейкопении кошек (FPV) известен с начала 20 века и на протяжении последующих десятилетий сохранял определенную генетическую стабильность [5]. Но в 1970-х годах был зарегистрирован возбудитель парвовирусного энтерита собак (CPV-2 - Canine parvovirus-2), эволюционировавший из FPV, приобретя около 6 аминокислотных изменений в капсиде, которые позволили вирусу также заражать собак [6]. В то время как собаки восприимчивы только к оригинальному CPV-2 и всем его вариантам, кошки восприимчивы как к вариантам FPV, так и к вариантам CPV-2 [3]. Данная особенность демонстрирует, что не смотря на общую консервативность ДНК-содержащих вирусов, данный возбудитель меняется, и существует риск заражения других видов животных [7]. Согласно руководству по вакцинации собак и кошек Международной ветеринарной ассоциации мелких домашних животных (WSAVA - the World Small Animal Veterinary Association) к базовым («core») вакцинам, которые должны получать все кошки независимо от обстоятельств (они обеспечивают защиту от заболеваний, опасных для жизни животных и распространенных по всему миру), также относятся вакцины против панлейкопении [8]. Несмотря на широкое распространение и огромный выбор вакцин для кошек, FPV по-прежнему остается значимой угрожающей болезнью. В связи с этим вопрос о необходимости разработки средств вакцинопрофилактики, обеспечивающих надежную защиту от новых штаммов панлейкопении кошек, остается актуальным.
В настоящее время наиболее известны следующие производственные штаммы вируса панлейкопении кошек, которые применяются для производства средств специфической профилактики против данного заболевания:
- Штамм «PLI IV» [9];
- Штамм «MW-1» [10];
- Штамм «LR 72» [11];
- Штамм «Snow Leopard» [12];
- Штамм «Мяу» [1].
Штаммы «PLI IV», «MW-1», «FPV», «LR 72», «Snow Leopard» входят в составы импортных вакцин против болезней кошек, которые созданы на основе штаммов, имеющих наибольшее распространение на территории стран-производителей. Тенденция к ежегодному росту случаев заболеваний панлейкопенией кошек может свидетельствовать о недостаточной эффективности зарубежных вакцин против штаммов, циркулирующих в популяции кошек на территории РФ. Кроме того, данные вакцины имеют высокую стоимость.
Наиболее близким предполагаемому изобретению по совокупности существенных признаков является штамм «Мяу» вируса панлейкопении кошек, входящий в состав ассоциированной вакцины «Мультифел-4», разработанной российским производителем НПО «Ветбиохим» [1]. Штамм «Мяу», депонированный в 1993 г., на сегодняшний день является одним из немногих в стране, чья иммуногенность, антигенная активность, безопасность, стабильность полностью изучены. Однако не изучены молекулярно-генетические свойства данного штамма.
Задача, на решение которой направлено настоящее изобретение, заключается в расширении арсенала производственных штаммов вируса панлейкопении кошек, обладающих новыми биологическими и генетическими характеристиками, и пригодных для изготовления средств диагностики и специфической профилактики данного заболевания. Указанная задача решена в результате депонирования нового штамма «Шеба» вируса панлейкопении кошек, который может быть использован для проведения лабораторных исследований и изготовления средств вакцинопрофилактики.
Изолят вируса панлейкопении кошек, послуживший источником для получения штамма «Шеба», был выделен из патологического материала, полученного от погибшего беспородного котенка, который содержался в ВООО Центре животных «Валента» на территории г. Владимир, в 2021 г.
Штамм «Шеба» вируса панлейкопении кошек депонирован во Всероссийской государственной коллекции экзотических типов вируса ящура и других патогенов животных ФГБУ «ВНИИЗЖ» под регистрационным номером: №455 - деп/23-5 - ГКШМ ФГБУ «ВНИИЗЖ».
Экспериментально подтверждена возможность использования штамма «Шеба» вируса панлейкопении кошек для изготовления средств диагностики и специфической профилактики панлейкопении кошек.
Для получения штамма «Шеба» вируса Carnivore protoparvovirus 1 панлейкопении кошек, обладающего оптимальными биотехнологическими свойствами, использовали первично-трипсинизированную культуру клеток почки котенка (ПК). В результате проведения серии последовательных пассажей на данной культуре клеток и перевиваемой культуре клеток почки кошки (CRFK) из ранее выделенного изолята был получен штамм «Шеба» вируса Carnivore protoparvovirus 1 панлейкопении кошек, имеющий необходимые биотехнологические свойства и пригодный для изготовления диагностических препаратов и препаратов специфической профилактики данного заболевания. Штамм адаптирован к перевиваемой культуре клеток почки кошки (CRFK), что позволяет в промышленных масштабах получать вирусный материал штамма «Шеба» вируса панлейкопении кошек с титрами гемагглютинирующей активности не менее 9 log2 НА.
Идентификация и филогенетическое родство штамма «Шеба» проводили при сравнительном анализе последовательности кДНК. Использовали обратную транскрипцию и полимеразную цепную реакцию (ОТ-ПЦР). Для идентификации и филогенетического анализа осуществляли секвенирование.
Редактор выравнивания последовательностей BioEdit использовался для анализа необработанных последовательностей. Выравнивания, содержащие полногеномные последовательности, были построены с использованием программы Clustal_W. Эволюционная история была выведена с использованием критерия максимального правдоподобия, основанного на 3 параметрах классической модели Tamura. Дерево было нарисовано в масштабе, с длиной ветвей, измеренной в количестве замен на сайт. Эволюционный анализ был проведен в MEGA7. Выравнивание аминокислотных последовательностей проводили с использованием Clustal X.
Дендрограмма основана на сравнении полных нуклеотидных последовательностей генов структурных и неструктурных белков ДНК вируса панлейкопении кошек (был взят участок длиной 4614 н.о.). Штамм «Шеба» имеет большое количество нуклеотидных отличий от других заявленных штаммов (степень сходства не более 39%), при этом относится к геногруппе 1 вида Carninove protoparvovirus (Фиг. 1).
Сущность изобретения отражена на графических изображениях:
Фиг. 1 - Филогенетическое древо для вируса панлейкопении кошек штамма «Шеба».
Сущность изобретения пояснена в перечне последовательностей, в котором:
SEQ ID NO: 1 представляет последовательность нуклеотидов генов структурных и неструктурных белков ДНК вируса панлейкопении кошек штамма «Шеба»;
SEQ ID NO: 2 представляет последовательность аминокислот структурных и неструктурных белков ДНК вируса панлейкопении кошек штамма «Шеба».
Штамм «Шеба» вируса панлейкопении кошек характеризуется следующими признаками и свойствами.
Морфологические признаки
Штамм «Шеба» вируса панлейкопении кошек относится к семейству Parvoviridae, роду Protoparvovirus, виду Carnivore protoparvovirus 1 и обладает морфологическими признаками, характерными для представителей парвовирусов: безоболочечные вирусы с одноцепочечной ДНК и икосаэдрическим капсидом.
Антигенные свойства
Антигенно вирус панлейкопении кошек родственен парвовирусу песцов (BFP), вирусу энтерита норок (MEV) и парвовирусу собак (CPV-2) [1]. Антитела, которые образуются у переболевших животных в сыворотках крови, выявляются в реакции торможения гемагглютинации (РТГА). Инокуляция в организм животного штамма «Шеба» вируса панлейкопении кошек сопровождается образованием антител в крови в титре от 10,33 log2 до 14 log2 НА у кроликов.
Биотехнологические характеристики
Штамм «Шеба» вируса панлейкопении кошек репродуцируется в перевиваемой культуре клеток почки кошки (CRFK), а также в первично-трипсинизированной и субкультуре клеток почки котенка (ПК). Инфицированная FPV культура клеток (CRFK или ПК) инкубируется в термостате при температуре (37,5±0,5)°С в течение 5 суток. Репродукция вируса в культуре клеток ПК и CRFK не сопровождается специфическим цитопатическим действием. Биологические свойства характеризуются путем определения гемагглютинирующей активности вируса каждого пассажа методом РГА. При культивировании вируса гемагглютинирующая активность штамма «Шеба» составляет не ниже 9 log2 НА. Исходные характеристики сохраняются при пассировании в чувствительных биологических системах в течение не менее 5 пассажей (срок наблюдения).
Гено- и хемотаксономическая характеристики
Вирус панлейкопении кошек представляет собой одноцепочечный ДНК-вирус с геномом объемом 5,1 кб, кодирующим 2 основных гена, неструктурные (NS) и структурные белковые гены. Ген NS кодирует белки NS1 и NS2, участвующие в репликации ДНК, сборке капсида и внутриклеточном транспорте, тогда как структурный ген кодирует белки VP1 и VP2 вирусного капсида. Вирусный капсид состоит из 60 белковых субъединицы (~10% VP1 и 90% VP2), расположенных в икосаэдрической симметрии.
Устойчивость к внешним факторам.
Вирус высокоустойчив к фенолу, эфиру, хлороформу, кислотам, трипсину, 0,2%-ному раствору дезоксихолата натрия, рН 3,0. При нагревании до 56°С активен и течение 60 мин. Хорошо сохраняется в 50%-ном глицерине, забуференном до рН 7,2. Переносит двукратное размораживание и оттаивание.
Дополнительные признаки и свойства:
Реактогенность - реактогенными свойствами не обладает.
Безвреден для кроликов, морских свинок, белых мышей при внутримышечном и подкожном заражении.
Стабильность - сохраняет исходные биологические свойства при пассировании в чувствительных биологических системах в течение 5 пассажей (срок наблюдения) на перевиваемой культуре клеток CRFK.
Контаминация бактериями, грибами, микоплазмами и посторонними вирусами - штамм «Шеба» не контаминирован бактериями, грибами, микоплазмами и посторонними вирусами.
Условия хранения
При хранении штамма в нативном состоянии при температуре -70±5°С допустимая длительность хранения без освежения составляет 12 мес, а при хранении в лиофилизированном состоянии при той же температуре - 10 лет.
Сущность предлагаемого изобретения пояснена примерами его использования, которые не ограничивают объем изобретения.
Пример 1. Биологические и вирусологические исследования штамма «Шеба» вируса Carnivore protoparvovirus 1 панлейкопении кошек
Биологические и вирусологические методы включали адаптацию вируса, выделенного из патологического материала, полученного от погибшего котенка, к культурам клеток ПК и CRFK. Для выделения вируса, вирусную суспензию вносили на освобожденный от ростовой среды монослой первично-трипсинизированной культуры клеток почки котенка (ПК) и экспонировали в течение 60 мин. при температуре (37,0±0,5)°С. Затем вносили поддерживающую среду ПСС (или аналог) с добавлением 2% фетальной сыворотки крови КРС и антибиотиков (стрептомицин 100 мкг/см3 и пенициллин 100 ЕД/см3). Инфицированную культуру инкубировали при температуре (37,0±0,5)°С в течение 5 дней, затем замораживали при минус (45,0±5,0)°С. Полученный вируссодержащий материал использовали для последующих пассажей. После проведения трех «слепых» пассажей в первично-трипсинизированной культуре клеток ПК, вируссодержащий материал вносили на освобожденный от ростовой среды монослой перевиваемой культуры клеток почки кошки (CRFK) и инкубировали в течение 60 мин. при температуре (37,0±0,5)°С. Затем вносили поддерживающую среду ПСС (или аналог) с добавлением 2% фетальной сыворотки крови КРС и антибиотиков (стрептомицин 100 мкг/см3 и пенициллин 100 ЕД/см3). Инфицированную культуру инкубировали при температуре (37,0±0,5)°С в течение 5 дней. После каждого пассажа с помощью РГА определяли гемагглютинирующую активность вируса. По истечении 5 суток культуральные флаконы с вирусным материалом замораживали в низкотемпературном холодильнике при температуре минус (45,0±5,0)°С. После цикла заморозки и разморозки вирусного материала при комнатной температуре производили его сбор с последующим отбором проб для исключения микробной контаминации и повторным определением гемагглютинирующей активности вируса методом РГА. Результаты адаптации вируса к перевиваемой линии клеток почки кошки CRFK представлены в таблице 1. Гемагглютинирующая активность вируса при репродукции в культуре клеток ПК в течение 3 пассажей составила 7,45±0,69 log2 НА. При репродукции в течение 5 пассажей в перевиваемой культуре клеток CRFK гемагглютинирующая активность вируса составила 9,47±0,90 log2 НА. Данные, приведенные в таблице 1, свидетельствовали о хорошей адаптационной активности штамма «Шеба» вируса панлейкопении кошек к данным клеточным культурам.
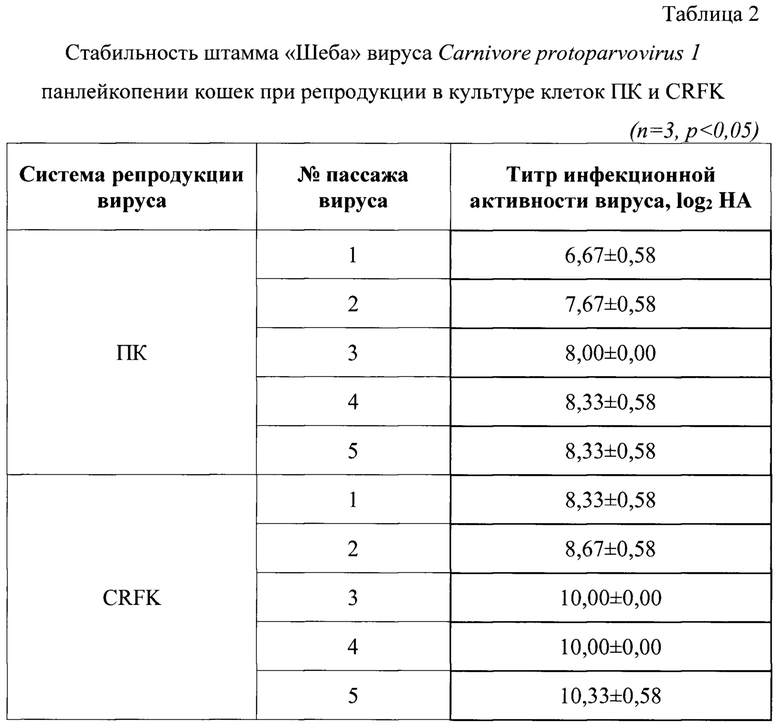
Пример 2. Контроль стабильности биологической активности штамма «Шеба» вируса Carnivore protoparvovirus 1 панлейкопении кошек
Контроль стабильности биологической активности штамма определяли в течение 5 последовательных пассажей в культурах клеток CRFK и ПК. Результаты изучения стабильности биологической активности штамма «Шеба» в течение 5 пассажей представлены в таблице 2. В ходе проведенных исследований установлено, что штамм «Шеба» вируса Carnivore protoparvovirus 1 панлейкопении кошек в течение 5 последовательных пассажей в культурах клеток ПК и CRFK проявлял стабильную биологическую активность, которая находилась в пределах от 6,67±0,58 до 8,33±0,58 log2 HA и от 8,33±0,58 до 10,33±0,58 log2 НА соответственно.
Пример 3. Получение антигена вируса Carnivore protoparvovirus 1 панлейкопении кошек штамма «Шеба»
Для приготовления антигена в культуру клеток CRFK, выращенную в культуральных флаконах с площадью рабочей поверхности 300 см2, предварительно слив с них ростовую среду, вносили вируссодержащий материал в количестве 30,0 см3 с гемагглютинирующей активностью не ниже 7 log2 НА. Флаконы помещали на один час в термостат при температуре (37,0±0,5)°С для контакта клеток культуры с вирусом. После этого вносили поддерживающую среду ПСС (или аналог) с добавлением 2% сыворотки крови КРС. Инфицированную культуру инкубировали при (37,0±0,5)°С в течение 5 дней, затем замораживали при минус (45,0±5,0)°С. Стерильный инфицированный монослой дезагрегировали с рабочей поверхности флаконов путем его разморозки при температуре (20±2)°С и периодического встряхивания. По окончании разморозки интенсивным встряхиванием остатки монослоя удаляли с рабочей поверхности, затем соблюдая условия асептики инфицированную суспензию собирали в общую емкость. Из собранного материала отбирали пробу для контроля. Контроль посевного материала штамма «Шеба» вируса Carnivore protoparvovirus 1 панлейкопении кошек перед лиофилизацией осуществляли по показателю отсутствия контаминации грибами, бактериями и микоплазмами. Контроль контаминации грибами и бактериями посевного материала штамма «Шеба» вируса Carnivore protoparvovirus 1 панлейкопении кошек проводили по ГОСТ 28085 [13]. Контроль контаминации микоплазмами осуществляли в соответствии с требованиями ГФ XIV, том II, с. 2997-3008 (ОФС.1.7.2.0031.15) [14]. Антиген вируса панлейкопении кошек с гемагглютинирующей активностью не ниже 9 log2 НА использовали для изготовления вакцинных и диагностических препаратов.
Пример 4. Получение гипериммунной сыворотки против антигена панлейкопении кошек штамма «Шеба».
Штамм «Шеба» вируса Carnivore protoparvovirus 1 панлейкопении кошек используют для получения высокоактивной гипериммунной сыворотки, предназначенной для оценки иммунобиологических свойств вируса панлейкопении кошек. Для гипериммунизации животных применяли антиген вируса панлейкопении кошек штамма «Шеба», полученный по методике, указанной в примере 3. Кроликов иммунизировали в дозе 1,0 см3 внутримышечно по следующей схеме: 1) однократно, с обескровливанием через 35 дней после иммунизации; 2) двукратно, отбор крови на 14 сутки после последней иммунизации. Полученную сыворотку крови исследования на наличие антител против антигена Carnivore protoparvovirus 1 вируса панлейкопении кошек штамма «Шеба». Титр антител определяли в реакции торможения гемагглютинации (РТГА). Данные, представленные в таблице 3, свидетельствуют, что способом, описанным в примере 4, получены диагностические сыворотки со специфической активностью от 10,33 до 14,00 log2 HI в РТГА.
Пример 5. Изучение антигенной активности штамма «Шеба» вируса Carnivore protoparvovirus 1 панлейкопении кошек на кроликах.
Для изучения антигенной активности штамма «Шеба» вируса Carnivore protoparvovirus 1 панлейкопении кошек использовали вируссодержащий материал с биологической активностью равной 10,0 log2 НА, определенной до инактивации. Инактивацию проводили с помощью водного раствора аминоэтилэтиленимина (АЭЭИ). Подопытным кроликам в количестве 5 голов вводили инактивированный материал в среднюю часть бедра в дозе 1,0 см3 двукратно с интервалом 21 сутки. Кроликов в количестве 5 голов оставили в качестве контроля. Титр антител к антигену вируса панлейкопении кошек в сыворотках крови кроликов определяли через 14 суток после второй иммунизации в РТГА по общепринятой методике.
Результаты исследований антигенной активности штамма «Шеба» вируса Carnivore protoparvovirus 1 панлейкопении кошек представлены в таблице 4, из которой следует, что титр антител у иммунизированных кроликов составил 12,00±1,00 log2 HI.
Пример 6. Изучение биологических свойств штамма «Шеба» вируса панлейкопении кошек (определение патогенности для кошек).
Патогенность штамма «Шеба» вируса Carnivore protoparvovirus 1 панлейкопении кошек изучали на естественно восприимчивых животных (беспородные котята в возрасте 2-3 мес). Животных разделили на две группы по 4 головы в каждой - подопытную и контрольную. Подопытным котятам вводили внутрибрюшинно вируссодержащую культуральную жидкость в объеме 2,0 см3 с титром инфекционной активности 10,0 log2 НА. Животным контрольной группы вводили внутрибрюшинно 0,9% раствор хлорида натрия в объеме 2,0 см3. На 2-3 сутки после заражения у всех животных подопытной группы наблюдали характерные клинические признаки панлейкопении кошек: снижение активности вплоть до апатии, отказ от корма, диарею, дегидратацию организма. Через 3-4 дня наблюдалась гибель подопытных животных. Специфичность заболевания животных подтверждена исследованиями биоматериала методом ПЦР.
Таким образом, штамм «Шеба» вируса Carnivore protoparvovirus 1 панлейкопении кошек, полученный в соответствии с предлагаемым изобретением, обладает высокой биологической, антигенной активностью, пригоден для изготовления инактивированных вакцин, определения их иммуногенной активности, а также диагностических целей, и расширяет арсенал новых отечественных производственных штаммов вируса панлейкопении кошек.
Источники информации, принятые во внимание при составлении описания изобретения к заявке на выдачу патента Российской Федерации на изобретение «Штамм «Шеба» вируса Carnivore protoparvovirus 1 панлейкопении кошек для изготовления биопрепаратов для диагностики и специфической профилактики панлейкопении кошек»:
1. Алипер Т.И., Непоклонов Е.А., Мухин А.Н. и др. Диагностика и профилактика инфекционных болезней кошек и кошек: руководство для практикующих ветеринарных врачей. Под ред. Т.И. Алипера. М.: ЗооВетКнига; 2017. 300 с.
2. Rehme Т., Hartmann К., Truyen U., Zablotski Y., Bergmann M. Feline Panleukopenia Outbreaks and Risk Factors in Cats in Animal Shelters. Viruses. 2022 Jun 8;14(6):1248. doi: 10.3390/v14061248. PMID: 35746719; PMCID: PMC9227120.
3. Truyen U., Addie D., Belak S., Boucraut-Baralon C, Egberink H., Frymus Т., Gruffydd-Jones Т., Hartmann K., Hosie M.J., Lloret A., Lutz H., Marsilio F., Pennisi M.G., Radford A.D., Thiry E., Horzinek M.C. Feline panleukopenia. ABCD guidelines on prevention and management. J Feline Med Surg. 2009 Jul; 11(7):538-46. doi: 10.1016/j.jfms.2009.05.002. PMID: 19481033; PMCID: PMC7129762.
4. Cotmore S.F., Tattersall P. Parvoviral host range and cell entry mechanisms. Adv Virus Res. 2007;70:183-232. doi: 10.1016/S0065-3527(07)70005-2. PMID: 17765706.
5. Mira F., Canuti M., Purpari G., Cannella V., Di Bella S., Occhiogrosso L., Schird G., Chiaramonte G., Barreca S., Pisano P., Lastra A., Decaro N., Guercio A. Molecular Characterization and Evolutionary Analyses of Carnivore Protoparvovirus 1 NS1 Gene. Viruses. 2019 Mar 29;11(4):308. doi: 10.3390/v11040308. PMID: 30934948; PMCID: PMC6520740.
6. Truyen U., Parrish C.R. Canine and feline host ranges of canine parvovirus and feline panleukopenia virus: distinct host cell tropisms of each virus in vitro and in vivo. J Virol. 1992 Sep;66(9):5399-408. doi: 10.1128/JVI.66.9.5399-5408.1992. PMID: 1323703; PMCID: PMC289096.
7. Truyen U., Parrish C.R. Feline panleukopenia virus: its interesting evolution and current problems in immunoprophylaxis against a serious pathogen. Vet Microbiol. 2013 Jul 26;165(l-2):29-32. doi: 10.1016/j.vetmic.2013.02.005. Epub 2013 Feb 18. PMID: 23561891.
8. WSAVA Руководство по вакцинации собак и кошек. - URL: https://wsava.org/ (дата обращения 28.03.23 г.).
9. Пуревакс RCPCh. - URL: https://www.vetlek.ru/directions/?id=448 (дата обращения 28.03.23 г.)
10. Нобивак Tricat Trio. - URL: https://vetsna PLI b.info/vetpreparaty/nobivak-tricat-trio-s-rastvoritelem-nobivak-diluent/ (дата обращения 28.03.23 г.).
11. Лейкофелиген. - URL: https://www.vetlek.ru/directions/?id=1113 (дата обращения 28.03.23 г.).
12. Фелоцел CVR. - URL: https://www.vetlek.ru/articles/?id=250 (дата обращения 28.03.23 г.)
13. ГОСТ 28085-13 «Средства лекарственные биологические для ветеринарного применения. Метод бактериологического контроля стерильности».
14. ГФ XIV, т. 2, с. 2997-3008 Испытания на присутствие микоплазм (ОФС.1.7.2.0031.15).



--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing dtdVersion="V1_3" fileName="FPV Sheba -
XML.xml" softwareName="WIPO Sequence" softwareVersion="2.1.2"
productionDate="2023-03-03">
<ApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>0</ApplicationNumberText>
<FilingDate>2023-03-03</FilingDate>
</ApplicationIdentification>
<ApplicantFileReference>488</ApplicantFileReference>
<EarliestPriorityApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>0</ApplicationNumberText>
<FilingDate>2023-03-03</FilingDate>
</EarliestPriorityApplicationIdentification>
<ApplicantName languageCode="ru">ФГБУ "Федеральный центр охраны
здоровья животных" (ФГБУ "ВНИИЗЖ")</ApplicantName>
<ApplicantNameLatin>FGBI "ARRIAH"</ApplicantNameLatin>
<InventorName languageCode="ru">Доронин Максим
Игоревич</InventorName>
<InventorNameLatin>Doronin Maksim Igorevich </InventorNameLatin>
<InventionTitle languageCode="ru">Штамм «Шеба» вируса панлейкопении
кошек для изготовления биопрепаратов для диагностики и специфической
профилактики панлейкопении кошек</InventionTitle>
<SequenceTotalQuantity>2</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>4614</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..4614</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>genomic DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q1">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>FPV</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>gaccgttactgacattcgcttcttgtctttgacagagtgaacctctctt
actttgactaaccatgtctggcaaccagtatactgaggaagttatggagggagtaaattggttaaagaaa
catgcagaaaatgaagcattttcgtttgtttttaaatgtgacaacgtccaactaaatggaaaggatgttc
gctggaacaactataccaaaccaattcaaaatgaagagctaacatctttaattagaggagcacaaacagc
aatggatcaaaccgaaaaagaagaaatggactgggaatcggaagttgatagtctcgccaaanngcangta
caancttttgatgcattaattaaaaaatgtctttttgaagtctttgtttctaaaaatatagaaccaaatg
aatgtgtttggtttattcaacatgaatggggaaaagatcaaggctggcattgtcatgttttacttcatag
taagaacttacaacaagcaactggtaaatggctacgcagacaaatgaatatgtattggagtagatggttg
gtgactctttgttcagtaaacttaacaccaactgaaaagattaagctcagagaaattgcagaagatagtg
aatgggtgactatattaacatacagacataagcaaacaaaaaaagactatgttaaaatggttcattttgg
aaatatgatagcatattactttttaacaaagaaaaaaattgtccacatgacaaaagaaagtggctatttt
ttaagtactgattctggttggaaatttaactttatgaagtatcaagacagacaaactgtcagcacacttt
acactgaacaaatgaaaccagaaaccgttgaaaccacagtgacgacagcacaggaaacaaagcgcgggag
aattcaaactaaaaaggaagtgtcaatcaaatgtactttgcgggacttggttagtaaaagagtaacatca
cctgaagactggatgatgttacaaccagatagttatattgaaatgatggcacaaccaggaggtgaaaacc
ttttaaaaaatacacttgaaatttgtactttgactttagcaagaacaaaaacagcatttgaattaatact
tgaaaaagcagataatactaaactaactaactttgatcttgcaaattctagaacatgtcaaatttttaga
atgcacggatggaattggattaaagtttgtcacgctatagcatgtgttttaaatagacaaggtggtaaaa
gaaatacagttctttttcatggaccagcaagtacaggaaaatctattattgctcaagccatagcacaagc
tgtgggtaatgttggttgttataatgcagcaaatgtaaattttccatttaatgactgtaccaataaaaat
ttaatttggattgaagaagctggtaactttggtcaacaagttaatcaatttaaagcaatttgttctggac
aaacaattagaattgatcaaaaaggtaaaggaagtaaacaaattgaaccaactccagtaattatgacaac
taatgaaaatataacaattgtaagaattggatgtgaagaaagacctgaacatacacaaccaataagagac
agaatgttgaacattaagttagtatgtaagcttccaggagactttggtttggttgataaagaagaatggc
ctttaatatgtgcatggttagtcaaacatggttatgaatcaaccatggctaactatacacatcattgggg
aaaagtaccagaatgggatgaaaactgggcggagcctaaaatacaagaaggtataaatttaccaggttgc
aaagacttagagacacaaacggcaagcaatcctcagagtcaagaccaagttctaactcctctgactccgg
acgtagtggaccttgcactggaaccgtggagtactccagatacgcctattgcagaaactgcaaatcaaca
atcaaaccaacttggcgttactcacaaagacgtgcaagcgagtccgacgtggtccgaaatagaggcagac
ctgagagccatctttacttctgaacaattggaagaagattttcgagacgacttggattaaggtacgatgg
cacctccggcaaagagagccaggagaggtaagggtgtgttagtagggtggggggaggggaaagatttaat
aacttaactaagtatgtgtttttttataggacttgtgcctccaggttataaatatcttgggcctgggaac
agtcttgaccaaggagaaccaactaacccttctgacgccgctgcaaaagaacacgacgaagcttacgctg
cttatcttcgctctggtaaaaacccatacttatatttctcgccagcagatcaacgctttatagatcaaac
taaggacgctaaagattggggggggaaaataggacattatttttttagagctaaaaaggcaattgctcca
gtattaactgatacaccagatcatccatcaacatcaagaccaacaaaaccaactaaaagaagtaaaccac
cacctcatattttcatcaatcttgccaaaaaaaaaaaagccggtgcaggacaagtaaaaaaaaacaatct
tgcaccaatgagtgatggaccatttcacccaaacgggggtcaacctgctgtcaaaaatgaaaaagctaca
ggatctggaaacgggtcgggaggcggggggggggggggttctgggggggtggggatttctacgggtactt
tcaataatcaaacggaatttaattttttggaaaacggaggggtggaaatcacagcaaactcaaccaaact
tgtacttttaaatatgccagaaagtgaaaattataaaagagtagttgtaaataatatggataaaactgca
gttaaaggaaacatggctttagatgatactcatgtacaaattgtaacaccttggtcattggttgatgcaa
atgcttggggagtttggtttaatccaggagattggcaactaattgttaatactatgagtgagttgcattt
agttagttttgaacaagaaatttttaatgttgttttaaagactgtttcagaatctgctactcagccacca
actaaagtttataataatgatttaactgcatcattgatggttgcattagatagtaataatactatgccat
ttactccagcagctatgagatctgagacattgggtttctatccatggaaaccaaccataccaactccatg
gagatattattttcaatgggatagaacattaataccatctcatactggaactagtggcacaccaacaaat
gtatatcatggtacagatccagatgatgttcaattttatactattgaaaattctgtgccagtacacttac
taagaacaggtgatgaatttgctacaggaacatttttttttgattgtaaaccatgtagactaacacatac
atggcaaacaaatagagcattgggcttaccaccatttctaaattctttgcctcaatctgaaggagctact
aactttggtgatataggagttcaacaagataaaagacgtggtgtaactcaaatgggaaatacagactata
ttactgaagctactattatgagaccagctgaggttggttatagtgcaccatattattcttttgaagcatc
cacacaagggccatttaaaacacctattgcagcaggacgggggggagcgcaaacagatgaaaatcaagca
gcaaatggtgatccaagatatgcatttggtagacagcatggtcaaaaaactactgcaacaggagaaacac
ctgagagatttacatatatagcacatcaagatacaggaagatatccagaaggagattggattcaaaatat
taactttaaccttcctgtaacaaatgataatgtattgctaccaacagatccaattggaggtaaaacagga
attaactatactaatatatttaatacttatggtcctttaactgcattaaataatgtaccaccagtttatc
caaatggtcaaatttgggataaagaatttgatactgacttaaaaccaagacttcatgtaaatgcaccatt
tgtttgtcaaaataattgtcctggtcaattatttgtaaaagttgcgcctaatttaacaaatgaatatgat
ccagatgcatctgctaatatgtcaagaattgtaacttactcagatttttggtggaaaggtaaattagtat
ttaaagctaaactaagagcatctcatacttggaatccaattcaacaaatgagtattaatgtagataacca
atttaactatgtaccaaataatattggagctatgaaaattgtatatgaaaaatctcaactagcacctaga
aaattatattaatatactcactgtgtttttatgtttattacatatcaactagcacctaaaaaattatatt
aatatacttactatgtttttatgtttattacatattattttaagattaattaaattacagcatagaaata
ttatacttgtatttgatataggatttagaaggtttgttatatggtatacaataactgtaagaaatagaag
aacatttagatcatagttagtagtttgttttataaaatgtattgtaaactattaatgtatgttgttatgg
tgtgggtggttggtt</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>1437</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..1437</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>FPV</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>DRYHSLLVFDRVNLSYFDPCLATSILRKLWREIGRNMQKMKHFRLFLNV
TTSNMERMFAGTTIPNQFKMKSHLLEEHKQQWIKPKKKKWTGNRKLIVSPXXXYXLLMHLKNVFLKSLFL
KINQMNVFGLFNMNGEKIKAGIVMFYFIVRTYNKQLVNGYADKICIGVDGWLFVQTHQLKRLSSEKLQKI
VNGLYHTDISKQKKTMLKWFILEIHITFQRKKLSTQKKVAIFVLILVGNLTLSIKTDKLSAHFTLNKNQK
PLKPQRQHRKQSAGEFKLKRKCQSNVLCGTWLVKEHHLKTGCYNQIVILKWHNQEVKTFKIHLKFVLLQE
QKQHLNYLKKQIILNLTLILQILEHVKFLECTDGIGLKFVTLHVFIDKVVKEIQFFFMDQQVQENLLLLK
PHKLWVMLVVIMQQMIFHLMTVPIKIFGLKKLVTLVNKLINLKQFVLDKQLELIKKVKEVNKLNQLQLQL
MKIQLELDVKKDLNIHNQETECTLSYVSFQETLVWLIKKNGLYVHGSNMVMNQPWLTIHIIGEKYQNGMK
TGRSLKYKKVIYQVAKTRHKRQAILRVKTKFLLLRTWTLHWNRGVLQIRLLQKLQINNQTNLALLTKTCK
RVRRGPKRQTEPSLLLNNWKKIFETTWIKVRWHLRQREPGEVRVCGGGRGKILNVCVFLDLCLQVINILG
LGTVLTKENQLTLLTPLQKNTTKLTLLIFALVKTHTYISRQQINALIKLRTLKIGGGKDIIFLELKRQLL
QYLIHQIIHQHQDQQNQLKEVNHHLIFSSILPKKKKPVQDKKKTILHQVMDHFTQTGVNLLSKMKKLQDL
ETGREAGGGGVLGGWGFLRVLSIIKRNLIFWKTEGWKSQQTQPNLYFICQKVKIIKELIIWIKLQLKETW
LMILMYKLHLGHWLMQMLGEFGLIQEIGNLLILVSCILVLNKKFLMLFRLFQNLLLSHQLKFIIMILHHW
LHIVIILCHLLQQLDLRHWVSIHGNQPYQLHGDIIFNGIEHYHLILELVAHQQMYIMVQIQMMFNFILLK
ILCQYTYEQVMNLLQEHFFLIVNHVDHIHGKQIEHWAYHHFILCLNLKELLTLVIEFNKIKDVVLKWEIQ
TILLKLLLDQLRLVIVHHIILLKHPHKGHLKHLLQQDGGERKQMKIKQQMVIQDMHLVDSMVKKLLQQEK
HLRDLHIHIKIQEDIQKEIGFKILTLTFLQMIMYCYQQIQLEVKQELTILIYLILMVLLHIMYHQFIQMV
KFGIKNLILTNQDFMMHHLFVKIIVLVNYLKLRLIQMNMIQMHLLICQELLTQIFGGKVNYLKLNEHLIL
GIQFNKVLMITNLTMYQIILELKLYMKNLNHLENYINILTVFLCLLHINHLKNYINILTMFLCLLHIILR
LIKLQHRNIILVFDIGFRRFVIWYTITVRNRRTFRSLVVCFIKCIVNYCMLLWCGWLV</INSDSeq_se
quence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---

Изобретение относится к области биотехнологии и касается нового штамма «Шеба» вируса Carnivore protoparvovirus 1 панлейкопении кошек семейства Parvoviridae, рода Protoparvovirus, вида Carnivore protoparvovirus 1, депонированный во Всероссийской государственной коллекции экзотических типов вируса ящура и других патогенов животных ФГБУ «ВНИИЗЖ» под регистрационным номером: №455 - деп/23-5 - ГКШМ ФГБУ «ВНИИЗЖ». Представленный штамм репродуцируется в перевиваемой культуре клеток почки кошки (CRFK). В перевиваемой культуре клеток почки кошки CRFK в течение 120 часов инкубирования титр инфекционной активности вируса достигает значений 9,47±0,90 log2 НА, сохраняя исходные характеристики при пассировании в клеточной культуре на протяжении 5 пассажей. Представленный штамм может быть использован для изготовления биопрепаратов для диагностики и специфической профилактики панлейкопении кошек и для контроля антигенной активности вакцин против данного заболевания. 1 ил., 4 табл., 6 пр.
Штамм «Шеба» вируса Carnivore protoparvovirus 1 панлейкопении кошек, депонированный во Всероссийской государственной коллекции экзотических типов вируса ящура и других патогенов животных ФГБУ «ВНИИЗЖ» под регистрационным номером: №455 - деп/23-5 - ГКШМ ФГБУ «ВНИИЗЖ» для изготовления биопрепаратов для диагностики и специфической профилактики панлейкопении кошек.
| АЛИПЕР Т.И., и др | |||
| Диагностика и профилактика инфекционных болезней кошек и кошек: руководство для практикующих ветеринарных врачей | |||
| Под ред | |||
| Т.И | |||
| Алипера | |||
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| ТКАЦКИЙ СТАНОК | 1920 |
|
SU300A1 |
| REHME Т., et al, Feline Panleukopenia Outbreaks and Risk Factors in Cats in Animal Shelters | |||
| Viruses | |||
| Способ получения продуктов конденсации фенолов с формальдегидом | 1924 |
|
SU2022A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| PMID: | |||
Авторы
Даты
2023-11-01—Публикация
2023-06-15—Подача