Изобретение относится к области биотехнологии и производству вакцин против калицивироза кошек, а именно к способу опосредованного определения титра инфекционной активности калицивируса кошек в сырье для вакцины методом полимеразной цепной реакции в режиме реального времени с применением разработанной логарифмической функции зависимости величины порогового цикла амплификации и титра инфекционной активности калицивируса кошек.
Калицивироз кошек (калицивирусная инфекция кошек) -высококонтагиозное вирусное заболевание, характеризующееся преимущественно поражением слизистой ротовой полости и верхних дыхательных путей [1, 2]. Вирус распространен повсеместно и поражает домашних кошек всех пород и возрастов, а также зоопарковых и диких представителей семейства кошачьих.
Возбудитель заболевания Feline calicivirus (FCV), относится к порядку Picornavirales, семейству Caliciviridae, роду Vesivirus. Нуклеиновая кислота вируса представлена одноцепочечной РНК (+) размером около 7690 н.о. Картирование генома калицивируса кошек (FCV) представлено в таблице 1, из которой видно, что 5'-NTR (нетранслируемый регион) соответствует 1…19 и.о., ORF1 (2С, протеаза, РНК-полимераза) - 20…5311 и.о., ORF2 (структурный белок VP1) - 5314…7329 и.о., ORF3 (белок VP2 с неизвестной функцией)-7617…7643 н.о. [3, 4, 5].
По литературным данным калицивироз кошек обнаруживали в 18-30% случаев заболеваний, связанных с поражением верхних дыхательных путей [2-4]. Также широко распространено вирусоносительство (до 75%), особенно среди бродячих кошек [6, 7]. Помимо часто встречающихся симптомов язвенного стоматита, ринита и конъюнктивита, заболевание может проявляться хромотой, отеками головы и конечностей, пневмонией, некрозами языка и неба, поражением желудочно-кишечного тракта [6, 8].
В различных источниках описана системная инфекция, вызывающая гибель до 60% заболевших животных [8, 9, 10]. Калицивирус характеризуется высокой степенью изменчивости и большим антигенным разнообразием штаммов, что значительно снижает эффективность существующих вакцин. Изучение генетической структуры штаммов кеалицивируса, циркулирующих на территории РФ, значительно облегчит разработку средств специфической профилактики, обеспечивающих надежную защиту от данной инфекции.
Система мер для борьбы с калицивирозом кошек и его профилактики предусматривает иммунизацию домашних животных [8]. Для этой цели применяют вакцинные препараты. При их изготовлении вируссодержащее сырье исследуют на определение титра инфекционной активности калицивируса кошек для оценки его активности в клетках. В 1,0 см3 суспензии вируса определяют количество клеточных культуральных инфекционных доз, вызывающих 50%-ное поражение клеток, что фактически отражает концентрацию полных вирусных частиц, содержащих РНК калицивируса кошек в активном состоянии.
Традиционно для определения титра инфекционной активности калицивируса кошек применяют метод титрования в перевиваемой монослойной культуре клеток почки кошки (CrFK), с помощью которой вычисляют минимальную дозу вируса, способную вызвать лизис 50% клеток (прототип). Данный метод имеет некоторые недостатки: 1) длительная процедура титрования, связанная с поражением клеток вирусом; 2) определенная степень субъективности при оценке результатов исследования; 3) высокая стоимость клеточной линии как тест-системы и затраты на ее поддержание; 4) высокая вероятность риска контаминации культуры клеток.
В связи с этим целесообразно провести поиск альтернативного способа опосредованного определения титра инфекционной активности калицивируса кошек в сырье для вакцины методом ПЦР в режиме реального времени.
Предложенный метод является высокочувствительным и специфичным, объективным и позволяет определять титр инфекционной активности калицивируса в вируссодержащих суспензиях в течение 3,0-3,5 часов, не требует использования культуры клеток для анализа, не предполагает контаминации исследуемых образцов, поскольку во время анализа пробирки закрыты, и предусматривает оценку степени чистоты выделенных элюатов РНК.
Задачей настоящего изобретения является разработка высокочувствительного, высокоспецифичного, экспрессного, объективного, не предполагающего применения линий клеток способа опосредованного определения титра инфекционной активности калицивируса кошек в сырье для вакцины методом ПЦР в режиме реального времени с целью устранения вышеуказанных недостатков.
Данная задача решена благодаря созданию нового опосредованного определения титра инфекционной активности калицивируса кошек в сырье для вакцины методом ПЦР в режиме реального времени. Разработанный способ дает возможность: 1) сократить время проведения анализа вируссодержащих суспензий для определения титра инфекционной активности калицивируса кошек до 3,0-3,5 ч; 2) исключить вероятность контаминации исследуемого образца; 3) увеличить чувствительность и специфичность анализа за счет применения высокоспецифичных оригинальных праймеров и ДНК-зонда, рассчитанных для 5'-NTR (нетранслируемый регион) и ORF1 (2С-белок); 4) повысить достоверность проводимого анализа благодаря установлению зависимости между титром инфекционной активности калицивируса кошек (TFCV) и пороговым циклом амплификации (Ct), представленной в виде логарифмической функции lg TFCV=-0,3012 × Ct+9,4669 с высокой достоверностью аппроксимации (R2=0,9991) и эффективностью амплификации 100,00%. Предложенная модель позволяет опосредованного определять титр инфекционной активности калицивируса кошек в сырье для вакцины методом ПЦР в режиме реального времени.
Сущность изобретения отражена на графических изображениях:
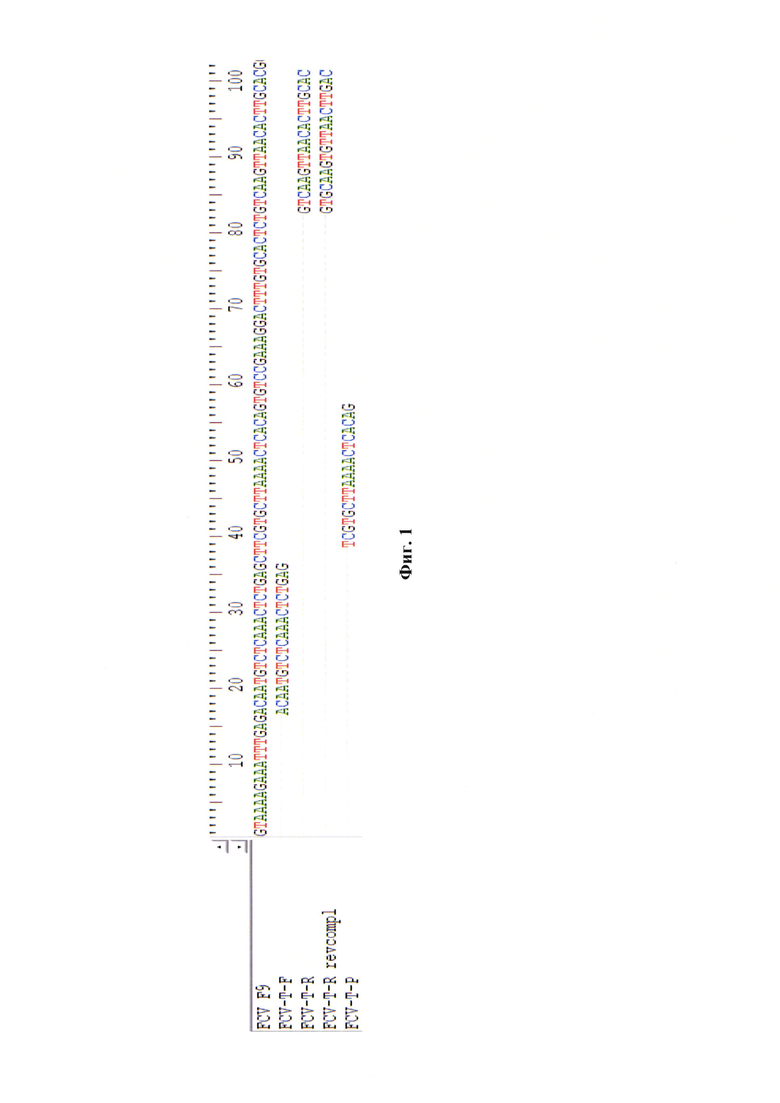
Фиг. 1 - Нуклеотидная последовательность прямого, обратного праймеров и молекулярного ДНК-зонда при выравнивании с референтным штаммм «F9» калицивируса кошек. Примечание: используя выравнивания других изолятов и производственных штаммов получили тот же дизайн олигонуклеотидов.
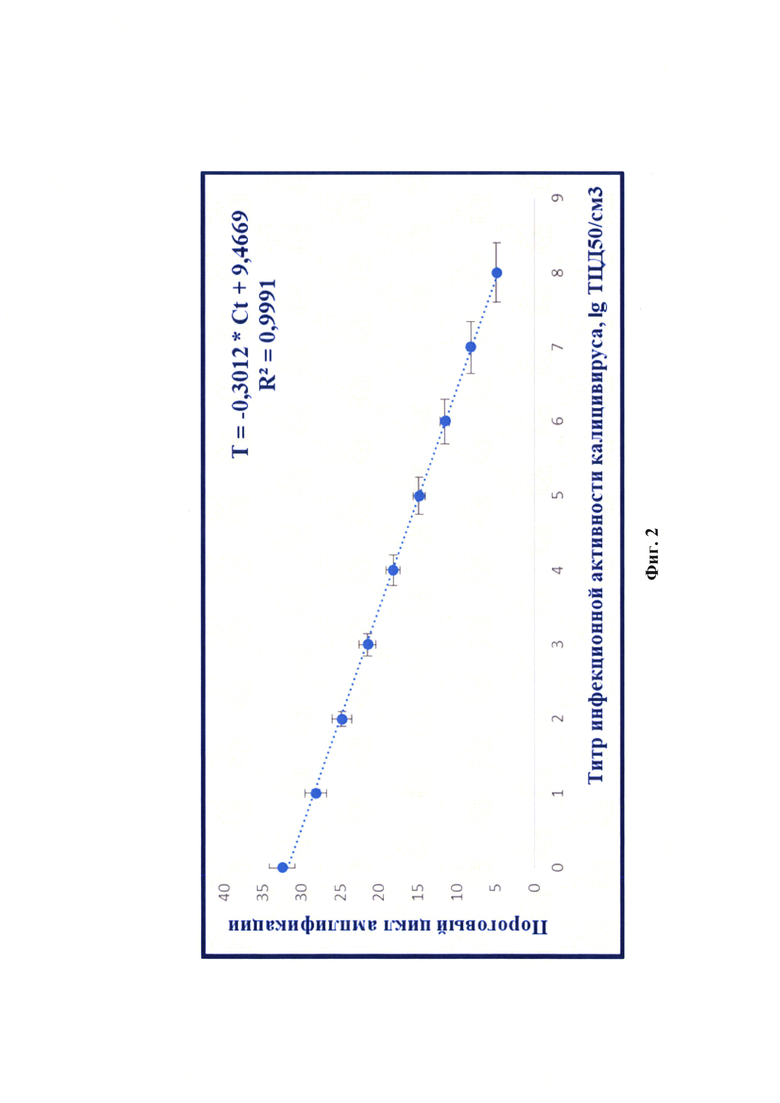
Фиг. 2 - Зависимость титра инфекционной активности калицивируса кошек (TFCV) и величины порогового цикла амплификации (Ct) с помощью метода ПЦР в режиме реального времени от (n=6, отмечены точки, отображающие средние значения пороговых циклов реакции амплификации).
Сущность изобретения заключается в подходе по опосредованному определению титра инфекционной активности калицивируса кошек в сырье для вакцины методом ПЦР в режиме реального времени. Заявляемый способ основан на: 1) элюировании РНК калицивируса с применением магнитных коллоидных частиц поверхностно-модифицированного оксида железа (II, III) Fe3O4 с инертной поверхностью за счет обработки полиэтиленимином (ПЭИ) и диаметром 100-110 нм; 2) проведении обратной транскрипции РНК с применением фермента MMLV-ревертазы; 3) амплификации специфического фрагмента 5'-NTR (нетранслируемый регион) и ORF1 (2С-белок) РНК калицивируса кошек с применение оригинальных специфических прямого и обратного праймеров, а также молекулярного зонда, меченого флуоресцентным красителем FAM (λmax флуоресценции=520 нм) и тушителем свечения RTQ-1 (λmax поглощения=520 нм); 4) проведение реакции амплификации с детекцей ампликонов с помощью флуоресцентного свечения и отображения накопления сигнала в виде сигмоиды, стремящейся к экспоненте; 5) определении титра инфекционной активности калицивируса кошек с применением логарифмической функции, выраженной в виде уравнения lg TFCV=-0,3012 × Ct+9,4669 с высокой достоверностью аппроксимации (R2=0,9991) и эффективностью амплификации 100,00%.
В настоящее время метод ПЦР в режиме реального времени применяют для индикации нуклеиновых кислот различных инфекционных агентов, в том числе калицивирусов. Для опосредованного определения титра инфекционной активности калицивируса кошек ранее данный метод с применением разработанной системы оригинальных праймеров и молекулярного зонда не использовался. Таким образом, сведений об аналогах предлагаемого способа опосредованного определения титра инфекционной активности калицивируса кошек в сырье для вакцины авторами не обнаружено.
Разработанный способ опосредованного определения титра инфекционной активности калицивируса кошек в сырье для вакцины с помощью метода ПЦР в режиме реального времени по сравнению с прототипом отличается более высокой чувствительностью и специфичностью, объективностью и экспрессностью выполнения анализа и значительным снижением риска контаминации.
В отличие от прототипа разработанный способ включает этап элюирования РНК калицивируса кошек с применением магнитных коллоидных частиц поверхностно-модифицированного Fe3O4 с инертной поверхностью за счет обработки ПЭИ и диаметром 100-110 нм; проведение обратной транскрипции РНК с применением фермента MMLV-ревертазы; амплификацию специфического фрагмента 5'-NTR (нетранслируемый регион) и ORF1 (2С-белок) РНК калицивируса кошек с применение оригинальных специфических прямого и обратного праймеров, а также молекулярного зонда, меченого флуоресцентным красителем FAM и тушителем свечения RTQ-1; проведение реакции амплификации с детекцией ампликонов с помощью флуоресцентного свечения и отображения накопления сигнала в виде сигмоиды, стремящейся к экспоненте; новый подход к методике опосредованного определения титра инфекционной активности калицивируса кошек с применением модели зависимости порогового цикла амплификации для кривой флуоресценции и титра инфекционной активности калицивируса кошек в виде логарифмической функции. Применение предложенного способа позволит сократить время проведения анализа вируссодержащих суспензий для определения титра инфекционной активности калицивируса кошек до 3,0-3,5 ч; исключить вероятность контаминации и использование клеточных линий; повысить специфичность и чувствительность анализа; увеличить достоверность проводимого анализа. Иными словами, актуально применять предложенный способ для опосредованного определения титра инфекционной активности калицивируса кошек в сырье для вакцины методом ПЦР в режиме реального времени.
Ключевым элементом заявляемого способа является определение значений пороговых циклов кривых реакции амплификации нуклеиновой кислоты калицивируса кошек в ПЦР режиме реального времени и расчет титра инфекционной активности данного вируса с использованием разработанной логарифмической модели зависимости порогового цикла амплификации и титра инфекционной активности.
Сопоставительный анализ с прототипом позволяет сделать вывод, что новизна и изобретательский уровень заявляемого изобретения заключается в применении способа на основе ПЦР в режиме реального времени, оригинальных специфичных праймеров и молекулярного зонда, рассчитанных на участок между 5'-NTR (нетранслируемый регион) и ORF1 (2С-белок), и разработанной логарифмической функции зависимости величины порогового цикла амплификации и титра инфекционной активности калицивируса кошек для опосредованного определения титра инфекционной активности данного вируса в сырье для вакцины.
Сущность предлагаемого изобретения пояснена на графическом материале - графике зависимости величины порогового цикла амплификации (Ct) и титра инфекционной активности калицивируса кошек (TFCV) (n=6) (фиг. 2).
С целью определения титра инфекционной активности калицивируса кошек подготавливают контрольную панель стандартов калицивируса штамма «F9», в качестве которых используют лиофильно высушенные суспензии вируса указанного штамма с титрами: 0,0; 1,0; 2,0; 3,0; 4,0; 5,0; 6,0; 7,0; 8,0 lg ТЦД50/см3, которые разводят 1/15 М фосфатно-буферным раствором до требуемого объема и титра инфекционной активности. В качестве отрицательных контролей применяют суспензию клеток CrFK, не зараженную калицивирусом кошек.
Из всех стандартных положительных образцов и отрицательных контролей, а также тестируемых проб выделяют РНК с помощью коллоидных частиц поверхностно-модифицированного Fe3O4 с инертной поверхностью за счет обработки ПЭИ и диаметром 100-110 нм. Данная процедура дает возможность избавляться от ингибиторов реакции амплификации при извлечении нуклеиновой кислоты из лизата [11].
Заранее готовят растворы для выделения РНК.
Лизирующий раствор. Смешивают гуанидинизотиоцианат (ГТЦ) (47,27 г), тритон Х-100 (2,02 г), поливинилпирролидон (2,00 г), тетрахлоруксусную кислоту (0,73 г) и ацетат аммония (0,40 г), растворяют в деионизированной воде, объем которой доводят до 100 мл. Конечная концентрация ГТЦ составляет 6 М, что на 2 М выше, чем обычно применяют в методике с использованием известных коммерческих наборов [11].
Раствор для отмывания 1 представляет собой 70% раствор этилового спирта.
Раствор для отмывания 2 представляет собой 100% изопропанол.
Раствор для элюирования РНК представляет собой буферный раствор ТЕ, состоящий из трис(оксиметил)аминометан (0,01 М) и этилендиамин-тетраацетата (0,001 М), свободного от РНКаз и ионов Mg2+(pH 7,20-7,35).
К 100 мкл суспензии калицивируса кошек добавляют 1000 мкл полученного лизирующего раствора, инкубируют содержимое в процессе перемешивания в течение 5 мин., затем продлевают инкубирование в открытом сухом термостате при температуре 60±2°С. К полученному лизату добавляют 10 мкл коллоидных частиц поверхностно-модифицированного Fe3O4, обработанных ПЭИ, с диаметром 100-110 нм. Содержимое пробирок тщательно перемешивают на вортексе, и помещают в магнитный штатив до полного осветления раствора. Не вынимая пробирки из магнитного штатива, удаляют супернатант, не захватывая магнитные частицы. Иными словами, оставляют магнитные частицы, которые сенсибилизированы РНК и балластными компонентами. На следующем этапе проводят отмывание магнитных частиц от балластных составляющих. Для этого в каждую пробирку добавляют по 500 мкл раствора для отмывания 1 (70% этиловый спирт), тщательно перемешивают на вортексе, и снова помещают в магнитный штатив до полного осветления раствора с последующим удалением супернатанта. Для очистки от гидрофобных примесей в каждую пробирку добавляют по 400 мл раствора для отмывки 2 (100% изопропанол), и повторяют процедуру с удалением жидкости в магнитном штативе. Пробирки с открытыми крышками оставляют в магнитном поле до полного высыхания магнитных частиц. В пробирки добавляют по 50 мкл раствора для элюирования (буфер ТЕ) и прогревают содержимое при температуре 60±2°С в течение 7 мин, периодически встряхивая их на вортексе. После процесса десорбции пробирки помещают в магнитный штатив и после полного осветления раствора, не задевая частицы, отбирают элюаты РНК. Полученный экстракт суммарной РНК хранят при температуре -20±2°С или сразу используют в дальнейшей работе.
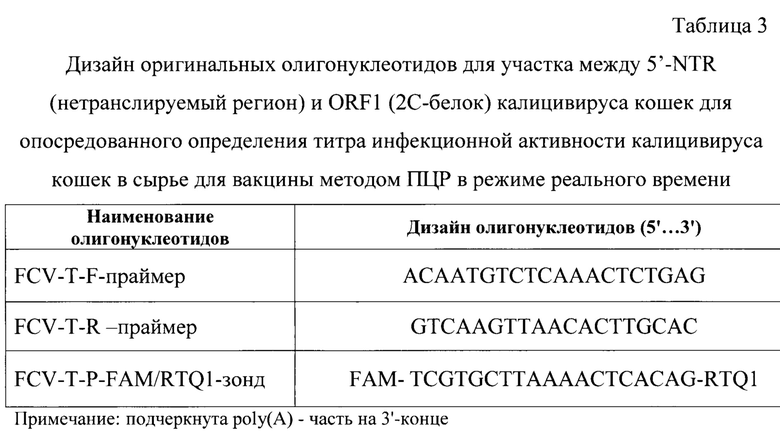
На следующем этапе проводят ПЦР в режиме реального времени для исследования контрольных образцов и проб. Для постановки реакции готовят реакционную смесь, рецептура которой представлена в таблице 2. Дизайн праймеров и молекулярного зонда отражены в таблице 3. Расчет праймеров и зонда проводили на основании нуклеотидных последовательностей между 5'-NTR (нетранслируемый регион) и ORF1 (2С-белок) калицивируса кошек производственного штамма «F9» и других изолятов, опубликованных в базах данных GenBank [12] и полученных в рамках исследований в «Федеральном центре охраны здоровья животных» (ФГБУ «ВНИИЗЖ»).
В качестве гомологичных участку между 5'-NTR (нетранслируемый регион) и ORF1 (2С-белок) калицивируса кошек олигонуклеотидов используют:
FCV-T-F-праймер (5'-ACAATGTCTCAAACTCTGAG-3'),
FCV-T-R-праймер (5'-GTCAAGTTAACACTTGCAC-3') и
FCV-T-P-зонд (5'-FAM-TCGTGCTTAAAACTCACAG-RTQ1-3') (фиг. 1) в концентрации 5 пМ на реакцию. Для элонгации применяют дезоксирибонуклеозидтрифосфаты с их концентрацией в реакционной смеси по 0,2 мМ. В качестве основы используют буферный раствор (5х), содержание которого составляет 20% от общего объема реакционной смеси. Буферный раствор включает в свой состав ионы калия (К+) (5×10-2 М) и диметилсульфооксид (DMSO) (1,3%). В смесь также добавляют хлорида магния до концентрации 3 мМ. В качестве катализаторов обратной транскрипции и ПЦР в режиме реального времени применяют следующие ферменты: MMLV-обратная транскриптаза (1 ед.) и Tag ДНК-зависимую ДНК-полимеразу (1 ед.). Элюаты РНК калицивируса кошек каждого образца добавляют к реакционной смеси по 5 мкл. Итоговый объем смеси для проведения одной реакции составляет 25 мкл.
Олигонуклеотиды для кДНК-матрицы подбирали в соответствии с рядом общих правил, которые отражены в работах В. Deiman и R. Sooknanan [13]. Длины FCV-T-F-праймера, FCV-T-R-праймера и FCV-T-P-зонда составляют 20, 19 и 19 и.о., что соответствует требованиям. Молекулярный вес олигонуклеотидов прямого, обратного праймеров и зонда равен 6085; 5771,8; 5771,7, соответственно. Праймеры и зонд очищены в полиакриламидном геле и с помощью высокоэффективной жидкостной хроматографии, соответственно. Нуклеотидная последовательность зонда не комплементарна олигонуклеотидным праймерам. Отсутствуют 4 и более подряд одинаковых нуклеотидов в цепи праймеров и зонда. Флуорофор FAM присоединен к 5'-концу, а гаситель флуоресценции RTQ1 - к 3'-концу. Данные условия соответствуют требованиям, предъявляемым к олигонуклеотидным праймерам и молекулярному зонду, которые участвуют в ПЦР в режиме реального времени. В качестве флуоресцентного красителя был выбран FAM с длиной волны максимальной флуоресценцией 520 нм. Для тушения свечения использовали гаситель флуоресценции RTQ1 с длиной волны максимального поглощения при 520 нм и возможном диапазоне гашения 470-570 нм. Иными словами, была выбрана подходящая пара «флуорофор-гаситель».
При анализе нуклеотидных последовательностей олигонуклеотидов установили, что для праймеров и зонда не характерно образование «шпилек», а также не выявлено З'-комплементарности и сайтов, отжигающих сами на себя. Расчет вероятности образования «шпилек» и димеров олигонуклеотидов проводили при условии, что минимальное количество пар оснований, необходимых для димеризации, - 5, а для образования «шпилек», - 4.
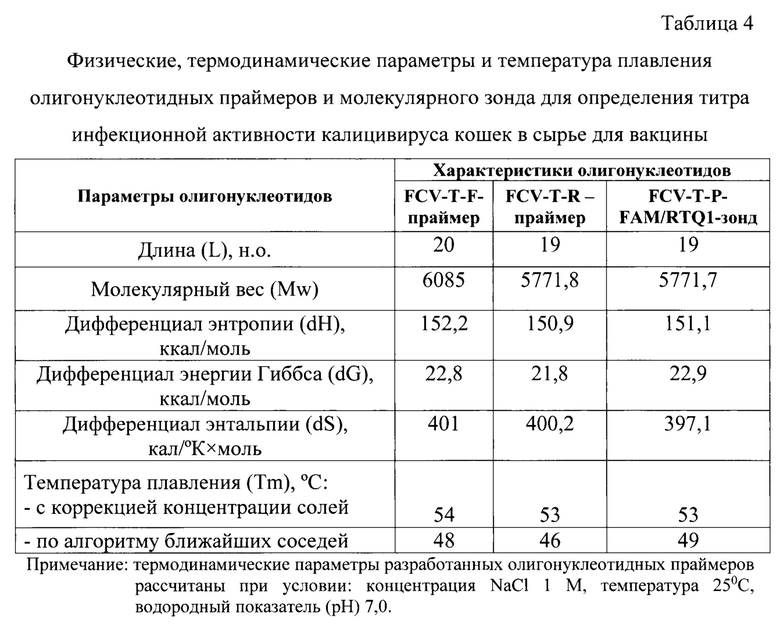
Проведено определение температур плавления (Tm) для олигонуклеотидных праймеров и зонда. Точное определение температуры плавления играет важную роль в молекулярно-биологических исследованиях, в том числе при подборе ДНК-праймеров и зонда для ПЦР в режиме реального времени кДНК калицивируса кошек. Для оценки температуры плавления олигонуклеотидов применяли несколько методов. Один из них - метод, учитывающий концентрации ионов К+ и диметилсульфооксида (DMSO) с применением формулы [13]:

где, [К+] - концентрация ионов калия (М),
[% DMSO] - количество диметилсульфооксида (%),
G - количество остатков гуанозинтрифосфата,
С - количество остатков цитидинтрифосфата.
Данный метод не является сверхточным, однако он позволяет оценить температуру плавления олигонуклеотидов.
Другой метод, который применяли в работе, высокоточный и основан на модели ближайших соседей {nearest neighbour, NN) с применением расчетной термодинамической формулы:
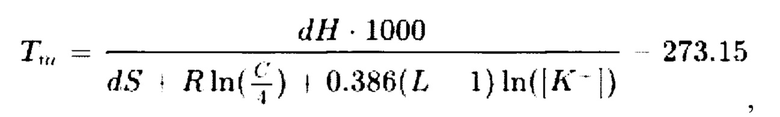
где, dH - дифференциал энтропии (ккал/моль),
dG - дифференциал энергии Гиббса (ккал/моль),
dS - дифференциал энтальпии (кал/°К-моль),
С - концентрация олигонуклеотида (М),
L - длина олигонуклеотида,
[К+] - концентрация ионов калия (М), In - натуральный логарифм.
В данной формуле учитывается длина олигонуклеотида (L), концентрация ионов калия ([К+]=5×10-2 М), газовая постоянная (R=1,987 кал/К⋅моль), концентрация олигонуклеотида в (с=2×10-7 М), значения энтропии (dH) (в ккал/моль) и энтальпии (dS) (в кал/°К×моль). Значения dH и dS вычисляли в соответствии с общеизвестными формулами и термодинамическими параметрами для ближайших соседей пар нуклеотидов при концентрации NaCl 1 М, температуре 25°С и значении водородного показателя рН 7,0.
Физические, термодинамические константы и расчет температур плавления разработанных олигонуклеотидных ДНК-праймеров и молекулярного зонда представлены в таблице 4. Из нее следует, что энтропия, энергия Гиббса и энтальпия для FCV-T-F-праймера составили 152,2 ккал/моль, 22,8 ккал/моль, 401 кал/(°К×моль), соответственно. Энтропия, энергия Гиббса и энтальпия для FCV-T-R-праймера составили 150,9 ккал/моль, 21,8 ккал/моль, 400,2 кал/(°К×моль), соответственно. Энтропия, энергия Гиббса и энтальпия для FCV-T-P-зонда - 151,1 ккал/моль, 22,9 ккал/моль, 397,1 кал/(°К×моль), соответственно. Данные значения необходимы для расчета температур плавления представленных олигонуклеотидов. Tm при использовании алгоритма ближайших соседей для прямого, обратного праймеров и зонда составили 48, 46, 49°С, соответственно.
При использовании более простого метода, учитывающего концентрации ионов К+ и диметилсульфооксида (DMSO) Tm для прямого, обратного праймеров и зонда составили 54, 53, 53 С.
Экспериментально было выявлено, что оптимальная температура отжига рассматриваемых олигонуклеотидов составляет 56°С.Для проведения ПЦР в режиме реального времени было решено проводить гибридизацию праймеров и зонда с участком между 5'-NTR (нетранслируемый регион) и ORF1 (2С-белок) при температуре 56°С.
Последовательности разработанных праймеров и молекулярного зонда проверили на наличие нежелательных совпадений с другими последовательностями нуклеиновых кислот с использованием Банка данных последовательности нуклеиновых кислот калицивируса. Последовательности праймеров и зонда также проанализировали на наличие внутренних вторичных структур с помощью программы сворачивания нуклеиновых кислот с помощью программы Mfold. Выявлено, что для разработанных олигонуклеотидов нежелательных совпадений с другими последовательностями нуклеиновых кислот, а также наличия внутренних вторичных структур не обнаружено.
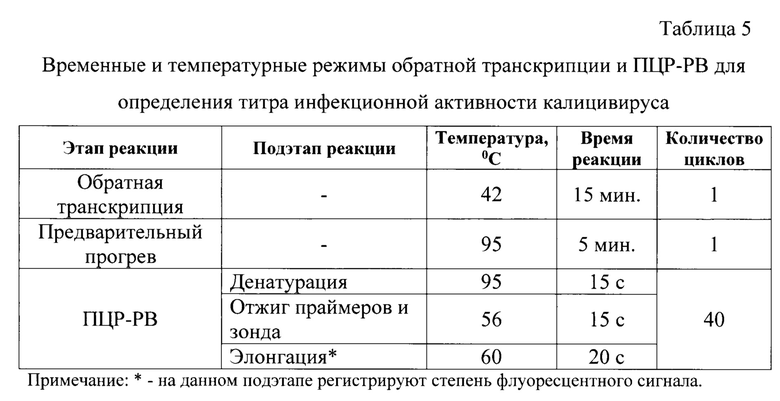
Постановку реакции осуществляли в детектирующем термоциклере любой марки при температурных и временных параметрах, сведения о которых представлены в таблице 5.
Обратную транскрипцию проводят при температуре 42°С в течение 15 мин. Перед проведением ПЦР в режиме реального времени осуществляют предварительный прогрев смеси при температуре 95°С в течение 5 мин. для активации фермента Taq ДНК-полимеразы и инактивации MMLV-ревертазы.
ПЦР в режиме реального времени включает в себя 3 подэтапа: денатурацию, отжиг олигонуклеотидов, элонгацию. Денатурацию проводят при температуре 95°С в течение 15 с, отжиг олигонуклеотидов - при температуре 56°С в течение 15 с, элонгацию - при температуре 60°С в течение 20 с (таблица 5).
Результаты реакции амплификации РНК в режиме реального времени анализируют, оценивая и сравнивая графики накопления флуоресцентного сигнала по значениям пороговых циклов амплификации Ct, определенных с помощью пересечения пороговой линии и логарифмическим отображением функции Fl=f (Ct). Учет результатов в реакции происходит на каждом цикле. Флуориметр определяет уровень флуоресценции и строит кинетическую кривую в координатах: уровень флуоресценции - цикл реакции амплификации. В случае присутствия в исследуемой пробе специфической кДНК-матрицы кинетическая кривая имеет экспоненциальную зависимость (график представлен в виде сигмоиды). Положительными считаются пробы, которым соответствуют сигмоиды, полученные при анализе флуоресценции красителя, входящего в состав молекулярного зонда. Пробы считаются отрицательными, если при их анализе отсутствует экспоненциальная кривая.
Устанавливают зависимость между пороговым циклом амплификации и титром инфекционной активности калицивируса кошек в сырье для вакцины в процессе построения логарифмической функции. Оценивают величину эффективности реакции амплификации (Е) по формуле:
Е=(10-1/к-1), где, k - угловой коэффициент в зависимости Ct=-k × lg TFCV+b, а также достоверность аппроксимации (R2). На основе разработанной модели рассчитывают значение титра инфекционной активности калицивируса кошек в сырье для вакцины.
Сущность предлагаемого изобретения пояснена примерами его использования, которые не ограничивают объем изобретения.
Пример 1. Выявление зависимости титра инфекционной активности калицивируса кошек в сырье для вакцины и порогового цикла реакции амплификации в виде логарифмической функции.
Для выявления зависимости титра инфекционной активности калицивируса кошек в сырье для вакцины и порогового цикла реакции амплификации подготавливали контрольную панель стандартов калицивируса кошек штамма «F9», в качестве которых использовали лиофилизированные суспензии вируса указанного штамма с титрами: 1,0; 2,0; 3,0; 4,0; 5,0; 6,0; 7,0; 8,0 lg ТЦД50/см3, которые растворяли в 1/15 М фосфатном буферном растворе до требуемого объема. В качестве отрицательных контролей применяли суспензию клеток CrFK, не зараженную калицивирусом кошек.
Из всех стандартных положительных образцов и отрицательных контролей, а также тестируемых проб выделяли РНК с помощью коллоидных частиц поверхностно-модифицированного Fe3O4 с инертной поверхностью за счет обработки ПЭИ и диаметром 100-110 нм. Процесс проводили, как описано выше.
Проводили обратную транскрипцию и ПЦР в режиме реального времени для исследования стандартов, как описано выше. Результаты реакции анализировали, оценивая и сравнивая графики накопления флуоресцентного сигнала по значениям пороговых циклов амплификации Ct, определенных с помощью пересечения пороговой линии и логарифмическим отображением функции Fl=f (Ct). Устанавливали зависимость между пороговым циклом амплификации и титром инфекционной активности калицивируса в сырье для вакцины в процессе построения логарифмической функции. Полученные данные отражены на фиг. 2 и выражены в виде логарифмической функции: lg TFCV=-0,3012 × Ct+9,4669 с высокой достоверностью аппроксимации (R2=0,9991) и эффективностью амплификации 100,00%. Предложенная модель позволяет опосредованного определять титр инфекционной активности калицивируса кошек в сырье для вакцины методом ПЦР в режиме реального времени.
Пример 2. Применение способа опосредованного определения титра инфекционной активности калицивируса в сырье для вакцины с использованием метода ОТ-ПЦР-РВ.
В исследовании использовали 6 суспензий культурального калицивируса кошек с титрами инфекционной активности 6,50; 6,75; 7,00; 7,25; 7,50; 7,75 lg ПЦД50/см3, соответственно (пробы №1-6). В качестве положительного контроля применяли суспензию культурального калицивируса с титром 7,00 lg ТЦД50/см3. В качестве отрицательных контролей применяли суспензию клеток CrFK, не зараженную калицивирусом кошек. Испытуемые пробы и контрольные образцы исследовали в пяти повторностях. Этапы выделения РНК, и постановку обратной транскрипции и ПЦР в режиме реального времени проводили, как описано в примере 1.
Средние значения пороговых циклов амплификации для проб №1-6 составляли 9,87±0,01, 9,01±0,02, 8,21±0,02, 7,36±0,01, 6,51±0,01, 5,72±0,01, соответственно. Пользуясь разработанной логарифмической функцией lg TFCV=-0,3012 × Ct+9,4669 (R2=0,9991, Е=100,00%), рассчитали средние значения титра инфекционной активности калицивируса кошек для проб №1-6, которые составили 6,49; 6,75; 6,99; 7,25; 7,51; 7,44 lg ТЦД50/см3, соответственно. Для положительного контроля значение порогового цикла амплификации составило 8,19±0,01, что соответствовало титру инфекционной активности калицивируса кошек, равному 7,00 lg ТЦД50/см3. Для отрицательных контролей экспоненциальные графики не были сформированы, что означало отсутствие калицивируса кошек в данных образцах.
Исследуемые образцы параллельно тестировали классическим методом титрования в монослойной клеточной линии CrFK. Обнаружили, что данные, полученные с помощью разработанного способа, коррелировали с методом титрования в культуре клеток на 99-100% (n=5). Полученные результаты свидетельствовали о высокой степени точности разработанного способа опосредованного определения титра инфекционной активности калицивируса кошек в сырье для вакцины методом ПЦР в режиме реального времени.
Иными словами, разработанный способ позволяет оценивать титр инфекционной активности калицивируса кошек в сырье для вакцины методом ПЦР в режиме реального времени.
Пример 3. Выявление степени достоверности определения титра инфекционной активности калицивируса кошек в сырье для вакцины с применением разработанного способа.
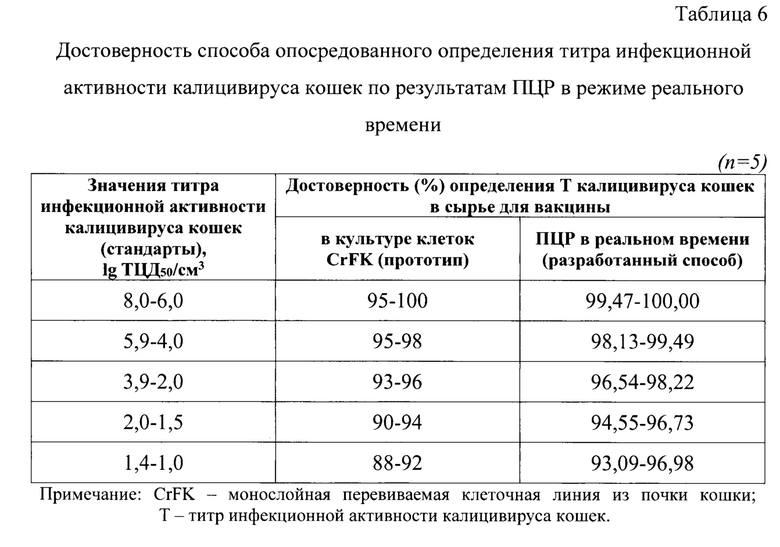
Для анализа использовали 245 суспензий культурального калицивируса кошек с титром инфекционной активности от 1,00 до 8,00 lg ТЦД50/см3. В качестве положительного контроля применяли суспензию культурального калицивируса кошек с титром инфекционной активности вируса 7,00 lg ТЦД50/см3. В качестве отрицательных контролей применяли суспензию клеток CrFK, не зараженную калицивирусом. Испытуемые пробы и контрольные образцы исследовали в трех повторностях. Этапы экстрагирования нуклеиновых кислот и постановку обратной транскрипции и ПЦР в режиме реального времени проводили, как отражено в примере 1. Результаты анализа представлены в таблице 6.
Интерпретацию результатов проводили, пользуясь разработанной логарифмической функцией lg TFCV=-0,3012 × Ct+9,4669 (R2=0,9991, Е=100,00%) с получением значений TFCV для каждой из 245 проб. Для положительного контроля значение порогового цикла амплификации составило 8,19±0,01, что соответствовало титру инфекционной активности калицивируса кошек, равному 7,00 lg ТЦД50/см3. Для отрицательных контролей экспоненциальные графики не были сформированы, что означало отсутствие калицивируса кошек в данных образцах.
Анализируемые пробы и контроли также тестировали классическим методом титрования в монослойной клеточной линии и в ПЦР в режиме реального времени. Выявили, что данные, полученные с помощью разработанного способа, коррелировали с методом титрования в культуре клеток на 99,47-100,00% для 8,0-6,0 lg ТЦД50/см3 (n=49), на 98,13-99,49% для 5,9-4,0 lg ТЦД50/см3 (n=49), на 94,55-98,22% для 3,9-1,5 lg ТЦД50/см3 (n=49), на 93,09-96,98% для 1,4-1,0 lg ТЦД50/см3 (n=49). Полученные результаты свидетельствовали о высокой степени точности разработанного способа опосредованного определения титра инфекционной активности калицивируса кошек в сырье для вакцины методом ПЦР в режиме реального времени.
Иными словами, разработанный способ позволяет с высокой степенью достоверности оценивать титр инфекционной активности калицивируса кошек в сырье для вакцины методом ПЦР в реальном времени.
Пример 4. Оценка аналитической чувствительности тест-системы, разработанной для способа опосредованного определения титра инфекционной активности калицивируса кошек в сырье для вакцины методом ПЦР в режиме реального времени.
При определении аналитической чувствительности разработанной тест-системы для способа опосредованного определения титра инфекционной активности калицивируса кошек подготавливали серию стандартов калицивируса кошек разных штаммов с TFCV, равными 1,00-8,00 lg ТЦД50/см3 с шагом 0,1 lg ТЦД50/см3. Контрольные образцы тестировали в 4 повторностях. Этапы элюирования нуклеиновой кислоты и постановку обратной транскрипции и ПЦР в режиме реального времени, как описано в примере 1. Выявлено, что с достоверностью 99,47-100,00% разработанным способом определены титры инфекционной активности калицивируса кошек со значениями от 6,0 до 8,0 lg ТЦД50/см3, с достоверностью 98,1-99,5% - с титрами от 4,0 до 5,9 lg ТЦД50/см3, с достоверностью 96,5-98,2%) - с титрами от 2,0 до 3,9 lg ТЦД50/см3, с достоверностью 94,5-96,7% - с титрами от 1,5 до 2,0 lg ТЦД50/см3, с достоверностью 93,0-96,98% - с титрами от 1,0 до 1,4 lg ТЦД5о/см3. При изготовлении вакцин применяют вируссодержащее сырье только с титрами инфекционной активности вируса ≥6,00 lg ТЦД50/см3. Для данных образцов достоверность определения титра инфекционной активности калицивируса кошек составляла 99,47-100%.
Следовательно, аналитическая чувствительность тест-системы, разработанной для способа опосредованного определения титра инфекционной активности калицивируса кошек в сырье для вакцины методом ПЦР в режиме реального времени, составляет не менее 1,0 lg ТЦД50/см3с достоверностью результатов исследования не менее 93,0%.
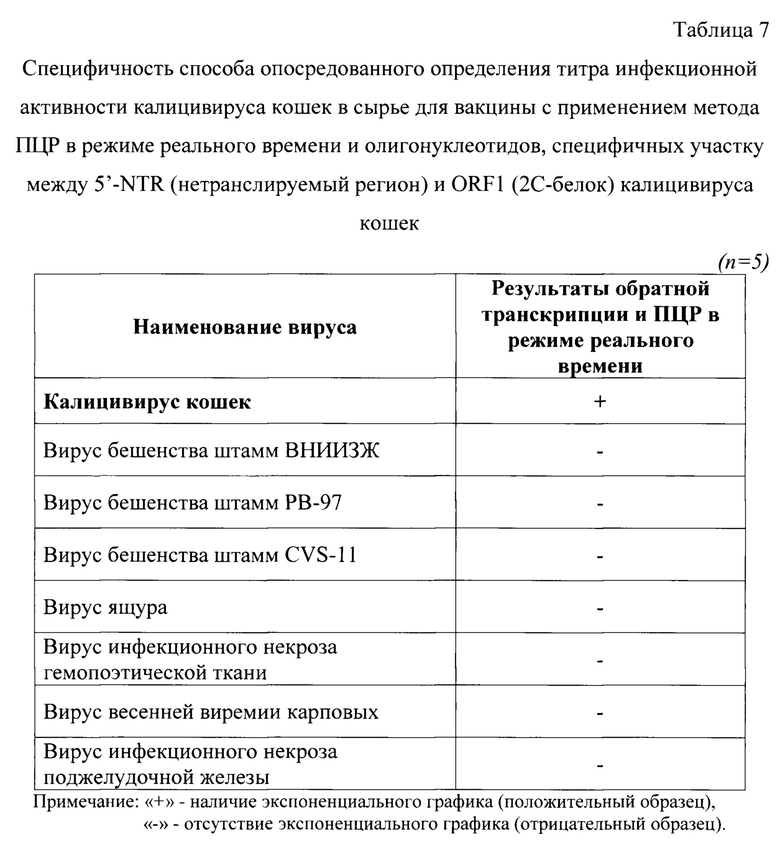
Пример 5. Оценка специфичности тест-системы, разработанной для способа опосредованного определения титра инфекционной активности калицивируса кошек в сырье для вакцины методом ПЦР в режиме реального времени.
При оценке специфичности тест-системы, разработанной для способа опосредованного определения титра инфекционной активности калицивируса кошек в сырье для вакцины методом ПЦР в режиме реального времени, исследовали суспензии калицивируса кошек, вируса бешенства штаммов «ВНИИЗЖ», «РВ-97», «CVS-П», вируса ящура штамма «О/Забайкальский/2016», инфекционного некроза гемопоэтической ткани лососевых, весенней виремии карповых, инфекционного некроза поджелудочной железы. Количество инфекционных доз вирусов в суспензиях составлял не менее 6,0 lg ТЦД50/см3. Исследования проводили в 5 повторностях.
Этапы элюирования РНК и постановку ПНР в режиме реального времени проводили, как описано в примере 1. Для проб, содержащих другие штаммы калицивируса и другие вирусы, не наблюдалось формирования графиков экспоненты, и они не выходили за пороговый уровень флуоресцентного сигнала (0,01 у.е.) (таблица 7). Таким образом, разработанный способ является специфичным по отношению к калицивирусу кошек и может быть использован для его количественного определения.
Основными преимуществами предлагаемого изобретения является возможность увеличить выход РНК калицивируса кошек в элюате за счет применения коллоидных частиц поверхностно-модифицированного оксида железа (II, III) Fe3O4 с инертной поверхностью за счет обработки полиэтиленимином и с диаметром 100-110 нм; исключить вероятность контаминации в ходе реакции; снизить время проведения анализа вируссодержащего сырья для вакцины до 3,0-3,5 ч; увеличить специфичность и чувствительность анализа по определению титра инфекционной активности калицивируса кошек. В предлагаемом изобретении между титром инфекционной активности калицивируса кошек (TFCV) и пороговым циклом амплификации (Ct) установлена зависимость, отраженная в виде логарифмической функции lg TFCV=-0,3012 × Ct+9,4669 (R2=0,9991, Е=100,00%). Разработанная математическая модель дает возможность оценивать титр инфекционной активности калицивируса кошек в сырье для производства вакцины.
Предлагаемое изобретение позволяет быстро и с высокой степенью достоверности определять титр инфекционной активности калицивируса кошек в сырье для вакцины на основе ПЦР в режиме реального времени с применением оригинальных специфических олигонуклеотидов для участка между 5'-NTR (нетранслируемый регион) и ORF1 (2С-белок) калицивируса кошек и разработанной логарифмической модели.
Источники информации, принятые во внимание при составлении описания изобретения к заявке на выдачу патента РФ на изобретение «Способ опосредованного определения титра инфекционной активности калицивируса кошек в сырье для вакцины методом ПЦР в режиме реального времени»:
1. Abd-Eldaim MM, Wilkes RP, Thomas KV, Kennedy MA. Development and validation of a TaqMan real-time reverse transcription-PCR for rapid detection of feline calicivirus. Arch Virol. 2009;154(4):555-60. doi: 10.1007/s00705-009-0337-5. Epub 2009 Mar 1. PMID: 19253013; PMCID: PMC7086925.
2. Алипер Т.И., Непоклонов Е.А., Мухин А.Н. и др. Диагностика и профилактика инфекционных болезней кошек и кошек: руководство для практикующих ветеринарных врачей. Под ред. Т.И. Алипера. М.: ЗооВетКнига; 2017. 300 с.
3. Komina A, Krasnikov N, Kucheruk О, Zhukova Е, Yuzhakov А, Gulyukin A. Distribution and genetic diversity of Feline calicivirus in Moscow metropolitan area. J Vet Sci. 2022 Nov; 23(6):e92. doi: 10.4142/jvs.22182. PMID: 36448438; PMCID: PMC9715382.
4. Глотова Т.И., Семенова O.B., Никонова A.A., Глотов А.Г., Вяткин Ю.В., Бондарь А.А. Выделение и филогенетический анализ калицивируса кошек в Сибири. Вопросы вирусологии. 2018; 63(6):268-274. DOI: http://dx.doi.org/ 10.18821/0507-4088-2018-63-6-268-274.
5. Hou J, Sanchez-Vizcaino F, McGahie D, Lesbros C, Almeras T, Howarth D, O'Hara V, Dawson S, Radford AD. European molecular epidemiology and strain diversity of feline calicivirus. Vet Rec. 2016 Jan 30; 178(5): 114-5. doi: 10.1136/vr. 103446. Epub 2016 Jan 25. PMID: 26811440; PMCID: PMC4752659.
6. Рахманина М.М. Калицивирусная инфекция кошек: биологические свойства возбудителя, эпизоотология, специфические средства и методы профилактики: Автореф. дисс.… д-ра ветеринар, наук. М.; 2005.
7. Hofmann-Lehmann R, Hosie MJ, Hartmann К, Egberink H, Truyen U, Tasker S, Belak S, Boucraut-Baralon C, Frymus T, Lloret A, Marsilio F, Pennisi MG, Addie DD, Lutz H, Thiry E, Radford AD, Mostl K. Calicivirus Infection in Cats. Viruses. 2022 Apr 29; 14(5):937. doi: 10.3390M4050937. PMID: 35632680; PMCID: PMC9145992.
8. Вакцина против калицивироза, вирусного ринотрахеита и панлейкопении кошек Нобивак Tricat Trio. - URL: https://www.vetlek.ru/directions/?id=l 12 (дата обращения 03.03.23 г.).
9. Zhou L, Fu N, Ding L, Li Y, Huang J, Sha X, et al. Molecular characterization and cross-reactivity of feline calicivirus circulating in Southwestern China. Viruses. 2021;13(9):1812.
10. Kim SJ, Park YH, Park KT. Development of a novel reverse transcription PCR and its application to field sample testing for feline calicivirus prevalence in healthy stray cats in Korea. J Vet Sci. 2020; 21(5):e71.
11. Boom R., Sol C.J.A., Salimans M.M.M., Hansen C.L. et al. Rapid and simple method for the purification of nucleic acids // J. Clin. Microbiol. - 1990. -Vol.28. - P. 495-503.
12. GenBank. [Электронный ресурс] / URL: http://www.ncbi.nlm.nih.gov. (Дата обращения: 02.02.2023).
13. Sooknanan R., van Gemen В., Malek L. Nucleis acid sequence-based amplification // Molecular methods for virus detection-London: Academic press, 1995. - P. 261-285.


Изобретение относится к биотехнологии и вирусологии. Предложен способ опосредованного определения титра инфекционной активности калицивируса кошек в сырье для вакцины методом полимеразной цепной реакции в режиме реального времени с применением оригинальных специфических олигонуклеотидов для участка между 5'-NTR (нетранслируемый регион) и ORF1 (2С-белок) калицивируса кошек и разработанной логарифмической функции зависимости величины порогового цикла амплификации и титра инфекционной активности калицивируса кошек. Предлагаемое изобретение позволяет быстро и с высокой степенью достоверности определять титр инфекционной активности калицивируса кошек в сырье для вакцины. Изобретение позволяет увеличить выход РНК калицивируса кошек в элюате, исключить вероятность контаминации в ходе реакции, снизить время проведения анализа вируссодержащего сырья для вакцины до 3,0-3,5 ч и увеличить специфичность и чувствительность анализа по определению титра инфекционной активности калицивируса кошек. 1 з.п. ф-лы, 2 ил., 7 табл., 5 пр.
1. Способ опосредованного определения титра инфекционной активности калицивируса кошек в сырье для вакцины методом ПЦР в режиме реального времени, включающий следующие стадии:
- выделение РНК калицивируса кошек с помощью коллоидных частиц поверхностно-модифицированного Fe3O4 с инертной поверхностью за счет обработки ПЭИ и диаметром 100-110 нм;
- проведение обратной транскрипции и реакции амплификации с детекцией флуоресцентного сигнала логистических кривых исследуемых образцов с использованием разработанных оригинальных олигонуклеотидов:
FCV-T-F-праймер с дизайном 5'- ACAATGTCTCAAACTCTGAG-3',
FCV-T-R-праймер с дизайном 5'- GTCAAGTTAACACTTGCAC-3' и
FCV-T-P-зонд с дизайном 5'-FAM-TCGTGCTTAAAACTCACAG-RTQ1-3',
которые рассчитаны на участок между генами 5'-NTR и ORF1 калицивируса кошек;
- расчет порогового цикла амплификации по данным ПЦР в режиме реального времени;
- определение титра инфекционной активности культурального калицивируса кошек в сырье для вакцины на основе разработанной логарифмической регрессионной функции: lg TFCV=-0,3012 × Ct+9,4669 с достоверностью аппроксимации 0,9991 и эффективностью амплификации 100,00%.
2. Способ по п. 1, отличающийся тем, что время проведения анализа сокращается до 3,0-3,5 ч, аналитическая чувствительность составляет не менее 1,0 lg ТЦД50/см3.
| Способ опосредованного определения титра инфекционной активности вируса бешенства штамма ВНИИЗЖ в сырье для инактивированной антирабической вакцины методом ПЦР в режиме реального времени | 2020 |
|
RU2755925C1 |
| Способ определения титра инфекционной активности вируса ящура в неинактивированном сырье для вакцины с применением метода обратной транскрипции-полимеразной цепной реакции в режиме реального времени | 2017 |
|
RU2674076C1 |
| Способ опосредованного определения титра инфекционной активности вируса ящура в неинактивированном сырье для вакцин с помощью математического двойного дифференциала данных точки crossing point при амплификации вирусной кДНК | 2022 |
|
RU2793900C1 |
| Способ опосредованного определения инфекционного титра вируса бешенства в неинактивированном сырье для антирабических вакцин при транскрипционной амплификации и детекции продуктов реакции с применением beacon-технологии | 2020 |
|
RU2756472C1 |
| Keven Lothert et al., Evaluating Novel Quantification Methods for Infectious Baculoviruses, Viruses, 15 p, Published: 19 April 2023. | |||
Авторы
Даты
2023-12-07—Публикация
2023-05-11—Подача