- метиновая группа или атом азота, углерод - углеродная связь между 3-м и 4-м положениями в карбостирильном . скелете является простой или двойной связью, замещенное положение группы
/ 3 формулы -0-А -CON явля «4
ется любым из 5-го, 6-го, 7-го или 8-го положений карбостирильного скелетаJ если группа формулы
-О-А-С ON „ нaxoдитcя
«4
в 5-м, 6-м, 7-м или 8-м положении карбостирильного скелета,
R,- атом водорода или низший алкнп; если R - группа
формулы -O-A-CON: 3,
К4
6-е, 7-е и 8-е положения в карбостирильном производном заняты атомами водорода и не замещены группой форму S
лы -0-А -CON
если Rj
низший алкил, R не может быть ни Cj - С д-циклоалкилом, С 3 - C j-циклоалкилнизшим алкилом, ни низшим алкилом,
отличающийся тем, что карбоксиалкокси-карбостирильное производное общей формулы
О-А-СООН Rt
I RI
глерод - углеродная связь меж- , 4-м положениями в карбостирил4ете имеют указанные значения: атом водорода, низший алкип или группа формулы -0-А -СООН, где А имеет указанные значения, группа -О-А -СООН находится в 5-м, 6-м, 7-м или 8-м положении карбостирильного скелета;: если группа -O-A-СООН находится в 5-м, 6-м, 7-м или 8-м положении карбостирильного скелета, атом водорода или низший алкил; если Rj группа
5-е, формулы -О-А -СООН, 5-е, 6-е, 7-е и 8-е положения карбостирильного скелета заняты атомами водорода . и не замещены группами формулы -0-А -СООН
ают взаимодействию с амином ормулы -
3
-HN;
X
где RJ и R имеют у:сазанные значения, с выделением целевого продукта в свободном виде.
























| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения карбостирильных производных | 1982 |
|
SU1395140A3 |
| Способ получения карбостирильных производных | 1981 |
|
SU1367857A3 |
| Способ получения карбостириловых производных (его вариант) | 1982 |
|
SU1779249A3 |
| Способ получения производных карбостирила | 1982 |
|
SU1331426A3 |
| Способ получения карбостирильных производных | 1981 |
|
SU1232144A3 |
| Способ получения тетразолилалкоксикарбостирилов | 1979 |
|
SU1064868A3 |
| Способ получения производных карбостирила | 1982 |
|
SU1356962A3 |
| Способ получения карбостирильных производных или их фармацевтически приемлемых солей с кислотами | 1979 |
|
SU1140687A3 |
| Способ получения производных карбостирила или их фармакологически приемлемых кислотно-аддитивных или четвертичных солей | 1980 |
|
SU1091857A3 |
| Способ получения карбостирильных соединений или их фармацевтически приемлемых солей | 1984 |
|
SU1331430A3 |
СПОСОБ ПОЛУЧЕНИЯ КАРБОСТИ.РИЛЬНЫХ ПРОИЗВОДНЫХ общей формулы R, О-А-С ON ,где R - атом водорода, низший ала кил, низший алкенил или фенил-низший алкил-, R- - атом водорода, низший алкил или группа формулы хКз 0-А -CON , в которой 4 А - насьш енная или ненасыщенная низшая алкиленовая группаi R, низший алкил окси-низший алкил, низший алканоилоксинизший алкнл или бензоилокси-низший алкилJ R.. С 3 - С -циклоалкил, который может содержать по крайней мере одну гидроксильную груп пу в качестве заместителя (лей) в циклоалкильном кольце, Сд - С р-циклоалкил-низший алкип, фенил, фенил-низСО ший алкил, которьй может иметь по крайней мере один низший алкоксил в качестве заместителя (лей) в фенильном кольце, низший алкил, который может иметь по крайней мере одну гидроксильную группу, пиридил или низший СП алкил, имеющий в качестве заместителя гетероцикличесCAD сд кий остаток, выбранный из группы, включающей пиридил, фурил, тетрагидрофурил, 3,4-дигидро-2Н-пиранил, тетрагидропиранил или тиенил Rj, R и связанный с ними атом азота, а также вместе или без другого атома азота, могут образовывать группу обг- щей формулы -N В-RK N-/ (Где Rj. - фенил, Cj - С -циклоалкил или фенил-низший алкил.

1
Изобретение относится к способу получения новых карбостирильных производных общей формулы
где R - атом водорода, низший алкил, низший алкенил или фенилнизший алкил,
R - атом водорода, низший алкил или группа формулы
R,
-О-А-CON
R/
где А насьш енная или ненасыщенная низшая алкиленовая группа. R. - низший алкил, окси-ниэший алкил, низший алканоилоксинизший алкил или бензоилок. си-низший алкил., R - Cj - С д-циклоалкил, которьй может содержать по крайней мере одну гидроксильную гру пу в качестве заместителя (заместителей) в циклоалкильном кольце, С - С гдиклоалкил-низший алкил, фенил фенил-низший алкил, которьй может содержать по крайней мере один низший алкоксил g качестве заместителя (заместителей) в фенильном коль це, низший алкил, которьй . может содержать по крайней мере одну гидроксильную груп пу, пиридил или низший алкил содержащий в качестве заместителя, гетероциклический ос таток, выбранными из группы включающей пиридил, .фурил, тетрагидрофурил, 3,4-дигидро -2Н-пиранил, тетрагидропиранил или тиенш R, R и связанный с ним атом азота, а также вместе или без другого атома азота, могут образовывать группу общей формулы -NQs-Rs где Rg - фенил Cj - С,д-циклоалкил, . или фенил-низший алкил, В - (метиновая группа или атом айота, углерод - углеродна связь между 3-ми и 4-ми пр ложениями в карбостирильно скелете является простой или двойной cвязьюj замещенное положение, группы формулы --0-А -CONявляется любым из 5-го, 6-го, 7-го или 8-го положений карбостирильного скелета} если группа -0-А -CON ц находитR fся в 5-м, 6-м, 7-м или. 8-м положении карбостирильного скелета, R,- - атом водорода или низший алкил, если R - группа формулы -о-А -CON Г., 5-е, 6-е, 7-е и 8-е положения в карбостирильном производном атомами водорода и незамещены группой формулы /г -0-A-CON если RJ - низший алкил, R не может быть ни Са - С р-циклоалкилом, Сд - С -циклоалкил-низшим алкилом, ни низшим алки- лом. .. Полученные новые карбдстирильные производные обладают ингибирз ющим действием на агрегацию тромбоцитов . крови, свойством ингибировать действие фосфодизстеразы, свойством усиливать сокращения миокарда (положительный инотропный эффект), противоязвенным действием, противо-, воспалительным действием, гипотензивным действием, свойством усиливать церебральный кр-овоток, рассасывать сгустки тромбоцитов и характеризуются антагонизмом к тромбоксану А и поэтому пригодны для профилактики и лечения тромбоза и эмболии, например церебральной апоплексии, церебральных инфарктов, инфарктов миокарда, в качестве агентовi улучшающих церебральный кровоток, противовоспалительных агентов, антиастматргаеских агентов, кардиостимуляторов, гипотензивных агентов и ингибиторов фосфодиэстеразы. Кроме того, карбостирильные производные, представленные общей формулой I обладают низкой токсичностью и особенно незначительными побочными действиями на сердце, как, например, повьш1ением частоты сердечных сокращений, сердечно-сосудистой гипертрофией, нарушениями миокарда или, тому подобными, хотя при этом они быстро и хорошо абсорбируются кровью и могут сохраняться в крови В . относительно высоких концентрациях, и указанные ранее фармакологические действия можно растянуть на относительно более длительный промежуток времени n-3J . Известна реакция взаимодействия аминов с карбоновыми кислотами. Условия проведения процесса зависят от характера исходных реагентов 4.J Цель изобретения - синтез новых соединений, обладающих полезными фармакологическими свойствами. Поставленная цель достигается те что согласно способу получения карбостирильных производных формулы 1 карбоксилалкокси-карбостирильное производное общей -формулы где R,, и углерод - углеродная связь между 3-м и 4-м положениями в карбо стирильном скелете имеет указанные значения: R - атом водорода, низший алкил или группа формулы -О-А -СООН, где А имеет указанные значения) группа -О-А-СООН находится в 5-м, 6-м 7-м или 8-м положении карбостирильного скелета; группа-О-А-СООН находится в 5-м, 6-м, 7-м или 8-м положении карбостирильного скелета, R,j - атом водорода или низший алкил, если Rj - группа формулы -О-А-СООН, 5-е, 6-е, 7-е и 8-е положения карбостирильного скелета заняты атомами водорода и не замещены группами формулы -О-А -СООН подвергают взаимодействию с амином общей формулы -HN где Rj и R .имеют указанные значения, с выделением целевого продукта в свободном виде. Среди соединений, представленных формулой (I), то соединения, в которых имеется кислотная группа, могут легко образовывать соли с фармацевтически приемлемыми основными соединениями, включая основания, например, такими гидроокисями металлов, как гидроокись натрия гидроокись калия, гидроокись кальция, гидроокись алюминия; с такими алкоголятами щелочных металлов, как метилат натрия, зтилат калия. Из соединений, представленных общей формулой (I), те соединения, которые содержат основную группу, могут легко образовывать соли с обычными фармацевтически приемлемыми кислотами, которые включают такие неорганические кислоты как серную кислоту, азотную кислоту, хлористоводородную кислоту, бромистоводородную кисI лоту и т.-п. Полученные таким образом предлагаемые соединения можно легко вьщелить и очистить с помощью обычных средств выделения, таких как переосаждение, экстракция, перекристаллизация, хроматография на колонке и препаративная тонкослойная хроматография. Предлагаемые соединения можно вводить либо в том виде, как они есть, либо вместе с обычными фармацевтически приемлемыми носителями как животным, так и человеку. Нет никаких конкретных ограничений относительно единичных форм приема, и предлагаемые соединения можно принимать в любой желательной единичной дозировке. Подходящие формь: для разового приема включают формы для орального приема: таблетки,.капсулы, гранулы и растворы, и формы для парэнтерального введения, инъекции. Дозировка активного ингредиента для приема не ограничена конкретными значениями, допускает выбор в широком интервале значений;. Однако для достижения желательного фармакологического действия рекомендуется выбирать указанную дозу в интервале 0,06-10 мг на кг живого веса в день. Предлагается также, чтобы каждая разовая доза приема содержада 1 500 мг активного ингредиента. Пример 1. В 100 мл диметилформамида добавляют 2,5 г 6-(3-карбоксипропокси) карбостирила и 1,7 мл триэтиламина. Реактор, содержащий указанную смесь, снаружи охлаждают . льдом, по каплям добавляют к этой смеси при перемешивании 1,4 мл изобутилхлорформата. После окончания операции добавления перемешивание продолжают еще в течение. 30 мин, после чего к реакционной
смеси добавляют 1,75 г Н-(2-оксиэтил)циклогексиламина, и перемеши вание реакционной смеси, продолжают в течение 3ч.
После завершения реакции растворитель отгоняют и полученньй остаток экстрагируют около 300 мл хлороформа, промывают разбавленным водным раствором NaHCO-, водой, разбавленной хлористоводородной кислотой, и водой в указанном порядке. Хлороформ отгоняют до получения остатка, а полученный остаток перекристализовывают .из смеси хлороформ - петролейньй эфир до получения 1,9 г 6-{3- N-(2-oкcиэтил)-N-циклoгeкcиламинокарбонил пропокси карбостирилав виде бесцветных иглообразных кристаллов. Т. пл. 165-166 С.
Пример 2. К 100 мл хлороформа добавляют 2,5 г 6-(3-карбоксипропокси)-3,4-дигидрокарбостирила 1И 1,65 г 1,8-дйазабицикл0-5,4,0-ундецена-7 (ДБУ). Реактор, в котором находится указанная смесь, снаружи охлаждают льдом, к реакционной смеси по каплям добавляют 1,5 мл изобутилхлорформата при перемешивании. После окончания добавления перемешивание продолжают еще в течение 30 мин, к реакционной смеси добавляют 2,0 г N-(2-oкcиэтил)циклoгексштамина и далее перемешивание . продолжают при комнатной температур еще В течение 2ч,
После завершения реакции хлороформовый раствор продукта реакции промывают разбавленным водным раствором NaHCO-, водой, разбавленной хлористоводородной кислотой, и водой в указанном порядке. Хлороформовьй раствор высушивают над безводным , затем хлороформ отгоняют н полученньй при этом остаток пере сристаллизовывают из смеси хлороформ - петролейньй эфир до получения 2,1 г (2-оксиэтш1)-М-циклогексиламинокарбонил пропокси}-3,4-дигидрокарбостирила в виде бесцветных иглообразных кристаллов. Т. пл. 139-141, 5С.
Аналогично . описанному способу Э примере 2, получают следующие соединения (примеры 3-18).
Пример 3. 5-{3- N-(2-OK- cиэтил)-N-циклoгeкcилaминoкapбoннлЗпропокси -3,4- дигидрокарбостири
Бесцветные иглообразные кристалы. Т. пл. 130-131,.
Пример 4. 6-f3- N-(2 -OKcибyтил)-N-циклoгeкcилaминoкapбoнилЗпропокси|-3,4-дигидрокарбостирил.
Бесцветные иглообразные кристалы. Т. пл. 132-133 0.
Пример 5. 6-{3- N-(2-OKCHэтил)-Ы-циклооктиламинокарбонил}пропокси -3,4-дигидрокарбостирил.
Бесцветньй кристаллический пороок. Т. пл. 104-107 с.
Пример 6. 6-{3- Ы-(2-Оксипpoпил)-N-ЦиклoгeкcилaминoкapбoнилJ пропоксиТкарбостирил. Бесцветные иглообразные кристалы, Т. пл. 201-203 С.
Пример. 7. 6- з-Сн-(4-Оксибутил)-М-циклогексиламинокарбонил пропокси карбостирил.
Бесцветньй кристаллический порошок Т. пл. 153-155 С.
Пример 8о 6-{4- м-(2-Оксипропил)-N-циклогексиламинокарбонил3бутоксиу-3,4-дигидрокарбостирш1.
Бесцветные иглообразные кристаллы. Т, пл„ 120,5-122,.
Пример 9 о 6-((2-Оксиэтил)-N-циклoгeкcIiлaминoкapбoнШI бутокси -3,4-дигидрокарбостирил.
Бесцветный кристаллический порошок. Т. пло 122-123,.
Пример 10. 6-{4- N-(2-OKсибутил)-М-циклогексиламинокарбо- пил бутокси}-3,4-дигидрокарбостирил.
Бесцветные иглообразные кристаллы. Т. пл. 91-93°С.
Пример 11. (2,3-Диoкcипpoпил)-N-циклoгeкcилaминoкарбонилЗбутокси З,4-дигидрокарбостирил.
Бесцветные призмоподобные кристаллы. Т. пл. 112,5-113,5С.
Пример 12.. 6-{4- N-(2-Oкcибyтил)-N-циклопентиламинокарбо- НИЛ }бутокси1 -3,4-дигидрокарбостирил.
Бесцветные иглообразные кристаллы. Т. пл. 102-103 С.
П р и м е.р 13. (2-Оксибутил)-N-циклогексиламинокарбонил бутокси карбостирил.
Бесцветный кристаллический порошок. Т. пл. 127-128,.
Пример 14. N-(2,3-Диоксипропил)-N-циклогексиламинокарбонил бутокси|карбостирил .
Бесцветные иглообразные кристаллы. Т. пл. ne-UO C.
Пример 13. 6-f4- N-(2-OKсибутил)-Ы-циклооктиламинокарбонил}бутокси}карбостирил,
Бесцветный кристаллический порошок, Т. пл. 86-89°С.
Пример 16. 6-{5- N-(2-OKcибyтил)-N-циклoгeкcилaминoкapбoНИЛ}пентилокси}3,4-дигидрокарбостирил.
Бесцветный кристаллический порошок. Т. пл. 98-100С.
Пример 17. 7- 3-Сн-(3-Окси пропил)-N-циклогексиламинокарбонилЗпропокси -3,4-дигидрокарбостири
Бесцветный кристаллический порошок. Т пл. 140-142С.
Пример 18. 6-{4-Сы-(2-Оксиэтил)-N-циклогексиламинокарбонил бутокси карбостирил.
Бесцветные гранулообразные кристаллы. Т. пл. 134-135С.
Пример 19. В 300 мл хлороформа добавляют 9,9 г б-(3-карбоксипропокси)карбостирила и 6,5 мл ДВУ. Реактор с указанной реакционной смесью снаружи охлаждают льдом, и при перемешивании добавляют по каплям 5,7 мл изобутилхлорформата. После окончания добавления перемешивание продолжают при комнатной температуре в течение 1 ч, и добавляют 5,4 г 2-этиламинопиридина по каплям а затем реакцию ведут еще 5 ч при перемешивании. Реакционную смесь
промьшают разбавленным водным раствором NaHCO и водой и концентриру|ют. Полученный при этом остаток обрабатывают на хроматографической колонке с силикагелем (в качестве растворителя используют смесь хлороформ: метанол 20:1), и полученный при этом элюат концентрируют, а затем перекристаллизовывают из метанола до получения 4,5 г 6- з- М-этил-Ы-(2-пиридил)-аминокарбонил пропокси карбостирила в виде бесцветных иглообразных кристаллов. Т. пл. UB-UQ C.
Аналогично способу, описанному в примере 19, получают следующие соединения (примеры 20-40).
Пример 20. 6-{з- N-Этил-Ы-(3 пиридил)аминокарбонил пропокси карбостирил.
Бесцветные иглообразные кристаллы. Т. пл. 148-149с.
Пример 21. 6-СЗ- Н-Метил-N-(3-пиридилметил)аминокарбонил пропокси карбостирил.
Бесцветные иглообразные кристаллы. Т. пл. 169,5-171 0.
Пример 22. 6- 3- н-Этш1-N-(3-пиридш1метил)аминокарбонил пропокси карбостирил.
Бесцветные иглообразные кристаллы. То пл. 145-147 с.
Пример 23. 6- 3- Ы-Метш1-Н-(2-фурилметил)аминокарбонил}пропокси карбостирил.
Бесцветные иглообразные кристаллы Т. пл. 125,5-127,.
Пример 24. б- З-СН-Метил-К-(2-тетрагидрофурилметил)аминокарбонил пропокси карбостирил.
Бесцветные иглообразные кристаллы. Т. пл. 123-125 с.
Пример 25. 6- з- К-Метил-Ы-(2-тиенилметил)аминокарбонил пропокси карбостирил.
Бесцветные иглообразные кристаллы Т. пл. 133,5-135С.
Пример 26. 6-| 3- н-Метш1-N-2(3,4-дигидро-2Н-пиранилметил)аминокарбонил}пропокси карбостирил.
Бесцветные иглообразные кристаллы То пл. 133,5 -135С.
Пример 27. 6-|3- М-Метил-Н-(2-тетрагидропиранилметил)аминокарбонилЗпропокси карбостирил.
Бесцветные гранулообразные крис- таллы. Т. пл. 150-151,.
Пример 28. 6- 3- н-Метш1-Н-(2-тетрагидропиранилметил)аминокарбонил пропокси -3,4-дигидрокарбостирил.
Бесцветные призмообразные кристаллы. Т. пл. 121,5-123,5°С.
Пример 29. 5-{3- Ы-(2-Окси этил)-Ы-циклогексиламинокарбоншт пропокси )-3, 4-дигидрокарбостирил. ,
Бесцветные иглообразные кристалТ. пл. 130-131,.
лы.
П р и м е р 30. 6-tN-Этйл-N-(3-пиридилметил)аминокарбонилметоксиJ- 3,4-дигидрокарбостирил.
Бесцветные иглообразные кристаллы Т. пл. 82-840.
Пример 31. 6-{5- N-Метил-Н-(2-тетрагидропиранилметил)аминокарбонил пентилоксиЗкарбостирил.
Бесцветные иглообразные кристаллы. Т. пл. 81-83°0.
Пример 32. 8-f3- N-MeTHn-К-(2-тетрагидропиранилметил)аминокарбонил пропокси карбостирил.
Бесцветные иглообразные кристаллы. Т. пл. 115,5-117 С.
П р, и м е р 33. 6- 4- N-ЭТИЛ-Ы-(2-тетрагидропиранилметил)аминокарбонил бутокси J-3,4-дигидрокарбостирил.
Бесцветные иглообразные кристаллы. Т. пл. 87-88,5С.
Пример 34. 6- 4- н-Пропил-Ы-(2-тетрагидропиранилметил)аминокарбонил}бутокси -3,4-дигидрокарбостирил.
Бесцветные иглообразные кристаллы. Т. пл. 77-79,5°С.
Пример 35. 6-{4-CN-Бyтил-М-(2-тетрагидропиранилметил)ами-, нокарбонил бутокси -3,4-дигидрокарбостирнл.
Бесцветные иглообразные кристаллы. Т. пл. 93,5-95,.
Пример 26. 6-{3- N-(2-OKсиэтил)-Н--(2-тетрагидропиранил)аминокарбонил пропокси1карбостирил.
Бесцветные иглообразные кристаллы. Т. пл. 175,5-177 0.
Пример 37. (2-Окcиэтил)-N-(3-пиpидшlмeтил)aминoкapбoнил бyтoкcиj-3,4-дигидpoкapбoстирил.
Бесцветные иглообразные кристаллы. Т. пл. 80-82,.
Пример 38. 6- 4-Сы-(2-ОксиэтшI)-N-(2-тeтpaгидpoпиpaнилмeтил) аминока рбонил//бутокси J-3,4-дигидрокарбостирил.
Бесцветные иглообразные кристалцы. Т. пл. 117-118,.
П р и м е р 39. 6- 4-CN-(3-OKсипропил-N-(2-тетрагидропиранилметил) аминокарбонил бутокси J-3 , 4дигидрокарбостирил.
Бесцветные иглообразные кристаллы. Т. пл. 98,5-100с.
Пример 40. 6-{4- N-(4-OKсибутил)-К-(2-тетрагидропиранилметил)аминокарбонил бутокси)-3,4-дигидрокарбостирил.
Бесцветные иглообразные кристаллы. Т. .пл. 114-11бС.
Пример 41. В 100 мл диметилформамида добавляют 3,1 г 1-бензш1-6-(4-карбоксибутокси)-3,4-дигидрокарбостирила и 1,7 мл тризтиламина. Реактор с указанной смесью
охлаждают снаружи льдом, и к .смеси при перемепгавании добавляют по каплям 1,4 мл изобутнлхлорформата. Пбс5 ле завершения добавления перемешивание продолжают еще в течение 30 мин, затем к реакционной смеси добавляют 1,75 г Н-этш1-Н-(2-тетрагидропиранилметйл)-амина и перемешивание продолжают при комнатной температуре Б течение 3 ч. После то- . го, как реакция завершилась, растворитель удаляют перегонкой, и полученный при этом остаток экстрагируют приблизительно 300 мл хлороформа, промывают разбавленным водным раствором NaHCOj, водой, разбавленной хлористоводородной кислотой, и водой в указанном порядке. Получен0 ньш при этом остаток обрабатывают на хроматографической колонке с силикагелем (при этом в качестве растворителя использзпот смесь хлороформ; метанол 20:1) и полученный таким
5 образом элюат концентрируют до получения 2,3 г 1-бензил-6-М- ы-(2-тетрагидропиранилметил)-Ы-этш1аминокарбонш1}бутокси}-3,4-дигидрокарбостирила в виде бесцветного сиропообразного вещества.
ИК-спектр поглощения ) , см : 1620, 1690.
Вычислено, %: С 75, 29; Н 8,28) N 6,06.
5 Найдено, %: С 75,36, Н 8,13; N 5,84.
Пример 42. В 400 мл хлороформа добавляют 5 г 6-(4-карбоксибу- токси)-3,4-дигидрокарбостирила и
0 3,2 г ДБУ. Реактор , содержащий указанную смесь, охлаждают снаружи льдом, и к этой смеси по каплям добавляют 2,8 г изобутилхлорформата при перемешивании. После того, как оканчивают
5 добавление, перемешивание продолжают еще в течение 30 мин, а затем к реакционной смеси добавляют 3,9 г N- (3-оксипропил)-N-циклогексилметиламина и реакцию ведут еще в течение
0 3ч. После завершения реакции реакционную смесь промьшают 1 н. водным раствором NaOH, 10%-ной НС1 и водой в указанном порядке и высушивают над безводным . Осзтпающий агент
5 удапяют фильтрованием и полученный таким образом сухой продукт концентрируют до получения остатка. Этот остаток обрабатывают на хроматографической колонке с силикагелем (в качестве растворителя используют смес хлороформ: метанол 40:1). Полученный при этом элюат концентрируют и перекристаллиэовывают из смеси этацетат - петролейньш эфир. Получают 4,0 г 6- 4- н-циклогексилметшт-Ы-(3-оксипропил)аминокарбонил бутокси J-3,4-дигидрокарбостирила в вцде бес цветных иглообразных кристаллов. .. Т. пл. 95-97 С.
Аналогично способу, описанному в примере 42, получают следующие со/(инения (примеры 43-67) о
Пример 43. 6-{N(2-Oкcиэтил)-N-фениламинокарбонилметокси карбостирил.
Бесцветньй кристаллический по- рошок. Т„ пл„ 162-165 С.
Пример 44. 6-{3- N(2-Meтоксиэтил)-К-циклогексиламинокарбонил пропокси карбостирил
Бесцветные гранулообразные кристаллы. Т. пл. 142,5-143,5с.
Пример 45. (2-0кси-1-метилпропил)-Н-циклогексилметиламинокарбонил пропокси|карбостирш1.
Бесцветные иглообразные кристаллы. Т. пл. 179,5-181,.
Пример 46. 6-{3- н(2 0ксиэтил-М-Бутиламинокарионил пропокси}карбостириле
Бесцветные иглообразные кристаллы. Т. пл. 153-154°С.
Пример 47. 6-{з- ы-ди(2 -Оксиэтил)аминокарбонил JnponoKcnJ карбостирил.
Бесцветные иглообразные кристал- лы. Т. пл. 122-123,5С.
Пример 48. (2-Оксиэтил)-N-фениламинокарбонил бутокси -3,4-дигидрокарбостирил.
Бесцветные иглообразные кристаллы. Т. пл. ПЗ-Пб С.
Пример 49. 6-{4- ы(2-Окси-этил)-Ы-бензиламинокарбонил бутокси -3,4-дигидрокарбостирил.
Бесцветньй кристаллический порешок. Т. пл. 91,5-93с.
Пример 50. 6-{4- N(2-OKCHэтил)-М-цйклогексиламиламинокарбонил Збутокси У-З,4-дигидрокарбостирил
Бесцветные пластинчатые кристаллы. Т. пл. 123-125 С.
Пример 51. 6-{4- N(2-OKсибутил )-Ы-циклогексилметил аминокарбонил бутокси -3,4-дигидрокарбостирил.
Бесцветные иглообразные кристаллы. Т. пл. 119-120,.
Пример 52. (2-Оксибутил)-N-циклoгeкcш мeтшIaминoкapбонил бутокси- -3 94-дигидрокарбостирил.
Бесцветные иглообразные кристаллы Т„ пл. 123-125 с.
Пример 53„ 6-f4- N(2-MeT оксиэтил)-Н-циклогексиламинокарбонил Jбyтoкcи карбостирил„
Бесцветные иглообразные кристаллы. Т. пло 107-109С.
Пример 54, (2-Оксиэтил)-N-бeнзилaиинoкapбoнилJпeнтшIокси}-3,4-дигидрокарбостирил.
Бесцветный кристаллический порошок. Т. пло 93,5-95,.
Пример 55. (2-BeHзоилоксиэтил)-М-циклогексиламинокарбонил JnponoKCHJ карбостирил .
Бесцветные иглообразные кристаллы. Т. пл. 94-97 с.
П р и м е р 56. 6-f4- N(5-Oкcипeнтил)-N-циклoгeкcилмeтилaминокарбонил}бутоксиу-3,4-дигидрокарбостирил.
Бесцветные иглообразные кристаллы. Т. пл. 113,5-115°С.
Пример 57„ (4-0ксибутил)-Ы-циклогексилметиламинокарбонил7пропокси}-3,4-дигидрокарбостири
Бесцветные иглообразные кристаллы. Т. пл. 109-111 0.
Пример 58о (5-Пропионилоксипентил)-К-циклогексияметиламинокарбонил бут,окси}-3,4-дигидрокбостирил.
Бесцветные иглообразные кристалл Т. пл. 60-62 С.
Пример 59. (2-OKсиэтил ) -N-(р-3,4-диметоксифенэтш1)ами нокарбонил бутокси карбостириЛо
Бесцветные иглообразные кристалл
Пример 60. 6-{4- Ы(3-Ацетшоксипропил)-Н-2-тетрагидропиранилметш1аминокарбонил бутокси -3,4-диг гидрокарбостирил.
Бесцветные иглообразные кристалл Т. пл., 64,5-66,5Со
Пример 61. (2,3-Диоксипропил)-М-циклогексилметиламинокарбонил}бутокси1-3 5 4-дигидрокарбостири-п.
Бесцветньй кристаллический порошок. Т. пл. 112-1 .
Пример 62. 6-{4-CN(2,3-flHоксипропил)-N-циклбгексилметиламино- 5 карбонил бутокси карбостирил.
Бесцветньй кристаллический порошок. Т. Щ1„ 125-128с.
Пример 63. (2-OKCHэтил)-К-(3-оксигексил)аминокарбо- Ю НИЛ пропокси карбостирило
Бесцветный кристаллический порошок. Т. пло 220-224 со
Пример 64. (2-Оксиэтил)-N-циклогексиламинокарбонилJnpo- 5 пркси}карбостирил.
Бесцветные иглообразные кристаллы Т. шт. 176-178 с.
Пример 65. 4-Метил-6-1 3-(N(2- оксиэтил)-К-циклогексиламино- 20 карбонил пропокси}карбостирил.
Бесцветные иглообразные кристаллы. Т. пл. 171-173 С.
Приме р 66о 1-Этил-6- 4- н(4-оксибутш1)-Н-циклогексилметиламинокарбонил бутокси}-3,4-дигидрокарбостирил.
Бесцветное сиропообразное вещество.
Ж-спектр поглощения -i , 1620, 1670о30
Вычислено, %: С 73,26, Н 9,56, Я 6,33.
Найдено, %: С 73,41 Н 9,38, N 6,10.
П р и м е р 67. В 200 мл хлорофор-35 Via добавляют 5,9 г 1-аллил-6-(3-карбрксипропокси)карбостирила и 3,2 г
ДБУ. Реактор с указанной смесью охлаждают снаружи льдом, и к смеси добавляют при перемешивании по kanлям 2,8 г изобутилхлорформата. После окончания добавления реакционную смесь перемешивают в течение 1 ч, затем к реакционной смеси добавляют по каплям 3,7 г N-циклогексилпиперазина и реакцию ведут далее в течение 5ч. После завершения реакции реакционную смесь промывают 1%-ным водным раствором NaOH i и водой, затем органический слой вы- 50 сушивают безводным . Осушающий агент удаляют фильтрованием и маточный раствор концентрируют. Полученный при этом остаток обрабатывают на хроматографической колонке с скли- 55 кагелем (в качестве .растворителя используют смесь хлороформ:метанол 30:1). Из полученного элюата вьщеляют 4,2 г 1-аллил-6-ГЗ-С4-циклогек сил-1-пипepaзинилкapбoннлJ пропокси карбостирила в виде бесцветного мас лянистого вещества.
ИК-спектр поглощения V, 1645, 1680.
Вычислено, %: С 71,04; Н 8,48 N 9,56.
Найдено, %: С 70,95; Н 8,61; N 9,72.
Пример 68. В 200 мл хлороформа добавляют 5 г 6-(3-карбоксипропокси)карбостирила и 3,2 г ДБУ. Реактор с указанной, смесью охлаждают снаружи льдом, и к смеси по каплям добавляют 2,8 г изобутилхлорформата при перемешивании. После окончания добавления реакционную смесь перемешивают еще в течение 1 ч, затем при комнатной температуре добавляют по каплям 3,7 г N-циклогексилпиперазина, и реакцию продолжают вести в течение 5ч. После завершения реакции реакционную смесь промывают 1%-ным водным раствором NaOH и водой, затем высушивают над безводным сульфатом натрия. Осушающий агент удаляют фильтрованием и маточный раствор концентрируют. Полученный при этом остаток обрабатывают на хроматографической колонке с силикагелем (в качестве растворителя; используют смесь хлороформ:метанол 30:1) до получения элюата, которьй концентрируют, остаток перекристаллизовьюают из воды, содержащей метанол до получения 4 г 6-{3-(4-циклогексил-1-пиперазилкарбонил) прйпоксиЯкарбостирила в виде бесцветных иглообразных кристаллов. То пл. 184,5-185 00
Аналогично способу, описанному в примере 68, получают следующие соединения (примеры 69-74).
Пример 69. 6-(3-(4-Фенш1-1-пиперазинилкарбонил)пропокси}карбостирил.
Бесцветные иглообразные кристаллы. Т. пл. 202,5-203,.
Пример 70. (4-Фенил-1-пиперазинилкарбонил)пропокси J-3 , 4-дигидрокарбостирил .
Бесцветные иглообразные кристаллы. Т. пл. 182,5-183,.
Пример 71. (4-Фенил-1-пиперидилкарбонил)пропокси карбостирил. Бесцветные иглообразные кристаллы Т. пл. igo-igi c. Пример 72. (4-Бензил-1-пиперазинилкарбонил)пропркси карбостирил. Бесцветные призмообразные кристал лы. Т. пл. 174,5-175,. Пример 73. (4-Циклогек сил-1-пиперазинилкарбонил)пропоксиJ-3,4-дигидрокарбостирил. Бесцветные иглообразные кристаллы Т. пл. 133-134С. Пример 74. (4-Бензил-1 -пиперидилкарбонил)пропоксиj карбости рил. Бесцветные иглообразные кристаллы Т. пл. 145-14бс. Пример 75.В смешанный раст воритель из 20 мл диоксана и 20 мл метиленхлорида добавляют 2,5 г б-(З-карбокси) пропоксикарбостирила и 1,3 г N-(2-oкcиэтшI)циклoгeкcиламина. Реактор, содержащий эту смесь охлаждают снаружи льдом. Затем к этой смеси добавляют по каплям раствор 2,1 г N,N-дициклогексилкарбодиимида в 5 мл метиленхлорида, поддерж вая при перемешивании температуру в интервале 10-20 с. После окончания добавления реакционную смесь перемешивают при той же самой температуре в течение 3,5 ч. Выпавшие в осадок кристаллы удаляют фильтрованием, и полученный фильтрат концентрируют при пониженном давлении досуха. Полученньй при этом остаток растворяют в 100 мл метиленхлорида и органический слой промывают 5%-ным водным раствором хлористоводородной кислоты 5%-ным водным раствором бикарбоната натрия и водой в указанном порядке, а затем высушивают над безводнь(м сул фатом, натрия. Растворитель удаляют перегонкой и полученный остаток перекристаплизовывают из смеси хлороформ - петролейный эфир до получения 1,1 г 6- 3-LN-(2-oкcиэтил)-N-циклoгeкcилaминoкapбoншI пpoпoкcи кapбocтиpи. в виде бесцветных иглообраз ных кристаллов, Т. пл. 165-166 С. Аналогично способу, описанному в примере 75, получают следующие сое динения (примеры 76-98). Пример 76. 6-{3- н-Этил-N-(2-пиридил)аминокарбонилJnponoKси карбостирил. Бесцветные иглообразные кристаллы. Т. пл. 148-149 С. Пример 77. 6-(3-CN-Meтил-N-(3-пиpидилмeтил)aминoкapбонил7пропокси}карбостирил. Бесцветные иглообразные кристаллы. Т. пл. 169,5-171,5С. Пример 78. 6- 3- N-Meтил-N-(2-фурилметил)аминокарбонил пропокси}карбостирил. Бесцветные иглообразные кристаллы. Т. пл. 125,5-127,. Пример 79. 6-ГЗ- N-Метил-М-(2-тетрагидропиранилметил)аминокарбонил Зпропокси карбостирил. Бесцветные гранулообразные кристаллы. Т. пл. 150-151,. Пример 80. 6-fЗ-ГN-Meтил-Н-(2-тиенилметил)аминокарбонил пропокси карбостирил. Бесцветные иглообразные кристаллы. Т. пл. 133,5-135 0. Пример 81. (2-Оксиэтил)-Н-циклогексиламинокарбонилЗ пропокси -3,4-дигидрокарбостирил. Бесцветные иглообразные кристаллы. Т. пл. 130-131,5°С. Пример 82. (2-тетрагидропиранилметил) аминокарбонил j пентилокси карбостирил. Бесцветные иглообразные кристаллы. Т. пл. 81-83С. . Пример 83. 6-{3-СМ-(2-Оксибутил)-К-циклогексиламинокарбонил ЗПРОПОКСИ }-3,4-дигидрокар.бостирШ1.. Бесцветные иглообразные кристаллы. Т.пл. 132-133 С. Пример 84. 6-((2-Оксипропил)-М-циклогексиламинокарбонил бутокси -3,4-дигидрокарбостирШ1. Бесцветные иглообразные кристаллы, Т. пл, 120,5-122,5С. Пример 85. (2-Оксиэтил)-Н-циклогексиламинокарбонилJ6yтокси -3,4-дигидрокарбостирил, Бесцветный кристаллический порошок. Т, пл. 122-123,. Пример 86, (2-Oкcибутил)-N-циклогексиламинокарбонил2бутокси -3,4-дигидрокарбостирил, Бесцветные иглообразные кристаллы, Т. пл. 91-93 С, Пример 87, (2,3-Диoкcипpoпил)-N-циклoгeкcилaминoкарбонил Збутокси -3,4-дигидрокарбостирил. Бесцветные призмообразные кристаллы. Т. пл. 112,5-113,. Пример 88. (2-Oкcи бyтил ) -N-циклогексиламинокарбонил J бутокси карбостирил, . . Бесцветный кристаллический порош Т. пл. 127-128,5С. Пример 89. 6-((2,3-Диоксипропил)-Н-циклогексиламинокapбoнилJбyтoкcи}кapбocтиpил. Бесцветные иглообразные кристаллы. Т. пл. 138-140 0. Пример 90. 6-{4- N-(2-OKси этил) -N-циклQгeкcилaминoкapбoнилЗ бутокси карбостирил. Бесцветный кристаллический порош Т. пл. 134-135С. Пример 91. 6-{з- н-(2-Окси (2-тетрагидропиранилметил а нокарбонил пропокси карбостирил. Бесцветные иглообразные кристаллы. Т. пл. 175,5-177 С. Пример 92. 6-{4-Сы-(2-Окси этил)-N-(2-тетрагидропиранилметил, аминокарбонил}бутокси J-3,4-дигидрокарбостирил, Бесцветные иглообразные кристаллы. Т. пл. 117-188,5°С. П р и м е р 93. (4-Окси бутил ) -N- ( 2-тетрагидропиранш1метил)амйнокарбонил}бутокси р-3,4-дигидрркарбостирил. Бесцветные иглообразные кристал лы. Т. пл. IH-lie C. , . Пример 94. 6-{3- N-(2-Me;токсиэтш1)-Н-циклогексиламинокарбонил 1пропокси кар остирил. Бесцветные иглообразные кристаллы. Т. пл. 142,5-143,. Пример 95. 6-{4- N(2,3-ДиIоксипропил)-N-цпклогексилме тиламино iкарбонил бутокси -3,4-дигидрокарбостирил. Бесцветный кристаллический порошок. Т. Ш1. 112-114 С Пример 96. (4-Фенил-1-пиперазинилкарбонил)пропоксиЗкар бостирил. Бесцветные иглообразные кристаллы. Т. пл. 202,5-203,. Пример 97. 6-{3- ы-(2-Окси этш1)-Н-(3-оксициклогексил)аминокарбонил пропокси1карбостирш1. Бесцветный кристаллический порошок. Т. 1Ш..220-224с.« Пример 98. 6-{4- ы-(2-Окси этш1)-М-циклогексилметиламинокарбоНШ1 бутокси -3,4-дигидрокарбостирил Бесцветньге пластинчатые кристаллы. Т. пл. 123-125С. Пример 99. В 200 мл метилеяхлорида суспендируют 2,4 г 6-(3-карбоксипропокси)карбостирила и к этой суспензии добавляют 2 мл пиридина. Затем при перемешивании по каплям добавляют 1,4 г тионилхлорида, причем температуру внутри реактора поддерживают в интервале . После окончания добавления реакцию продолжают вести при той же самой температуре еще в течение 1 ч при перемешивании. Затем к реакционной смеси по каплям добавляют 2 мл Ы-(2-оксиэтил)циклогексиламина, после чего реакцию продолжают вести еще 4 ч при комнатной температуре и при перемешивании. Затем реакционную смесь тщательно промывают водным раствором K,COj, затем еще раз водой и разбавленной хлористоводородной кислотой, а затем высушивают над безводным сульфатом натрия. Растворитель отгоняют и полученньш при этом остаток очищают и вьщеляют на хроматографической колонке (используют силикатель марки W ако С 200, а в качестве растворителя используют смесь хлороформ-метанол 20:1), и перекристаллизовывают из смеси хлороформ - петролейный эфир. Получают 1,2 г (2-оксиэтил)-N-циклогексиламинокарбонил jnponoKcnj кар- бостирила в виде бесцветных игло(Рбразных кристаллов. Т. пл. 165Тбб С, Аналогично способу, описанному в примере 99, получили следующие соединения (примеры 100-119). Пример 100. 6- 3- ы-Этил-N-(2-пиридил)аминокарбонил пропркси карбостирил. Бесцветные иглообразные кристаллы. Т. пл. 148-149 0. Пример 101. 6-{3-CN-MeTi«i-N-(3-пиридилметил ) аминокарбон-ил пропокси карбостирил. Бесцветные иглообразные кристаллы. Т. пл. 169-171 с. -П р и м е .р 102. 6-{3- N-MeTmiN-(2-тетрагидрофур1спметил) аминокарбонил пропокси карбостирил. Бесцветные иглообразные кристаллы. Т. пл. 123-125 С. Пример 103. 6-{3- К-Йет ил-К-(2-тиенилметил)аминокарбонил} пропокси | карбостирил.
Бесцветные иглообразные кристаллы. Т. пл. 133,5-135С.
Пример 104. б-Сз-Сн-СМетил -N-(2-фypилмeтил)aминoкapбoнилJпpoпокси карбостирил.
Бесцветные иглообразные кристаллы. Т. пл. 126,5-127,5С.
Пример 105. 6- з- н-Метил-М-(2-тетрагидропиранилметил)аминокарбонил пропокси1-3,5-дигидрокарбостирил.
Бесцветные призмообразные крис.таллы. Т. пл. 121,5-123,5С.
Пример 106.. (2-OKсибутил)-Н-циклогексиламинокарбонил пропокси -3,4-дигидрокарбостирил.
Бесцветные иглообразные кристаллы. Т. пл. .
Пример 107. (2-Оксиэтил)-М-циклогексиламинокарбонил бутокси У-З , 4-дигидрокарбостирил
Бесцветный кристаллический порошок. Т. пл. 122-123,
Пример 108. 6-{4- ы-(2-Оксибутил)-Н-циклогексиламинокарбонилJ бутокси |-3,4-дигидрокарбостирил
Бесцветные иглообразные кристаллы. Т. пл. 91-93 С.
Пример 109. 6- 4--CN-(2,3-Диоксипропш1)-Н-циклогексиламинокарбонил бутокси J-3,4-дигидрокарбостирил.
Бесцветные призмообразные кристалы. Т. шт. 112,5-113,.
Пример 110. 6-{4- N-(2-OKсибутил)-Н-циклогексиламинокарбонил бутоксиЯ карбостирил. .
Бесцветный кристаллический порошок. Т. пл. 127-128,.
Пример 111. (2-OKcиэтил)-N-циклoгeкcилaминoкapбoнил бутокси карбостирил.
Бесцветные гранулообразные кристаллы. Т. пл. 134-135С.
Пример 112. 6-Сз- ы-(2-Оксизтил)(2-тетрагидропиранил)аминокарбонил2пропоксиНкарбостирил.
Бесцветные иглообразные кристаллы. Т. пл. 175,5-177 0.
Пример 113. (2-Оксиэтш1)-Ы-(2-тетрагидропиранилметил ) аминокарбонил бутокси1-3,4-дигидрокарбостирил.
Бесцветные иглообразные кристаллы. Т. пл. 117-118,. ,
Пример 114. 6-{4- К-(4-Оксибутил)-К-(2-тетрагидропиранилметил) аминокарбонилД бутоксиJ-3,4-диокси5 карбостиршГ.
Бесцветные иглообразные кристаллы. Т. пл. 114-116°С.
Пример 115. (2-Метоксиэтил)-К-циклогексш1аминокарбо нил}пропокси}карбостирил.
Бесцветные гранулообразные кристаллы. Т. пл. 142,5-143,.
Пример 116. (2,3-Диоксипропил)-Ы-циклогексилметилами15 HOKap6oHKnj6yTOKCHJ-3,4-дигидрокарбостирил.
Бесцветный кристаллический порошок. Т. пл. 112-114 с.
Пример 117. (4-Фенил20 -1-пиперанилкарбонил)пропокси 1карбо- стирил.
Бесцветные иглообразные кристаллы. Т. пл. 202,5-203,.
Пример 118. 6-{3- N-(2-OKсиэтил)-М-(3-оксициклогексил)аминокарбонил пропокси1карбостирил.
Бесцветньй кристаллический порошок. Т. пл. 220-224С.
Пример 119. (2-OKCH30 этил)-К-циклогексилметил)аминокарбонилЗбутокси} -3,4-дигидрЬкарбостирил. Бесцветные пластинчатые кристаллы. Т. пл. 123-125 0.
Пример 120. 3,8 г (п5 -нитрофеноксикарбонил)пропокси2кар,бостирила растворяют в 40 мл диметилформамида, затем к нему добавляют 1,6 htn N-(2-oкcиэтил)циклoгeкcнлaми- на, и реакционную смесь перемеши- 0 вают при 60-70 С в течение 12 ч. Прс(ле завершения реакции растворитель отгоняют, и полученньй при этом остаток очищают на хроматографической колонке с силикагелем (используют 5 силикагель марки w ако С-200, а в качестве растворителя используют смесь хлороформ:метанол 20:1). Полученные при этом неочищенные кристаллы перекристаллизовывают из 0 смеси хлороформ - кетролейньй эфир до получения 1,3 г (2-оксизтил)-Н-циклогексиламинокарбонилТпропоксиЛкарбостирила в виде бесцветных иглообразных кристаллов. Т.пл. 5 165-166 с.
Аналогично способу, описанному в примере 120, получают следующие соединения (примеры 121-134).
Пример 121, 6- 3-CN-3THn-N-(2-пиридил)-аминокарбонил пропокси карбостнрил,
Бесцветные иглообразные кристаллы. Т. пл. 148-149 с.
Пример 122. 6-{3- N-Meтил-N-(2-тетра гидропиранилме тил)аминокарбонил пропокси}карбостирил.
Бесцветные гранулообразные кристаллы. Т. пл. 150-151,.
Пример 123. 6-f4- N-(2,3-Диоксипропил)-Ы-циклогексш1аминокабонш1 бутокси J-3,4-дигидрокарбостирил..
Бесцветные призмообразные кристаллы. Т. пл. 112,5-113,.
Пример 124. 6-{4- N-(2-OKсибутшт)-Н-циклогексиламинокарбонилJбyтoкcи|кapбocтиpил.
Бесцветный кристаллический порошок. Т. пл. 127-128,5.
Пример 125. (2Оксиэтил)-К-циклогексиламинокарбо- нш13бутокси|карбостирил. ,
Бесцветные гранулообразные кристаллы. Т. Ш1. 134-135®С.
Пример 126. 6-{3- N-(2-OKсибутш1)-М-циклогексиламинокарбо- нш1}пропокси -3,4-дигидрокарбостири
Бесцветные иглообразные кристаллы. Т. пл. 132-1J3fc.
Пример 127. 6-{4-CN-(2-OKсиэтил)-Ы-циклогексш1аминокарбонилJбyтoкcи -3,4-дигидрокарбостирил
.Бёсцветньй кристаллический порошок. Т. пл. 122-123,5С.
Пример 128. 6-{4-CN-(2-OKсибутил)-К-циклогексиламинокарбонил2бутокси -3,4-дигндрокарбостирил
Бесцветные иглообразные кристаллы. Т. пл. 91-93С.
Пример 129. (4-Фенил-1-пиперазинилкарбонйл)пропокси карбостирил.
Бесцветнь1е иглообразные кристаллы. Т. пло 202,5-203.,.
Пример 130. (2-OKсиэтил)-М-циклогексилметиламинокарбонил бутокси5-3,4-дигидрокарбости(рил. Бесцветные пластинчатые кристалл Т. пл. .123-125 С.
Пример 131. 6-{3- м-(2-Оксиэтил)-Ы-(2-тетрагидропиранилмет1 л аминокарбонйл пропокси карбостирил.
Бесцветные иглообразные кристалл Т. пл. 175,5-177С„ ,
Пример 132. 6-{4-fN-(2-OKCHэтил)-М-(2-тетрагидропиранилметил) аминокарбонил бутокси J-3,4-ди гидрок бостирил.
Бесцветные иглообразные кристаллы Т. пл. 117-118,5С.
Пример 133. 6-f4- N-(4-Oкcибутил)-Ы-(2-тетрагидропиранилметил) аминокарбонилХбутокси}-3,4-дигидрокабостирил.
Бесцветные иглообразные кристаллы Т. пл. 114-116 0.
Пример 134. 6-{3- N-(2-Meтоксиэтил)-Н-циклогексш1аминокарбонилJпpoпoкcиJ карбостирил..
Бесцветные гранулообразные кристаллы. Т. пло 142,5 С - 143,5С.
Пример 135. В 100 мл этанола добавляют 2,7 г 6-(3-этоксикарбонилпропокси)карбостирила, 0,5 г этилата натрия и 5 мл К-(2-оксиэтил) циклогексиламина, и проводят реакцию в автоклаве под давлением 110атм при температуре 140-150 0 в течение 6 ч.
После завершения реакции реакционную смесь охлаждают и концентрируют при пониженном давлении. Полученный при этом остаток растворяют в 200 мп хлороформа ипромьюают 1%-ным водным раствором КлСО, разбавленной хлористоводородной кислотой и водой в указанной последовательности, а затем высушивают над безводным сульфатом натрия. Затем растворитель отгоняют, и полученный остаток очи щают на хроматографической колонке, заполненной силикагелем (в качестве силикагеля используют W ако , а в качестве растворителя используют смесь хлороформ:метанол 20:1). Полученные при этом сырые кристаллы перекристаллизовывают из смеси хлороформ - петролейный эфир до получения 0,9 г 6-{3-rN-(2-oкcиэтшI)-N-циклoгeкcилaминoкapбонил}пропокси карбостирила в виде бесцветных иглообразных кристаллов Т. пл. 165-1ббс.
Аналогично способу, oпиQaнHoмy в примере 135-, получают следующие соединения (примеры 136-143)„
Пример 136. 6-{3- Ы-Метил-N-С3-пиридилметил)аминокарбонил пропоксн карбостирил.
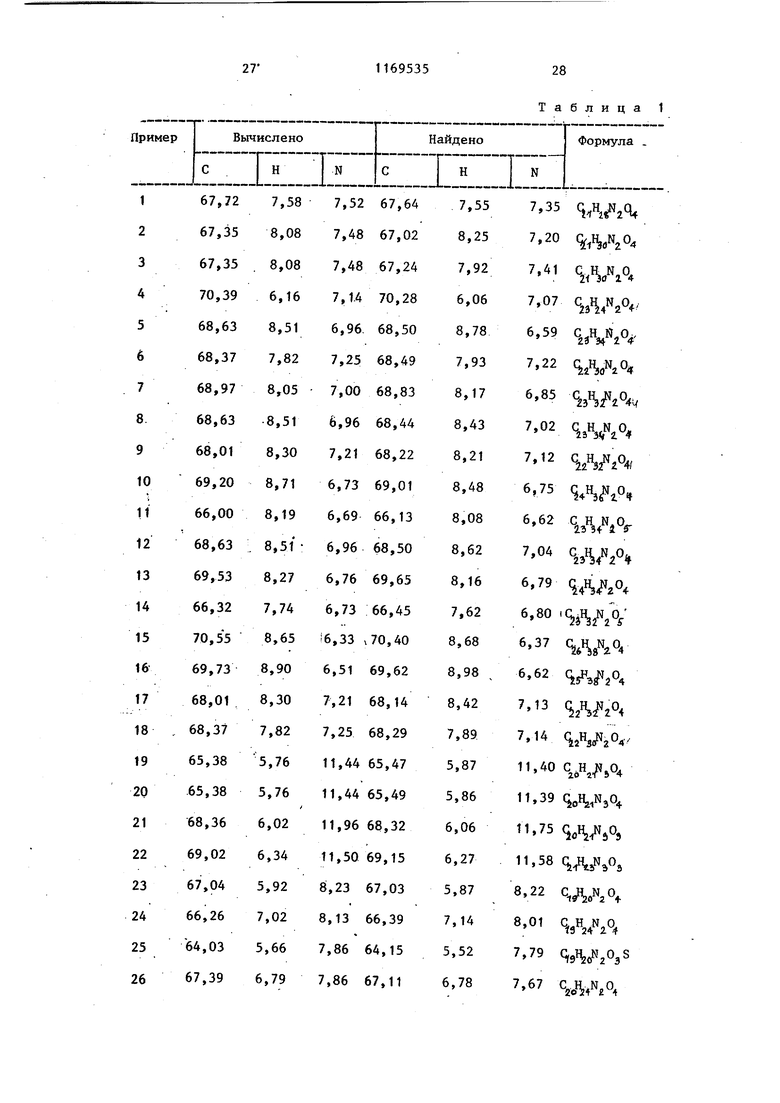
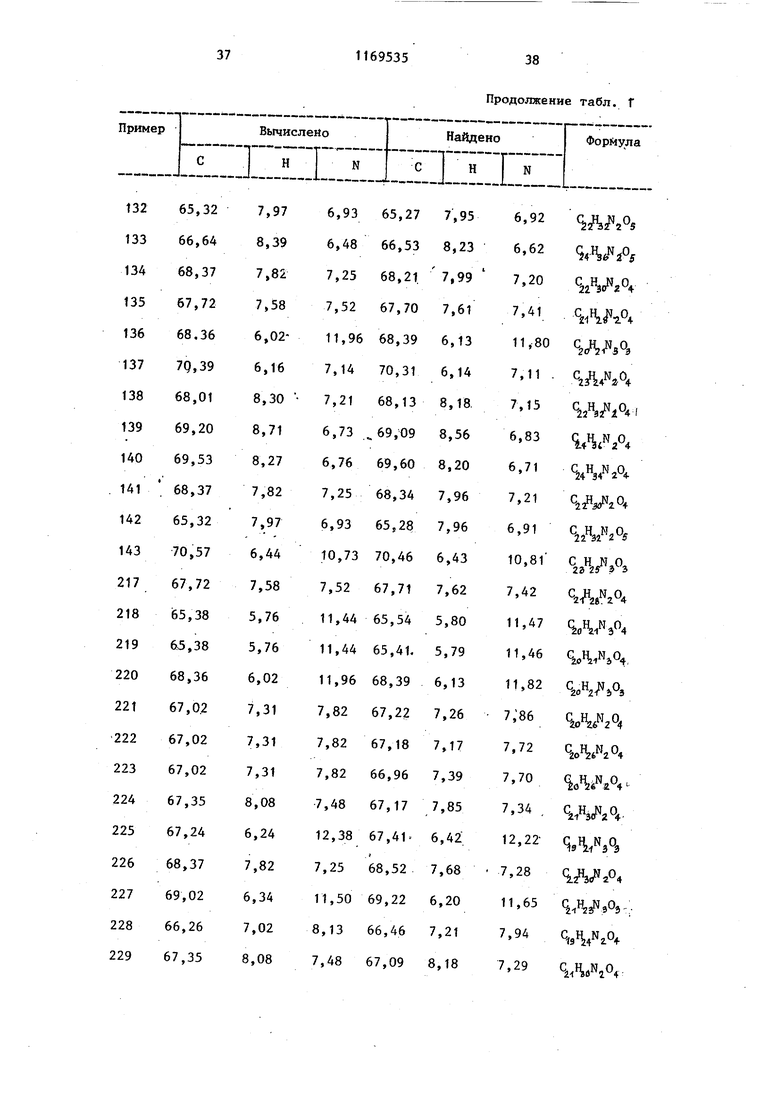
Бесцветные иглообразные кристаллы. Т. пл. 169,5-171 с. Пример 137. 6- 3-CN-(2-OKсибутил)-N-циклогексиламинокарбо- нш1 пропокси -3,4-дигидрокарбостирил. . Бесцветные иглообразные кристаллы Т. пл. 132-133С. Пример 138. (2-Окс этил)-N-циклoгeкcилaминoкapбoнил бy токси -3,4-дигидрокарбостирил. Бесцветный кристаллический порошок. Т. пл. 122-123,. Пример 139. (2-Окс бутил)-Ы-циклогексиламинокарбонил бутокси -3,4-дигидрркарбостирШ1. Бесцветные иглообразные кристаллы. Т. пл. 91-93С. Пример 140. 6-{4- ы-(2-Окс бутил)-N-циклогексиламинокарбонил бутоксиЯ-карбостирил, Бесцветньй кристаллический порошок. Т. пл. 127-128,. Пример 141. 6-{4- Ы-(2-Окcиэтил)-N-циклoгeкcилaминoкapбoнил бутокси1карбостирил. Бесцветные гранулообразные кристаллы. Т. пл. 134-135 0. П р-и м е р 142. 6-{4- N-(2-OKсиэтш1)-Ы-(2-тетрагиДропиранилметил)аминокарбонил бутокси 3,4-дигид рокарбостирил. Бесцветные иглообразные кристаллы. Т. пл. 117-118,5С. Пример 143. 6-{3-(4-Фенил-1-пиперазинш1карбонил)пропокси карбостирил. Бесцветные иглообразные кристаллы. Т. пл. 202,5-203,5С. Пример 144. В 100 мл хлоро форма добавляют 3,7 г (2-оксиэтил)-N-циклогексиламинокарбонил пропокси карбостирила и 1,8 г триэтиламина. Реактор, в котором на ходится указанная смесь, охлаждают снаружи. Затем к этой смеси по каплям добавляют 1,4 мл бензоилхлорида при перемешивании. После окончания добавления реакционную смесь продол жают перемешивать при комнатной тем пературе в течение 1 ч. Затем реак- ционную смесь промьгоают 5%-ным водным раствором NaHCOj, разбавленной хлористоводородной кислотой и водой в указанной последовательности, затем высушивают над безводным сульфатом натрия. Осушающий агент удаляют Фильтрованием и маточный раствор концентрируют. Полученный при этом остаток обрабатывают на хроматографической колонке с силикагелем (в качестве растворителя используют смесь хлороформ:метанол 30:1), и элюат перекристаллизовывают из смеси хлороформ - петролейньш эфир до получения 3,0 г 6-tЗ-CN-(2-бeнзoил-оксиэтил)-N-циклогексиаламино карбoнилjпpoпoкcи|кapбocтиpилa в виде бесцветных иглообразных кристаллов. Т. пло 94-96 с. Аналогично способу, описанному в примере 144, получают соединения (примеры 145-146). Пример 145. 6- 4-CN-(5-Пропионилоксипентил)-N-циклогексилметиламинокарбонил бутокси|-3,4-дигидрокарбостирил. Бесцветные иглообразные кристаллы. Т. пл. 60-62 0 Пример 146. (3-Ацетш1Оксипропил)-Н-(2-тетрагкдро пиранилметил)аминокарбонилЗбутокси -3,4-дигидрокарбостирш1. Бесцветные иглообразные кристаллы. Т. пл. 64,5-66,5с. Далее приводятся результаты фармакалогических тестов, проведенных для предлагаемых соединений. П р и м е р 147. 1 г 6-{з- ы-(метил-N-(З-пиридилметил)аминокарбонил карбостирил растворяют в 20 мл этанола, затем туда добавил 10 мл концентрированной соляной кислоты и смесь перемешивают при комнатной температуре в течение 30 мин. Растворитель удаляют дистилляцией и полученный остаток перекристаллизовывают из метанола. Получают 1,01 г хлоргидрата (метил-N-(З-пиридилметил)аминокарбонил J пропоксиЯкарбостирила. Т. пл, 280- 283°С. Данные элементного анализа приведены в табл. 1.
Таблица 1
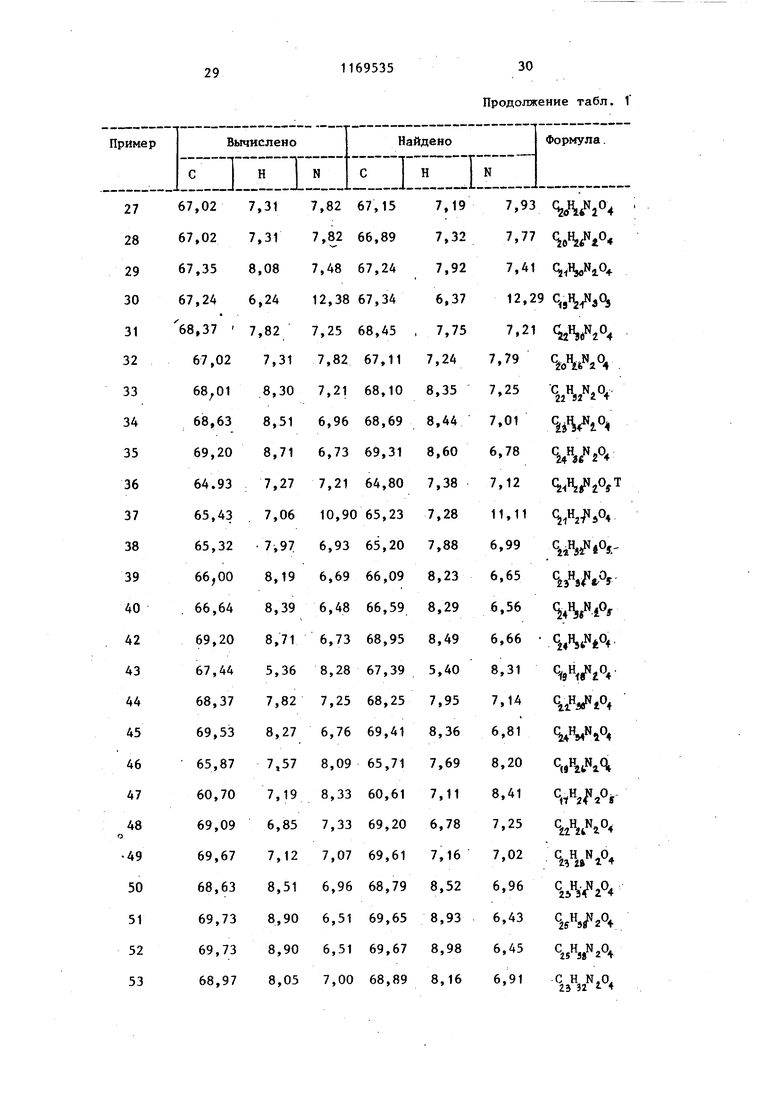
Продолжение табл. 1
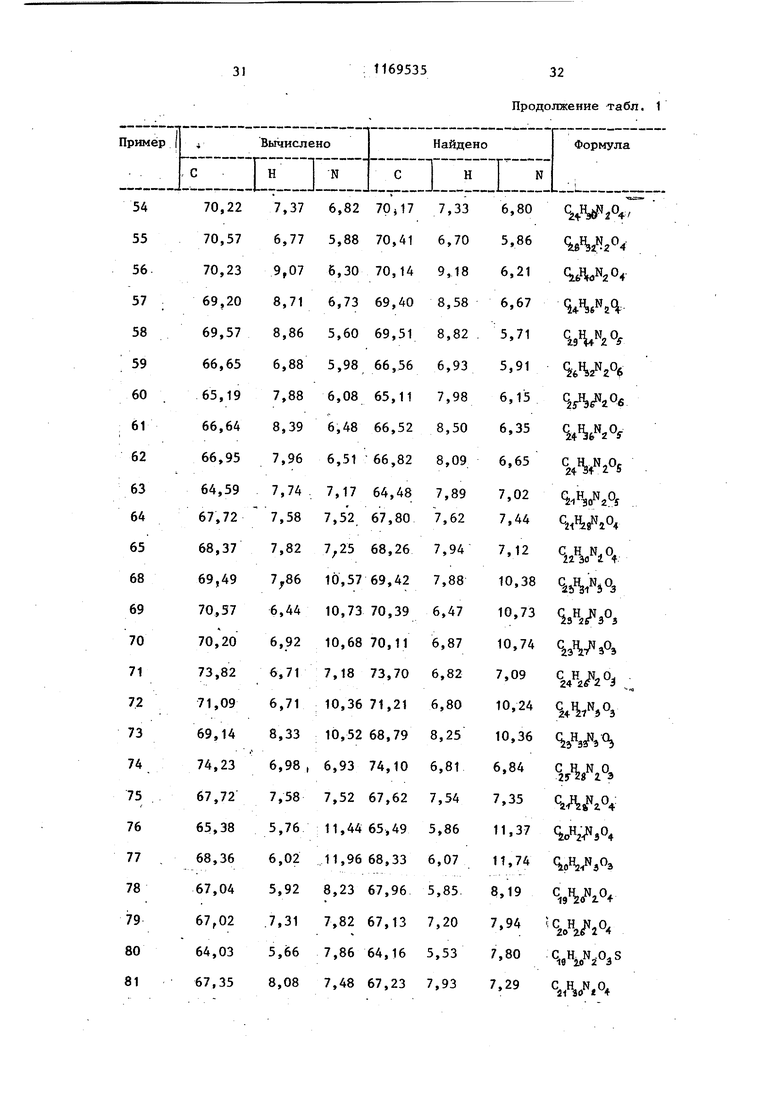
Продолжение табл. 1
Продолжение табл. 1
Продолжение табл. 1
Продолжение табл. f
Продолжение табл. 1
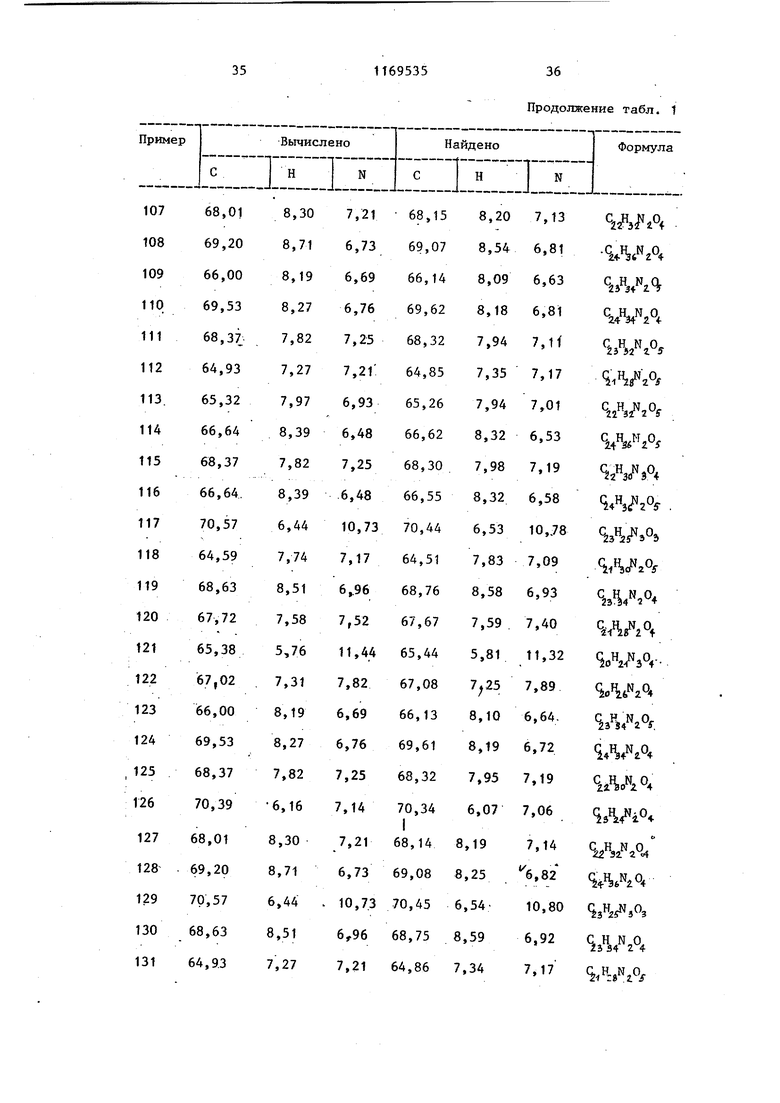
Продолжение табл.
Фармакологический тест 1.
Способность ингибировать агрегацию тромбоцитов определяют с помощью AG- 11 агрегометра (изготовляемо,го Bryston Monufaturing Co.).Образе крови, которьй используют для теста представляет собой смесь 1/9 (по объему) цитрата натрия и полного образца крови, собранной у кролика, Указанный образец в течение 10 мин центрифугируют со скоростью ... 1000 об/мин до получения обогащенной тромбоцитами плазмы (PRP). Полученный таким образом PRP вьщеляют, а оставшийся образец крови подвергают дальнейшей обработке на центрифуге в течение 15 мин со скоростью 3000 об/мин для получения обедненной тромбоцитами плазмы (PRP).
Количество тромбоцитов в PRP определяют по методу .Brecher Clohkite и PRP разбавляют PRJP для получения. образца PRP с концентрацией тромбоцитов ЗОбоОО/нм для теста агрегации, вызванной аденозиндифосфатом (АДР). Приготавливают также х образец PRP с концентрацией тромбо1ЩТОВ 450000/мм для теста агрегации, вызванной коллагеном. 0,6 мл указанного образца PRP добавляют в 0,01 раствора тестового соединения заранее определённой концентрации и полученную, смесь помещают в repMoctar с температурой 37°С на 1 мин. Затем 0,07 мл АДР или колредлагаемое
100 t
100
2 3
100
92,5
4
85, 7 5 6 7
100
100
лагенового раствора добавляют в смеси. Определяют пропускание смеси и изменение пропускания записывают, используя агрегометр со скоростью неремешивания 1100 об./мин. В этом тесте исвользуют буфер Auren Beronal , (рН 7,35( для приготовления раствора АДР или коллагена. Раствор АДР доводят до концентрации 7, М, а раствор коллагена приготавливают, растирая 100 мг коллагена с 5 мл указанного буфера, и надосадочную жидкость используют в качестве индуктора. Ацетилсалициловую кислоту используют в качестве контроля для теста агрегации, вызванной АДР, и теста агрегации, вызванной коллагеном, соответственно. Ингибирующее действие на агрегацию тромбоцитов определяют в единицах (процент ингибированияпо отношению к скорости агрегации контроля . Скорость агрегации (СА) рассчитывают по формуле:
.§. 100,
СА
где а - пропускание PRP;
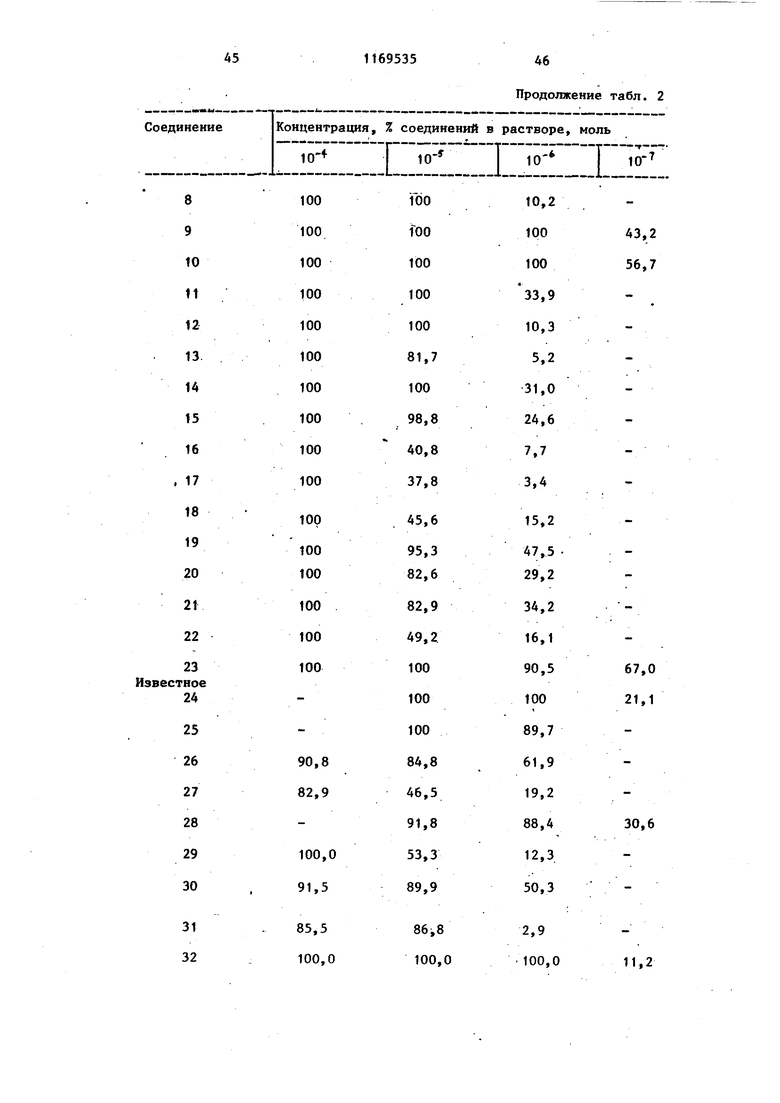
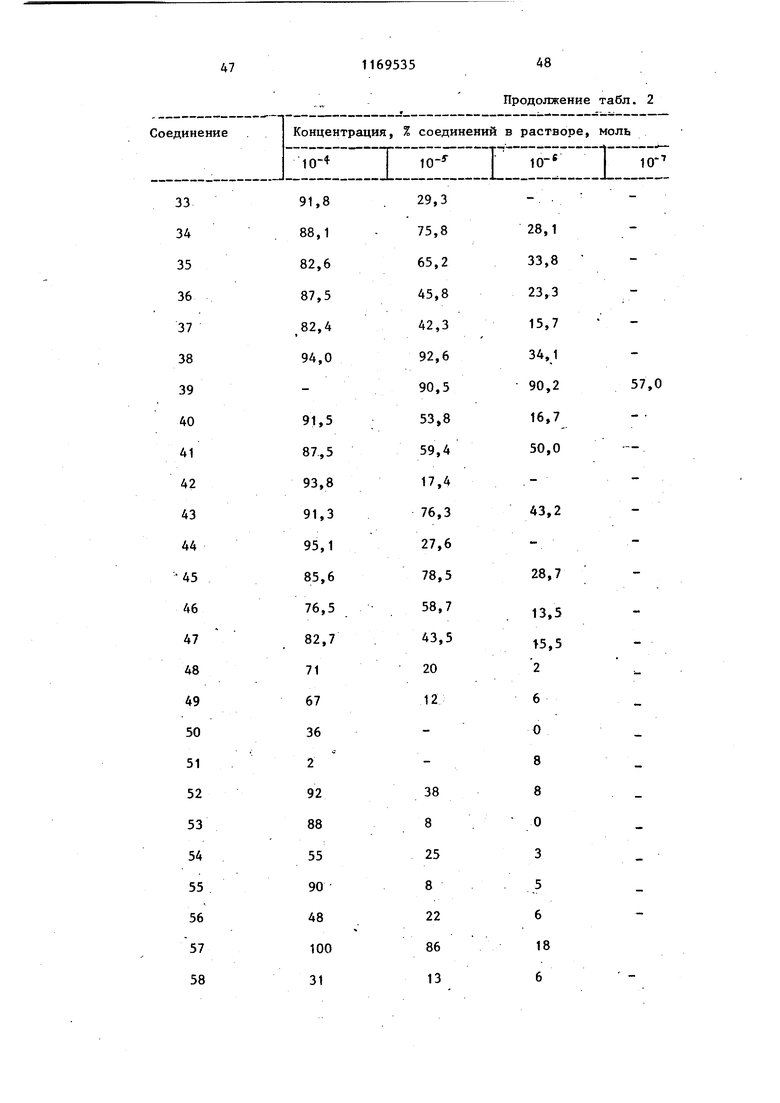
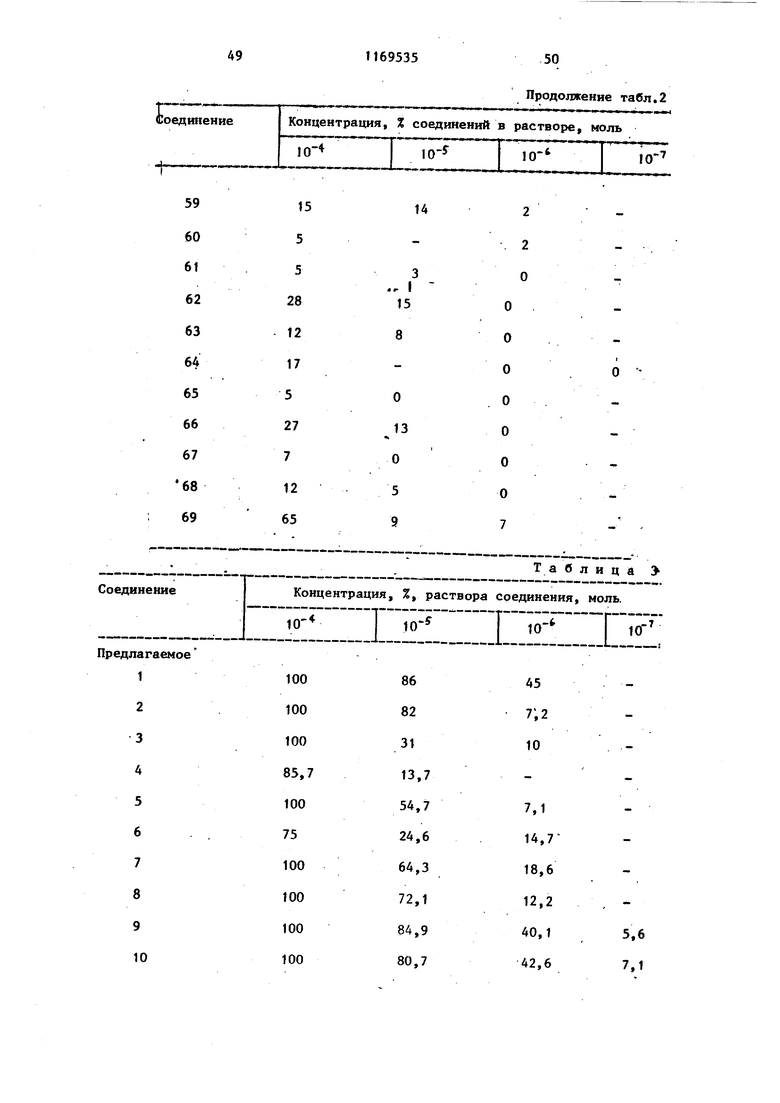
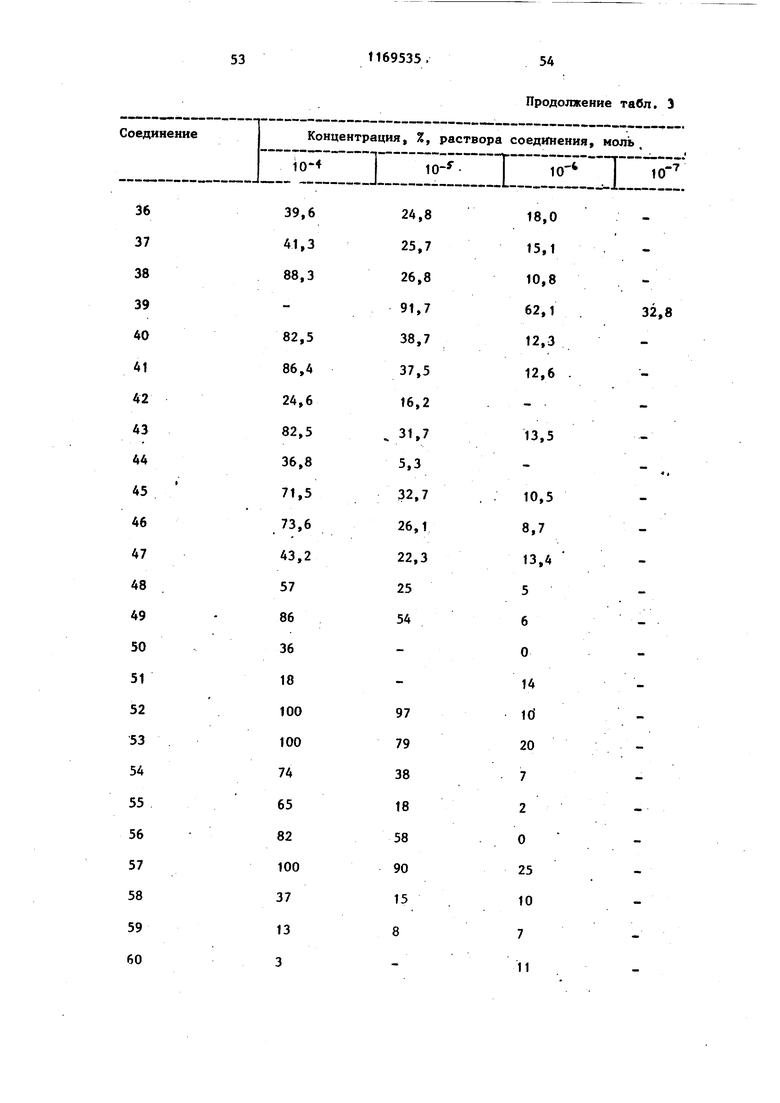
b - пропускание PRP, содержащего тестовое соединение или индуктор агрегации; с - пропускание PRP. Ингибирукщее действие карбостирильных производных на агрегацию тромбоцитов кроликов, вызванную коллагеном, представлено в табл. 2, а аналогичное действие на агрегацию, вызванную АДР, представлено в табл. 3.
Т а -6 л и гг. а ,2
60,1
100 7,2 14 4,0
3,8 13,3
15
5
5
28 12 17 5 27 7
12 65 Концентрация, %, Соединение Предлагаемое 1
Продолжение табл.2
14
2 2 О
. I 15
О
8
О
О
О
О
О
13
О
О
О
О
9
7 Та блица раствора соединения, моль. :Е
Продолжение табл. 3 Тестовым испытаниям подвергают соединения. Предлагаемые соединения (1-23). 1.6-{3-Сн-(2-Оксиэтил)-Ы-циклогексш аминокарбойил}пропокси}карбостирш1. 2.6-{3- н-Этил-Н-(3-пиридилметш1) aминoкapбoнилaминoJпpoпoкcиlкapбocти рил.. 3.6 - 3- N-ЭтшI-N-(2-пиpидил)aминoкарбонилТпропокси1карбостирил. 4.6- S-LN-Mermi-N-(2-фурилметил)ами нокарбонил пропокси(карбостирил. 5о 6-{з- н-Метил-К-(2-тиенилметил) аминокарбонил}пропокси карбостирил. 6. Ы-Метил-К-(2-тетрагидропира нилметил) aминoкapбQHШIJпpoпoкcиJкap бостирил. 7.5-{4- N-(2-Оксибутил)-N-циклогексилметиламинокарбонил бутокси -3,4- дигидракарбостирил. 8. 6-Г4- К-(4-Окснбутил)-Ы-циклогек силметиламинокарбонил бутокси -3,4-дигидрокарбостирил. 9о )2-Оксибутил-К-циклоокстш1г аминокарбонил)бутокси карбостирил.. 10.(2-Бензоилоксиэтил)-К циклогексиламинокарбонилЗпропоксикарбосч- ирил, 11,6-{4- к-(2-Оксиэтил)-М-фенилами нокарбонил бутокси у-3,4-дигидрокарб .
Продолжениетабл.3 12.6-f4-LN-Бyтил-N-(2-тeтpaгидpoпираню1метил)аминокарбонил бутокс1А-3,4-дигидрокарбостирил. , 13.6-f4-iN-(2-Oкcиэтил)-N-(2-тeтрагидропиранилметил)аминокарбонилЗ бутокси -3,4-дигидрокарбостирил. 14.(4-ФeншI-l-пипepaзинилкapбoнил)пpoпoкcиJкapбocтиpил. 15.. (4-Бензип-1-пиперазинилкарбонил)пропокси -3,4-дигидрокарбостирил. 16.6-tз-(4-Фeнил-1-пипepидшIкapбoнил ) пропокси карбостирил . 17.6- з-(4-Фенил-1-пиперазинилкарбонил)пропокси -3,4-дигидрокарбостирил. 18.6- 3- (4-Циклогексил-1 -пиперазинилкарбонил)пропокси2-3,4-дигидро- карбоксистирил. 19.6-{3- N-(2-Оксиэтил)-N-(3-оксициклoгeкcил)aминoкapбoншIJпpoпoкcиj карбостирил. 20.(2-Оксиэтил)-Н-(-3,4т -диметоксифенэтш1)аминокарбонил J бутокси карбостирил. 21.6-{4- М-(3-Ацетилоксипропил)-М-(2-тетрагидропиранилметил)амино- карбонил бутокси 3,4-дигидрокарбостирил. . 22.6-{4- н-(2-Оксиэтил)-Н-бензш1аминокарбонилЗбутоксиJ-3,4-дигидрокарбостирил.
Известные (24-69) соединения
(сравнительные соединения).
49о 6-(1-Этоксикарбонилзтокси)карбостирил. ,
Фармакологический тест 2.
Противодействие против циклической AMP фосфодиэстеразы. определяют по методу определения активности 2 и З , т.е. для определения противодействия против циклической AMP фосфодиэстеразы 10 мп раствора, полученного добавлением 1 мноль MgCl к 50 ммоль буфера трис-хлористоводородная кислота с рН 7,4, добавляю к тромбоцитам, полученным при дальнейшем центрифугировании указанного PRP кролика при 3000 об./мин в течение 10 мин, и суспендированные тромбоциты измельчают в тефлоновом гомогенизаторе. После этого дважды, замораживают препарат и дважды его оттаивают, а затем измельчают 300 с ультразвуком мощностью 200 Вт. Пос- ле дополнительных 60 мин центрифугирования при 100000 G надосадочную жидкость собирают для использования в качестве неочищенного раствора фермента. .
10 мл неочищенного буферного раствора вводят в колонку размером 1,5-20 см, заполненную ДЕАЕ-целлюлозой, которую предварительно буферируют 50 мм трис-ацетатного буфера (рН 6,0) с последующей промывкой и элюированием 30 мл 50 мм трисацетатным буфером, а затем этот буферньй раствор обрабатывают линейным градиентным элюированием О 0,5 моль буфера ацетат - трис-ацетат (полное количество элюированное составило 300 мл. Скорость потока составляет 0,5 мл/мин, причем собирают фракции по 50 мп каждая. В ре зультате этой операции получают фракции с низкой активностью менее 2 моль/мл мин с высокой (100 мк моль) кон1|);ентрацией Циклического АИР субстрата и все еще высокой активностью свыше 100 р моль/млмин при низкой (0,4 мкм моль) концентрации циклического субстрата. Эту фракцию и используют как циклическую AMP фосфодиэстеразу.
О,1 мл водного раствора каждого тестового соединения определенной концентрации смешивают с 40 ммоль буфера - трис-хлористоводородная килота с рН 8,0, содержащего 50 мкг. сывороточного альбумина, и с 4ммоль MgClj, содержащего заранее определенные 1,О мк моль циклического AMP
(тритиум AMP) и 0,2 MJJ этого смешанного раствора используют в качестве раствора субстрата.
0,2 МП ранее приготовленной циклической AMP фосфодиэстеразы заранее определенной концентрации добавляют к указанному раствору субстрата и полученная смесь реагирует при в течение 20 мин, выделяя тритиум 5 AMP для тритиум циклик AMP.
Реакционную систему погружают в кипящую воду на 2 мин для остановки реакции, а затем этот реакционный раствор охлаждают в ледяной воде, и для превращения полученного тритиум 5 - AMP в тритиут аденозин к раствору добавляют 0,05 мл (1 мг/мл) змеиного яда в виде 5 -нуклеотидазы и реакцию ведут при в течение 10 мин. Все количество реакционного раствора вводят затем в колонку с катионообменной смолой (АС 500 Wj 4,200 - 400 мешей, изготовлена BioRad Со, размеры колонки; 0,,5 см) и полученный тритийанодезин один оставляют собираться, промывают 6 мл дистиллированной воды и элюируют 1,5 мл 3 н. аммиачной водой. К полному количеству элюата добавляют 10 мл тритон-толуольного типа единтиллятор и полученньй тритиумадено- ЗИН определяют с помощью сцинтилляционного жидкостного счетчика для определения активности фосфЬдиэстеразы,
Таким образом, определяют активационное значение (V) фосфодиэстеразы тестового соединения соответствующей концентрации и из этого активационного значения Vg и контрольного значения V., полученного для воды, в которой не содержится никакого тестового соединения, определяют степень противодействия фосфодиэстеразе (СПФ, %) из следующей формулы
СПФ .Y
X 100.
с
Дпя контроля используют извест- , ный 1-метил-З-изобутилоксантин.
Полученные результаты приведены в табл. 4.
;Т а б л и ц а 4
Продолжение табл.4
1-Метил-3-изоi7
5,4 10 бутилоксантйн
Фармакологический тест 3.
Положительные инотропные эффекты новых карбостирильных производных изобретения определяют по способу 4 J. следующим образом.
Взрослых гибридных собак обоих полов весом 8-12 кг анестезируют фентобарбиталом - Na в дозеЗОмг/кг, внутривенно. После следующего внутривенного введения гепарина натрия (1000 мкг/кг) тестовых собак умерщвляют, выпуская им кровь. Вырезают сердце собаки и немедленно помещают его в раствор Лока, затем вырезают артериальную париллярнуш мыпщу вместе с интервентикулярной перегородкой, Септальную артерию тщательно извлекают, проходят полиэтиленовой канюлей и зашивают ниткой, Септальные артерии (остальные, которые не были присоединены к артериальной папиллярной мьшце) сшивают нитками. Затем донорных гибридных собак весом 18-27 кг анестезируют фентабарбитапрм - Na (30 мг/кг), внутривенным введением, и вводят внутривенно гепарин натрия (1000 мкг/кг).
Перфузируют артериальную папиллярную мышцу канюлированную через септальную артерию полиэтиленовой канюлей с кровью, поступающей из каротидной артерии донорной собаки с
помощью Peristaric насоса. Давление перфузии поддерживают постоянКлым 100 мм рт.ст. Мышцу стимулиру- ют , электричеством с помощью электронного стимулятора через биполярные
электроды в контакте с интервентикулярной перегородкой. Сила стимулирования 2Х (минимальное значение, при котором проявлялось действие).с частотой 2 Гц, длительность пульсации
2 мс.
Изометрическое сокращение, создаваемое при этом, измеряют с помощью force displacement, franducer. Количество протекающей крови в коронарной артерии определяют, измеряя кровяной поток, поступающий в септальную артерию с помощью электромагнитного измерителя потока. Ес& данные записывают на самописце.
Раствор, содержащий тестовое
соединение, вводят в септальную артерию через резиновую трубку, соединенную с полиэтиленовой канюяей в количестве 10-30 мкл„
Полученные результаты приведены в табл, 5, где повышение (%) сокращений выражено как отношение количества сокращений до и после введения (инъекций) раствора, содержащего тестовое соединение
Таблица 5
62,5
17 Фармакологический тест 4 Эффект повышения церебрального потока крови определяют по извест- ному методу. Гибридную собаку (самца весом 12-20 кг) фиксируют в prone (положении), анестезируют 20 мг/кг фенобарбитала натрия и делают искусственное дыхание с частотой 20 раз/мин. Затем обнажают скулу и удаляют повер ностную кость для того, чтобы открыт венозный синус, используя гриндер, и венозную кровь отбирают из канюлированной вены. Определяют скорость кроветока из вены, используя электро магнитный измеритель потока, и зарем измеряют количество капель кроПродолжение табл.5
38,7
89,4
38,9
94,3,
2,7
51,4 ви за 10 с, используя счетчик капель. Эффект повьппения церебрального кровяного потока определяют, сравнивая число капель крови за 30 с в максимуме повьшения, который наблюдается перед и после введения тестового соединения. Каждое соединение растворяет в диметилформамиде, разбавляют физиологическим раствором и вводят через канюлю, вставленную в profunda fomoris vein. В качестве сравнительного соединения используют папаверин. Ползгченные результаты приведены в табл. 6. Таблица 6
Фармакологический тест 5.
Гипотензивное действие соединений измеряют, определяя максимальное кровяное давление тестовых животных по методу Tail-Cuff.
Используют два типа тестовых животных.
Взрослых крыс штамма Вистар,весом 160-180 г анастезйруют эфиром и левостороннюю ренальную артерию пережимают серебряным зажимом с внутренним диаметром 0,2 мм, тогда как правостороннюю ренальную артерию оставляют неоперированной. Спустя 4 недели после операции отбирают крыс с максимальным кровяньтм давлением выше 150 мм рт.ст, и тестовым животным не дают пищив течение ночи,
Самцов крыс штамма Вистар весом . 150-170 г анастезйруют эфиром и вылущивают левую почку. Спустя неделю .
после операции раз в неделю йводят подкожно 10 мг/кг ДОСА и в качестве питьевой воды дают 1%-ный водный раствор соли, спустя 5 недель после операции крыс с максимальным кровяным давлением вьше 150 мм рт.ст. отбирают и используют в качесве тестовых животных, которым не дают пищи в течение ночи.
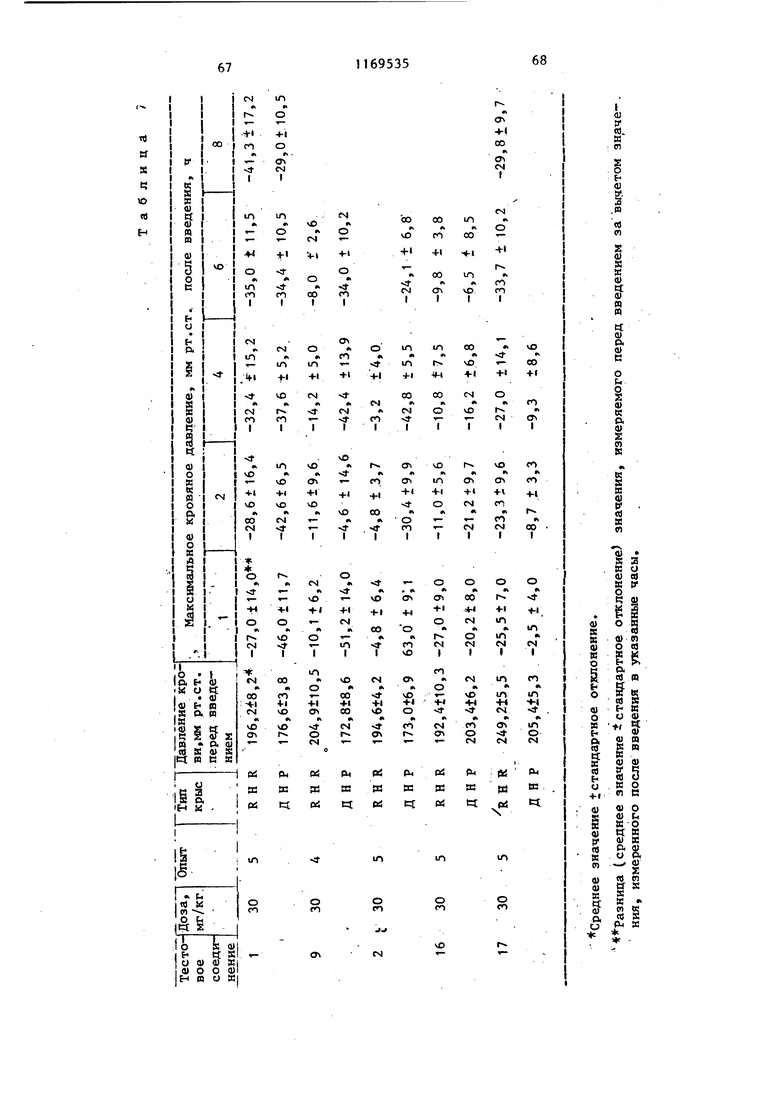
Каждое из тестируемых соединений вводят орально и кровяное давление измеряют перед введением и спустя 1,2,4,6 и 8 ч после введения. Полученные результаты приведены в табл.7« Кровяное давление измеряют с помощью самописца Rectuhoriz type 8S, Sanei Instrument и электростигноманометpa PE-300 Macro Bio System.
Авторы
Даты
1985-07-23—Публикация
1981-05-11—Подача