Изобретение относится к области медицины, конкретно к экспериментальной гематологии, токсикологии, и касается способов морфологической оценки гибели клеток при апоптозе.
Известны способы морфологической оценки гибели клеток при апоптозе путем гистохимического исследования костного мозга на нуклеопротеиды, включая световую и электронную микроскопию (1), путем культивирования костно-мозговых клеток в диффузионных камерах в брюшной полости мышей-реципиентов и последующем микроскопическом исследовании на фильтре клеток, окрашенных гематоксилин-эозином (2), путем исследования парафиновых срезов ткани по метке концов фрагментов ДНК in situ (3).
Однако данные способы чрезвычайно трудоемкие, длительные, требуют дорогостоящих реактивов и оборудования.
Наиболее близким прототипом является способ морфологической оценки гибели клеток при апоптозе in vitro, заключающийся в удалении тимуса у экспериментального животного, приготовления культуры из его клеток и однократного введения в нее испытуемого вещества, приготовления через 3-6 ч культивирования цитологического препарата - отпечатка, его высушивания, фиксации, окраски и определения содержания апоптозных тел и клеток под микроскопом (4).
Однако данный способ показывает непосредственное действие препарата на клетки, без учета процессов, происходящих в организме, требует владения культуральными методами исследования, является более трудоемким и дорогостоящим.
Задачей, решаемой данным изобретением, является повышение воспроизводимости и упрощение способа.
Поставленная задача решается путем однократного введения (внутрь, параэнтерально) испытуемого вещества экспериментальным животным (мышь, крыса), удаления через 6 ч тимуса, приготовлении из гомогената его фрагмента с аутологической сывороткой мазка, его высушивания, фиксации, окрашивания и определения содержания апоптозных тел и клеток под микроскопом.
Новым является то, что испытуемые вещества вводят экспериментальному животному, через 6 ч удаляют тимус и из его гомогената с аутологической сывороткой готовят мазки.
Данные отличительные признаки не найдены авторами в проанализированной ими литературе и они явным образом не вытекают для специалиста из уровня техники. Таким образом, предлагаемое техническое решение соответствует критерию изобретения "Новизна" и "Изобретательский уровень". Данное техническое решение можно применять в доклинических токсикологических исследованиях, таким образом оно соответствует критерию изобретения "Промышленно применимо".
Способ осуществляют следующим образом: экспериментальному животному (мышь, крыса) вводят однократно (внутрь или параэнтерально) любое испытуемое вещество (например, лекарственный препарат или токсическое средство). Через 6 ч животное забивают методом дислокации шейных позвонков и извлекают тимус. Из гомогената небольшого фрагмента тимуса (1-1,5 x 1-1,5 мм) и аутологичной сыворотки (1:1) приготавливают на чистом обезжиренном предметном стекле мазок - цитологический препарат. Мазок высушивают, фиксируют 5 мин в метаноле и окрашивают азурП-эозином по методу Нохта-Максимова. На окрашенном мазке тимуса под микроскопом (окуляр 7х, объектив 90х или 100х) определяют содержание апоптозных тел (мембранозамкнутых фрагментов клетки) и апоптозных клеток (клеток с кариопикнозом, кариорексисом, маргинацией хроматина, выпочковыванием апоптозных тел) на 100 неизмененных тимоцитов.
Конкретные примеры выполнения способа.
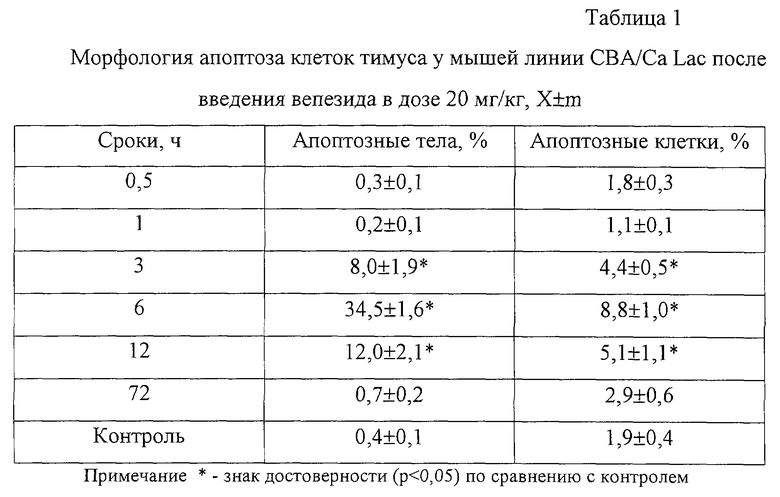
Пример 1. Противоопухолевый препарат вепезид вводили однократно внутрибрюшинно в 1/2 LD50 (20 мг/кг) 35 мышам-самцам линии СВА/Са Lac. Через 0,5, 1, 3, 6, 12 и 72 ч их забивали (по 5 животных на точку) методом дислокации спинного мозга в шейном отделе, извлекали у них тимус. Из гомогената фрагментов тимуса и аутологической сыворотки (1:1) готовили мазки, которые высушивали, фиксировали 5 мин в метаноле и окрашивали азур II эозином по Нохту-Максимову. На мазках тимуса под микроскопом подсчитывали процент апоптозных тел и апоптозных клеток. Контролем служили данные, полученные от интактных животных. Статистическую обработку результатов проводили методом вариационной статистики с применением критерия Стьюдента.
Наибольшее содержание клеток в апоптозе было обнаружено через 6 ч (табл. 1).
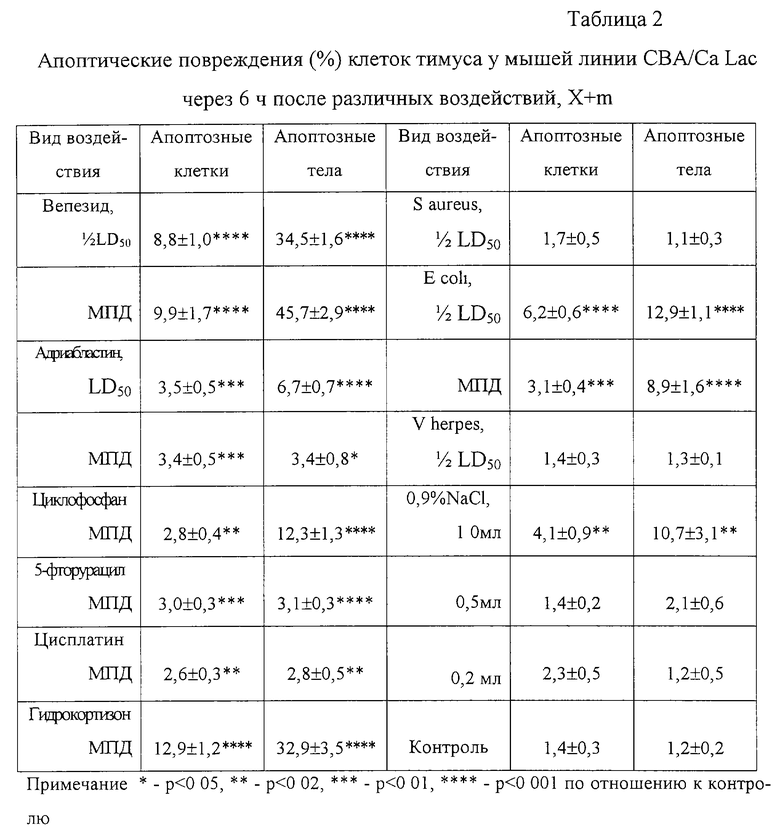
Пример 2. Мышам-самцам линии СВА/Са Lac (80) массой 18-20 г вводили однократно внутрибрюшинно цитостатические препараты различных групп: вепезид (Германия) в 1/2 LD50 (20 мг/кг) и МПД (10 мг/кг), адриабластин (Италия) в LD50 (30 мг/кг) и МПД (6 мг/кг), циклофосфан (Минмедпром, Саранский завод медпрепаратов) в МПД (200 мг/кг), 5-фторурацил (Израиль) в МПД (228 мг/кг), цисплатин (Москва) в МПД (9 мг/кг); инфекционные возбудители: Staphylococcus aureus (штамм Б 243) в 1/2 LD50 (200 млн живых микробов), Escherichia coli (штамм Н304) в 1/2 LD50 (400 млн. живых микробов) и в МПД (40 млн. живых микробов) и Virus herpes simplex (штамм L2) в 1/2 LD50 (разведение вируса 10-4); а так же гидрокортизон (Венгрия) в дозе 250 мг/кг, физиологический раствор (1,0, 0,5 и 0,2 мл). Через 6 ч после введения животных забивали методом дислокации спинного мозга в шейном отделе, извлекали тимус. Из гомогенета фрагментов тимуса и аутологической сыворотки (1:1) готовили мазки, которые высушивали, фиксировали 5 мин в метаноле и окрашивали азур II-эозином по Нохту-Максимову. На мазках тимуса под микроскопом подсчитывали процент апоптозных тел и апоптозных клеток. Контролем служили интактные животные. Статистическую обработку результатов проводили методом вариационной статистики с применением критерия Стьюдента (табл.2).
Таким образом, через 6 ч после введения противоопухолевых препаратов различных групп и воздействия других стрессорных факторов наблюдалось усиление апоптической гибели клеток тимуса различной степени выраженности. Вепезид по сравнению с другими противоопухолевыми препаратами обладает наибольшим апоптоз- индуцирующим действием, о чем свидетельствуют и данные, полученные in vitro (5, 6, 7).
Обоснование способа. Предлагаемый способ изучения позволяет in vivo выявить максимальные изменения в монопопуляции клеток тимуса при апоптозе, универсальном явлении в первые часы (3-12 ч) при стресс-воздействиях. Процесс апоптоза скоротечен, происходит быстрая элиминация апоптозных тел и клеток путем фагоцитоза, наибольшие изменения наблюдаются через 6 ч. Для выявления морфологических изменений при апоптозе явные преимущества имеет исследование мазков, где клетки распластаны на стекле и тонкие цитоморфологические структуры клеточных элементов хорошо просматриваются.
Преимущество способа. Предлагаемый способ является более физиологичным, простым и общедоступным, не требует специального оборудования и реактивов, результаты можно получить в день исследования, рекомендуется для скрининговых исследований при доклиническом изучении новых лекарственных средств.
ЛИТЕРАТУРА
1. Власов П.А., Квачева Ю.Е. // Гематология и трансфузиология. - 1997. - N 6. - С. 30-32.
2. Егорова А.Б., Успенская Ю.А., Круглик О.В. и др.// Экспериментальная и клиническая фармакология. - 1998.- N 4.-С. 34-37.
3. Погорелов В. М. , Козинец Г.И. // Гематология и трансфузиология. - 1995.-N 5.-С. 17-25.
4. Bruno S., Lassota P., Gairetti W., Darzynkiewiz Z. // Onkol. Res. - 1992. - Vol. 4, N 1. - P. 29-35.
5. Forbes F.J., Zalewski S.C., Cowled P.A. // Exp. Cell. Res. - 1992. - Vol. 198, N2.-P. 367-372.
6. Yoshidal H., Takase M., Bando T. et al //Cancer J. - 1993.- Vol. 6, N 4, -P.220-228.
7. Walker P.R., Smith C., Jondale T. et al.// Cancer Res.- 1991. -Vol. 51, N 4, -P.1078-1085.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕКАРСТВЕННОЕ СРЕДСТВО, СТИМУЛИРУЮЩЕЕ ЭРИТРОИДНЫЙ И ГРАНУЛОЦИТАРНЫЙ РОСТКИ КРОВЕТВОРЕНИЯ ПРИ ЦИТОСТАТИЧЕСКИХ МИЕЛОДЕПРЕССИЯХ | 1993 |
|
RU2083201C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО, СТИМУЛИРУЮЩЕЕ ЭРИТРОИДНЫЙ РОСТОК КРОВЕТВОРЕНИЯ ПРИ ЦИТОСТАТИЧЕСКИХ МИЕЛОДЕПРЕССИЯХ | 1992 |
|
RU2061475C1 |
| СРЕДСТВО, ИЗБИРАТЕЛЬНО СТИМУЛИРУЮЩЕЕ ГРАНУЛОМОНОЦИТОПОЭЗ ПРИ ГИПОПЛАЗИИ КОСТНОМОЗГОВОГО КРОВЕТВОРЕНИЯ, ВЫЗВАННОГО ЦИТОСТАТИКОМ | 1988 |
|
RU2020936C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ УГНЕТЕНИЯ ГАРМОНАЛЬНОЙ АКТИВНОСТИ ЯИЧНИКОВ | 1999 |
|
RU2191584C2 |
| СПОСОБ ОЦЕНКИ ГРАНУЛОЦИТОПОЭЗСТИМУЛИРУЮЩЕЙ АКТИВНОСТИ ФАРМАКОЛОГИЧЕСКИХ ВЕЩЕСТВ | 2006 |
|
RU2332667C1 |
| ГЕМОСТИМУЛЯТОР | 1994 |
|
RU2088249C1 |
| Способ моделирования гепатита | 1989 |
|
SU1691877A1 |
| АНТИМУТАГЕННОЕ СРЕДСТВО | 2000 |
|
RU2189232C2 |
| СРЕДСТВО, СТИМУЛИРУЮЩЕЕ ФУНКЦИИ КЛЕТОК СИСТЕМЫ МОНОНУКЛЕАРНЫХ ФАГОЦИТОВ | 1994 |
|
RU2098080C1 |
| СПОСОБ ТЕРАПИИ ИНДИВИДУАЛЬНЫХ НАРУШЕНИЙ В СИСТЕМЕ КРОВИ ПРИ ЭКСПЕРИМЕНТАЛЬНЫХ НЕВРОТИЧЕСКИХ ВОЗДЕЙСТВИЯХ | 2006 |
|
RU2329806C2 |
Изобретение относится к медицине, а именно к экспериментальной гематологии, токсикологии, и касается способов морфологической оценки гибели клеток при апоптозе. Лабораторному животному однократно вводят испытуемые вещества. Через 6 ч удаляют тимус. Приготавливают из гомогената фрагмента тимуса и аутологической сыворотки мазок. Высушивают, фиксируют, окрашивают и определяют содержание апоптозных тел и клеток под микроскопом. Способ позволяет повысить воспроизводимость и упростить исследование. 2 табл.
Способ морфологической оценки гибели клеток при апоптозе, заключающийся в извлечении у лабораторного животного тимуса, приготовлении цитологического препарата, его высушивании, фиксации, окрашивании и определении содержания апоптозных тел и клеток под микроскопом, отличающийся тем, что лабораторному животному однократно вводят испытуемое вещество, через 6 ч удаляют тимус и из гомогената его фрагмента с аутологической сывороткой готовят цитологические препараты.
| Bruno S.et.al., Onkol | |||
| Rec., 1992, vol.4, N 1, p.29-35 | |||
| СПОСОБ ДИАГНОСТИКИ ГИПЕРИММУНОГЛОБУЛИНЕМИИ | 1989 |
|
RU2023269C1 |
| СПОСОБ ДИАГНОСТИКИ АУТОИММУННОЙ ТРОМБОЦИТОПЕНИИ | 1993 |
|
RU2036474C1 |
| Способ определения аутоиммунного процесса | 1989 |
|
SU1709220A1 |
| СПОСОБ ОЦЕНКИ КЛЕТОЧНЫХ ИММУННЫХ РЕАКЦИЙ IN VITRO | 1987 |
|
SU1575711A1 |
| СПОСОБ ОЦЕНКИ РЕГУЛИРУЮЩИХ МЕХАНИЗМОВ АНТИТЕЛОГЕНЕЗА | 1997 |
|
RU2143116C1 |
Авторы
Даты
2000-10-20—Публикация
1999-03-11—Подача